Um ensaio para detectar a proteção da vasculatura retiniana contra a morte relacionada ao diabetes em camundongos
In This Article
Summary
Um ensaio de proteção foi desenvolvido para monitorar a resiliência da vasculatura retiniana à morte por diabetes/insultos relacionados à retinopatia diabética, como estresse oxidativo e citocinas.
Abstract
A retinopatia diabética (RD) é uma doença ocular complexa e progressiva caracterizada por duas fases distintas em sua patogênese. A primeira fase envolve a perda de proteção contra danos induzidos pelo diabetes na retina, enquanto a segunda fase centra-se no acúmulo desse dano. Os ensaios tradicionais concentram-se principalmente na avaliação da degeneração capilar, que é indicativa da gravidade do dano, abordando essencialmente a segunda fase da RD. No entanto, eles apenas indiretamente fornecem informações sobre se os mecanismos protetores da vasculatura retiniana foram comprometidos. Para abordar essa limitação, uma nova abordagem foi desenvolvida para avaliar diretamente os mecanismos protetores da retina - especificamente, sua resiliência contra insultos induzidos pelo diabetes, como estresse oxidativo e citocinas. Este ensaio de proteção, embora inicialmente projetado para retinopatia diabética, tem potencial para aplicações mais amplas em contextos fisiológicos e patológicos. Em resumo, a compreensão da patogênese da retinopatia diabética envolve o reconhecimento das fases duplas de perda de proteção e acúmulo de danos, com este ensaio de proteção inovador oferecendo uma ferramenta valiosa para pesquisa e potencialmente estendendo-se a outras condições médicas.
Introduction
A retinopatia diabética (RD) é uma das complicações microvasculares do diabetes mellitus (DM) e a principal causa de cegueira em indivíduos em idade produtiva nos paísesdesenvolvidos1. Os principais fatores de risco para retinopatia diabética são a duração e o grau de hiperglicemia 2,3,4. Enquanto o DM causa disfunção dos componentes vasculares e neurais da retina5, o diagnóstico de RD baseia-se nas características morfológicas da vasculatura retiniana6.
O estresse oxidativo induzido pela hiperglicemia é um dos fatores determinantes da patogênese da RD7. O aumento do estresse oxidativo causa danos generalizados, o que compromete a funcionalidade das mitocôndrias e, assim, aumenta ainda mais o nível de espécies reativas de oxigênio. Esses eventos são acompanhados por vazamento de vasos da retina, aumento do nível de citocinas inflamatórias e morte de ambos os tipos de células neurais e vasculares dentro da retina. A perda de células vasculares e, consequentemente, a funcionalidade da extensa rede capilar da retina resulta em hipóxia, potente estímulo para uma variedade derespostas5. Tais respostas incluem o aumento da expressão do fator de crescimento endotelial vascular (VEGF), que impulsiona tanto a permeabilidade quanto a angiogênese, características cardinais dos estágios avançados e ameaçadores da RD - edema macular diabético e retinopatia diabética proliferativa6.
Certas características da RD sugerem que um organismo (tanto pacientes quanto animais de experimentação) tem uma capacidade intrínseca de resistir a essa indicação. Os pacientes experimentam várias décadas de DM antes de desenvolverem RD com risco visual 8,9,10,11,12,13. Enquanto os modelos de roedores com DM não desenvolvem os estágios avançados e que ameaçam a visão da RD14, a forma inicial/leve da RD que se manifesta só o faz após um período de semanas ou meses de DM15,16. Além disso, tanto em pacientes quanto em animais de experimentação, a RD é progressiva, e a disfunção/dano retiniano aumenta à medida que a duração do DM é prolongada. Finalmente, alguns pacientes com DM nunca desenvolvem RD. Em certos casos, isso ocorre porque esses indivíduos não experimentam diabetes por tempo suficiente para que a DR se desenvolva. Em outros casos, é porque eles mostram uma resistência extraordinária à RD; como é o caso dos participantes do estudo Medalist, que não desenvolvem RD após 50 ou mais anos deDM17. Apesar desse apoio convincente à existência de proteção contra RD e sua enorme relevância translacional, o mecanismo subjacente à proteção não foi investigado agressivamente.
O ensaio de proteção aqui descrito foi desenvolvido para facilitar a investigação de por que a RD é atrasada desde o início do DM em camundongos diabéticos. As principais etapas deste ensaio, aplicado a camundongos com e sem DM, incluem (1) causar um insulto submáximo ao olho indutor de morte (ex vivo ou in vivo), (2) isolar a vasculatura retiniana, (3) colorir a vasculatura com TUNEL e DAPI, (4) fotografar as imagens resultantes e quantificar a porcentagem de espécies duplamente positivas para TUNEL/DAPI.
Protocol
Todos os estudos em animais foram aprovados pelo Office of Animal Care and Institutional Biosafety da Universidade de Illinois em Chicago. Camundongos C57/BL6/J machos de sete semanas de idade foram alojados em gaiolas de grupo em um ambiente livre de patógenos em um ciclo claro/escuro de 12 h e forneceram acesso gratuito à água e ração. Os camundongos foram eutanasiados por asfixia por CO2 , e os olhos foram enucleados e processados imediatamente18. Os animais foram obtidos de fonte comercial (ver Tabela de Materiais). As ferramentas essenciais necessárias para o estudo estão representadas na Figura 1.
1. Entrega do insulto indutor de morte
- Realizar estresse oxidativo com TBH (ex vivo).
- Eutanasiar os camundongos seguindo protocolos aprovados institucionalmente e enuclear os olhos18 (Figura 2A).
- Colocar os globos oculares diretamente em poços individuais de uma placa de 24 poços contendo DMEM + 1% BSA, com ou sem 5 mM de terc-butil hidroperóxido (TBH) (ver Tabela de Materiais); Incubar durante 1 h a 37 °C. Uma amostra controle positiva é tratada com DNase (50 U/100 μL) por 10 min para fragmentar o DNA.
NOTA: A dose de TBH (agente indutor do estresse oxidativo) foi escolhida para induzir um nível de morte celular facilmente detectável e submáximo dentro dos vasos isolados da retina18. - Fixar os olhos em formalina tamponada a 10% durante a noite (mínimo de 16 h).
- Use coquetel de citocinas para induzir inflamação (in vivo).
- Anestesiar os camundongos com uma injeção intraperitoneal de 100 mg/kg de quetamina e 5 mg/kg de xilazina.
- Use uma agulha personalizada de 33 G (ver Tabela de Materiais) para injetar 1 μL/olho do coquetel de citocinas no vítreo; o local da injeção está a 2-3 mm do limbo (Figura 2B).
NOTA: O cocktail de citocinas contém uma proporção de 1:1:1 de 1 μg/ml de TNF-α, 1 μg/ml de IL-1β e 1500 U/μL de IFN-γ18 (ver Tabela de Materiais). - 24 h após a injeção, eutanasiar os camundongos (seguindo protocolos aprovados institucionalmente), enuclear seus olhos e fixar com formalina tamponada a 10% durante a noite.
NOTA: O experimento pode ser pausado após a fixação por no máximo 1 semana e, em seguida, reiniciado mais tarde.
2. Isolamento da retina
- Abra o globo ocular.
- Use pinça reta para agarrar o nervo óptico suavemente (Figura 2C). Segure uma microfaca com a outra mão para fazer uma incisão de 2-3 mm posterior ao limbo.
- Mude da microfaca para a microtesoura para cortar paralelamente ao limbo enquanto gira o globo ocular junto com o nervo óptico até que o globo ocular tenha sido cortado em duas metades.
- Descarte a metade anterior do olho, incluindo o cristalino (Figura 2C).
- Remova a esclera.
- Use pinças retas para levantar suavemente a esclera 1-3 mm da retina.
- Use micro-tesoura para fazer dois cortes radiais na esclera parte do caminho para o nervo óptico. Evite cortar a retina subjacente.
- Use um par de pinças curvas para agarrar o retalho escleral e retirá-lo da retina. A camada de EPR sairá com a esclera.
- Lave a retina.
- Use uma microespátula para transferir a retina isolada para um poço dentro de um prato de 24 poços que foi preenchido com água bidestilada.
- Agite suavemente o prato a uma velocidade média-moderada à temperatura ambiente. Troque a água a cada 30 min a 1 h, pelo menos 4-5 vezes, depois saia durante a noite.
3. Isolamento da vasculatura retiniana
- Digestão: Substitua a água bidestilada por 800 μL de solução de tripsina YL (tripsina a 3% em tampão Tris 0,1 M (pH 7,8)). Incubar a 37 °C com agitação suave ou nula durante 4 h 15 min19 (Figura 2D).
NOTA: Evite agitação rápida, pois isso pode danificar a vasculatura. - Transferência: Mergulhe a extremidade larga de uma pipeta de transferência de vidro com solução de tripsina YL para transferir a retina para uma placa de Petri de 35 mm contendo água bidestilada sem fiapos.
- Remover a camada nuclear externa (fotorreceptores) (Figura 2E).
- Vire a semiesfera da retina virada para baixo. Use a escova lisa de cabelo único para pressionar suavemente a retina até o fundo do prato.
- Use a escova de alça para escovar suavemente os fotorreceptores da retina. As pinceladas são aplicadas em uma direção do nervo óptico em direção à periferia da retina. Os fotorreceptores podem se desprender em grandes folhas porque não estão ancorados ao resto da retina pelos vasos sanguíneos.
- Usando uma pipeta de 200 μL para coletar e descartar as folhas de tecido neural.
- Remova o vítreo.
- Vire a semiesfera da retina para que ela fique voltada para cima. Use um par de pinças curvas (A) para agarrar o vítreo o máximo possível sob um microscópio dissecante.
NOTA: O vítreo parece uma folha de tecido transparente ligada ao nervo óptico ou retina. - Use outra pinça curva (B) para agarrar a extremidade do vítreo onde ela conecta o nervo óptico. Remova o vítreo puxando a pinça A para longe da pinça B.
- Descarte o vítreo. Examine o remanescente do vítreo e repita esta etapa para remover todo o vítreo, pois o residual impedirá os próximos passos.
- Vire a semiesfera da retina para que ela fique voltada para cima. Use um par de pinças curvas (A) para agarrar o vítreo o máximo possível sob um microscópio dissecante.
- Remover o tecido neural e glial remanescente (Figura 2F).
- Vire a semiesfera da retina para que ela fique virada para baixo novamente. Mais uma vez, use a escova lisa para pressionar suavemente a retina até o fundo do prato (não use a ponta do cabelo).
- Use a escova de alça para escovar suavemente a vasculatura da cabeça do nervo óptico em direção à periferia para remover o tecido neural remanescente20.
- Gire a retina lentamente com a escova reta e use a escova de alça para remover todos os pequenos pedaços de tecido neural na vasculatura retiniana, até que a rede vascular esteja bem limpa (Figura 2G,H).
4. Montagem da vasculatura retiniana isolada em lâmina de microscópio
- Coloque uma lâmina de microscópio.
- Coloque um de montagem limpo (ver Tabela de Materiais) sob um microscópio dissecante. Encha o com água bidestilada.
- Use um fundo preto sob o microscópio de dissecação para ajudar a gerar contraste para ver a vasculatura transparente iluminada.
- Use pinças para colocar uma lâmina de microscópio limpa e rotulada na parte inferior do de montagem.
- Transfira a vasculatura retiniana.
- Mergulhe a extremidade larga de uma pipeta de transferência de vidro com solução de tripsina YL.
- Transfira a vasculatura retiniana limpa e desloque suavemente a vasculatura para a água bidestilada dentro do de montagem e acima da lâmina do microscópio.
- Monte a vasculatura retiniana.
NOTA: Enquanto a vasculatura estiver flutuando acima da lâmina do microscópio, a vasculatura isolada adquirirá sua forma normal de tigela.- Use a escova de alça para virar a semiesfera da retina voltada para cima e empurre suavemente a vasculatura para baixo na lâmina de vidro e, em seguida, use o cabelo para prender a vasculatura aberta no centro da lâmina. A vasculatura deve grudar na lâmina ao tocar.
- Monte a vasculatura escovando o vaso retiniano em forma de tigela do nervo óptico para a periferia.
- Repita a escovação em todas as direções até que a vasculatura grude completamente na lâmina.
- O ar seco da vasculatura retiniana.
- Uma vez que toda a vasculatura retiniana se conecte à lâmina, retire a lâmina da água levantando suavemente uma borda ou drenando lentamente a água no canto do para minimizar as correntes, retirando-a (Figura 2I).
NOTA: A vasculatura tornar-se-á facilmente visível uma vez seca ao ar (Figura 2J). - Marque a circunferência da vasculatura retiniana na parte de trás da lâmina com uma caneta marcadora.
- Proceder à coloração da amostra sem pausa.
- Uma vez que toda a vasculatura retiniana se conecte à lâmina, retire a lâmina da água levantando suavemente uma borda ou drenando lentamente a água no canto do para minimizar as correntes, retirando-a (Figura 2I).
5. Detecção de óbito com coloração TUNEL
NOTA: Para obter detalhes sobre esse procedimento, consulte Zheng et al.21. Imagens representativas de corpos apoptóticos induzidos por estresse de isquemia +/- ox em vasos isolados da retina são mostradas na Figura 3.
- Reidratar a vasculatura isolada com PBS. Enxaguar 3 vezes em PBS e incubar com Triton X-100 a 1% em PBS por 2 min em gelo para permeabilizar a vasculatura isolada.
- Enxágue as lâminas duas vezes com PBS para remover o Triton X-100 residual. Secar a área ao redor da amostra.
- Adicionar 50 μL de mistura de reacção TUNEL (ver Tabela de Materiais) à amostra. Incubar a lâmina numa atmosfera humidificada durante 60 minutos a 37 °C no escuro.
- Enxágue a lâmina 3 vezes com PBS para remover a mistura de reação TUNEL. Secar a área ao redor da amostra.
- Adicione uma gota de mídia de montagem DAPI para manchar os núcleos com DAPI e monte a amostra com um vidro de cobertura. Conservar a 4 °C no escuro.
NOTA: O protocolo pode ser pausado por até 1 semana antes da captura de imagens. - Fotografar a vasculatura resultante com um microscópio confocal de fluorescência (ver Tabela de Materiais). Capturar de seis a oito campos selecionados aleatoriamente na periferia distante ao redor do nervo óptico (Figura 4).
NOTA: Imagens representativas de corpos apoptóticos induzidos por citocinas em vasos isolados da retina são ilustradas na Figura 5. - Analise os resultados.
- Para amostras ex vivo, tratadas com TBH, execute as seguintes etapas.
- Conte o número de corpos apoptóticos (espécies duplamente positivas TUNEL/DAPI) em cada campo usando a Imagem J (ver Tabela de Materiais). Contabilizar a média dos corpos apoptóticos em todos os campos de uma única amostra.
- Calcular a mudança de dobra no número de corpos apoptóticos entre um par selecionado aleatoriamente de amostras de não-DM e DM.
- Determinar se há diferença estatisticamente significante utilizando o teste t de Student bicaudal18.
OBS: Manchar as amostras controle e experimental (não DM e MS) na mesma ocasião, pois a extensão da coloração TUNEL pode variar, mesmo quando feita da mesma forma. Como até 10 retinas podem ser limpas e montadas por dia por um usuário experiente, planeje processar um número igual de retinas de controle e experimentais antes de iniciar este protocolo.
- Para amostras tratadas com coquetel de citocinas in vivo, execute as seguintes etapas.
- Contar manualmente o número de corpos apoptóticos (espécies duplamente positivas TUNEL/DAPI) em toda a vasculatura retiniana.
- Calcular a mudança de dobra no número de corpos apoptóticos entre um par selecionado aleatoriamente de amostras de não-DM e DM.
- Determine se há diferença estatisticamente significante usando o teste t de Student bicaudal.
- Para amostras ex vivo, tratadas com TBH, execute as seguintes etapas.
Representative Results
O isolamento bem sucedido da vasculatura retiniana resulta em uma montagem plana de toda a rede da vasculatura retiniana de camundongos, com a integridade arquitetural intacta (Figura 2J). Na coloração com hematoxilina ácido periódico de Schiff (PASH), é possível distinguir os dois tipos celulares vasculares: células endoteliais (CE) e pericitos (PCs) (Figura 6). Os núcleos das células endoteliais são alongados, levemente corados e residem inteiramente dentro das paredes dos vasos. Os núcleos dos pericitos são circulares, densamente corados e se projetam das paredes capilares. As amostras coradas pelo PASH também revelam capilares acelulares, que carecem de núcleos.
A abordagem para induzir a morte foi norteada pelo seguinte raciocínio. Especulava-se que a proteção era limitada, ou seja, poderia ser sobrecarregada por um insulto muito forte que induz à morte. Consequentemente, os insultos (tanto isquemia/estresse oxidativo quanto citocinas18) foram otimizados para induzir um aumento facilmente detectável, mas ainda assim submáximo da extensão do óbito (Figura 3 e Figura 5).
É importante ressaltar que a presença de núcleos TUNEL-positivos foi contingente ao tipo específico de insulto empregado para desencadear a morte celular. O insulto à isquemia/estresse oxidativo levou a um padrão tram-track de apoptose celular, como ilustrado na Figura 3, enquanto o insulto à citocina resultou em um padrão distinto e bem definido, como ilustrado na Figura 5. Ambos os padrões podem ser observados em vasos da retina de pacientes comRD22, sugerindo que ambos os tipos de agentes induzem morte celular em humanos. Além disso, as distinções morfológicas observadas oferecem um meio de avaliar se a patologia foi impulsionada por estresse oxidativo ou citocinas.
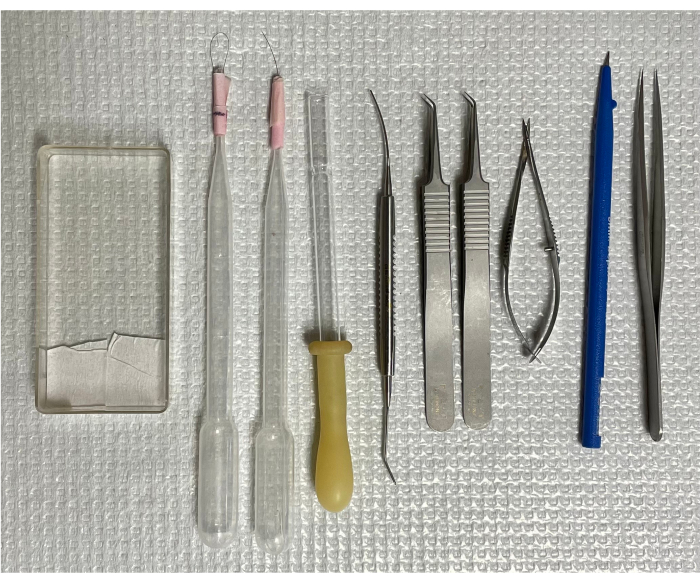
Figura 1: Ferramentas para isolamento da vasculatura retiniana de camundongos. Da esquerda para a direita: o de montagem, duas escovas de cabelo único, uma pipeta de transferência invertida, microespátula, duas pinças curvas, tesouras de mola, microfaca e pinça com pontas retas. Clique aqui para ver uma versão maior desta figura.

Figura 2: Esquema mostrando os principais passos para cometer um insulto indutor de morte e, em seguida, isolar a vasculatura retiniana de um olho de camundongo. (A) Indução de isquemia/lesão oxidativa, ex vivo. Após a enucleação, o globo ocular é submetido à isquemia na presença de TBH. (B) Administração in vivo (injeção intravítrea) de citocinas. (C) Cortar o globo ocular em duas metades. (D) Digestão enzimática retiniana: remoção da esclera e lavagem da retina em água bidestilada durante a noite. Incubar em solução de tripsina YL a 37 °C durante 4 h 15 min num poço de placa de 24 poços. (E) Remoção dos fotorreceptores. (F) Remoção do tecido neural e glial remanescente. (G) Rede vascular em forma de tigela limpa voltada para cima. (H) Rede vascular isolada em placa de 35 mm com fundo preto no palco de microscópio dissecante. (I) Vasculatura retiniana plana sobre lâmina. (J) Vasculatura retiniana seca ao ar em lâmina. Esse valor foi modificado de Li et al.18. Clique aqui para ver uma versão maior desta figura.
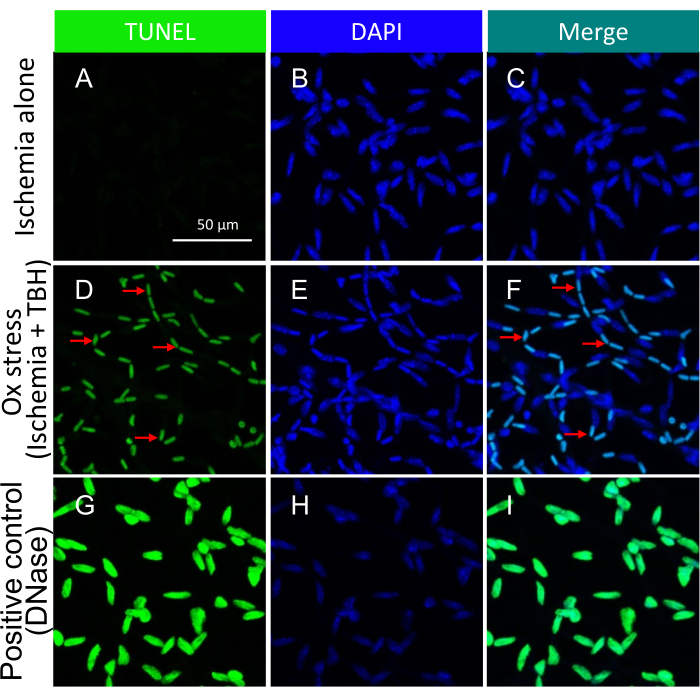
Figura 3: Detecção de corpos apoptóticos dentro de vasos da retina de camundongos tratados ex vivo com isquemia +/- TBH. Imagens representativas de corpos apoptóticos induzidos por estresse de isquemia +/- ox em vasos isolados da retina. O título de cada coluna indica a mancha. (A-C) Vasos da retina isolados de globos oculares submetidos a 1 h de isquemia isoladamente. (D-F) O mesmo que (A-C), exceto que o insulto de 1 h foi uma combinação de isquemia e estresse oxidativo (5 mM TBH). As setas vermelhas apontam para espécies representativas TUNEL/DAPI duplamente positivas. (G-I) Controle positivo tratado com DNase. Barra de escala = 50 μm. Esse valor foi modificado de Li et al.18. Clique aqui para ver uma versão maior desta figura.

Figura 4: Ilustração da seleção de campo para quantificação dos resultados. Uma varredura de mosaico 5 x 5 da vasculatura retiniana com a fusão do sinal TUNEL e DAPI. A seleção de seis a oito campos na periferia distante ao redor do nervo óptico é mostrada com quadrados vermelhos. Ampliação, 200x. Barra de escala = 100 μm. Clique aqui para ver uma versão maior desta figura.
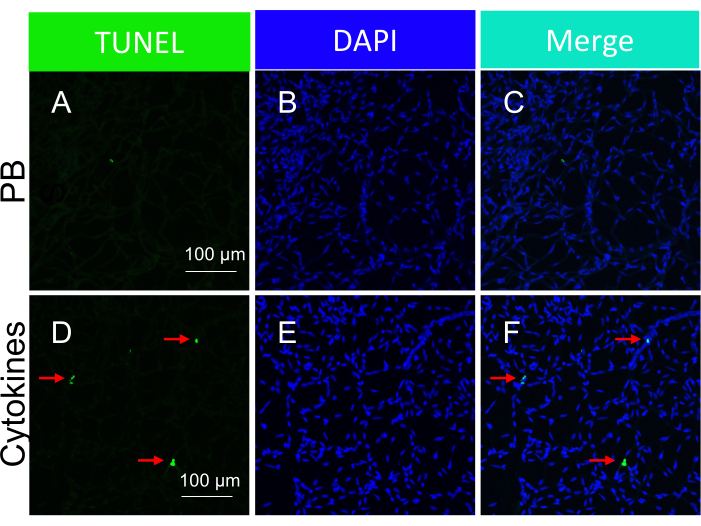
Figura 5: Detecção dos corpos apoptóticos dentro dos vasos da retina de camundongos em resposta à injeção intravítrea de citocinas (administração in vivo). Imagens representativas de corpos apoptóticos induzidos por citocinas em vasos isolados da retina. O título de cada coluna indica a mancha. (A-C) Imagens dos vasos da retina isolados de camundongos intravítreos injetados com PBS. (D-F) O mesmo que (A-C), exceto que um coquetel de citocinas foi injetado junto com PBS. As setas vermelhas apontam para espécies representativas TUNEL-positivas. Barras de escala = 100 μm. Esse valor foi modificado de Li et al.18. Clique aqui para ver uma versão maior desta figura.
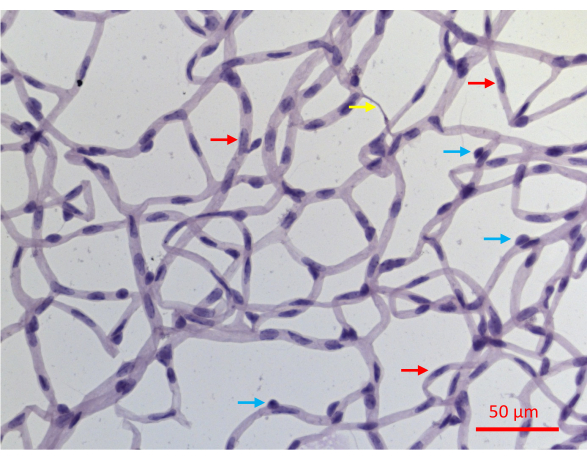
Figura 6: Imagem representativa de vasos da retina corados com PASH. Os vasos da retina de um camundongo que apresentou 20 semanas de DM induzido por STZ foram isolados como descrito na Figura 2, corados com PASH e fotografados enquanto iluminados com luz visível. Os núcleos pericitários nos capilares tendem a ser mais circulares e densamente corados (setas azuis), enquanto os núcleos alongados e menos densamente corados são diagnósticos de células endoteliais (setas vermelhas). A seta amarela aponta para um capilar acelular. Barra de escala = 50 μm. Clique aqui para ver uma versão maior desta figura.
Discussion
Neste estudo, um ensaio foi estabelecido para detectar resistência/vulnerabilidade da vasculatura retiniana à morte induzida por insultos relacionados ao DM/DR, como isquemia/estresse oxidativo e citocinas. Este manuscrito fornece uma descrição detalhada deste ensaio, que é uma modificação de vários protocolos publicados 19,20,21.
O protocolo engloba várias etapas cruciais. Primeiro, é imperativo dissecar meticulosamente a retina, garantindo a preservação da rede vascular e evitando rupturas substanciais. Isso pode ser feito fazendo uma incisão 2-3 mm posterior ao limbo, uma vez que a retina adere firmemente à ora serrata, e separá-la é um desafio. Em segundo lugar, cubra todos os instrumentos que entram em contato com os vasos (por exemplo, escovas de cabelo único, pipeta de transferência e pinças) com tripsina mergulhando essas ferramentas na solução de tripsina YL durante todo o procedimento. Isso impede que a vasculatura adera aos instrumentos utilizados nesse protocolo. Terceiro, como a microvasculatura é quase invisível sob luz normal, é necessária maior vigilância durante a aspiração de debris e transferência para a lâmina do microscópio, a fim de evitar perda acidental.
Um grau adequado de digestão enzimática das várias camadas da retina é crucial; A digestão insuficiente impede a separação do tecido neuronal da rede vascular, enquanto a digestão excessiva dissolve o plexo vascular. Vários tempos de digestão variando de 1 h19 a noite 23 foram relatados. Com base nas observações, um tempo de digestão de 4 h e 15 min produz os resultados mais favoráveis em comparação com durações de 2 h, 3 h e 4 h. É improvável que o prolongamento da digestão para além deste ponto melhore o processo e possa comprometer a integridade da vasculatura.
Nos casos em que a retina digerida adere à escova de cabelo único, mergulhe o cabelo em solução de tripsina YL várias vezes. Isso reduz as áreas pegajosas da escova. Se a escova de cabelo ainda adere ao tecido vascular, inspecione-a em busca de fragmentos residuais de vítreo e remova-os com pinças.
O momento ideal para a remoção completa do vítreo é após a eliminação dos fotorreceptores, mas antes da remoção do tecido neural e glial remanescente. A retina mantém a rigidez até que os fotorreceptores sejam removidos. A extração do vítreo nessa fase poderia potencialmente rasgar a retina/vasculatura. As delicadas camadas de tecido neural e glial residual desempenham um papel fundamental na preservação da forma curva da estrutura vascular. Eles impedem que a retina rasgue em seu centro quando o vítreo é descolado do nervo óptico.
Se a vasculatura isolada não aderir à lâmina do microscópio, isso indica que a seção da lâmina onde se espera que ocorra a adesão está suja. Tente mover os vasos pela superfície do slide para localizar um ponto pegajoso, mudar para um slide diferente ou limpar meticulosamente o slide e tentar novamente. Se os vasos aderirem à lâmina antes de se desenrolarem em sua forma de tigela, levante a vasculatura da lâmina para permitir que ela flutue livremente na água mais uma vez. Faça esta etapa com pinças que foram repetidamente mergulhadas na solução de tripsina YL.
Várias técnicas alternativas para o isolamento da vasculatura têm sido relatadas, as quais não seriam adequadas para o ensaio de proteção aqui descrito. Por exemplo, a lise osmótica tem sido empregada para isolar a vasculatura de amostras de retina não fixadas, facilitando as investigações bioquímicas do tecido24,25. No entanto, esse procedimento pode não preservar a anatomia da vasculatura, bem como a abordagem empregada neste artigo. Da mesma forma, enquanto o método de impressão tecidual para isolar grandes segmentos de microvasculatura permite a análise da arquitetura eletrotônica da vasculatura26, todo o leito vascular normalmente não é recuperado.
Este ensaio foi desenvolvido porque as abordagens existentes para monitorar a degeneração capilar não abordam a questão da proteção. A degeneração capilar, que ocorre após DM prolongado, indica se a RD se desenvolveu. Além de diagnosticar RD, esse resultado é útil para avaliar se um agente/terapia previne a RD. No entanto, os ensaios de degeneração capilar existentes não falam sobre o mecanismo de ação subjacente do agente. Tal agente pode prevenir eventos patológicos que conduzem a RD, como aumento do estresse oxidativo ou citocinas. Alternativamente, o agente pode reforçar a proteção, aumentando a resiliência ao estresse oxidativo e às citocinas e/ou promover a reparação de danos. Este novo ensaio de proteção pode ser usado para determinar se o efeito benéfico de uma determinada terapia envolve a aplicação do sistema endógeno que protege da morte relacionada ao DM.
Uma desvantagem deste ensaio de proteção é que ele não distingue os dois tipos celulares dentro dos vasos da retina: células endoteliais (CE) e pericitos (PCs). Embora a aparência de seus núcleos em cortes corados com PASH seja específica do tipo celular (Figura 6), nem todos os núcleos exibem características diagnósticas. Aproximadamente 30% dos núcleos não podem ser inequivocamente definidos como CE ou CP, pelo menos em parte, porque as imagens bidimensionais obtidas de amostras coradas com PASH resolvem incompletamente a estrutura tridimensional do plexo vascular. Esse obstáculo poderia ser superado por análises adicionais, como a coloração por imunofluorescência com marcadores específicos do tipo celular. Tais imagens, que distinguem os dois tipos celulares, poderiam ser co-coradas com TUNEL para determinar a resistência/vulnerabilidade de cada um dos tipos celulares vasculares.
Este ensaio vascular focado não fornece nenhuma informação sobre a retina neural. Ensaios adicionais poderiam ser desenvolvidos para fornecer tais informações. Por exemplo, em vez de isolar a vasculatura retiniana, uma única suspensão celular de toda a retina poderia ser gerada e então analisada (por triagem celular ativada fluorescente) quanto à resistência/vulnerabilidade. A inclusão de marcadores específicos do tipo celular (neurais e vasculares) juntamente com indicadores de morte celular forneceria um quadro mais completo dos tipos celulares da retina que têm a capacidade de proteção contra a morte mediada por DM/DR.
Em conclusão, o ensaio de proteção aqui descrito fornece uma abordagem poderosa para investigar o mecanismo responsável pelo atraso entre o início do DM e a manifestação da RD em camundongos.
Disclosures
Os autores não têm conflitos de interesse a declarar.
Acknowledgements
Este trabalho foi apoiado por subsídios da Illinois Society to Prevent Blindness, National Institute of Health (EY031350 e EY001792) e uma bolsa irrestrita da Research to Prevent Blindness Foundation.
Materials
| Name | Company | Catalog Number | Comments |
| 10% neutral buffered formalin | Fischer Scientific | SF100-4 | Fixation |
| 24-well plates | Falcon | 353047 | |
| 33 G needle | Hamilton | customized | |
| Ammonium hydroxide | Sigma | 221228-1L-PCA | |
| C57/BL6/J mice | The Jackson Laboratory | Jax #000664 | |
| Cytokine cocktail | consisted of a 1:1:1 ratio of 1 µg/mL TNF-α, 1 µg/mL IL-1 β and and 1500 U/µLIFN- γ | ||
| Dissecting microscope | Any microscope that allows good visualization of the retina is adequate. | ||
| Dumont #3 forceps | Fine Science Tools (FST) | 11231-30 | Straight tips |
| Dumont #5 forceps | Fine Science Tools (FST) | 11253-25 | Micro-blunted tips |
| Easy-Grip Tissue Culture Dishes | Falcon | 353001 | 35 x 10 mm |
| Glass transfer pipet | Fischer Scientific | 1367820A | snap off the thin end of a Pasteur pipet and fit the “broken” end with a rubber bulb. |
| Harris modified hematoxylin | Sigma | HHS32 | |
| Image J | NIH, Bethesda | https://imagej.nih.gov/ij/ | |
| In Situ Cell Death Detection Kit, Fluorescein | Milipore | 11684795910 | TUNEL reaction mixture |
| Micro cover glasses | VWR | 48366-227 | 22 mm x 22 mm |
| Microknife | Sharpoint | 72-1551 | |
| Micro-spatula | Fine Science Tools | 10091-12 | |
| Mounting cassette | Any transparent cassette that is slightly bigger than the microscope slide | ||
| Periodic acid | Sigma | 3951 | |
| Periodic acid solution | 35 mM periodic acid with 12 mM sodium acetate in H2O | ||
| Permount mounting medium | Fischer Scientific | SP15- 100 | |
| Prism 9 | GraphPad | ||
| Prolog Gold antifade reagent with DAPI | Invitrogen | P36935 | |
| Recombinant human IFN- γ | Peprotec | 300-02 | |
| Recombinant human IL-1 β | Peprotec | 200-01B | |
| Recombinant human TNF-α | Peprotec | 300-01A | |
| Schiff reagent base | Sigma | 3952016 | |
| Shaker Incubator (belly button shaker) | IBI Scientific | BBUAAUV1S | |
| Sodium acetate | Sigma | 71196 | |
| Steritop sterile vacuum bottle | Millipore | SCGPS05RE | Create filtered water |
| Superfrost Plus treated microscope slides | Fischer Scientific | 12-550-15 | use slides from unopened box |
| Tert-butyl hydroperoxide (TBH) | Sigma | 75-91-2 | |
| TRIZMA base | Fischer Scientific | 11-101-5522 | make 100 mM Tris, adjust pH to 7.8 using HCl) |
| Trypsin 1:250 | Amresco | 0458-50G | |
| Two “brushes” | made from single black hair taped to the end of plastic transfer pipet. One brush with a free end. The other brush with a loop | ||
| Vannas Spring Scissors | Fine Science Tools (FST) | 15000-00 | |
| Xylene | Sigma | 65351-M | |
| YL trypsin solution | 3% trypsin in 0.1 M Tris (pH 7.8) | ||
| Zeiss LSM 710 fluorescence microscope | Zeiss Microscopy |
References
- Teo, Z. L., et al. Global prevalence of diabetic retinopathy and projection of burden through 2045: Systematic review and meta-analysis. Ophthalmology. 128 (11), 1580-1591 (2021).
- Lee, R., Wong, T. Y., Sabanayagam, C. Epidemiology of diabetic retinopathy, diabetic macular edema and related vision loss. Eye Vis (Lond). 2, 21 (2015).
- Lima, V. C., Cavalieri, G. C., Lima, M. C., Nazario, N. O., Lima, G. C. Risk factors for diabetic retinopathy: A case-control study. Int J Retina Vitreous. 2, 21 (2016).
- Sabanayagam, C., Yip, W., Ting, D. S., Tan, G., Wong, T. Y. Ten emerging trends in the epidemiology of diabetic retinopathy. Ophthalmic Epidemiol. 23 (4), 209-222 (2016).
- Antonetti, D. A., Silva, P. S., Stitt, A. W. Current understanding of the molecular and cellular pathology of diabetic retinopathy. Nat Rev Endocrinol. 17 (4), 195-206 (2021).
- Wong, T., Cheung, C., Larsen, M., Sharma, S., Simó, R. Diabetic retinopathy. Nat Rev Dis Primers. 2, 16012 (2016).
- Wu, M. Y., Yiang, G. T., Lai, T. T., Li, C. J. The oxidative stress and mitochondrial dysfunction during the pathogenesis of diabetic retinopathy. Oxid Med Cell Longev. 2018, 3420187 (2018).
- Hietala, K., Harjutsalo, V., Forsblom, C., Summanen, P., Groop, P. H. Age at onset and the risk of proliferative retinopathy in type 1 diabetes. Diabetes Care. 33 (6), 1315-1319 (2010).
- Aiello, L. P., et al. Diabetic retinopathy. Diabetes Care. 21 (1), 143-156 (1998).
- Klein, R., Klein, B. E., Moss, S. E., Davis, M. D., Demets, D. L. The wisconsin epidemiologic study of diabetic retinopathy. Prevalence and risk of diabetic retinopathy when age at diagnosis is less than 30 years. Arch Ophthalmol. 102 (4), 520-526 (1984).
- Nathan, D. M., et al. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med. 329 (14), 977-986 (1993).
- . Clustering of long-term complications in families with diabetes in the diabetes control and complications trial. The diabetes control and complications trial research group. Diabetes. 46 (11), 1829-1839 (1997).
- Cruickshanks, K. J., Moss, S. E., Klein, R., Klein, B. E. Physical activity and proliferative retinopathy in people diagnosed with diabetes before age 30 yr. Diabetes Care. 15 (10), 1267-1272 (1992).
- Robinson, R., Barathi, V. A., Chaurasia, S. S., Wong, T. Y., Kern, T. S. Update on animal models of diabetic retinopathy: From molecular approaches to mice and higher mammals. Dis Model Mech. 5 (4), 444-456 (2012).
- Samuels, I. S., Bell, B. A., Pereira, A., Saxon, J., Peachey, N. S. Early retinal pigment epithelium dysfunction is concomitant with hyperglycemia in mouse models of type 1 and type 2 diabetes. J Neurophysiol. 113 (4), 1085-1099 (2015).
- Sergeys, J., et al. Longitudinal in vivo characterization of the streptozotocin-induced diabetic mouse model: Focus on early inner retinal responses. Invest Ophthalmol Vis Sci. 60 (2), 807-822 (2019).
- Sun, J. K., et al. Protection from retinopathy and other complications in patients with type 1 diabetes of extreme duration: The joslin 50-year medalist study. Diabetes Care. 34 (4), 968-974 (2011).
- Li, Y., et al. The slow progression of diabetic retinopathy is associated with transient protection of retinal vessels from death. Int J Mol Sci. 24 (13), 10869 (2023).
- Chou, J. C., Rollins, S. D., Fawzi, A. A. Trypsin digest protocol to analyze the retinal vasculature of a mouse model. J Vis Exp. 76, e50489 (2013).
- Veenstra, A., et al. Diabetic retinopathy: Retina-specific methods for maintenance of diabetic rodents and evaluation of vascular histopathology and molecular abnormalities. Curr Protoc Mouse Biol. 5 (3), 247-270 (2015).
- Zheng, L., Gong, B., Hatala, D. A., Kern, T. S. Retinal ischemia and reperfusion causes capillary degeneration: Similarities to diabetes. Invest Ophthalmol Vis Sci. 48 (1), 361-367 (2007).
- Mizutani, M., Kern, T. S., Lorenzi, M. Accelerated death of retinal microvascular cells in human and experimental diabetic retinopathy. J Clin Invest. 97 (12), 2883-2890 (1996).
- Weerasekera, L. Y., Balmer, L. A., Ram, R., Morahan, G. Characterization of retinal vascular and neural damage in a novel model of diabetic retinopathy. Invest Ophthalmol Vis Sci. 56 (6), 3721-3730 (2015).
- Dagher, Z., et al. Studies of rat and human retinas predict a role for the polyol pathway in human diabetic retinopathy. Diabetes. 53 (9), 2404-2411 (2004).
- Podestà, F., et al. Bax is increased in the retina of diabetic subjects and is associated with pericyte apoptosis in vivo and in vitro. Am J Pathol. 156 (3), 1025-1032 (2000).
- Puro, D. G. Retinovascular physiology and pathophysiology: New experimental approach/new insights. Prog Retin Eye Res. 31 (3), 258-270 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved