Трансформация и регенерация волосистых корней у Arabidopsis thaliana и Brassica napus
In This Article
Summary
В протоколе описана индукция волосистых корней с использованием первичных стеблей соцветий арабидопсиса и гипокотилей Brassica napus . Волосистые корни могут быть культивированы и использованы в качестве эксплантов для регенерации трансгенных растений.
Abstract
Волосистая трансформация корня представляет собой универсальный инструмент для биотехнологии растений у различных видов. Заражение штаммом Agrobacterium , несущим корнеиндуцирующую плазмиду (Ri), индуцирует образование волосистых корней в месте раны после переноса Т-ДНК из плазмиды Ri в геном растения. В протоколе подробно описана процедура инъекционной индукции волосистого корня у Brassica napus DH12075 и Arabidopsis thaliana Col-0. Волосистые корни могут быть использованы для анализа интересующего трансгена или обработаны для получения трансгенных растений. Среда регенерации, содержащая цитокинин-6-бензиламинопурин (5 мг/л) и ауксин 1-нафталинуксусную кислоту (8 мг/л), успешно вызывает побегообразование у обоих видов. Протокол охватывает генотипирование и селекцию регенерантов и растений Т1 для получения растений, несущих интересующий трансген и свободных от Т-ДНК из плазмиды Ri . Также изображен альтернативный процесс, приводящий к образованию композитного завода. В этом случае волосистые корни сохраняются на побеге (вместо естественных корней), что позволяет изучать трансген в волосистых корневых культурах в разрезе всего растения.
Introduction
Трансформация растений является узким местом любого генетического исследования в биологии растений. Почвенная бактерия Agrobacterium tumefaciens широко используется в качестве средства для доставки генов с помощью цветочного соуса или культуры тканей для получения трансформантов. A. tumefaciens инфицирует растения в месте раны и вызывает опухоли из-за переноса и интеграции Т-ДНК из плазмиды, индуцирующей опухоль (Ti), в геном растения-хозяина. В качествеэффективной системы трансформации растений обычно используют сконструированные штаммы A. tumefaciens с модифицированной Ti-плазмидой без Т-ДНК дикого типа и бинарный вектор с искусственной Т-ДНК и сайтами клонирования для вставки интересующего гена. Тем не менее, многие модельные виды и культуры не поддаются регенерации растений или регенерации in vitro или имеют длительные циклы роста, что влияет на эффективность этой системы трансформации.
Agrobacterium rhizogenes вызывает образование придаточных корней, или волосистых корней, в месте поражения после заражения растения-хозяина. Подобно A. tumefaciens, A. rhizogenes переносит Т-ДНК из корнеиндуцирующей плазмиды (Ri) в геном растения-хозяина, вызывая развитие трансгенных волосистых корней. Этот процесс контролируется в основном генами корневых онкогенных локусов (ROL) 2,3. Используя агробактериальные штаммы, несущие как плазмиду Ri, так и искусственный бинарный вектор, кодирующий интересующий ген, культуры волосатых корней были использованы для получения рекомбинантных белков, анализа функции промоторов или генов или редактирования геномов с использованием кластеризованных регулярно чередующихся коротких палиндромных повторов (CRISPR)/CRISPR-ассоциированного белка 9 (Cas9)4,5,6.
В нашем протоколе используется трансконъюгантный штамм Ti-less A. tumefaciens C58C1, несущий плазмиду Ri pRiA4b7. Т-ДНК плазмиды Ri состоит из двух участков, правой и левой Т-ДНК (TR-ДНК и TL-ДНК соответственно), которые могут независимо интегрироваться в геном растения8. Использование этой системыпозволило оптимизировать длительный процесс трансформации эксплантов в сорте Brassica napus DH12075 9. Протокол, подробно описанный ниже, позволяет осуществить регенерацию выбранных волосистых корневых линий и получить растения Т1, несущие интересующий трансген и свободные от генов rol, примерно за 1 год. Инъекционная трансформация волосистого корня может быть использована и для других видов Brassicaceae, как показано на примере трансформации Arabidopsis thaliana Col-0. В то время как гипокотиль используется для трансформации B. napus, A. thaliana вводится в основной стебель соцветия.
Protocol
1. Приготовление сред и растворов
- Приготовьте гормональные исходные растворы.
- Для приготовления 50 мл исходного раствора 1-нафталинуксусной кислоты (NAA), 6-бензиламинопурина (БАТ) и индол-3-масляной кислоты (IBA) с концентрацией 5 мг/мл растворяют 250 мг порошкообразного гормона в 2 мл 1 М гидроксида натрия (NaOH) и доводят объем до 50 мл сверхчистой водой.
- Для приготовления 50 мл гиббереллиновой кислоты (ГА3) с концентрацией 1 мг/мл растворяют 50 мг порошкообразного гормона в 2 мл этанола и доводят объем до 50 мл сверхчистой воды.
- Раствор фильтруют с помощью стерильного шприцевого фильтра с размером пор 0,22 мкм и распределяют по стерильным пробиркам по 2 мл для хранения. Хранить раствор при температуре -20 °C или 4 °C, в зависимости от рекомендаций производителя.
- Приготовьте исходные растворы антибиотиков. Для 50 мл исходного раствора цефотаксима и тикарциллина динатрия с концентрацией 100 мг/мл растворяют 0,5 г порошкообразного антибиотика в 40 мл сверхчистой воды и доводят до конечного объема 50 мл. Раствор фильтруют с помощью стерильного шприцевого фильтра с размером пор 0,22 мкм и распределяют по стерильным пробиркам по 2 мл для хранения. Хранить раствор при температуре -20 °C.
ПРИМЕЧАНИЕ: В охлажденную среду всегда добавляются антибиотики и гормоны. - Приготовьте 1 л бульона Лурия (LB) среды, добавив 10 г бакто-триптона, 5 г дрожжевого экстракта и 5 г хлорида натрия (NaCl) в мерный цилиндр объемом 1 л, и отрегулируйте объем до 1 л с двойной дистиллированной водой. Отрегулируйте pH до 7,0 с помощью KOH с помощью pH-метра (следуя инструкциям производителя). Раствор переносят во флакон объемом 1 л и добавляют 15 г бактериологического агара (1,5%), если готовится твердая среда и автоклавируют среду. При необходимости в охлажденную среду добавляют соответствующие антибиотики (бактериальная резистентность переносится бинарным вектором).
ПРИМЕЧАНИЕ: Используйте автоклав для стерилизации раствора. Поместите флакон в корзину, закройте крышкой и стерилизуйте в течение 20 минут при температуре 121 °C и 98,9 кПа. Этот протокол всегда используется для автоклавных растворов на дальнейших этапах. - Приготовьте 1 л среды с дрожжевым экстрактом говядины (YEB), смешав 5 г говяжьего экстракта, 1 г дрожжевого экстракта, 5 г пептона, 5 г сахарозы и 0,5 г хлорида магния (MgCl2) с двойной дистиллированной водой. Отрегулируйте объем до 1 л. Перелейте раствор в бутылку объемом 1 л. Автоклавирование среды.
- Приготовьте 1 л среды для проращивания семян, смешав 2,2 г порошка Мурасиге и Скуга (МС), 10 г сахарозы (1%) и 0,5 г натриевых солей 2-(N-морфолино)этансульфоновой кислоты (МЭС) с двойной дистиллированной водой. Отрегулируйте объем до 1 л, перемешайте и отрегулируйте pH до 5,8 с помощью KOH. Перелейте раствор в бутылку объемом 1 л и добавьте 8 г растительного агара (0,8%). Автоклавирование среды.
- Приготовьте 1 л питательной среды для растений, смешав 2,2 г порошка MS, 5 г сахарозы (0,5%) и 0,5 г солей MES с двойной дистиллированной водой. Отрегулируйте объем до 1 л, перемешайте и отрегулируйте pH до 5,8 с помощью KOH. Перелейте раствор в бутылку объемом 1 л и добавьте 8 г растительного агара (0,8 %). Автоклавирование среды.
- Приготовьте 1 л волосистой корневой питательной среды, смешав 4,4 г порошка витаминов MS + B5, 30 г сахарозы (3%) и 0,5 г солей MES в дважды дистиллированной воде. Отрегулируйте объем до 1 л, перемешайте и отрегулируйте pH до 5,8 с помощью KOH и перелейте раствор в бутылку объемом 1 л. Добавьте 3 г желирующего агента (0,3%) и автоклавируйте среду. Добавьте цефотаксим и тикарциллин динатрий до конечной концентрации 100 - 200 мг/л и 100 - 500 мг/л соответственно. При необходимости добавляют соответствующие антибиотики (резистентность обусловлена Т-ДНК бинарного вектора).
- Приготовьте 1 л композитной питательной среды для растений, смешав 2,2 г порошка витаминов MS + B5, 10 г сахарозы (1%) и 0,5 г солей MES в дважды дистиллированной воде. Отрегулируйте объем до 1 л, перемешайте, отрегулируйте pH до 5,8 с помощью KOH и перелейте раствор в бутылку объемом 1 л. Добавьте 6 г желирующего агента (0,6%) и автоклавируйте среду. Добавьте цефотаксим и тикарциллин динатрий до конечной концентрации 200 мг/л и 500 мг/л соответственно. При необходимости добавляют соответствующие антибиотики (резистентность обусловлена Т-ДНК бинарного вектора).
- Приготовьте 1 л регенеративной среды, смешав 4,4 г порошка витаминов МС+В5, 30 г сахарозы (3%) и 0,5 г солей МЭС с двойной дистиллированной водой. Отрегулируйте объем до 1 л, перемешайте и отрегулируйте pH до 5,8 с помощью KOH. Перелейте раствор в бутылку объемом 1 л и добавьте 3 г желирующего агента (0,3 %). Автоклавирование среды. Добавьте NAA и BAP до конечной концентрации 8 мг/л и 5 мг/л соответственно и тикарциллин динатрий до конечной концентрации 100 мг/л.
- Приготовьте 1 л среды для удлинения побегов, смешав 4,4 г порошка витаминов МС+В5, 20 г сахарозы (2%) и 0,5 г солей МЭС с двойной дистиллированной водой. Отрегулируйте объем до 1 л, перемешайте и отрегулируйте pH до 5,8 с помощью KOH. Перелейте раствор в бутылку объемом 1 л и добавьте 3 г растительного агара (0,3%). Автоклавирование среды. Добавьте БАТ и ГА3 до конечной концентрации 0,5 мг/л и 0,03 мг/л соответственно и цефотаксим до конечной концентрации 100 мг/л.
- Приготовьте 1 л корневой индукционной среды, смешав 2,2 г порошка витаминов MS + B5, 10 г сахарозы (1%) и 0,5 г солей MES с двойной дистиллированной водой. Отрегулируйте объем до 1 л, перемешайте и отрегулируйте pH до 5,8 с помощью KOH. Перелейте раствор в бутылку объемом 1 л и добавьте 3 г желирующего агента (0,3%). Автоклавирование среды. Добавьте IBA и цефотаксим до конечной концентрации 0,5 мг/л и 100 мг/л соответственно.
- Приготовьте 1 л цетилтриметиламмония бромида (CTAB) буфера, добавив 20 г CTAB (2% по сравнению с окончательным результатом), 100 мл 1M Tris-HCl, pH 8,0 (100 мМ конечного), 40 мл 0,5 М ЭДТА, pH 8,0 (20 мМ конечного), 81,8 г NaCl (1,4 М конечного) и 5 г PVP40 (0,5% с окончательным результатом). Доведите до 1 л двойной дистиллированной водой. Автоклавируйте раствор. Хранить раствор до 1 года при комнатной температуре.
2. Трансформация агробактерии бинарным вектором
- Подготовьте ДНК верифицированной бинарной плазмиды, содержащей кассету Т-ДНК, для интеграции в геном растения. Убедитесь, что плазмидная ДНК содержит мало солей, чтобы избежать электрических искр при использовании электропорации. Рекомендуется использовать набор для экстракции плазмидной ДНК по выбору.
- Электрокомпетентные клетки Agrobacterium tumefaciens C58C1, содержащие плазмиду, индуцирующую волосистый корень, pRiA4b , подготавливают 200 мл предварительно нагретой (28 °C) жидкости YEB 8 мл свежей ночной культуры. Инкубируйте культуру при 28 °C при встряхивании до тех пор, пока оптическая плотность при 600 нм (OD600) не станет около 0,5, что соответствует средней логарифмической фазе. Это займет около 4 - 5 часов.
- Разделите культуру Agrobacterium на четыре предварительно охлажденные стерильные центрифужные пробирки объемом 50 мл. Центрифуга в течение 15 мин при 4 °C при 3 200 x g.
ПРИМЕЧАНИЕ: Начиная с этого этапа, клетки должны храниться в холоде. - Удалите надосадочную жидкость и осторожно суспендируйте гранулу в (4x) 2,5 мл холодного (4 °C) 10% глицерина. Добавьте еще 47,5 мл холодного 10% глицерина и аккуратно перемешайте.
- Грануляторы при 3 200 x g в течение 15 мин при 4 °C. Выбросьте надосадочную жидкость и повторно суспендируйте клетки в (4x) 10 мл холодного 10% глицерина.
- Снова гранулируйте клетки и повторно суспендируйте их в (4x) 0,75 мл холодного 10% глицерина. Объедините содержимое всех четырех пробирок в одну (общий объем = 3 мл).
- Разделяют агробактериальный раствор на аликвоты по 50 мкл в предварительно охлажденных стерильных микропробирках по 1,5 мл. Заморозьте аликвоты на сухом льду или жидком азоте. Храните пробирки при температуре -80 °C для использования в будущем.
- Поместите одну пробирку компетентных клеток (50 мкл) на лед, смешайте с 5 мкл плазмидной ДНК (всего 1 мкг, начиная с шага 2.1), перелейте смесь в электропорационную кювету (зазор 0,2 см) и инкубируйте в течение 5 мин на льду.
- Поместите кювету в электропоратор и электропорируйте ячейки со следующими настройками: емкость 25 мкFD, сопротивление 400 Ω, электрическое напряжение 2,5 кВ, длительность импульса 9,7 мс.
- Добавьте 950 мкл жидкой среды LB в клетки, которые затем культивируют при 28 °C в течение 2 ч при 300 об/мин в термомиксере. Распределите 50 мкл клеточной культуры на твердую среду LB с соответствующим селективным антибиотиком. Культивируйте планшеты в течение 2 дней при температуре 28 °C.
ПРИМЕЧАНИЕ: Рекомендуется наносить различные клеточные культуры (10 мкл - 100 мкл) на пробирку, чтобы определить надлежащий объем культуры и избежать чрезмерного роста бактерий. - Готовят жидкие культуры из нескольких отобранных колоний в 5 мл жидкой среды LB с антибиотиками. Выращивайте бактерии в течение ночи при температуре 28 °C при встряхивании. Используйте эти культуры для запасов глицерина, смешивая 0,5 мл жидкой бактериальной культуры и 0,5 мл 40% глицерина.
ПРИМЕЧАНИЕ: Эти колонии проверяются на наличие трансгена с помощью ПЦР колонии. Для этого добавляют небольшое количество колонии из планшета в мастер-смесь ПЦР, содержащую буфер, dNTP и Taq-полимеразу по выбору, вместе с праймерами, амплифицирующими часть Т-ДНК из бинарного вектора. Посевной материал из запасов глицерина используется для трансформации растений.
3. Волосистая трансформация корня Brassica napus DH12075
- Поместите семена Brassica napus DH12075 в микропробирки и стерилизуйте их в флоубоксе. Сначала обезжирьте семена водой и 0,1% моющим средством, встряхивая в течение 60 с. Затем промойте семена водой, а затем 70% этиловым спиртом, оба в течение 60 с.
- Стерилизуют семена, используя 10% раствор товарного отбеливателя, содержащего гипохлорит натрия. Встряхивайте семена в этом растворе в течение 20 минут.
- Промойте семена 4 раза стерильной водой в течение 60 с каждое. Поместите их в чашки Петри, содержащие среду для прорастания семян. Семена следует стратифицировать в холодном режиме при температуре 4 °C в течение ночи и переместить планшеты в помещение для выращивания (21 °C, 16 часов света / 8 часов темноты).
- Перенесите 5-дневную рассаду в ящики для культуры растений, содержащие питательную среду для растений.
ПРИМЕЧАНИЕ: Наилучшая эффективность трансформации в DH12075 была выявлена для 18-дневной рассады. Возраст саженцев может быть оптимизирован для местных условий произрастания или других сортов. - Инокулируют жидкую культуру Agrobacterium tumefaciens C58C1 , несущую волосистую плазмиду pRiA4b , индуцирующую корень, и бинарный вектор для трансформации (из шага 2.11) с помощью инокуляционной петли. Используйте 5 мл LB medium. Выращивайте эту культуру в течение ночи при 28 °C, пока она не достигнет OD600 = 0,9 - 1.
ПРИМЕЧАНИЕ: Агробактерии, содержащие только плазмиду Ri , используются, если образуются волосистые корни дикого типа. - Ввести небольшое количество культуры (примерно 50 мкл) с помощью инсулинового шприца в гипокотиль 18-дневного саженца (с шага 3.4.). Проколите гипокотиль иглой 26G, установленной на шприце на высоте около 1 см над поверхностью среды. Введите жидкость в рану. Ткань на поверхности гипокотиля также может быть поцарапана шприцем.
ПРИМЕЧАНИЕ: Количество привитых саженцев должно быть адаптировано к потребностям экспериментатора. - Верните растения в помещение для культивации при температуре 21 °C на 2-4 недели до тех пор, пока на месте раны не образуются каллус и волосистые корни.
- Срежьте каллус с появившимися волосистыми корнями от гипокотиля и поместите его в чашку Петри с волосистой корневой питательной средой, содержащей селективные антибиотики (переносимые Т-ДНК) и цефотаксим (200 мг/л) и тикарциллин (500 мг/л) для подавления роста агробактерий. Заклейте чашки Петри газопроницаемой лентой. Культивируйте волосистые корни при температуре 24 °C в темноте.
ПРИМЕЧАНИЕ: Надлежащая концентрация специфических антибиотиков, используемых для функционального отбора, должна быть проверена на волосистых корнях дикого типа. Для B. napus DH12075 волосистыми корнями, несущими резистентность к канамицину, применяют концентрацию канамицина 25 мг/л.
ПРИМЕЧАНИЕ: На этом этапе можно создать сложное растение, состоящее из побега дикого типа и трансгенных волосистых корней, поддерживающих рост такого растения. Вместо того, чтобы срезать волосистые корни со стебля, удаляют родные корни растения. Растение с появляющимися волосистыми корнями переносят в ящик для культивирования растений с композитной питательной средой, содержащей цефотаксим (200 мг/л) и тикарциллин (500 мг/л) для подавления роста агробактерий и селективный антибиотик (переносимый Т-ДНК). - Через 1 – 2 недели изолируют волосистые корни на чашке Петри от каллуса и индивидуализируют их на планшетах с той же питательной средой. Пересаживайте культуру на свежую тарелку каждые 4 – 5 недель. Добавьте 0,25 мг/л ИМК для увеличения ветвления корней.
- Снижают концентрации цефотаксима и тикарциллина постепенно при каждом переносе на 100 мг/л (т.е. среда для первого переноса содержит 100 мг/л цефотаксима и 400 мг/л тикарциллина; для второго переноса — 300 мг/л тикарциллина и т. д.). Через 3-4 месяца культивируйте волосистые корни на волосистой питательной среде с тикарциллином в дозе 100 мг/л и селективным антибиотиком.
4. Регенерация Brassica napus DH12075 волосистыми корнями
- Независимые волосистые корневые линии переносят на пластины со средой регенерации в стерильных условиях с помощью пинцета, перед применением поджигают. Пересадите 5 - 10 корней в чашку Петри и культивируйте их при 21 °C в фотопериод длинного дня (16 ч света / 8 ч темноты). Заклейте чашки Петри газопроницаемой лентой.
- Каждые 3-4 недели пересаживайте волосистые корни на пластины со свежей средой регенерации. Обратите внимание, что каллусы образуются примерно через 2 недели. Костная мозоль начинает стрелять еще через 2 недели и до 8 - 9 недель после образования мозолей.
- Индивидуализируйте побеги и перенесите их в ящики для культуры растений со средой удлинения побегов на 2-3 недели, чтобы способствовать удлинению побегов.
- Вытянутые побеги переносят в ящики для культуры растений с корневой индукционной средой. Обновляйте культуру каждые 3 – 4 недели. Эффективность укоренения в DH12075 составляет 87% через 30 дней и до 100% через 60 дней.
- Перенесите укоренившиеся растения в почву после удаления следов желирующего агента, чтобы предотвратить грибковую инфекцию. Убедитесь, что растения сначала акклиматизированы в фитотронах (21 °C, фотопериод длинного дня, 150 мкЭ), а затем перенесите их в теплицу для цветения (21 °C / 18 °C, фотопериод длинного дня, 150 мкЭ).
5. Выбор регенеранта и установки Т1
ПРИМЕЧАНИЕ: Волосистые корневые линии могут быть выбраны до начала процесса регенерации. Тип отбора зависит от содержания, переносимого трансгеном. Волосистые корни могут быть отобраны для экстракции ДНК и генотипирования или выявления мутаций, экстракции РНК с последующим синтезом кДНК и ОТ-кПЦР для анализа на уровне экспрессии гена выбора, микроскопии для обнаружения флуоресценции или обработаны для окрашивания ГУС.
- После переноса в почву повторно генотипируют растения-регенеранты Т0 (и сеянцы Т1), чтобы избежать побегов из селекционных процедур. Растения T0 демонстрируют измененный фенотип, называемый фенотипом Ri: обширный рост корней, курчавые листья и карликовые побеги, вызванные присутствием TL и/или TR-ДНК плазмиды Ri , вставленной в геном растения.
- Чтобы ускорить селекцию Т1, используйте семена, содержащие зеленые зрелые эмбрионы (примерно через 21 - 28 дней после опыления для DH12075 для эмбриона торпеды или старше) из растений-регенерантов Т0 для спасения эмбрионов.
- Работа в стерильном поточном боксе. Соберите силики и стерилизуйте их поверхность 70% этанолом.
- Поместите их на двусторонний скотч, приклеенный скотчем к крышке тарелки или слайду.
- С помощью стереобинокля разрежьте кремнезем по краям клапана с помощью иглы 26G. Следите за тем, чтобы срез не повредил семена. Для удобства захвата установите иглу на шприц объемом 1 мл.
- Раскройте плодолистики и приклейте их к ленте. Соберите недозревшие семена и переложите их на тарелки со средой для прорастания семян. Заклейте пластины газопроницаемой лентой.
- Поместите планшеты в помещение для культивации (21 °C, 16 часов света / 8 часов темноты) до появления всходов.
- Генотип проростков Т1 на наличие интересующего трансгена и отсутствие Ri TR/TL (рис. 1). Соберите материал листьев и извлеките их ДНК выбранным методом. Метод CTAB описан здесь:
- Соберите листовой материал в микропробирку объемом 2 мл, содержащую две керамические шарики. Заморозьте трубку в жидком азоте.
- Измельчите материал с помощью шаровой мельницы. В качестве альтернативы можно использовать пестик и ступку.
- После быстрого отжима добавьте в порошок 400 мкл буфера CTAB. Ненадолго взболтайте, открутите вниз и инкубируйте при 60 °C не менее 50 минут.
- Остудить раствор до комнатной температуры в течение 15 мин. Добавьте один объем хлороформа и аккуратно перемешайте.
ВНИМАНИЕ: При использовании хлороформа работайте под потоком химикатов и используйте перчатки для защиты. Любой раствор, содержащий хлороформ, следует выбрасывать в соответствующий мусорный бак. - Центрифуга в течение 5 мин при 18 400 x g с помощью настольной центрифуги. Переносят 250 - 350 мкл верхней водной фазы в новую микропробирку. Опустите интерфазу.
- Добавьте один объем изопропанола, хорошо перемешайте и выдержите 5 минут при комнатной температуре. Центрифуга в течение 40 мин при 18 400 x g.
- Слейте жидкость и добавьте 200 мкл 70% этанола. Промывайте гранулы и центрифугу в течение 15 минут при 18 400 x g.
- Слейте жидкость. Высушите гранулу на воздухе и добавьте 50 - 100 мкл сверхчистой воды. Дайте ДНК раствориться в течение 1 часа или ночи в холодильнике.
- Выполните генотипирование методом ПЦР для гена rolA (TL), гена aux1 (TR) и локуса virC (Agrobacterium). Готовят реакцию ПЦР с использованием подготовленной ДНК (из шага 5.3.), праймеров, буфера, dNTP и Taq-полимеразы в соответствии с протоколом производителя. Амплифицированные фрагменты имеют длину 200 - 500.н.
Праймеры, специфичные для rolA:
Нападающий: GTTAGGCGTGCAAAGGCCAAG
Реверс: TGCGTATTAATCCCGTAGGTC
Праймеры, специфичные для aux1:
Вперед: CATAGGATCGCCTCACAGGT
Реверс: CGTTGCTTGATGTCAGGAGA
Праймеры, специфичные для virC:
Вперед: AATGCGTCTCTCTCGTGCAT
Реверс: AAACCGACCACTAACGCGGAT
Примечание: Перенос и интеграция Т-ДНК могут быть частичными, и только части TL и/или TR могут интегрироваться в геном. Таким образом, рекомендуется проанализировать наличие других ORF TL (например, rolB и rolC) и TR (aux2, mas1, ags1) в проростках Т1. Последовательности праймеров, специфичные для этих локусов, перечислены в Jedličková et al.9. - Оценка реакций ПЦР методом гель-электрофореза.
ПРИМЕЧАНИЕ: Рекомендуется включить положительный контроль в этот анализ, чтобы убедиться в наличии ДНК ПЦР-класса. - Отбирают на наличие (или отсутствие) трансгена по протоколам, основанным на содержании этого трансгена.
- Перенесите выбранную рассаду в почву.
6. Трансформация и регенерация волосистых корней у Arabidopsis thaliana Col-0
- Стерилизовать семена A. thaliana с поверхности любым способом (отбеливатель, этанол или газообразный хлор).
- Пластинчатые стерильные семена на среде для проращивания семян. После 2 суток холодной стратификации переместите планшеты в помещение для культивации (21 °C с фотопериодом длинного дня и влажностью 50%).
- Перенесите 1-недельную рассаду в ящик для культуры растений с питательной средой для растений.
- Подготовьте агробактериальные культуры, как указано в шаге 3.5.
- Ввести небольшое количество культуры (примерно 50 мкл) иглой, установленной на инсулиновом шприце, у основания первичного стебля соцветия (примерно на 1 – 2 см выше розетки) 1-месячных проростков арабидопсиса . Ткань на поверхности первичного стержня также может быть поцарапана шприцем.
- Через 2-4 недели после инъекции удаляют появляющиеся волосистые корни и культивируют их на чашках Петри с волосистой средой для роста корней, дополненной селективным антибиотиком (переносимым Т-ДНК) и цефотаксимом (200 мг/л) и тикарциллином (500 мг/л) для подавления роста агробактерий. Инкубируйте планшеты при температуре 24 °C в темноте.
- Через 1 – 2 недели индивидуализировать волосистые корни на пластинах с той же питательной средой. Пересаживайте выбранные волосистые корневые линии на свежую среду каждые 4 – 5 недель.
ПРИМЕЧАНИЕ: Волосистые корни A. thaliana тоньше, чем у B. napus, и необходимо соблюдать осторожность при переносе на свежую среду. - Перенесите волосистые корни на пластины с регенерирующей средой, чтобы вызвать образование каллуса. Культивируйте планшеты при температуре 21 °C в фотопериод длинного дня (16 ч светлый / 8 ч темный).
- Побеги появляются из каллуса через 18 – 21 день выращивания. Обрежьте побеги и перенесите их в среду для удлинения побегов на 2 - 3 недели, чтобы стимулировать рост и удлинение.
- Вытянутые побеги перенесите в корневую индукционную среду.
- Перенесите укоренившиеся растения в почву. Растения T0 также имеют фенотип Ri. Проведите трансгенный отбор, как описано для B. napus DH12075 (шаг 5).
Representative Results
Ранее мы оптимизировали протокол индукции волосистого корня на основе инъекций у трех сортов Brassica napus, а именно DH12075, Topas DH4079 и Westar9. Для применения этого протокола трансформации к модельному виду A. thaliana первичным стеблям соцветий 1-месячных сеянцев вводили агробактериальный инокулюм. Волосистые корни появились на месте инъекции через 2-4 недели. Волосистые корни иссекали и культивировали на твердой среде. Сравнение метода у этих двух видов изображено на рисунке 1.
Отобранные волосистые корневые линии переносили в среду регенерации, чтобы стимулировать образование побегов. У A. thaliana желтые каллусы индуцировались в течение 14 дней во всех 10 исследованных волосистых корневых линиях. Зачатки первых побегов видны в виде темно-зеленых пятен, появившихся в течение 3 недель после переноса в среду регенерации (рис. 2). Через 4 недели культуры побеги покрыли волосистые корни в 9 из 10 волосистых корневых линий (эффективность регенерации 90%). В некоторых случаях из каллуса выделялись придаточные корни (рис. 2H). Одна линия не регенерировала даже через 3 месяца на среде Regeneration (каждые 4 недели волосистые корни пересаживались на свежую среду). Таким образом, эффективность регенерации волосистых корней A. thaliana сходна с эффективностью B. napus DH120759.
Волосистые корневые регенеранты B. napus и A. thaliana демонстрируют карликовый фенотип (рис. 3), что является типичной чертой волосистых корневых растений2. Мы также наблюдали густую корневую систему, морщинистые листья и изменения во времени цветения. Этот так называемый фенотип волосистого корня (или Ri) обусловлен генами rol плазмиды Ri , вставленными в геном растения. Вставка Ri Т-ДНК и трансгена, кодируемого на бинарном векторе, может быть независимой или сцепленной. Таким образом, сегрегационный анализ потомства Т1, созданного путем самоопыления, помогает идентифицировать растения без рулонов, экспрессирующие интересующий трансген. Генотипирование растений Т1 проводят с помощью ПЦР-праймеров, специфичных для ORF TL и TR и интересующего трансгена. Отсутствие агробактериальной обсемененности проверяется отсутствием продуктов ПЦР праймеров virC (рис. 1).
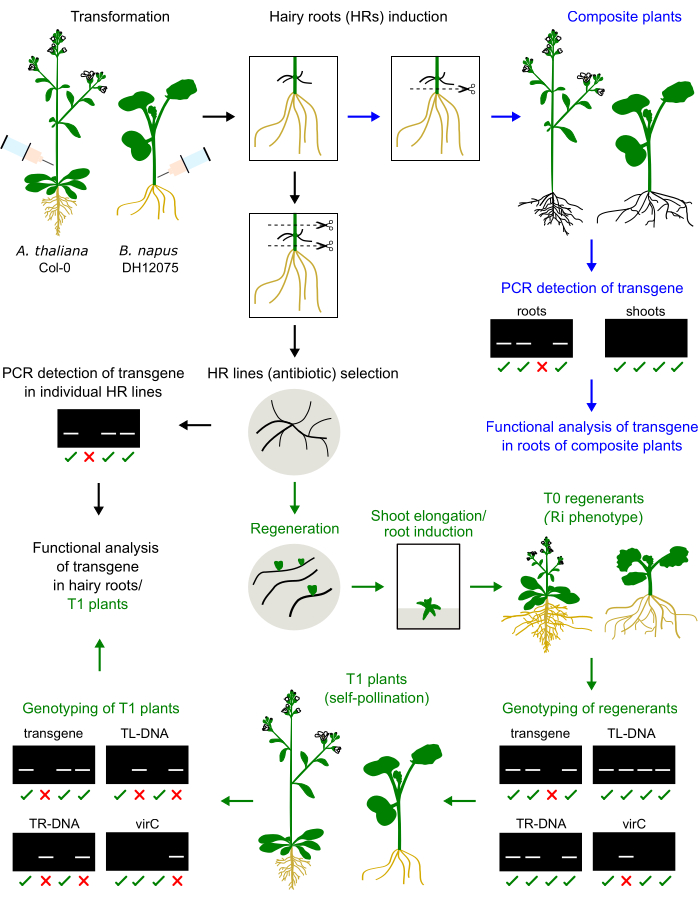
Рисунок 1: Краткое описание процедуры у A. thaliana и B. napus. Инъекция Agrobacterium inoculum в стебель гипокотиля или первичного соцветия вызывает развитие волосистых корней. Волосатые корни могут заменить родные корни, чтобы создать сложное растение, которое будет генотипировано и проанализировано (синие стрелки). Культивируемые волосистые корни могут быть регенерированы в растения Т0, размножаться в растениях Т1 и генотипированы (зеленые стрелки). Волосатые корни также могут быть субкультивированы для функционального анализа (черная стрелка). Приведены примеры результатов генотипирования. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
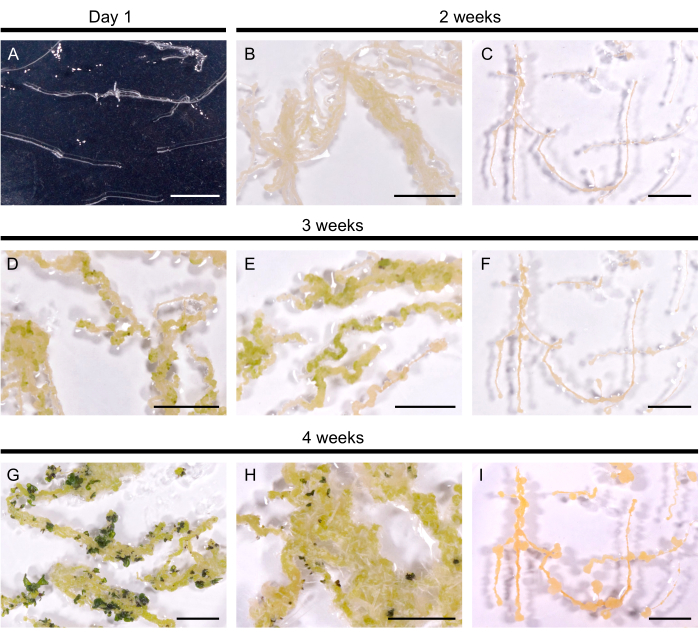
Рисунок 2: Регенерация волосистых корней у A. thaliana. (А) Волосистая корневая культура через 1 сутки после ее переноса на пластины. (В, В) Каллусы развивались в течение 2 недель культивирования на регенерационной среде. (Г, Д) Побег зачатков появился через 3 недели культивирования. (Г, Н) Всходы образуются через 4 недели. (H) Придаточные корни развились из каллуса. (С, Ж, И) Нерегенерирующая волосистая корневая линия. Масштабные линейки обозначают 1 см. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Репрезентативные фотографии дикорастущих растений B. napus и A. thaliana и регенерантов с волосистыми корнями (растения T0). Обратите внимание на фенотип Ри регенерантов. Масштабные линейки обозначают 2 см. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Discussion
Мы разработали простой протокол трансформации волосистого корня и последующей регенерации у B. napus и A. thaliana. Этот процесс включает в себя инъекционную индукцию волосистого корня в гипокотиль (B. napus) или первичный стебель соцветия (A. thaliana). Метод введения в гипокотиль агробактериального штамма C58C1, несущего плазмиду Ri, был эффективен также в семействе Fabaceae10,11, помимо представителей семейства Brassicaceae, представленных в данном исследовании.
Альтернативой инъекционному методу является иммерсионная трансформация, состоящая из погружения экспланта в бактериальную суспензию с последующим совместным культивированием экспланта с агробактериями. Преимущество инъекционного метода перед иммерсионным заключается в экономии времени за счет отсутствия некоторых протокольных этапов: подготовки экспланта, теста времени совместного культивирования и культивирования на среде, содержащей гормон для индукции волосистых корней. Несмотря на то, что оба подхода эффективны для индукции волосистого корня, у некоторых видов наблюдалась более высокая эффективность трансформации при инъекционном методе по сравнению с эксплант-иммерсионным12,13. Кроме того, инъекционная трансформация также полезна для получения сложных растений (трансгенных волосистых корней и побегов дикого типа). После отрезания первоначальных корней трансформированного растения волосистые корни поддерживают рост растения, и трансген может быть изучен в контексте всего растения.
Критическим этапом индукции волосистого корня является введение посевного материала в гипокотиль, или первичный стебель соцветия. Гипокотили B. napus хрупкие, и разрезание всего гипокотиля может легко произойти. То же самое можно наблюдать и с A. thaliana из-за тонкости стебля соцветия. Если требуется сравнение эффективности трансформации разных видов/сортов, мы рекомендуем одному человеку проводить все эксперименты, чтобы избежать ошибки, вызванной манипуляциями и навыками введения растений.
Разработан эффективный протокол регенерации волосистых корней у B. napus DH12075 и A. thaliana Col-0. Поскольку регенерация является очень изменчивым процессом, некоторые модификации протокола могут быть применены к выбранному виду или сорту. Например, волосистые корневые побеги могут быть вызваны другим соотношением ауксин/цитокинин (1:1) у B. oleracea14. В качестве альтернативы вместо БАТ можно использовать цитокинин тидиазурон, например, в случае волосистых корней B. campestris 15.
Множественные вставки Т-ДНК плазмиды Ri в геном растения представляют собой потенциальное ограничение системы трансформации и регенерации корня волоса. В таких случаях после сегрегационного анализа проростков Т1 не обнаруживается ни одного растения, свободного от TL/TR из плазмиды Ри. Таким образом, мы рекомендуем генерировать несколько независимых волосистых корневых линий для каждого трансгена.
Волосистые корневые культуры являются чрезвычайно мощным инструментом для функциональных исследований генов, главным образом из-за их быстрого укоренения и дешевого обслуживания (в питательных средах не требуются гормоны). Этот протокол охватывает методы индукции и регенерации волосистых корней у B. napus и A. thaliana, которые могут быть использованы для изучения интересующего трансгена непосредственно в волосистых корневых культурах, в контексте всего растения с использованием сложных растений или после регенерации трансгенных растений.
Disclosures
Авторы заявляют, что исследование проводилось без каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Acknowledgements
Выражаем благодарность Йиржи Макасу (Jiří Macas) (Биологический центр CAS, Ческе-Будеёвице, Чешская Республика) за предоставление агробактериального штамма. Отдел наук о базовых установках CEITEC MU получил признание за свою техническую поддержку. Эта работа была поддержана Министерством образования, молодежи и спорта Чешской Республики совместно с Европейским фондом регионального развития-проектом «ПОЮЩЕЕ РАСТЕНИЕ» (no. CZ.02.1.01/0.0/0.0/16_026/0008446) и проект INTER-COST LTC20004.
Materials
| Name | Company | Catalog Number | Comments |
| 1.50 mL tubes | Eppendorf | 125.215 | |
| 10% solution of commercial bleach | SAVO | ||
| 1-naphthaleneacetic acid (NAA) | Duchefa | N0903 | Callus regeneration medium |
| 2.0 mL tubes | Eppendorf | 108.132/108.078 | |
| 3M micropore tape | Micropore | ||
| 6-Benzylaminopurine (BAP) | Duchefa | B0904 | Callus regeneration medium, Shoot elongation medium |
| 70% ethanol | |||
| bacteriological agar | HiMedia | RM201 | LB medium |
| Bacteriological peptone | Oxoid | LP0037 | LB and YEB media |
| Beef extract | Roth | X975.1 | YEB medium |
| Bottles | DURAN | L300025 | |
| Cefotaxime sodium | Duchefa | C0111 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium |
| chloroform | Serva | 3955301 | |
| CTAB Hexadecyltrimethylammonium bromide | Sigma | 52365 | |
| dNTP mix | Thermo Fisher Scientific | R0193 | |
| EDTA - Titriplex III, (Ethylenendinitrilo)tetraacetic Acid, Disodium Salt, Dihydrate | Sigma | ES134-250G | |
| elctroporation cuvette | |||
| electrophesis agar, peqGOLD universal | VWR | 732-2789 | |
| electrophoresis chamber | BIO-RAD | ||
| electrophoresis gel reader | BIO-RAD | ||
| electroporator GenePulser Xcell | BIO-RAD | ||
| ethidium bromide | AppliChem | ||
| Gene Pulser/MicroPulser electroporation cuvettes, 0.2 cm gap | BIO-RAD | 1652082 | |
| Gene Ruler DNA ladder mix | Thermo Fisher Scientific | SM0331 | |
| Gibberellic acid (GA3) | Duchefa | G0907 | Shoot elongation medium |
| glycerol | Sigma | G5516-1L | |
| HEPES (2-(4-(2-hydroxyethyl)-1-pirerazinyl)-ethansulfonique | Merck | 1101100250 | |
| indole-3-butyric acid (IBA) | Duchefa | I0902 | Root induction medium |
| kanamycin monosulfate | Duchefa | K0126 | |
| Magenta GA-7 Plant Culture Box w/ Lid | Plant Media | V8505-100 | |
| Measuring cylinder | |||
| MES monohydrate | Duchefa | M1503 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium, Medium for germination, Plant growing medium |
| Murashige and Skoog medium (MS) | Duchefa | M0237 | Medium for germination, Plant growing medium |
| Murashige and Skoog medium (MS) + B5 vitamins | Duchefa | M0231 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium |
| needle Agani 26G x 1/2 - 0.45 x 13mm | Terumo | ||
| pH meter | |||
| Phytagel | Sigma | P8169 | Callus regeneration medium, Root induction medium, Medium for germination |
| PVP 40 (polyvinylpyrolidone Mr 40000) | Sigma | 9003-39-8 | |
| Redtaq DNA Polymerase,Taq for routine PCR with inert dye, 10X buffer included | Sigma | D4309-250UN | |
| Retsh mill | Qiagen | ||
| sodium chloride | Lachner | 30093-APO | LB medium |
| square Petri Dishes | Corning | GOSSBP124-05 | |
| sucrose | Penta | 24970-31000 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium, Medium for germination, Plant growing medium |
| Syringe filter | Carl Roth | P666.1 | Rotylabo syringe filters 0.22 µm pore size |
| thermomixer | Eppendorf | ||
| Ticarcillin disodium | Duchefa | T0180 | Hairy root growing medium |
| Tris(hydroxymethyl)aminomethan | Serva | 3719003 | |
| ultrapure water | Millipore Milli-Q purified water | ||
| Yeast extract | Duchefa | Y1333 | LB medium |
References
- Lee, L. Y., Gelvin, S. B. T-DNA binary vectors and systems. Plant Physiology. 146 (2), 325-332 (2008).
- Christey, M. C. Use of Ri-mediated transformation for production of transgenic plants. In Vitro Cellular & Developmental Biology - Plant. 37 (6), 687-700 (2001).
- Gelvin, S. B. Agrobacterium-Mediated Plant Transformation: the Biology behind the “Gene-Jockeying” Tool. Microbiology and Molecular Biology Reviews. 67 (1), 16-37 (2003).
- Georgiev, M. I., Agostini, E., Ludwig-Müller, J., Xu, J. Genetically transformed roots: from plant disease to biotechnological resource. Trends in Biotechnology. 30 (10), 528-537 (2012).
- Gutierrez-Valdes, N., et al. Hairy root cultures—a versatile tool with multiple applications. Frontiers in Plant Science. 11, 33 (2020).
- Niazian, M., Belzile, F., Torkamaneh, D. CRISPR/Cas9 in planta hairy root transformation: a powerful platform for functional analysis of root traits in Soybean. Plants. 11 (8), 1044 (2022).
- Petit, A., et al. Further extension of the opine concept: plasmids in Agrobacterium rhizogenes cooperate for opine degradation. Molecular and General Genetics MGG. 190 (2), 204-214 (1983).
- Ozyigit, I. I., Dogan, I., Tarhan, E. A. Agrobacterium rhizogenes-mediated transformation and its biotechnological applications in crops. Crop improvement. , (2013).
- Jedličková, V., et al. Hairy root transformation system as a tool for CRISPR/Cas9-directed genome editing in oilseed rape (Brassica napus). Frontiers in Plant Science. 13, 919290 (2022).
- Steinbauerová, V., Neumann, P., Macas, J. Experimental evidence for splicing of intron-containing transcripts of plant LTR retrotransposon Ogre. Molecular Genetics and Genomics. 280 (5), 427-436 (2008).
- Neumann, P., et al. Centromeres off the hook: massive changes in centromere size and structure following duplication of CenH3 gene in Fabeae species. Molecular Biology and Evolution. 32 (7), 1862-1879 (2015).
- Montazeri, M., et al. A Comparative analysis of the hairy root induction methods in Hypericum perforatum. Journal of Plant Molecular Breeding. 7 (1), 67-76 (2019).
- Zhang, X., et al. Peat-based hairy root transformation using Rhizobium rhizogenes as a rapid and efficient tool for easily exploring potential genes related to root-knot nematode parasitism and host response. Plant Methods. 19 (1), 22 (2023).
- Christey, M. C., Sinclair, B. K. Regeneration of transgenic kale (Brassica oleracea var. acephala), rape (B. napus) and turnip (B. campestris var. rapifera) plants via Agrobacterium rhizogenes mediated transformation. Plant Science. 87 (2), 161-169 (1992).
- Christey, M. C., Sinclair, B. K., Braun, R. H., Wyke, L. Regeneration of transgenic vegetable brassicas (Brassica oleracea and B. campestris) via Ri-mediated transformation. Plant Cell Reports. 16 (9), 587-593 (1997).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved