Профилирование эпитопов поверхностных белков на вирусных частицах с помощью мультиплексной стратегии двойного репортера
In This Article
Summary
В данной работе мы описываем недавно разработанный мультиплексный флуоресцентный иммуноферментный анализ, в котором используется проточная цитометрическая система с двойным репортером для одновременного обнаружения двух уникальных эпитопов спайкового белка на интактных вирусных частицах коронавируса тяжелого острого респираторного синдрома 2 (SARS-CoV-2), которые были захвачены магнитными микросферами, связанными с ангиотензинпревращающим ферментом-2.
Abstract
Мембранные белки оболочечных вирусов играют важную роль во многих биологических функциях, включая прикрепление вируса к рецепторам клеток-мишеней, слияние вирусных частиц с клетками-хозяевами, взаимодействие вируса с хозяином и патогенез заболевания. Кроме того, белки вирусных мембран на вирусных частицах и на поверхности клеток хозяина оказались отличными мишенями для противовирусных препаратов и вакцин. В этой статье мы описываем протокол исследования поверхностных белков на интактных частицах коронавируса тяжелого острого респираторного синдрома 2 (SARS-CoV-2) с использованием проточной цитометрической системы с двойным репортером. В анализе используется технология мультиплексирования для получения тройного обнаружения вирусных частиц с помощью трех независимых аффинных реакций. Магнитные шарики, конъюгированные с рекомбинантным ангиотензинпревращающим ферментом-2 человека (ACE2), использовались для захвата вирусных частиц из надосадочной жидкости клеток, инфицированных SARS-CoV-2. Затем одновременно применяли два реагента для детектирования, меченных R-фикоэритрином (PE) или Brilliant Violet 421 (BV421). В качестве доказательства концепции были использованы фрагменты антител, нацеленные на различные эпитопы поверхностного белка SARS-CoV-2 Spike (S1). Обнаружение вирусных частиц с помощью трех независимых аффинных реакций обеспечивает высокую специфичность и подтверждает захват интактных вирусных частиц. Кривые дозозависимости инфицированного SARS-CoV-2 клеточного супернатанта были построены с дисперсией коэффициента репликации (среднее/стандартное отклонение) ˂14%. Хорошие результаты анализа в обоих каналах подтвердили, что два эпитопа белка-мишени на поверхности вируса обнаруживаются параллельно. Описанный здесь протокол может быть применен для (i) высокомультиплексного высокопроизводительного профилирования поверхностных белков, экспрессируемых на оболочечных вирусах; ii) обнаружение активных интактных вирусных частиц; и (iii) оценка специфичности и аффинности антител и противовирусных препаратов к поверхностным эпитопам вирусных антигенов. Применение потенциально может быть распространено на любой тип внеклеточных везикул и биочастиц, подвергая воздействию поверхностные антигены в жидкостях организма или других жидких матрицах.
Introduction
Наиболее распространенными патогенными вирусами, такими как грипп, ВИЧ, цитомегаловирус человека и штаммы SARS-CoV, являются оболочечные вирусы. Инфицирование клеток оболочечными вирусами требует слияния мембран вирусной клетки и мембраны клетки-хозяина, что приводит к высвобождению вирусного генома в цитоплазму. Затем вирусная РНК будет реплицироваться, прежде чем быть упакованной в новую вирусную частицу 1,2. В ходе этих процессов не только вирусные белки, но и белки мембраны хозяина могут быть включены в оболочку, становясь неотъемлемой частью новой вирусной частицы. Мембранные белки клетки-хозяина, включенные в оболочку вируса, могут способствовать проникновению вируса в новую клетку-хозяина, используя механизмы межклеточных взаимодействий, хоуминга и ускользания иммунной системы 3,4.
Несмотря на важность исследования вирус-ассоциированных белков, большинство доступных в настоящее времяметодов вирусного анализа5 не поддерживают высокопроизводительную и мультиплексную характеристику поверхностного антигена вируса. Они также не способны обнаруживать отдельные вирусные частицы или различать инфекционные интактные вирусные частицы, неинфекционные РНК, вирусные белки и субпопуляции вирусов, экспрессирующие различные антигены. В последнее время проточная цитометрия была модифицирована и адаптирована в новый метод анализа вирусных частиц, а именно проточную вирометрию. Проточная вирометрия позволяет исследовать отдельные вирусные частицы и их поверхностные антигены. Тем не менее, остаются ограничения, включая низкую пропускную способность, низкую мультиплексную способность, сложную экспериментальную установку и анализ данных, а также ограниченную обнаруживаемость вирусных частиц малого размера.
Мультиплексное количественное определение белков и нуклеиновых кислот на основе микросфер является хорошо зарекомендовавшей себя технологией с многочисленными применениями, начиная от количественного определения белков в жидкостях организма, исследований взаимодействия белков и заканчивая диагностикой вирусных инфекций 8,9,10,11,12,13 . Недавно представленный прибор для анализа потока оснащен двойным репортерным каналом, позволяющим измерять две флуоресцентные репортерные молекулы в одной и той же реакционной лунке. Эта новая возможность оказалась особенно полезной для параллельного профилирования различных изотипов иммуноглобулина14. Здесь описывается, как двойная репортерная система может быть использована для обнаружения интактных вирусных частиц, нацеленных на несколько поверхностных антигенов параллельно.
В качестве доказательства концепции в этом отчете подробно описывается разработка системы тройного обнаружения вирусных частиц SARS-CoV-2. SARS-CoV-2 состоит из четырех основных белков, один из которых является спайковым белком (S), который состоит из двух субъединиц. Первая субъединица, S1, осуществляет первичное связывание с ACE2, экспрессируемым в клеточных мембранах человека. Вторая субъединица, S2, облегчает проникновение в клетку-мишень с помощью фьюжн-пептида, создавая пору в мембране клетки-мишени, в которую вирион может проникнуть через15. Тремя оставшимися строительными блоками SARS-CoV-2 являются нуклеокапсид (N), мембранный белок (M) и белок оболочки (E). Нуклеокапсид отвечает за упаковку вирусного генома путем формирования рибонуклеопротеиновых структур с РНК, в то время как мембранные и оболочечные белки играют центральную роль в сборке вируса.
Описанный здесь анализ нацелен на три независимых эпитопа субъединицы S1, экспрессируемых на поверхности оболочки SARS-CoV-2. Используются серийные разведения как инфицированных SARS-CoV-2, так и неинфицированных супернатантов клеток. Вирусные частицы захватываются с помощью ACE2-конъюгированных микросфер, связывающих субъединицу S1 вируса. Затем поверхностный S-белок вируса детектируется параллельно с коммерчески доступным одноцепочечным вариабельным фрагментом иммуноглобулина (scFv) и человеческим моноклональным антителом против S1 (Hu-anti-S1) вместе с разработанным в собственной разработке scFv с мечкой FLAG. Hu-anti-S1 детектируется первым каналом (RP1) в системе двойного репортера с оранжевым R-фикоэритрином (PE)-конъюгированным вторичным антителом IgG-Fc человека, а scFv обнаруживается вторым каналом (RP2) с синим Brilliant Violet 421 (BV421)-конъюгированным вторичным антителом против FLAG. Анализ вирусных частиц представлен на рисунке 1.
Protocol
1. Конъюгация нейтравидина и контрольных антител к магнитным микросферам
ПРИМЕЧАНИЕ: Флуоресцентно окрашенные магнитные шарики (полистирольные микросферы диаметром 6,5 мкм со встроенным магнетитом) с различными флуоресцентными метками, перечисленными в Таблице материалов , используются для получения следующих конъюгатов и контрольных шариков: (1) Биотинилированный рекомбинантный человеческий ACE2, связанный с бусинами, соединенный с нейтравидиновым линкером; (2) Биотин связывается с бусинами в сочетании с нейтравидиновым линкером; (3) Козий IgG, соединенный непосредственно с бусинами; и (4) Неконъюгированные бусины. Белок, который должен быть соединен с гранулами, не должен содержать азида натрия, бычьего сывороточного альбумина (БСА), глицина, трис(гидроксиметил)аминометана (Трис), глицерина или аминосодержащих добавок. Буфер активации 0,1 М натрия фосфат одноосновный, безводный (2PO4), pH 6. 2-морфолиноэтансульфоновая кислота (MES; 50 мМ) Буфер pH 5 используется для разбавления конъюгатов. Буфер для промывки - PBS-T (1x PBS [фосфатно-солевой буфер], pH 7,4 + 0,05 % (v/v) Tween-20). Буфер хранения представляет собой блокирующий реагент 2,7 мг/мл для ИФА (BRE) + 0,1% антибиотиков (в данном случае, ProClin 300).
- Достаньте порошок сульфо-N-гидроксисульфосукцинимида (NHS) из холодильника и 65 мг предварительно аликвотированного 1-этил-3-[3-диметиламинопропил]карбодиимида гидрохлорида (EDC) и дайте нагреться до комнатной температуры (RT; 18-22 °C) в течение 30 минут. Храните NHS и EDC в конверте, содержащем гранулы диоксида кремния во время этого этапа, чтобы предотвратить гидролиз атмосферной влаги.
- Подготовьте микросферы к активации и сопряжению.
ПРИМЕЧАНИЕ: Флуоресцентные красители в микросферах чувствительны к свету, поэтому гранулы следует хранить в темноте и при температуре холодильника (4-8 °C), когда они не используются активно.- Ресуспендируйте 4 различных запаса микросфер с цветовой кодировкой (12,5 x 106/мл) (Таблица материалов) путем кратковременного вортексирования, ультразвука или вращения (15 минут при 15-30 об/мин), в соответствии с информационным листом продукта.
- Перенесите 40 μL каждой суспензии шариков (5 x 105 микросфер) в назначенные лунки полулуночного, плоскодонного, 96-луночного микротитровального планшета (Таблица материалов).
- Вымойте магнитные шарики.
ПРИМЕЧАНИЕ: Этапы мойки могут быть выполнены вручную или с помощью автоматической мойки пластин.- Добавьте в шарики активационный буфер 80 μл/лунку и обездвижьте шарики на магнитном пластинчатом сепараторе на 30 секунд. Отсасывайте надосадочную жидкость из микросфер, в то время как шарики иммобилизуются на магнитном пластинчатом сепараторе.
- Извлеките микротитровую пластину из сепаратора магнитных пластин и суспендируйте гранулы в 50 мкл активационного буфера.
- Активируйте шарики с помощью Sulfo-NHS и EDC.
- Приготовьте рабочий раствор Sulfo-NHS в концентрации 50 мг/мл в активационном буфере в микропробирке объемом 1,5 мл. Верните запас порошка NHS в холодильник (4-8 °C), защищенный от влаги.
- Приготовьте рабочий раствор EDC в концентрации 50 мг/мл в активационном буфере в микрофуге объемом 1,5 мл. Растворите предварительно приготовленные аликвоты порошка EDC по 65 мг в 1,3 мл буфера для активации.
ПРИМЕЧАНИЕ: Сульфо-NHS и EDC начинают гидролизоваться и терять активность после растворения. Не прерывайте процедуру спаривания до тех пор, пока в бусины не будут добавлены NHS и EDC. Не сохраняйте растворенные растворы NHS или EDC для последующего использования. - Приготовьте раствор активации для активации гранул путем объемного смешивания 20% стокового раствора Sulfo-NHS (50 мг/мл), 20% стокового раствора EDC (50 мг/мл) и 60% буфера активации. Для каждой реакции активации шариков требуется раствор активации в объеме 50 мкл (с использованием 5 ×10 5 шариков на реакцию), а также достаточный дополнительный объем для компенсации потерь при пипетировании.
- Добавьте 50 μл полного раствора активации в каждую лунку, содержащую промытые гранулы. При ранее существовавшем объеме суспензии в гранулах 50 мкл в активационном буфере на лунку конечная концентрация Sulfo-NHS составит 5 мг/мл, а конечная концентрация EDC также составит 5 мг/мл.
- Запайку микросферной реакционной пластины одноразовым клейким пластиковым или фольгированным запайщиком для пластин и инкубировать в течение 20 мин на орбитальном шейкере (650 об/мин) при комнатной температуре (18-22 °C) в темноте.
- Смойте излишки раствора активации с шариков.
- Центрифугируйте микротитровую пластину при 233 × г в течение 1 мин.
- Обездвижьте активированные шарики на магнитном пластинчатом сепараторе в течение 30 с. Снимите запайщик пластин и отасуньте надосадочную жидкость из магнитных шариков, при этом микротитровальная пластина все еще находится на магнитном сепараторе.
- Снимите микротитровую пластину с магнитного сепаратора и добавьте 100 мкл буфера MES в каждую лунку.
- Повторите шаги 1.4.2-1.4.3 еще один раз, всего два промывки.
- Соедините нейтравидин и козий IgG (контроль) в соответствующие наборы бусин. Приготовьте достаточное количество рабочих растворов нейтравидина и козлятника IgG, планируя 100 μл/реакцию и достаточное количество для компенсации потерь при пипетировании, следующим образом:
ПРИМЕЧАНИЕ: Протеиновый порошок нейтравидина восстанавливают в сверхчистой воде, а затем разбавляют до 1 мг/мл стокового раствора с PBS перед выделением для хранения/использования (белок нейтравидин не растворяется непосредственно в PBS, но растворяется в воде до ~10 мг/мл).- Приготовьте рабочий раствор нейтравидина в концентрации 125 мкг/мл в MES-буфере в пробирке с низким содержанием белка.
- Приготовьте рабочий раствор козьего контрольного антитела IgG в концентрации 17,5 мкг/мл в буфере MES.
- Подготовьте микротитровую пластину, содержащую активированные гранулы. Иммобилизуйте валики на магнитном пластинчатом сепараторе в течение 30 с. Пока микротитровальная пластина все еще находится на магнитном сепараторе, аспирируйте надосадочную жидкость из магнитных гранул.
- Добавьте 100 мкл рабочего раствора нейтравидина (125 мкг/мл) в соответствующие лунки, содержащие гранулы (для соединения нейтравидина-биотина и нейтравидина-ACE2).
- Добавьте 100 мкл рабочего раствора козьего IgG (17,5 мкг/мл) в лунку, содержащую гранулы, предназначенные для контроля только козьего IgG.
- Добавьте 100 мкл буфера MES в лунку, предназначенную в качестве контрольных несопряженных шариков.
- Запечатайте микротитровальную пластину и инкубируйте в течение 2 ч на орбитальном шейкере (650 об/мин) при RT (18-22 °C) в темноте. После 1 ч инкубации кратковременно перебейте пластину, чтобы убедиться, что шарики остаются во взвешенном состоянии.
- Вымойте бусины с помощью PBS-T.
- Центрифугируйте микротитровую пластину при 233 × г в течение 1 мин.
- Иммобилизуйте спаренные валики на магнитном пластинчатом сепараторе в течение 30 с. Пока микротитровальная пластина все еще находится на магнитном сепараторе, аспирируйте надосадочную жидкость из магнитных гранул.
- Снимите микротитровальную пластину с магнитного сепаратора.
- Добавьте 100 μL PBS-T в каждую лунку, содержащую гранулы.
- Повторите этапы стирки 1.6.2-1.6.4 один раз для получения в общей сложности двух стирок PBS-T.
- Подготовьте сопряженные бусины для хранения.
- Иммобилизуйте спаренные валики на магнитном пластинчатом сепараторе в течение 30 с. Пока микротитровальная пластина все еще находится на магнитном сепараторе, аспирируйте надосадочную жидкость из магнитных гранул. Снимите микротитровальную пластину с магнитного сепаратора.
- Добавьте 50 μL буфера хранения к каждому идентификатору микросферы, чтобы погасить оставшуюся активность гранул.
- Инкубируйте микротитровую пластину при температуре холодильника (4-8 °C) в темноте в течение ночи (16-22 ч).
- Перенесите неконъюгированные и конъюгированные с козьим IgG гранулы суспензии (50 мкл) в соответствующим образом маркированные пробирки с низким содержанием белка объемом 1,5 мл в микрофуге объемом 1,5 мл в сочетании с двумя промывками буфера хранения объемом 100 мкл лунок для обеспечения максимального извлечения гранул.
ПРИМЕЧАНИЕ: Неконъюгированные и козьи IgG-конъюгированные бусины будут насчитывать 5 × 105 в конечном объеме 250 мкл (т.е. 2 × 103 бусины/мкл). Храните микрофуги при температуре холодильника (4-8 °C) до использования.
- Связывают биотинилированный ACE2 и биотин с нейтравидин-конъюгированными гранулами.
- Готовьте рекомбинантный биотинилированный рабочий раствор человека ACE2 в концентрации 18 мкг/мл ACE2 в 10 мМ PBS. На одну реакцию потребуется 100 μл. Приготовьте рабочий раствор биотина в концентрации 2,4 мг/мл биотина в 10 мМ PBS. На одну реакцию потребуется 100 μл.
- Подготовьте микротитровую пластину, содержащую нейтравидин-конъюгированные микросферы.
- Иммобилизуйте микросферы на магнитном пластинчатом сепараторе на 30 с. Пока микротитровальная пластина все еще находится на магнитном сепараторе, снимите пломбировщик пластины и аспирируйте надосадочную жидкость из микросфер, иммобилизованных магнитом.
- Снимите микротитровую пластину с магнитного сепаратора и добавьте 50 мкл 10 мМ PBS на лунку.
- Повторите шаги 1.8.2.1-1.8.2.2 один раз.
- Добавьте 100 мкл рабочего раствора биотинилированного ACE2 в соответствующие лунки, содержащие нейтравидин-конъюгированные микросферы. Добавьте 100 мкл рабочего раствора биотина в соответствующие лунки, содержащие нейтравидин-конъюгированные микросферы.
- Запечатайте микротитровальную пластину и инкубируйте в течение 1 ч на орбитальном шейкере (650 об/мин) при RT (18-22 °C) в темноте.
- Промойте микросферы, как описано в пунктах 1.6.1-1.6.5.
- Подготовьте и храните микросферы, конъюгированные с ACE2 и биотином, как описано в шагах 1.7.1-1.7.4.
ПРИМЕЧАНИЕ: Биотинилированные ACE2- и биотин-конъюгированные гранулы будут насчитывать 5 × 105в конечном объеме 250 мкл (т.е. 2 × 103 бусины/мкл).
2. Тест на конъюгацию
- Приготовьте смесь гранул, объединив все четыре типа микросфер, созданных в разделе 1 (т.е. нейтравидин-конъюгированный биотинилированный ACE2, нейтравидин-конъюгированный биотин, козий IgG-конъюгированный и неконъюгированный).
ПРИМЕЧАНИЕ: Исходные микросферы хранили при концентрации 2 × 103 бусины/мкл и объединяли таким образом, чтобы конечная концентрация гранул в рабочей смеси бусин составляла 40 бусин каждого набора/мкл.- Рассчитайте объем рабочей смеси шариков, необходимый для тестирования (5 мкл/реакция), учитывая дополнительный объем для компенсации потерь при пипетировании. Кратковременно перебейте каждую пробирку и объедините равные рассчитанные объемы каждой суспензии бусин в новой микропробирке с низким связыванием белков. Концентрация шариков теперь составляет 400 шариков на каждый набор/мкл.
- Создайте рабочую смесь шариков, разбавив комбинированную суспензию шариков еще в 10 раз буфером для хранения (40 единиц каждого комплекта/мкл рабочей концентрации).
ПРИМЕЧАНИЕ: Сначала приготовьте небольшое количество рабочей смеси шариков, чтобы оценить количество микросфер/мкл для каждого ID.
- Инкубируйте микросферы с козьим антителом к ACE2.
- Пипетка 5 мкл рабочей смеси для бисера в 3 лунки 96-луночного микротитровального планшета с плоским дном.
- Добавьте по 50 мкл козьего анти-ACE2 (0,4 мкг/мл, разведенный в PBS-T, Table of Materials) в 3 лунки, содержащие гранулы в микротитровом планшете. Запечатайте микротитровальную пластину, вортекс и инкубируйте на орбитальном вибростенде (650 об/мин) при RT (18-22 °C) в течение 1 часа в темноте.
- Пульсируйте вниз микротитровальный планшет со скоростью 233 × г в течение 1 мин и трижды промойте микросферы PBS-T, как описано в 1.6.2-1.6.4.
- Инкубируйте микросферы с обнаружением антител.
- Пипеткой внесите 5 мкл рабочей смеси шариков в 6 новых лунок микротитрового планшета.
- Приготовьте по 1 г/мл каждой из рабочих детектирующих смесей: антикозий IgG PE, антимышиный IgG PE и антикроличий IgG PE в 3 отдельных пробирках по 1,5 мл, используя PBS-T в качестве разбавителя.
- Добавьте 50 мкл детектирующих смесей в 3 лунки в каждую, и антикозий IgG добавляют в те же лунки, что и анти-ACE2 из шага 2.2.
- Запечатать, закрутить и инкубировать на орбитальном вибростенде (650 об/мин) при RT (18-22 °C) в течение 30 минут.
- Пульсируйте на пластине при 233 × г в течение 1 минуты и трижды промойте микросферы PBS-T, как описано в пунктах 1.6.2-1.6.4.
- Добавьте 100 μL PBS-T и запустите на приборе для анализа потока с двумя репортерами со следующими настройками:
Режим: Двойной репортер; Тайм-аут: 45 с; DD-стробирование: 7500-17500; Минимальное количество микросфер: 100 микросфер/набор (наименьшее пороговое значение контроля качества: 35 микросфер/комплект).
3. Производство надосадочной жидкости, инфицированной SARS-CoV-2
Вирус SARS-CoV-2 размножается в клетках Vero E6 хозяина (линия эпителиальных клеток почек обезьян; ATCC; Таблица материалов). Клетки Vero E6 культивируют в модифицированной среде Eagles (MEM) при температуре 37°C в атмосфере с содержаниемCO2 5% и относительной влажностью 95%. Каждый литр MEM дополняют 10 мл L-глутамина (200 мМ), 38 мл NaHCO3 (7,5%), 5 мл раствора пенициллина/стрептомицина и 50 мл фетальной бычьей сыворотки (FCS); Таблица материалов.
ВНИМАНИЕ: Используйте соответствующие процедуры биобезопасности и оборудование при работе с SARS-CoV-2.
- Клетки Vero E6 выращивают до слияния в двух колбах для культур тканей размером 150см2 . Заразите одну колбу вирусом SARS-CoV-2 и используйте другую фиктивно зараженную в качестве контроля.
- Смешайте около 100 000 инфекционных частиц SARS-CoV-2 дикого типа (WT) с 5 мл среды Eagles MEM.
- Отсадите среду из одной колбыразмером 150 см 2 и добавьте 55 мл полного MEM для получения неинфицированных контрольных надосадочных линий. Отсадите среду из другой колбы 150-см2 и добавьте вирусную смесь в клетки. Инкубируйте клетки в течение 1 ч при 37 °C. Слегка встряхивайте колбу каждые 15 минут, чтобы распределить вирус.
- Добавьте 50 мл полной среды MEM в колбу с добавлением SARS-CoV-2 и инкубируйте клетки до тех пор, пока не проявятся цитопатические эффекты, визуально оценивая колбы каждые 24 часа.
ПРИМЕЧАНИЕ: Для возникновения цитопатии должно пройти примерно 3-4 дня после заражения. Цитопатические эффекты на монослойную структуру клеток Vero E6 (например, ретракция клеток, кренации, округление, удаление адгезии, потеря внутрицитоплазматической зернистости, явный лизис) оцениваются качественно путем наблюдения за клетками с помощью микроскопа с инвертированным светом в соответствии с рекомендациями Международной организации стандартизациипо тестированию цитотоксичности in vitro. - Соберите надосадочную жидкость из обеих колб и отжимайте в течение 6 минут при 253 × г , чтобы отложить клеточный мусор.
- УФ-инактивирующий вирус SARS-CoV-2 в надосадочной жидкости клеток
- Пипеткой 0,5 мл надосадочной жидкости на лунку в 12 лунок в 24-луночный микротитровальный планшет. УФ-излучение микротитровальной пластины, без крышки, в течение 30 с под подходящей ультрафиолетовой лампой (Таблица материалов).
ПРИМЕЧАНИЕ: Инактивация вируса в супернатанте клеток должна быть установлена путем попытки размножения вируса в культурах клеток Vero E6.
- Пипеткой 0,5 мл надосадочной жидкости на лунку в 12 лунок в 24-луночный микротитровальный планшет. УФ-излучение микротитровальной пластины, без крышки, в течение 30 с под подходящей ультрафиолетовой лампой (Таблица материалов).
- Аликвотировать надосадочную жидкость клетки в пробирки объемом 1,5 мл и хранить при температуре -20 °С до дальнейшего использования.
ПРИМЕЧАНИЕ: Надосадочная жидкость ячейки может храниться при температуре -80 °C.
4. Анализ: Обнаружение вирусных частиц SARS-CoV-2 в надосадочной жидкости клеток
- Приготовьте буфер для анализов, смешав 0,1% казеина, 0,5% поливинилового спирта, 0,8% поливинилпирролидона и 1% BSA (все по объему) (pH 7). Приготовьте буфер для разведения образца, приготовив 10% IgG кролика в буфере для анализа.
- Рассчитайте и подготовьте необходимый для тестирования объем рабочей смеси шариков (шаг 2.1) (5 мкл/реакция), учитывая избыточный объем для компенсации потерь при пипетировании.
- Приготовьте серию разведения надосадочной жидкости. Рассчитайте необходимые объемы надосадочной жидкости. Проанализируйте каждую точку разубоживания в тройных лунках для каждой из пяти scFv, в результате чего получается 15 лунок на точку разубоживания и тип пробы. Используйте 45 мкл разбавленной надосадочной жидкости в каждой лунке, всего требуется 675 мкл; достаточно одной микропробирки объемом 1,5 мл для каждого из супернатантов SARS-CoV-2 и контроля.
- Разморозьте надосадочную жидкость SARS-CoV-2 и контрольную надосадочную жидкость при температуре 4 °C в течение не менее 1 ч. Храните надосадочную жидкость и их разбавления в холоде (2-8 °C) до использования. Промаркируйте и расположите восемь микрофуговых пробирок объемом 1,5 мл для SARS-CoV-2 и контрольных надосадочных жидкостей.
ПРИМЕЧАНИЕ: Самая высокая концентрация будет определяться при разведении надосадочной жидкости в соотношении 1:1 (в 2 раза), из которого будет выполнена серия разведений в соотношении 1:2 (3) с использованием буфера для разведения образца, при этом самым высоким разведением будет разведение в соотношении 1:1458. Заготовки, содержащие буфер для разбавления пробы, служат только в качестве контроля без надосадочной жидкости. Таким образом, тестируемые разведения каждого типа надосадочной жидкости (SARS-CoV-2 или контроль) будут в 2, 6, 18, 54, 162, 486 и 1458 раз, при контроле только на буфере. - Добавьте буфер для разбавления образца в помеченные микрофуговые пробирки. Для пробирок с разбавлением 1:1 (2-кратный) требуется 600 мкл буфера, а для остальных пробирок требуется 800 мкл буфера. Создайте максимальное разведение (1:1; в 2 раза) каждой надосадочной жидкости путем смешивания 600 мкл надосадочной жидкости с 600 мкл буфера для разбавления образца в соответствующим образом помеченных пробирках, с последующим кратковременным перемешиванием пробирки для смешивания.
- Продолжайте ряд, последовательно перенося 400 мкл разбавленной надосадочной жидкости в соотношении 1:1 (в 2 раза) в следующую пробирку для разведения (т.е. 6-кратное разведение), и продолжайте 3-кратное разведение до тех пор, пока не будет получено наименьшее разведение (в 1458 раз). Кратковременно перебейте каждый разведенный надосадочный жидкость, прежде чем приступить к следующему разведению.
- Разморозьте надосадочную жидкость SARS-CoV-2 и контрольную надосадочную жидкость при температуре 4 °C в течение не менее 1 ч. Храните надосадочную жидкость и их разбавления в холоде (2-8 °C) до использования. Промаркируйте и расположите восемь микрофуговых пробирок объемом 1,5 мл для SARS-CoV-2 и контрольных надосадочных жидкостей.
- Инкубируйте микросферы с надосадочной жидкостью.
- Предварительно приготовленную рабочую смесь шариков в течение 30 с пересуспендируйте микросферы и добавьте по 5 л смеси в каждую назначенную лунку 384-луночного микротитровального планшета с плоским дном.
ПРИМЕЧАНИЕ: Также можно использовать 96-луночные планшеты. - Добавьте 45 мкл приготовленных надосадочных разведений в назначенные лунки, содержащие микросферы в 384-луночном планшете. Закройте планшет и инкубируйте в течение ночи (16-22 ч) на орбитальном вибростенде (650 об/мин) при RT (18-22°C) в темноте.
- Предварительно приготовленную рабочую смесь шариков в течение 30 с пересуспендируйте микросферы и добавьте по 5 л смеси в каждую назначенную лунку 384-луночного микротитровального планшета с плоским дном.
- Смойте излишки надосадочной жидкости с шариков.
- Снимите микротитровую пластину с орбитального шейкера и снимите герметик пластин. Центрифугируйте планшет при давлении 931 x g в течение 1 минуты.
- Обездвижите шарики, поместив микротитровую пластину на магнитный разделитель пластин на 30 с. Пока микротитровальная пластина все еще находится на магнитном сепараторе, снимите пломбировщик пластины и аспирируйте надосадочную жидкость из магнитных гранул.
- Снимите микротитровальную пластину с магнитного сепаратора.
- Добавьте 60 μL PBS-T в каждую лунку, содержащую гранулы.
- Повторите шаги стирки 4.5.2-4.5.4 два раза, всего три стирки PBS-T.
- Приготовьте различные смеси для детектирования в отдельных пробирках объемом 1,5 мл. Каждая смесь для детектирования состоит из коммерческого моноклонального антитела человека против S1 (Hu-anti-S1) (1 мкг/мл) и одного из пяти различных scFvs с маркировкой FLAG (1 мкг/мл) (Дополнительный файл 1, Дополнительная таблица 1 и Дополнительная таблица 2), нацеленных на спайковый белок на частице SARS-CoV-2, разведенный в буфере для анализа (этап 4.1), в результате чего получается в общей сложности пять различных детектирующих смесей.
- Повторите шаги 4.5.2-4.5.3. Ресуспендируйте промытые микросферы в 50 мкл/лунку соответствующей scFv-специфичной смеси для обнаружения спайков. Запечатайте микротитровальную пластину и инкубируйте в течение 1 ч на орбитальном шейкере (650 об/мин) при RT (18-22 °C) в темноте.
- Центрифугируйте микротитровую пластину при 931 × г в течение 1 мин. Смойте излишки реагента Spike Detection с гранул. Выполните три этапа промывки с 60 мкл PBS-T в соответствии с шагами 4.5.2-4.5.5.
- Инкубируйте микросферы со смесью антител для флуоресцентного обнаружения.
- Приготовьте смесь флуоресцентных растворов, состоящую из коммерчески доступного ПЭ-конъюгированного античеловеческого IgG вместе с BV421-конъюгированным анти-FLAG-антителом, разведенным в буфере для анализа, с рабочими концентрациями 0,2 мкг/мл и 1 мкг/мл соответственно. На одну реакцию требуется 50 μл флуоресцентного реагента.
- Повторите шаги 4.5.2-4.5.3. Ресуспендируйте микросферы в 50 мкл/лунку смеси флуоресцентных растворов. Запечатайте микротитровую пластину и инкубируйте в течение 30 минут на орбитальном шейкере (650 об/мин) при RT (18-22 °C) в темноте.
- Отжим микротитровальный планшет при 931 × g в течение 1 мин. Смойте излишки смеси флуоресцентного раствора с микросфер. Выполните три этапа промывки с 60 мкл PBS-T в соответствии с шагами 4.5.2-4.5.5.
- Суспендируйте микросферы в 60 мкл PBS-T с последней стадии стирки. Проанализируйте пластину в системе анализа потоков с двумя репортерами с настройками, описанными в шаге 2.6.
Representative Results
Тест на конъюгацию
Тест на конъюгацию показал, что козий IgG и нейтравидин-биотинилированный ACE2 были успешно конъюгированы с микросферами. Специфичность обнаружения анализа была подтверждена зондированием ACE2-конъюгированных микросфер с мечеными ПЭ вторичными антителами, полученными у различных видов животных (рис. 2). Перекрестной реактивности между различными антителами обнаружения не наблюдалось. Когда смеси гранул зондировали с козьим анти-ACE2 + антикозьим IgG PE, среднее значение интенсивности флуоресценции (MFI; условные единицы) выше фона было обнаружено как для ACE2, так и для козьих IgG-сопряженных микросфер, но не для несопряженной микросферы (голой) или для микросфер, покрытых биотином. Антимышиный IgG PE и антикроличий IgG PE использовали в качестве отрицательного контроля для проверки ложноположительных сигналов. При инкубации с микросферами был получен незначительный флуоресцентный сигнал, указывающий на специфичность положительных сигналов для ACE2 и IgG козы.
Обнаруживаемость вирусных частиц в клеточных надосадочных клетках
Магнитные шарики, соединенные с рекомбинантным человеческим ACE2, были использованы для захвата вирусных частиц SARS-CoV-2 из инфицированных и контрольных (без вируса) супернатантов клеточных культур VeroE6, а затем были одновременно исследованы для двух различных областей вирусных шипов с использованием моноклонального антитела и одного из пяти различных scFv. Зависящий от концентрации сигнал в разведениях инфицированных SARS-Cov-2 супернатантов клеток наблюдался в обоих репортерных каналах (RP1 и RP2) (рис. 3), что указывает на то, что как коммерческое антитело Hu-anti-S1, так и различные scFvs обнаруживали вирусную частицу, связанную с ACE2-конъюгированной микросферой. В трех из пяти scFv вирус обнаруживается в разведениях до 1:18 (scFv2, scFv3, scFv5); для остальных двух scFv (scFv7 и scFv9) он обнаруживается с точностью до 1:6 разведений. Это может быть связано с различным сродством к объекту. Как показано на рисунке 3 и в таблице 1, scFv3 обеспечивает самую высокую интенсивность MFI, за ним следуют scFv5, scFv2, scFv7 и scFv9 соответственно.
В глобальном масштабе обнаружение scFvs приводит к более низкому MFI по сравнению с Hu-anti-S1. Это может указывать на более низкое сродство, но также может быть артефактом из-за мечения различными флуоресцентными красителями (PE и BV421). Еще одна тенденция, которую можно наблюдать для scFv7 и scFv9, заключается в том, что значения MFI немного ниже для канала RP1 (анти-спайк) по сравнению с тремя другими конфигурациями. Это может указывать на то, что scFv либо взаимно реагируют, либо иным образом вмешиваются во взаимодействие ACE2-Hu-anti-S1, что также может объяснить более низкий сигнал в канале RP2. Вирусные частицы не были обнаружены в надосадочной жидкости неинфицированных клеток Vero E6 ни в канале RP1, ни в канале RP2.
Конъюгированная с нейтравидином и биотином микросфера, микросфера козьего IgG и неконъюгированные микросферы используются в качестве негативных контрольных шариков. Вирусные частицы были захвачены магнитными микросферами, соединенными с ACE2, и протестированы с коммерческим антиспайком человека в репортерном канале RP1 и с различными scFv в репортерном канале RP2 (scFv указан в верхнем левом углу каждой панели). Ни в инфицированных, ни в неинфицированных образцах вирусных частиц обнаружено не было.
Точность и надежность анализа
Чтобы оценить точность анализа, все условия были прогонены в трех экземплярах. Коэффициент дисперсии (CV) для микросферы ACE2 был рассчитан для каждой точки разбавления. Все рассчитанные CV для анализа были ниже 15%, где самый высокий измеренный CV составил 13%, а самый низкий CV - 1% (Таблица 2). Как видно на графике плотности (рис. 4) канала RP1, обнаружение ПЭ коммерческого Hu-anti-S1 показывает более высокую точность, в основном концентрируясь вокруг CV 3%. Канал RP2, обнаружение БВ scFV, показывает более высокие CV. Однако, как видно из таблицы 2, более высокий диапазон CV обусловлен образцами с низкими концентрациями вирусных частиц, такими как холостые. Чтобы проверить надежность протокола, анализ был повторен дважды разными операторами, с использованием смесей гранул, полученных в разные дни, и меньшего объема образца (на 72% ниже). Очень хорошая корреляция по шкале Пирсона, в диапазоне от 0,98 до 1, наблюдалась для обоих каналов RP1 и RP2 (p-значение < 0,01), что подтверждает надежность анализа и возможность применения анализа при меньшем количестве образца (рис. 5). Эта технология анализа потока следует «теории аналита окружающей среды»17, что делает анализ чувствительным к концентрации, но не к объему.
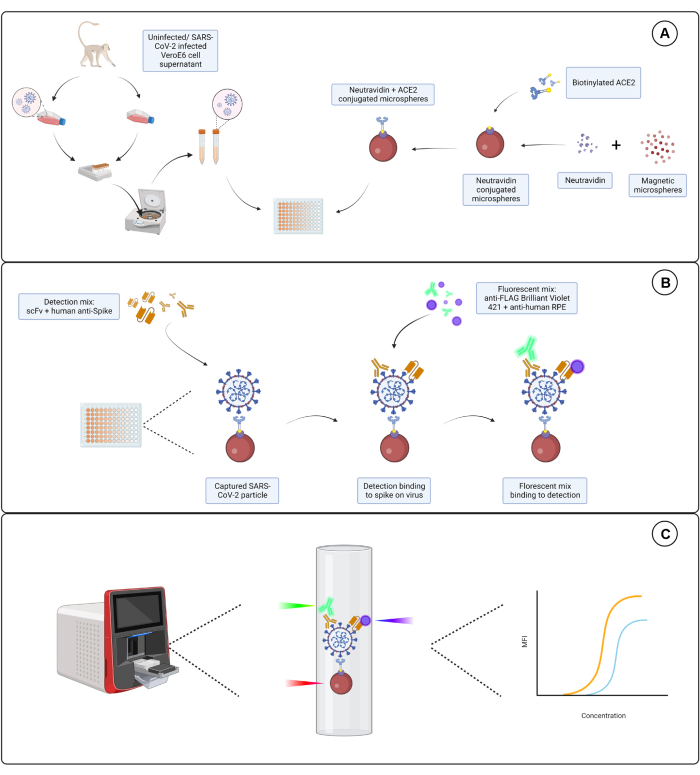
Рисунок 1: Анализ вирусных частиц. (А) Клеточный супернатант как из инфицированных, так и из неинфицированных клеток Vero E6 добавляют в последовательном разведении либо на 96-луночный, либо на 384-луночный планшет вместе с магнитными микросферами, конъюгированными с нейтравидином, а затем связывают либо с биотинилированным человеческим ACE2, либо с биотином. Неконъюгированные микросферы в сочетании с козьим IgG и голыми микросферами используются в качестве отрицательного контроля вместе с конъюгированной микросферой нейтравидин-биотин. (B) Образовавшиеся комплексы микросфер-вирусных частиц детектируются с помощью детектирующего коктейля, состоящего из Hu-anti-S1 и одного из различных scFvs с FLAG-меткой. Затем добавляется флуоресцентная смесь с античеловеческим IgG PE, нацеленным на Hu-anti-S1, и анти-FLAG Brilliant Violet 421, нацеленным на scFvs. (C) Система с тремя лазерами и двойным детектированием излучает красный, зеленый и фиолетовый лазер для обнаружения комплекса микрочастиц. Красный лазер обнаруживает метку на микросферном красителе, в то время как зеленый и фиолетовый лазеры обнаруживают анти-S1 и scFvs соответственно. Затем сгенерированные данные анализируются. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
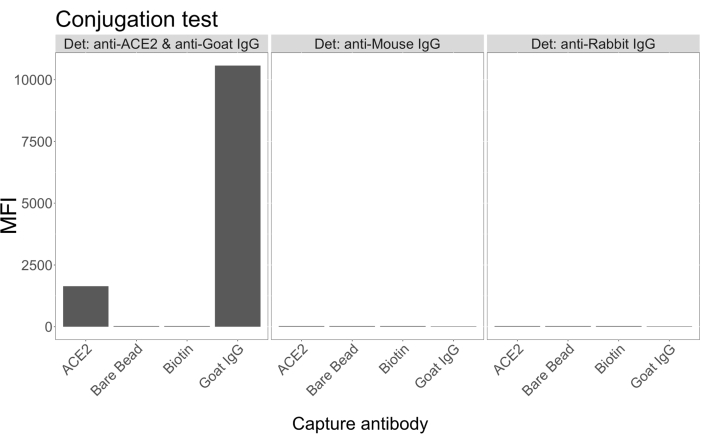
Рисунок 2: График подтверждения конъюгации. Смеси шариков состояли из четырех различных микросфер, каждая из которых была конъюгирована с различными белками: нейтравидин-биотин-ACE2 (ACE2), неконъюгированная микросфера (Bare Bead), нейтравидин-биотин (Biotin) и козлятник-IgG (Goat IgG). В тесте конъюгации использовались три различные конфигурации детектирующих флуорофоров. А именно, козий анти-ACE2 + антикозий IgG PE, антимышиный IgG PE и антикроличий IgG PE. По оси Y отображается средний измеренный сигнал MFI (медианная интенсивность флуоресценции; условные единицы) от каждой микросферы при трех различных условиях. По оси X показаны различные применяемые антитела захвата. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
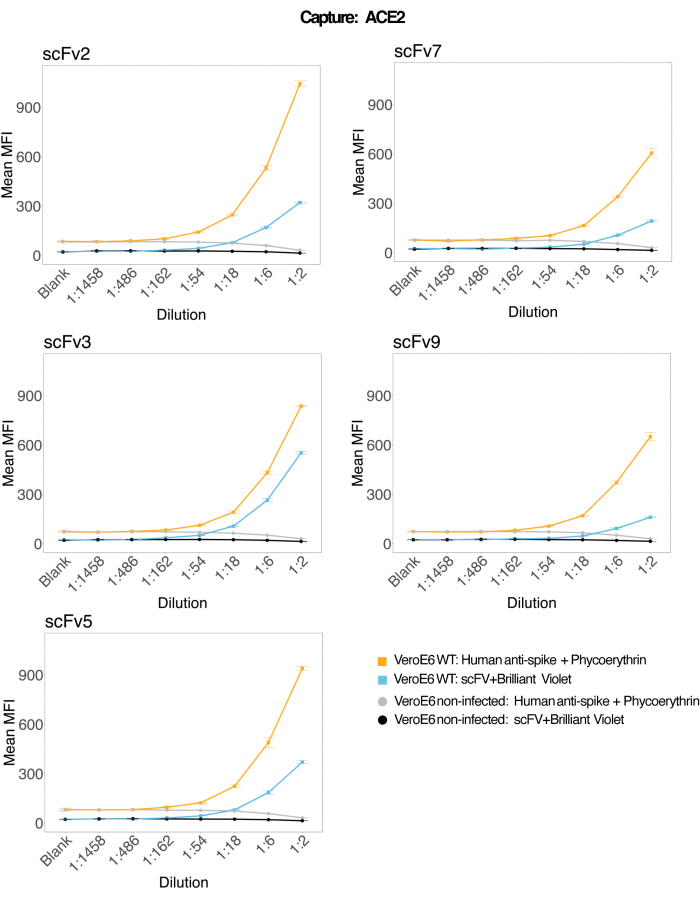
Рисунок 3: Мультиплексное обнаружение поверхностных белков. Ось Y: Среднее значение MFI (медианная интенсивность флуоресценции; условные единицы ± стандартное отклонение) для каждого образца, анализируемого в трех лунках для каждого условия. Ось X: Точки серийного разведения надосадочной жидкости клетки. Оранжевый: Вирусные частицы в надосадочной жидкости из Vero E6, инфицированной SARS-CoV-2 WT, обнаружены с помощью человеческого антиспайка + античеловеческого PE (фикоэритрина). Синий: надосадочная жидкость от Vero E6, инфицированная SARS-CoV-2 WT, обнаруженная с помощью различных scFvs + anti-FLAG Brilliant Violet 421. Серый: Обнаружен неинфицированный клеточный супернатант с антиспайком + античеловеческим ТЭЛА. Черный: Неинфицированный клеточный супернатант, обнаруженный с помощью пяти различных scFvs + анти-FLAG Brilliant Violet 421. Вирусные частицы были захвачены магнитными микросферами, соединенными с ACE2, и протестированы с коммерческими человеческими антиспайковыми антителами в репортерном канале RP1 и с различными scFv в репортерном канале RP2 (scFv указан в верхнем левом углу каждой панели). Ни в одном из неинфицированных образцов вирусных частиц обнаружено не было. Эпитоп, на который нацелен scFv3, имел наибольшее сродство. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
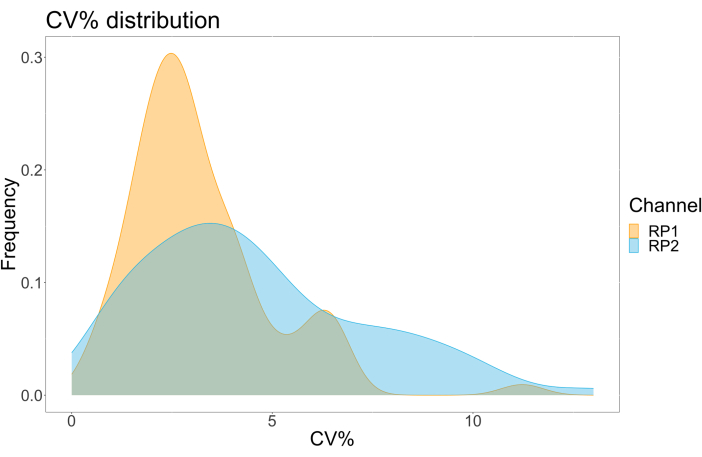
Рисунок 4: График вариационной дисперсии. Ось Y — это частота событий, а ось X показывает коэффициент дисперсии (CV) в процентах для каждой реплики различных выборок. RP1 и RP2 являются первым и вторым репортерными каналами, которые обнаруживают флуоресценцию, связанную с фикоэритрином и Brilliant Violet 421 соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
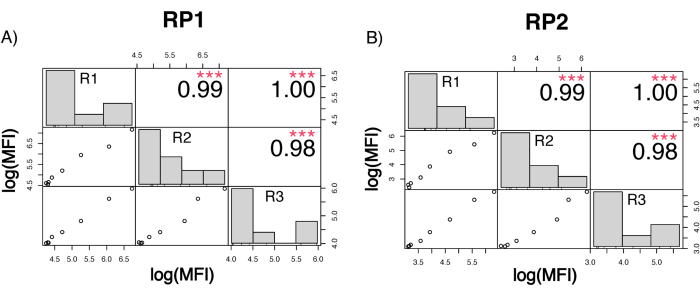
Рисунок 5: Матрица корреляции прогона. (A,B) Ось Y: Матрица корреляции Пирсона в масштабе log10 между тремя отдельными прогонами, выполняемыми тремя разными операторами и с разными смесями шариков. Меньший объем образца был применен в третьем прогоне. Гистограммы показывают распределение различных кластеров переменных на основе измеренных MFI. (A) Корреляция для репортерного канала RP1 между различными прогонами. (B) Корреляция для репортерного канала RP2 между различными прогонами. MFI=медианная интенсивность флуоресценции в условных единицах. p < 0,001. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Обнаружение | Реактивность |
| scFv2 | ++ |
| scFv3 | +++ |
| scFv5 | ++ |
| scFv7 | + |
| scFv9 | + |
| Человеческий антиспайковый IgG | ++++ |
Таблица 1: Ранжирование scFvs при обнаружении на основе интенсивности MFI, полученной на стандартных кривых.
| RP1 (PE) | RP2 (BV421) | |
| Разбавление образца | Диапазон CV [%] | Диапазон CV [%] |
| Пустой | 3–11 | 2–13 |
| 1:1458 | 1–7 | 2–7 |
| 1:456 | 4–6 | 3–8 |
| 1:162 | 3–6 | 3–7 |
| 1:54 | 2–4 | 2–4 |
| 1:18 | 2–4 | 1–4 |
| 1:6 | 2–6 | 1–6 |
| 1:2 | 1–5 | 1–3 |
Таблица 2: CV% (среднее/стандартное отклонение × 100) диапазон каждой точки разведения инфицированного SARS-CoV-2 надосадочной жидкости для репортерных каналов RP1 и RP2.
Дополнительный файл 1: Генерация одноцепочечного вариабельного фрагмента иммуноглобулина (scFv). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительная таблица 1: Скрининг scFvs в паре с Fabs на серийное разведение рекомбинантного Spike (RBD). Для оценки эффективности различных детектирующих пептидов использовали 12 комбинаций спайкового белка Fab в качестве захвата в буфере, спайксированном рекомбинантным RBD. В качестве детекции было применено десять (10) scFv, нацеленных на различные эпитопы спайкового белка. В зависимости от производительности пары захват-обнаружение они были помечены как неудачные (-) или успешные (+). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительная таблица 2: Скрининг scFvs в парах с Fabs на серийное разведение супернатанта клеток Calu-3, инфицированного SARS-Cov-2. Для оценки эффективности различных детектирующих пептидов в супернатанте клеток Calu-3, инфицированных SARS-Cov-2, использовали 12 комбинаций спайкового белка Fab. В качестве детекции было применено десять (10) scFv, нацеленных на различные эпитопы спайкового белка. В зависимости от производительности пары захват-обнаружение они были помечены как неудачные (-) или успешные (+). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Discussion
Мультиплексная технология на основе шариков показала себя как ценная платформа для высокопроизводительного обнаружения патогенов в ряде клинических приложений. Высокая гибкость платформы, основанная на принципах проточной цитометрии, позволяет нацеливаться на антитела, белки и нуклеиновые кислоты 18,19,20,21,22, мультиплексируя сотни аналитов одновременно. Однако, насколько нам известно, эта технология ранее не применялась для обнаружения интактных вирусных частиц. В этом отчете технология была применена для обнаружения интактных вирусных частиц путем нацеливания на три независимых поверхностных эпитопа SARS-CoV-2.
Вирусы с оболочечной РНК демонстрируют высокое структурное сходство с внеклеточными везикулами (ВВ), небольшими фосфолипидными мембранами, несущими вирусную РНК и белки вместе с белками хозяина23. Сэндвич-иммунологические анализы ранее применялись для обнаружения ВВ с использованием пары антител, нацеленных на два различных поверхностных белка24,25. Ограничение сэндвич-анализов на одновременное обнаружение только двух белков снимается с помощью мультиплексных подходов, которые позволяют одновременно обнаруживать более двух белков за одну реакцию.
Описанная здесь система обнаружения с тремя лазерами с двойным репортером является самым совершенным на сегодняшний день инструментом анализа потока на основе валиков. Что касается систем считывания с одним репортером, то двойной репортер (каналы RP1 и RP2) позволяет обнаруживать три поверхностных белка/эпитопа параллельно. Нацеливание на несколько вирусных поверхностных белков и эпитопов обеспечивает более точное представление вирусной белковой нагрузки, что, помимо подтверждения того, что вирус на самом деле неповрежден, также открывает возможность для дальнейшего исследования вирусных поверхностных антигенов и механизмов взаимодействия вируса и белка хозяина.
Во время пандемии COVID-19 важность своевременного выявления лиц, являющихся носителями активных вирусных частиц, была важна для сдерживания распространения вируса. Геномная РНК обнаруживается с помощью количественной ОТ-ПЦР независимо от ее происхождения (интактные вирусные частицы или свободные). Однако только неповрежденная оболочка с доступным S-белком может опосредовать проникновение в клетку и последующую репликацию вируса. Предыдущие исследования с использованием микрофлюидных чипов в образцах пациентов показали, как обнаружение интактных вирусных частиц в сочетании с тестированием в местах оказания медицинской помощи позволит проводить частое тестирование и усиленное наблюдение за распространением заболевания, включая более осознанный выбор лиц, подлежащихкарантину. Применение мультиплексного анализа на основе микросфер позволит разработать анализы, направленные на скрининг множественных вирусов и их поверхностных антигенных вариантов, получая более точную картину распространения вируса в популяции.
Проточная вирометрия — это новейшая разработка проточной цитометрии, направленная на анализ вирусных частиц. Несмотря на способность обнаруживать дискретные вирусные частицы, анализ малых вирусов представляет собой актуальную проблему для проточной вирометрии27,28. Подобно описанному здесь методу, проточная вирометрия включает захват интактных вирионов наночастицами золота, связанными с антителами. Ограничения для обоих методов включают (i) зависимость от высокоаффинных реагентов захвата и детектирования поверхностно экспрессируемого антигена, на которые нацелены микросферы или наночастицы, (ii) ограниченную способность различать вирусные частицы и внеклеточные везикулы, и (iii) отсутствие стандартов для надлежащего количественного определения частиц.
Клетки выделяют ВВ в окружающую среду, и при заражении вирусом они также могут выделять вирионы, которые имеют такой же размер, как и ВВ, и в конечном итоге могут экспрессировать те же антигены29. Поскольку EV будут иметь схожие мембранные составы, что и вирус, может быть трудно отличить их друг от друга, используя только методы, основанные на аффините, такие как подход с двойным лазером с одним репортером. Тем не менее, описанные здесь стратегии имеют более высокую мультиплексную способность, что позволяет более широко и глубоко исследовать белковый состав частиц. Методы, основанные на потоках, позволяют отслеживать дискретные частицы, предоставляя возможности для цифровой количественной оценки. Одной из стратегий решения проблемы количественной оценки в нашем методе является использование хорошо охарактеризованных синтетических везикул, экспрессирующих представляющие интерес антигены в виде вирусоподобных частиц (VLP) для подготовки стандартных кривых.
Общий путь проникновения и выхода SARS-CoV-2 из клеток-хозяев — через взаимодействие вируса и мембраны клетки-хозяина 2,15. В этом процессе высока вероятность того, что белки мембраны хозяина будут включены в поверхность вируса. Проводя скрининг включенных белков хозяина, можно отследить путь развития инфекции и потенциально предсказать течение заболевания у пациентов с различным риском, что позволяет принимать более ранние решения о лечении. Это также позволяет характеризовать вирусы на различных партиях образцов в исследовательских лабораториях. Это можно дополнительно изучить, проверив, связаны ли различные характеристики с разными уровнями вирусной инфекционности, а также для скрининга антител и молекул лекарств, нацеленных на вирусные поверхностные белки.
Важным аспектом описанного метода является то, что он основан на аффинности реагентов захвата и детектирования по отношению к их белкам-мишеням на вирусе. Таким образом, выбор аффинных реагентов является определяющим фактором для эффективности анализа. Возможно, несколько аффинных реагентов должны быть проверены и протестированы на захват и обнаружение, чтобы выбрать реагенты с наибольшим сродством. Здесь эффективность десяти scFv и двенадцати фрагментов Fab была предварительно оценена с использованием рекомбинантного RBD и вирусных частиц из надосадочной жидкости эпителиальных клеток легких Calu-3, инфицированных SARS-Cov-2 (клетки VeroE6 использовались для культивирования/оценки цитотоксичности во всех последующих исследованиях). Для обнаружения scFv, помеченных тегом FLAG, использовался Anti-FLAG PE (Дополнительная таблица 1 и Дополнительная таблица 2). Затем были отобраны пять наиболее эффективных scFv для применения в двухотчетном анализе вместе с коммерческим Hu-anti-S1 (Таблица 1) на надосадочной жидкости из инфицированных эпителиальных клеток почек африканской зеленой мартышки VeroE6.
Еще одним важным фактором успеха протокола является выбранная процедура сопряжения микросфер. Метод связывания должен быть эффективным и в то же время сохранять конформационные эпитопы или аминокислотные остатки, участвующие в связывании белка, нетронутыми и немодифицированными. В данном случае реакция EDC-NHS была применена к сопряжению нейтравидина непосредственно к микросферам, адаптировав ранее описанный протокол30 и систему нейтравидин + биотин для связывания рекомбинантного ACE2 со связанными микросферами. Альтернативные методы соединения и их эффективность могут быть проверены и сравнены. Наконец, было замечено, что различные флуоресцентно меченные реагенты для детектирования (например, анти-ФЛАГ ПЭ (фикоэритрин) и анти-ФЛАГ Бриллиантовый фиолетовый 421) могут приводить к различным уровням MFI, которые могут влиять на чувствительность анализа.
В заключение следует отметить, что описанный метод позволяет обнаруживать интактные вирусные частицы в растворе, применяя стратегию двойного репортера. Параллельный анализ трех поверхностных детерминант дает более специфичный инструмент для характеристики вирусных частиц и, в конечном итоге, их отличия от других EV (например, не содержащих вирусные антигены). Эта стратегия является альтернативой проточной вирометрии. Несмотря на то, что текущий подход не делает различий по размерам частиц, стратегии магнитных гранул с использованием микросфер с цветовой кодировкой предлагают более широкие возможности в профилировании поверхностных антигенов и планировании экспериментов с помощью высокомультиплексного и высокопроизводительного анализа. Анализ демонстрирует высокую точность и надежность и может быть расширен для анализа любого типа внеклеточных везикул и любого другого типа биочастиц, подвергающих воздействию поверхностные антигены в жидкостях организма или других жидких матрицах. Это было экспериментальное исследование, которое продемонстрировало полезность использования scFvs в качестве одного реагента для обнаружения в мультиплексном анализе нескольких эпитопов белков на вирусных частицах. Дальнейшие исследования необходимы для определения специфических характеристик scFvs (например, аффинности связывания, перекрестной реакционной способности с другими реагентами и мишенями), если они будут использоваться в количественных или клинических целях.
Disclosures
Авторы заявляют об отсутствии конфликта интересов.
Acknowledgements
Мы выражаем признательность в SciLifeLab (Швеция) команде Affinity Proteomics-Stockholm Scilifelab Unit за разработку и применение описанного здесь метода, Human Body Therapeutics Unit за предоставление scFvs и реагентов Fab, а также Йонасу Клингстрёму за клетки VeroE6, инфицированные изолятами SARS-CoV-2, полученными из клинических образцов. Авторы благодарят Шерри Данбар, доктора философии, магистра делового администрирования корпорации Luminex (Остин, штат Техас), за поддержку исследований, и Мэтта Сильвермана, магистра наук, доктора философии Biomedical Publishing Solutions (Панама-Сити, штат Флорида; mattsilver@yahoo.com году) за помощь в написании научных и письменных материалов. Эта работа была поддержана средствами Фонда Кнута и Алисы Валленберг и Лаборатории «Наука для жизни» (SciLifeLab) (VC2020-0015 Клаудии Фредолини и Франческа Чиоди и VC-2022-0028 Клаудии Фредолини).
Materials
| Name | Company | Catalog Number | Comments |
| ACE2-Biotin | Acro Biosystems (Newark, DE) | AC2-H82E6-25 ug | Conc: 340 µg/mL, LOT#BV35376-203HFI-2128 |
| Anti-Goat IgG, PE-conjugated | Jackson ImmunoResearch (West Grove, PA) | 705-116-147 | Host species: Donkey |
| Anti-Human IgG R-PE | Life Technologies/Thermo Fisher (Waltham, MA) | H10104 | Conc: 0.15 mg/mL, LOT#2079224, Host species: Goat |
| Anti-Mouse IgG, PE-conjugated | Jackson ImmunoResearch (West Grove, PA) | 115-116-146 | Host species: Goat |
| Anti-Rabbit IgG, PE-conjugated | Jackson ImmunoResearch (West Grove, PA) | 111-116-144 | Host species: Goat |
| Biotin | Thermo-Fisher Scientific (Waltham, MA) | 20RUO | 100 mM, pH 10 Conc. 1 mg/mL |
| Blocker Casein in PBS | Thermo-Fisher Scientific (Waltham, MA) | 37528 | LOT#VD301372 |
| Blocker reagent for ELISA (BRE) | Roche (Basel, Switzerland) | 11112589001 | |
| Brilliant Violet 421 anti-DYKDDDDK Tag Antibody (Anti-FLAG) 0.2 mg/ml, rat IgG2a, λ | BioLegend (Amsterdam, The Netherlands) | 637321 | |
| Bovine serum albumin (BSA) | Saveen & Werner (Limhamn, Sweden) | B2000-500 | LOT#04D5865 |
| EDC (1-Ethyl-3-[3-dimethylaminopropyl]carbodiimide hydrochloride) | Proteochem (Hurricane, UT) | C1100-custom (65 mg) | LOT# MK3857 |
| Fetal calf serum (FCS) | Gibco/Thermo Fisher (Waltham, MA) | 10270-106 | |
| Goat anti-ACE2 polyclonal antibody | R&D Systems/Bio-Techne (Minneapolis, MN) | AF933 | Host species: Goat |
| Goat IgG | Bethyl Labs (Montgomery, TX) | P50-200 | LOT#P50-200-6 |
| L-glutamine | Thermo-Fisher Scientific (Waltham, MA) | 25030024 | |
| Low-bind 1.5 mL microfuge tubes | VWR (Radnor, PA) | 525-0133 | |
| MagPlex-C Microspheres | Luminex Corporation (Austin, TX) | MC10XXX-01 | |
| MEM tissue cuture media | Gibco/Thermo Fisher (Waltham, MA) | 21430-020 | |
| Microplate, 96-Well, Polystyrene, Half-area, Clear | Greiner Bio-One (Kremsmünster, Austria) | 675101 | |
| NaHCO3 | Gibco/Thermo Fisher (Waltham, MA) | 25080-060 | |
| Neutravidin | Thermo-Fisher Scientific (Waltham, MA) | 31000 | LOT#UK292857 |
| PBS tablets | Medicago AB (Uppsala, Sweden) | 09-9400-100 | LOT#272320-01 |
| Penicillin/Streptomycin | Gibco/Thermo Fisher (Waltham, MA) | 15140122 | |
| Poly(vinyl alcohol) | Sigma-Aldrich (St. Louis, MO) | 360627 | |
| Polyvinylpyrrolidone | Sigma-Aldrich (St. Louis, MO) | 437190 | |
| ProClin 300 | Sigma-Aldrich (St. Louis, MO) | 48915-U | |
| Rabbit IgG | Bethyl Labs (Montgomery, TX) | P120-301 | LOT#12 |
| scFv-FAb1 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc: 0.12 mg/mL. | |
| scFv-FAb2 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc batch1: 0.38 mg/mL. Conc batch2: 0.45 mg/mL | |
| scFv-FAb3 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc: 0.34 mg/mL. | |
| scFv-FAb4 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc: 2.85 mg/mL. | |
| scFv-FAb5 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc:2.7mg/mL. | |
| SARS-CoV-2 infectious particles, Swedish isolate | In-house production | The Public Health Agency of Sweden | |
| SARS-CoV-2 Spike Antibody (Hu-anti-S1) | Novus Biologicals (Centennial, CO) | NBP2-90980 | Monoclonal antibody. Conc: 1 mg/mL. Host: Human. Clone: CR3022. Isotype: IgG1 Kappa. LOT#T201B06 |
| Sodium phosphate monobasic, anhydrous | Sigma-Aldrich (St. Louis, MO) | S3139 | |
| Sulfo-NHS (N-hydroxysulfosuccinimide) | Thermo-Fisher Scientific (Waltham, MA) | 24510 | LOT# XH321563 |
| Tween | Thermo-Fisher Scientific (Waltham, MA) | BP337-50 | LOT#194435 |
| Ultraviolet lamp | Vilber Lourmat GmbH (Eberhardzell, Germany) | VL-215.G | Wavelength = 254 nm; 2 × 15-watt bulbs |
| Vero E6 cells | ATCC (Manassus, VA) | CRL-1586 | |
| xMAP INTELLIFLEX DR-SE (dual-reporter flow instrument) | Luminex Corporation (Austin, TX) | INTELLIFLEX-DRSE-RUO |
References
- Rey, F. A., Lok, S. M. Common features of enveloped viruses and implications for immunogen design for next-generation vaccines. Cell. 172 (6), 1319-1334 (2018).
- V'kovski, P., Kratzel, A., Steiner, S., Stalder, H., Thiel, V. Coronavirus biology and replication: implications for SARS-CoV-2. Nature Reviews Microbiology. 19 (3), 155-170 (2021).
- Burnie, J., et al. Flow virometry quantification of host proteins on the surface of HIV-1 pseudovirus particles. Viruses. 12 (11), 1296 (2020).
- Gentili, M., et al. Transmission of innate immune signaling by packaging of cGAMP in viral particles. Science. 349 (6253), 1232-1236 (2015).
- Modrow, S., Falke, D., Truyen, U., Schätzl, H. . Viruses: Definition, Structure, Classification. In Molecular Virology. , 163-181 (2013).
- Trinh, K. T. L., Do, H. D. K., Lee, N. Y. Recent advances in molecular and immunological diagnostic platform for virus detection: A review. Biosensors. 13 (4), 490 (2023).
- Zamora, J. L. R., Aguilar, H. C. Flow virometry as a tool to study viruses. Methods. 134-135, 87-97 (2018).
- Graham, H., Chandler, D. J., Dunbar, S. A. The genesis and evolution of bead-based multiplexing. Methods. 158, 2-11 (2019).
- Byström, S., et al. Affinity proteomic profiling of plasma for proteins associated to area-based mammographic breast density. Breast Cancer Research. 20 (1), 14 (2018).
- Rudberg, A. -. S., et al. SARS-CoV-2 exposure, symptoms and seroprevalence in healthcare workers in Sweden. Nature Communications. 11 (1), 5064 (2020).
- Liu, J., et al. Multiplex reverse transcription PCR Luminex assay for detection and quantitation of viral agents of gastroenteritis. Journal of Clinical Virology. 50 (4), 308-313 (2011).
- Gadsby, N. J., Hardie, A., Claas, E. C. J., Templeton, K. E. Comparison of the Luminex respiratory virus panel fast assay with in-house real-time PCR for respiratory viral infection diagnosis. Journal of Clinical Microbiology. 48 (6), 2213-2216 (2010).
- Lorenzen, E., et al. Multiplexed analysis of the secretin-like GPCR-RAMP interactome. Science Advances. 5 (9), (2019).
- Angeloni, S., Cameron, A., Pecora, N. D., Dunbar, S. A rapid, multiplex dual reporter IgG and IgM SARS-CoV-2 neutralization assay for a multiplexed bead-based flow analysis system. Journal of Visualized Experiments: JoVE. (170), e62487 (2021).
- Jackson, C. B., Farzan, M., Chen, B., Choe, H. Mechanisms of SARS-CoV-2 entry into cells. Nature Reviews Molecular Cell Biology. 23 (1), 3-20 (2022).
- ISO10993-5 Biological evaluation of medical devices - Part 5: Tests for in vitro cytotoxicity. International Standardization Organization Available from: https://nhiso.com/wp-content/uploads/2018/05/ISO-10993-5-2009.pdf (2009)
- Poetz, O., et al. Sequential multiplex analyte capturing for phosphoprotein profiling. Molecular & Cellular Proteomics. 9 (11), 2474-2481 (2010).
- Dunbar, S. A., Vander Zee, C. A., Oliver, K. G., Karem, K. L., Jacobson, J. W. Quantitative, multiplexed detection of bacterial pathogens: DNA and protein applications of the Luminex LabMAP system. Journal of Microbiological Methods. 53 (2), 245-252 (2003).
- Taniuchi, M., et al. Multiplex polymerase chain reaction method to detect Cyclospora, Cystoisospora, and Microsporidia in stool samples. Diagnostic Microbiology and Infectious Disease. 71 (4), 386-390 (2011).
- Wu, M., et al. High-throughput Luminex xMAP assay for simultaneous detection of antibodies against rabbit hemorrhagic disease virus, Sendai virus, and rabbit rotavirus. Archives of Virology. 164 (6), 1639-1646 (2019).
- Dias, D., et al. Optimization and validation of a multiplexed Luminex assay to quantify antibodies to neutralizing epitopes on human papillomaviruses 6, 11, 16, and 18. Clinical and Vaccine Immunology. 12 (8), 959-969 (2005).
- Opalka, D., et al. Simultaneous quantitation of antibodies to neutralizing epitopes on virus-like particles for human papillomavirus types 6, 11, 16, and 18 by a multiplexes lumina assay. Clinical and Diagnostic Laboratory Immunology. 10 (1), 108-115 (2003).
- Nolte-'T Hoen, E., Cremer, T., Gallo, R. C., Margolis, L. B. Extracellular vesicles and viruses: Are they close relatives. Proceedings of the National Academy of Sciences. 113 (33), 9155-9161 (2016).
- Ohmichi, T., et al. Quantification of brain-derived extracellular vesicles in plasma as a biomarker to diagnose Parkinson's and related diseases. Parkinsonism & Related Disorders. 61, 82-87 (2019).
- Ter-Ovanesyan, D., et al. Framework for rapid comparison of extracellular vesicle isolation methods. Elife. 10, e70725 (2021).
- Gamage, S. S. T., et al. Microfluidic affinity selection of active SARS-CoV-2 virus particles. Science Advances. 8 (39), (2022).
- Renner, T. M., Tang, V. A., Burger, D., Langlois, M. -. A. Intact viral particle counts measured by flow virometry provide insight into the infectivity and genome packaging efficiency of moloney murine leukemia virus. Journal of Virology. 94 (2), e01600-01619 (2020).
- Niraja, S., et al. A flow virometry process proposed for detection of SARS-CoV-2 and large-scale screening of COVID-19 cases. Future Virology. 15 (8), 525-532 (2020).
- Lippé, R. Flow virometry: A powerful tool to functionally characterize viruses. Journal of Virology. 92 (3), e01765 (2018).
- Drobin, K., Nilsson, P., Schwenk, J. M. Highly multiplexed antibody suspension bead arrays for plasma protein profiling. Methods in Molecular Biology. 1023, 137-145 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved