Высокопроизводительное фенотипирование на основе изображений для определения морфологических и физиологических реакций на одиночные и комбинированные стрессы у картофеля
In This Article
Summary
Мы разработали протокол фенотипирования на основе изображений для определения морфологических и физиологических реакций на однократную и комбинированную обработку тепла, засухи и заболачивания. Такой подход позволил идентифицировать ранние, поздние и восстановительные реакции на уровне всего предприятия, особенно на наземных участках, и подчеркнул необходимость использования нескольких датчиков визуализации.
Abstract
Высокопроизводительное фенотипирование на основе изображений является мощным инструментом для неинвазивного определения развития и продуктивности растений в определенных условиях с течением времени. Используя несколько датчиков изображения, можно оценить многие интересующие их характеристики, включая биомассу растений, эффективность фотосинтеза, температуру полога и индексы отражательной способности листьев. Растения часто подвергаются множественным стрессам в полевых условиях, когда сильная жара, наводнения и засухи серьезно угрожают урожайности сельскохозяйственных культур. Когда стрессы совпадают, результирующие эффекты для растений могут быть отчетливыми из-за синергетических или антагонистических взаимодействий. Чтобы выяснить, как растения картофеля реагируют на одиночные и комбинированные стрессы, которые напоминают естественные стрессовые сценарии, в начале клубнеобразования выбранному сорту картофеля (Solanum tuberosum L., cv. Lady Rosetta) было применено пять различных обработок, т.е. контроль, засуха, жара, заболачивание и комбинации стрессов от жары, засухи и заболачивания. Наш анализ показывает, что стресс от заболачивания оказал наиболее пагубное влияние на продуктивность растений, что привело к быстрым и резким физиологическим реакциям, связанным с закрытием устьиц, включая снижение количественного выхода и эффективности фотосистемы II, а также повышение температуры растительного покрова и индекса воды. При термической и комбинированной обработке стрессом относительная скорость роста снижалась на ранней стадии стресса. В условиях засухи и комбинированных стрессов объем растений и фотосинтетическая производительность снижались с повышением температуры и закрытием устьиц в поздней фазе стресса. Сочетание оптимизированной обработки стресса в определенных условиях окружающей среды с выбранными протоколами фенотипирования позволило выявить динамику морфологических и физиологических реакций на одиночные и комбинированные нагрузки. Здесь представлен полезный инструмент для исследователей растений, которые хотят определить признаки растений, свидетельствующие об устойчивости к нескольким стрессам, связанным с изменением климата.
Introduction
Потенциальные последствия изменения климата, включая увеличение интенсивности и частоты волн тепла, наводнений и засух, оказывают негативное воздействие на выращивание сельскохозяйственных культур1. Важно понимать влияние изменения климата на изменчивость сельскохозяйственных культур и связанные с этим колебания годового производства сельскохозяйственных культур2. В условиях роста численности населения и спроса на продовольствие поддержание урожайности сельскохозяйственных культур является проблемой, в связи с чемсрочно требуется поиск климатически устойчивых культур для селекции. Картофель (Solanum tuberosum L.) является одной из основных продовольственных культур, которая вносит вклад в глобальную продовольственную безопасность благодаря своей высокой питательной ценности и повышению эффективности использования воды. Однако снижение роста и урожайности при неблагоприятных условиях является основной проблемой, особенно у восприимчивых сортов 5,6. Во многих исследованиях подчеркивалась важность изучения альтернативных подходов к поддержанию урожайности картофеля, включая методы ведения сельского хозяйства, поиска толерантных генотипов и понимания влияния стресса на развитие и урожайность 7,8,9, что также очень востребовано европейскими картофелеводами (или фермерами)10.
Автоматизированные платформы фенотипирования, в том числе фенотипирование на основе изображений, позволяют проводить количественный анализ структуры и функций растений, которые необходимы для выбора соответствующих признаков, представляющих интерес11,12. Высокопроизводительное фенотипирование является передовым неинвазивным методом для определения различных морфологических и физиологических признаков, представляющих интерес, воспроизводимым и быстрым способом 13. Хотя фенотип отражает генотипические различия в связи с воздействием окружающей среды, сравнение растений в контролируемых условиях со стрессом позволяет связать обширную информацию о фенотипировании с конкретным (стрессовым) состоянием. Фенотипирование на основе изображений имеет важное значение для описания фенотипической изменчивости, а также способно отсеивать набор признаков на протяжении всего развития растений независимоот размера популяции. Например, измерение морфологических признаков, включая форму, размер и цветовой индекс листьев с помощью датчиков изображения Red-Green-Blue (RGB), используется для определения роста и развития растений. Кроме того, измерения физиологических характеристик, включая эффективность фотосинтеза, температуру полога и отражательную способность листьев, количественно оцениваются с помощью нескольких типов датчиков, таких как флуоресценция хлорофилла, тепловое инфракрасное излучение (ИК) и гиперспектральнаявизуализация. Недавние исследования в контролируемых средах показали потенциал использования фенотипирования на основе изображений для оценки различных механизмов и физиологических реакций растений в условиях абиотических стрессов, таких как тепло у картофеля17, засуха у ячменя18, риса19 и комбинированная засуха и тепловые обработки у пшеницы20. Несмотря на то, что изучение реакции растений на множественные стрессовые взаимодействия является сложной задачей, полученные результаты открывают новые возможности для понимания механизмов работы растений в условиях быстрых измененийклиматических условий.
Физиологические и морфологические реакции растений напрямую зависят от условий абиотического стресса (высокая температура, дефицит воды и наводнения), что приводит к снижению урожайности. Несмотря на то, что картофель имеет высокую эффективность использования воды по сравнению с другими культурами, дефицит воды негативно влияет на количество и качество урожая из-за неглубокойкорневой архитектуры. В зависимости от интенсивности и продолжительности засухи индекс площади листьев снижается, а на более поздних стадиях стресса проявляется задержка роста полога с подавлением образования новых листьев, приводящая к снижению скорости фотосинтеза23. Пороговый уровень воды имеет решающее значение при избытке воды или длительных периодах засухи, что приводит к негативному влиянию на рост растений и развитие клубней из-за ограничения кислорода, снижения гидравлической проводимости корней и ограничения газообмена24,25. Кроме того, картофель чувствителен к высоким температурам, при которых температура выше оптимального уровня приводит к задержке зарождения, роста и ассимиляции клубней26. Когда стрессы возникают в комбинации, биохимическая регуляция и физиологические реакции отличаются от индивидуальных реакций на стресс, что подчеркивает необходимость изучения реакций растений на комбинации стрессов. Комбинированные стрессы могут привести (даже в большей степени) к значительному снижению роста растений и детерминантному влиянию на репродуктивныепризнаки. Влияние комбинации стрессов зависит от доминирования каждого стресса над другими, что приводит к усилению или подавлению реакции растений (например, засуха обычно приводит к закрытию устьиц, в то время как устьица открыты, чтобы обеспечить охлаждение поверхности листьев при тепловом стрессе). Тем не менее, исследования комбинированных напряжений все еще находятся в стадии разработки, и необходимы дальнейшие исследования, чтобы лучше понять сложную регуляцию, опосредующую реакцию растений в этих условиях29. Таким образом, данное исследование направлено на то, чтобы выделить и рекомендовать протокол фенотипирования с использованием нескольких датчиков визуализации, которые могут быть пригодны для оценки морфофизиологических реакций и понимания основных механизмов общей продуктивности картофеля при однократном и комбинированном лечении стрессом. Как и предполагалось, объединение нескольких датчиков изображения оказалось ценным инструментом для характеристики ранних и поздних стратегий во время реакции растений на стресс. Оптимизация протокола фенотипирования на основе изображений станет интерактивным инструментом для исследователей растений и селекционеров для поиска признаков, представляющих интерес для абиотической стрессоустойчивости.
Protocol
1. Подготовка растительного материала и условия роста
- Пересадка in vitro картофеля (Solanum tuberosum L., cv. Lady Rosetta) черенков из культуры тканей в горшки объемом 250 мл.
- Заполните горшки полностью насыщенным субстратом Klasmman Substrate 2 и выдержите их в камере роста в условиях низкой освещенности в течение 1 недели.
- Отрегулируйте условия освещенности на уровне полога до 160 мкмоль·м-2·с-1 с помощью комбинации 25% белого света и 35% инфракрасного с помощью экспонометра.
- Пересадите растения через 10 дней выращивания черенков in vitro в почву в горшки объемом 3 л (диаметр 15,5 см, высота 20,5 см).
- Наполните горшок объемом 3 л 1850 г субстрата 3:1 Klasmann 2: Песок.
- Поместите растения в камеру выращивания в условия освещения 320 мкм·м-2·с-1 с комбинацией 55% белого света и 81% инфракрасного и установите режим длинного дня (фотопериод 16 часов).
- Установите температуру в ростовой камере на 22 °C/19 °C для дня и ночи и относительную влажность (RH) на уровне 55% для всего эксперимента.
- Поддерживайте вес горшка на уровне 60% относительного содержания воды в почве (SRWC) в качестве подходящего контрольного уровня для поддержания роста и урожайности30,31.
ПРИМЕЧАНИЕ: Согласно предыдущим испытаниям, поддержание объемного содержания воды выше 60% способствовало росту мха на поверхности почвы и повышало риск заболеваний растений. Кроме того, присутствие мха может генерировать вводящие в заблуждение положительные сигналы при флуоресцентной визуализации хлорофилла, которую трудно отфильтровать. Используйте следующее уравнение: SRWC% = (FW-DW)/(TW-DW) × 100, где FW — свежий вес почвы, TW — тургор, а DW — сухой вес32.- Выберите образцы почвы (100 г) из трех различных мешков со смесью Klasmman Substrate 2 в качестве реплик и взвесьте свежий вес почвы.
- Насыщайте почву водой до тех пор, пока горшки не удерживают воду без капания и не взвешивают тургор почвы под тяжестью тургора.
- Поместите образец в духовку при температуре 80 °C на 3 дня, пока образцы почвы полностью не высохнут и не взвесят сухой вес почвы33.
- Положите синие коврики на поверхность горшка, чтобы уменьшить испарение.
ПРИМЕЧАНИЕ: Синий цвет необходим для вычитания фона почвы из пикселей растений при сегментации изображения. - Выберите десять биологических репликаций для каждой процедуры.
- Рандомизируйте горшки во время полива (всего 50 горшков).
- Добавьте синие держатели для поддержки растений и предотвращения механических повреждений при их размещении в системе фенотипирования.
2. Приложение стресса
- На ранней стадии клубнеобразования (через 28 дней после пересадки черенков in vitro ) разделите растения на пять групп обработки и фенотип десяти растений на обработку (Рисунок 1).
- Вызовите одиночный и комбинированный стресс до уровня, который не будет вредным, следующим образом:
- В камере выращивания держите растения под контролем, засуху и обработку от переувлажнения при температуре 22 °C/19 °C днем/ночью (шаг 1.7), с различными процентами SRWC:
Контроль (C) с 60% SRWC в течение всего эксперимента.
Засуха (D) с 20% SRWC постепенно в течение 7 дней с последующим 1 днем восстановления.
Заболачивание (W) со 160% SRWC в течение 5 дней с последующим 10 днями восстановления. - Чтобы поддерживать уровень воды над поверхностью почвы при обработке от переувлажнения, вставьте полиэтиленовый пакет в пустой горшок, а затем поместите основной горшок с почвой в подготовленный второй горшок.
- Поместите растения в капсулу роста при температуре 30/28 °C днем/ночью и относительной влажности 55% для термической обработки. Применяйте одиночные и комбинированные тепловые напряжения следующим образом:
- Для жары (H) поддерживайте температуру 30-28 °C с 60% SRWC в течение 15 дней.
- Для тройного стресса «Жара + Засуха + Заболачивание» (HDW) подвергните растения термической обработке при температуре 30 °C/28 °C днем/ночью в течение первых 7 дней (сохраняя 60% SRWC), затем повторите комбинированную обработку от засухи + тепла в течение остальных 7 дней (20% SRWC и 30 °C / 28 °C) и, наконец, подвергните растения стрессу от переувлажнения в течение 1 дня. В последнем случае поместите растения обратно в камеру роста (см. шаг 1.7 для условий) и вызовите заболачивание до 160% SRWC в течение 1 дня.
Примечание: Выбранная продолжительность индуцированных напряжений была основана на экспериментальном эксперименте, который показал эффекты стресса без вредных воздействий со 100% выживаемостью обработанных растений. В условиях ростовой камеры изменение условий окружающей среды находилось в диапазоне ± 0,2 °C для температуры и ± 3% для влажности.
- В камере выращивания держите растения под контролем, засуху и обработку от переувлажнения при температуре 22 °C/19 °C днем/ночью (шаг 1.7), с различными процентами SRWC:
3. Подготовка растений к фенотипированию
- После включения света в 6:00 утра в камерах роста дайте растениям акклиматизироваться в условиях постоянной освещенности роста (320 мкмоль·м-2·с-1) в течение не менее 2-3 часов до начала протокола фенотипирования. Это гарантирует, что фотосинтез и устьичная регуляция находятся в устойчивом состоянии34.
- Перед измерением переместите растения из места их выращивания в буферную зону для роста системы фенотипирования, используемой для ручной загрузки растений в систему, в то время как автоматический подсчет растений находится в режиме ожидания и расположен внутри теплицы (дополнительный рисунок 1, дополнительный рисунок 2 и дополнительный рисунок 3).
ПРИМЕЧАНИЕ: Растения содержались в буферной зоне роста в течение периода фенотипирования продолжительностью 3,5 ч. В теплице колебания условий окружающей среды находились в диапазоне ± 2 °C для температуры, ± 5% для влажности и 20% колебаний интенсивности света. Таким образом, учтите, что измерения должны начинаться сразу и быть короткими, не допуская влияния тепличных условий на растения. - На платформе фенотипирования поместите горшки в диски, которые автоматически перемещаются по конвейерной ленте с заданными интервалами к датчику изображения в соответствии с протоколами измерений, указанными в разделе 4.
- Пометьте каждое растение/лоток уникальным идентификатором, чтобы гарантировать, что измеренные данные будут назначены правильному растению на протяжении всего эксперимента.
4. Протокол фенотипирования
- Оптимизируйте протокол фенотипирования с помощью нескольких датчиков визуализации (флуоресцентный хлорофилл, тепловой инфракрасный, RGB и гиперспектральная визуализация), что позволит одновременно измерять как физиологические, так и морфологические параметры растений (рис. 2).
ПРИМЕЧАНИЕ: Поскольку реакция растений отражает условия окружающей среды и суточные эффекты, важно рассмотреть возможность рандомизации горшков и проведения фенотипирования в течение одного и того же периода дня. - На платформе фенотипирования убедитесь, что растения поступают в систему через адаптационный туннель (рис. 2A), где сначала фиксируется высота растения, а затем высота каждого датчика регулируется на основе фиксированного рабочего расстояния.
- Проведите измерения в два раунда, как указано в протоколе измерений, с помощью программного обеспечения.
- В первом раунде проводятся измерения физиологических реакций, количественно выраженных как «быстрые реакции», с использованием флуоресценции хлорофилла и тепловизионной визуализации.
- Начните с измерения физиологических параметров при лечении тепловым стрессом, а затем перейдите к остальным процедурам.
- Во втором раунде продолжите другие измерения для оценки более медленных откликов, включая структурную RGB и гиперспектральную визуализацию, за которыми последует оценка веса и увлажнение.
- На этапе взвешивания и полива определите контрольный вес для каждого растения, чтобы обеспечить автоматический полив и взвешивание для данной обработки.
- Убедитесь, что общий контрольный вес включает вес диска, вставки, расположенной на конвейерной ленте, поддерживающего синий держатель, синий коврик, горшок, почву и биомассу растений в соответствии с определенным протоколом.
- Для точного измерения эвапотранспирации на этапе взвешивания и полива подготовьте пустые горшки в качестве эталона. Кроме того, подготовьте дополнительные горшки с поправкой на биомассу растения.
- Для измерения 50 растений вся продолжительность протокола фенотипирования занимает 215 минут (85 минут в1-м раунде и 130 мин во2-м раунде).
- Фенотипируйте ежедневно все растения в контрольных условиях (за 1 день до обработки), а затем проводите стрессовые обработки для мониторинга динамических реакций и оценки ранних и поздних фаз индуцированного стресса.
5. Настройка параметров для каждого датчика изображения
- Кинетическая флуоресцентная визуализация хлорофилла
Кинетическая флуоресценция хлорофилла используется для исследования фотосинтетической способности растений в ответ на различные условия окружающей среды, включая абиотические стрессы, а также для получения ценной информации о квантовой эффективности фотохимии и рассеивания тепла (нефотохимических процессов).- Проведите измерение флуоресценции хлорофилла на растениях, адаптированных к свету, с использованием протокола короткого света для различения реакций растений при различных обработках.
- Акклиматизируйте35 растений в течение 5 мин под светом в адаптационном туннеле, оборудованном холодно-белыми светодиодами (6500 К) при давлении 500 мкмоль·м-2·с-1.
ПРИМЕЧАНИЕ: Флуоресцентная визуализация хлорофилла является первым измерением после адаптации света, используемым для мониторинга изменений фотосинтетических способностей растений. - Выберите и оптимизируйте предварительно определенный протокол в соответствии с размером установки и требуемой интенсивностью освещения.
- Оптимизируйте настройки измерения, включая настройки камеры и интенсивности света, чтобы обеспечить получение сильного сигнала с оптимальным соотношением сигнал/шум.
- Отрегулируйте настройки камеры, такие как затвор (время экспозиции, длительность измерительных вспышек) и чувствительность (электрическое усиление камеры). Используйте затвор на 2 мс и чувствительность на 12%.
ПРИМЕЧАНИЕ: Эти значения корректируются в зависимости от размера и формы листьев, а также заданного расстояния между верхней частью полога и датчиком изображения. - Отрегулируйте интенсивность актинического света на 500 мкмоль·м-2·с-1 и установите импульс насыщения на 3200 мкмоль·м-2·с-1, что по крайней мере в 6-7 раз выше актинического света.
- Отрегулируйте настройки камеры, такие как затвор (время экспозиции, длительность измерительных вспышек) и чувствительность (электрическое усиление камеры). Используйте затвор на 2 мс и чувствительность на 12%.
- Для измерения параметров в стационарном состоянии света (Lss) (описано ниже) светоадаптированные установки за 5 мин до измерений в светоадаптационном туннеле.
- Чтобы оценить квантовый выход стационарной фотосистемы II (PSII) для растений, адаптированных к свету, выберите протокол короткого света (рис. 3) и настройте протокол следующим образом.
ПРИМЕЧАНИЕ: Продолжительность протокола составляла 10 с на одну установку.- Начните измерение, включив холодно-белый актинический свет с давностью 500 мкмоль·м-2·с-1 на 3 с, чтобы измерить стационарную флуоресценцию в свете (Ft_Lss aka. Фт')
- Подайте импульс насыщения при давлении 3200 мкмоль·м-2·с-1 в течение 800 мс, чтобы измерить установившуюся максимальную флуоресценцию в свету (Fm_Lss aka. Фм')
- Выключите актинический свет, затем включите дальний красный свет (735 нм), чтобы PSII мог расслабиться в темноте в течение 800 мс и измерить установившуюся минимальную флуоресценцию в свете (Fo_Lss aka. Fo').
- Чтобы рассчитать относительные параметры, используйте программное обеспечение для анализа данных, которое вычитает фон и извлекает соответствующие параметры.
ПРИМЕЧАНИЕ: Параметры, извлеченные из используемого протокола, следующие: максимальная эффективность фотохимии PSII адаптированного к свету образца в стационарном световом состоянии, определенная как Fv/Fm_Lss aka. Fv'/Fm', квантовый выход фотосистемы II или операционная эффективность фотосистемы II в стационарном световом состоянии, определенная как QY_Lss aka. φPSII = Fq'/Fm', а доля открытых реакционных центров в PSII (окисленный QA) определяется как qL_Lss = (Fq'/Fv') x (F0'/Ft').
- Тепловизионная инфракрасная (ИК) визуализация
ПРИМЕЧАНИЕ: Тепловизионная инфракрасная визуализация используется для неинвазивного измерения фактической температуры полога, тем самым определяя различные устьичные регуляции. В блоке тепловизионного инфракрасного изображения тепловизионная камера установлена сбоку на роботизированной руке для измерения температуры купола с бокового обзора.- Чтобы увеличить контрастность фоновой температуры по сравнению с температурой изображаемого объекта во время обработки изображения, используйте автоматически управляемую нагреваемую стену на противоположной стороне тепловизионной камеры для увеличения контраста. Отрегулируйте температуру стенки на 8 °C выше температуры воздуха в формирователе изображения.
ПРИМЕЧАНИЕ: Тепловизионные изображения были получены в темноте с использованием режима линейного сканирования35. - После получения изображения сгенерируйте маску растения на основе данных бокового обзора RGB и используйте ее для совместной регистрации с тепловыми данными при анализе изображений. Это обеспечивает точную идентификацию сканируемого объекта, устраняя фоновые помехи, такие как держатель растения.
- Чтобы предотвратить влияние изменяющихся условий окружающей среды на протяжении всего эксперимента, рассчитайте разницу температур параметра (дельта T или ΔT).
ПРИМЕЧАНИЕ: Delta T (ΔT) определяется как разница между измеренной температурой листовой поверхности (среднее значение всех пикселей от всей обнаруженной поверхности растения) и температурой окружающего воздуха внутри камеры визуализации.
- Чтобы увеличить контрастность фоновой температуры по сравнению с температурой изображаемого объекта во время обработки изображения, используйте автоматически управляемую нагреваемую стену на противоположной стороне тепловизионной камеры для увеличения контраста. Отрегулируйте температуру стенки на 8 °C выше температуры воздуха в формирователе изображения.
- RGB-изображение
ПРИМЕЧАНИЕ: RGB-визуализация основана на камерах визуальной инерциальной системы (VIS), которые обнаруживают свет в видимом диапазоне от 400 до 700 нм, где он используется для глубокого анализа морфологии растений, архитектуры и извлечения особенностей цветового индекса.- Блок формирования изображения содержит вращающийся стол для точного позиционирования лотка и одновременно позволяет делать снимки под разными углами для бокового обзора.
- Настройте RGB-изображение на основе изображения сбоку, чтобы захватить растение под тремя углами (0°, 120° и 240°), которое снимается в режиме линейного сканирования (RGB1), а изображение сверху — в режиме моментального снимка (RGB2).
- Обе камеры оснащены светодиодным источником света, обеспечивающим равномерное освещение фотографируемого растения и, таким образом, точно определяющим морфологические и цветовые особенности.
- Извлекайте рассчитанные параметры с помощью программного обеспечения для анализа данных.
- Для получения дополнительных параметров на основе вида сбоку и сверху рассчитайте объем растения (цифровую биомассу)36:
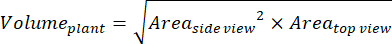
- Рассчитайте относительный темп роста (RGR)37:
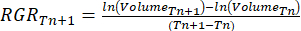
Где Tn и Tn+1 обозначают временной интервал (дни).
- Гиперспектральная визуализация
ПРИМЕЧАНИЕ: Гиперспектральная визуализация используется для визуализации спектральной отражательной способности растений. Изменения отражательной способности листьев являются индикаторами различного физиологического состояния данного растения.- Используйте гиперспектральный датчик изображения для количественной оценки отражательной способности полога в видимой части световых спектров с гиперспектральной камерой видимого ближнего инфракрасного диапазона (VNIR) в диапазоне 380–900 нм и коротковолновой инфракрасной камерой (SWIR) в диапазоне 900–1700 нм.
- Камеры установлены на роботизированной руке с галогенным источником света (600 Вт) для равномерного и спектрально соответствующего освещения образца во время получения изображения, движущегося по области XZ.
- Обе камеры работают в режиме линейного сканирования и размещены в светоизолированном видеобоксе.
- Перед каждым раундом измерений выполните два калибровочных измерения (автоматически): калибровку темнового тока и радиометрическую калибровку с использованием тефлонового стандарта спектрального отражения.
- Темное калибровочное изображение вычитается из необработанного и белого калибровочного изображения для удаления темнового тока. Затем сгенерируйте окончательный гиперспектральный вид, разделив исходное изображение после вычитания на белое калибровочное изображение.
6. Экспорт данных и анализ изображений
- Используйте программное обеспечение для анализа данных для автоматического извлечения, вычитания фона и сегментации по маске растений конвейера обработки изображений (рис. 2B).
- Программное обеспечение выполняет полностью автоматизированный анализ, в котором нанесение маски, вычитание фона, при котором растения изолированы от фона, и расчет параметров, как описано для RGB imaging38 и тепловизионного изображения20.
- Извлекайте измеренные и рассчитанные параметры из пикселей, специфичных для растения, как определено маской растения и маской лотка, сгенерированными RGB-изображением.
- Если изображения были выбраны не полностью, что может произойти из-за изменения зелени растительности на более поздних стадиях развития или влияния стрессовой обработки, откройте раздел анализа локальных данных в программном обеспечении и повторно настройте параметры Plant Mask в программном обеспечении анализатора данных в зависимости от каждого датчика.
- При обработке изображений флуоресценции хлорофилла отрегулируйте параметры анализа параметров флуоресценции хлорофилла Plant Mask (дополнительный рисунок 4).
- Установите пороговое значение True, что означает, что сегментация растений выполняется автоматически.
- Установите для параметра Индекс кадра маски значение False, что означает, что для обнаружения маски растения используется временной визуальный кадр, как определено в протоколе флуоресценции хлорофилла.
- При обработке тепловизионных изображений задайте параметры для анализа Plant Mask (дополнительный рисунок 5).
- Установите автоматический порог для генерации маски объекта равным False.
- Установите маску из изображения на стороне RGB в значение True , которая будет использоваться для анализа.
- При обработке изображений RGB настройте параметры анализа настроек Plant Mask (Дополнительный рисунок 6 и Дополнительный рисунок 7) в зависимости от вида и стадии развития.
- Выберите формулу 4*G-3*B-R, которая является определением для генерации маски объекта и определяет используемую цветовую составляющую (Красный, Зеленый, Синий компонент).
ПРИМЕЧАНИЕ: Эта стандартная формула и другие настройки могут меняться в зависимости от типа используемой камеры (вид сверху или размер), применяемой обработки и различных сортов. - Настройте пороговое значение , используемое для преобразования изображения в оттенках серого с усиленным зеленым каналом в двоичное изображение, определяющее поверхность, покрытую растением.
- Отрегулируйте размер медианного фильтра, используемого для уменьшения шума и недопустимых пикселей и заполнения недостающих.
- Настройте Минимальный размер объекта в пикселях, который будет включен в анализ.
- Настройте минимальный размер отверстий в объектах маски в пикселях, обычно в десятках пикселей. Отверстия меньше этого значения закрываются и включаются в пиксели объекта.
- Установите параметр Использовать подавление отражения в значение True для нормализации значений RGB в каждом пикселе.
- Установите параметр Пропускать точки с плохой экспозицией в значение True для обрезки сверх/ниже экспонированных пикселей из маски растения (например, пропуская поверхностные отражения или темные пиксели, где шум больше сигнала).
- Выберите формулу 4*G-3*B-R, которая является определением для генерации маски объекта и определяет используемую цветовую составляющую (Красный, Зеленый, Синий компонент).
- Раскрасьте настройки сегментации, проанализированные из RGB, с помощью программного обеспечения анализатора данных, чтобы предоставить информацию об изменениях цвета, связанных с реакцией на стресс и старением растений.
ПРИМЕЧАНИЕ: Зелень оценивается с использованием заранее определенного диапазона цветов, представляющих все стадии развития растения. Интенсивность цветовых каналов из всех пикселей, соответствующих поверхности растения, была сгруппирована и кластеризирована для использования в качестве исходной цветовой карты для цветовой сегментации.- Предоставьте обработанное RGB изображение (удаленный фон), цветовую карту - список оттенков для конкретного анализа, в качестве входных данных в программном обеспечении.
- Чтобы получить объективные результаты, выполните подбор оттенков с помощью «обучающего» набора данных и выберите различные стадии развития и методы лечения.
ПРИМЕЧАНИЕ: При анализе сохраняются значения R, G и B для каждого пикселя каждого изображения из этого обучающего набора данных. - Определите количество оттенков (выберите 6 оттенков) с помощью программного обеспечения для вывода определения цвета, в диапазоне от 0 до 255 для каждого канала.
- Укажите список оттенков, сгенерированных в программном обеспечении анализатора данных (Цвета).
- При обработке гиперспектральных изображений полученные гиперспектральные данные обрабатываются с помощью попиксельного анализа, реализованного в программном обеспечении гиперспектрального анализатора, включающего калибровку радиометрических и темновых шумов, вычитание фона и сегментацию по маскам растений. Используйте средние спектры и вегетационные индексы для дальнейшего анализа.
- Создание маски для извлечения данных из гиперспектрального изображения из изображения ВНИР, полученного гиперспектральной камерой ВНИР. Для гиперспектрального сканирования SWIR сгенерируйте маску растения на основе анализа SWIR.
- В VNIR Plant Mask используйте формулу 1.2*(2.5*(R740-R672)-1.3*(R740-R556)) для визуализации изображений, где R представляет значение отражательной способности на определенной длине волны (дополнительный рисунок 8).
- В SWIR Plant Mask используйте формулу (R960-R1450)-(R960-R1200) в обработке изображений для визуализации изображений (дополнительный рисунок 9).
7. Взвешивание и полив
- Сохраняйте вес (до) полива во время процедуры взвешивания и полива. Затем применяйте полив, и сохраняйте вес после полива также.
- Поливать лотки в эталонном режиме - у каждого лотка хранилось эталонное значение, хранящееся в базе данных, до которого он всегда поливался. Определите референс на основе проведенного лечения.
8. Анализ данных
- Проанализируйте данные с помощью ANOVA и теста Шапиро.
- Проведите попарное сравнение между различными обработками с помощью теста Pairwise Wilcox в R studio (версия 4.2.3) с использованием пакетов (dplyr), (tidyverse), (rstatix) и (ggpubr).
ПРИМЕЧАНИЕ: Анализ изображений был выполнен автоматически с помощью программного обеспечения для анализа данных. Для дальнейшего анализа полученного изображения используйте программное обеспечение для анализа данных, специфичное для датчиков.
Representative Results
В этом исследовании было использовано автоматизированное фенотипирование на основе изображений для изучения морфологических и физиологических реакций картофеля (cv. Lady Rosetta) на одиночный и комбинированный стресс. Примененный подход показал динамические реакции растений с высоким пространственно-временным разрешением на индуцирование стресса на стадии инициации клубней. Для оценки ранней и поздней фаз стресса результаты были представлены в виде 3 временных периодов ([0-5 дней фенотипирования (DOP)], [6-10 DOP] и [11-15 DOP]) (рис. 1). До 0 DOP все растения выращивали в контрольных условиях (C), затем от 1-5 DOP, где применяли напряжение от переувлажнения (W) и тепловое напряжение (H). Таким образом, реакции наблюдались следующим образом: (i) в 0-5 DOP указывали на первоначальную жару и заболачивание; (ii) в 6-10 DOP отразили раннюю засуху (D) и наблюдались комбинированные напряжения в жару и засуху (HD) и (iii) в 11-15 DOP показали позднюю жару, засуху и комбинированную жару + засуху + заболачивание (HDW). Восстановление после заболачивания наблюдалось в 6-10 ДОП и 11-15 ДОП.
Морфологические признаки
Для определения влияния различных напряжений и комбинаций на надземный рост растений была применена RGB-визуализация. Результаты, представленные на рисунке 4 , показывают, что термическая обработка и напряжение заболачивания (0-5 DOP) уже приводят к снижению объема установки и RGR по сравнению с контролем. В течение 6-10 DOP объем растений и RGR контрольных растений непрерывно увеличивались, в то время как в условиях жары, комбинированной жары, засухи и заболачивания это увеличение объема растений явно уменьшалось (Рисунок 4А). Поскольку растения очень восприимчивы к стрессу от переувлажнения, было выражено снижение RGR (рис. 4B). Во время стресса от поздней засухи (11-15 DOP), когда SRWC поддерживался на уровне 20%, наблюдалось явное снижение RGR по сравнению с контролем. Однако в поздней фазе комбинированного ГБР применение обработки от заболачивания привело к увеличению ВВВ в последний день стресса.
Физиологические особенности
Комбинация структурного и физиологического фенотипирования была применена для выявления дальнейших реакций на стресс. Использование нескольких датчиков изображения позволяет определить физиологические реакции на ранней стадии стресса. Дальнейший анализ данных флуоресценции хлорофилла показал, что заболачивание отрицательно влияет на эффективность фотосинтеза, где Fv'/Fm' (Fv/Fm_Lss) резко снижается при 0-5 DOP и 6-10 DOP, но восстановительная реакция наблюдалась при 11-15 DOP, где Fv'/Fm' немного увеличивается (рис. 5A). Во время поздней фазы стресса (11-15 DOP) наблюдалось снижение Fv'/Fm' при засухе и комбинированной жаре и засухе. На переувлажненных установках эффективность работы установок (QY_Lss также известная как φPSII) была значительно ниже по сравнению с другими обработками при 0-5 DOP и 6-10 DOP, но небольшое увеличение при 11-15 DOP, что указывает на восстановление растений (рис. 5B). Кроме того, различные механизмы регулирования эффективности, способствующей защите от PSII, были определены путем расчета доли открытых реакционных центров в PSII в легком стационарном состоянии (qL_Lss) (рис. 5C). Только в условиях засухи наблюдалось увеличение qL, вероятно, за счет фотоингибирования.
Эти результаты соответствовали данным ИИ, которые отражали различные основные механизмы под действием напряжений (Рисунок 6). При заболачивании наблюдалось увеличение дельтаТ (ΔT), снижающее скорость газообмена. В условиях поздней засухи и комбинированной жары и засухи увеличение ΔT было связано с закрытием устьиц, что считается одной из основных реакций для предотвращения избыточной потери воды. С другой стороны, наблюдалось снижение ΔT при термической обработке при открытии устьиц для повышения эффективности транспирации и охлаждения поверхности листа.
При исследовании гиперспектральных данных из гиперспектральных данных ВНИР были выбраны два параметра для оценки индексов отражательной способности листьев, в том числе NDVI как индикатор содержания хлорофилла и PRI как показатель эффективности фотосинтеза. Результаты показали снижение NDVI и PRI только при заболачивании в связи с наблюдаемым снижением морфологических признаков (рис. 7A, B). Кроме того, по гиперспектральным данным SWIR, использованным для оценки содержания воды в растениях, наблюдалось увеличение индекса воды при заболачивании при 0-5 DOP (рис. 7C). Однако при термической обработке наблюдалась обратная реакция, когда индекс воды был ниже контрольного. Эти результаты были получены в соответствии с исследованием растительности на основе цветовой сегментации вида RGB сверху. Изменения в соотношении оттенков указывают на реакцию на стресс с течением времени (рис. 8). Индекс озеленения показал снижение содержания пигмента в условиях засухи и комбинированного ГР в поздней фазе стресса и постепенное восстановление после обработки от заболачивания. Таким образом, использование нескольких датчиков визуализации отразило корреляцию морфофизиологических признаков и позволило оценить общую производительность растений при абиотических стрессах.
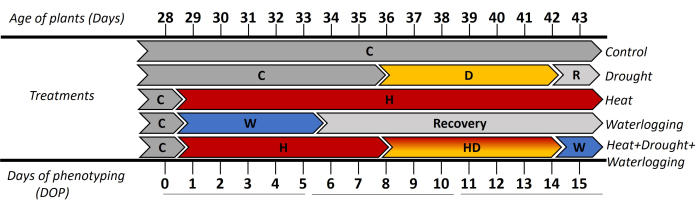
Рисунок 1: График применения различных методов лечения, включая возраст растений через несколько дней после пересадки черенков in vitro . День 0 фенотипирования (DOP) измерялся в контрольных условиях (C), а затем индуцировались различные стрессы разной продолжительности. От 1-5 DOP применялось напряжение заболачивания (W) и начальная реакция термической обработки (H). В последующие дни 6-10 DOP, где была представлена начальная фаза стресса от засухи (D) и комбинированной жары и стресса от засухи (HD). В течение 11-15 ДОП отражена реакция растений на позднюю фазу засухи и термических обработок и применение переувлажнения до БГ (ЖР) в течение 1 суток. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
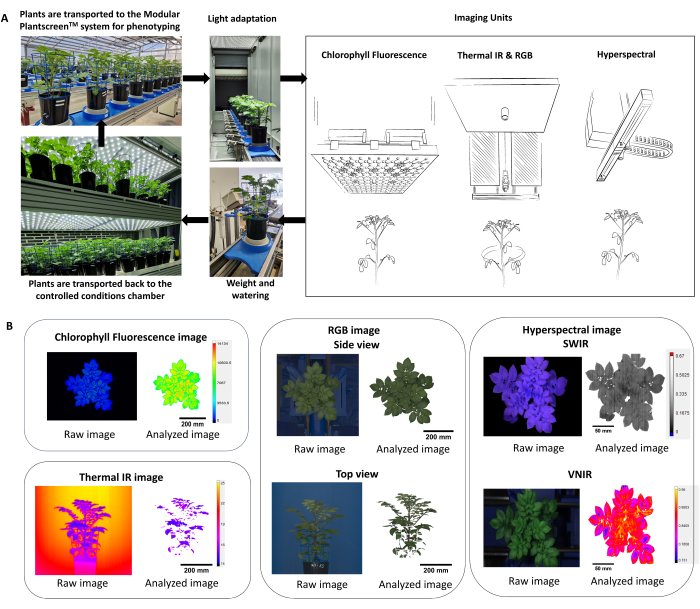
Рисунок 2: Схема, обобщающая протокол фенотипирования и анализ данных. (A) Обзор протокола фенотипирования. Растения транспортируются в систему фенотипирования из контролируемых условий в камере выращивания (PSI) FS-WI. Перед измерениями растения акклиматизировали на свету в светоадаптационной камере в течение 5 мин при давлении 500 мкм-2.с-1. Для определения морфологических и физиологических признаков использовали несколько датчиков изображения, за которыми последовала станция взвешивания и водопоя. В зависимости от обработки установки были помещены обратно в контролируемые условия при температуре 22 °C/19 °C или 30 °C/28 °C. (B) Автоматическое извлечение и сегментация конвейера обработки изображений от каждого датчика изображения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
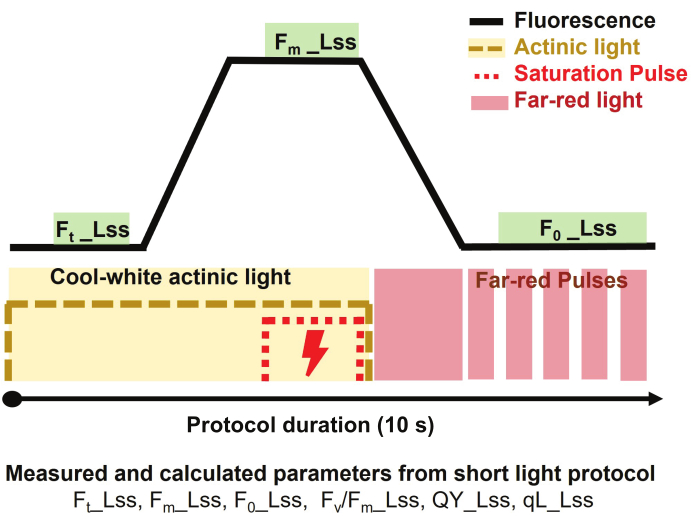
Рисунок 3: Обзор протокола короткого света для флуоресцентной визуализации хлорофилла. Протокол измерения начинался с включения холодного белого актинического света для измерения стационарной флуоресценции в свете (Ft_Lss), а затем подачи импульса насыщения для измерения установившейся максимальной флуоресценции в свете (Fm_Lss). Актинический свет был выключен, а дальний красный свет был включен для определения установившейся минимальной флуоресценции в свете (Fo_Lss). Продолжительность протокола составляла 10 с на растение. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
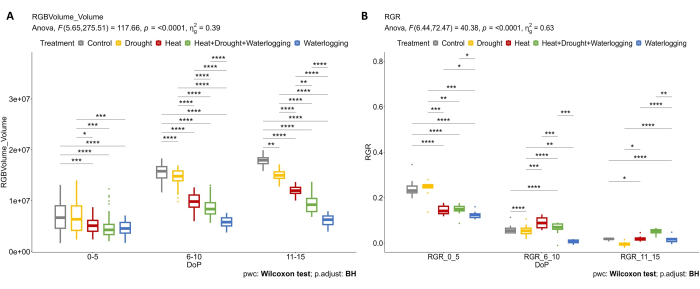
Рисунок 4: Визуализация RGB, используемая для морфологической оценки. (A) Объем растения рассчитан на основе RGB верхней и боковой проекций. В) Относительная скорость роста (ВВ) на стадии зарождения клубней. Данные представляют собой средние значения ± стандартного отклонения (n = 10). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
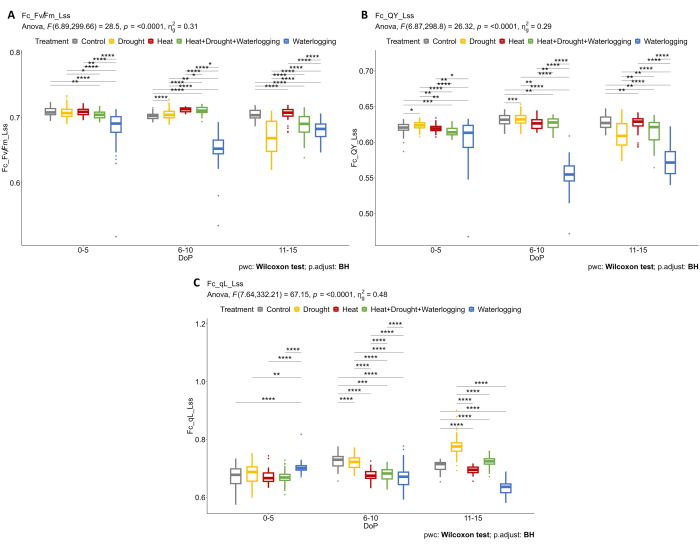
Рисунок 5: Флуоресцентная визуализация хлорофилла на растениях, адаптированных к свету. (A) Максимальная эффективность фотохимии PSII адаптированного к свету образца в стационарном состоянии света (Fv/Fm_Lss). (B) Квантовый выход фотосистемы II или эффективность работы фотосистемы II в стационарном световом состоянии (QY_Lss). (C) Фракция открытых реакционных центров в PSII в легком установившемся состоянии (окисленный QA) (qL_Lss). Данные представляют собой средние значения ± стандартного отклонения (n = 10). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
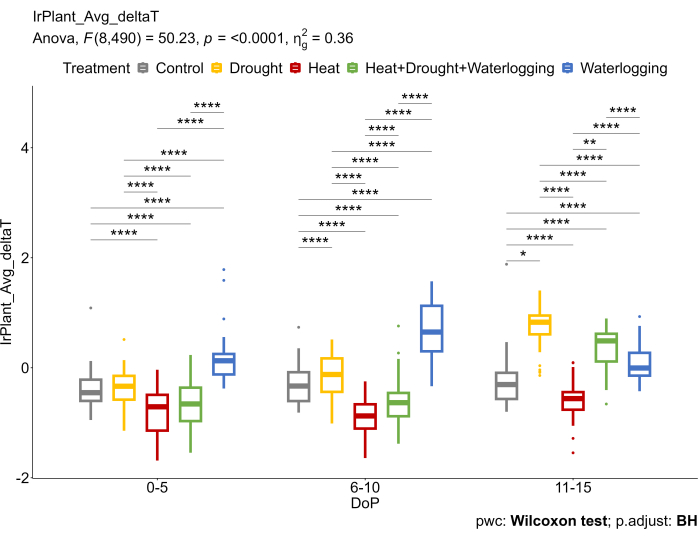
Рисунок 6: Тепловизионное ИК-изображение использовалось для расчета разницы между средней температурой растительного покрова, полученной из тепловых ИК-изображений, и температурой воздуха (ΔT). Данные представляют собой средние значения ± стандартного отклонения (n = 10). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
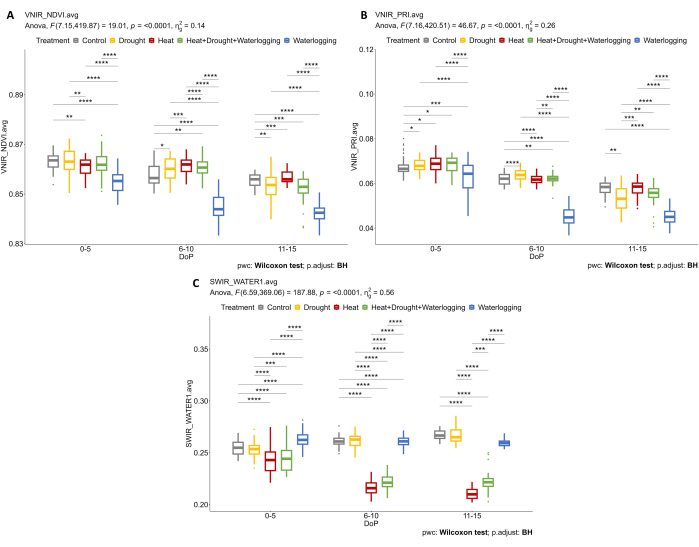
Рисунок 7: Гиперспектральная визуализация для определения вегетационных индексов и содержания воды. (A) Нормализованный разностный вегетационный индекс (NDVI). (B) Индекс фотохимического отражения (PRI), рассчитанный по данным VNIR. (C) Водный индекс, рассчитанный на основе изображений SWIR. Данные представляют собой средние значения ± стандартного отклонения (n = 10). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
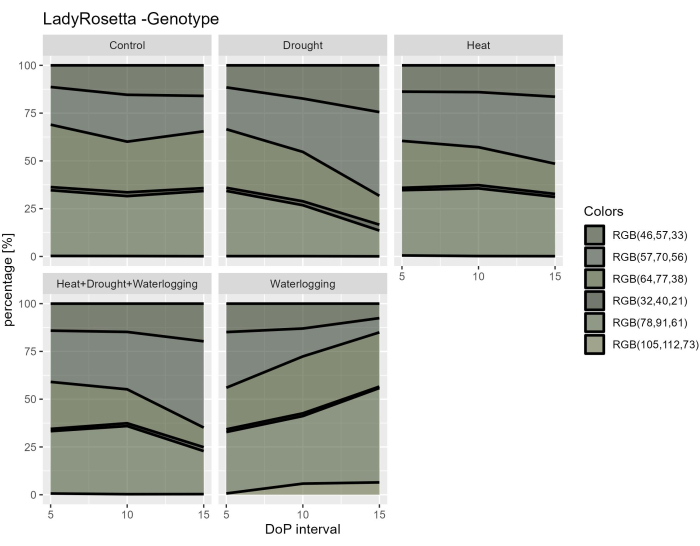
Рисунок 8: Индекс озеленения для растений при различных обработках. Обработка изображения основана на преобразовании исходного изображения RGB в цветовую карту, состоящую из 6 определенных оттенков. Данные представляют собой средние значения ± стандартного отклонения (n = 10). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительный рисунок 1: Интенсивность света, измеренная в дни фенотипирования (DOP). Продолжительность измерений с 9:00 до 12:35. LI_Buff относится к медианным данным с 5 датчиков освещенности, распределенных в теплице. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 2: Относительная влажность (RH), измеренная в дни фенотипирования (DOP). Продолжительность измерений с 9:00 до 12:35. RH_Buff относится к медианным данным с 5 датчиков влажности, распределенных в теплице. RH2 относится к относительной влажности в адаптационной камере. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 3: Температура, измеренная в дни фенотипирования (DOP). Продолжительность измерений с 9:00 до 12:35. T_Buff относится к медианным данным с 5 датчиков температуры, распределенных в теплице. T2 относится к температуре в адаптационной камере. Т3 относится к температуре нагревательной стены. T4 относится к температуре в блоке тепловизионного инфракрасного изображения. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 4: Скриншот из программного обеспечения анализатора данных, показывающий параметры, скорректированные для анализа масок растений в датчиках флуоресцентной визуализации хлорофилла. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 5: Скриншот из программного обеспечения Data Analyzer, показывающий параметры, скорректированные для анализа маски завода в тепловизионных инфракрасных датчиках. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 6: Скриншот из программного обеспечения анализатора данных, показывающий параметры, скорректированные для анализа по маске предприятия в 1-боковых датчиках изображения RGB. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 7: Скриншот из программного обеспечения для анализа данных, показывающий параметры, скорректированные для анализа по маске предприятия в датчиках изображения RGB2-top view. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 8: Скриншот из программного обеспечения Data Analyzer, показывающий параметры, скорректированные для анализа масок предприятия в датчиках визуализации VNIR. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 9: Скриншот из программного обеспечения Data Analyzer, показывающий параметры, скорректированные для анализа масок растений в датчиках изображения SWIR. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Discussion
Усовершенствованные усовершенствованные инструменты визуализации с высоким разрешением и методы компьютерного зрения позволили быстро развить фенотипирование растений для получения количественных данных из массивных изображений растений воспроизводимым образом. Это исследование было направлено на адаптацию и оптимизацию высокопроизводительной методологии на основе изображений с использованием ряда доступных в настоящее время датчиков визуализации для мониторинга динамических реакций растений на одиночные и комбинированные абиотические стрессы. Некоторые критически важные шаги применяемого подхода требуют корректировки, включая применение напряжения и выбор подходящего протокола визуализации для измерений. Использование нескольких датчиков для получения изображений позволяет количественно оценить ключевые фенотипические признаки (такие как рост растений, эффективность фотосинтеза, устьичная регуляция, отражательная способность листьев и т. д.). Кроме того, улучшается понимание того, как растения картофеля реагируют на различные абиотические стрессы. Это является ключевой предпосылкой для ускорения селекционных проектов по выведению климатически устойчивых генотипов40. Морфологические реакции на индуцированное напряжение зависят от стадии развития. Например, индуцирование стресса на стадии инициации столона или клубней подавляет развитие листьев и растений и ограничивает количество столонов, тем самым снижая конечный урожай41. Однако в неблагоприятных условиях растения используют стрессовые реакции в качестве адаптивной реакции для предотвращения и восстановления стресс-индуцированныхповреждений клеток. Растения обладают адаптационными механизмами для избегания и переноса стрессовых состояний в зависимости от степени тяжести43.
Для понимания механизмов работы растений одним из важнейших шагов считается индуцирование соответствующей продолжительности и интенсивности стресса и определение реакции растений на стресс с помощью датчиков визуализации. Когда несколько напряжений совпадают, интенсивность одного напряжения может перекрывать действие других в зависимости от сочетания, интенсивности и продолжительности напряжений. Таким образом, эффекты стресса могут суммироваться, или противоположные реакции могут (частично) нейтрализовать друг друга, что в конечном итоге приводит к положительным или отрицательным последствиям для растений. Протокол, выбранный в этом исследовании, был основан на предыдущем опыте, чтобы обеспечить применение достаточных уровней стресса. Например, применение стресса от засухи было скорректировано до умеренного уровня, так как в предыдущем эксперименте реакция не отличалась от контрольной обработки на ранней стадии стресса на основе флуоресцентной визуализации хлорофилла. Это связано с возникновением фотодыхания, которое выступает в качестве альтернативного стока электронов в тилакоидной мембране и защитного механизма для фотосистемы II44,45. При комбинированной реакции на стресс воздействие на растения умеренного первичного стрессора может повысить толерантность к следующему стрессору, что может оказать положительное или отрицательное воздействие46. В этом исследовании наблюдалась более сильная реакция при комбинированном стрессе по сравнению с индивидуальным стрессом от засухи. Исследуя другие физиологические реакции, результаты показали увеличение ΔT (дельтаТ) в условиях засухи, поскольку устьица приближаются, чтобы избежать избыточной потери воды. Напротив, обратная реакция наблюдалась при тепловом стрессе, где ΔT был ниже по сравнению с контролем, отражающим раскрытие устьиц для улучшения охлаждения листьев в соответствии с результатами, полученными на пшенице в условиях комбинированного теплового и засушливого стресса20. Во время заболачивания увеличение ΔT из-за смыкания устьиц происходило в результате недостатка кислорода в почве и нарушения гомеостаза корневых вод, что приводило к снижению транспирационного потока с увеличением АБК, ключевого гормона в реакциях на водный стресс47.
В исследованиях стресса растений продолжительность стресса и последующих восстановительных процедур прямо пропорциональна интенсивности стресса. Например, умеренный стресс от засухи, такой как поддержание влажности почвы на уровне 20% емкости поля (FC), вызывает обратимые фенотипические изменения, которые обычно восстанавливаются после одного дня повторного полива. Напротив, тяжелые стрессовые условия, такие как заболачивание, приводят к обширным фенотипическим повреждениям, требующим более длительного периода восстановления. Несмотря на то, что нормализация продолжительности лечения является идеальным вариантом, присущая ей изменчивость интенсивности напряжений должна быть учтена при планировании эксперимента.
Вторым важным шагом является выбор подходящего протокола и оптимизация настроек для каждого датчика. Флуоресценция хлорофилла является мощным инструментом в определении производительности фотосинтетического аппарата под нагрузкой48. Различные протоколы измерения флуоресценции хлорофилла могут быть выбраны как для светлых, так и для темных растений в зависимости от исследовательского вопросаи плана эксперимента. В данном исследовании выбранный протокол (короткий световой отклик) позволяет определить различные признаки, включая Fv'/Fm', φPSII и qL, которые указывают на производительность фотосинтеза в различных условиях50. Предыдущие исследования показали, что используемый протокол при высокопроизводительном фенотипировании эффективен при исследовании эффективности фотосинтеза растений при различных применениях стрессовых обработок и различении здоровых и стрессовых растений14,20. Исходя из плана эксперимента, очень важно учитывать продолжительность выбранного протокола при измерении в системе с высокой пропускной способностью и высокой численностью завода. Таким образом, измерение флуоресценции хлорофилла на растениях, адаптированных к свету, с использованием кратковременного протокола было выбрано для различения реакций при различных обработках. Взаимодействие генотипа и окружающей среды может влиять на многие фенотипические признаки, что имеет решающее значение при измерении12. Важно учитывать, что продолжительность измерения должна быть завершена за короткое время, чтобы свести к минимуму суточное влияние на ограничения фотосинтеза.
Тепловизионная инфракрасная визуализация использовалась для определения температуры купола и понимания регуляции устья при различных обработках52. Стоит упомянуть, что технологическая оптимизация использовалась там, где нагревательная стена располагалась с противоположной стороны камеры, а температура стены динамически контролировалась и программировалась. Таким образом, настройка фона обогреваемой стены с помощью встроенных датчиков окружающей среды необходима для правильного выбора растений из фона за счет увеличения контраста фоновой температуры над температурой изображаемого объекта.
Несмотря на то, что анализ изображений автоматизирован, для получения надлежащей двоичной маски в RGB-образии для точного выбора растений53 по-прежнему требуется корректировка пороговых индексов RGB. Кроме того, выбор нескольких ракурсов важен для правильной оценки количественных параметров, включая цифровую биомассу и темпы роста. В этом исследовании были выбраны и усреднены три угла (0°, 120° и 240°) на боковом виде RGB для точного расчета объема растения и относительной скорости роста.
В зависимости от спектрального диапазона многие физиологические особенности могут быть исследованы с помощью гиперспектральной визуализации54. Необходимо определить, какой из индексов отражательной способности дает необходимую информацию и показывает реакцию растений в различных условиях14. Он весьма востребован при скрининге толерантных сортов и фенотипировании растений для определения корреляции между гиперспектральными индексами и другими физиологическими признаками55. В этом исследовании растения, подвергшиеся обработке от переувлажнения, показали выраженную реакцию на содержание хлорофилла и эффективность фотосинтеза по данным визуализации VNIR. Кроме того, наблюдались различные реакции в индексе воды, рассчитанном по данным SWIR, при термической обработке и переувлажнении из-за разной регуляции устьиц и содержания воды в листьях.
Таким образом, эти результаты подчеркивают полезность такого подхода после оптимизации настроек и потенциал использования нескольких датчиков для поиска стрессовых характеристик, имеющих отношение к климатической устойчивости. Оценка динамики реакций с использованием нескольких датчиков изображения может быть использована в качестве одного из мощных инструментов для улучшения программ разведения.
Disclosures
Авторы заявляют, что у них нет известных конкурирующих финансовых интересов или личных отношений, которые могли бы повлиять на работу, описанную в этой статье.
Acknowledgements
Этот проект ADAPT (Ускоренное развитие мультистрессоустойчивого картофеля) получил финансирование от программы исследований и инноваций Европейского Союза Horizon 2020 в рамках грантового соглашения No GA 2020 862-858. Эта работа была частично поддержана Министерством образования, молодежи и спорта Чешской Республики в рамках проекта Европейского фонда регионального развития "SINGING PLANT" (no. CZ.02.1.01/0.0/0.0/16_026/0008446). Компания CEITEC MU получила признание за поддержку объектов по выращиванию. Мы выражаем признательность компании Meijer BV за предоставление черенков in vitro, использованных в этом исследовании. Мы благодарим Ленку Сочуркову за помощь в графическом дизайне рисунка 2 и Павлу Хомолову за помощь в подготовке растительного материала во время экспериментов в исследовательском центре Photon Systems Instruments (PSI) (Драшов, Чехия).
Materials
| Name | Company | Catalog Number | Comments |
| 1.1” CMOS Sensor with RGB camera | PSI, Drásov, Czech Republic | https://psi.cz/ | The sensor delivers a resolution of 4112 × 4168 pixels for side view and 2560 × 1920 pixels for top view. The sensor is extremely sensitive and is a real megapixel CCD replacement and produces sharp, low-noise images |
| FluorCam | PSI, Drásov, Czech Republic | FC1300/8080-15 | Pulse amplitude modulated (PAM) chlorophyll fluorometer |
| Fluorcam 10 software | PSI, Drásov, Czech Republic | Version 1.0.0.18106 | For Chlorophyll fluorescence images visualization and analysis |
| GigE PSI RGB – 12.36 Megapixels Camera | PSI, Drásov, Czech Republic | https://psi.cz/ | For the side view projections, line scan mode was used with a resolution of 4112 px/line, 200 lines per second. The imaged area from the side view was 1205 × 1005 mm (height × width), while the imaged area from the top view position was 800 × 800 mm. |
| Hyperspectral Analyzer software | PSI, Drásov, Czech Republic | Version 1.0.0.14 | For hyperspectral images visualization and analysis |
| Hyperspectral camera HC-900 Series | PSI, Drásov, Czech Republic | https://hyperspec.org/products/ | Visible-near-infrared (VNIR) camera 380-900 nm with a spectral resolution of 0.8 nm FWHM |
| Hyperspectral camera SWIR1700 | PSI, Drásov, Czech Republic | https://hyperspec.org/products/ | Short-wavelength infrared camera (SWIR) camera 900 - 1700 nm with a spectral resolution of 2 nm FWHM |
| InfraTec thermal camera (VarioCam HEAD 820(800)) | Flir, United States | https://www.infratec.eu/thermography/infrared-camera/variocam-hd-head-800/ | Resolution of 1024 × 768 pixels, thermal sensitivity of < 20 mK and thermal emissivity value set default to 0.95. with a scanning speed of 30 Hz and each line consisting of 768 pixels. The imaged area was 1205 × 1005 mm (height × width). |
| LED panel | PSI, Drásov, Czech Republic | https://led-growing-lights.com/products/ | Equipped with 4 × 240 red-orange (618 nm), 120 cool-white LEDs (6500 K) and 240 far-red LEDs (735 nm) distributed equally over an imaging area of 80 × 80 cm |
| Light, temperature and relative humidity sensors | PSI, Drásov, Czech Republic | https://psi.cz/ | Sensors used to monitor controlled conditions in greenhouse |
| MEGASTOP Blue mats | Friedola | 75831 | To cover soil surface |
| Morphoanalyzer software | PSI, Drásov, Czech Republic | Version 1.0.9.8 | For RGB images visualization and analysis and color segmentation analysis |
| PlantScreen Data Analyzer software (Version 3.3.17.0) | PSI, Drásov, Czech Republic | https://plantphenotyping.com/products/plantscreen-modular-system/ | To visualize and analyze the data from all imaging sensors, watering-weighing unit and environmental conditions in greenhouse |
| PlantScreen Modular system | PSI, Drásov, Czech Republic | https://plantphenotyping.com/products/plantscreen-modular-system/ | Type of phenotyping platform |
| Plantscreen Scheduler software | PSI, Drásov, Czech Republic | Version 2.6.8368.25987 | To plan the experiment and set the measuring protocol |
| SpectraPen MINI | PSI, Drásov, Czech Republic | https://handheld.psi.cz/products/spectrapen-mini/#details | Light meter to adjust light level on a canopy level |
| TOMI-2 high-resolution camera | PSI, Drásov, Czech Republic | https://fluorcams.psi.cz/products/handy-fluorcam/ | Resolution of 1360 × 1024 pixels, frame rate 20 fps and 16-bit depth) with a 7-position filter wheel is mounted on a robotic arm positioned in the middle of the multi-color LED light panel with dimensions of 1326 x 1586 mm. |
| Walk-in FytoScope growth chamber | PSI, Drásov, Czech Republic | https://growth-chambers.com/products/walk-in-fytoscope-fs-wi/ | Type of chambers used to grow the plant |
References
- Climate Change 2021: The Physical Science Basis. IPCC Available from: https://www.ipcc.ch/report/ar6/wg1/ (2021)
- Ray, D. K., Gerber, J. S., Macdonald, G. K., West, P. C. Climate variation explains a third of global crop yield variability. Nat Commun. 6, 5989 (2015).
- Acevedo, M., et al. A scoping review of adoption of climate-resilient crops by small-scale producers in low- and middle-income countries. Nat Plants. 6 (10), 1231-1241 (2020).
- van Dijk, M., Morley, T., Rau, M. L., Saghai, Y. A meta-analysis of projected global food demand and population at risk of hunger for the period 2010-2050. Nat Food. 2 (7), 494-501 (2021).
- Handayani, T., Gilani, S. A., Watanabe, K. N. Climatic changes and potatoes: How can we cope with the abiotic stresses. Breed Sci. 69 (4), 545-563 (2019).
- Devaux, A., Goffart, J. P., Kromann, P., Andrade-Piedra, J., Polar, V., Hareau, G. The potato of the future: Opportunities and challenges in sustainable agri-food systems. Potato Res. 64 (4), 681-720 (2021).
- Dahal, K., Li, X. Q., Tai, H., Creelman, A., Bizimungu, B. Improving potato stress tolerance and tuber yield under a climate change scenario - a current overview. Front Plant Sci. 10, 563 (2019).
- Ahmad, U., Sharma, L. A review of best management practices for potato crop using precision agricultural technologies. Smart Agricultural Technology. 4, 100220 (2023).
- Cabello, R., Monneveux, P., De Mendiburu, F., Bonierbale, M. Comparison of yield based drought tolerance indices in improved varieties, genetic stocks and landraces of potato (Solanum tuberosum L). Euphytica. 193 (2), 147-156 (2013).
- von Gehren, P., et al. Farmers feel the climate change: Variety choice as an adaptation strategy of European potato farmers. Climate. 11 (9), 189 (2023).
- Fiorani, F., Schurr, U. Future scenarios for plant phenotyping. Annu Rev Plant Biol. 64, 267-291 (2013).
- Poorter, H., et al. Pitfalls and potential of high-throughput plant phenotyping platforms. Front Plant Sci. 14, 1233794 (2023).
- Berger, B., de Regt, B., Tester, M. High-throughput phenotyping of plant shoots. Methods Mol Biol. 918, 9-20 (2012).
- Humplík, J. F., Lazár, D., Husičková, A., Spíchal, L. Automated phenotyping of plant shoots using imaging methods for analysis of plant stress responses - a review. Plant Methods. 11, 29 (2015).
- Danilevicz, M. F., Bayer, P. E., Nestor, B. J., Bennamoun, M., Edwards, D. Resources for image-based high-throughput phenotyping in crops and data sharing challenges. Plant Physiol. 187 (2), 699-715 (2021).
- Abebe, A. M., Kim, Y., Kim, J., Kim, S. L., Baek, J. Image-based high-throughput phenotyping in horticultural crops. Plants. 12 (10), 2061 (2023).
- Lazarević, B., Carović-Stanko, K., Safner, T., Poljak, M. Study of high-temperature-induced morphological and physiological changes in potato using nondestructive plant phenotyping. Plants. 11 (24), 3534 (2022).
- Marchetti, C. F., et al. A novel image-based screening method to study water-deficit response and recovery of barley populations using canopy dynamics phenotyping and simple metabolite profiling. Front Plant Sci. 10, 1252 (2019).
- Kim, S. L., et al. High-throughput phenotyping platform for analyzing drought tolerance in rice. Planta. 252 (3), 38 (2020).
- Abdelhakim, L. O. A., Rosenqvist, E., Wollenweber, B., Spyroglou, I., Ottosen, C. O., Panzarová, K. Investigating combined drought- and heat stress effects in wheat under controlled conditions by dynamic image-based phenotyping. Agronomy. 11 (2), 364 (2021).
- Zandalinas, S. I., Sengupta, S., Fritschi, F. B., Azad, R. K., Nechushtai, R., Mittler, R. The impact of multifactorial stress combination on plant growth and survival. New Phytologist. 230 (3), 1034-1048 (2021).
- Raza, A., et al. Impact of climate change on crops adaptation and strategies to tackle its outcome: A review. Plants. 8 (2), 34 (2019).
- Nasir, M. W., Toth, Z. Effect of drought stress on potato production: A review. Agronomy. 12 (3), 635 (2022).
- Wagg, C., Hann, S., Kupriyanovich, Y., Li, S. Timing of short period water stress determines potato plant growth, yield and tuber quality. Agric Water Manag. 247, 106731 (2021).
- Yamauchi, T., Colmer, T. D., Pedersen, O., Nakazono, M. Regulation of root traits for internal aeration and tolerance to soil waterlogging-flooding stress. Plant Physiol. 176 (2), 1118-1130 (2018).
- Aien, A., Chaturvedi, A. K., Bahuguna, R. N., Pal, M. Phenological sensitivity to high temperature stress determines dry matter partitioning and yield in potato. Indian J Plant Physiol. 22 (1), 63-69 (2017).
- Zandalinas, S. I., Mittler, R., Balfagón, D., Arbona, V., Gómez-Cadenas, A. Plant adaptations to the combination of drought and high temperatures. Physiol Plant. 162 (1), 2-12 (2018).
- Suzuki, N., Rivero, R. M., Shulaev, V., Blumwald, E., Mittler, R. Abiotic and biotic stress combinations. New Phytologist. 203 (1), 32-43 (2014).
- Atkinson, N. J., Jain, R., Urwin, P. E. The Response of Plants to Simultaneous Biotic and Abiotic Stress. Combined Stresses in Plants. , (2015).
- Harris, P. M., Harris, P. M. . The Potato Crop. 2nd ed. , (1992).
- Weisz, R., Kaminski, J., Smilowitz, Z. Water deficit effects on potato leaf growth and transpiration: Utilizing fraction extractable soil water for comparison with other crops. Am Potato J. 71 (12), 829-840 (1994).
- Wang, X., Vignjevic, M., Jiang, D., Jacobsen, S., Wollenweber, B. Improved tolerance to drought stress after anthesis due to priming before anthesis in wheat (Triticum aestivum L.) var. Vinjett. J Exp Bot. 65 (22), 6441-6456 (2014).
- Junker, A., et al. Optimizing experimental procedures for quantitative evaluation of crop plant performance in high throughput phenotyping systems. Front Plant Sci. 5, 770 (2015).
- Smith, S. M., et al. Diurnal changes in the transcriptome encoding enzymes of starch metabolism provide evidence for both transcriptional and posttranscriptional regulation of starch metabolism in arabidopsis leaves. Plant Physiol. 136 (1), 2687-2699 (2004).
- Findurová, H., Veselá, B., Panzarová, K., Pytela, J., Trtílek, M., Klem, K. Phenotyping drought tolerance and yield performance of barley using a combination of imaging methods. Environ Exp Bot. 209, 105314 (2023).
- Klukas, C., Chen, D., Pape, J. M. Integrated analysis platform: an open-source information system for high-throughput plant phenotyping. Plant Physiol. 165 (2), 506-518 (2014).
- Paul, K., et al. Understanding the biostimulant action of vegetal-derived protein hydrolysates by high-throughput plant phenotyping and metabolomics: A case study on tomato. Front Plant Sci. 10, 47 (2019).
- Awlia, M., et al. High-throughput non-destructive phenotyping of traits that contribute to salinity tolerance in Arabidopsis thaliana. Front Plant Sci. 7, 1414 (2016).
- Li, Z., Guo, R., Li, M., Chen, Y., Li, G. A review of computer vision technologies for plant phenotyping. Comput Electron Agric. 176, 105672 (2020).
- Li, L., Zhang, Q., Huang, D. A review of imaging techniques for plant phenotyping. Sensors (Switzerland). 14 (11), 20078-20111 (2014).
- Obidiegwu, J. E., Bryan, G. J., Jones, H. G., Prashar, A. Coping with drought: Stress and adaptive responses in potato and perspectives for improvement. Front Plant Sci. 6, 542 (2015).
- Zhang, H., Zhao, Y., Zhu, J. K. Thriving under stress: How plants balance growth and the stress response. Dev Cell. 55 (5), 529-543 (2020).
- Bandurska, H. Drought stress responses: Coping strategy and resistance. Plants. 11 (7), 922 (2022).
- Wingler, A., Lea, P. J., Quick, W. P., Leegood, R. C. Photorespiration: metabolic pathways and their role in stress protection. Philos Trans R Soc Lond B Biol Sci. 355 (1402), 1517-1529 (2000).
- Baker, N. R., Rosenqvist, E. Applications of chlorophyll fluorescence can improve crop production strategies: an examination of future possibilities. J Exp Bot. 55 (403), 1607-1621 (2004).
- Georgieva, M., Vassileva, V. Stress management in plants: Examining Provisional and Unique Dose-Dependent Responses. Int J Mol Sci. 24 (6), 5105 (2023).
- Leeggangers, H. A. C. F., Rodriguez-Granados, N. Y., Macias-Honti, M. G., Sasidharan, R. A helping hand when drowning: The versatile role of ethylene in root flooding resilience. Environ Exp Bot. 213, 105422 (2023).
- Baker, N. R. Chlorophyll fluorescence: a probe of photosynthesis in vivo. Annu Rev Plant Biol. 59 (1), 89-113 (2008).
- Murchie, E. H., Lawson, T. Chlorophyll fluorescence analysis: a guide to good practice and understanding some new applications. J Exp Bot. 64 (13), 3983-3998 (2013).
- Maxwell, K., Johnson, G. N. Chlorophyll fluorescence-a practical guide. J Exp Bot. 51 (345), 659-668 (2000).
- Yokoyama, G., Ono, S., Yasutake, D., Hidaka, K., Hirota, T. Diurnal changes in the stomatal, mesophyll, and biochemical limitations of photosynthesis in well-watered greenhouse-grown strawberries. Photosynthetica. 61 (1), 1-12 (2023).
- Jones, H. G. Application of thermal imaging and infrared sensing in plant physiology and ecophysiology. Advances in Botanical Research. 41, 107-163 (2004).
- Brainard, S. H., Bustamante, J. A., Dawson, J. C., Spalding, E. P., Goldman, I. L. A digital image-based phenotyping platform for analyzing root shape attributes in carrot. Front Plant Sci. 12, 690031 (2021).
- Huber, S., Tagesson, T., Fensholt, R. An automated field spectrometer system for studying VIS, NIR and SWIR anisotropy for semi-arid savanna. Remote Sens Environ. 152, 547-556 (2014).
- Mertens, S., et al. Proximal hyperspectral imaging detects diurnal and drought-induced changes in maize physiology. Front Plant Sci. 12, 640914 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved