Количественное определение Acanthamoeba spp. Подвижность
In This Article
Summary
В этой процедуре описывается, как визуализировать, отслеживать и количественно оценить Acanthamoeba spp. подвижность.
Abstract
Акантамебный кератит — это тяжелая глазная инфекция, которая затрудняет лечение и может привести к слепоте. Несмотря на его повсеместное распространение и потенциальное загрязнение контактных линз после воздействия воды, естественное поведение этого патогена остается неуловимым. Понимание двигательных паттернов Acanthamoeba может рассказать нам о том, как она колонизирует контактные линзы и загрязняет роговицу пациента. К счастью, Acanthamoeba spp. видны с помощью светлопольной микроскопии, начиная с 4-кратного увеличения. Предыдущие методы были разработаны для количественной оценки подвижности акантамёбы в отношении цитопатических эффектов или недостаточного воздействия электрического поля. В этой статье мы опишем метод отслеживания и количественного определения Acanthamoeba spp. Долгосрочная подвижность (от нескольких часов до нескольких дней), которая является протоколом, применимым к различным штаммам амебы, поверхностям и пищевому статусу амебы. Эта процедура имеет отношение к определению многих количественных показателей основной подвижности, таких как расстояние, скорость, локализация и направленность, которые необходимы для мониторинга различных стадий инфекции, пролиферации или изменения поведения.
Introduction
Исследования акантамебы резко возросли в последние годы из-за возросшей распространенности акантамёбного кератита (АК), который является паразитарной инфекцией после прикрепления акантамёбы к роговице1. В то время как вспышки АК могут быть связаны с неправильным уходом за контактными линзами или неэффективными решениями по уходу за контактными линзами 2,3,4,5, в настоящее время нет требований для демонстрации эффективности дезинфекции Acanthamoeba для любого продукта, представленного на рынке. Тем не менее, в научном сообществе и в организациях по стандартизации предпринимаются постоянные усилия по изучению протоколов, необходимых для количественной оценки эффективности дезинфекции продуктов по уходу за контактными линзами 6,7. Кроме того, из-за своего сходства в клеточных и функциональных аспектах с человеческими макрофагами, было отмечено, что Acanthamoeba играет значительную роль в размещении и распространении других человеческихпатогенов8, в дополнение к патогенности, которую приносит сама амеба.
Были описаны последние методы, которые позволили количественно оценить подвижность акантамебы, которая, как правило, не сильно подвержена броуновскому движению 9,10, в отношении цитопатических эффектов или недостаточного воздействия электрического поля 9,11, а также достижения в анализе подвижности в исследованиях гигантских вирусов с использованием акантамебы в качестве отслеживаемого вирусного вектора. 13. Кроме того, в течение последних 20 лет наблюдаются постоянные и значительные улучшения в отслеживании клеток и частиц с использованием новых программ, таких как используемое здесь программное обеспечение для визуализации, а также новые алгоритмы и технологии глубокого обучения. Тем не менее, это относительно новая и растущая область науки в отношении настольных исследований, клинического применения и промышленных стандартов, и было опубликовано мало данных о методах визуализации и отслеживания этой амебы, особенно для количественной оценки поведенческих изменений после приверженности контактным линзам или во время или после дезинфекции контактных линз. Другие области, расширяющиеся до долгосрочного визуального мониторинга, поддержали эти усилия 15,16,17. Из-за присущей акантамебе сложной природы, включая общую устойчивость к плазмидам (которые могут придавать флуоресценцию), способность амебы потреблять и разрушать стандартные клеточные красители, а также уникальный внешний белковый состав, затрудняющий мечение антителами, методы, доступные другим клеткам, которые делают их видимыми в условиях, отличных от визуализации в светлом поле, были непригодны для использования в этом организме. Таким образом, количественная оценка подвижности этой амебы продемонстрировала значительный вклад в эту область. Используя описанный здесь способ, мы смогли установить, что амеба остается подвижной в течение по меньшей мере 12 ч без питательных веществ18 и что амеба, которая подвергается процессу дезинфекции и теряет подвижность во время дезинфекции, может восстановить свою подвижность после дезинфекции, если она не полностью лизирована19.
В этом протоколе подробно описано, как визуально отслеживать и количественно измерять подвижность амебы под микроскопом. Основными шагами являются запись амебы в светлом поле с использованием соответствующего фокуса и времени между изображениями, преобразование изображений в двоичные с помощью программного обеспечения для обработки изображений, а затем использование плагина отслеживания программного обеспечения для обработки изображений для установки экспериментальных параметров и отслеживание каждой амебы для определения необходимых измерений, таких как скорость, расстояние и ограничение. После этого можно количественно оценить хемотаксис амебы или популяции амебы, чтобы определить направленность. Ключевым вкладом этого метода является визуализация и количественная оценка поведения амебы во время различных состояний питательной поддержки, прилипания к поверхности, дезинфекции или других изменений окружающей среды, таких как совместное проживание с культурой клеток млекопитающих.
Protocol
1. Приготовление акантамебы
ПРИМЕЧАНИЕ: Этот протокол был проверен на соответствие ATCC 50655, 30872, 50702, 30010, 30461, 50370, 50703, 30137, PRA-115 и PRA-411. Это патоген BSL2, и его следует работать в вытяжке и лаборатории BSL2.
- Создать мастер-культуру из пробирки с образцом или подготовленной пробки20 , наполнив колбу Т75 30 мл среды АС6 и асептически добавить в нее одну пробку или содержимое пробирки для пробы. Инкубируйте колбу в течение 3-5 дней при температуре 26-30 °C, пока колба не сгустится на 50-80%.
- Пассаж клеток за день до этого нужен для создания однородной популяции трофозоитов.
- В зависимости от потребностей штамма встряхните и/или быстро ударьте по мастер-культуре 2 раза, чтобы выбить прилипшие трофозоиты.
- Наполните колбу T75 30 мл среды AC6. Добавьте в пассаж 2 мл мастер-культуры. Инкубировать колбу в течение 18-24 ч при температуре 26-30 °C.
- Перед сбором урожая визуально осмотрите популяцию трофозоитов при 4-кратном увеличении в микроскоп. Убедитесь, что трофозоиты адгезивы и однородны.
- Энергично ударьте по колбе 2 раза, чтобы выбить прилипшие трофозоиты. Высыпьте содержимое в коническую пробирку объемом 50 мл.
- Вращайте пробирку при давлении 500 x g в течение 5 минут в сбалансированной центрифуге, чтобы гранулировать амебу. Слейте или слейте пипеткой надосадочную жидкость и выбросьте. Развести гранулу в 2-10 мл 1/4 раствора Рингера.
- Сделайте образец вихревым. Добавьте 10 мкл образца в одноразовый гемоцитометр и подсчитайте КОЕ/мл акантамебы.
- На основании подсчета гемоцитометра развести гранулу амебы до концентрации 7,5 х 103 клеток/мл в растворе Рингера.
- Посадите амебу на поверхности, которая может быть стеклянной, пластиковой или непитательной агаром, а также различных форм лунок в зависимости от экспериментальных потребностей, как описано ниже.
- Планшет на 96 лунок: Засейте каждую лунку 200 μл суспензии Acanthamoeba и закройте планшет крышкой.
- 48-луночный планшет: Засейте каждую лунку 1 мл суспензии Acanthamoeba и закройте планшет крышкой.
- Проточная ячейка: Медленно добавьте 4 мл суспензии акантамебы через стерильные порты стерильной алюминиевой проточной ячейки, избегая образования пузырьков в камере. Зажмите закрытые отверстия после добавления подвески.
- Перед визуализацией дайте амебе не менее 30 минут, чтобы она прилипла к поверхности, прежде чем начать микроскопическую запись.
2. Визуализация и запись Acanthamoeba
- Визуализируйте амебу при 4-кратном увеличении в светлом поле. Фон должен казаться светло-серым, а амеба – черной. Отрегулируйте свет и сфокусируйтесь так, чтобы амеба представляла собой сплошные темные круги, а не полупрозрачные (так, немного не в фокусе, рис. 1.).
ПРИМЕЧАНИЕ: Оптимальное увеличение составляет 4x для слежения по нескольким причинам: амебы, которые покидают или входят в поле зрения во время слежения, не должны включаться в анализ данных, поэтому меньшее увеличение лучше всего поддерживает максимальное количество амеб, включенных в анализ за определенный период времени. Амебы должны отображаться в виде сплошных черных кругов в светлом поле, чтобы преобразовать их в двоичные для анализа слежения. Этого легче всего добиться при меньшем увеличении, так как при более высоком увеличении легко раскрывается полупрозрачная природа и внутренние структуры амебы. В целом, больше амеб может быть запечатлено в одном поле зрения при меньшем увеличении, что способствует более надежному анализу данных. - Настройте программы записи в программном обеспечении для обработки изображений на запись изображения через равные промежутки времени для отслеживания амебы. Максимальное время между изображениями, которое позволит обеспечить точное отслеживание, составляет 30 с, оптимальное время для размера файла и деталей отслеживания рекомендуется составлять 12 с или 24 с.
- Амеб можно отслеживать в течение нескольких дней подряд, но помните о размере файла, который будет создана при такой записи, и о сложности, присущей работе с очень большими файлами. Чтобы этого избежать, записывайте амебы для отрезков времени через определенные промежутки времени. Например, запись на 1 час каждые 12 часов в течение 5 дней.
- Если микроскоп и программа позволяют, запишите несколько лунок за один сеанс, используя координаты XY пластинчатых лунок или нескольких мест проточной ячейки. При необходимости сшейте несколько секций одной лунки или проточной ячейки, чтобы создать большее поле зрения при 4-кратном увеличении.
ПРИМЕЧАНИЕ: Единственным ограничением на количество мест, которые могут быть зарегистрированы, является то, насколько быстро предметный столик микроскопа может перемещаться между местами в пределах интервала времени изображения (например, съемка изображения каждые 12 с, 24 с и т. д.). Однако это не обязательно, и отслеживание видео, сделанных из одного места, все равно может иметь достаточное количество дорожек для надежного статистического анализа. В этом исследовании использовался микроскоп Nikon Eclipse Ti-U, а автоматизированный подвижный столик использовался для одновременной записи изображений в нескольких скважинах. Тем не менее, подойдет любой микроскоп с возможностью программируемой записи. Микроскоп должен подключаться к компьютеру и иметь возможность записывать изображения на программу или жесткий диск.
3. Анализ размеров амеб
- Откройте файл микроскопа в программном обеспечении для обработки изображений. Откроются опции импорта биоформатов. В диалоговом окне убедитесь, что выполняются следующие условия: Просмотр стека; Просмотр с помощью: Selection-Hyperstack; Управление памятью: отметьте галочкой Использовать виртуальный стек; Цветовой режим: По умолчанию.
- Убедитесь, что ни одно из других выпадающих меню или флажков не активировано. Нажмите «ОК».
- Откройте варианты био-форматов сериалов. Выберите, какая серия необходима. Если одновременно записывается только одно местоположение, то, скорее всего, здесь будет только один вариант. Нажмите «ОК».
- Выберите Изображение > Дублировать, чтобы дублировать одну лунку, с которой ведется работа в данный момент, выбрав только один канал C и только один канал Z.
- С этого момента для манипуляций и анализа можно работать только с дублированным изображением, а не с оригиналом. Выберите тип изображения > > 8-битный. Выберите «Процесс» > «Вычесть фон».
- Установите катящийся шар на 10,0. Проверьте светлый фон. Проверьте скользящий параболоид.
- Выберите «Процесс» > «Усилить контрастность». Установите насыщенные пиксели на 0,1% для трофозоитов или 0,3% для группы ячеек и агрегатов.
- Выберите Изображение > Настроить >пороговое значение (по умолчанию > черно-белый). Откроется процесс Make Binary. Выберите По умолчанию и отметьте Черный фон (из Бинарных масок).
- Выберите порог агрессивно так, чтобы большинство фоновых пятен не было видно, но была видна некоторая часть каждой амебы.
- Если программное обеспечение для обработки изображений инвертировало изображение и фон белый, а амеба черная, перейдите в меню «Редактировать > инвертировать », чтобы зафиксировать черный фон и белую амебу.
- Выберите Процесс> Бинарный > Закрыть, если клетки имеют небольшое пространство во внешней мембране из-за расфокусировки или подвижности клетки.
- Выберите «Обработать» > «Двоичный файл» > «Заполнить пробелы». Удалите артефакты, не относящиеся к амебе, с помощью инструментов рисования фигур и Edit > Fill. Если к этому моменту фон белый, а амеба черная, выберите «Редактировать» > «Инвертировать». На этом этапе изображение должно представлять двоичные изображения, показанные на рисунке 2.
- Чтобы записать размер каждой амебы, выберите «Анализ» > «Анализ частиц». Размер набора: 10-Infinitiy, Круговость: 0-1, Показать: ничего. Отметьте галочкой только отображение результатов и подведение итогов.
- Сохраните появившиеся CSV-файлы. Выберите «Файл» > «Сохранить как > Tiff » и отредактируйте имя до нужной спецификации.
4. Подготовка файлов микроскопа к отслеживанию (анализ подвижности)
- Откройте файл микроскопа в программном обеспечении для обработки изображений. Откроются опции импорта биоформатов.
- В диалоговом окне убедитесь, что выполняются следующие условия: Просмотр стека; Просмотр с помощью: Selection-Hyperstack. Для управления памятью установите флажок Use Virtual Stack. Нажмите «ОК».
- Откроются опции серий биоформатов. Выберите, какая серия необходима. Если одновременно записывается только одно местоположение, то, скорее всего, здесь будет только один вариант. Нажмите «ОК».
- Выберите изображение > Дублировать. С этого момента вы будете работать только над дублированным участком видео, а не над исходным файлом.
ПРИМЕЧАНИЕ: Дублируйте часть отслеживаемого видео в это время. Для этого нужно знать кадры, которые соответствуют минутам, необходимым для проведения эксперимента. Например, если кто-то хочет отслеживать1-й час и делает снимки каждые 24 с, то в1-й час должно быть 150 кадров. Следовательно,1-й час будет 1-150 кадрами,2-й час 151-300 и так далее. - Выберите тип изображения > > 8-битный. Выберите «Процесс» > «Вычесть фон». Установите катящийся шар на 10,0.
- Проверьте светлый фон. Проверьте скользящий параболоид. Выберите Процесс > Усилить контрастность (Hydrate) Усилить контраст (Enhancement Contrast), установите его на 0.1%.
- Отметьте Все срезы x# (например, Все 150 срезов). Снимите флажок Нормализовать. Выберите Изображение > Настроить >пороговое значение (по умолчанию > черно-белый).
- Откроется процесс Make Binary. Выберите По умолчанию. Проверьте черный фон (бинарных масок).
- Порог агрессивный, поэтому большинство фоновых пятен не видно, но некоторые участки амебы видны. На этом шаге, если фон белый, а амеба черная, выберите Редактировать > Инвертировать. Фон должен быть черным, а амеба – белой.
- Выберите «Процесс» > двоичный файл > «Закрыть». Выберите «Процесс» > двоичный файл > «Заполнить пробелы». Выберите «Файл» > «Сохранить как» > Tiff и отредактируйте имя до нужной спецификации. Теперь файл готов к отслеживанию.
5. Анализ моторики с помощью трекинга
- В программном обеспечении для работы с изображениями с файлом tiff, который необходим для отслеживания, перейдите в раздел Плагины > Отслеживание > Trackmate. Откроется версия Trackmate.
- Нажмите кнопку Далее. Выберите детектор LoG в выпадающем меню детектора. Установите расчетный диаметр большого двоичного объекта: 35,0 мкм, порог 1,0. Снимите флажки Использовать медианный фильтр и Делать субпиксельную локализацию.
- Нажмите кнопку Предварительный просмотр на первом, среднем и конечном срезах. Убедитесь, что все амебы запечатлены фиолетовым кругом и что в них не включены фоновые дефекты или артефакты.
- Нажмите кнопку Далее. Начнется обработка, и этот шаг может занять несколько минут. Полоса обнаружения в верхней части экрана покажет, какая часть процесса завершена.
- Выберите «Далее» при появлении запроса. При начальном пороговом значении снова нажмите кнопку Далее, ничего не выбирая. Выберите Hyperstack Displayer при выборе вида. Нажмите кнопку Далее.
- Установите фильтр на пятна и нажмите «Далее », ничего не выделяя. Выберите трекер; для этого выберите LAP Tracker (вместо Simple LAP Tracker). Нажмите кнопку Далее.
- При покадровом связывании установите максимальное расстояние на 40 мкм. На отрезке трека для закрытия зазора установите флажок Allow Gap Closing. Установите максимальное расстояние для этого на 100 мкм, а максимальный зазор между кадрами на 4. Не выбирайте ничего для Разбиения сегмента трека или Объединения сегментов трека.
- Нажмите кнопку Далее. Отслеживание может занять значительное время. Когда он будет завершен, в окне внизу должно быть написано: Отслеживание выполнено в x с. Нажмите кнопку Далее.
- Нажмите «Далее» еще раз, когда отслеживание будет завершено. Установите фильтры на треках: Выберите знак + в левом нижнем углу, чтобы добавить фильтр по количеству спотов в треках. Установите фильтр в положение Выше по крайней мере для 93% кадров (например, для 150 кадров потребуется минимум 140 пятен).
ПРИМЕЧАНИЕ: Некоторые версии этого программного обеспечения требуют выбора противоположного эквивалента, например, Ниже не менее 7%, что можно сделать, перетащив линию влево или вправо, чтобы достичь нужного числа. - Нажмите кнопку Далее. Появятся параметры отображения. Убедитесь, что дорожки в каждом кадре не деформированы или не имеют нечетных движений амебы, прежде чем сохранять XML-файл Trackmate или CSV-файл Tracks.
- Если трек необходимо удалить, нажмите на TrackScheme. TrackScheme покажет все треки и точки соприкосновения амебы на всех кадрах.
ПРИМЕЧАНИЕ: Возможными причинами для удаления следа являются то, что амеба появлялась/исчезала из поля зрения во время записи, след имеет неподходящую форму по сравнению с фактическим путем амебы, или по какой-то причине след или амеба является выбросом в данных в соответствии с экспериментальными параметрами и т.д. - Нажмите на амебу, чтобы выделить зеленое пятно на экране, и в Trackscheme пятно будет окружено зеленым квадратом. Это укажет, какой след или пятно необходимо удалить.
- Кликните правой кнопкой мыши по дорожке, которую нужно удалить, и выберите «Вся дорожка». Нажмите кнопку Delete .
- Просмотрев все треки, сохраните файл трека, нажав «Сохранить » в левом нижнем углу всплывающего окна программы для отслеживания. Сохраните XML-файл, указав имя видео. Нажмите «Возобновить », чтобы вернуться к всплывающему окну программы для отслеживания.
- Нажмите «Треки » и выберите «Треки » слева. Нажмите «Экспортировать в CSV» и сохраните файл CSV.
- Если таблица не распознает полученный CSV, выполните следующие действия.
- Откройте сохраненный файл CSV в Блокноте. Нажмите Control + A и Control + C , чтобы скопировать все содержимое.
- Откройте таблицу и нажмите Control + V , чтобы вставить ее в таблицу. Все данные будут находиться в одной ячейке.
- Выделив ячейки с данными, перейдите в раздел Данные > Текст в столбцы. Выберите С разделителями > Далее. Выберите запятую > Next > Finish. Сохраните этот файл как новый CSV.
- Отслеживающий CSV-файл будет иметь множество параметров, доступных для анализа (рисунок 3). Скопируйте и вставьте нужные параметры в новый файл CSV (рисунок 4) для анализа. Используемые здесь параметры описаны ниже.
- Общее пройденное расстояние: общее расстояние, пройденное амебой, в мкм.
- Максимальное пройденное расстояние: максимальное расстояние на пути амебы от ее начальной точки - это не обязательно может быть конечная точка
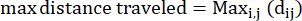
Где dij — расстояние до любой точки i до любой точки j на трассе. - Коэффициент удержания: Коэффициент удержания показывает, насколько эффективно амеба удалялась от своей начальной точки: двигалась ли она по прямой линии от своей начальной точки (значение, близкое к 1), или она оставалась относительно близко к своей начальной точке (значение, близкое к 0).
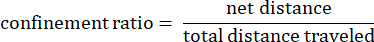
- Track mean speed: средняя скорость амебы на общем пройденном расстоянии в микронах в секунду.
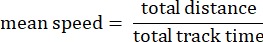
- Смещение гусеницы: расстояние между начальной точкой амебы и конечной точкой в микронах.
ПРИМЕЧАНИЕ: Все параметры анализа программного обеспечения для визуализации и их определения можно найти здесь: https://imagej.net/plugins/trackmate/analyzers/. Помните, что каждый сохраненный файл представляет собой сводку треков, проанализированных на тот момент. Для проведения надежного анализа данных необходимо соответствующим образом объединить результаты нескольких повторов, часов и т. д., в зависимости от пригодности данных (рис. 5 и рис. 6).
Representative Results
Чтобы добиться успеха с помощью этого метода, необходимо учитывать несколько важных общих моментов. Первый — это физическая настройка амебы и микроскопа, второй — правильное использование программного обеспечения для визуализации, а третий — экспорт и анализ данных визуализации осмысленным образом.
Прежде чем начать микроскопическую регистрацию, крайне важно убедиться, что амеба правильно сфокусирована на предметном столике микроскопа (Рисунок 1). Вместо того, чтобы сосредотачиваться на амебе в наиболее оптимальной плоскости Z для отдельных деталей, здесь идеально рассматривать их немного не в фокусе, чтобы они превратились в сплошные черные точки, а не в полупрозрачное состояние при детальном рассмотрении. Просмотр их таким образом позволит программному обеспечению обработки изображений и отслеживанию гораздо легче находить каждую отдельную амебу при преобразовании файла в двоичный файл (рис. 2). Знание цели в программном обеспечении для обработки изображений, т.е. чтобы каждая амеба отображалась в виде четко очерченного белого круга, может помочь читателю найти правильный фокус при съемке исходных изображений в светлом поле. Затем, когда каждый круг будет четко определен, программное обеспечение для отслеживания сможет правильно отслеживать подвижность и собирать индивидуальные показатели подвижности для каждой амебы.
После выполнения пошаговых инструкций в перечисленном выше протоколе для программного обеспечения для обработки изображений и программного обеспечения для слежения, а также после обращения к соответствующему видео, чтобы помочь в важных первых шагах использования программного обеспечения для обработки изображений, пришло время экспортировать данные программного обеспечения для обработки изображений для количественной оценки и анализа данных. Исходные выходные данные программного обеспечения слежения будут аналогичны тому, что показано на рисунке 3. Здесь важно проверить, что количество мест в экспортируемых треках соответствует ожидаемому (например, если кто-то попросил 93% кадров присутствовать в каждом треке, а у другого было 100 кадров в видео, то каждый экспортированный трек должен иметь больше или равный 93 местам). Если пятна не соответствуют требованиям, то может потребоваться вернуться к этапам работы программного обеспечения для отслеживания, чтобы убедиться, что требуемые параметры были установлены правильно.
Из необработанного экспорта начните построение листа анализа данных (рис. 4). Важно помнить, что каждый след представляет собой единичную амебу внутри одной реплики. Следовательно, как видно на рисунках 4, 5 и 6, все дорожки для набора кадров или временной точки должны быть усреднены (рисунок 4), и этот процесс должен быть проделан для каждого набора кадров или временной точки во всей серии (т.е. если всего снято 3 часа видео и точки данных разделены по часам, затем будет три набора кадров в час для анализа на одну репликацию ( рисунок 5). Наконец, исходя из этой комбинации средних значений в каждом наборе кадров в каждой реплике, усредненные данные из каждой репликации должны быть объединены в одно пространство, чтобы можно было проанализировать данные по нескольким репликациям для определения истинного среднего значения и стандартного отклонения за определенный момент времени (рис. 6).
Средние значения из каждой репликации будут использоваться для анализа данных, а объединенное среднее и стандартное отклонение или стандартная ошибка из всех реплик будут использоваться для графического представления (как показано в примере на рисунке 7). При анализе данных, как мы сделали здесь, то есть при отслеживании нескольких выборок в течение нескольких временных точек, наиболее целесообразно анализировать их с помощью двухфакторного повторного измерения ANOVA с апостериорным тестом Тьюки. Это позволяет нам определить различия между образцами в каждый момент времени, а также определить различия внутри каждого образца с течением времени.

Рисунок 1: Амеба выглядит как непрозрачные темные формы в светлопольной микроскопии. Увеличено репрезентативное изображение амебы при 4-кратном увеличении, немного не в фокусе, чтобы выглядеть как сплошные темные круги. Масштабная линейка = 500 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
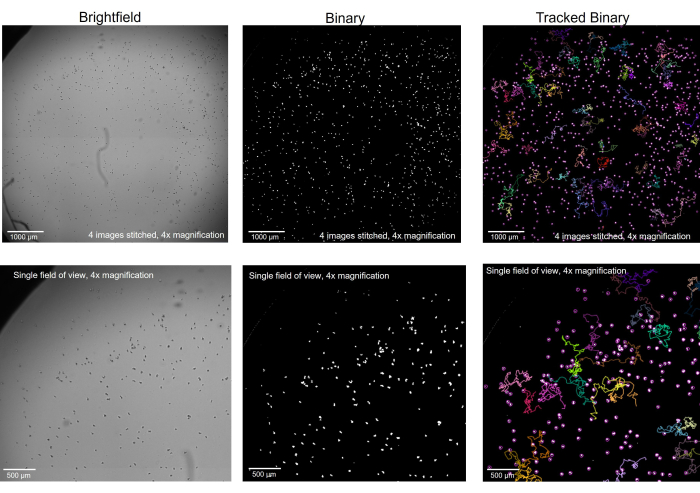
Рисунок 2: Амеба, полученная с помощью светлопольной микроскопии, преобразована в двоичную и отслеживается. Амеба при 4-кратном увеличении, в светлом поле (слева), была преобразована в двоичную систему с удаленными артефактами (в центре) и, после отслеживания, с отображением выбранных дорожек (справа). Верхний ряд: целая лунка изображена путем сшивания 4 изображений вместе, масштабная линейка = 1000 мкм. Нижний ряд: размер одного изображения до сшивки, масштабная линейка = 500 мкм . Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
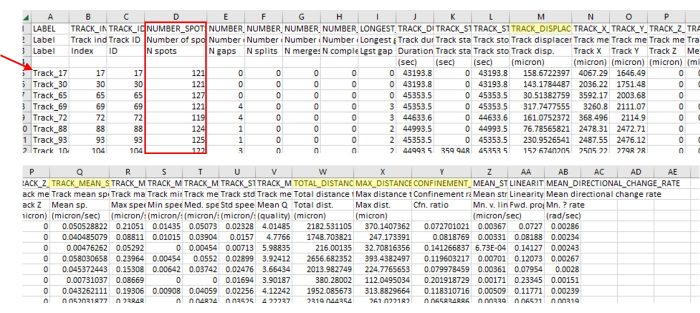
Рисунок 3: Немедленный анализ данных, полученный с помощью программного обеспечения для визуализации и слежения, содержит широкий спектр типов данных. Репрезентативные выходные данные трекинга показаны на рисунке 2, который представляет собой отдельное видео. Обратите внимание на номера треков (красная стрелка) пропускает номера, указывающие на то, что программное обеспечение для слежения правильно удалило треки, которые не совпали с параметрами. В данном примере только 71 из 5385 идентифицированных треков выровнен по параметрам. Такое соотношение является нормальным, учитывая такие строгие рекомендации. Это количество дорожек также соответствует количеству амеб, используемых в этом протоколе (например, если в 96-луночный планшет засеяно 200 мкл 7,5 x 103 КОЕ/мл на лунку, то следует ожидать около 1500 амеб в лунке и примерно столько же видно в поле зрения с 4 стежками. Вероятно, следов будет гораздо больше, чем амеб, поскольку амеба появляется и исчезает из поля зрения, генерируя новые следы. Этот номер трека снова виден на рисунке 2, где видно всего несколько треков по сравнению с большим количеством пятен. Всегда проверяйте количество мест на дорожке (красное поле), чтобы убедиться, что в нее включены только правильные длины дорожек. Например, здесь мы включили более 93% кадров, а в этом разделе было 127 кадров, поэтому все количество мест должно быть больше 118. Желтым цветом выделены измерения, которые были упомянуты в протоколе. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
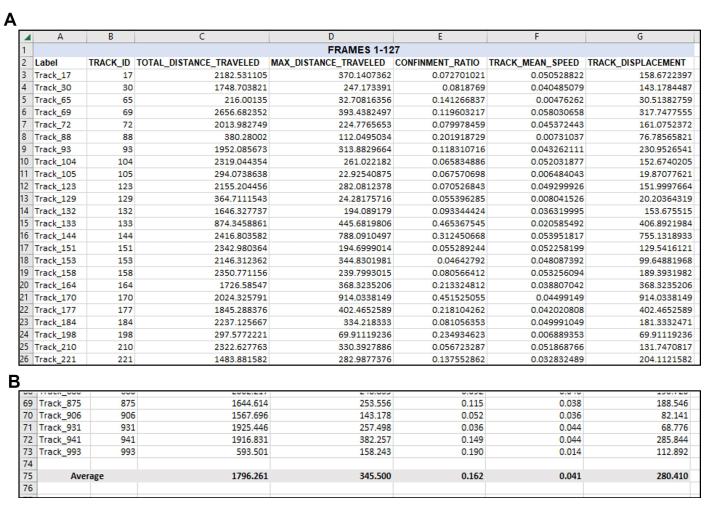
Рисунок 4: Данные реорганизованы по мере необходимости после исходного вывода данных. Организация нужных данных после экспорта. (A) Соответствующие измерения, выбранные для количественной оценки, были скопированы из экспорта программного обеспечения для слежения (рисунок 3) и вставлены в новую электронную таблицу. (B) После того, как желаемые измерения были организованы в новой электронной таблице, следует рассчитать среднее значение по каждому треку. Таким образом, в этом репрезентативном примере общее расстояние, максимальное расстояние, ограничение, средняя скорость и смещение каждого пригодного для использования трека в этом единственном числе в этом единственном числе были усреднены до единственного числа для каждого измерения. Обратите внимание, что в общей сложности 71 трек удовлетворял параметрам для кадров 1-127. Вероятно, будет разное количество подходящих дорожек из каждого анализируемого видео или набора кадров, как показано на рисунке 5. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
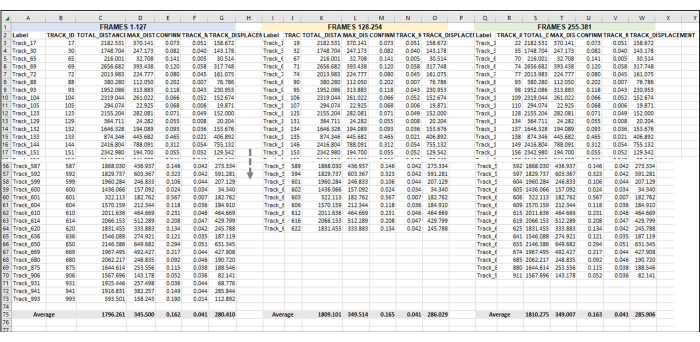
Рисунок 5: Набор последовательных кадров для анализа всей серии изображений или видео. Это репрезентативное изображение добавления последовательных видео к анализу данных. Предположим, что кадры с 1 по 127 составляют час 1 видео (здесь 1 час состоит из съемки изображения раз в 28 с). Кадры 128-254 будут часом 2 видео, а кадры 255-381 будут часом 3 видео. Объедините экспортированные данные (как было экспортировано на рисунке 3) из всех часов в один лист для работы со всеми сразу. Как было сделано на рисунке 4, данные со всех пригодных для использования дорожек для каждого набора кадров в час будут усреднены. Все, что изображено на рисунке 5 , — это данные из одной реплики или одной выборки. Если имеется 3 репликации, то будут 3 идентично расположенные отдельные вкладки электронных таблиц, и данные из них будут подаваться в новую вкладку, как показано на рисунке 6. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
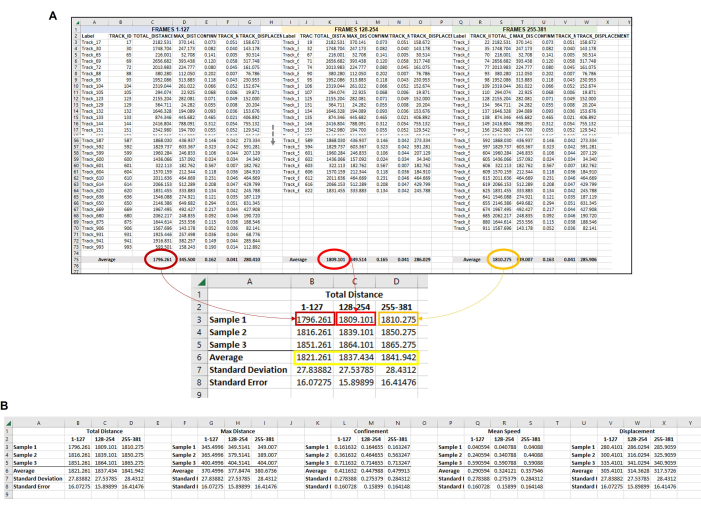
Рисунок 6: Составные данные от всех амеб в каждом наборе кадров, используемых для представления одной реплики. (A) Все средние значения из каждого набора кадров на рисунке 5 должны быть собраны в центральном месте, чтобы можно было завершить окончательный анализ данных. На этом репрезентативном изображении показаны средние значения общего расстояния по первым трем наборам кадров (или часам). Это необходимо повторить для каждого запускаемого образца/условия/репликации. Затем необходимо усреднить средние значения по каждой выборке из каждого набора кадров (желтый прямоугольник). Это конечная точка данных, от которой можно вычислить стандартное отклонение и стандартную ошибку. Индивидуальные средние значения по каждой выборке (здесь числа в B3, B4 и B5 для выборки общего расстояния 1; C3, C4 и C5 для выборки общего расстояния 2 и т. д.) будет использоваться для проведения статистического анализа. Этот процесс будет повторен для всех необходимых измерений (максимальное расстояние, ограничение, средняя скорость, смещение и т. д.) (B) Чтобы сделать графическое представление количественной оценки, используйте числа в желтом поле в качестве точек данных для использования в итоговом графике. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
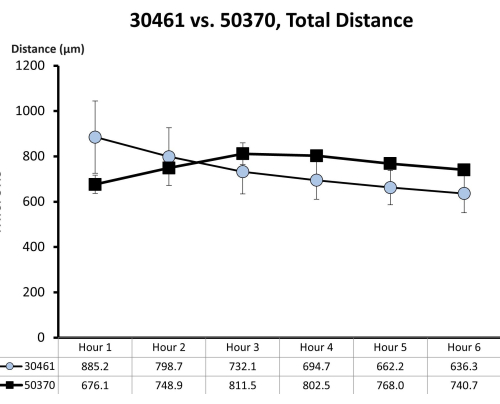
Рисунок 7: Исходные данные о подвижности для ATCC 30461 и ATCC 50370. Исходные данные (представленные здесь в виде среднего значения ± SE за каждый час) были ранее собраны и не опубликованы для предыдущих исследований18,19. Эта количественная оценка подвижности показывает, что эти две амебы одинаковы в течение первых 6 часов подвижности (измеряемой общим расстоянием в микронах, пройденных за этот час) в 1/4 раствора Рингера на стеклянной поверхности. Каждая временная точка представляет собой три отдельные реплики, каждая из которых состоит из 20-200 следов амебы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Discussion
Возможность отслеживать и количественно оценивать подвижность амеб, таких как Acanthamoeba, которые являются адгезивными микроскопическими организмами, не подверженными влиянию броуновского движения с низкой скоростью 9,10, раскрывает значительный объем информации о поведении амеб и может значительно повысить осведомленность о методах профилактики АК. Этот протокол был подробно описан в недавних публикациях, и данные были подтверждены или объединены с другими аналогичными анализами данных18,19. Отметим здесь, что скорость амебы, подробно описанная с помощью этого метода, аналогична той, которая была опубликована другими группами. Этот протокол примечателен своей способностью использоваться практически на любой поверхности или обработке амебы, которая прозрачна для света, но важно отметить, что, хотя этот протокол потенциально может быть модифицирован для работы с другими организмами, он был оптимизирован только для Acanthamoeba. Описанный выше протокол неизменно хорошо работает в лаборатории, но в него внесены следующие изменения для изменения метода в соответствии с другими потребностями или устранения сложных ситуаций.
Определение параметров отслеживания: В приведенном выше протоколе были перечислены покадровая связь, закрытие разрыва, максимальный интервал между кадрами и количество пятен на треке, которые были наиболее применимы для последних публикаций. Однако не исключено, что другие параметры будут более подходящими для других нужд. Кроме того, могут быть параметры, которые другие хотели бы использовать, но не использовали здесь (например, максимальное расстояние трека под фильтрами трека). Более подробную информацию о каждом параметре и о том, что они описывают, можно найти здесь, на веб-сайте (см. ссылку21). Решая, какие параметры и фильтры наиболее релевантны для других экспериментов и как их следует задавать, подумайте о том, что статистически рационально для конкретного проекта; Например, нужны ли были бы данные от амебы, которая уходит из поля зрения, а затем возвращается в него? Или кто-то захочет сохранить данные от амебы, которая вообще не двигалась, но все равно была помечена как след? и что имеет смысл для количества кадров и продолжительности времени между кадрами, когда были записаны изображения.
Изменение размера капли: Мы обнаружили, что с помощью любого программного обеспечения или любой конфигурации микроскопа, основанной на современных технологиях и программном обеспечении, доступных в стандартных лабораториях, чрезвычайно сложно точно отследить количество амеб в совокупности, поскольку оно меняется с течением времени. Если вы отслеживаете размер капли и пытаетесь соотнести этот размер с количеством организмов в нем, используйте стандартную кривую, сгенерированную после повторных экспериментов, чтобы математически предсказать размер агрегата. Например, агрегаты были созданы путем посева лунок с различным количеством амеб, таких как 8, 16, 32, 125, 250, 500, 1000 и 2000 клеток на скважину. Были получены таймлапс-изображения в различных временных точках каждой скважины в течение 24 часов. Каждый сфероид (который имел известное количество амеб) был проанализирован для двумерной области, и стандартная кривая была сгенерирована как функция зависимости количества амеб от размера сфероида с течением времени. Этот эксперимент был повторен по крайней мере в трех экземплярах, чтобы получить соответствующее стандартное отклонение любой сгенерированной кривой.
Определение направленности амебы: Хотя это может и не быть необходимым для конкретных исследований, может быть полезно понять направленность амебы. Это позволило бы получить данные о хемотаксических эффектах лечения или эксперимента. Эти данные также могут быть использованы для создания как визуальных (графических), так и количественных данных. Это доступно с помощью инструмента Chemotaxis and Migration Tool, который является бесплатным плагином для программного обеспечения для обработки изображений. Он доступен на веб-сайте вместе с руководством по применению и образцами изображений и видеороликов (см. Таблицу материалов).
Детальная динамика движения: другие группы исследовали динамику спрединга и диффузионные траектории с помощью высокоразвитого и развитого статистического анализа, выходящего за рамки того, что обсуждается здесь 9,10,22. Они могут быть рассмотрены в зависимости от потребностей пользователя.
Как и в случае с любым успешным методом, протокол, подробно описанный в этой рукописи, прошел множество раундов устранения неполадок для достижения согласованности. В то время как отличные высококачественные отслеживаемые видео могут быть сделаны путем съемки изображения каждую секунду (или так быстро, как микроскоп может это сделать, это может быть меньше секунды), это создает чрезвычайно большие файлы, с которыми может быть трудно работать. Это реально подходит только для очень краткосрочных видео, записанных максимум на несколько минут. И наоборот, делая изображение каждые несколько секунд, мы обнаружили, что поведение амебы по-прежнему очень легко отслеживается в зависимости от скорости этого вида, и можно создавать рабочие видео в течение нескольких часов или дней. Мы обнаружили, что максимальный промежуток времени между изображениями составляет 30 с, что является временем, которое требуется для точного отслеживания амебы программным обеспечением для обработки изображений. Временной интервал, выбранный пользователем, следует учитывать с учетом известных ограничений, связанных с тем, с какой скоростью микроскоп может записывать изображения, сколько изображений требуется на лунку и сколько лунок записывается на каждом интервале. Аналогичным образом, параметры, упомянутые в этом протоколе относительно максимального смещения, допустимых промежутков между кадрами, минимального количества необходимых кадров и т. д., были определены методом проб и ошибок этой лабораторией для создания информации о дорожке, которая включает в себя наиболее полные следы амебы и игнорирует шум, создаваемый незавершенными дорожками, амебой, которая присоединяется к сцене или покидает ее в середине видео, или ошибками, вызванными путаницей программного обеспечения для обработки изображений, например, когда две амебы встречаются в середине трека, а затем разделяются. Такого рода ошибки и неполные треки по понятным причинам высоки при создании чрезвычайно длинных (от нескольких часов до нескольких дней) видео микроскопических биологических организмов, которые постоянно взаимодействуют друг с другом и являются причиной того, что очень большая часть ошибочных треков должна быть отбракована. Следует отметить, что этап заполнения отверстий в протоколе, по опыту этой лаборатории, важен для уменьшения ошибок в том, как программное обеспечение для визуализации отслеживает амебу. Убедившись, что каждая амеба представляет собой сплошной круг, а не пончик или букву «с», программное обеспечение с гораздо большей вероятностью сможет успешно отслеживать каждую амебу.
Кроме того, как уже говорилось, существует множество параметров, доступных пользователю для анализа изображения или видео. Основываясь на экспериментальных потребностях, мы постоянно извлекаем наибольшую пользу из анализа общего расстояния, максимального расстояния, скорости и водоизмещения. Они подробно обсуждаются (в том числе с использованием различных деформаций и поверхностей) с графическими интерпретациями в предыдущих публикациях18,19. Эти четыре параметра позволяют пользователю экстраполировать способность амебы преодолевать линейные расстояния и время, необходимое для этого, что помогает понять их поведение в отношении загрязнения контактных линз. Получение и анализ этих параметров — это большая работа, как подробно описано на наших рисунках. Работая с большими и многочисленными электронными таблицами из выходных данных программного обеспечения для обработки изображений, мы ограничили количество непреднамеренных ошибок, создав заблокированные шаблоны электронных таблиц, которые автоматически рассчитывали все необходимые анализы. Тем не менее, возможным улучшением этого метода было бы написание скрипта, который может обрабатывать эти данные, сортировать и анализировать их.
В заключение следует отметить, что здесь описан доступный и точный метод измерения размера и подвижности акантамебы в самых разных условиях. Мы продемонстрировали, что этот метод может быть применен ко многим различным штаммам амебы, и показали, что, хотя могут существовать простые параметры для получения информации о подвижности, эта экспериментальная установка может быть в значительной степени адаптирована к любым конкретным потребностям.
Disclosures
Все авторы являются сотрудниками ООО «Алкон Ресерч».
Acknowledgements
Эта работа была профинансирована компанией Alcon Research, LLC.
Materials
| Name | Company | Catalog Number | Comments |
| ¼ Ringer’s solution | ThermoFisher Scientific | BR0052G | Oxoid Ringers Solution Tablets. Follow directions to make one-quarter strength instead of full strength Ringers. |
| 10 µL pipette | Eppendorf Research | 3123000039 | 2 µL-20 µL single channel |
| 10 µL pipette tips | Neptune Scientific, San Diego, CA, USA | BT10.N | 10 µL Universal Barrier Tip |
| 48 well plate | Millipore Sigma, | CLS3548 | Corning Costar TC-Treated Multiple Well Plate: polystyrene plate, flat bottom wells, sterile, with lid |
| 50 mL conical tubes (1 for each sample, 1 for each pass 2 sample) | Fisher Scientific | Falcon 352098 | Falcon 50 mL High Clarity Conical Centrifuge Tubes, polypropylene |
| 96-well plate | Millipore Sigma, Burlington, MA, USA | CLS3596 | Corning Costar TC-Treated Multiple Well Plate: polystyrene plate, flat bottom wells, sterile, with lid |
| Acanthamoeba | American Type Culture Collection, Manassas, VA, USA | ATCC 30461 | This protocol has been verified for ATCC 50655, 30872, 50702, 30010, 30461, 50370, 50703, 30137, PRA-115, and PRA-411 |
| Axenic culture media (AC6) | Made in house | n/a | Containing 20 g biosate peptone, 5 g glucose, 0.3 g KH2PO4, 10 µg vitamin B12, and 1 glass5 mg l-methionine per liter of distilled deionized water. Adjust pH to 6.6-6.95 with 1 M NaOH and autoclave at 121 °C for 20 min, store at room temperature for up to 3 months. |
| Centrifuge and appropriate rotor | Thermo Scientific, Waltham, MA, USA | Sorvall ST 40R | Any equivalent centrifuge and rotor are acceptable so long as it can spin 50 mL conical tubes at 500 x g for 5 min |
| Chemotaxis and Migration Tool | Free software based on ImageJ, available at https://ibidi.com/chemotaxis-analysis/171-chemotaxis-and-migration-tool.html | ||
| Disposable hemocytometer | Bulldog Bio, Portsmouth, NH, USA | DHC-N01 | Neubauer Improved 2-Chip Disposable Hemocytometer, Individually packaged, Nonpyrogenic |
| ImageJ software with Trackmate plugin (this protocol written with Trackmate version 6.0.2.) | Free software developed by the National Institutes of Health, available at imagej.net. Trackmate plugin available at https://imagej.net/plugins/trackmate/ | ||
| Microscope, preferably with automated moveable stage | Nikon, Tokyo, Japan | A Nikon Eclipse Ti-U Microscope was used in this study and the automated moveable stage was utilized to be able to record images in multiple wells at a time. | |
| NIS-Elements software | Nikon | ||
| Serological pipette | Fisher Scientific, Hampton, NH, USA | BrandTech 26331 | BrandTech accu-jet pro Pipet Controller |
| Serological pipette tips | VWR | 5 mL: 76201-710 10 mL: 170356 25 mL: 89130-900 50 mL: 75816-088 | VWR Serological Pipette, Non-Pyrogenic |
| Sterile aluminum transmission flow cell | Biosurface Technologies Corporation, Bozeman, MT, USA | FC 81-AL | Anodized aluminum single channel transmission flow cell with 96-well plate footprint for use with an inverted microscope |
| T75 Flasks | VWR, Radnor, PA, USA | 734-2316 | VWR Tissue Culture Flask, 182.5 cm, Surface treated, Plug seal cap, Sterile |
References
- Randag, A. C., et al. The rising incidence of Acanthamoeba keratitis: A 7-year nationwide survey and clinical assessment of risk factors and functional outcomes. PLoS One. 14 (9), e0222092 (2019).
- Szentmary, N., et al. Acanthamoeba keratitis - Clinical signs, differential diagnosis and treatment. J Curr Ophthalmol. 31 (1), 16-23 (2019).
- Carnt, N., et al. Acanthamoeba keratitis: confirmation of the UK outbreak and a prospective case-control study identifying contributing risk factors. Br J Ophthalmol. 102 (12), 1621-1628 (2018).
- Verani, J. R., et al. National outbreak of Acanthamoeba keratitis associated with use of a contact lens solution, United States. Emerg Infect Dis. 15 (8), 1236-1242 (2009).
- Tu, E. Y., Joslin, C. E. Recent outbreaks of atypical contact lens-related keratitis: what have we learned. Am J Ophthalmol. 150 (5), 602-608.e2 (2010).
- . ISO 14729:2001/A1. Ophthalmic optics-Contact lens care products-Microbiological requirements and test methods for products and regimens for hygienic management of contact lenses. , (2010).
- . ASC Z80, Parent Committee Meeting, February 27 Available from: https://www.thevisioncouncil.org/sites/default/files/ASCZ80_ParentCommitteeMinutes_February_27_2018_FINALMar19-2018.pdf (2023)
- Rayamajhee, B., et al. Acanthamoeba, an environmental phagocyte enhancing survival and transmission of human pathogens. Trends Parasitol. 38 (11), 975-990 (2022).
- Reverey, J. F., et al. Superdiffusion dominates intracellular particle motion in the supercrowded cytoplasm of pathogenic Acanthamoeba castellanii. Sci Rep. 5, 11690 (2015).
- Thapa, S., Lukat, N., Selhuber-Unkel, C., Cherstvy, A. G., Metzler, R. Transient superdiffusion of polydisperse vacuoles in highly motile amoeboid cells. J Chem Phys. 150 (14), 144901 (2019).
- Rudell, J. C., et al. Acanthamoeba migration in an electric field. Invest Ophthalmol Vis Sci. 54 (6), 4225-4233 (2013).
- Fukaya, S., Aoki, K., Kobayashi, M., Takemura, M. Kinetic analysis of the motility of giant virus-infected amoebae using phase-contrast microscopic images. Front Microbiol. 10, 3014 (2019).
- Fukaya, S., Takemura, M. Kinetic analysis of Acanthamoeba castellanii infected with giant viruses quantitatively revealed process of morphological and behavioral changes in host cells. Microbiol Spectr. 9 (1), e0036821 (2021).
- Cheng, H. J., Hsu, C. H., Hung, C. L., Lin, C. Y. A review for cell and particle tracking on microscopy images using algorithms and deep learning technologies. Biomed J. 45 (3), 465-471 (2022).
- Mathieu, E., et al. Time-lapse lens-free imaging of cell migration in diverse physical microenvironments. Lab Chip. 16 (17), 3304-3316 (2016).
- Svensson, C. M., Medyukhina, A., Belyaev, I., Al-Zaben, N., Figge, M. T. Untangling cell tracks: Quantifying cell migration by time lapse image data analysis. Cytometry A. 93 (3), 357-370 (2018).
- Piltti, K. M., et al. Live-cell time-lapse imaging and single-cell tracking of in vitro cultured neural stem cells - Tools for analyzing dynamics of cell cycle, migration, and lineage selection. Methods. 133, 81-90 (2018).
- Campolo, A., et al. Continuous real-time motility analysis of Acanthamoeba reveals sustained movement in absence of nutrients. Pathogens. 10 (8), 995 (2021).
- Campolo, A., Patterson, B., Lara, E., Shannon, P., Crary, M. Complete recovery of Acanthamoeba motility among surviving organisms after contact lens care disinfection. Microorganisms. 11 (2), 299 (2023).
- Crary, M. J., Walters, R., Shannon, P., Gabriel, M. M. Variables affecting the recovery of Acanthamoeba trophozoites. Pathogens. 10 (2), 221 (2021).
- . Trackmate Available from: https://imagej.net/plugins/trackmate/tutorials/getting-started (2024)
- Cherstvy, A. G., Nagel, O., Beta, C., Metzler, R. Non-Gaussianity, population heterogeneity, and transient superdiffusion in the spreading dynamics of amoeboid cells. Phys Chem Chem Phys. 20 (35), 23034-23054 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved