הקלה על הזרקות חוזרות תוך קרוטיד במודלים של עכברים על ידי טכניקת תיקון אתר הזרקה חדשנית
In This Article
Summary
תיקון עורק התרדמה במודל עכברי לאחר הזרקה מחזיר את זרימת הדם לעורק מבלי להשפיע לרעה על פיזור החומר המוזרק. תיקון אתר ההזרקה מאפשר זריקות עוקבות דרך אותו עורק ומונע איסכמיה מוחית בזני עכברים חסרי מעגל שלם של וויליס.
Abstract
לאור ההתקדמות האחרונה במתן טיפולים אנטי-סרטניים חדשניים באמצעות שיטות הולכה תוך-עורקית סלקטיבית אנדו-וסקולרית בנוירו-אונקולוגיה, יש צורך דחוף לפתח שיטות להזרקות תוך קרוטיד במודלים של עכברים, כולל שיטות לתיקון עורק התרדמה בעכברים לאחר ההזרקה כדי לאפשר זריקות עוקבות. פיתחנו שיטה של הזרקת תוך קרוטיד במודל עכבר כדי להעביר טיפולים לעורק התרדמה הפנימי (ICA) עם שני הליכים חלופיים.
במהלך ההזרקה, המחט מוחדרת לעורק התרדמה המשותף (CCA) לאחר קשירת תפר סביב עורק התרדמה החיצוני (ECA) וטיפולים מוזרקים מועברים לתוך האגודה למלחמה בסרטן. לאחר ההזרקה ניתן לקשור את עורק התרדמה המשותף (CCA), מה שמגביל את מספר הזריקות התוך-קרוטיות לאחת. ההליך החלופי המתואר במאמר זה כולל שינוי שבו הזרקת עורק תוך קרוטיד מלווה בתיקון אתר ההזרקה של CCA, אשר משחזר את זרימת הדם בתוך CCA ומונע את הסיבוך של איסכמיה מוחית שנראה בכמה מודלים עכבר.
כמו כן, השווינו את המסירה של תאי גזע מזנכימליים אנושיים שמקורם במח עצם (BM-hMSCs) לגידולים תוך גולגולתיים כאשר הם מועברים באמצעות הזרקה תוך קרוטידית עם וללא תיקון אתר ההזרקה לאחר ההזרקה. משלוח של BM-hMSCs אינו שונה באופן משמעותי בין השיטות. התוצאות שלנו מראות כי תיקון אתר ההזרקה של CCA מאפשר הזרקות חוזרות דרך אותו עורק ואינו פוגע באספקה ובפיזור של החומר המוזרק, ובכך מספק מודל עם גמישות רבה יותר המדמה באופן הדוק יותר הזרקת תוך קרוטיד בבני אדם.
Introduction
מתן טיפולים לגידולי מוח הוא מאתגר בשל האטימות של מחסום הדם-מוח (BBB) ומחסום הדם-גידול (BTB). הזרקה תוך-גידולית ישירה של תרופות כדי לעקוף את BBB יכולה להיות מושגת באמצעות שימוש בצנתר מאגר אומאיה, עירוי מיקרואינפוזיה בזרימה נמוכה להעברה משופרת של הסעה, או הזרקה מקומית לחלל הכריתה או לרקמה סמוכה1. עם זאת, הנפח הכולל של רקמת הגידול כי הוא הגיע עם שיטות אלה מוגבל 2,3,4. זריקות תוך עורקיות שימשו בעבר כדי לספק סוכנים טיפוליים לגידולי מוח במטרה להגיע ליותר מהגידול 5,6,7,8 ובתקופה האחרונה, ההתקדמות הן בטכניקות מסירה תוך עורקית והן בסוכנים טיפוליים חדשניים הוכיחו את היתרון בשימוש בגישה זו בטיפול בגידולי מוח7, 9. התקדמות זו כוללת פיתוח של microcatheters, אספקה תוך עורקית סלקטיבית אנדווסקולרית (ESIA) עם הדמיה מתקדמת, שימוש בחומרים אוסמוטיים כדי לשבש את BBB ו- BTB, ופיתוח טיפולים ביולוגיים ממוקדים. לכן, כדי לבצע בדיקות פרה-קליניות של חומרים טיפוליים חדשניים הניתנים באמצעות זריקות תוך עורקיות, יש צורך במודלים מחקריים תרגומיים מתאימים 9,10.
במודלים עכבריים של גידולי מוח, סוכנים טיפוליים המועברים תוך צפקית או תוך ורידי (דרך וריד הזנב) עוברים דרך הכבד או הלב והריאות, בהתאמה, לפני שהם מופצים לכל הגוף, כולל המוח. השפעות מעבר ראשון אלה עשויות ללכוד ולהסיר את הסוכן, או לדלל את הסוכן לפני שהוא מגיע למוח, ועשויות להציג רעילות מגבילה מינון לפני השגת מינון טיפולי במוח. לעומת זאת, הזרקת עורק התרדמה מאפשרת העברה ממוקדת למוח לפני מחזור הדם על ידי עקיפת חילוף החומרים במעבר הראשון והגבלת המסירה מחוץ למטרה. בעוד הזרקת תוך קרוטיד בעכברים דורשת עבודה רבה יותר, הספציפיות והשכפול של הטכניקה מביאים לירידה במספר בעלי החיים להשלמת חקירות11,12.
באופן כללי, בשיטות שתוארו קודם לכן של הזרקת עורק התרדמה בעכברים, עורק התרדמה המשותף קשור לאחר ההזרקה וזרימת הדם למוח מסופקת על ידי עורק התרדמה הנגדי ומחזור הדם המוחי האחורי דרך מעגל וויליס11,12. לשיטה זו יש מגבלה מובנית המאפשרת רק מקסימום של זריקה אחת לעורק התרדמה הפנימי או החיצוני. כמו כן, קריטי שלזני העכבר המשמשים בניסויים שבהם עורק התרדמה קשור יהיה מעגל שלם של וויליס למניעת איסכמיה מוחית עקב העורק הקשור13. חסימה של עורק התרדמה הוכחה גם כמפחיתה את זרימת הדם במוח ומגבילה את התפלגות החלקיקים המוזרקים14. בנוסף, חסימת עורק התרדמה בעכברים לאחר ההזרקה אינה מדמה הזרקה של עורק התרדמה בחולים אנושיים.
הקבוצה שלנו השתמשה בעבר בזריקות עורקי התרדמה כדי להעביר בהצלחה תאי גזע מזנכימליים למוח 10,15,16,17,18,19. במאמר זה נתאר בפירוט שיטה זו של הזרקת עורק התרדמה ונכלול שינוי של השיטה שפיתחנו, בה מתקן את אתר ההזרקה מבלי לחסום את העורק, תוך הימנעות מהמגבלות שמציבה קשירת עורק התרדמה לאחר ההזרקה. בשיטה זו, עורק התרדמה המשותף (CCA) מוכן להזרקה על ידי הנחת שני תפרים, אחד בכל קצה של אתר ההזרקה המיועד, ואת התפר התחתון (מתחת למקום ההזרקה) הוא הידוק. עורק התרדמה החיצוני (ECA) נאטם באמצעות תפר אחר. המחט מוחדרת לתוך CCA, וטיפולים מועברים לעורק התרדמה הפנימי (ICA). בעקבות זאת, מהדקים את התפר העליון ב-CCA כדי למנוע זרימה חוזרת מה-ICA. בשלב זה, ניתן לקשור או לתקן את ה- CCA המוזרק. אם רוצים לקשור את ה-CCA, מהדקים את התפרים ומשאירים אותם במקומם. אם אתר ההזרקה מתוקן, התפרים מוסרים לאחר התיקון, וזרימת הדם משוחזרת. פירוט הליכים חלופיים אלה מובא להלן.
Protocol
כל השלבים המפורטים להלן תואמים את הפרוטוקול שלנו, אשר עוקב אחר הנחיות שנקבעו ואושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים במרכז הסרטן MD Anderson באוניברסיטת טקסס.
1. הכנת שולחן הניתוחים והעכבר להליך כירורגי
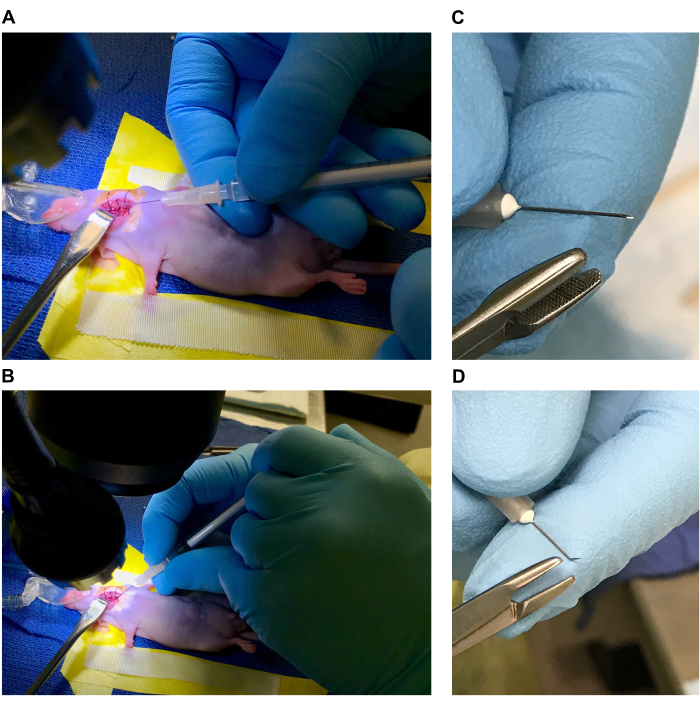
- הכנת שולחן הניתוחים והעכבר להליך כירורגי (עיין באיור 1A,B)
- סדרו את המיקרוסקופ המנתח ואת מקור האור מול וופורייזר האיזופלורן עם מערכת נבלות פעילה או הניחו על טבלת מטה. הניחו את כרית החימום החשמלית על בסיס המיקרוסקופ המנתח (או עדיף מתחת למיקרוסקופ אם הבסיס מוצק ויכול להעביר חום) וכסו בשפשוף כירורגי סטרילי.
הערה: יש לעקר את כל כלי הניתוח והווילונות על ידי אוטוקלאבינג לפני השימוש וכל הכלים החד-פעמיים צריכים להיות סטריליים וארוזים בנפרד. יש להשתמש בכפפות סטריליות לאורך כל ההתקנה וההליך ולהחליף במידת הצורך כדי לשמור על סטריליות. - הכינו את המיטה (4-5 אינץ' אורך x 2 אינץ' רוחב) על וילון הניתוח באמצעות סרט מעבדה ויניל. חותכים 1.5 אינץ 'x 1.5 אינץ 'מרובע של גזה, לגלגל אותו בחוזקה, ומניחים את הגזה מגולגלת מתחת לחתיכה 3 אינץ 'של סרט ויניל ב "ראש" המיטה כדי ליצור כרית (הטיית הראש עם השימוש בכרית מאפשרת הרחבה גדולה יותר של אזור צוואר הגחון).
- הניחו חתיכות 4 אינץ 'של סרט כירורגי לאורך צידי המיטה (על גבי סרט הויניל). [אם אתם משתמשים באיזופלורן, הניחו חרוט אף בהרדמה עם משקל (או סרט הדבקה) מחובר ליד ראש המיטה. התאם אותו למיקום ספציפי לאחר שהעכבר מורדם ומרוסן.] ראו איור 1A,B.
- בעזרת מחט או מלקחיים כבדים, קורעים חתיכות קטנות של כותנה ממקלון צמר גפן ומגלגלים לכדורים בגדלים שונים בקוטר 0.5-1 מ"מ (8-10 חתיכות כותנה לעכבר). שמור את הכותנה על הווילונות הכירורגיים ליד ראש המיטה.
- בעזרת מכשירים סטריליים חותכים חוט תפר 6-0 לחתיכות של 1 ס"מ (3-4 חתיכות לעכבר). מניחים את אורכי התפרים המוכנים על שפשוף סטרילי. הכינו מזרק 1 מ"ל למתן בופרנורפין או משכך כאבים מתאים אחר (כפי שאושר על ידי פרוטוקול הוועדה המוסדית לטיפול ושימוש בבעלי חיים [IACUC]). יש לעקר את כל כלי הניתוח על פי תקני IACUC לפני הצבת הכלים בשדה הסטרילי.
- סדרו את המיקרוסקופ המנתח ואת מקור האור מול וופורייזר האיזופלורן עם מערכת נבלות פעילה או הניחו על טבלת מטה. הניחו את כרית החימום החשמלית על בסיס המיקרוסקופ המנתח (או עדיף מתחת למיקרוסקופ אם הבסיס מוצק ויכול להעביר חום) וכסו בשפשוף כירורגי סטרילי.
- הכנת עכבר להליך הכירורגי (עיין באיור 1C-F)
- יש להרדים עכבר אחד בשיטות שאושרו על ידי IACUC לניתוחי הישרדות גדולים (השתמש באיזופלורן 1%-4%, בהתבסס על רגישות של עכברים בודדים, או קוקטייל של 10 מ"ג/מ"ל קטמין, 1 מ"ג/מ"ל קסילזין במשקל גוף של 100-200 מ"ג/ק"ג (קטמין). קוצצים את הפרווה או מפרקים במידת הצורך. מתן 0.5-1.0 מ"ג / ק"ג buprenorphine ER (שחרור מורחב) על ידי הזרקה תת עורית 30 דקות לפני תחילת ההליך הכירורגי.
- מקמו את העכבר המורדם כך שהכרית תנוח מתחת לצוואר (איור 1C). הכרית מסייעת להאריך ולתמוך בצוואר כאשר משתמשים בה עם חרוט האף להרדמה. אם אתם משתמשים בקוקטייל קטמין/קסילזין, הניחו מוט שיניים משוקלל או כלי דומה בפה, מאחורי החותכות כדי להטות את הראש ולהאריך את הצוואר.
- ריסון הגפיים הקדמיות באמצעות סרט הניתוח שהונח בעבר לאורך צידי מיטת הניתוח (איור 1D). התאימו את מיקום העכבר מתחת למיקרוסקופ כך שהמשטח הגחוני של הצוואר יהיה גלוי, וכווננו את ההגדלה כדי לצפות בנוחות באתר הניתוח (איור 1E).
הערה: ההגדלה של המיקרוסקופ המנתח צריכה להיות מותאמת על ידי המנתח לרמת הנוחות שלהם עבור כל שלב. - מרחו דמעות מלאכותיות באמצעות צמר גפן סטרילי. חיטאו את אתר הניתוח על-ידי מקלונים עגולים לסירוגין של בטאדין או כלורהקסידין ואלכוהול שלוש פעמים בכל חומר חיטוי (איור 1F).
- אשר את עומק ההרדמה על ידי וידוא שהעכבר אינו מושך את רגלו בתגובה לצביטת בוהן. לפקח על קצב הנשימה ולוודא כי העכבר אינו מתנשף, שכן זוהי אינדיקציה של הרדמה מוגזמת בעת שימוש isoflurane. במידת הצורך, התאימו את קצבי זרימת החמצן והאיזופלורן כדי להגיע לעומק הרדמה מתאים ואפילו לנשימה.
2. הליך כירורגי (איור 2, איור 3, איור 4, איור 5, איור 6 ואיור 7)
- חתך ראשוני ודיסקציה
- התחילו בביצוע חתך אורכי בקו האמצע בקוטר 1 ס"מ, החל מעצם הגולגולת ועד למנובריום (גוש בולט בקצה הגולגולת של עצם החזה) והמשיכו מעל קנה הנשימה באמצעות להב אזמל סטרילי או מכשיר דומה בהתאם להנחיות IACUC שאושרו למשתמש (איור 2A).
- הכנס את קצה המספריים הסגורים לתוך החתך ופתח אותו בעדינות כדי לבצע דיסקציה קהה של רקמת החיבור התת עורית, המפרידה בין שתי בלוטות הרוק. בעזרת המלקחיים העדינים, משכו בעדינות את בלוטת הרוק הימנית דרך החתך כדי לנוח על משטח העור שהוכן באופן אספטי או משכו את בלוטת הרוק לרוחב באמצעות מסיר הוו הקהה (איור 2B,C). אם הבלוטה החיצונית נראית יבשה או דביקה, יש להרטיב במי מלח סטריליים.
- המשיכו בדיסקציה קהה של רקמת החיבור עד שהסטרנוקלידומסטואיד ושרירי הקיבה נראים לעין (איור 2D).
הערה: המשולש השרירי שנוצר על ידי שריר קנה הנשימה/סטרנוהיואיד (sh), שריר הסטרנוקלידומסטואיד (sm) ושריר הקיבה (dg) (בטן קאודלית) ישמשו לאיתור CCA ימין והתפצלות עורק התרדמה בפרוטוקול. באופן כללי, ניתן לראות גם את שריר האומוהיואיד (oh) הקטן יותר שוכב לרוחב ה-CCA (איור 2D); עם זאת, שריר זה משתנה בגודל וזה לא נדיר עבור שריר omohyoid להיות נעדר לחלוטין בעכברים צעירים או קטנים.
- בידוד CCA
- בעזרת המלקחיים הזוויתיים יש להמשיך בדיסקציה זהירה של רקמת החיבור (על ידי פתיחת קצות המלקחיים) בסמוך לקצה הקאודלי של המשולש השרירי כדי לחשוף את עורק התרדמה המשותף, הווריד הצווארי והעצב התועה.
הערה: עורק התרדמה המשותף הוא כלי הדם הגדול ביותר הסמוך לקנה הנשימה, ובאופן כללי ניתן לזהות אותו בקלות בבסיס המשולש השרירי (איור 2E, חץ). היזהר מאוד עם המלקחיים העדינים סביב כלי הדם מכיוון שהקצוות יכולים בקלות לנקב את כלי הדם וכתוצאה מכך לדימום מוגזם ועלול להיות קטלני. - המשך בדיסקציה זהירה של רקמת החיבור סביב החלק של עורק התרדמה המשותף מבסיס המשולש השרירי עד לשריר האומוהיואיד. השתמשו בכדורי הצמר גפן הקטנים והסטריליים כדי לשלוט בכל דימום קל ולספוג נוזלים המופרשים מבלוטות הרוק לפי הצורך.
- נתחו בזהירות את רקמת החיבור כדי להפריד את ה-CCA מהעצב התועה. יש להקפיד במיוחד למזער את הטיפול והנזק לעצב התועה, שקל לזהותו כצרור העצבים העבה והלבן הסמוך ל-CCA (איור 2F).
- בעזרת המלקחיים הזוויתיים יש להמשיך בדיסקציה זהירה של רקמת החיבור (על ידי פתיחת קצות המלקחיים) בסמוך לקצה הקאודלי של המשולש השרירי כדי לחשוף את עורק התרדמה המשותף, הווריד הצווארי והעצב התועה.
- הכנת CCA
- לאחר שה-CCA גויס לחלוטין משריר הסטרנוקלידומסטואיד, והיכן שהוא נראה, עד לשריר האומוהיואיד, הניחו חתיכה של 1 ס"מ של תפר 6-0 על העור המוכן של עצם החזה של העכבר (לשליפה קלה) והעבירו את המלקחיים הזוויתיים מתחת ל-CCA (תוך הקפדה על בידוד CCA מהעצב התועה והווריד הצווארי) (איור 3A). אם שריר האומיואיד אינו קיים, נקה את האזור סביב CCA מספיק כדי להיות מסוגל להניח תפרים על CCA, גולגולתי וקאודלי לאתר ההזרקה המוצע, ולהחדיר את המחט.
- עם המלקחיים העדינים ביד שמאל, מעבירים את התפר למלקחיים בקצה הזוויתי, תוך אחיזה קרוב לקצה התפר. משכו בעדינות מחצית מאורך התפר מתחת ל-CCA בעזרת מלקחיים זוויתיים (איור 3B).
- חזרו על התהליך הזה בתפר שני, במקביל לתפר הראשון (איור 3C).
- קשרו באופן רופף כל תפר סביב CCA, אך אל תהדקו את הקשרים או הגבילו את זרימת הדם (איור 3D).
- בידוד והכנה של עורק התרדמה החיצוני
- בעזרת המלקחיים הזוויתיים הסירו בזהירות את רקמת החיבור בקצה הגולגולתי של המשולש השרירי, גולגולתי לשריר האומוהיואיד, כדי לאתר את ה-CCA ואת הביפורקציה ל-ECA ול-ICA (איור 4A).
הערה: ה-ECA נוטה לכיוון קו האמצע והוא מעט שטחי יותר, בעוד שה-ICA זוית לרוחב ונעה עמוק יותר לתוך הצוואר. יש להקפיד במיוחד על מניעת נזק לעצב ההיפוגלוסלי (HN) החוצה את ה-ICA ממש מעל הביפורקציה. - יש לפנות בזהירות את רקמת החיבור מכל צידי ה-ECA בסמוך לביפורקציה. לאחר שמספיק רקמת חיבור פונתה מה- ECA, הניחו חתיכת תפר על העור המוכן על עצם החזה של העכבר והעבירו את המלקחיים הזוויתיים מתחת ל- ECA. עם המלקחיים העדינים ביד שמאל, העבירו את התפר למלקחיים הזוויתיים בקצה ברווח שבין ה-ICA ל-ECA ומשכו בעדינות חצי מאורך התפר (איור 4B). קשרו באופן רופף את התפר סביב ECA, אך אל תהדקו את הקשר.
הערה: חשוב לפנות מספיק רקמת חיבור מה-ECA כדי שתוכל לתפוס את התפר עם המלקחיים הזוויתיים מבלי לתפוס בשוגג גם את רקמת החיבור המקיפה את העורקים, ולגרום נזק לעורקים בעת שליפת התפר.
- בעזרת המלקחיים הזוויתיים הסירו בזהירות את רקמת החיבור בקצה הגולגולתי של המשולש השרירי, גולגולתי לשריר האומוהיואיד, כדי לאתר את ה-CCA ואת הביפורקציה ל-ECA ול-ICA (איור 4A).
- הכנת מחטים ומזרקים
הערה: בשלב זה ניתן לבצע את ההזרקה באמצעות מחט ישרה, המאפשרת למזרק להישען על גופו של העכבר ולייצב אותו (איור 5A). לחלופין, ניתן לבצע את ההזרקה באמצעות מחט הכפופה בסמוך לקצה, מה שמאפשר להחזיק את המזרק כמו עיפרון כשהיד מונחת על שולחן הניתוחים (איור 5B). שתי הטכניקות עובדות היטב, ובחירת הטכניקה היא העדפה אישית.- כדי להכין את המחט המכופפת, החזיקו מחט במשקל 33 גרם, 1/2 אינץ' כשהשיפוע פונה כלפי מעלה ואחזו בקצה עם דרייבר מחט סטרילי (איור 5C). כופפו את המחט בערך 30-40° ישירות לכיוון השיקוע (איור 5D).
- מלא את המזרק בנפח המתאים של התמיסה להזרקה (הקפד להסביר את חלל החלל של המחט אם הפתרון להזרקה אינו נמשך דרך המחט כדי לטעון את המזרק). חבר את המחט והסר בועות אוויר. ודא כי המניסקוס של הפתרון גלוי בשיפוע המחט.
- הזרקת תוך קרוטיד
- הדקו את קשר התפר סביב ECA. לאחר מכן, החלק את התפר התחתון על CCA כלפי מטה לכיוון שריר sternocleidomastoid ככל האפשר ולהדק את הקשר. ודא כי התפר העליון על CCA נשאר רופף עד לאחר ההזרקה. מניחים כדור צמר גפן סטרילי בקצה החלל כדי לספוג נוזלים מופרשים ודם במהלך ההזרקה.
- מחזיקים את המזרק ביד ימין ואת המלקחיים העדינים ביד שמאל, מביאים את המחט לעורק ממש מעל התפר התחתון ב- CCA. בעזרת המלקחיים העדינים, משכו בעדינות את הקצה הרופף של התפר התחתון בכיוון קאודלי כדי ליצור רמת מתח נמוכה על ה-CCA (איור 6A).
- הכניסו את המחט לתוך ה-CCA ממש מעבר לשיפוע ושחררו לאט מתח מהתפר (איור 6B).
הערה: לעורק יש זרימת דם משמעותית וסביר להניח שהוא ידמם לתוך חלל הניתוח עם החדרת המחט. עם זאת, ברגע שהמחט מוחדרת מעבר לשיפוע, העורק ייצור אטם סביב המחט והדימום ייפסק. דימום מתמשך כאשר המחט במקומה מצביע על כך שהמחט אינה רחוקה מספיק לתוך העורק (הרווח מהשיפוע מאפשר לדם לזרום) או שהמחט נדחפה דרך החלק האחורי של העורק. חשוב כעת להחזיק את המחט ללא תזוזה כדי למנוע קריעת העורק או לאפשר למחט להחליק החוצה. יש לעקוב באופן רציף אחר בעלי חיים עם אירועי דימום, ואם הדימום משמעותי (כגון כאשר בעל חיים מאבד צבע, נראה ציאנוטי, נעשה קריר למגע, או כל נקודת קצה הומנית אחרת המתוארת בפרוטוקול השימוש בבעלי חיים), יש צורך ליישם נקודות קצה אנושיות. - השתמשו ביד שמאל כדי לדחוף את בוכנה המזרק כדי להזריק את התמיסה לאט מאוד (איור 5B, לא פחות מ-15 שניות כדי להזריק 100 מיקרוליטר של תמיסה). אין להסיר את המחט בסיום הזרקת התמיסה. כדי למנוע זרימה חוזרת, עם המלקחיים העדינים ביד שמאל, אחזו את התפר העליון ב-CCA (עדיין קשור באופן רופף) על ידי הקשר והרימו כדי לעקם את העורק (איור 6C).
- מוציאים את המחט, מניחים את המזרק בצד, ומרימים מלקחיים זוויתיים ביד ימין. שמירה על הקינק בעורק, הדקו את הקשר בתפר העליון ב-CCA (איור 6D).
הערה: בשלב זה, לא אמור להיות דימום נוסף לתוך חלל הניתוח. לאחר שלב זה, קיימים שני הליכים חלופיים כמתואר בשלבים 2.7 ו- 2.8 להלן. אם יש צורך ב-CCA, בצע את שלב 2.7. אם יש לתקן את ה-CCA באתר ההזרקה, בצע את השינוי המפורט בשלב 2.8.
- קשירת CCA
- במקרים בהם אין צורך להחזיר את זרימת הדם ל-CCA, השאירו את העורק קשור, והותירו את שני התפרים מהודקים על ה-CCA. חותכים את קצות התפרים ומוודאים שקשרי התפרים מהודקים במלואם.
- המשך להליכי סגירה ושיכוך כאבים המתוארים בשלב 2.9.
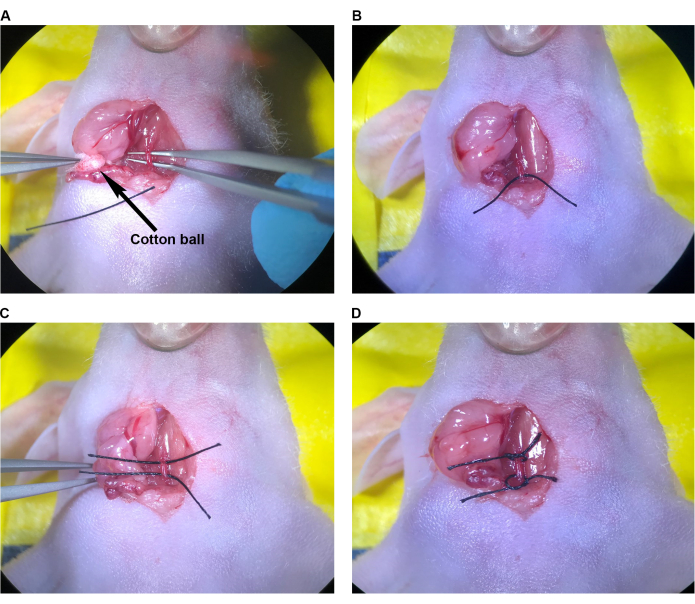
- חלופה לקשירה של CCA-Injection site תיקון ושחזור זרימת הדם
- באמצעות כדורי צמר גפן סטריליים, לספוג כל שאריות דם בתוך חלל הניתוח. אתר את אתר ההזרקה ב-CCA (איור 7A) וקבע את מספר התפרים הדרושים לסגירה. להשקות את אתר ההזרקה ואת לומן של האזור המבודד של CCA ביסודיות כדי להסיר דם קרוש.
- בעזרת המלקחיים הזוויתיים תופסים את מחט התפר 9-0 בגוף המחט קרוב לביוב. תוך שימוש במלקחיים עדינים לתמיכה בעורק מהצד הנגדי, מניחים תפר בודד ב-CCA על ידי חדירה לדופן העורק כ-1-1.5 מ"מ לרוחב לאתר ההזרקה, בניצב לעורק. החזיקו את העורק עם המלקחיים העדינים, פתחו את אתר ההזרקה והעבירו את המחט והתפר דרך צד ימין וצד שמאל בנפרד. לחלופין, החזיקו את העורק, לחצו בעדינות את הצדדים יחד עם המלקחיים העדינים, העבירו את המחט, ותפרו דרך שני צידי העורק בנשיכה אחת.
הערה: בשתי הטכניקות, היזהר שהמחט והתפר לא יחדרו את הקיר האחורי בתוך העורק מכיוון שזה יסגור את הלומן כאשר הידוק זה. - סגור את אזור ההזרקה עם קשר מנתח המבצע קשירת מכשיר עם המלקחיים העדינים והמלקחיים הזוויתיים באמצעות מינימום של ארבע זריקות (איור 7B). באופן כללי, השתמש בתפר אחד פשוט קטוע כדי לסגור את אתר ההזרקה של מחט 33 גרם.
- כדי לשחזר את זרימת הדם באמצעות המלקחיים העדינים, התירו והוציאו את התפר סביב ECA, ולאחר מכן את התפר העליון ב-CCA (איור 7C,D). לאחר מכן, לאט לשחרר את התפר התחתון על CCA אבל לא מיד להתיר. ודא שאתר ההזרקה סגור מספיק כדי למנוע דימום משמעותי עם לחץ דם וזרימה משוחזרים (איור 7D).
הערה: אם מתרחש דימום משמעותי במקום ההזרקה, ניתן להדק מחדש במהירות את התפר התחתון ב- CCA וניתן להתאים או לתפור מחדש את אתר ההזרקה במידת הצורך. - הסר את התפרים העליונים והתחתונים של CCA (איור 7E). עבור לשלב 2.9.
- סגירה ושיכוך כאבים
- מקמו מחדש את בלוטת הרוק בחלל וסגרו את החתך בשלושה תפרים פשוטים שנקטעו באמצעות חבילת תפרים סטרילית. הסר את מעצורי סרט הניתוח ואפשר לעכבר להתאושש מהרדמה על כרית חימום.
הערה: יש לתת מנות מעקב של משכך כאבים בהתאם לתדירות ולמינון שצוינו בפרוטוקול IACUC המאושר של המשתמש. מומלץ משך החלמה של שבוע בין זריקות. אם יש צורך בזריקות חוזרות, ניתן להשתמש בתיקון אתר ההזרקה לאחר ההזרקה הראשונה וניתן לבצע את אותו הליך כירורגי לזריקות הבאות. ההזרקה הבאה יכולה להינתן לתוך גולגולת CCA לאתר ההזרקה המתוקן, שכן תפירה חוזרת לתיקון אותו אתר הזרקה תוביל ככל הנראה לצלקות ולקרישי דם.
- מקמו מחדש את בלוטת הרוק בחלל וסגרו את החתך בשלושה תפרים פשוטים שנקטעו באמצעות חבילת תפרים סטרילית. הסר את מעצורי סרט הניתוח ואפשר לעכבר להתאושש מהרדמה על כרית חימום.
Representative Results
דיווחים קודמים הראו כי תאי גזע מזנכימליים אנושיים שמקורם במח עצם (BM-hMSCs) המועברים על ידי הזרקת תוך קרוטיד הוחזרו בהצלחה לגליומות תוך גולגולתיות בעכברים19. השתמשנו במודל זה כדי להשוות את ההשפעות של קשירת CCA לעומת תיקון CCA עם זרימת דם משוחזרת לאחר הזרקה תוך-קרוטיד של BM-hMSCs בעכברים נושאי גליומה. עכברים עירומים אתימיים הושתלו עם תאי גליומה U87, ולאחר מכן הזרקה של BM-hMSCs עם תווית GFP עם קשירת CCA לאחר מכן או תיקון CCA עם מחזור דם משוחזר. לאחר 3 ימים, עכברים הוקרבו ומוחות נקצרו, תוקנו, ואימונוהיסטוכימיה בוצעה כדי לזהות GFP, ותאים חיוביים ל-GFP נספרו (איור 8A-D).
הביות הכולל של GFP-BM-hMSCs לגליומות תוך גולגולתיות הוערך על ידי המספר הכולל של תאים חיוביים ל-GFP בתוך גבול הגידול בשתי שקופיות שונות (חתכים >75 מיקרומטר זה מזה) מאותה דגימה. השוואת האמצעים על ידי מבחן t לא מזווג הצביעה על כך שלא היה הבדל משמעותי בין הביות הממוצע שנצפה בין שני ההליכים (P = 0.6858) (איור 8E). פיזור GFP-BM-hMSCs לאורך הגידול הוערך על ידי ספירת תאים חיוביים ל-GFP על פני 10 שדות רבי עוצמה בתוך הגידול. מספר תאים מוגבר בתוך שדות רבי עוצמה עשוי להצביע על שינויים בפיזור התאים לאורך הגידול כתוצאה מהשונות בהליך. השוואת הערכים החציוניים באמצעות מבחן Wilcoxon Signed Rank הצביעה על כך שלא היה הבדל משמעותי בין הספירות החציוניות של תאים חיוביים ל-GFP בשדות רבי עוצמה בין קשירת CCA לקבוצות תיקון CCA (איור 8F).

איור 1: הכנת שולחן הניתוחים והעכבר לניתוח. (A,B) מיטת ניתוח (תוויות א. סרט ויניל היוצר את המיטה, ב. סרט כירורגי מעצורי גפיים קדמיות, ג. כרית, ד. משקל, ה. חרוט אף הרדמה, ו. מחזיר וו קהה, ג. תפרים בקוטר 1 ס"מ באתנול 70%, ח. מלקחיים עדינים, א. מלקחיים בעלי קצה זוויתי, י. מספריים צרים, ק. כדורי צמר גפן סטריליים). (ג,ד) מיקום העכבר. (ה,ו) אתר כירורגי וחיטוי של אתר הניתוח. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
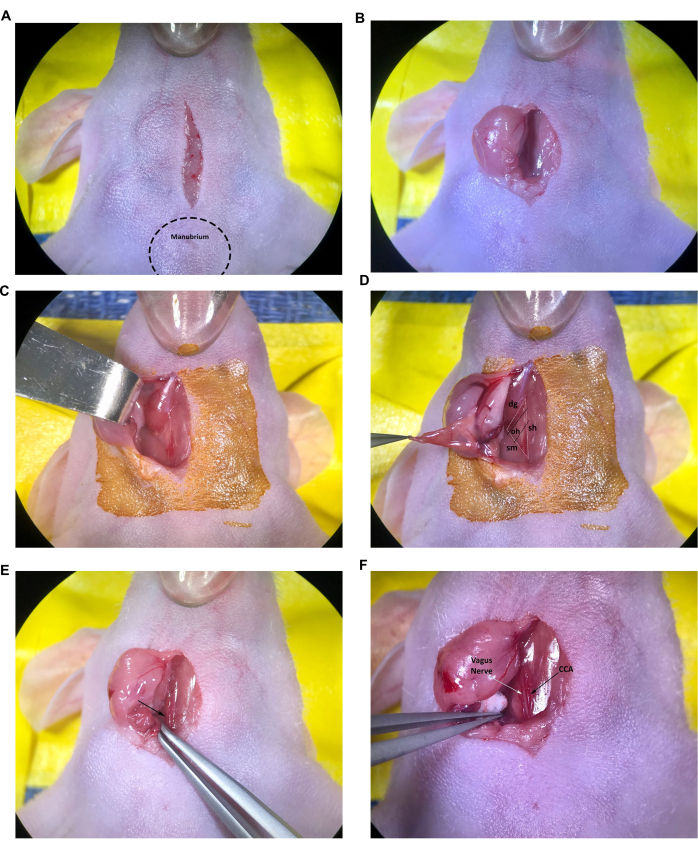
איור 2: חתך וחשיפה של מבנים באתר ההזרקה. (A) חתך בקו האמצע. (ב,ג) נסיגה של בלוטת הרוק הימנית. (D) משולש שרירי שנוצר על ידי שריר קנה הנשימה/סטרנוהיואיד, שריר הסטרנוקלידומסטואיד ושריר הקיבה, שריר אומוהיואיד נראה גם כן. (E) עורק התרדמה המשותף, המסומן על ידי החץ. (F) עצב הואגוס ועורק התרדמה המשותף, המסומנים על ידי החיצים. קיצורים: sh = קנה הנשימה/שריר סטרנוהיואיד; SM = שריר sternocleidomastoid ; dg = שריר קיבה; הו = שריר אומוהיואיד; CCA = עורק התרדמה המשותף. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
איור 3: הכנת CCA להזרקה. (A) מלקחיים זוויתיים שעברו תחת CCA. (B) התפר נמשך באמצע הדרך מתחת ל-CCA באמצעות מלקחיים בעלי קצה זוויתי. (C) התפר השני נמשך באמצע הדרך מתחת ל-CCA. (ד) תפור קשור בידע רופף סביב CCA. קיצור: CCA = עורק התרדמה המשותף. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
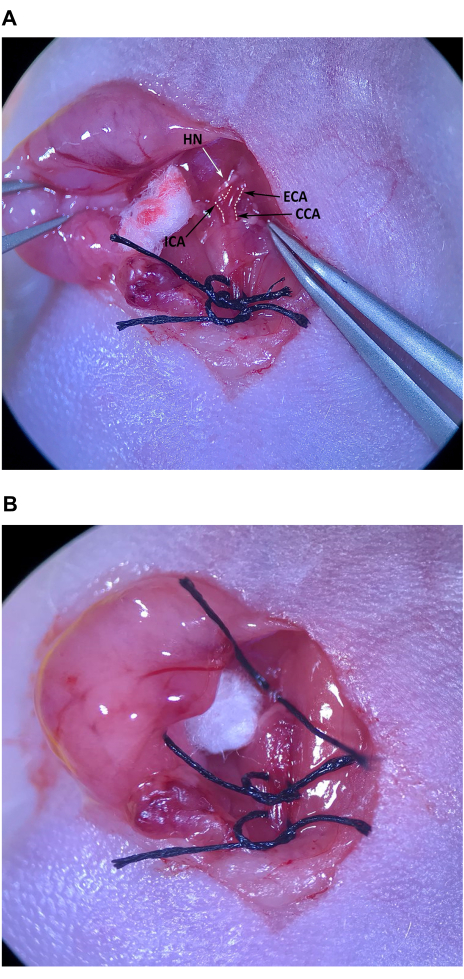
איור 4: בידוד והכנה של עורק התרדמה החיצוני. (A) CCA, עורק התרדמה החיצוני ועורק התרדמה הפנימי. (B) תפר שנמשך באמצע הדרך מתחת ל-ECA. קיצורים: CCA עורק התרדמה המשותף; ECA = עורק התרדמה החיצוני; ICA = עורק התרדמה הפנימי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
איור 5: הכנת מחט ומזרק. (A) הזרקה עם מחט ישרה עם מזרק מונח על גוף העכבר. (B) הזרקה עם מחט כפופה, עם יד מונחת על שולחן הניתוחים. (ג,ד) הכנת מחט כפופה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
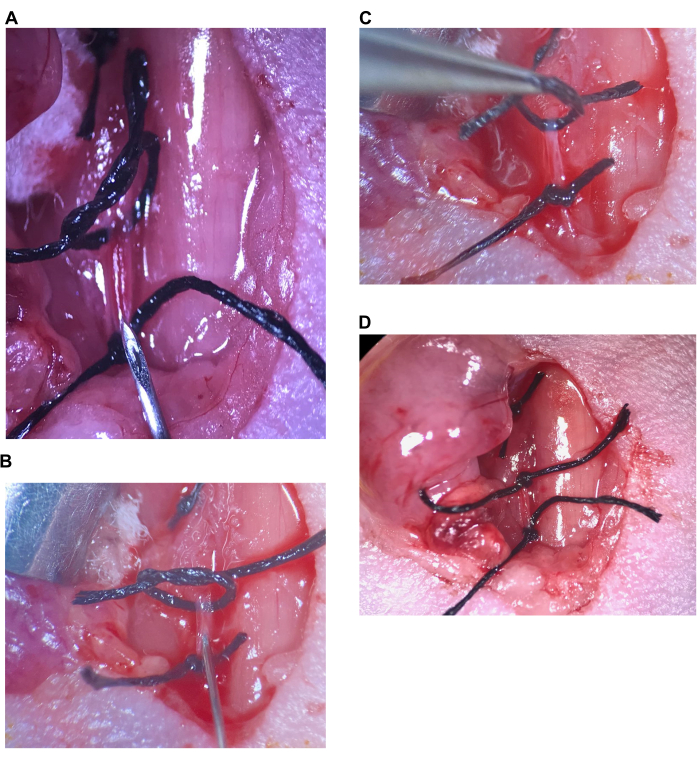
איור 6: הזרקה תוך-קרוטידית. (A) התפר העליון רופף, התפר התחתון מהודק על CCA, המחט ממוקמת מעל התפר התחתון. (B) המחט מוחדרת ממש מעבר לשיפוע, העורק אטום סביב המחט. (C) התפר העליון מורם כדי לסובב את העורק כלפי מעלה ולמנוע זרימה חזרה. (D) התפר העליון ב-CCA מהודק. קיצור: CCA = עורק התרדמה המשותף. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
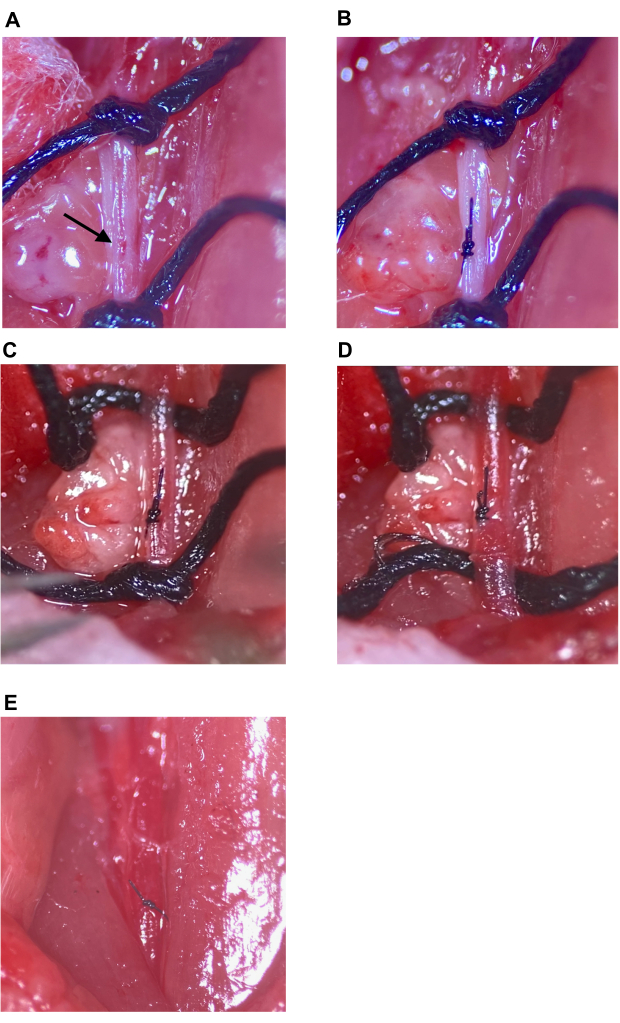
איור 7: תיקון אתר ההזרקה ושחזור זרימת הדם. (A) אתר ההזרקה המסומן בחץ. (B) מקום ההזרקה נסגר בקשר מנתח, לפחות ארבע זריקות. (ג,ד) התרופפות התפרים העליונים והתחתונים ב- CCA לאחר תיקון אתר ההזרקה; לא נראה דימום לאחר התרופפות התפר. (ה) התפרים מוסרים לאחר שנקבע כי מקום ההזרקה תוקן במידה מספקת. קיצור: CCA = עורק התרדמה המשותף. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
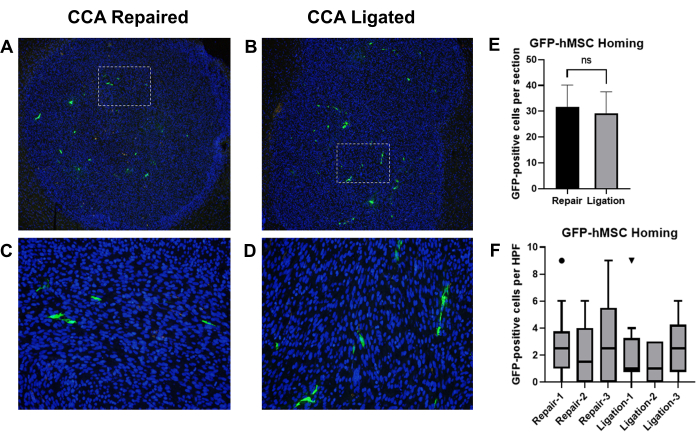
איור 8: הזרקה תוך-קרוטית של GFP-BM-hMSCs והשוואת ביות לגידולי גליומה תוך גולגולתיים לאחר קשירת CCA או תיקון CCA עם מחזור דם משוחזר. חלקי רקמת מוח של עכברים נושאי גידול הוכתמו בנוגדנים משניים נגד GFP ראשוני ו-Alexa Fluor 488 כדי לסמן GFP-BM-hMSCs (ירוק). גרעינים הוכתמו ב-Hoechst 33342 (כחול). שדות מייצגים בהספק נמוך של מקטעים מסומנים המציגים ביות כולל לגידול ושדות בעלי עוצמה גבוהה המציגים התפלגות תאים חיובית GFP לאחר (A,C) תיקון CCA או (B,D) קשירת CCA. (E) הביות הכולל של GFP-BM-hMSCs לגידולים הוערך על ידי המספר הכולל של תאים חיוביים ל-GFP בתוך גבולות הגידול בשתי שקופיות ואמצעים שונים הושוו על ידי מבחן t. לא נצפה הבדל משמעותי בביות הכולל בין ההליכים החלופיים (P = 0.6858). (F) פיזור של GFP-BM-hMSCs לאורך הגידול הוערך על ידי ספירת תאים חיוביים ל-GFP על פני 10 שדות רבי עוצמה בתוך הגידול. השוואת הערכים החציוניים על ידי מבחן Wilcoxon Signed Rank מצביעה על כך שאין הבדל משמעותי בין אנשים, ללא קשר להליך (P = 0.1914, 0.5000, 0.1641, 0.9512, 0.8828, 0.2207). קיצורים: GFP = חלבון פלואורסצנטי ירוק; GFP-BM-hMSCs = תאי גזע מזנכימליים אנושיים שמקורם במח עצם שמקורם במח עצם; CCA = עורק התרדמה המשותף. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
זריקות עורק התרדמה שימשו יותר ויותר בשנים האחרונות כדי לספק טיפולים לגידולי מוח. כתוצאה מכך, חשוב לבסס מודלים עכבריים המשקפים הזרקות עורק תוך התרדמה בבני אדם למטרות מחקר. בעבר, זריקות עורק התרדמה בעכברים בוצעו עם קשירה עוקבת של העורק, אשר מגביל את מספר הזריקות לתוך העורק11,12. בנוסף, חסימה של עורק התרדמה בעכברים עלולה להוביל לאיסכמיה מוחית בזני עכברים מסוימים שאין להם מעגל שלם של וויליס13. פיתחנו שיטה לתיקון עורק התרדמה המוזרק כדי להתגבר על מגבלות השיטות הקודמות. תיקון אתר ההזרקה מביא לביסוס מחדש של זרימת הדם לעורק המוזרק, מקטין את הסיכוי לאיסכמיה מוחית ומקל על זריקות עוקבות לאותו עורק התרדמה הפנימי.
מספר צעדים, שהם קריטיים להצלחה, דורשים טיפול זהיר של כלי ניתוח או רקמות, הכוללים: החדרת המחט כראוי לתוך לומן של העורק כדי למנוע דימום במהלך הזרקת intracarotid; דיסקציה זהירה של רקמת החיבור מאתר ההזרקה לפני החדרת המחט; הסרת כל הגושים ובועות האוויר במזרק ובמחט לפני ההזרקה; וסגירה נכונה של אתר ההזרקה כדי למנוע סגירה של לומן העורק במהלך התיקון. כדי למנוע דימום לאחר החדרת המחט, ודא שהמחט מוחדרת לעורק מעבר לשיפוע כדי ליצור אטם סביב מוט המחט. כדי למנוע קרע בדופן האחורית של העורק, הכנס את המחט בזווית רדודה וניער בעדינות את המזרק והמחט בחזרה כדי לשמור על קצה המחט נקי מהדופן האחורית של העורק. אם התמיסה המוזרקת דולפת החוצה במהלך ההזרקה, הדבר מצביע על כך שהמחט הוחדרה רק לרקמת החיבור המקיפה את העורק; דיסקציה זהירה של רקמת החיבור העודפת מאתר ההזרקה לפני ההזרקה תמנע בעיה זו.
לגבי בחירת טכניקת התפר והסגירה, אם ההזרקה הראשונית השתמשה במחט 33 גרם וביצעה החדרה נקייה לעורק, די בתפר אחד פשוט עם תפר 9-0 כדי לתקן את העורק. אם משתמשים במחט גדולה יותר להזרקה (30 גרם וכו') או אם מתרחשת קריעה כלשהי בעת החדרת המחט (למשל, כאשר המחט לא במרכז או שהעורק זז כי העכבר נושם), התוצאה היא חור מעט גדול יותר שצריך לתקן. שני תפרים פשוטים או דמות של שמונה מספיקים בדרך כלל כדי לתקן סוג זה של חור גדול יותר. הבחירה בין שתי הטכניקות הללו מבוססת על העדפת המנתח במצב זה. חשוב לציין כי טכניקת התיקון לא נבדקה במצבים בהם החור באתר ההזרקה גדול משמעותית מאשר במצב שהוזכר לעיל. אם הקרע באתר ההזרקה משתרע לרוחב (יצירת חור רחב יותר, הגדול משליש מהיקף העורק), תיקון בשיטה זו עלול לגרום להתכווצות העורק ולסיכון מוגבר לפקקת.
אם יש דימום מאתר ההזרקה המתוקן בעת הסרת התפרים, זה יכול להיות בגלל מתיחה של האתר המתוקן כמו זרימת הדם הרגילה מתחדשת; ניתן לתקן זאת על ידי כיסוי עדין של אתר ההזרקה המתוקן בכותנה סטרילית והפעלת לחץ קל למשך 30 שניות. לחילופין, אם יש דימום מאתר ההזרקה המתוקן ללא זרימת דם נראית לעין ועורק פרוקסימלי נפוח, הדבר מעיד על כך שמחט התפר עברה דרך הדופן האחורית של העורק במהלך התיקון. במקרה זה, פתחו בעדינות את קצוות אתר ההזרקה במהלך התיקון, העבירו את מחט התפר דרך העורק בזווית רדודה, וודאו ויזואלית שהתפר לא עבר דרך הדופן האחורית לפני קשירת קשר התפר.
עם אמצעים אלה, השיטה של תיקון אתר ההזרקה היא מדויקת וחוזרת על עצמה על פני קבוצות של בעלי חיים ללא קשר לרקע גנטי או גיל. מניסיוננו, אחוזי ההצלחה היו 100% עם שלושה מנתחים שונים שביצעו את ההליך. עם ניסיון הולם ומעקב אחר הפרוטוקול שסופק בקפידה, איננו צופים כל קושי למנתחים אחרים לבצע הליך זה. עם תרגול, מנתח מיומן יכול להשלים את ההליך בתוך 15-20 דקות. אם הניסוי מאפשר זאת, ניתן גם לקצר את הזמן לכל חיה על ידי השארת התפרים העליונים והתחתונים של CCA ללא פגע, תוך ויתור על תיקון אתר ההזרקה. עם זאת, כפי שצוין לעיל, תועדו הבדלים ספציפיים לזן באנטומיה של כלי הדם במוח וחשוב לוודא כי זן העכבר המשמש בהליך יכול לסבול זאת לפני תחילת הניסוי.
מכיוון שמדובר בהליך כירורגי, יש לקחת בחשבון את התאוששות העכברים. עמידות ללחץ והתאוששות מפצעים הם שיקולים חשובים שישתנו עם זני עכברים שונים. בנוסף, דלקת באתר הניתוח והיווצרות רקמת צלקת עשויים להאריך את זמן ההחלמה לאחר ניתוחים חוזרים. ביצענו בהצלחה זריקות מרובות בהפרש של 7 ימים, אך אם יש צורך בזריקות תכופות יותר, יש להעריך אותן בזהירות בזני העכבר הספציפיים שבהם יש להשתמש. טיפול בכוח ולחץ על ה-CCA (במהלך בידוד, קשירה והסרה של תפרים והזרקות) עלולים לפגוע ולהחליש את דפנות העורקים ולהוביל לקריעה במהלך הזרקות חוזרות. חשוב למזער את הדיסקציה של רקמת החיבור התומכת סביב CCA וביפורקציה ולהימנע מהפעלת מתח יתר על העורק.
התוצאות שלנו מצביעות על כך שבמודל ספציפי זה, קשירת CCA או תיקון CCA עם מחזור דם משוחזר לאחר הזרקה אינם שונים בתדירות הביות הכוללת או בפיזור של BM-hMSCs מוזרקים על פני גידולים תוך גולגולתיים. בעוד שזה עשוי להשתנות בזני עכברים שונים, השימוש בתיקון אתר ההזרקה מציע את היתרון של החזרת זרימת הדם לעורק המוזרק, המאפשר זריקות עוקבות לאותו עורק, וחשוב מכך, דומה לזריקות תוך קרום העורק בחולים אנושיים. הבחירה בין קשירה לעומת תיקון העורק המוזרק מבוססת על סוג הניסוי ומודל העכבר בו נעשה שימוש. אם יש צורך בזריקה שנייה, או אם לדגם העכבר אין מעגל שלם של וויליס, יש להשתמש בתיקון אתר ההזרקה. היכולת להזריק מחדש את CCA במודלים עכבריים יכולה להקל על מניפולציה ניסיונית נוספת. לדוגמה, כדי לבדוק מינונים מרובים של טיפול פוטנציאלי שניתן לאורך זמן, תיקון העורק המוזרק חיוני לביצוע זריקות הבאות. שיטה זו תהיה שימושית גם בניסויים הכוללים הזרקה של שילובים של חומרים טיפוליים שיש להזריק בזמנים שונים. הגמישות המוגברת בזריקות תוך קרוטיד המתאפשרות על ידי תיקון העורק המוזרק משפרת את התועלת התרגומית של מודלים של גידולי מוח בעכבר.
Disclosures
למחברים אין גילויים/ניגודי עניינים רלוונטיים.
Acknowledgements
מחקר זה נתמך על ידי מענקים מהמכון הלאומי לסרטן (R01CA115729, R01CA214749 ו- 1P50 CA127001) ועל ידי התרומות הפילנתרופיות הנדיבות לתוכנית™ צילומי הירח של מרכז הסרטן ע"ש מ.ד. אנדרסון באוניברסיטת טקסס, קרן ברואץ' לחקר סרטן המוח, קרן משפחת אליאס לחקר גידולי המוח, הקרן לחקר הסרטן ע"ש פריסילה היילי, הקרן לחקר סרטן המוח ע"ש משפחת באומן, קרן Chuanwei Lu, הקרן לחקר סרטן המוח של המשפחה המתוקה, הקרן לחקר הסרטן ע"ש איירה שניידר, קרן ג'ים ופאם האריס, קרן ג'ין פנבייקר לחקר סרטן המוח, קרן סורנסון לחקר גידולי המוח, קרן הזיכרון של בריאן מק'קולוך, קרן TLC מהלב וקרן מרי האריס פאפאס לחקר גליובלסטומה, הכל לפ.פ.ל.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL syringes (low dead space) | Air-tite Products Co. | A1 | |
| 26 G; 1/2" needle | Air-tite Products Co. | N2612 | |
| 33 G; 1/2" needle | JBP, Air-tite Products Co. | JBP3313B | |
| 3 cm Petri dish | Falcon, Fisher Scientific | 08-772A | |
| 3M durapore surgical tape | Fisher Scientific | 19-071-152 | |
| 6-0 suture thread | Fine Science Tools | 18020-60 | |
| 70% Ethanol | Fisher Scientific | 04-355-122 | |
| 9-0 microsurgical suture with needle | Fine Science Tools | 12052-09 | |
| Analgesic for major surgery | |||
| Artificial tears/ophthalmic ointment | Covetrus | 8897 | |
| Bead Sterilizer | Fisher Scientific | 14-955-341 | |
| Betadine/Chlorhexidine | McKesson, Fisher Scientific | NC1696484 | |
| Blunt hook retractor | Fine Science Tools | 17022-13 | |
| Dissecting microscope | Zeiss Microscopy, LLC | 491903-0010-000 | |
| Electric heating pad | Insource, Fisher Scientific | NC0667724 | |
| Extra narrow scissors | Fine Science Tools | 14088-10 | |
| Fine forceps - Dumont #5 forceps with micro-blunted tips | Fine Science Tools | 11253-20 | |
| Fine forceps - Dumont #5/45 angled tip forceps with micro-blunted tips | Fine Science Tools | 11253-25 | |
| Isoflurane vaporizer (or Ketamine/Xylazine cocktail) | Kent Scientific | VetFlo-1231 | |
| Light source | Laxco, Fisher Scientific | AMPSILED21 | |
| Mouse anesthesia nose cone | Braintree Scientific, Inc | XENO- M | |
| Needle driver | Fine Science Tools | 12002-12 | |
| Sterile cotton swabs | Texwipe, Fisher Scientific | 18-366-472 | |
| Sterile gauze pads | Covidien, Fisher Scientific | 22-037-907 | |
| Sterile saline (0.9%) | KD Medical, Fisher Scientific | 50-103-1363 | |
| Sterile surgical drapes | Fisher Scientific | 50-129-6666 | |
| Sterile surgical/downdraft table | |||
| Sterile suture pack (any suitable diameter for mouse wound closure) | Ethicon, Fisher Scientific | 50-209-2811 | |
| Surgical tools | |||
| Vinyl lab tape | Fisher Scientific | 15-901 |
References
- Loya, J., Zhang, C., Cox, E., Achrol, A. S., Kesari, S. Biological intratumoral therapy for the high-grade glioma part i: Intratumoral delivery and immunotoxins. CNS Oncol. 8 (3), (2019).
- Garfield, J., Dayan, A. D. Postoperative intracavitary chemotherapy of malignant gliomas. A preliminary study using methotrexate. J Neurosurg. 39 (3), 315-322 (1973).
- Kroin, J. S., Penn, R. D. Intracerebral chemotherapy: Chronic microinfusion of cisplatin. Neurosurgery. 10 (3), 349-354 (1982).
- Sendelbeck, S. L., Urquhart, J. Spatial distribution of dopamine, methotrexate and antipyrine during continuous intracerebral microperfusion. Brain Res. 328 (2), 251-258 (1985).
- Alter, R. A., et al. Long-term benefit of intra-arterial bevacizumab for recurrent glioblastoma. J Exp Ther Oncol. 12 (1), 67-71 (2017).
- Angelov, L., et al. Blood-brain barrier disruption and intra-arterial methotrexate-based therapy for newly diagnosed primary cns lymphoma: A multi-institutional experience. J Clin Oncol. 27 (21), 3503-3509 (2009).
- Chen, S. R., Chen, M. M., Ene, C., Lang, F. F., Kan, P. Perfusion-guided endovascular super-selective intra-arterial infusion for treatment of malignant brain tumors. J Neurointerv Surg. 14 (6), 533-538 (2022).
- Faltings, L., et al. Rechallenging recurrent glioblastoma with intra-arterial bevacizumab with blood brain-barrier disruption results in radiographic response. World Neurosurg. 131, 234-241 (2019).
- Srinivasan, V. M., et al. Advances in endovascular neuro-oncology: Endovascular selective intra-arterial (esia) infusion of targeted biologic therapy for brain tumors. J Neurointerv Surg. 12 (2), 197-203 (2020).
- Shinojima, N., et al. Tgf-β mediates homing of bone marrow-derived human mesenchymal stem cells to glioma stem cells. Cancer Res. 73 (7), 2333-2344 (2013).
- Liu, Z., et al. Improving orthotopic mouse models of patient-derived breast cancer brain metastases by a modified intracarotid injection method. Scientific Reports. 9 (1), 622 (2019).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid cancer cell injection to produce mouse models of brain metastasis. Journal of visualized experiments : JoVE. (120), e55085 (2017).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse strain differences in susceptibility to cerebral ischemia are related to cerebral vascular anatomy. J Cereb Blood Flow Metab. 13 (4), 683-692 (1993).
- Benbenishty, A., et al. Maintaining unperturbed cerebral blood flow is key in the study of brain metastasis and its interactions with stress and inflammatory responses. Brain, behavior, and immunity. 62, 265-276 (2017).
- Doucette, T., et al. Mesenchymal stem cells display tumor-specific tropism in an rcas/ntv-a glioma model. Neoplasia. 13 (8), 716-725 (2011).
- Hata, N., et al. Platelet-derived growth factor bb mediates the tropism of human mesenchymal stem cells for malignant gliomas. Neurosurgery. 66 (1), 144-156 (2010).
- Nakamizo, A., et al. Human bone marrow-derived mesenchymal stem cells in the treatment of gliomas. Cancer Res. 65 (8), 3307-3318 (2005).
- Qiao, Y., et al. Magnetic resonance and photoacoustic imaging of brain tumor mediated by mesenchymal stem cell labeled with multifunctional nanoparticle introduced via carotid artery injection. Nanotechnology. 29 (16), 165101 (2018).
- Yong, R. L., et al. Human bone marrow-derived mesenchymal stem cells for intravascular delivery of oncolytic adenovirus delta24-rgd to human gliomas. Cancer Res. 69 (23), 8932-8940 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved