Facilitando injeções intracarotídeas repetidas em modelos de camundongos por uma nova técnica de reparo no local da injeção
In This Article
Summary
O reparo da artéria intracarótida em um modelo de camundongo após a injeção retorna o fluxo sanguíneo para a artéria sem afetar negativamente a distribuição do material injetado. O reparo no local da injeção facilita as injeções subsequentes através da mesma artéria e previne a isquemia cerebral em cepas de camundongos que não possuem um Círculo de Willis completo.
Abstract
Dados os recentes avanços na administração de novas terapias antitumorais usando métodos de entrega intra-arterial seletiva endovascular em neuro-oncologia, há uma necessidade urgente de desenvolver métodos para injeções intracarotídeas em modelos de camundongos, incluindo métodos para reparar a artéria carótida em camundongos após a injeção para permitir injeções subsequentes. Desenvolvemos um método de injeção intracarotídea em um modelo de camundongo para administrar terapêutica na artéria carótida interna (ACI) com dois procedimentos alternativos.
Durante a injeção, a agulha é inserida na artéria carótida comum (CCA) após amarrar uma sutura ao redor da artéria carótida externa (ECA) e a terapêutica injetada é administrada na ACI. Após a injeção, a artéria carótida comum (CCA) pode ser ligada, o que limita o número de injeções intracarotídeas a uma. O procedimento alternativo descrito neste artigo inclui uma modificação em que a injeção da artéria intracarótida é seguida pelo reparo do CCA no local da injeção, que restaura o fluxo sanguíneo dentro do CCA e evita a complicação da isquemia cerebral observada em alguns modelos de camundongos.
Também comparamos a entrega de células-tronco mesenquimais humanas derivadas da medula óssea (BM-hMSCs) a tumores intracranianos quando administradas por injeção intracarotídea com e sem reparo no local da injeção após a injeção. A administração de BM-hMSCs não difere significativamente entre os métodos. Nossos resultados demonstram que o reparo do local de injeção do CCA permite injeções repetidas pela mesma artéria e não prejudica a entrega e distribuição do material injetado, proporcionando assim um modelo com maior flexibilidade que emula mais de perto a injeção intracarotídea em humanos.
Introduction
A administração terapêutica para tumores cerebrais é desafiadora devido à impermeabilidade da barreira hematoencefálica (BHE) e da barreira hematotumoral (BTB). A injeção intratumoral direta de terapêutica para contornar a BHE pode ser obtida por meio do uso de um cateter-reservatório de Ommaya, microinfusão de baixo fluxo para entrega com convecção ou injeção local na cavidade de ressecção ou tecido adjacente1. No entanto, o volume total de tecido tumoral que é atingido com esses métodos é limitado 2,3,4. As injeções intra-arteriais foram usadas anteriormente para fornecer agentes terapêuticos a tumores cerebrais com o objetivo de atingir mais do tumor 5,6,7,8 e, nos últimos tempos, os avanços nas técnicas de entrega intra-arterial e novos agentes terapêuticos demonstraram o benefício do uso dessa abordagem no tratamento de tumores cerebrais7, 9. Esses avanços incluem o desenvolvimento de microcateteres, administração intra-arterial seletiva endovascular (ESIA) com imagens avançadas, o uso de agentes osmóticos para interromper a BHE e a BTB e o desenvolvimento de terapias biológicas direcionadas. Portanto, para realizar testes pré-clínicos de novos agentes terapêuticos administrados por meio de injeções intra-arteriais, são necessários modelos de pesquisa translacional apropriados 9,10.
Em modelos de tumores cerebrais em camundongos, os agentes terapêuticos administrados por via intraperitoneal ou intravenosa (através da veia da cauda) passam pelo fígado ou pelo coração e pulmões, respectivamente, antes de serem distribuídos por todo o corpo, incluindo o cérebro. Esses efeitos de primeira passagem podem aprisionar e remover o agente, ou diluir o agente antes de atingir o cérebro, e podem apresentar toxicidades limitantes da dose antes de atingir uma dose terapêutica no cérebro. Em contraste, a injeção da artéria intracarotídea permite a entrega focada no cérebro antes da circulação, ignorando o metabolismo de primeira passagem e limitando a entrega fora do alvo. Embora a injeção intracarotídea em camundongos seja mais trabalhosa, a especificidade e a reprodutibilidade da técnica resultam em redução do número de animais para completar as investigações11,12.
Em geral, nos métodos previamente descritos de injeção da artéria intracarótida em camundongos, a artéria carótida comum é ligada após a injeção e a circulação para o cérebro é fornecida pela artéria carótida contralateral e pela circulação cerebral posterior através do círculo de Willis11,12. Este método tem a limitação inerente de permitir apenas um máximo de uma única injeção na artéria carótida interna ou externa. Também é fundamental que as cepas de camundongos usadas em experimentos em que a artéria carótida é ligada tenham um Círculo de Willis completo para prevenir a isquemia cerebral devido à artéria ligada13. A oclusão da artéria carótida também demonstrou reduzir o fluxo sanguíneo cerebral e limitar a distribuição das partículas injetadas14. Além disso, a oclusão da artéria carótida em camundongos após a injeção não emula a injeção da artéria intracarótida em pacientes humanos.
Nosso grupo já usou injeções de artéria intracarotídea para entregar com sucesso células-tronco mesenquimais ao cérebro 10,15,16,17,18,19. Neste artigo, descrevemos detalhadamente esse método de injeção da artéria intracarótida e incluímos uma modificação do método que desenvolvemos, no qual o local da injeção é reparado sem ocluir a artéria, evitando as limitações impostas pela ligadura da artéria carótida pós-injeção. Neste método, a artéria carótida comum (ACC) é preparada para injeção colocando duas suturas, uma em cada extremidade do local de injeção pretendido, e a sutura inferior (abaixo do local da injeção) é apertada. A artéria carótida externa (ECA) é selada com outra sutura. A agulha é inserida na ACC e a terapêutica é administrada na artéria carótida interna (ACI). Em seguida, a sutura superior do CCA é apertada para evitar o refluxo do ICA. Nesta etapa, o CCA injetado pode ser ligado ou reparado. Se o CCA for ligado, as suturas são apertadas e deixadas no lugar. Se o local da injeção for reparado, as suturas são removidas após o reparo e o fluxo sanguíneo é restaurado. Os detalhes desses procedimentos alternativos são fornecidos abaixo.
Protocol
Todas as etapas descritas abaixo estão em conformidade com nosso protocolo, que segue as diretrizes estabelecidas e aprovadas pelo Comitê Institucional de Cuidados e Uso de Animais do MD Anderson Cancer Center da Universidade do Texas.
1. Preparação da mesa cirúrgica e do mouse para o procedimento cirúrgico
- Preparação da mesa cirúrgica e do mouse para o procedimento cirúrgico (consulte a Figura 1A,B)
- Disponha o microscópio de dissecação e a fonte de luz na frente do vaporizador de isoflurano com um sistema de limpeza ativo ou coloque em uma mesa de corrente descendente. Coloque a almofada de aquecimento elétrico na base do microscópio de dissecação (ou de preferência sob o microscópio se a base for sólida e puder transmitir calor) e cubra com uma cortina cirúrgica estéril.
NOTA: Todas as ferramentas cirúrgicas e campos cirúrgicos devem ser esterilizados em autoclavagem antes do uso e todos os descartáveis devem ser estéreis e embalados individualmente. Luvas estéreis devem ser usadas durante toda a configuração e procedimento e trocadas quando necessário para manter a esterilidade. - Prepare a cama (4-5" de comprimento x 2" de largura) na cortina cirúrgica usando fita adesiva de vinil. Corte um quadrado de gaze de 1,5 polegadas x 1,5 polegadas, enrole-o firmemente e coloque a gaze enrolada sob um pedaço de fita de vinil de 3 polegadas na "cabeceira" da cama para formar um travesseiro (a inclinação da cabeça com o uso de um travesseiro permite uma maior extensão da área ventral do pescoço).
- Coloque pedaços de fita cirúrgica de 4 polegadas ao longo das laterais da cama (em cima da fita de vinil). [Se estiver usando isoflurano, coloque um cone nasal de anestesia com peso (ou fita) preso perto da cabeceira da cama. Ajuste-o para posicionamento específico assim que o mouse estiver anestesiado e contido.] Veja a Figura 1A,B.
- Usando uma chave de agulha ou uma pinça pesada, rasgue pequenos pedaços de algodão de um cotonete e enrole em bolas de vários tamanhos de 0,5 a 1 mm de diâmetro (8 a 10 pedaços de algodão por mouse). Mantenha o algodão na cortina cirúrgica perto da cabeceira da cama.
- Usando instrumentos estéreis, corte o fio de sutura 6-0 em pedaços de 1 cm (3-4 pedaços por mouse). Coloque os comprimentos de sutura preparados em uma cortina estéril. Prepare uma seringa de 1 mL para administração de buprenorfina ou outro analgésico adequado (conforme aprovado pelo protocolo do Comitê Institucional de Cuidados e Uso de Animais [IACUC]). Esterilize todas as ferramentas cirúrgicas de acordo com os padrões da IACUC antes de colocá-las no campo estéril.
- Disponha o microscópio de dissecação e a fonte de luz na frente do vaporizador de isoflurano com um sistema de limpeza ativo ou coloque em uma mesa de corrente descendente. Coloque a almofada de aquecimento elétrico na base do microscópio de dissecação (ou de preferência sob o microscópio se a base for sólida e puder transmitir calor) e cubra com uma cortina cirúrgica estéril.
- Preparação do camundongo para o procedimento cirúrgico (consulte a Figura 1C-F)
- Anestesiar um camundongo seguindo os métodos aprovados pela IACUC para grandes cirurgias de sobrevivência (usar isoflurano 1%-4%, com base na sensibilidade de camundongos individuais, ou um coquetel de 10 mg/mL de cetamina, 1 mg/mL de xilazina a 100-200 mg/kg (cetamina) de peso corporal). Corte o pelo ou depile, se necessário. Administre 0,5-1,0 mg/kg de buprenorfina ER (liberação prolongada) por injeção subcutânea 30 minutos antes do início do procedimento cirúrgico.
- Posicione o mouse anestesiado de forma que o travesseiro fique sob o pescoço (Figura 1C). O travesseiro ajuda a estender e apoiar o pescoço quando usado com o cone nasal de anestesia. Se estiver usando o coquetel de cetamina / xilazina, coloque uma barra de dente pesada ou ferramenta semelhante na boca, atrás dos incisivos para inclinar a cabeça e estender o pescoço.
- Conter os membros torácicos com a fita cirúrgica previamente colocada nas laterais do leito cirúrgico (Figura 1D). Ajuste a posição do mouse sob o microscópio para que a superfície ventral do pescoço fique à vista e ajuste a ampliação para observar confortavelmente o local da cirurgia (Figura 1E).
NOTA: A ampliação do microscópio de dissecação deve ser ajustada pelo cirurgião ao seu nível de conforto para cada etapa. - Aplique lágrimas artificiais usando um cotonete estéril. Desinfete o local da cirurgia alternando swabs circulares de betadina ou clorexidina e álcool três vezes por desinfetante (Figura 1F).
- Confirme a profundidade da anestesia, garantindo que o mouse não retraia a perna em resposta a um beliscão no dedo do pé. Monitore a frequência respiratória e certifique-se de que o camundongo não esteja ofegante, pois isso é uma indicação de anestesia excessiva ao usar isoflurano. Se necessário, ajuste as taxas de fluxo de oxigênio e isoflurano para atingir a profundidade anestésica adequada e até mesmo a respiração.
2. Procedimento cirúrgico (Figura 2, Figura 3, Figura 4, Figura 5, Figura 6 e Figura 7)
- Incisão primária e dissecção
- Comece fazendo uma incisão longitudinal de 1 cm na linha média, começando apenas cranialmente ao manúbrio (nódulo saliente na extremidade cranial do esterno) e continuando sobre a traqueia usando uma lâmina de bisturi estéril ou instrumento semelhante seguindo as diretrizes IACUC aprovadas pelo usuário (Figura 2A).
- Insira a ponta da tesoura fechada na incisão e abra-a suavemente para realizar a dissecção romba do tecido conjuntivo subcutâneo, separando as duas glândulas salivares. Com a pinça fina, puxe suavemente a glândula salivar direita através da incisão para descansar na superfície da pele preparada assepticamente ou retraia a glândula salivar lateralmente usando o afastador de gancho rombudo (Figura 2B, C). Se a glândula exteriorizada parecer seca ou pegajosa, umedeça com solução salina estéril.
- Continue a dissecção romba do tecido conjuntivo até que os músculos esternocleidomastóideo e digástrico estejam visíveis (Figura 2D).
NOTA: O triângulo muscular formado pelo músculo traqueia/esterno-hióideo (sh), músculo esternocleidomastóideo (sm) e músculo digástrico (dg) (ventre caudal) será utilizado para localizar a ACC direita e a bifurcação da artéria carótida no protocolo. Em geral, o músculo omo-hióideo menor (oh) também pode ser visto transversalmente ao longo da ACC (Figura 2D); No entanto, esse músculo varia em tamanho e não é incomum que o músculo omo-hióideo esteja totalmente ausente em camundongos jovens ou pequenos.
- Isolamento CCA
- Usando a pinça de ponta angular, continue a dissecção cuidadosa do tecido conjuntivo (abrindo as pontas da pinça) perto da extremidade caudal do triângulo muscular para expor a artéria carótida comum, a veia jugular e o nervo vago.
NOTA: A artéria carótida comum é o maior vaso sanguíneo adjacente à traqueia e geralmente pode ser facilmente identificada na base do triângulo muscular (Figura 2E, seta). Tenha muito cuidado com as pinças finas ao redor dos vasos sanguíneos, pois as pontas podem facilmente cortar os vasos, resultando em sangramento excessivo e potencialmente letal. - Continue a dissecção cuidadosa do tecido conjuntivo ao redor da porção da artéria carótida comum da base do triângulo muscular até o músculo omo-hióideo. Use as pequenas bolas de algodão estéreis para controlar qualquer sangramento menor e absorver os fluidos secretados das glândulas salivares conforme necessário.
- Disseque cuidadosamente o tecido conjuntivo para separar o CCA do nervo vago. Tome cuidado especial para minimizar o manuseio e os danos ao nervo vago, facilmente identificado como o feixe nervoso espesso e branco adjacente ao CCA (Figura 2F).
- Usando a pinça de ponta angular, continue a dissecção cuidadosa do tecido conjuntivo (abrindo as pontas da pinça) perto da extremidade caudal do triângulo muscular para expor a artéria carótida comum, a veia jugular e o nervo vago.
- Preparação do CCA
- Uma vez que a CCA tenha sido completamente mobilizada do músculo esternocleidomastóideo, e quando visível, até o músculo omo-hióideo, coloque um pedaço de sutura 6-0 de 1 cm na pele assepticamente preparada do esterno do camundongo (para facilitar a recuperação) e passe a pinça de ponta angulada sob a CCA (tomando cuidado para isolar a CCA do nervo vago e da veia jugular) (Figura 3A). Se o músculo omo-hióideo não estiver presente, limpe a área ao redor do CCA o suficiente para poder colocar suturas no CCA, cranial e caudal ao local de injeção proposto, e inserir a agulha.
- Com a pinça fina na mão esquerda, passe a sutura para a pinça de ponta angular, segurando perto do final da sutura. Puxe suavemente metade do comprimento da sutura sob o CCA com a pinça de ponta angulada (Figura 3B).
- Repita esse processo com uma segunda sutura, paralela à primeira sutura (Figura 3C).
- Amarre frouxamente cada sutura ao redor do CCA, mas não aperte os nós ou restrinja o fluxo sanguíneo (Figura 3D).
- Isolamento e preparo da artéria carótida externa
- Usando a pinça de ponta angulada, remova cuidadosamente o tecido conjuntivo na extremidade cranial do triângulo muscular, cranial ao músculo omo-hióideo, para localizar a ACC e a bifurcação em ECA e ICA (Figura 4A).
NOTA: A ACE inclina-se em direção à linha média e é ligeiramente mais superficial, enquanto a ACI inclina-se lateralmente e se move mais profundamente no pescoço. Tome cuidado especial para evitar danos ao nervo hipoglosso (NH) que atravessa a ACI logo acima da bifurcação. - Limpe cuidadosamente o tecido conjuntivo de todos os lados do ECA próximo à bifurcação. Uma vez que o tecido conjuntivo suficiente tenha sido removido do ECA, coloque um pedaço de sutura na pele preparada assepticamente no esterno do camundongo e passe a pinça de ponta angular sob o ECA. Com a pinça fina na mão esquerda, passe a sutura para a pinça de ponta angulada no espaço entre a ACI e a ECA e puxe suavemente metade do comprimento da sutura (Figura 4B). Amarre frouxamente a sutura ao redor do ECA, mas não aperte o nó.
NOTA: É importante que tecido conjuntivo suficiente seja removido da ECA para que você possa agarrar a sutura com a pinça de ponta angular sem também agarrar inadvertidamente o tecido conjuntivo ao redor das artérias, causando danos às artérias quando a sutura é recuperada.
- Usando a pinça de ponta angulada, remova cuidadosamente o tecido conjuntivo na extremidade cranial do triângulo muscular, cranial ao músculo omo-hióideo, para localizar a ACC e a bifurcação em ECA e ICA (Figura 4A).
- Preparação de agulhas e seringas
NOTA: Para esta etapa, a injeção pode ser realizada com uma agulha reta, o que permite que a seringa se apoie e seja estabilizada pelo corpo do camundongo (Figura 5A). Alternativamente, a injeção pode ser realizada usando uma agulha dobrada perto da ponta, permitindo que a seringa seja segurada como um lápis com a mão apoiada na mesa cirúrgica (Figura 5B). Ambas as técnicas funcionam bem e a escolha da técnica é uma preferência pessoal.- Para preparar a agulha dobrada, segure uma agulha de 33 G, 1/2 polegada com o chanfro voltado para cima e segure a ponta com uma chave de agulha estéril (Figura 5C). Dobre a agulha aproximadamente 30-40° diretamente em direção ao chanfro (Figura 5D).
- Encha a seringa com o volume adequado da solução a injetar (certifique-se de que tem em conta o espaço da cavidade da agulha se a solução injetável não for aspirada através da agulha para carregar a seringa). Anexe a agulha e remova quaisquer bolhas de ar. Certifique-se de que o menisco da solução esteja visível no bisel da agulha.
- Injeção intracarotídea
- Aperte o nó da sutura ao redor do ECA. Em seguida, deslize a sutura inferior do CCA para baixo em direção ao músculo esternocleidomastóideo o máximo possível e aperte o nó. Certifique-se de que a sutura superior do CCA permaneça solta até depois da injeção. Coloque uma bola de algodão estéril na borda da cavidade para absorver o fluido e o sangue secretados durante a injeção.
- Segurando a seringa na mão direita e a pinça fina na mão esquerda, leve a agulha até a artéria imediatamente acima da sutura inferior no CCA. Com a pinça fina, puxe suavemente a extremidade solta da sutura inferior na direção caudal para colocar um baixo nível de tensão no CCA (Figura 6A).
- Insira a agulha no CCA logo após o chanfro e libere lentamente a tensão da sutura (Figura 6B).
NOTA: A artéria tem fluxo sanguíneo substancial e provavelmente sangrará na cavidade cirúrgica quando a agulha for inserida. No entanto, uma vez que a agulha é inserida além do chanfro, a artéria formará uma vedação ao redor da agulha e o sangramento parará. O sangramento contínuo com a agulha no lugar indica que a agulha não está longe o suficiente na artéria (a lacuna do chanfro permite que o sangue flua) ou que a agulha foi empurrada pela parte de trás da artéria. É importante agora manter a agulha extremamente imóvel para não rasgar a artéria ou permitir que a agulha escorregue. Monitore continuamente os animais com eventos hemorrágicos e, se o sangramento for significativo (como quando um animal perde a coloração, parece cianótico, fica frio ao toque ou qualquer outro desfecho humano descrito no protocolo de uso de animais), é necessário aplicar desfechos humanos. - Use a mão esquerda para empurrar o êmbolo da seringa para injetar a solução muito lentamente (Figura 5B, não menos de 15 segundos para injetar 100 μL de solução). Não remova a agulha quando terminar de injetar a solução. Para evitar o refluxo, com a pinça fina na mão esquerda, segure a sutura superior da ACC (ainda frouxamente amarrada) pelo nó e levante para dobrar a artéria (Figura 6C).
- Remova a agulha, coloque a seringa de lado e pegue a pinça de ponta angular com a mão direita. Mantendo a dobra na artéria, aperte o nó na sutura superior da ACC (Figura 6D).
NOTA: Neste ponto, não deve haver sangramento adicional na cavidade cirúrgica. Após esta etapa, há dois procedimentos alternativos, conforme descrito nas etapas 2.7 e 2.8 abaixo. Se o CCA for ligado, siga a etapa 2.7. Se o CCA for reparado no local da injeção, siga as modificações indicadas no passo 2.8.
- Ligadura da CCA
- Nos casos que não exigem que a circulação seja restaurada para a ACC, deixe a artéria ligada, deixando ambas as suturas apertadas na ACC. Apare as extremidades da sutura e confirme se os nós da sutura estão totalmente apertados.
- Prossiga para os procedimentos de fechamento e analgesia descritos na etapa 2.9.
- Alternativa à ligadura do reparo do local de injeção de CCA e restauração da circulação
- Usando bolas de algodão estéreis, absorva qualquer sangue residual dentro da cavidade cirúrgica. Localize o local da injeção no CCA (Figura 7A) e determine o número de suturas necessárias para fechar. Irrigue bem o local da injeção e o lúmen da área isolada do CCA para remover o sangue coagulado.
- Usando a pinça de ponta angular, segure a agulha de sutura 9-0 pelo corpo da agulha próximo ao swage. Enquanto usa a pinça fina para apoiar a artéria do lado oposto, coloque uma única sutura no CCA penetrando na parede arterial aproximadamente 1-1,5 mm lateral ao local da injeção, perpendicular à artéria. Segure a artéria com a pinça fina, abrindo o local da injeção e passando a agulha e a sutura pelos lados direito e esquerdo individualmente. Como alternativa, segure a artéria, pressionando suavemente os lados com a pinça fina, passando a agulha e suturando os dois lados da artéria com uma única mordida.
NOTA: Com qualquer técnica, tome cuidado para que a agulha e a sutura não penetrem na parede posterior dentro da artéria, pois isso fechará o lúmen quando apertado. - Feche o local da injeção com um nó de cirurgião realizando uma amarração de instrumento com a pinça fina e a pinça de ponta angular, usando um mínimo de quatro arremessos (Figura 7B). Em geral, use uma única sutura simples interrompida para fechar o local da injeção de uma agulha 33 G.
- Para restaurar a circulação usando a pinça fina, desamarre e remova a sutura ao redor do ECA, seguida pela sutura superior no CCA (Figura 7C,D). Em seguida, afrouxe lentamente a sutura inferior do CCA, mas não desamarre imediatamente. Confirme se o local da injeção está fechado o suficiente para evitar sangramento importante com pressão arterial e fluxo restaurados (Figura 7D).
NOTA: Se ocorrer sangramento importante no local da injeção, a sutura inferior do CCA pode ser rapidamente reapertada e o local da injeção pode ser ajustado ou ressuturado, se necessário. - Remova as suturas superior e inferior do CCA (Figura 7E). Vá para a etapa 2.9.
- Fechamento e analgesia
- Reposicione a glândula salivar na cavidade e feche a incisão com três suturas simples interrompidas usando um pacote de sutura estéril. Remova as restrições da fita cirúrgica e permita que o mouse se recupere da anestesia em uma almofada de aquecimento.
NOTA: As doses de acompanhamento do analgésico devem ser administradas de acordo com a frequência e a dose especificadas no protocolo IACUC aprovado pelo usuário. Recomenda-se uma duração de cicatrização de uma semana entre as injeções. Se forem necessárias injeções repetidas, o reparo do local da injeção pode ser usado após a primeira injeção e o mesmo procedimento cirúrgico pode ser seguido para injeções subsequentes. A injeção subsequente pode ser administrada no CCA cranial ao local da injeção reparado, pois a sutura repetida para reparar o mesmo local da injeção provavelmente levará a cicatrizes e coágulos sanguíneos.
- Reposicione a glândula salivar na cavidade e feche a incisão com três suturas simples interrompidas usando um pacote de sutura estéril. Remova as restrições da fita cirúrgica e permita que o mouse se recupere da anestesia em uma almofada de aquecimento.
Representative Results
Relatórios anteriores mostraram que células-tronco mesenquimais humanas derivadas da medula óssea (BM-hMSCs) administradas por injeção intracarotídea se alojaram com sucesso em gliomas intracranianos em camundongos19. Empregamos este modelo para comparar os efeitos da ligadura do CCA versus o reparo do CCA com a circulação restaurada após injeção intracarotídea de BM-hMSCs em camundongos portadores de glioma. Camundongos nus atímicos foram implantados com células de glioma U87, seguidas de injeção de BM-hMSCs marcadas com GFP com subsequente ligação de CCA ou reparo de CCA com circulação restaurada. Após 3 dias, os camundongos foram sacrificados e os cérebros foram colhidos, fixados e a imuno-histoquímica foi realizada para detectar GFP, e as células positivas para GFP foram contadas (Figura 8A-D).
O homing geral de GFP-BM-hMSCs para gliomas intracranianos foi avaliado pelo número total de células GFP-positivas dentro do limite do tumor em duas lâminas diferentes (seções >75 μm de distância) do mesmo espécime. A comparação das médias pelo teste t não pareado sugeriu que não houve diferença significativa entre as médias de homing observadas entre os dois procedimentos (P = 0,6858) (Figura 8E). A dispersão de GFP-BM-hMSCs em todo o tumor foi avaliada pela contagem de células GFP-positivas em 10 campos de alta potência dentro do tumor. O aumento do número de células em campos de alta potência pode indicar alterações na dispersão das células por todo o tumor resultantes da variação no procedimento. A comparação dos valores medianos usando o teste Wilcoxon Signed Rank indicou que não houve diferença significativa entre as contagens medianas de células positivas para GFP em campos de alta potência entre os grupos de ligadura CCA e reparo de CCA (Figura 8F).

Figura 1: Preparo da mesa cirúrgica e do mouse para a cirurgia. (A,B) Leito cirúrgico (etiquetas A. Fita de vinil formando o leito, B. Fita cirúrgica de contenção de membros anteriores, C. Travesseiro, D. Peso, E. Cone nasal de anestesia, F. Afastador de gancho rombudo, G. Suturas de 1 cm em etanol a 70%, H. Pinça fina, I. Pinça de ponta angular, J. Tesoura estreita, K. Bolas de algodão estéreis). (C, D) Posicionando o mouse. (E, F) Local cirúrgico e desinfecção do sítio cirúrgico. Clique aqui para ver uma versão maior desta figura.
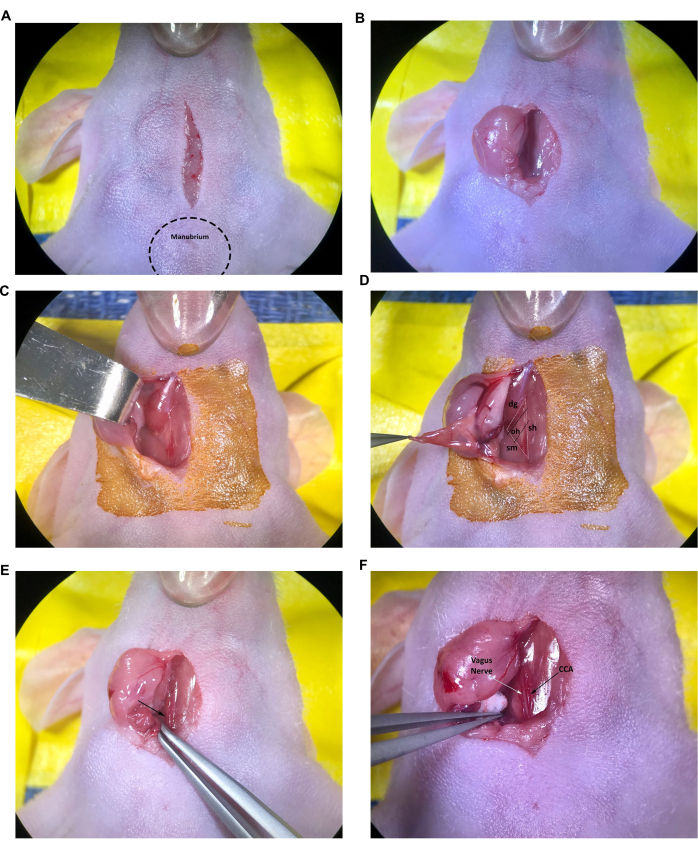
Figura 2: Incisão e exposição de estruturas no local da injeção. (A) Incisão na linha média. (B, C) Retração da glândula salivar direita. (D) Triângulo muscular formado pelo músculo traqueia/esterno-hióideo, músculo esternocleidomastóideo e músculo digástrico, músculo omo-hióideo também é visível. (E) Artéria carótida comum, indicada pela seta. (F) Nervo vago e artéria carótida comum, indicados pelas setas. Abreviaturas: sh = músculo traqueia/esterno-hióideo; SM = músculo esternocleidomastóideo; dg = músculo digástrico; oh = músculo omo-hióideo; ACC = Artéria carótida comum. Clique aqui para ver uma versão maior desta figura.
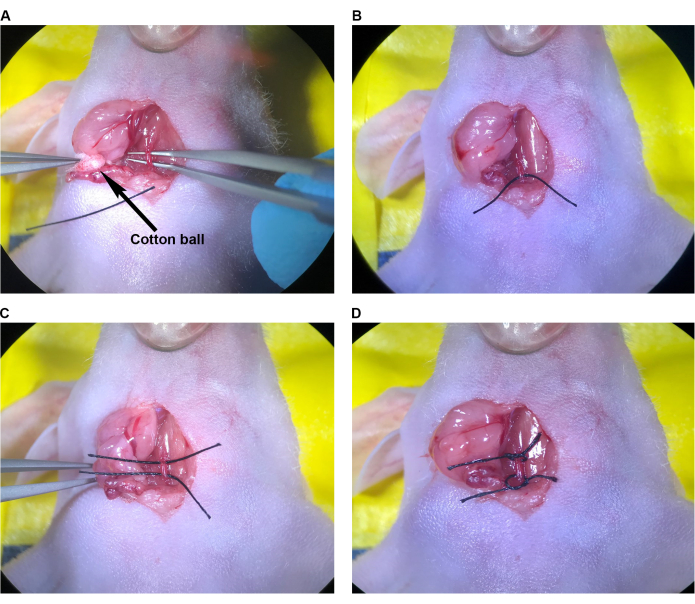
Figura 3: Preparando o CCA para injeção. (A) Pinça de ponta angular passada sob o CCA. (B) A sutura foi puxada até a metade sob a ACC com pinça de ponta angulada. (C) A segunda sutura foi puxada até a metade do CCA. (D) Suturado amarrado em solto sabe ao redor do CCA. Abreviatura: CCA = artéria carótida comum. Clique aqui para ver uma versão maior desta figura.
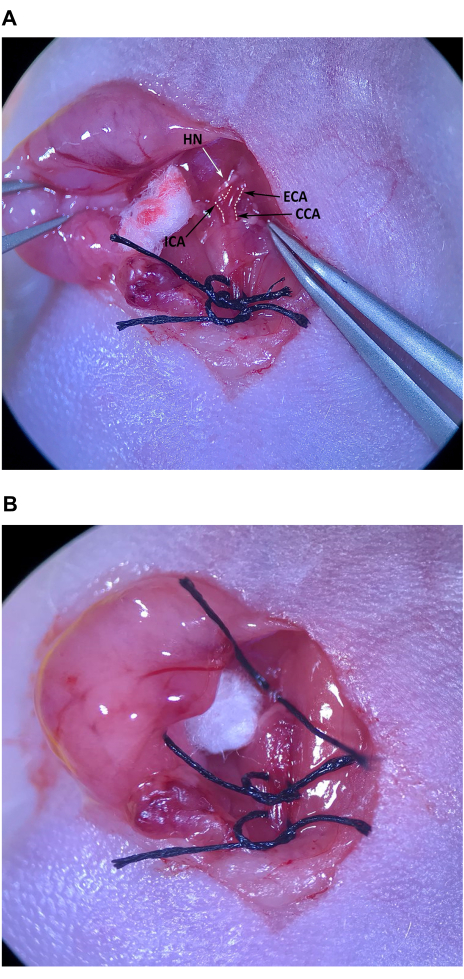
Figura 4: Isolamento e preparo da artéria carótida externa. (A) ACC, artéria carótida externa e artéria carótida interna. (B) Sutura puxada até a metade sob o ECA. Abreviaturas: CCA Artéria carótida comum; ECA = artéria carótida externa; ACI = artéria carótida interna. Clique aqui para ver uma versão maior desta figura.
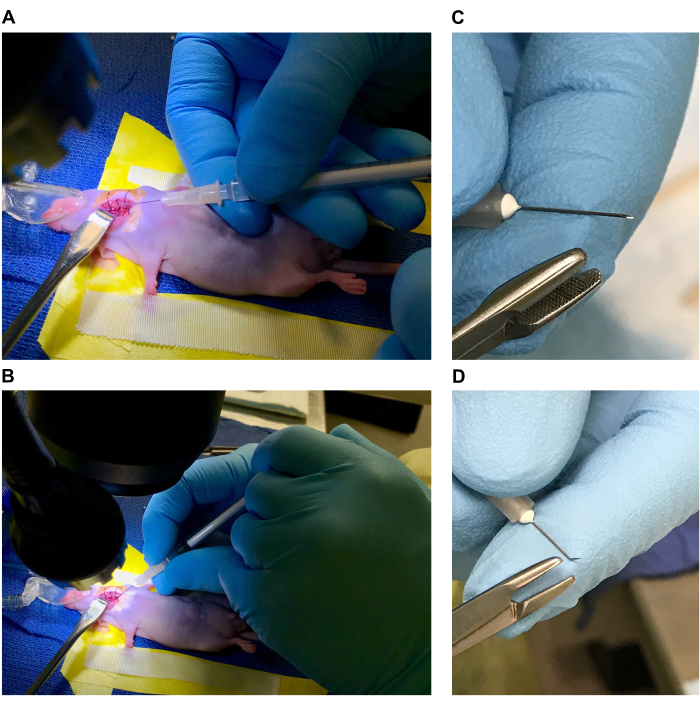
Figura 5: Preparação da agulha e da seringa. (A) Injeção com uma agulha reta com uma seringa apoiada no corpo do camundongo. (B) Injeção com agulha dobrada, com a mão apoiada na mesa cirúrgica. (C, D) Preparando uma agulha dobrada. Clique aqui para ver uma versão maior desta figura.
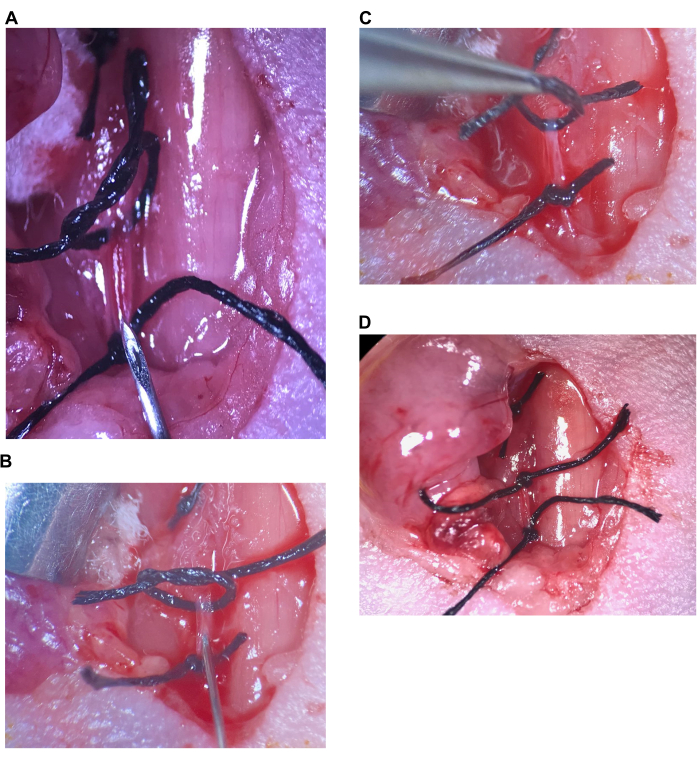
Figura 6: Injeção intracarotídea. (A) A sutura superior é solta, a sutura inferior é apertada no CCA, a agulha é colocada acima da sutura inferior. (B) A agulha é inserida logo após o chanfro, a artéria é selada ao redor da agulha. (C) A sutura superior é levantada para dobrar a artéria para cima e evitar o refluxo. (D) A sutura superior do CCA é apertada. Abreviatura: CCA = artéria carótida comum. Clique aqui para ver uma versão maior desta figura.
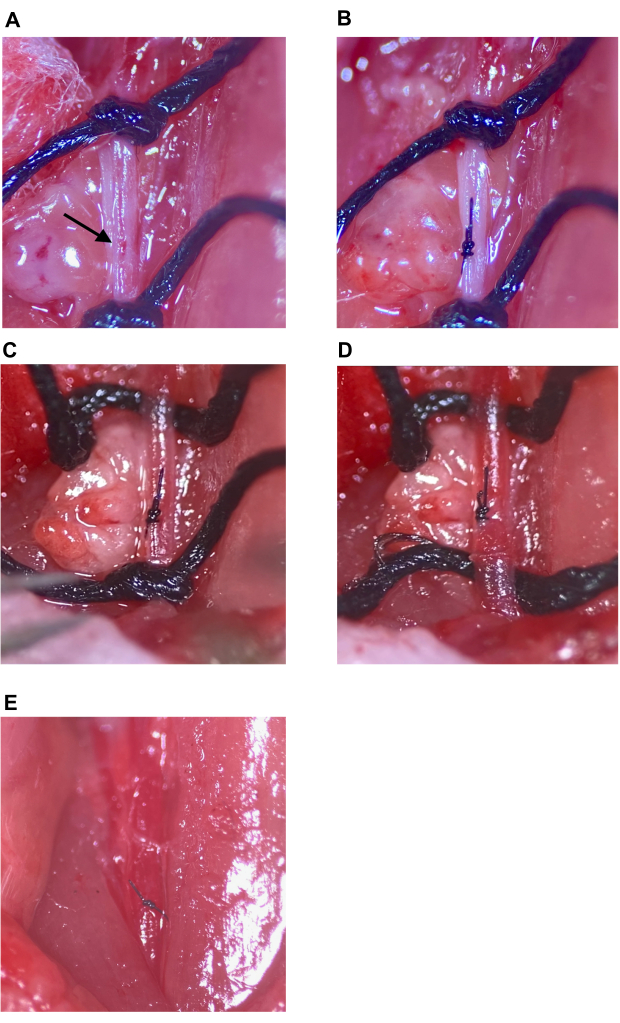
Figura 7: Reparação do local da injeção e restabelecimento da circulação. (A) O local da injeção indicado com uma seta. (B) O local da injeção fechou com um nó de cirurgião, um mínimo de quatro arremessos. (C, D) Soltura das suturas superior e inferior no CCA após o reparo no local da injeção; nenhum sangramento observado após o afrouxamento da sutura. (E) As suturas são removidas após o local da injeção ser determinado como suficientemente reparado. Abreviatura: CCA = artéria carótida comum. Clique aqui para ver uma versão maior desta figura.
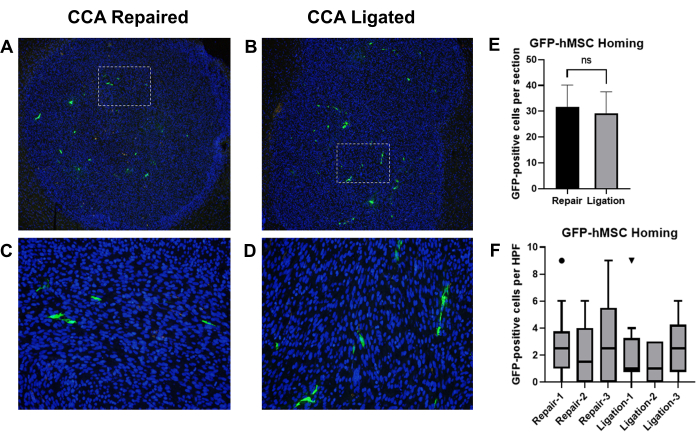
Figura 8: Injeção intracarotídea de GFP-BM-hMSCs e comparação de homing com tumores de glioma intracraniano após ligadura CCA ou reparo de CCA com circulação restaurada. Seções de tecido cerebral de camundongos portadores de tumor foram coradas com anticorpos primários anti-GFP e secundários Alexa Fluor 488 para marcar GFP-BM-hMSCs (verde). Os núcleos foram corados com Hoechst 33342 (azul). Campos representativos de baixa potência de seções marcadas mostrando o retorno geral ao tumor e campos de alta potência mostrando distribuição celular positiva para GFP após reparo de CCA (A, C) ou ligação de CCA (B, D). (E) O homing geral de GFP-BM-hMSCs para tumores foi avaliado pelo número total de células GFP-positivas dentro do limite do tumor em duas lâminas diferentes e as médias foram comparadas pelo teste t. Não foi observada diferença significativa no homing geral entre os procedimentos alternativos (P = 0,6858). (F) A dispersão de GFP-BM-hMSCs em todo o tumor foi avaliada pela contagem de células GFP-positivas em 10 campos de alta potência dentro do tumor. A comparação dos valores medianos pelo teste Wilcoxon Signed Rank não indica diferença significativa entre os indivíduos, independentemente do procedimento (P = 0,1914, 0,5000, 0,1641, 0,9512, 0,8828, 0,2207). Abreviaturas: GFP = proteína fluorescente verde; GFP-BM-hMSCs = células-tronco mesenquimais humanas derivadas da medula óssea marcadas com GFP; ACC = Artéria carótida comum. Clique aqui para ver uma versão maior desta figura.
Discussion
As injeções de artéria intracarótida têm sido cada vez mais usadas nos últimos anos para fornecer terapêutica a tumores cerebrais. Consequentemente, é importante estabelecer modelos de camundongos que espelhem as injeções de artéria intracarotídea em humanos para fins de pesquisa. Anteriormente, as injeções intracarotídeas em camundongos eram realizadas com posterior ligadura da artéria, o que limita o número de injeções na artéria11,12. Além disso, a oclusão da artéria carótida em camundongos pode levar à isquemia cerebral em certas linhagens de camundongos que não possuem um Círculo de Willis13 completo. Desenvolvemos um método para reparar a artéria carótida injetada para superar as limitações dos métodos anteriores. O reparo do local da injeção resulta no restabelecimento do fluxo sanguíneo para a artéria injetada, reduzindo a chance de isquemia cerebral e facilitando as injeções subsequentes na mesma artéria carótida interna.
Várias etapas, que são críticas para o sucesso, requerem o manuseio cuidadoso de instrumentos ou tecidos cirúrgicos, que incluem: inserção da agulha corretamente no lúmen da artéria para evitar sangramento durante a injeção intracarotídea; dissecção cuidadosa do tecido conjuntivo do local da injeção antes da inserção da agulha; remoção de todos os aglomerados e bolhas de ar na seringa e na agulha antes da injeção; e fechamento correto do local da injeção para evitar o fechamento do lúmen da artéria durante o reparo. Para evitar sangramento após a inserção da agulha, certifique-se de que a agulha seja inserida na artéria além do chanfro para formar uma vedação ao redor da haste da agulha. Para evitar um rasgo na parede posterior da artéria, insira a agulha em um ângulo raso e balance sutilmente a seringa e a agulha para trás para manter a ponta da agulha afastada da parede posterior arterial. Se a solução injetada vazar durante a injeção, isso sugere que a agulha foi inserida apenas no tecido conjuntivo ao redor da artéria; A dissecção cuidadosa do excesso de tecido conjuntivo do local da injeção antes da injeção evitará esse problema.
Em relação à escolha da técnica de sutura e fechamento, se a injeção inicial utilizou agulha 33G e fez uma inserção limpa na artéria, uma simples sutura com sutura 9-0 é suficiente para reparar a artéria. Se uma agulha maior for usada para injeção (30 G, etc.) ou ocorrer qualquer rasgo ao inserir a agulha (por exemplo, quando a agulha está fora do centro ou a artéria está se movendo porque o mouse está respirando), isso resulta em um orifício um pouco maior que precisa ser reparado. Duas suturas simples ou uma figura de oito geralmente são suficientes para reparar esse tipo de orifício maior. A escolha entre essas duas técnicas é baseada na preferência do cirurgião nessa situação. É importante notar que a técnica de reparo não foi avaliada em situações em que o orifício no local da injeção é significativamente maior do que na situação mencionada acima. Se o rasgo no local da injeção se estender lateralmente (fazendo um orifício mais largo, maior que um terço da circunferência da artéria), o reparo com esse método pode causar contração da artéria e um risco aumentado de trombose.
Se houver sangramento do local de injeção reparado à medida que as suturas são removidas, pode ser devido ao alongamento do local reparado à medida que a circulação normal é retomada; Isso pode ser corrigido cobrindo suavemente o local de injeção reparado com algodão estéril e aplicando uma leve pressão por 30 s. Alternativamente, se houver sangramento do local da injeção reparada sem fluxo sanguíneo visível e uma artéria distendida proximal, isso indica que a agulha de sutura passou pela parede posterior da artéria durante o reparo. Nesse caso, abra suavemente as bordas do local da injeção durante o reparo, passe a agulha de sutura pela artéria em um ângulo raso e confirme visualmente se a sutura não passou pela parede posterior antes de dar o nó de sutura.
Com essas medidas em vigor, o método de reparo do local da injeção é preciso e repetível em todas as coortes de animais, independentemente do histórico genético ou da idade. Em nossa experiência, a taxa de sucesso foi de 100% com três cirurgiões diferentes realizando o procedimento. Com experiência adequada e seguindo o protocolo fornecido criteriosamente, não prevemos nenhuma dificuldade para outros cirurgiões realizarem esse procedimento. Com a prática, um cirurgião qualificado pode concluir o procedimento em 15 a 20 minutos. Se o experimento permitir, o tempo por animal também pode ser reduzido deixando as suturas superior e inferior do CCA intactas, renunciando ao reparo do local da injeção. No entanto, como observado acima, diferenças específicas da cepa na anatomia vascular cerebral foram documentadas e é importante verificar se a cepa do camundongo usado no procedimento pode tolerar isso antes de iniciar o experimento.
Por se tratar de um procedimento cirúrgico, a recuperação dos camundongos deve ser levada em consideração. A tolerância ao estresse e a recuperação de feridas são considerações importantes que variam de acordo com as diferentes cepas de camundongos. Além disso, a inflamação no local da cirurgia e a formação de tecido cicatricial podem aumentar o tempo de recuperação após cirurgias repetidas. Realizamos com sucesso várias injeções com 7 dias de intervalo, mas se forem necessárias injeções mais frequentes, elas devem ser avaliadas cuidadosamente nas cepas específicas de camundongos a serem usadas. O manuseio vigoroso e o estresse no CCA (durante o isolamento, amarração e remoção de suturas e injeção) podem danificar e enfraquecer as paredes arteriais, levando ao rompimento durante injeções repetidas. É importante minimizar a dissecção do tecido conjuntivo de suporte ao redor da ACC e da bifurcação e evitar a aplicação de tensão excessiva na artéria.
Nossos resultados sugerem que, neste modelo específico, a ligadura CCA ou o reparo CCA com circulação restaurada após a injeção não diferem na frequência geral de homing ou na distribuição de BM-hMSCs injetados em tumores intracranianos. Embora isso possa variar em diferentes cepas de camundongos, o uso de reparo no local da injeção oferece a vantagem de retornar o fluxo sanguíneo para a artéria injetada, permitindo injeções subsequentes na mesma artéria e, mais importante, assemelhando-se a injeções de artéria intracarótida em pacientes humanos. A escolha de ligar versus reparar a artéria injetada é baseada no tipo de experimento e no modelo de camundongo que está sendo usado. Se uma segunda injeção for necessária, ou se o modelo do camundongo não tiver um Círculo de Willis completo, o reparo no local da injeção deve ser usado. A capacidade de reinjetar o CCA em modelos de camundongos pode facilitar a manipulação experimental adicional. Por exemplo, para testar várias doses de uma potencial terapêutica administrada ao longo do tempo, o reparo da artéria injetada é essencial para realizar injeções subsequentes. Este método também seria útil em experimentos envolvendo a injeção de combinações de agentes terapêuticos que precisam ser injetados em momentos diferentes. O aumento da flexibilidade nas injeções intracarotídeas proporcionado pelo reparo da artéria injetada melhora a utilidade translacional dos modelos de tumor cerebral de camundongo.
Disclosures
Os autores não têm divulgações / conflitos de interesse relevantes.
Acknowledgements
Este estudo foi apoiado por doações do National Cancer Institute (R01CA115729, R01CA214749 e 1P50 CA127001) e pelas generosas contribuições filantrópicas para o Programa™ Moon Shots do MD Anderson Cancer Center da Universidade do Texas, a Fundação Broach para Pesquisa do Câncer Cerebral, o Fundo da Família Elias para Pesquisa de Tumores Cerebrais, o Fundo de Pesquisa do Câncer Priscilla Hiley, o Fundo de Pesquisa do Câncer Cerebral Curefest da Família Bauman, Fundo Chuanwei Lu, Fundo de Pesquisa do Câncer Cerebral da Sweet Family, Fundação de Pesquisa do Câncer Memorial Ira Schneider, Fundo Jim & Pam Harris, Fundo Gene Pennebaker para Pesquisa do Câncer Cerebral, Fundo Sorenson para Pesquisa de Tumores Cerebrais, Fundo Memorial Brian McCulloch, Fundação TLC do Coração e Fundo Mary Harris Pappas para Pesquisa de Glioblastoma, tudo para F.F.L.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL syringes (low dead space) | Air-tite Products Co. | A1 | |
| 26 G; 1/2" needle | Air-tite Products Co. | N2612 | |
| 33 G; 1/2" needle | JBP, Air-tite Products Co. | JBP3313B | |
| 3 cm Petri dish | Falcon, Fisher Scientific | 08-772A | |
| 3M durapore surgical tape | Fisher Scientific | 19-071-152 | |
| 6-0 suture thread | Fine Science Tools | 18020-60 | |
| 70% Ethanol | Fisher Scientific | 04-355-122 | |
| 9-0 microsurgical suture with needle | Fine Science Tools | 12052-09 | |
| Analgesic for major surgery | |||
| Artificial tears/ophthalmic ointment | Covetrus | 8897 | |
| Bead Sterilizer | Fisher Scientific | 14-955-341 | |
| Betadine/Chlorhexidine | McKesson, Fisher Scientific | NC1696484 | |
| Blunt hook retractor | Fine Science Tools | 17022-13 | |
| Dissecting microscope | Zeiss Microscopy, LLC | 491903-0010-000 | |
| Electric heating pad | Insource, Fisher Scientific | NC0667724 | |
| Extra narrow scissors | Fine Science Tools | 14088-10 | |
| Fine forceps - Dumont #5 forceps with micro-blunted tips | Fine Science Tools | 11253-20 | |
| Fine forceps - Dumont #5/45 angled tip forceps with micro-blunted tips | Fine Science Tools | 11253-25 | |
| Isoflurane vaporizer (or Ketamine/Xylazine cocktail) | Kent Scientific | VetFlo-1231 | |
| Light source | Laxco, Fisher Scientific | AMPSILED21 | |
| Mouse anesthesia nose cone | Braintree Scientific, Inc | XENO- M | |
| Needle driver | Fine Science Tools | 12002-12 | |
| Sterile cotton swabs | Texwipe, Fisher Scientific | 18-366-472 | |
| Sterile gauze pads | Covidien, Fisher Scientific | 22-037-907 | |
| Sterile saline (0.9%) | KD Medical, Fisher Scientific | 50-103-1363 | |
| Sterile surgical drapes | Fisher Scientific | 50-129-6666 | |
| Sterile surgical/downdraft table | |||
| Sterile suture pack (any suitable diameter for mouse wound closure) | Ethicon, Fisher Scientific | 50-209-2811 | |
| Surgical tools | |||
| Vinyl lab tape | Fisher Scientific | 15-901 |
References
- Loya, J., Zhang, C., Cox, E., Achrol, A. S., Kesari, S. Biological intratumoral therapy for the high-grade glioma part i: Intratumoral delivery and immunotoxins. CNS Oncol. 8 (3), (2019).
- Garfield, J., Dayan, A. D. Postoperative intracavitary chemotherapy of malignant gliomas. A preliminary study using methotrexate. J Neurosurg. 39 (3), 315-322 (1973).
- Kroin, J. S., Penn, R. D. Intracerebral chemotherapy: Chronic microinfusion of cisplatin. Neurosurgery. 10 (3), 349-354 (1982).
- Sendelbeck, S. L., Urquhart, J. Spatial distribution of dopamine, methotrexate and antipyrine during continuous intracerebral microperfusion. Brain Res. 328 (2), 251-258 (1985).
- Alter, R. A., et al. Long-term benefit of intra-arterial bevacizumab for recurrent glioblastoma. J Exp Ther Oncol. 12 (1), 67-71 (2017).
- Angelov, L., et al. Blood-brain barrier disruption and intra-arterial methotrexate-based therapy for newly diagnosed primary cns lymphoma: A multi-institutional experience. J Clin Oncol. 27 (21), 3503-3509 (2009).
- Chen, S. R., Chen, M. M., Ene, C., Lang, F. F., Kan, P. Perfusion-guided endovascular super-selective intra-arterial infusion for treatment of malignant brain tumors. J Neurointerv Surg. 14 (6), 533-538 (2022).
- Faltings, L., et al. Rechallenging recurrent glioblastoma with intra-arterial bevacizumab with blood brain-barrier disruption results in radiographic response. World Neurosurg. 131, 234-241 (2019).
- Srinivasan, V. M., et al. Advances in endovascular neuro-oncology: Endovascular selective intra-arterial (esia) infusion of targeted biologic therapy for brain tumors. J Neurointerv Surg. 12 (2), 197-203 (2020).
- Shinojima, N., et al. Tgf-β mediates homing of bone marrow-derived human mesenchymal stem cells to glioma stem cells. Cancer Res. 73 (7), 2333-2344 (2013).
- Liu, Z., et al. Improving orthotopic mouse models of patient-derived breast cancer brain metastases by a modified intracarotid injection method. Scientific Reports. 9 (1), 622 (2019).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid cancer cell injection to produce mouse models of brain metastasis. Journal of visualized experiments : JoVE. (120), e55085 (2017).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse strain differences in susceptibility to cerebral ischemia are related to cerebral vascular anatomy. J Cereb Blood Flow Metab. 13 (4), 683-692 (1993).
- Benbenishty, A., et al. Maintaining unperturbed cerebral blood flow is key in the study of brain metastasis and its interactions with stress and inflammatory responses. Brain, behavior, and immunity. 62, 265-276 (2017).
- Doucette, T., et al. Mesenchymal stem cells display tumor-specific tropism in an rcas/ntv-a glioma model. Neoplasia. 13 (8), 716-725 (2011).
- Hata, N., et al. Platelet-derived growth factor bb mediates the tropism of human mesenchymal stem cells for malignant gliomas. Neurosurgery. 66 (1), 144-156 (2010).
- Nakamizo, A., et al. Human bone marrow-derived mesenchymal stem cells in the treatment of gliomas. Cancer Res. 65 (8), 3307-3318 (2005).
- Qiao, Y., et al. Magnetic resonance and photoacoustic imaging of brain tumor mediated by mesenchymal stem cell labeled with multifunctional nanoparticle introduced via carotid artery injection. Nanotechnology. 29 (16), 165101 (2018).
- Yong, R. L., et al. Human bone marrow-derived mesenchymal stem cells for intravascular delivery of oncolytic adenovirus delta24-rgd to human gliomas. Cancer Res. 69 (23), 8932-8940 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved