Облегчение повторных инъекций в сонную артерию у мышей с помощью новой техники восстановления места инъекции
In This Article
Summary
Восстановление внутрисонной артерии на мышиной модели после инъекции возвращает кровоток к артерии, не оказывая негативного влияния на распределение введенного материала. Восстановление места инъекции облегчает последующие инъекции через ту же артерию и предотвращает ишемию головного мозга у линий мышей, у которых отсутствует полный круг Виллиса.
Abstract
Учитывая последние достижения в области доставки новых противоопухолевых препаратов с использованием эндоваскулярных селективных методов внутриартериальной доставки в нейроонкологии, существует острая необходимость в разработке методов внутрисонных инъекций на мышиных моделях, включая методы восстановления сонной артерии у мышей после инъекции для обеспечения последующих инъекций. Мы разработали метод интракаротидной инъекции в мышиной модели для доставки терапевтических препаратов во внутреннюю сонную артерию (ВСА) с помощью двух альтернативных процедур.
Во время инъекции игла вводится в общую сонную артерию (ОСА) после наложения шва вокруг наружной сонной артерии (ЭКА) и вводимые терапевтические препараты вводятся в ВСА. После инъекции общая сонная артерия (ОСА) может быть перевязана, что ограничивает количество интракаротидных инъекций до одной. Альтернативная процедура, описанная в этой статье, включает в себя модификацию, при которой инъекция внутрисонной артерии сопровождается восстановлением места инъекции ОСА, что восстанавливает кровоток внутри ОСА и позволяет избежать осложнения в виде ишемии головного мозга, наблюдаемого на некоторых моделях мышей.
Мы также сравнили доставку мезенхимальных стволовых клеток человека (BM-hMSCs), полученных из костного мозга, с внутричерепными опухолями при доставке через интракаротидную инъекцию с восстановлением места инъекции и без нее после инъекции. Доставка БМ-МСК существенно не отличается между методами. Наши результаты показывают, что восстановление места инъекции ОСА позволяет проводить повторные инъекции через одну и ту же артерию и не ухудшает доставку и распределение введенного материала, тем самым обеспечивая модель с большей гибкостью, которая более точно имитирует интракаротидную инъекцию у человека.
Introduction
Доставка терапевтических препаратов к опухолям головного мозга затруднена из-за непроницаемости гематоэнцефалического барьера (ГЭБ) и гематоэнцефалического барьера (БТБ). Прямое внутриопухолевое введение терапевтических средств для обхода ГЭБ может быть достигнуто путем использования резервуарного катетера Ommaya, микроинфузии с низкой скоростью потока для доставки с усиленной конвекцией или местной инъекции в резекционную полость или прилегающие ткани1. Однако общий объем опухолевой ткани, который достигается с помощью этих методов, ограничен 2,3,4. Внутриартериальные инъекции ранее использовались для доставки терапевтических агентов к опухолям головного мозга с целью охвата большей части опухоли 5,6,7,8, а в последнее время достижения как в методах внутриартериальной доставки, так и в новых терапевтических агентах продемонстрировали преимущества использования этого подхода в лечении опухолей головного мозга7. 9. Эти достижения включают разработку микрокатетеров, эндоваскулярную селективную внутриартериальную доставку (ЭСИА) с усовершенствованной визуализацией, использование осмотических агентов для разрушения ГЭБ и БТБ, а также разработку таргетной биологической терапии. Таким образом, для проведения доклинических испытаний новых терапевтических агентов, вводимых посредством внутриартериальных инъекций, необходимы соответствующие модели трансляционных исследований 9,10.
На мышиных моделях опухолей головного мозга терапевтические агенты, вводимые внутрибрюшинно или внутривенно (через хвостовую вену), проходят через печень или сердце и легкие, соответственно, прежде чем распространяться по всему организму, включая мозг. Эти эффекты первого прохождения могут захватывать и удалять агент или разбавлять агент до того, как он достигнет мозга, и могут представлять собой дозоограничивающую токсичность до достижения терапевтической дозы в мозге. Напротив, инъекция внутрисонной артерии обеспечивает целенаправленную доставку в мозг до начала кровообращения, минуя метаболизм первого прохождения и ограничивая нецелевую доставку. В то время как внутрисонная инъекция мышам является более трудоемкой, специфичность и воспроизводимость метода приводят к сокращению количества животных для завершения исследований 11,12.
В целом, при ранее описанных способах инъекции внутрисонной артерии у мышей общая сонная артерия перевязывается после инъекции, а кровообращение в мозг обеспечивается контралатеральной сонной артерией и задним мозговым кровообращением через кругВиллиса 11,12. Этот метод имеет неотъемлемое ограничение, позволяющее сделать максимум одну инъекцию во внутреннюю или внешнюю сонную артерию. Также важно, чтобы линии мышей, используемые в экспериментах с перевязкой сонной артерии, имели полный Виллис круг для предотвращения ишемии головного мозга из-за перевязанной артерии13. Также было продемонстрировано, что окклюзия сонной артерии снижает мозговой кровоток и ограничивает распределение вводимых частиц14. Кроме того, окклюзия сонной артерии у мышей после инъекции не имитирует инъекцию внутрисонной артерии у людей.
Наша группа ранее использовала инъекции внутрисонной артерии для успешной доставки мезенхимальных стволовых клеток в мозг 10,15,16,17,18,19. В этой статье мы подробно описываем этот метод инъекции интракаротидной артерии и включаем модификацию разработанного нами метода, при котором место инъекции восстанавливается без окклюзии артерии, избегая ограничений, связанных с постинъекционным лигированием сонной артерии. При этом методе общая сонная артерия (ОЦА) подготавливается к инъекции путем наложения двух швов, по одному на каждом конце предполагаемого места инъекции, а нижний шов (ниже места инъекции) затягивается. Наружная сонная артерия (ЭКА) пломбируется с помощью другого шва. Игла вводится в ОСА, а терапевтические препараты доставляются во внутреннюю сонную артерию (ВСА). После этого верхний шов на ОСА затягивается, чтобы предотвратить обратный отток из ВСА. На этом этапе введенный ОСА может быть либо перевязан, либо восстановлен. Если ОСА необходимо перевязать, швы затягиваются и остаются на месте. Если место инъекции восстановлено, после операции снимаются швы, восстанавливается кровоток. Подробная информация об этих альтернативных процедурах представлена ниже.
Protocol
Все шаги, описанные ниже, соответствуют нашему протоколу, который соответствует рекомендациям, установленным и одобренным Комитетом по институциональному уходу за животными и их использованию в Онкологическом центре им. М. Д. Андерсона Техасского университета.
1. Подготовка операционного стола и мыши к хирургическому вмешательству
- Подготовка операционного стола и мыши к хирургическому вмешательству (см. рис. 1A, B)
- Расположите препарирующий микроскоп и источник света перед испарителем изофлурана с активной системой очистки или поставьте на стол с нисходящей вытяжкой. Положите электрическую грелку на основание препарирующего микроскопа (или лучше под микроскоп, если основание твердое и может пропускать тепло) и накройте стерильной хирургической простыней.
ПРИМЕЧАНИЕ: Все хирургические инструменты и простыни должны быть стерилизованы автоклавированием перед использованием, а все одноразовые материалы должны быть стерильными и индивидуально упакованными. Стерильные перчатки следует использовать на протяжении всей настройки и процедуры и менять их по мере необходимости для поддержания стерильности. - Подготовьте кровать (4-5 дюймов в длину и 2 дюйма в ширину) на хирургической простыне с помощью виниловой лабораторной ленты. Отрежьте квадрат марли размером 1,5 x 1,5 дюйма, плотно сверните его и поместите свернутую марлю под 3-дюймовый кусок виниловой ленты в «изголовье» кровати, чтобы сформировать подушку (наклон головы с использованием подушки позволяет увеличить площадь брюшной шеи).
- Проложите 4-дюймовые куски хирургической ленты по бокам кровати (поверх виниловой ленты). [При использовании изофлурана поместите носовой конус для анестезии с прикрепленным грузом (или лентой) рядом с изголовьем кровати. Отрегулируйте его для определенного положения, как только мышь будет обезболена и пристегнута.] Смотрите рисунки 1А, В.
- С помощью игольницы или тяжелых щипцов оторвите от ватной палочки небольшие кусочки ваты и скатайте в шарики различного размера от 0,5 до 1 мм в диаметре (8-10 кусочков ваты на мышку). Держите вату на хирургической простыне возле изголовья кровати.
- С помощью стерильных инструментов разрежьте 6-0 шовных нитей на кусочки по 1 см (по 3-4 штуки на мышь). Выложите подготовленные длины швов на стерильную простыню. Подготовьте шприц объемом 1 мл для введения бупренорфина или другого подходящего анальгетика (в соответствии с протоколом Комитета по институциональному уходу и использованию животных [IACUC]). Стерилизуйте все хирургические инструменты в соответствии со стандартами IACUC перед помещением инструментов в стерильное поле.
- Расположите препарирующий микроскоп и источник света перед испарителем изофлурана с активной системой очистки или поставьте на стол с нисходящей вытяжкой. Положите электрическую грелку на основание препарирующего микроскопа (или лучше под микроскоп, если основание твердое и может пропускать тепло) и накройте стерильной хирургической простыней.
- Подготовка мыши к хирургическому вмешательству (см. рисунок 1C-F)
- Обезболите одну мышь в соответствии с методами, одобренными IACUC для серьезных операций по выживанию (используйте либо изофлуран 1%-4%, в зависимости от чувствительности отдельных мышей, либо коктейль из 10 мг/мл кетамина, 1 мг/мл ксилазина в дозе 100-200 мг/кг (кетамина) массы тела). При необходимости подстригите мех или сделайте депилят. Введите 0,5-1,0 мг/кг бупренорфина ER (с пролонгированным высвобождением) подкожно за 30 минут до начала хирургического вмешательства.
- Расположите мышь под наркозом так, чтобы подушка располагалась под шеей (рисунок 1C). Подушка помогает вытянуть и поддержать шею при использовании с носовым обтекателем для анестезии. При использовании коктейля кетамина и ксилазина поместите утяжеленный зубной стержень или аналогичный инструмент в рот за резцами, чтобы наклонить голову и вытянуть шею.
- Зафиксируйте передние конечности с помощью хирургической ленты, предварительно размещенной по бокам хирургического ложа (рисунок 1D). Отрегулируйте положение мыши под микроскопом так, чтобы была видна вентральная поверхность шеи, и отрегулируйте увеличение, чтобы удобно наблюдать за операционным участком (рис. 1E).
ПРИМЕЧАНИЕ: Увеличение препарирующего микроскопа должно быть отрегулировано хирургом в соответствии с его уровнем комфорта для каждого шага. - Нанесите искусственные слезы с помощью стерильного ватного тампона. Продезинфицируйте место операции, чередуя круговые тампоны бетадина или хлоргексидина и спирта три раза на дезинфицирующее средство (Рисунок 1F).
- Подтвердите глубину анестезии, убедившись, что мышь не втягивает ногу в ответ на пощипывание пальца ноги. Следите за частотой дыхания и следите за тем, чтобы мышь не задыхалась, так как это является признаком чрезмерного обезболивания при использовании изофлурана. При необходимости отрегулируйте скорость потока кислорода и изофлурана, чтобы достичь подходящей глубины анестетика и равномерного дыхания.
2. Хирургическое вмешательство (Рисунок 2, Рисунок 3, Рисунок 4, Рисунок 5, Рисунок 6 и Рисунок 7)
- Первичный разрез и диссекция
- Начните с того, что сделайте продольный разрез по средней линии шириной 1 см, начиная прямо краниально до манубриума (выступающего уплотнения на краниальном конце грудины) и продолжая по трахее с помощью стерильного лезвия скальпеля или аналогичного инструмента в соответствии с утвержденными рекомендациями пользователя IACUC (Рисунок 2A).
- Вставьте кончик закрытых ножниц в разрез и аккуратно раскройте его, чтобы выполнить тупое рассечение подкожной соединительной клетчатки, разделяя две слюнные железы. С помощью тонких щипцов осторожно протяните правую слюнную железу через разрез так, чтобы она легла на асептически подготовленную поверхность кожи, или втяните слюнную железу в сторону с помощью тупого крючкового ретрактора (рис. 2B, C). Если наружная железа кажется сухой или липкой, смочите ее стерильным физиологическим раствором.
- Продолжайте тупое рассечение соединительной ткани до тех пор, пока не станут видны грудино-ключично-сосцевидные и двужелудочные мышцы (рисунок 2D).
ПРИМЕЧАНИЕ: Мышечный треугольник, образованный трахеей/грудиноподъязычной мышцей (sh), грудино-ключично-сосцевидной мышцей (sm) и двуглавой мышцей (dg) (каудальным животом), будет использоваться для определения местоположения правой CCA и бифуркации сонной артерии в протоколе. В целом, меньшая омоевидная мышца (OH) также может быть видна лежащей поперечно поперек CCA (Рисунок 2D); Тем не менее, эта мышца различается по размеру, и нередки случаи, когда подъязычная мышца полностью отсутствует у молодых или маленьких мышей.
- Изоляция CCA
- Используя щипцы с наклонным концом, продолжайте осторожное рассечение соединительной ткани (путем раскрытия кончиков щипцов) возле каудального конца мышечного треугольника, чтобы обнажить общую сонную артерию, яремную вену и блуждающий нерв.
ПРИМЕЧАНИЕ: Общая сонная артерия является самым большим кровеносным сосудом, прилегающим к трахее, и, как правило, может быть легко идентифицирована в основании мышечного треугольника (Рисунок 2E, стрелка). Будьте предельно осторожны с тонкими щипцами вокруг кровеносных сосудов, так как кончики могут легко повредить сосуды, что приведет к чрезмерному и потенциально смертельному кровотечению. - Продолжайте осторожное рассечение соединительной ткани вокруг участка общей сонной артерии от основания мышечного треугольника до подъязычной мышцы. Используйте маленькие стерильные ватные шарики, чтобы остановить любое незначительное кровотечение и абсорбировать выделяемую жидкость из слюнных желез по мере необходимости.
- Осторожно рассеките соединительную ткань, чтобы отделить ОСА от блуждающего нерва. Будьте особенно осторожны, чтобы свести к минимуму обработку и повреждение блуждающего нерва, который легко идентифицировать как толстый белый нервный пучок, прилегающий к CCA (рис. 2F).
- Используя щипцы с наклонным концом, продолжайте осторожное рассечение соединительной ткани (путем раскрытия кончиков щипцов) возле каудального конца мышечного треугольника, чтобы обнажить общую сонную артерию, яремную вену и блуждающий нерв.
- Подготовка к КЦА
- После того, как ОСА полностью мобилизована от грудино-ключично-сосцевидной мышцы и там, где она видна, до подъязычной мышцы, поместите кусочек шва длиной 1 см 6-0 на асептически подготовленную кожу грудины мыши (для легкого извлечения) и пропустите щипцы с наклонным кончиком под ОСА (с осторожностью, чтобы изолировать ОСА от блуждающего нерва и яремной вены) (Рисунок 3А). Если подъязычная мышца отсутствует, очистите область вокруг ОСА настолько, чтобы можно было наложить швы на ОСА, краниальные и каудальные, к предполагаемому месту инъекции, и ввести иглу.
- С тонкими щипцами в левой руке проведите шов к щипцам с наклонным концом, захватывая ближе к концу шва. Аккуратно протяните половину длины шва под CCA с помощью щипцов с наклонным концом (Рисунок 3B).
- Повторите этот процесс со вторым швом, параллельным первому шву (Рисунок 3C).
- Свободно завяжите каждый шов вокруг CCA, но не затягивайте узлы и не ограничивайте кровоток (Рисунок 3D).
- Изоляция и подготовка наружной сонной артерии
- С помощью щипцов с наклонным концом осторожно удалите соединительную ткань на краниальном конце мышечного треугольника, краниально по отношению к омогибоидной мышце, чтобы локализовать ОСА и разветвление на ЭКА и ВСА (Рисунок 4А).
ПРИМЕЧАНИЕ: ECA наклонена к средней линии и немного более поверхностна, в то время как ICA наклонена латерально и движется глубже в шею. Соблюдайте особую осторожность, чтобы предотвратить повреждение подъязычного нерва (HN), пересекающего ВСА непосредственно над разветвлением. - Тщательно очистите соединительную ткань со всех сторон ЭКА в районе разветвления. После того, как достаточное количество соединительной ткани будет очищено от ECA, наложите кусок шва на асептически подготовленную кожу на грудине мыши и пропустите щипцы с угловым концом под ECA. Держа в левой руке тонкие щипцы, проденьте шов на щипцы с наклонным концом в пространстве между ВСА и ЭХА и осторожно протяните через него половину длины шва (рисунок 4B). Неплотно завяжите шов вокруг ЭКА, но не затягивайте узел.
ПРИМЕЧАНИЕ: Важно, чтобы из ECA было очищено достаточное количество соединительной ткани, чтобы вы могли захватить шов с помощью щипцов с наклонным концом, не захватывая при этом непреднамеренно соединительную ткань, окружающую артерии, что может привести к повреждению артерий при наложении шва.
- С помощью щипцов с наклонным концом осторожно удалите соединительную ткань на краниальном конце мышечного треугольника, краниально по отношению к омогибоидной мышце, чтобы локализовать ОСА и разветвление на ЭКА и ВСА (Рисунок 4А).
- Подготовка иглы и шприца
ПРИМЕЧАНИЕ: На этом этапе инъекция может быть выполнена с помощью прямой иглы, что позволяет шприцу упираться в тело мыши и стабилизироваться им (Рисунок 5A). В качестве альтернативы инъекция может быть выполнена с помощью иглы, которая изогнута рядом с кончиком, что позволяет держать шприц как карандаш, положив руку на операционный стол (рисунок 5B). Оба метода работают хорошо, и выбор техники является личным предпочтением.- Чтобы подготовить изогнутую иглу, держите иглу 33 G, 1/2 дюйма скосом вверх и возьмитесь за кончик стерильным иглоотводчиком (Рисунок 5C). Согните иглу примерно на 30-40° прямо по направлению к скосу (рисунок 5D).
- Наполните шприц соответствующим объемом раствора, который будет вводиться (обязательно учитывайте пространство полости иглы, если раствор для инъекции не набирается через иглу для загрузки шприца). Прикрепите иглу и удалите пузырьки воздуха. Убедитесь, что мениск раствора виден в месте скоса иглы.
- Внутрисонная инъекция
- Затяните узел шва вокруг ЭКА. Затем сдвиньте нижний шов на CCA вниз по направлению к грудино-ключично-сосцевидной мышце как можно дальше и затяните узел. Следите за тем, чтобы верхний шов на ОСА оставался свободным до тех пор, пока не будет сделана инъекция. Поместите стерильный ватный тампон на край полости, чтобы впитать выделяемую жидкость и кровь во время инъекции.
- Держа шприц в правой руке и тонкие щипцы в левой руке, подведите иглу к артерии непосредственно над нижним швом на ОСА. С помощью тонких щипцов осторожно потяните свободный конец нижнего шва в каудальном направлении, чтобы обеспечить низкий уровень натяжения CCA (Рисунок 6A).
- Введите иглу в ОСА сразу за скосом и медленно ослабьте натяжение шва (Рисунок 6B).
ПРИМЕЧАНИЕ: Артерия имеет значительный кровоток и, скорее всего, будет кровоточить в операционную полость при введении иглы. Однако, как только игла будет введена за скос, артерия образует уплотнение вокруг иглы, и кровотечение остановится. Непрерывное кровотечение с установленной иглой указывает на то, что игла недостаточно далеко продвинулась в артерию (зазор от скоса позволяет крови течь) или что игла была протолкнута через заднюю часть артерии. Теперь важно держать иглу очень неподвижно, чтобы не порвать артерию и не позволить игле выскользнуть. Постоянно наблюдайте за животными с кровотечениями, и если кровотечение значительное (например, когда животное теряет окраску, становится синим, становится холодным на ощупь или любая другая гуманная конечная точка, описанная в протоколе использования животных), необходимо применять гуманные конечные точки. - Используйте левую руку, чтобы нажать на поршень шприца, чтобы вводить раствор очень медленно (рисунок 5B, не менее 15 секунд для введения 100 μл раствора). Не извлекайте иглу после окончания введения раствора. Чтобы предотвратить обратный поток, с помощью тонких щипцов в левой руке возьмитесь за узел верхнего шва на CCA (все еще слабо завязанном) и приподнимите, чтобы перевернуть артерию (Рисунок 6C).
- Извлеките иглу, отложите шприц в сторону и возьмите щипцы с угловым концом правой рукой. Удерживая излом в артерии, затяните узел в верхнем шве на ОСА (рисунок 6D).
ПРИМЕЧАНИЕ: На этом этапе не должно быть дополнительного кровотечения в операционную полость. После этого шага существуют две альтернативные процедуры, описанные в шагах 2.7 и 2.8 ниже. Если CCA необходимо перевязать, выполните шаг 2.7. Если CCA необходимо отремонтировать в месте инъекции, выполните изменения, перечисленные в шаге 2.8.
- Лигирование ОСА
- В случаях, когда не требуется восстановление кровообращения в ОСА, оставьте артерию перевязанной, оставив оба шва затянутыми на ОСА. Обрежьте концы швов и убедитесь, что узлы швов полностью затянуты.
- Приступайте к закрытию и обезболивающим процедурам, описанным в шаге 2.9.
- Альтернатива лигированию ССА-Инъекции для восстановления и восстановления кровообращения
- С помощью стерильных ватных шариков впитайте остатки крови в операционную полость. Найдите место инъекции на CCA (рисунок 7A) и определите количество швов, которые необходимо закрыть. Тщательно орошите место инъекции и просвет изолированного участка ОСА для удаления свернувшейся крови.
- С помощью щипцов с наклонным концом захватите иглу шовного материала 9-0 за корпус иглы рядом с обжигом. Используя тонкие щипцы для поддержки артерии с противоположной стороны, наложите один шов в ОЦА, проникая в стенку артерии примерно на 1-1,5 мм латеральнее места инъекции, перпендикулярно артерии. Удерживайте артерию тонкими щипцами, открывая место инъекции и пропуская иглу и шов через правую и левую стороны по отдельности. В качестве альтернативы удерживайте артерию, аккуратно прижимая стороны друг к другу тонкими щипцами, пропуская иглу, и проложите шов через обе стороны артерии одним укусом.
ПРИМЕЧАНИЕ: При любом из этих методов будьте осторожны, чтобы игла и шов не проникли через заднюю стенку внутри артерии, так как это закроет просвет при затягивании. - Закройте место инъекции хирургическим узлом, выполняя завязку инструмента тонкими щипцами и щипцами с угловым концом, используя минимум четыре приема (Рисунок 7B). Как правило, используйте один простой прерывистый шов, чтобы закрыть место инъекции иглы 33 G.
- Чтобы восстановить кровообращение с помощью тонких щипцов, развяжите и снимите шов вокруг ЭКА, а затем верхний шов на ОСА (Рисунок 7C,D). Далее медленно ослабьте нижний шов на КСА, но не стоит сразу развязывать. Убедитесь, что место инъекции достаточно закрыто, чтобы предотвратить сильное кровотечение с восстановлением артериального давления и кровотока (Рисунок 7D).
ПРИМЕЧАНИЕ: Если в месте инъекции возникает сильное кровотечение, нижний шов на ОСА может быть быстро затянут, а место инъекции может быть скорректировано или повторно сшито, если это необходимо. - Снимите верхний и нижний швы CCA (рисунок 7E). Перейдите к шагу 2.9.
- Закрытие и обезболивание
- Переместите слюнную железу в полость и закройте разрез тремя простыми прерывистыми швами с использованием стерильного компресса. Снимите ограничители хирургической ленты и дайте мыши восстановиться после анестезии на грелке.
ПРИМЕЧАНИЕ: Последующие дозы анальгетика должны назначаться в соответствии с частотой и дозой, указанными в утвержденном пользователем протоколе IACUC. Рекомендуется продолжительность заживления между инъекциями в течение одной недели. Если необходимы повторные инъекции, восстановление места инъекции может быть использовано после первой инъекции, а для последующих инъекций может быть применена та же хирургическая процедура. Последующая инъекция может быть введена в ОСА краниально к восстановленному месту инъекции, так как повторное наложение швов для восстановления одного и того же места инъекции, скорее всего, приведет к образованию рубцов и тромбов.
- Переместите слюнную железу в полость и закройте разрез тремя простыми прерывистыми швами с использованием стерильного компресса. Снимите ограничители хирургической ленты и дайте мыши восстановиться после анестезии на грелке.
Representative Results
Предыдущие исследования показали, что мезенхимальные стволовые клетки человека (BM-hMSCs), полученные из костного мозга, доставленные путем интракаротидной инъекции, успешно приживаются во внутричерепных глиомах у мышей19. Мы использовали эту модель для сравнения эффектов лигирования ОСА с восстановлением кровообращения после внутрисонного введения BM-hMSCs у мышей с глиомой. Обнаженным мышам-атимам имплантировали клетки глиомы U87 с последующим введением меченых GFP BM-hMSCs с последующим лигированием CCA или репарацией CCA с восстановленным кровообращением. Через 3 дня мышей умерщвляли, а мозг собирали, фиксировали, а также проводили иммуногистохимию для выявления GFP, а также подсчитывали GFP-положительные клетки (рис. 8A-D).
Общее хоуминг GFP-BM-hMSCs во внутричерепные глиомы оценивали по общему количеству GFP-положительных клеток в пределах границы опухоли на двух разных предметных стеклах (срезы >на расстоянии 75 мкм друг от друга) из одного и того же образца. Сравнение средних значений с помощью непарного t-критерия показало, что не было существенной разницы между средним значением, наблюдаемым между двумя процедурами (P = 0,6858) (рис. 8E). Диспергацию GFP-BM-hMSCs по всей опухоли оценивали путем подсчета GFP-положительных клеток по 10 мощным полям внутри опухоли. Увеличение числа клеток в мощных полях может указывать на изменения в дисперсии клеток по всей опухоли в результате вариаций в процедуре. Сравнение медианных значений с использованием критерия Вилкоксона показало, что не было существенной разницы между медианным количеством GFP-положительных клеток в мощных полях между группами лигирования CCA и репарации CCA (рис. 8F).

Рисунок 1: Подготовка операционного стола и мыши к операции. (А,Б) Хирургическое ложе (этикетки А. Виниловая лента, образующая кровать, Б. Хирургическая лента фиксаторов передних конечностей, В. Подушка, Г. Груз, Д. Анестезиологический конус для носа, Ф. Тупой крючок ретрактора, Ж. 1 см швов из 70% этанола, Н. Тонкие щипцы, I. Щипцы с угловым концом, J. Узкие ножницы, К. Стерильные ватные шарики). (К,Г) Позиционирование мыши. (Э,Ж) Место операции и дезинфекция места операции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
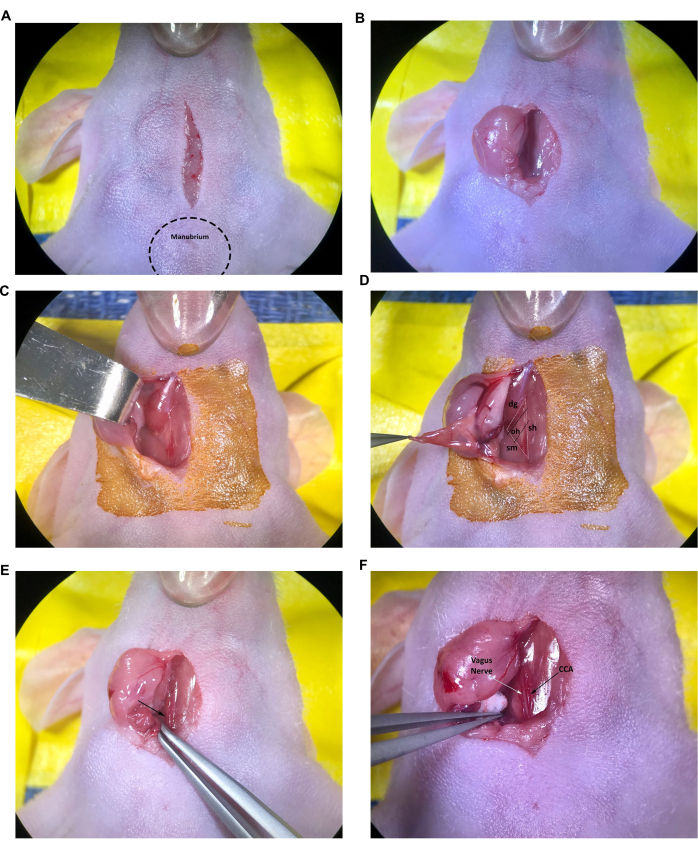
Рисунок 2: Разрез и обнажение структур в месте инъекции. (А) Разрез по срединной линии. (В,В) Ретракция правой слюнной железы. (D) Также виден мышечный треугольник, образованный трахеей/грудиноподъязычной мышцей, грудино-ключично-сосцевидной мышцей и двужелудочной мышцей, омоподъязычной мышцей. (E) Общая сонная артерия, обозначенная стрелкой. (F) Блуждающий нерв и общая сонная артерия, обозначенные стрелками. Сокращения: sh = трахея/грудиноподъязычная мышца; sm = грудино-ключично-сосцевидная мышца; dg = двужелудочная мышца; oh = подъязычная мышца; CCA = Общая сонная артерия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
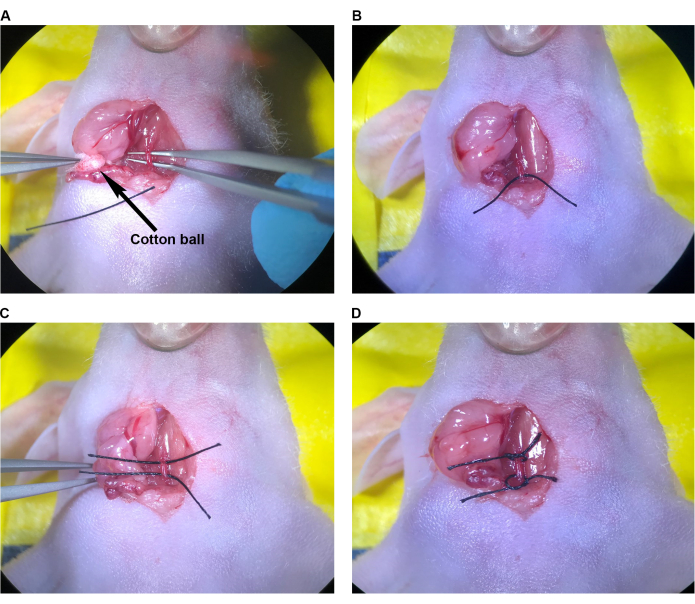
Рисунок 3: Подготовка ОСА к инъекции. (А) Щипцы с угловым наконечником, пропущенные под ОСА. (B) Шов был наполовину натянут под CCA с помощью щипцов с угловым наконечником. (C) Второй шов был натянут на полпути под CCA. (D) Зашитые завязанные в свободные узы вокруг CCA. Аббревиатура: CCA = Общая сонная артерия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
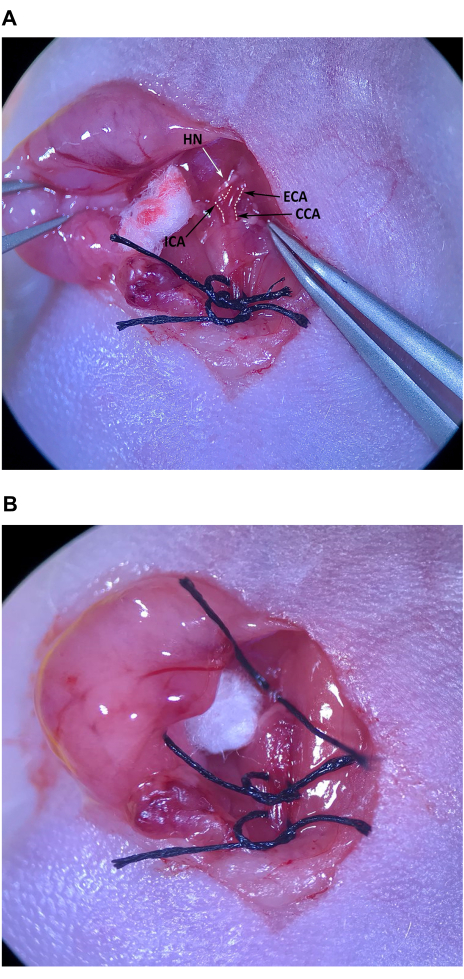
Рисунок 4: Изоляция и подготовка наружной сонной артерии. (A) CCA, наружная сонная артерия и внутренняя сонная артерия. (B) Шов наполовину протянут под ECA. Сокращения: CCA Общая сонная артерия; ECA = наружная сонная артерия; ICA = внутренняя сонная артерия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
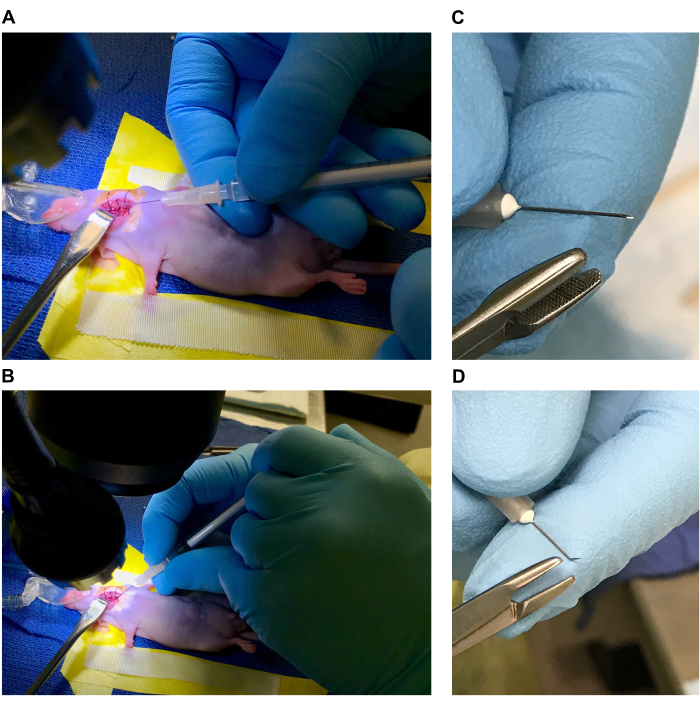
Рисунок 5: Подготовка иглы и шприца. (А) Инъекция прямой иглой, при этом шприц прилегает к телу мыши. (В) Инъекция с помощью изогнутой иглы, при этом рука опирается на операционный стол. (К,Г) Готовим изогнутую иглу. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
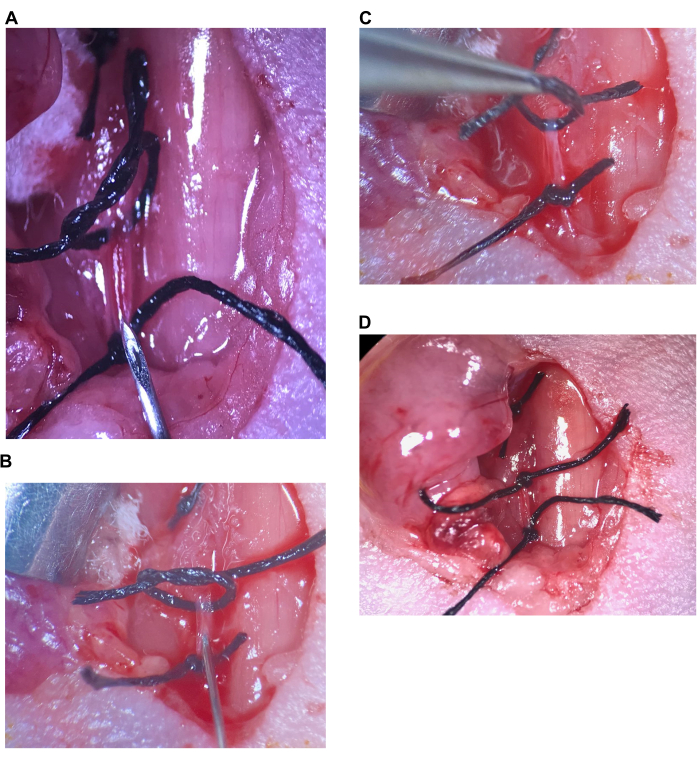
Рисунок 6: Интракаротидное введение. (A) Верхний шов ослаблен, нижний шов затягивается на CCA, игла размещается над нижним швом. (В) Игла вводится сразу за скосом, артерия запаивается вокруг иглы. (C) Верхний шов приподнимается, чтобы перевернуть артерию вверх и предотвратить обратный поток. (D) Верхний шов на ОСА затягивается. Аббревиатура: CCA = Общая сонная артерия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
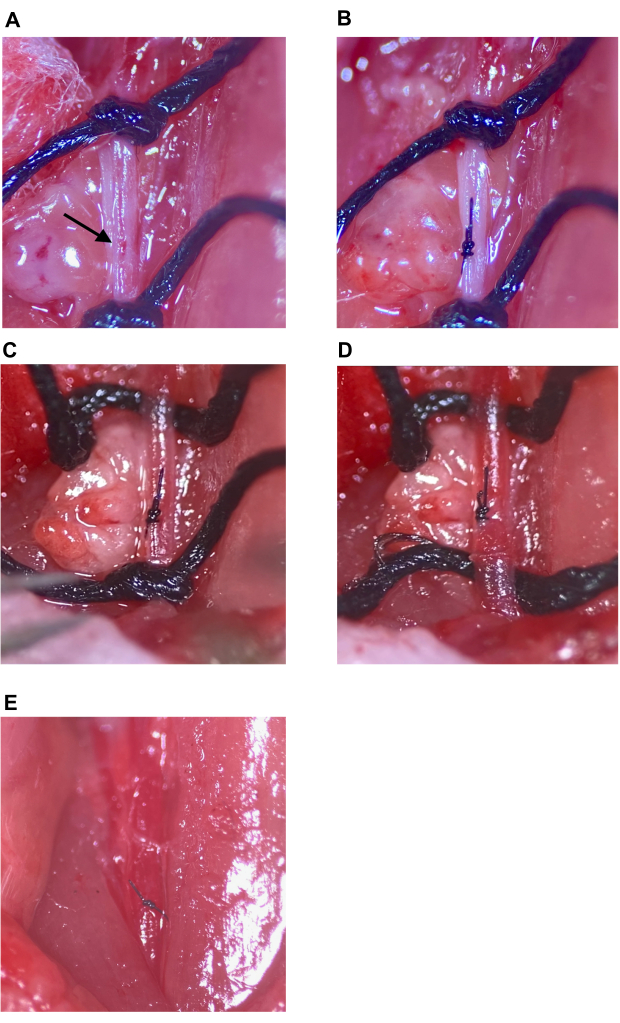
Рисунок 7: Восстановление места инъекции и восстановление кровообращения. (A) Место инъекции обозначено стрелкой. (Б) Место инъекции закрывается хирургическим узлом, минимум четыре захода. (К,Г) Расшатывание верхних и нижних швов на ОСА после восстановления места инъекции; После ослабления швов кровотечение не наблюдается. (E) Швы снимаются после того, как будет установлено, что место инъекции достаточно восстановлено. Аббревиатура: CCA = Общая сонная артерия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
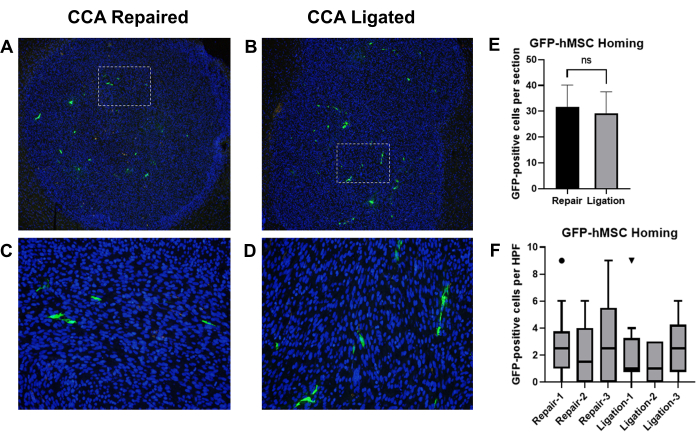
Рисунок 8: Интракаротидное введение GFP-BM-hMSCs и сравнение хоуминга с внутричерепными опухолями глиомы после лигирования CCA или восстановления CCA с восстановленным кровообращением. Срезы тканей мозга мышей с опухолями окрашивали первичными анти-GFP и вторичными антителами Alexa Fluor 488 для мечения GFP-BM-hMSC (зеленым цветом). Ядра окрашивали в цвет Hoechst 33342 (синий). Репрезентативные маломощные поля меченых секций, показывающие общее хоуминг на опухоль, и поля высокой мощности, показывающие GFP-положительное распределение клеток после репарации CCA (A,C) или лигирования CCA (B,D). (E) Общее наведение GFP-BM-hMSCs на опухоли оценивали по общему количеству GFP-положительных клеток в пределах границы опухоли на двух разных предметных стеклах, а средние сравнивали с помощью t-критерия. Существенной разницы в общем самонаведении между альтернативными методами не наблюдалось (P = 0,6858). (F) Диспергирование GFP-BM-hMSCs по всей опухоли оценивали путем подсчета GFP-положительных клеток по 10 мощным полям внутри опухоли. Сравнение медианных значений по критерию Вилкоксона не показывает существенной разницы между индивидуумами, независимо от процедуры (P = 0,1914, 0,5000, 0,1641, 0,9512, 0,8828, 0,2207). Сокращения: GFP = зеленый флуоресцентный белок; GFP-BM-hMSCs = меченые GFP мезенхимальные стволовые клетки костного мозга человека; CCA = Общая сонная артерия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Discussion
Инъекции внутрисонной артерии в последние годы все чаще используются для доставки терапевтических средств к опухолям головного мозга. Следовательно, важно создать мышиные модели, которые отражают инъекции внутрисонной артерии у человека в исследовательских целях. Ранее инъекции в интракаротидную артерию у мышей выполняли с последующей перевязкой артерии, что ограничивает количество инъекций в артерию11,12. Кроме того, окклюзия сонной артерии у мышей может привести к ишемии головного мозга у некоторых линий мышей, которые не имеют полного круга Виллиса13. Мы разработали метод восстановления инъецированной сонной артерии для преодоления ограничений предыдущих методов. Восстановление места инъекции приводит к восстановлению притока крови к инъецируемой артерии, снижению вероятности ишемии головного мозга и облегчению последующих инъекций в ту же внутреннюю сонную артерию.
Несколько шагов, которые имеют решающее значение для успеха, требуют осторожного обращения с хирургическими инструментами или тканями, которые включают: правильное введение иглы в просвет артерии во избежание кровотечения во время внутрисонной инъекции; тщательное рассечение соединительной ткани из места инъекции перед введением иглы; удаление всех комочков и пузырьков воздуха в шприце и игле перед инъекцией; и правильное закрытие места инъекции для предотвращения закрытия просвета артерии во время ремонта. Чтобы предотвратить кровотечение после введения иглы, убедитесь, что игла введена в артерию за скосом, чтобы образовалось уплотнение вокруг стержня иглы. Чтобы избежать разрыва задней стенки артерии, введите иглу под небольшим углом и слегка покачайте шприц и иглу назад, чтобы кончик иглы не касался задней стенки артерии. Если введенный раствор вытекает во время инъекции, это говорит о том, что игла была введена только в соединительную ткань, окружающую артерию; Тщательное рассечение избытка соединительной ткани в месте инъекции перед инъекцией предотвратит эту проблему.
Что касается выбора шовной нити и техники закрытия, если при первоначальной инъекции использовалась игла 33 G и было произведено чистое введение в артерию, для восстановления артерии достаточно одного простого шва со швом 9-0. Если для инъекции используется игла большего размера (30 г и т. д.) или при введении иглы происходит разрыв (например, когда игла смещена от центра или артерия движется из-за дыхания мыши), это приводит к образованию немного большего отверстия, которое необходимо заделать. Двух простых швов или восьмерки обычно достаточно, чтобы заделать этот тип большого отверстия. Выбор между этими двумя методами основан на предпочтениях хирурга в данной ситуации. Важно отметить, что методика ремонта не оценивалась в ситуациях, когда отверстие в месте инъекции значительно больше, чем в ситуации, упомянутой выше. Если разрыв в месте инъекции распространяется в боковом направлении (создавая более широкое отверстие, превышающее одну треть окружности артерии), восстановление с помощью этого метода может привести к сокращению артерии и повышенному риску тромбоза.
Если при снятии швов из восстановленного места инъекции возникает кровотечение, это может быть связано с растяжением восстановленного участка при возобновлении нормального кровообращения; Это можно исправить, аккуратно накрыв отремонтированное место инъекции стерильной ватой и слегка надавливая на нее в течение 30 с. В качестве альтернативы, если есть кровотечение из восстановленного места инъекции без видимого кровотока и проксимальная расширенная артерия, это указывает на то, что игла шва прошла через заднюю стенку артерии во время восстановления. В этом случае аккуратно вскрыть края места инъекции во время ремонта, пропустить иглу шва через артерию под небольшим углом и визуально подтвердить, что шов не прошел через заднюю стенку перед завязыванием шовного узла.
С учетом этих мер метод восстановления места инъекции является точным и воспроизводимым для всех когорт животных, независимо от генетического фона или возраста. По нашему опыту, вероятность успеха составила 100% при трех разных хирургах, выполняющих процедуру. Обладая достаточным опытом и тщательно следуя предоставленному протоколу, мы не предвидим никаких сложностей для других хирургов при выполнении этой процедуры. С практикой опытный хирург может завершить процедуру за 15-20 минут. Если эксперимент позволяет это сделать, время на одно животное также можно сократить, оставив верхние и нижние швы CCA нетронутыми, отказавшись от ремонта места инъекции. Однако, как отмечалось выше, специфические для штамма различия в анатомии сосудов головного мозга были задокументированы, и важно убедиться, что штамм мыши, использованный в процедуре, может выдержать это, прежде чем начинать эксперимент.
Поскольку это хирургическая процедура, необходимо учитывать восстановление мышей. Стрессоустойчивость и заживление ран являются важными факторами, которые будут варьироваться в зависимости от разных линий мышей. Кроме того, воспаление в месте операции и образование рубцовой ткани могут увеличить время восстановления после повторных операций. Мы успешно провели несколько инъекций с интервалом в 7 дней, но если необходимы более частые инъекции, их следует тщательно оценить на конкретных линиях мышей, которые будут использоваться. Сильное воздействие и нагрузка на ОСА (во время изоляции, наложения и снятия швов, а также инъекций) могут повредить и ослабить стенки артерий, что приведет к разрыву при повторных инъекциях. Важно свести к минимуму рассечение поддерживающей соединительной ткани вокруг ОСА и бифуркацию и воздерживаться от чрезмерного натяжения артерии.
Полученные нами результаты свидетельствуют о том, что в данной модели лигирование ОСА или репарация ОСА с восстановлением кровообращения после инъекции не различаются по общей частоте хоуминга или распределению вводимых BM-hMSC по внутричерепным опухолям. Хотя это может варьироваться у разных линий мышей, использование восстановления места инъекции дает преимущество в виде восстановления кровотока к инъецируемой артерии, что позволяет проводить последующие инъекции в ту же артерию и, что важно, напоминает инъекции внутрисонной артерии у пациентов. Выбор лигирования или восстановления инъецированной артерии основан на типе эксперимента и используемой мышиной модели. Если требуется повторная инъекция или если модель мыши не имеет полного Willis Circle, следует использовать восстановление места инъекции. Возможность повторного введения CCA в мышиные модели может облегчить дополнительные экспериментальные манипуляции. Например, для тестирования нескольких доз потенциального терапевтического препарата, вводимого с течением времени, восстановление инъецированной артерии имеет важное значение для выполнения последующих инъекций. Этот метод также может быть полезен в экспериментах, связанных с введением комбинаций терапевтических агентов, которые необходимо вводить в разное время. Повышенная гибкость инъекций в сонную артерию, обеспечиваемая восстановлением инъецируемой артерии, улучшает трансляционную полезность моделей опухолей головного мозга мышей.
Disclosures
Авторы не имеют соответствующего раскрытия информации/конфликта интересов.
Acknowledgements
Это исследование было поддержано грантами Национального института рака (R01CA115729, R01CA214749 и 1P50 CA127001) и щедрыми благотворительными взносами в Программу™ лунных выстрелов Онкологического центра им. М. Д. Андерсона Техасского университета, Фонд Броча по исследованию рака мозга, Фонд семьи Элиас по исследованию опухолей мозга, Фонд исследований рака Присциллы Хайли, Фонд исследований рака мозга семьи Бауман Curefest. Фонд Чуаньвэй Лу, Фонд исследований рака мозга «Сладкая семья», Мемориальный фонд исследования рака Айры Шнайдера, Фонд Джима и Пэм Харрис, Фонд Джина Пеннебейкера по исследованию рака мозга, Фонд Соренсона по исследованию опухолей мозга, Мемориальный фонд Брайана Маккаллоха, Фонд TLC от сердца и Фонд Мэри Харрис Паппас по исследованию глиобластомы. все в F.F.L.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL syringes (low dead space) | Air-tite Products Co. | A1 | |
| 26 G; 1/2" needle | Air-tite Products Co. | N2612 | |
| 33 G; 1/2" needle | JBP, Air-tite Products Co. | JBP3313B | |
| 3 cm Petri dish | Falcon, Fisher Scientific | 08-772A | |
| 3M durapore surgical tape | Fisher Scientific | 19-071-152 | |
| 6-0 suture thread | Fine Science Tools | 18020-60 | |
| 70% Ethanol | Fisher Scientific | 04-355-122 | |
| 9-0 microsurgical suture with needle | Fine Science Tools | 12052-09 | |
| Analgesic for major surgery | |||
| Artificial tears/ophthalmic ointment | Covetrus | 8897 | |
| Bead Sterilizer | Fisher Scientific | 14-955-341 | |
| Betadine/Chlorhexidine | McKesson, Fisher Scientific | NC1696484 | |
| Blunt hook retractor | Fine Science Tools | 17022-13 | |
| Dissecting microscope | Zeiss Microscopy, LLC | 491903-0010-000 | |
| Electric heating pad | Insource, Fisher Scientific | NC0667724 | |
| Extra narrow scissors | Fine Science Tools | 14088-10 | |
| Fine forceps - Dumont #5 forceps with micro-blunted tips | Fine Science Tools | 11253-20 | |
| Fine forceps - Dumont #5/45 angled tip forceps with micro-blunted tips | Fine Science Tools | 11253-25 | |
| Isoflurane vaporizer (or Ketamine/Xylazine cocktail) | Kent Scientific | VetFlo-1231 | |
| Light source | Laxco, Fisher Scientific | AMPSILED21 | |
| Mouse anesthesia nose cone | Braintree Scientific, Inc | XENO- M | |
| Needle driver | Fine Science Tools | 12002-12 | |
| Sterile cotton swabs | Texwipe, Fisher Scientific | 18-366-472 | |
| Sterile gauze pads | Covidien, Fisher Scientific | 22-037-907 | |
| Sterile saline (0.9%) | KD Medical, Fisher Scientific | 50-103-1363 | |
| Sterile surgical drapes | Fisher Scientific | 50-129-6666 | |
| Sterile surgical/downdraft table | |||
| Sterile suture pack (any suitable diameter for mouse wound closure) | Ethicon, Fisher Scientific | 50-209-2811 | |
| Surgical tools | |||
| Vinyl lab tape | Fisher Scientific | 15-901 |
References
- Loya, J., Zhang, C., Cox, E., Achrol, A. S., Kesari, S. Biological intratumoral therapy for the high-grade glioma part i: Intratumoral delivery and immunotoxins. CNS Oncol. 8 (3), (2019).
- Garfield, J., Dayan, A. D. Postoperative intracavitary chemotherapy of malignant gliomas. A preliminary study using methotrexate. J Neurosurg. 39 (3), 315-322 (1973).
- Kroin, J. S., Penn, R. D. Intracerebral chemotherapy: Chronic microinfusion of cisplatin. Neurosurgery. 10 (3), 349-354 (1982).
- Sendelbeck, S. L., Urquhart, J. Spatial distribution of dopamine, methotrexate and antipyrine during continuous intracerebral microperfusion. Brain Res. 328 (2), 251-258 (1985).
- Alter, R. A., et al. Long-term benefit of intra-arterial bevacizumab for recurrent glioblastoma. J Exp Ther Oncol. 12 (1), 67-71 (2017).
- Angelov, L., et al. Blood-brain barrier disruption and intra-arterial methotrexate-based therapy for newly diagnosed primary cns lymphoma: A multi-institutional experience. J Clin Oncol. 27 (21), 3503-3509 (2009).
- Chen, S. R., Chen, M. M., Ene, C., Lang, F. F., Kan, P. Perfusion-guided endovascular super-selective intra-arterial infusion for treatment of malignant brain tumors. J Neurointerv Surg. 14 (6), 533-538 (2022).
- Faltings, L., et al. Rechallenging recurrent glioblastoma with intra-arterial bevacizumab with blood brain-barrier disruption results in radiographic response. World Neurosurg. 131, 234-241 (2019).
- Srinivasan, V. M., et al. Advances in endovascular neuro-oncology: Endovascular selective intra-arterial (esia) infusion of targeted biologic therapy for brain tumors. J Neurointerv Surg. 12 (2), 197-203 (2020).
- Shinojima, N., et al. Tgf-β mediates homing of bone marrow-derived human mesenchymal stem cells to glioma stem cells. Cancer Res. 73 (7), 2333-2344 (2013).
- Liu, Z., et al. Improving orthotopic mouse models of patient-derived breast cancer brain metastases by a modified intracarotid injection method. Scientific Reports. 9 (1), 622 (2019).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid cancer cell injection to produce mouse models of brain metastasis. Journal of visualized experiments : JoVE. (120), e55085 (2017).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse strain differences in susceptibility to cerebral ischemia are related to cerebral vascular anatomy. J Cereb Blood Flow Metab. 13 (4), 683-692 (1993).
- Benbenishty, A., et al. Maintaining unperturbed cerebral blood flow is key in the study of brain metastasis and its interactions with stress and inflammatory responses. Brain, behavior, and immunity. 62, 265-276 (2017).
- Doucette, T., et al. Mesenchymal stem cells display tumor-specific tropism in an rcas/ntv-a glioma model. Neoplasia. 13 (8), 716-725 (2011).
- Hata, N., et al. Platelet-derived growth factor bb mediates the tropism of human mesenchymal stem cells for malignant gliomas. Neurosurgery. 66 (1), 144-156 (2010).
- Nakamizo, A., et al. Human bone marrow-derived mesenchymal stem cells in the treatment of gliomas. Cancer Res. 65 (8), 3307-3318 (2005).
- Qiao, Y., et al. Magnetic resonance and photoacoustic imaging of brain tumor mediated by mesenchymal stem cell labeled with multifunctional nanoparticle introduced via carotid artery injection. Nanotechnology. 29 (16), 165101 (2018).
- Yong, R. L., et al. Human bone marrow-derived mesenchymal stem cells for intravascular delivery of oncolytic adenovirus delta24-rgd to human gliomas. Cancer Res. 69 (23), 8932-8940 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved