Interface Regenerativa de Nervos Periféricos: Protocolo Cirúrgico para um Estudo Controlado Randomizado em Dor Pós-amputação
In This Article
Summary
Aqui, descrevemos o procedimento cirúrgico para realizar a cirurgia de Interface Regenerativa de Nervos Periféricos (RPNI) para o tratamento da dor neuropática pós-amputação no contexto de um estudo controlado randomizado (RCT) internacional (ClinicalTrials.gov, NCT05009394). O ECR compara o RPNI com duas outras técnicas cirúrgicas, a saber, Reinervação Muscular Direcionada (TMR) e excisão de neuroma combinada com transposição intramuscular.
Abstract
Procedimentos cirúrgicos, incluindo reconstrução nervosa e reinervação muscular de órgãos-alvo, tornaram-se mais proeminentes no campo protético na última década. Desenvolvidos principalmente para aumentar a funcionalidade dos membros protéticos, esses procedimentos cirúrgicos também reduzem a dor neuropática pós-amputação. Hoje, alguns desses procedimentos são realizados com mais frequência para o manejo e prevenção da dor pós-amputação do que para a adaptação protética, indicando uma necessidade significativa de soluções eficazes para a dor pós-amputação. Um procedimento emergente notável neste contexto é a Interface Regenerativa de Nervos Periféricos (RPNI). A cirurgia RPNI envolve uma abordagem operatória que envolve a divisão longitudinal da extremidade nervosa em seus fascículos principais e a implantação desses fascículos em enxertos musculares desnervados e desvascularizados livres. O procedimento RPNI assume uma postura proativa no tratamento de terminações nervosas recém-cortadas, facilitando a prevenção e o tratamento de neuromas dolorosos, permitindo que o nervo se regenere e inerva um órgão-alvo, ou seja, o enxerto muscular livre. Estudos retrospectivos mostraram a eficácia do RPNI no alívio da dor pós-amputação e na prevenção da formação de neuromas dolorosos. A crescente frequência de utilização dessa abordagem também deu origem a variações na técnica. Este artigo tem como objetivo fornecer uma descrição passo a passo do procedimento RPNI, que servirá como o procedimento padronizado empregado em um ensaio clínico randomizado internacional (ClinicalTrials.gov, NCT05009394). Neste estudo, o RPNI é comparado a dois outros procedimentos cirúrgicos para o tratamento da dor pós-amputação, especificamente, reinervação muscular direcionada (TMR) e excisão de neuroma acoplada à transposição intramuscular e enterramento.
Introduction
A dor crônica pós-amputação é uma ocorrência frequente após uma amputação maior do membro1. Dor pós-amputação é um termo geral para sensações desagradáveis que podem se manifestar após a amputação e é definida pela Associação Internacional para o Estudo da Dor como dor percebida no membro residual (dor no membro residual, PLR) ou dor percebida na extremidade ausente (dor no membro fantasma, PLP)2. A fonte de PLR é diversa e pode resultar de várias causas, como inflamação, infecção, neuromas, ossificação heterotópica, bursas, síndrome dolorosa regional complexa e anormalidades musculares e ósseas3. Para a PLP, as origens precisas permanecem incompletamente elucidadas e acredita-se que tenha uma etiologia multifacetada envolvendo influências dos sistemas nervoso periférico e central 4,5.
Quando um nervo periférico é lesado, ele tentará se regenerar e se reconectar com os órgãos-alvo relevantes6. Na situação de uma amputação em que os órgãos-alvo são perdidos, ocorre o surgimento anormal de axônios no tecido cicatricial circundante e cria o chamado neuroma7. O neuroma consiste em uma densa matriz colágena onde um emaranhado desorganizado de axônios, células de Schwann, células endoneurais e células perineurais estão presos. As fibras nociceptivas lesadas dentro do neuroma têm um limiar de ativação mais baixo, o que resulta na transmissão de potenciais de ação na ausência de estímulos externos8. Além disso, os neuromas liberam citocinas inflamatórias, que estão associadas a alterações no processamento da dor no córtex somatossensorial. Isso pode levar a alterações desadaptativas no sistema nervoso central, alimentando ainda mais a amplificação e a continuação da resposta neuropática à dor 9,10. Existem interações complexas e bidirecionais entre os sistemas nervosos periférico e central que influenciam a cronificação da dor. Por exemplo, indivíduos com neuropatia periférica sustentada podem experimentar sensibilização central, fazendo com que processem novas informações sensoriais de maneira diferente daqueles sem dor crônica11. Os neuromas dolorosos são uma das fontes conhecidas de PLR e PLP; portanto, focar em gerenciá-los é um passo crucial para minimizar a incidência e prevalência da dor pós-amputação.
Várias estratégias cirúrgicas têm sido sugeridas para o tratamento e prevenção de neuromas dolorosos, e essas estratégias geralmente podem ser classificadas como reconstrutivas ou não reconstrutivas. Os métodos não reconstrutivos geralmente incluem a excisão do neuroma sem a intenção de que o nervo cortado reinerva um alvo fisiologicamente apropriado, como nervo a osso ou nervo a um músculo já inervado12. Considerando que, as intervenções reconstrutivas são projetadas para facilitar a regeneração fisiológica saudável do nervo doador após a excisão do neuroma. Vários métodos não reconstrutivos incluem técnicas como implantação nervosa dentro de tecido próximo, capeamento nervoso, aplicação de pressão proximal ou uso de procedimentos térmicos controlados na extremidade nervosa distal13. Um dos tratamentos mais comuns é a excisão do neuroma com implantação em tecidos próximos, como músculos, ossos ou veias14. No entanto, de acordo com os princípios neurofisiológicos, em todas essas estratégias mencionadas, o nervo periférico recém-cortado sofrerá brotamento axonal e alongamento novamente. Esse processo provavelmente resultará na recorrência do neuroma doloroso, pois os axônios em regeneração não terão órgãos-alvo apropriados para reinervar15. Os resultados dessa técnica foram diversos; Alguns pacientes não apresentaram alívio gradual ou total da dor, enquanto outros experimentaram alívio da dor logo após o tratamento cirúrgico, mas desenvolveram dor após algum tempo14,16. No entanto, apesar de a técnica ter sucesso limitado na redução da dor, a transposição do neuroma com implante e enterramento no músculo ainda é amplamente utilizada no tratamento da amputação e é, em grande parte, vista como o "padrão ouro" para o tratamento cirúrgico de neuromas terminais dolorosos12,17.
Nas últimas décadas, novos desenvolvimentos no tratamento de neuromas dolorosos centraram-se em uma abordagem mais proativa para tratar a terminação nervosa após a remoção do neuroma, onde o objetivo é garantir a satisfação da terminação nervosa e promover um processo mais natural de regeneração neuronal12,13. Uma nova intervenção desenvolvida pelo grupo do professor Paul Cederna na Universidade de Michigan, Ann Arbor, EUA, é a interface regenerativa de nervos periféricos (RPNI). Essa técnica inclui a excisão de um neuroma, a dissecção longitudinal do coto do nervo doador em múltiplos agrupamentos de fascículos e, posteriormente, o implante direto dos fascículos em enxertos de músculo esquelético desnervado livre18,19. O implante no músculo desvascularizado e desnervado permite que os fascículos nervosos reinervam o enxerto muscular livre após sua revascularização dentro do leito da ferida implantada20. O trabalho histológico mostrou a inervação de enxertos musculares livres de diferentes volumes; no entanto, sua viabilidade e função têm dimensões ótimas21. Uma vez que o enxerto de músculo livre enxertado se torna revascularizado e reinervado, o RPNI evita a recorrência de neuromas dolorosos. O procedimento foi adotado em várias clínicas, principalmente nos EUA, mas também em locais da Europa e da Ásia. No entanto, isso deu origem a variações no procedimento. Portanto, neste artigo, propomos um consenso sobre a técnica entre os cirurgiões que a praticam em todo o mundo.
Este artigo descreve o protocolo passo a passo para a cirurgia RPNI, que é usado em um ECR internacional (ClinicalTrials.gov, NCT05009394). O objetivo deste ECR é avaliar a eficácia das duas técnicas reconstrutivas mais utilizadas, RPNI e TMR, em comparação com o tratamento cirúrgico padrão mais utilizado22. O objetivo deste artigo de método é padronizar a técnica para os centros envolvidos no ECR e disponibilizar o procedimento para todos que desejam usá-lo no tratamento da amputação.
Protocol
O RCT foi aprovado na Suécia e na Itália pela Autoridade Sueca de Revisão de Ética, Etikprövningsmyndigheten, em 30 de junho de 2021 com o número de pedido 2021-0234622 e pelo Comitê de Ética da Região da Emilia Romagna, respectivamente. Mais detalhes sobre o RCT estão descritos no protocolo22.
1. Preparações pré-cirúrgicas
- Diagnosticar o(s) neuroma(s) doloroso(s) seguindo o protocolo internacional de ECR22.
- Planeje as incisões na pele dependendo dos resultados da etapa 1.1 e dependendo da localização de cada neuroma doloroso.
NOTA: Em princípio, qualquer músculo esquelético pode ser usado; no entanto, o enxerto muscular é mais frequentemente colhido do músculo vasto lateral na coxa.
2. Preparação do local destinatário
- Realize anestesia regional ou geral.
NOTA: O tipo de anestesia varia de acordo com o local do procedimento. - Coloque o paciente em decúbito dorsal ou prono, dependendo do local do neuroma doloroso. Para neuromas dolorosos na extremidade superior, coloque o braço em uma placa cirúrgica.
- Realize o comprimento e a forma da incisão na pele, dependendo da localização do neuroma doloroso.
- Identifique o nervo com o neuroma doloroso sob dissecção romba.
- Isole suavemente o nervo e o neuroma com instrumentos finos. Use ampliação de lupa, se necessário.
NOTA: O isolamento do neuroma é opcional quando desafiador. - Mobilize o nervo e atravesse o neuroma até fascículos neurais saudáveis usando um conjunto comercial de corte/preparação de nervos.
NOTA: A ressecção do neuroma é opcional quando desafiadora. - Faça dissecções intraneurais longitudinais da extremidade distal do nervo por cerca de 2-3 cm com microtesouras retas. O número de fascículos dependerá do nível de amputação e do tamanho do nervo. Certifique-se de que o diâmetro de cada fascículo seja de no máximo 4-6 mm. Para cada nervo, um número de fascículos neurais que devem ser preparados é sugerido na Tabela 1.
| Nível de amputação | Nervo | Número sugerido de fascículos neurais |
| Desarticulação do ombro | Axilar | 2 |
| Músculo-cutâneo | 2 | |
| Mediana | 3 | |
| Ulnar | 2 | |
| Radial | 2 | |
| Transumeral | Axilar | 2 |
| Músculo-cutâneo | 2 | |
| Mediana | 3 | |
| Ulnar | 3 | |
| Radial | 2 | |
| Transradial | Mediana | 3 |
| Ulnar | 2 | |
| Radial | 1* | |
| Desarticulação do quadril | Ciático | 4 |
| Femoral | 3 | |
| Femoral cutâneo lateral | 1* | |
| Obturador | 1* | |
| Coxa Cutânea Posterior | 2 | |
| Transfemoral | Ciático | 3 |
| Tibial | 2 | |
| Fibular profundo | 1* | |
| Fibular superficial | 1* | |
| Sural | 1* | |
| Safena | 1* | |
| Transtibial | Tibial | 2 |
| Fibular profundo | 2 | |
| Fibular superficial | 1* | |
| Sural | 1* | |
| Safena | 1* | |
| * Use o nervo inteiramente | ||
Tabela 1: Número sugerido de fascículos neurais especificados para cada nervo em um nível específico de amputação.
3. Preparação da área doadora
- Identifique um músculo doador nativo saudável como fonte para a obtenção de um enxerto muscular livre. Colha o enxerto muscular da seguinte forma:
- Certifique-se de que cada enxerto tenha as dimensões de 3 cm (comprimento) x 1,5 cm (largura) x 0,5 cm (espessura).
NOTA: O eixo principal deve ser paralelo às fibras musculares. - Disseque o enxerto muscular com uma delicada tesoura de dissecação seguindo o eixo principal das fibras musculares. Use lupas de aumento conforme necessário.
- Extirpar suavemente o tecido adiposo e a fáscia muscular do enxerto muscular usando uma tesoura de dissecação.
- Certifique-se de que cada enxerto tenha as dimensões de 3 cm (comprimento) x 1,5 cm (largura) x 0,5 cm (espessura).
- Mantenha o músculo colhido em uma gaze úmida com 0,9% de NaCl estéril até a utilização na seção 4.
- Repita as etapas 3.1-3.2 para cada enxerto muscular, com base no número de nervos e fascículos nervosos correspondentes a serem envolvidos com um enxerto muscular livre preparado para uma construção RPNI.
4. Fabricação de construção RPNI
- Exponha o nervo, já isolado e dividido em fascículos.
- Coloque o fascículo no enxerto muscular de forma que o coto distal caia no terço central ou proximal do enxerto muscular, tendo sua orientação paralela às fibras musculares.
NOTA: Uma orientação paralela é preferida para otimizar a reinervação axonal bem-sucedida. - Prenda o coto nervoso no centro do eixo longitudinal do enxerto muscular usando suturas monofilamentares não reabsorvíveis 6-0. Adicione mais um ponto para prender o nervo na borda proximal do enxerto muscular.
NOTA: Não suture a extremidade nervosa no enxerto muscular; a porção seccionada do nervo permanece livre. - Dobre o enxerto muscular ao redor do fascículo e prenda-o com uma sutura monofilamentar 6-0 interrompida ou contínua não reabsorvível.
- Repita as etapas 4.1-4.4 para cada fascículo.
- Realize a dissecção romba no membro residual para fornecer uma área protegida onde cada RPNI possa ficar confortavelmente e fora das superfícies de suporte de peso do membro. Sempre que possível, desloque a localização de cada RPNI em série.
- Feche as feridas cirúrgicas em camadas.
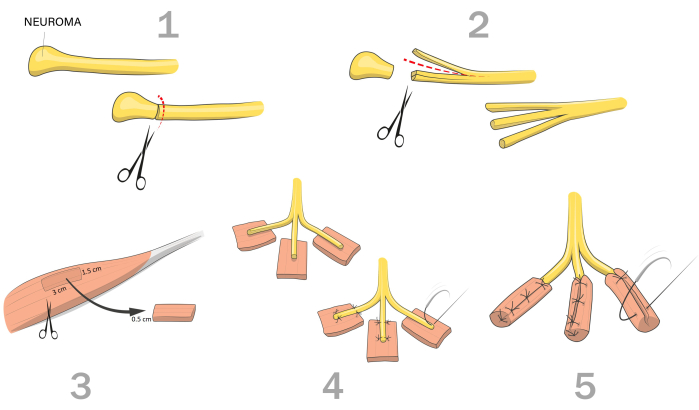
Figura 1: Ilustração esquemática do procedimento de Interface Regenerativa de Nervos Periféricos (RPNI). 1) Identifique e isole o nervo com o neuroma doloroso. Mobilize o nervo e atravesse o neuroma até fascículos neurais saudáveis; 2) Realize dissecções intraneurais longitudinais a partir da extremidade distal do nervo. O número de fascículos neurais depende do nível de amputação e do tamanho do nervo; 3) Identificar um músculo doador nativo saudável e colher um enxerto muscular com as dimensões: 3 cm (comprimento) x 1,5 cm (largura) x 0,5 cm (espessura); 4) Coloque o fascículo no enxerto muscular de forma que o coto caia no centro do enxerto muscular, mantendo sua orientação paralela às fibras musculares. Prenda o nervo dentro do enxerto muscular com suturas proximal e distalmente do coto do nervo; 5) Dobre o enxerto muscular ao redor do fascículo e prenda. Clique aqui para ver uma versão maior desta figura.
Representative Results
O procedimento RPNI encontrou aplicação no tratamento da dor pós-amputação em membros superiores e inferiores (Tabela 2), além de servir como método para tratamento e prevenção do desenvolvimento de neuroma doloroso (Tabela 3)23,24. Em um estudo piloto publicado em 2016, 16 pacientes foram tratados com RPNIs e foram acompanhados por uma média de 7,5 meses (variação de 3 a 15 meses) após o tratamento23. Os dados foram coletados retrospectivamente entre 2013 e 2016, e 71% dos pacientes relataram redução da dor no neuroma e 53% na PLP. Houve diferença estatisticamente significativa no escore de dor pré e pós-RPNI tanto para dor no neuroma quanto para PLP. Além do alívio da dor, os pacientes relataram diminuição (56%) ou estabilidade (44%) do uso de analgésicos e uma diminuição significativa na interferência da dor pré e pós-RPNI. Complicações cirúrgicas foram relatadas em 5 pacientes, incluindo atraso na cicatrização da ferida, isquemia aguda do membro, trombose venosa profunda, hematoma e neuroma em diferentes locais23.
O procedimento também tem sido utilizado para o tratamento de neuromas dolorosos após amputação parcial da mão ou do dedo25. Em um estudo com coleta retrospectiva de dados entre 2014 e 2019, foram realizados 30 RPNIs em 14 pacientes. Os pacientes foram, em média, acompanhados por 37 semanas (intervalo de 6 a 128 semanas) após a cirurgia de RPNI, e 85% dos pacientes relataram alívio total da dor ou redução considerável da dor na última consulta de acompanhamento. Em termos de complicações cirúrgicas, vale a pena notar que 2 pacientes necessitaram de duas cirurgias separadas de RPNI e outros 2 pacientes apresentaram infecções após procedimentos de RPNI. Além disso, não houve casos relatados de cicatrização tardia da ferida no aspecto volar do dedo ou na área doadora do enxerto muscular. Além disso, não foram identificadas ocorrências de contraturas em flexão ou dificuldades com o deslizamento do tendão após a cirurgia de RPNI25.
| Estudar | Desenho do estudo | Nível de amputação (número de membros) | Redução de RLP/NP (%, valor de p) | Redução de PLP (%, valor de p) |
| Woo et al. 201621 | Retrospectiva | Membro superior = 3 Membro inferior = 14 | 71 %, p = 0,000001 | 53%, p = 0,009 |
| Hooper et al. 202023 | Retrospectiva | Membro superior = 17 | 85% | N/A |
| Lee et al. 202324 | Retrospectiva | 37 (nível de amputação não especificado) | 77% | 61% |
| PLR, dor no membro residual; NP, dor no neuroma; PLP, dor no membro fantasma | ||||
Tabela 2: Estudos que investigam o efeito da interface nervosa periférica regenerativa (RPNI) como tratamento para a dor pós-amputação em amputações secundárias. Valores elevados de redução da dor no membro residual (PLR), dor no neuroma (PN) e dor no membro fantasma (PLP) indicam maior eficácia do RPNI como tratamento da dor pós-amputação.
Dados de longo prazo sobre o procedimento RPNI como tratamento e prevenção de neuromas foram apresentados em um resumo publicado recentemente26. Esses dados foram coletados retrospectivamente entre 2014 e 2021, onde 37 pacientes receberam RPNI para dor pós-amputação existente e 40 pacientes receberam RPNI no momento da amputação. Todos os pacientes tiveram pelo menos 1 ano de acompanhamento após RPNI, e o tempo médio entre a cirurgia e a última consulta de acompanhamento foi de 4,2 anos. No grupo de tratamento, no seguimento mais recente, resultados positivos, como ausência de sintomas relatados ou melhora dos sintomas, foram observados em 77% dos pacientes para dor no neuroma e 61% para PLP. Para o grupo profilático, 97% dos pacientes não relataram dor no neuroma ou PLP na última consulta de acompanhamento. Além disso, as prescrições e consumíveis de opioides pré-operatórios e na última consulta de acompanhamento foram menores para ambos os grupos26.
Além disso, dois estudos apresentaram dados retrospectivos em que o RPNI foi conduzido como medida profilática contra o desenvolvimento de neuromas dolorosos no momento da amputação24,27. Na pesquisa realizada por Kubiak et al., um total de 90 pacientes foram incluídos, sendo 45 pacientes submetidos à RPNI concomitantemente à amputação primária, enquanto os 45 restantes receberam tratamento padrão. No grupo RPNI, nenhum dos pacientes desenvolveu neuromas dolorosos, enquanto no grupo controle, seis pacientes apresentaram essa condição. Além disso, no grupo RPNI, 23 pacientes desenvolveram PLP, em oposição a 41 pacientes no grupo controle. Uma taxa maior de complicações pós-operatórias foi relatada no grupo controle (55,6%) em comparação com o grupo tratamento (31,1%). Essas complicações incluíram problemas menores, como cicatrização tardia de feridas, infecção no local cirúrgico e hematoma, bem como complicações maiores, como infecção profunda que requer lavagem da sala de cirurgia (SO), deiscência da ferida que requer fechamento da sala de cirurgia e cicatrização tardia da ferida que requer desbridamento da sala de cirurgia24. Em um estudo realizado por Lin et al., a RPNI foi realizada durante a amputação de membros inferiores em sete pacientes, e seus resultados foram comparados aos de sete pacientes submetidos à amputação tradicional. Esses pacientes foram acompanhados nos 3 meses e 6 meses de pós-operatório. O estudo revelou escores de dor no neuroma significativamente mais baixos no grupo RPNI em comparação com o grupo de amputação tradicional em ambas as visitas de acompanhamento27.
| Estudar | Desenho do estudo | Nível de amputação (número de membros) | Incidência de PLR/PN (%, p-valor) | Incidência de PLP (%, valor de p) |
| Kubiak et al. 201922 | Retrospectiva | Grupo RPNI Membro superior = 6 Membro inferior = 46 Grupo controle Membro superior = 48 Membro inferior = 4 | Grupo RPNI 0 % Grupo controle 13.3 % p = 0,026 | Grupo RPNI 51.1 % Grupo controle 91.1 % p < 0,0001 |
| Lin et al. 202325 | Retrospectiva | Grupo RPNI Membro inferior = 7 Grupo controle Membro inferior = 7 | Grupo RPNI 31 % Grupo controle 69 % | N/A |
| Lee et al. 202324 | Retrospectiva | 40 (nível de amputação não especificado) | 3% | 3% |
| PLR, dor no membro residual; NP, dor no neuroma; PLP, dor no membro fantasma | ||||
Tabela 3: Estudos que examinam a interface nervosa periférica regenerativa (RPNI) como tratamento profilático para prevenir a dor pós-amputação no momento da amputação primária. Baixos valores percentuais de incidência de dor no membro residual (PLR), dor no neuroma (NP) e dor no membro fantasma (PLP) indicam maior eficácia do RPNI como tratamento preventivo.
Um ponto crucial a ser observado é a ausência de dados prospectivos relatados sobre os resultados do RPNI para alívio da dor28. Essa lacuna de informações serve como uma das principais motivações por trás da realização deste RCT e do desenvolvimento deste protocolo. Além disso, vale destacar que a maioria dos estudos publicados tem períodos de acompanhamento inferiores a 1 ano, e há uma variação significativa nos tempos de acompanhamento dentro da mesma população de estudo e em diferentes estudos.
Discussion
Os RPNIs demonstraram seu potencial para servir como tratamento para a dor pós-amputação, bem como prevenir o desenvolvimento de neuromas dolorosos. A distinção fundamental entre o procedimento RPNI e abordagens alternativas para o tratamento de neuromas, como capeamento de nervos, aplicação de pressão proximal ou emprego de procedimentos térmicos no nervo distal, reside no objetivo principal do nervo cortado reinervar um órgão terminal fisiologicamente apropriado. Além disso, um contraste importante entre RPNI e técnicas como transposição de neuroma e implantação e enterramento muscular, onde o alvo final do nervo também é apropriado, é o uso de alvos musculares desnervados. Nos casos em que o alvo muscular já está inervado, cada fibra muscular já está em contato fisiológico e ocupada por uma fibra nervosa. Isso significa que o nervo recém-cortado não pode reinervar o músculo e, portanto, provavelmente desenvolverá novamente um neuroma doloroso. Além disso, em comparação com a cirurgia TMR, onde a extremidade nervosa recém-cortada é coaptada a um nervo motor dispensável próximo e suas unidades motoras próximas de um músculo-alvo, ambas as técnicas utilizam um músculo-alvo desnervado. No entanto, uma distinção reside no fato de que o RPNI emprega um enxerto muscular não vascularizado, enquanto no TMR, o nervo reinerva um músculo vascularizado. Além disso, existem duas outras diferenças importantes com a TMR relacionadas à incompatibilidade de calibre considerável entre os nervos do doador e do receptor e à necessidade de sacrificar inervações saudáveis. A incompatibilidade de tamanho entre os nervos do doador e do receptor pode potencialmente resultar em um neuroma em continuidade, e os nervos sacrificados podem desenvolver neuromas dolorosos. Além disso, o procedimento TMR pode ser considerado mais complexo que o RPNI, pois incorpora técnicas como transferência nervosa e coaptação. Enquanto o RPNI requer uma dissecção longitudinal para separar os fascículos nunca, o restante das etapas pode ser realizado por uma gama mais ampla de cirurgiões, incluindo cirurgiões ortopédicos, cirurgiões gerais e outros envolvidos em amputações, em vez de exigir exclusivamente a experiência de cirurgiões de nervos, microcirurgiões ou cirurgiões de mão. Além disso, houve várias combinações de RPNI e TMR usando conceitos-chave de cada técnica. Por exemplo, coaptação nervo a nervo, incluindo envoltório de enxerto muscular livre sobre a coaptação29 ou divisão do nervo em dois e realização de coaptação com uma parte e construções RPNI com a outra30.
O procedimento envolve etapas críticas que devem ser cuidadosamente consideradas para garantir resultados bem-sucedidos. Em primeiro lugar, o processo de coleta do enxerto muscular deve estar alinhado com o eixo da fibra muscular para evitar a ruptura das fibras musculares individuais, e o enxerto muscular deve ser cortado de todo o tecido conjuntivo para otimizar a regeneração. A escolha do local de colheita pode variar dependendo da disponibilidade. Nas amputações primárias, recomendamos o uso da parte amputada quando possível. Para amputações transradiais, o músculo braquiorradial é uma área doadora adequada, enquanto para amputações transumerais os músculos tríceps podem ser utilizados. No caso de amputações de membros inferiores, como transradial e transfemoral, a coxa proximal ipsilateral, tipicamente o vasto lateral, serve como um local de coleta adequado. Além disso, para amputações transfemorais, os músculos sartório e grácil também são opções viáveis de doadores18. No entanto, esses locais de colheita mencionados para cada nível de amputação devem ser vistos como recomendações. Na cirurgia RPNI para alívio da dor, quando a parte amputada não está disponível, o local de coleta pode ser de qualquer um dos locais mencionados, independentemente do nível de amputação.
Além disso, é vital considerar a relação entre o coto nervoso e o enxerto muscular. Enxertos excessivamente espessos são suscetíveis à necrose central, e enxertos muito finos ou fibras musculares insuficientemente desnervadas resultarão na formação de neuroma dentro da construção RPNI. Neste protocolo, recomendamos que o coto nervoso tenha no máximo 4-6 mm de espessura para um enxerto muscular com dimensões de 3 cm de comprimento, 1,5 cm de largura e 0,5 cm de espessura. As dimensões podem ser ajustadas com base na espessura do nervo; Para nervos com diâmetro superior a 10 mm, a largura do enxerto de nervo pode ser de até aproximadamente 2 cm, mas ainda deve facilitar o envolvimento completo do nervo, estendendo-se pelo menos 1 cm proximal à sua extremidade18. A circunferência do nervo deve ser coberta sem causar tensão, mantendo também a espessura suficiente para permitir a revascularização. Nos casos de nervos espessos, como o nervo ciático, recomendamos a dissecção fascicular, criando vários RPNIs em vez de criar um RPNI grande (ver Tabela 1).
A cirurgia RPNI é um tratamento fácil, seguro, direto e confiável; No entanto, a técnica tem suas desvantagens quando comparada ao tratamento convencional. Conforme documentado anteriormente na literatura por Dellon et al., esse método envolve etapas cirúrgicas adicionais, necessitando do uso de códigos de terminologia processual mais atual (CPT), como a incorporação de um enxerto muscular. Isso, por sua vez, resulta em aumento do tempo necessário na sala cirúrgica e, portanto, aumento das despesas cirúrgicas31. O tempo cirúrgico adicional de realização de RPNI ou TMR é altamente dependente do nível de amputação e do número de construtos. No entanto, apesar do aumento associado nas despesas, várias considerações vitais de longo prazo entram em jogo. Indivíduos com dor crônica após amputação requerem controle contínuo da dor, abrangendo medicação, reabilitação e intervenções especializadas. Além disso, a dor pós-amputação geralmente leva a uma maior utilização de cuidados de saúde, envolvendo visitas frequentes a profissionais de saúde, idas ao pronto-socorro e internações hospitalares. Intervenções cirúrgicas como RPNI ou TMR, projetadas para tratar a dor pós-amputação, têm o potencial de prolongar significativamente a vida útil, promover mobilidade, emprego remunerado e melhorar a qualidade de vida geral de indivíduos com dor pós-amputação. Ao aliviar o sofrimento, facilitar melhores resultados funcionais e promover o bem-estar psicológico, essas intervenções oferecem benefícios inestimáveis que vão muito além de meras considerações financeiras.
Além de seu papel no manejo do neuroma, os RPNIs também têm sido empregados em pacientes com perda de membros para melhorar a função protética motora e sensorial 30,32,33,34. Ao fornecer uma interface estável e responsiva entre o nervo residual e a tecnologia protética, os RPNIs permitem que indivíduos com perda de membros obtenham um controle mais natural e preciso sobre seus membros protéticos. Esse avanço tem o potencial de melhorar muito sua mobilidade, destreza e qualidade de vida30. Como resultado, os RPNIs representam uma abordagem multifacetada que não apenas gerencia questões relacionadas ao neuroma, mas também oferece soluções promissoras para as necessidades mais amplas de indivíduos com amputação, ressaltando ainda mais sua importância no campo da reabilitação de amputação.
Disclosures
Os autores não têm divulgações.
Acknowledgements
Os autores gostariam de agradecer aos financiadores deste projeto: Fundação Promobilia, Fundação IngaBritt e Arne Lundbergs e Conselho Sueco de Pesquisa (Vetenskapsrådet). Os autores agradecem sinceramente àqueles que doaram seus corpos para a ciência para que pesquisas anatômicas pudessem ser realizadas. Os resultados de tais pesquisas podem potencialmente melhorar o atendimento ao paciente e aumentar o conhecimento geral da humanidade. Portanto, esses doadores e suas famílias merecem nossa maior gratidão. Além disso, os autores agradecem à Prof. Lucia Manzoli e ao Prof. Stefano Ratti pela preciosa colaboração do Centro de Anatomia da Alma Mater Studiorum-Universidade de Bolonha para este projeto. Por fim, um reconhecimento especial é estendido a Carlo Piovani por sua contribuição para a criação das ilustrações.
Materials
| Name | Company | Catalog Number | Comments |
| 0.9% NaCl sterile solution | Thermo Fisher Scientific | Z1376 | The company and the catalog number is one example. |
| 6-0 Ethilon suture | Ethicon | 660H | The company and the catalog number is one example. |
| Dissecting scissors | Stille | 101-8172-23 | The company and the catalog number is one example. |
| Gauze | Mölnlycke | 152040 | The company and the catalog number is one example. |
| Loupes | Zeiss | Various | User can choose loupes according to personal preferences. |
| Nerve cutting set | Checkpoint Surgical | 9250 | The company and the catalog number is one example. |
| Straight microscissors | S&T | SAS-12 R-7 | The company and the catalog number is one example. |
References
- Hsu, E., Cohen, S. P. Postamputation pain: Epidemiology, mechanisms, and treatment. J Pain Res. 6, 121-136 (2013).
- Schug, S. A., Lavand, P., Barke, A., Korwisi, B., Rief, W. The IASP classification of chronic pain for ICD-11 chronic postsurgical or posttraumatic pain. Pain. 160 (1), 45-52 (2019).
- Davis, R. W. Phantom sensation, phantom pain, and stump pain. Arch Phys Med Rehabil. 74 (1), 79-91 (1993).
- Ortiz-Catalan, M. The stochastic entanglement and phantom motor execution hypotheses: A theoretical framework for the origin and treatment of Phantom limb pain. Front Neurol. 9, 748 (2018).
- Flor, H. Phantom-limb pain: Characteristics, causes, and treatment. Lancet Neurol. 1 (3), 182-189 (2002).
- Rotshenker, S. . Traumatic Injury to Peripheral Nerves. Nerves and Nerve Injuries. , (2015).
- Stokvis, A., Der Avoort, D. J. J. C., Van Neck, J. W., Hovius, S. E. R., Coert, J. H. Surgical management of neuroma pain: A prospective follow-up study. Pain. 151 (3), 862-869 (2010).
- Curtin, C., Carroll, I. Cutaneous neuroma physiology and its relationship to chronic pain. J Hand Surg Am. 34 (7), 1334-1336 (2009).
- Khan, J., Noboru, N., Young, A., Thomas, D. Pro and anti-inflammatory cytokine levels (TNF-α, IL-1β, IL-6 and IL-10) in rat model of neuroma. Pathophysiology. 24 (3), 155-159 (2017).
- Clark, A. K., Old, E. A., Malcangio, M. Neuropathic pain and cytokines: current perspectives. J Pain Res. 6, 803 (2013).
- Costigan, M., Scholz, J., Woolf, C. J. Neuropathic pain: A maladaptive response of the nervous system to damage. Annu Rev Neurosci. 32, 1-32 (2009).
- Eberlin, K. R., Ducic, I. Surgical algorithm for neuroma management: A changing treatment paradigm. Plast Reconstr Surg Glob Open. 6 (10), e1952 (2018).
- Ives, G. C., et al. Current state of the surgical treatment of terminal neuromas. Neurosurgery. 83 (3), 354-364 (2018).
- Dellon, A. L., Mackinnon, S. E. Treatment of the painful neuroma by neuroma resection and muscle implantation. Plast Reconstr Surg. 77, 427-438 (1986).
- Neumeister, M. W., Winters, J. N. Neuroma. Clin Plast Surg. 47 (2), 279-283 (2020).
- Guse, D. M., Moran, S. L. Outcomes of the surgical treatment of peripheral neuromas of the hand and forearm: A 25-year comparative outcome study. Ann Plast Surg. 71 (6), 654-658 (2013).
- Eftekari, S. C., Nicksic, P. J., Seitz, A. J., Donnelly, D. T., Dingle, A. M., Poore, S. O. Management of symptomatic neuromas: a narrative review of the most common surgical treatment modalities in amputees. Plast and Aesthet Res. 9 (7), 43 (2022).
- Dean, R. A., Tsai, C., Chiarappa, F. E., Cederna, P. S., Kung, T. A., Reid, C. M. Regenerative peripheral nerve interface surgery: Anatomic and technical guide. Plast Reconstr Surg Glob Open. 11 (7), 5127 (2023).
- Santosa, K. B., Oliver, J. D., Cederna, P. S., Kung, T. A. Regenerative peripheral nerve interfaces for prevention and management of neuromas. Clin Plast Surg. 47 (2), 311-321 (2020).
- Cedars, M. G. M. D., Miller, T. A. M. D. A review of free muscle grafting. Plast Reconstr Surg. 74 (5), 712-720 (1984).
- Hu, Y., et al. Regenerative peripheral nerve interface free muscle graft mass and function. Muscle Nerve. 63 (3), 421-429 (2021).
- Pettersen, E., et al. Surgical treatments for postamputation pain study protocol for an international , double - blind, randomised controlled trial. Trials. 24 (1), 304 (2023).
- Woo, S. L., Kung, T. A., Brown, D. L., Leonard, J. A., Kelly, B. M., Cederna, P. S. Regenerative peripheral nerve interfaces for the treatment of postamputation neuroma pain: A pilot study. Plast Reconstr Surg Glob Open. 4 (12), e1038 (2016).
- Kubiak, C. A., Kemp, S. W. P., Cederna, P. S., Kung, T. A. Prophylactic regenerative peripheral nerve interfaces to prevent postamputation pain. Plast Reconstr Surg. 144 (3), 421-430 (2019).
- Hooper, R. C., et al. Regenerative peripheral nerve interfaces for the management of symptomatic hand and digital neuromas. Plast Reconstr Surg Glob Open. 8 (6), e2792 (2020).
- Lee, J. C., Kumar, N. G., Kemp, S. W. P., Cederna, P. S., Kung, T. A. S. P. 0. 6. Regenerative peripheral nerve interface surgery and its four-year pain and medication intake outcomes for treatment or prevention of postamputation pain. Plast Reconstr Surg Glob Open. 11, 123-123 (2023).
- Lin, Z., Yu, P., Chen, Z., Li, G. Regenerative peripheral nerve interface reduces the incidence of neuroma in the lower limbs after amputation: a retrospective study based on ultrasound. J Orthop Surg Res. 18 (1), 619 (2023).
- Mauch, J. T., Kao, D. S. Targeted muscle reinnervation and regenerative peripheral nerve interfaces for pain prophylaxis and treatment A systematic review. PM R. 15 (11), 1457-1465 (2023).
- Kurlander, D. E., et al. TMRpni: Combining two peripheral nerve management techniques. Plast Reconstr Surg Glob Open. 8 (10), e3132 (2020).
- Zbinden, J., et al. Improved control of a prosthetic limb by surgically creating electro-neuromuscular constructs with implanted electrodes. Sci Transl Med. 15 (704), 3665 (2023).
- Dellon, A. L., Aszmann, O. C. In musculus, veritas? Nerve "in muscle" versus targeted muscle reinnervation versus regenerative peripheral nerve interface: Historical review. Microsurgery. 40 (4), 516-522 (2020).
- Vu, P. P., et al. A regenerative peripheral nerve interface allows real-time control of an artificial hand in upper limb amputees. Sci Transl Med. 12 (533), 2857 (2020).
- Vu, P. P., et al. Long-term upper-extremity prosthetic control using regenerative peripheral nerve interfaces and implanted EMG electrodes. J Neural Eng. 20 (2), 026039 (2023).
- Ortiz-Catalan, M., et al. A higly integrated bionic hand with neural control and feedback for use in daily life. Sci Robot. 8 (83), (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved