מודל מורין של אי ספיקת לב הנגרמת על ידי היפרליפידמיה עם מקטע פליטה שמור
In This Article
Summary
פרוטוקול זה מציג גישה מפורטת לשכפול מודל מורין של אי ספיקת לב הנגרמת על ידי היפרליפידמיה עם מקטע פליטה שמור (HFpEF). התכנון משלב מתן של וירוס הקשור אדנו, 9-טרופונין לבבי, T-צפיפות נמוכה ליפופרוטאין קולטן (AAV9-cTnT-LDLR) ו poloxamer-407 (P-407).
Abstract
הפתופיזיולוגיה של אי ספיקת לב עם מקטע פליטה שמור (HFpEF) המונע על ידי lipotoxicity אינו מובן לחלוטין. בהתחשב בצורך הדחוף במודלים של בעלי חיים המחקים במדויק HFpEF לבבי-מטבולי, פותח מודל מורין המושרה על ידי היפרליפידמיה על ידי פנוטיפים של הנדסה לאחור שנצפו בחולי HFpEF. מודל זה נועד לחקור את HFpEF, תוך התמקדות ביחסי הגומלין בין ליפוטוקסיות ותסמונת מטבולית. היפרליפידמיה הושרה בעכברי בר (WT) על רקע זן 129J באמצעות זריקות תוך-שבועיות תוך פריטוניאליות של פולוקסמר-407 (P-407), קו-פולימר בלוק החוסם ליפופרוטאין ליפאז, בשילוב עם זריקה תוך ורידית יחידה של נגיף 9-טרופונין לבבי T-קולטן ליפופרוטאין בצפיפות נמוכה (AAV9-cTnT-LDLR). הערכות מקיפות נערכו בין 4 ל -8 שבועות לאחר הטיפול, כולל אקוקרדיוגרפיה, רישום לחץ דם, פלטיסמוגרפיה של כל הגוף, טלמטריה של אקוקרדיוגרפיה (ECG), ניטור גלגל פעילות (AWM) וניתוחים ביוכימיים והיסטולוגיים. עכברי LDLR/P-407 הפגינו מאפיינים ייחודיים לאחר ארבעה שבועות, כולל תפקוד לקוי של הדיאסטוליה, מקטע פליטה שמור ועובי מוגבר של דופן החדר השמאלי. יש לציין כי לחץ הדם והתפקוד הכליתי נותרו בטווח התקין. בנוסף, אק"ג ו-AWM חשפו חסימות לב ופעילות מופחתת, בהתאמה. התפקוד הדיאסטולי הידרדר לאחר שמונה שבועות, מלווה בירידה משמעותית בקצב הנשימה. חקירה נוספת של מודל הטיפול הכפול גילתה פיברוזיס מוגבר, יחסי ריאות רטובים/יבשים ויחסי משקל לב/גוף. עכברי LDLR/P-407 הציגו קסנטלזמות, מיימת ואיסכמיה לבבית. באופן מעניין, מקרי מוות פתאומיים התרחשו בין 6 ל -12 שבועות לאחר הטיפול. מודל HFpEF מציע משאב ניסיוני יקר ומבטיח להבהרת המורכבות של תסמונת מטבולית התורמת לתפקוד דיאסטולי בהקשר של HFpEF בתיווך ליפוטוקסיות.
Introduction
אי ספיקת לב עם מקטע פליטה משומר (HFpEF) מציינת תסמונת קרדיומטבולית המלווה במחלות רקע מרובות ומהווה מעל 50% מכלל מקרי אי ספיקת הלב 1,2. יתר על כן, התדירות של HFpEF עלתה בהתמדה בעשור האחרון3. עם אפשרויות טיפול מוגבלות, HFpEF מייצג את הצורך הרפואי המשמעותי ביותר שלא נענה במחלות לב וכלי דם, בהתחשב בפתופיזיולוגיה רבת הפנים שלו4. לפיכך, קיים צורך דחוף לשפר את ההבנה של המנגנונים הבסיסיים ואת הפתופיזיולוגיה של HFpEF לפתח טיפולים יעילים.
למרות התקדמות משמעותית בשנים האחרונות, הפתופיזיולוגיה של HFpEF המיוחסת לליפוטוקסיות נותרה מובנת לחלוטין. נקבע כי חולים עם HFpEF מפגינים הצטברות שומנים בולטת בשריר הלב בהשוואה לאלה עם אי ספיקת לב עם מקטע פליטה מופחת (HFrEF) וקבוצת ביקורת בריאה5. נתוני ריצוף RNA מביופסיות לב הראו ירידה בוויסות הגן ליפופרוטאין ליפאז (LPL) בקבוצת HFpEF בהשוואה לחולים בריאים וחולי HFrEF6. Poloxamer-407 (P-407) הוא קו-פולימר בלוק הגורם להיפרליפידמיה על ידי חסימת LPL ולאחר מכן הגדלת טריגליצרידים בפלזמה וליפופרוטאין בצפיפות נמוכה (LDL) כולסטרול7. מחקרים קודמים הדגימו ביטוי גבוה של קולטן LDL (LDLR) בליבם של עכברי HFpEF8.
בהתבסס על ממצאים אלה ומתוך הכרה בצורך הדחוף במודלים של בעלי חיים המחקים במדויק HFpEF לבבי-מטבולי, פותח והוצג מודל מורין המושרה על ידי היפרליפידמיה. מודל זה נתפר כדי לחקור את HFpEF, תוך התמקדות מפורשת במעורבות של lipotoxicity לצד תסמונת מטבולית. מודל זה, המושרה על ידי חסימת היפרליפידמיה/LPL וביטוי LDLR לבבי משופר, הוקם בעכברי WT-129 על רקע 129J באמצעות זריקות תוך-פריטוניאליות דו-שבועיות (i.p.) של P-407 בשילוב עם הזרקה תוך ורידית אחת (i.v.) של וירוס 9-טרופונין לבבי הקשור לאדנו T-LDLR (AAV9-cTnT-LDLR)9.
בין 4 ל -8 שבועות לאחר הטיפול, נערך מערך נרחב של הערכות, כולל אקוקרדיוגרפיה, רישומי לחץ דם, פלטיסמוגרפיה של כל הגוף (WBP), טלמטריה אלקטרוקרדיוגרפית רציפה (ECG), ניטור גלגל פעילות (AWM), כמו גם ניתוחים ביוכימיים והיסטולוגיים9. לאחר ארבעה שבועות, עכברי LDLR/P407 או "טיפול כפול" הציגו תכונות HFpEF מובהקות, כולל תפקוד דיאסטולי, מקטע פליטה שמור ועובי מוגבר של דופן החדר השמאלי9. בנוסף, טלמטריית אק"ג ו-AWM חשפו חסימות לב ופעילות מופחתת, בהתאמה. יש לציין כי לחץ הדם והתפקוד הכליתי נותרו תקינים9. לאחר שמונה שבועות, התפקוד הדיאסטולי הידרדר, ומדידות WBP חשפו קצב נשימה מופחת9.
חקירה נוספת של מודל הטיפול הכפול גילתה פיברוזיס, יחס ריאות רטוב/יבש גבוה ויחס משקל לב/גוף9. נקרופסי גילה מיימת, איסכמיה לבבית וקסנטלזמות. באופן מסקרן, מקרי מוות פתאומיים תועדו בין 6 ל-12 שבועות לאחר הטיפול9. מודל HFpEF מונע היפרליפידמיה מורין זה מספק כלי ניסיוני מהיר, בעל ערך ומבטיח לפענוח המורכבות של תסמונת מטבולית התורמת לתפקוד לקוי של דיאסטולי עם HFpEF בתיווך ליפוטוקסיות.
Protocol
פרוטוקול בעלי החיים אושר על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC) באוניברסיטת מיאמי, בהתאם להנחיות המכון הלאומי לבריאות (NIH) (פרוטוקול IACUC 23-103-ad03). במחקר הנוכחי, עכברי בר (WT) על רקע 129J נרכשו ממקור מסחרי (ראו טבלת חומרים) וגודלו בבית. כל העכברים היו המלטות על רקע 129J. הניסויים כללו עכברים זכרים ונקבות. עכבר LDLR/P-407 HFpEF הוקם על ידי מתן מנה אחת של AAV9-cTnT-LDLR בשבוע הראשון ודו-שבועי p407 במשך ארבעה שבועות.
1. הכנה וניהול AAV9-cTnT-LDLR
הערה: פלסמיד AAV9-cTNT-hLDLR (ראו טבלת חומרים) מקודד את חלבון ה-LDLR האנושי המלא (2664bp) (איור 1).
- הכנת וקטור נגיפי AAV-LDLR
- בהתבסס על מספר בעלי החיים, הפשירו בקבוקוני מלאי AAV9 על קרח במשך 20 דקות, ואז דללו חלקיקי AAV במי מלח חוצצים פוספט (DPBS) של דולבקו כדי לקבל ריכוז של 1 x10 12 גנומים וקטוריים / עכבר ב 100 μL.
- מניחים את הפתרון הנגיפי לתוך מחט 28-30 גרם על מזרק 1 מ"ל. היזהר להימנע משיכת בועות אוויר לתוך המחט.
- הליכי הזרקת ורידי זנב תוך ורידי (i.v.)
- הפעל את החמצן עד 0.5 ליטר לדקה והגדר את מערכת ההרדמה isoflurane ל 4%-5%. הניחו את העכבר בתא האינדוקציה למשך ~2 דקות, עד שבעל החיים אינו מגיב.
- הניחו את בעל החיים על משנן מאיר זנב עכבר (לדוגמה, Braintree Scientific, Inc. (Braintree, MA)) והתאימו את בעל החיים השוכב על צדו. יש להשתמש בהרדמה איזופלורנית עד 2%-3% לתחזוקה.
הערה: החימום על ידי מכשיר הריסון יגרום להתרחבות וריד זנב העכברים ולכן יקל משמעותית על ההזרקה. - זהה את וריד הזנב לרוחב. נקו את אזור ההזרקה עם חומר חיטוי באמצעות פד גזה.
- החזק את קצה הזנב כדי להאריך אותו, ועסה את זנב העכבר באצבעות עד שהווריד הוא דמיין. הכנס את המחט בזווית נמוכה (זווית של 10-15 מעלות) והזריק 100 μL של AAV מדולל לתוך וריד הזנב (איור 2A).
- למשוך את המחט ולהפעיל לחץ מיד עם אצבע עד הדימום מפסיק. החזירו את העכבר לכלוב המקורי.
2. הכנת P-407 וניהולו
- הכנת P-407
- הכן את התמיסה על ידי דילול סוכן P-407 (ראה טבלת חומרים) עם DPBS לריכוז סופי של 100 מ"ג / מ"ל בתוך מכסה אדים. יש לקרר את התמיסה בטמפרטורה של 4°C למשך הלילה על גבי מסובב כדי להקל על המסת ה-P-40710.
- הליך הזרקה תוך צפקי דו-שבועי (i.p.)
- לשקול כל עכבר ביום הראשון של זריקות i.p. באמצעות הפורמולה 1 גרם/ק"ג, מחשבים את המינון המתאים לכל עכבר לפי משקלים ומזרקים למילוי מראש.
- מתחת למכסה מנוע, יש לרסן ידנית את העכבר כאשר הראש והגוף מוטים כלפי מטה על מנת למקם מחדש את האיברים הפנימיים באופן גולגולתי. טכניקה זו מונעת ניקוב של מבנים חיוניים בסביבה.
- זהה את חלל הצפק השמאלי ברביע התחתון של הבטן, לרוחב לקו האמצע. נקו את האתר עם חומר חיטוי.
- בזווית של 45 מעלות או פחות, הכניסו את המחט לחלל הצפק (איור 2B). שאפו את המזרק כדי להבטיח החדרה נאותה.
- אם קיים דם או רקמה בשאיפה, משוך את המחט וחזור על שלבים 2.2.2 -2.2.4 עד שהמזרק נקי. השליכו את המחט למיכל החדים המתאים והחזירו את העכבר לכלוב המקורי.
3. הערכת אקוקרדיוגרפיה
- הכנה
- יש למרוח קרם דפילטורי על החזה והבטן העליונה של העכבר יום לפני או מספר שעות לפני ההדמיה. מוציאים את הקרם עם גזה רטובה לאחר 2 דקות.
- מרדימים את העכבר עם איזופלורן 2.5%-3.0% בקצב זרימה של 0.8 ליטר/דקה ושומרים על איזופלורן של 1%-1.5%. לאחר מכן, אבטח את העכבר לפלטפורמה המתאימה במצב שכיבה עם הכפות על רפידות אלקטרודות עם ג'ל מוליך ולכסות את האף והפה עם חרוט האף כדי להבטיח הרדמה רציפה עם isoflurane.
- מבט על ציר ארוך Parasternal
- כאשר העכבר ממוקם בצורה יציבה, הטה את הצד הימני של הפלטפורמה 45 מעלות.
- לאחר מכן, יישרו באלכסון את בדיקת המתמר במערכת המסילה, וסובבו אותה 30-40 מעלות בכיוון השעון מהגפיים העליונות הימניות לבטן השמאלית כדי לקבל ולאחסן תמונות במצב B.
- נתחו את התמונות במצב B באמצעות תוכנה לניתוח אולטרסאונד (ראו טבלת חומרים) כדי לקבל את מקטע הפליטה (איור 3A).
- מבט על ציר קצר Parasternal
- סובב את בדיקת המתמר במערכת המסילות ב-90 מעלות בכיוון השעון כדי לקבל ולאחסן תמונות במצב B ובמצב M.
- מבט אפי
- הטה את הפינה השמאלית העליונה של הרציף כלפי מטה ולכיוון ימין. כיוון את המתמר לכיוון כתף ימין של החיה.
- דמיינו את המסתם המיטרלי במצב B ובמצב דופלר צבע. רכישה ואחסון של דופלר גל פועם (PW) ותמונות דופלר רקמות5.
- נתחו את תמונות דופלר PW ודופלר רקמות באמצעות תוכנת ניתוח האולטרסאונד כדי להשיג את IVRT, E/E' ו-E/A (איור 3B-E).
4. הקלטת נתוני לולאת נפח לחץ (PV)
- לבצע ניתוחים המודינמיים בסיום המחקר כדי להעריך את התפקוד הסיסטולי והדיאסטולי של החדר השמאלי (LV), בעקבות ההליךהמתואר לעיל 11,12.
- התחל על ידי גרימת העכבר עם isoflurane (3-5%, תא אינדוקציה).
- כאשר מתחילה פעולת ההרדמה, העבירו את בעל החיים לספסל הניתוחים, ושמרו על הרדמה עם איזופלורן (1-3%, מסכת פנים).
- בצע חתך קטן בעור מעל הצוואר כדי לאפשר אינטובציה אנדוטרכאלית (דרך הפה).
- אווררו את בעל החיים בתערובת של חמצן ואיזופלורן באמצעות מאוורר מכרסמים (למשל, מיקרו אוורור מודל 848, מכשיר הרווארד) המוגדר בנפח ~0.15-0.2 מ"ל וקצב הנשימה ב 120-170 נשימות לדקה.
- עקוב אחר טמפרטורת הגוף ב~ 37 ° C ± 1 ° C לאורך כל ההליך באמצעות שולחן ניתוחים מבוקר טמפרטורה.
- לחשוף ו cannulate את הווריד הצוואר הפנימי השמאלי עם מחט 30 G למתן תמיכה נוזלים.
- חותכים את העור מעל האתר של צוואר הגחון החציוני וחושפים את עורק התרדמה. לאחר חסימת החלק הדיסטלי של עורק התרדמה הימני, יש לבצע חתך קטן בעורק כדי לאפשר החדרת צנתר PV (ראו טבלת חומרים) לחדר שמאל (גישה לחזה סגור).
- הקלט לולאות PV במצב יציב וחסימת ורידי קאווה נחותים.
- בסיום הניסוי, יש להרדים את בעל החיים באופן הומני (בהרדמה עמוקה) בשיטת AVMA מאושרת (למשל, איזופלורן ואחריו נקע צוואר הרחם).
- נתח את נתוני PV באמצעות תוכנת LabChart (ראה טבלת חומרים), וכייל נפחים באמצעות מדידות אקו לב.
Representative Results
לאחר 4 שבועות של מינון יחיד משולב i.v. AAV9-cTnT-LDLR ו- i.p דו-שבועי. זריקות P-407, אקוקרדיוגרפיה גילתה HFpEF, כפי שמעידים מקטע הפליטה שהשתמר, זמן הרפיה תוך ורידי ממושך (IVRT) ו- E/E' וכן ירידה ב- E/A (איור 3A-E). תפקוד דיאסטולי גרוע יותר נצפה לאחר 8 שבועות בהשוואה לנתונים לאחר 4 שבועות. ניתוח לולאת לחץ-נפח (PV) לאחר 8 שבועות של טיפול הראה שיפוע מוגבר של יחסי לחץ-נפח דיאסטולי, המאשש את ממצאי אקוקרדיוגרפיה של תפקוד דיאסטולי לקוי (איור 3F). יש לציין שמוות פתאומי התרחש במספר משמעותי של עכברים שטופלו ב-LDLR/P-407 בין 6 ל-12 שבועות לאחר הטיפול ב-LDLR/P-407 (איור 3G). תוצאות אלה מצביעות על HFpEF קרדיו-מטבולי, המאשרות את היעילות של פרוטוקול זה ועיצוב ניסוי. היפרליפידמיה נצפתה בעכברים שטופלו ב-LDLR/P407 לאחר 4 ו-8 שבועות, כפי שמעידים רמות כולסטרול כלליות גבוהות, טריגליצרידים, ליפופרוטאין בצפיפות נמוכה מאוד (VLDL), כולסטרול ליפופרוטאין בצפיפות נמוכה (LDL) ורמות כולסטרול נורמליות של ליפופרוטאין בצפיפות גבוהה, מה שמחזק את הממצאים שלנו לגבי היפרליפידמיה (איור 3H).
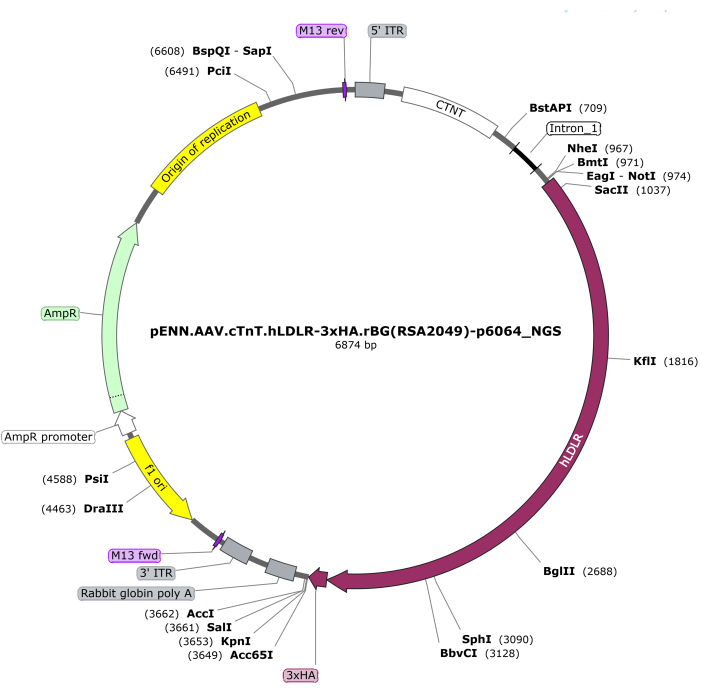
איור 1: מפת פלסמיד עבור AAV9-cTnT-LDLR. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
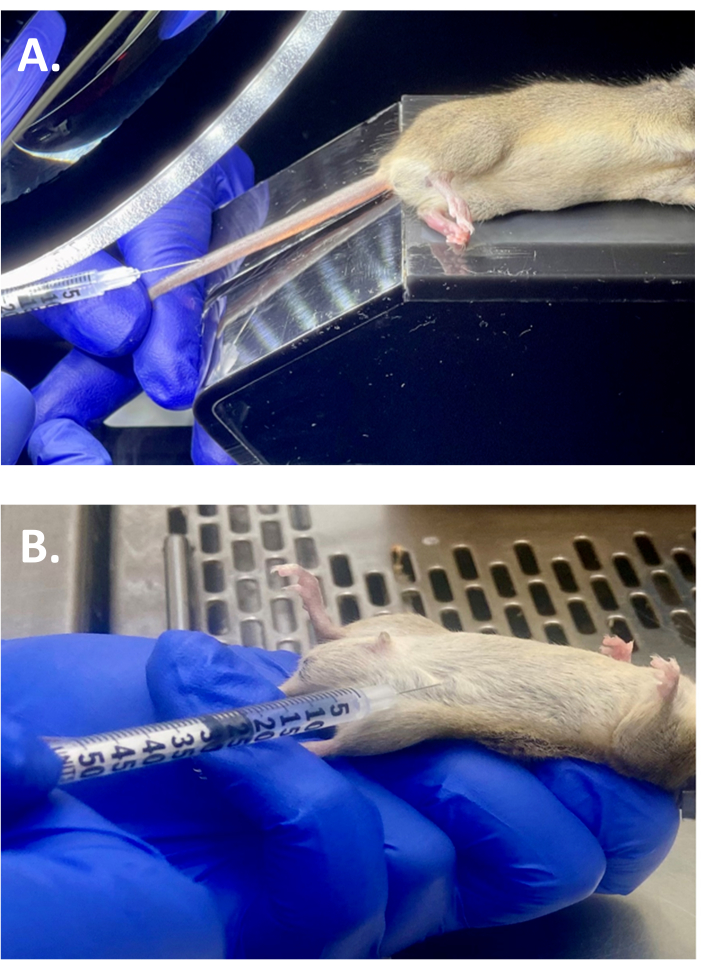
איור 2: הליכי הזרקה. (A) תמונה מייצגת המדגימה את הזרקת ורידי הזנב תוך ורידי (i.v.) של AAV9-cTnT-LDLR בעכבר WT על רקע זן 129J. (B) איור של הזרקה תוך-צפקית של P-407 בעכבר WT על רקע זן 129J שטופל בעבר במינון i.v. יחיד של AAV9-cTnT-LDLR. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
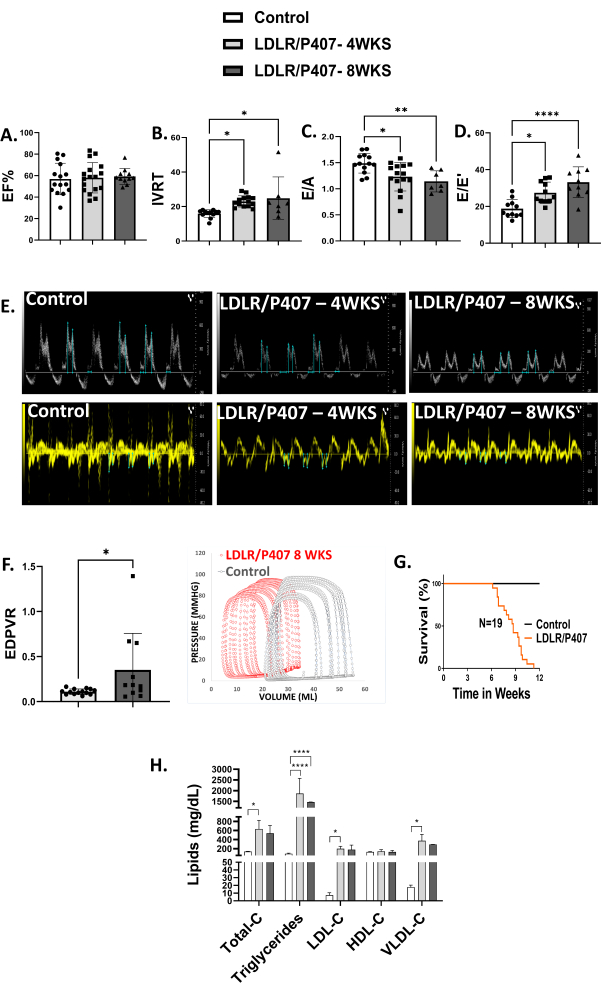
איור 3: HFpEF לבבי-מטבולי. (A-E) פרמטרים של אקוקרדיוגרפיה המצביעים על אי ספיקת לב עם מקטע פליטה שמור (HFpEF) לאחר 4 (n = 17) ו -8 שבועות (n = 11) של טיפול LDLR/P-407 בהשוואה לעכברים שלא טופלו (n = 15). עדות לכך היא מקטע פליטה שמור, זמן הרפיה איזובולומי ממושך (IVRT), E / E מוגבר ו E / A מופחת, כל האינדיקטורים של תפקוד דיאסטולי. (F) רכישת לולאת נפח לחץ וניתוחים גילו שיפוע מוגבר של יחסי לחץ-נפח דיאסטולי (EDPVR) לאחר 8 שבועות של טיפול. (G) מוות פתאומי התרחש בין 6 ל -12 שבועות לאחר הטיפול ב- LDLR/P-407. (H) פאנל שומנים תמך בממצאים של היפרליפידמיה בעכברים שטופלו ב-LDLR/P407 לאחר 4 (n = 4) ו-8 שבועות (n = 3), כפי שמעידים רמות כולסטרול כלליות גבוהות, טריגליצרידים, ליפופרוטאין בצפיפות נמוכה מאוד (VLDL), כולסטרול ליפופרוטאין בצפיפות נמוכה (LDL) ורמות כולסטרול ליפופרוטאין נורמליות בצפיפות גבוהה בהשוואה לעכברים שלא טופלו (n = 5). הנתונים מיוצגים כממוצע ± SD. *P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.0001. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
למרות העלייה המתמדת בשכיחות של HFpEF בעשור האחרון, הבנה קונקרטית של הפתופיזיולוגיה הבסיסית נותרה חמקמקה13. יתר על כן, נכון להיום, קיים טיפול מוגבל מבוסס ראיות13. יש צורך בהבנה משופרת של המנגנונים המעורבים ב-HFpEF קרדיו-מטבולי. בעבר הוצג מודל עכבר היפרליפידמי המחקה HFpEF ללא מחלת כליות כרונית (CKD) או יתר לחץ דם הנגרם על ידי זריקות LDLR OE ו-p4079.
הממצאים הראו כי השילוב של LDLR OE לבבי והיפרליפידמיה גורם לתפקוד דיאסטולי, הפרעות קצב, היפרטרופיה של החדר השמאלי (LV), אי סבילות לפעילות גופנית, הצטברות שומנים בלב ופיברוזיס בעכברים לאחר ארבעה שבועות, כפי שפורסם קודם לכן9. כמו כן נצפתה עלייה בספיגת כולסטרול LDL בלב, בכבד ובשרירי השלד וירידה בטריגליצרידים בלב ובכבד של עכברים אלה9. יתרונה של שיטה זו טמון במהירות שלה לחקר מסלולי תסמונת לב-מטבולית, שאינם מובנים היטב בהשוואה למודלים אחרים של עכברי HFpEF היפרליפידמיים, כגון דיאטה עתירת שומן (HFD) הדורשים עד 16 ו -20 שבועות לפתח14. פיתוח מודל זה אורך ארבעה שבועות והוא מחקה הפרעות מטבוליות בבני אדם. לכן, יכולת השחזור של מודל זה היא חיונית.
זה הכרחי כדי להבטיח הכנה יסודית וניהול של AAV9-cTnT-LDLR ו P-407. יכולת השכפול של מודל זה תלויה מאוד בחישובים מדויקים של ריכוזים ומינונים של P-407 ו- AAV9-cTnT- LDLR, כמו גם מדידות משקל. לא פחות חשובים הם תכשירי תמיסה וטכניקות הזרקה תוך ורידית ותוך צפקית נכונות. סטיות בטכניקות אלה עלולות לגרום לשינויים משמעותיים ולתוצאות לא רצויות.
למרות האפקטיביות והיעילות של מודל זה, קיימות מספר מגבלות. יש צורך בהכשרה קפדנית לביצוע זריקות תוך ורידי ותוך צפק. בנוסף, קיים סיכון פוטנציאלי לתחלואה ולתמותה הקשורים לזריקות תוך ורידי ותכופות תוך צפקיות. פציעות זנב עכבר עלולות להיגרם בעת ביצוע זריקות תוך ורידי, בעוד ניקוב cecal עלול להתרחש עם זריקות intraperitoneal, המוביל דלקת הצפק15. פציעות אלה נובעות בדרך כלל מטכניקות שגויות ועלולות לגרום לאיבוד נבדקים ניסיוניים וטיפול. לכן, יש צורך בהכשרה מקיפה לפני ביצוע הליכים אלה. מגבלה נוספת היא המיקוד של דגם זה בזן 129J. הרציונל מאחורי הבחירה בזן 129J נובע ממחקרים ראשוניים שהניבו תפקוד דיאסטולי מהיר יותר וממצאי HFpEF בזן זה בהשוואה לעכברי C57BL/6 שחקרנו בתחילה במחקרים שלא פורסמו.
ללא קשר למגבלות אלה, מודל זה יאפשר חקירות מהירות יותר של המנגנונים הבסיסיים המעורבים ב- HFpEF ואפשרויות טיפול יעילות פוטנציאליות. מחקרים קודמים הובילו לפיתוח מודל פתופיזיולוגי עבור HFD המושרה על ידי HFpEF ו- N[w]-nitro-l-arginine methyl ester (L-NAME) במשך 5-15 שבועות13. עם זאת, בשל העלייה המתמדת בשכיחות של HFpEF, יש צורך דחוף בהבנה נוספת של הפתופיזיולוגיה של HFpEF cardiometabolic ופיתוח טיפול יעיל. מודל מורין זה של LDLR OE לבבי והיפרליפידמיה הנגרמת על ידי p407 הוא שיטה מהירה ואפשרית לגרימת HFpEF קרדיומטבולי למאמצי מחקר עתידיים.
Disclosures
JH רשום כממציא שותף על פטנטים על אנלוגים GHRH, אשר הוקצו לאוניברסיטת מיאמי והמחלקה לענייני חיילים משוחררים. JH החזיקה בעבר במניות בחברת Biscayne Pharmaceuticals, בעלת הרישיון לקניין רוחני שנעשה בה שימוש במחקר זה. Biscayne Pharmaceuticals לא סיפקה מימון למחקר זה. JH דיווחה שיש לה פטנט על טיפול מבוסס תאי לב. הוא מחזיק במניות ב-Vestion Inc. ומקיים מערכת יחסים מקצועית עם Vestion Inc. כיועץ וחבר במועצת המנהלים ובמועצה המדעית המייעצת. JH הוא המדען הראשי, יועץ מתוגמל וחבר במועצה המייעצת של Longeveron ומחזיק במניות בלונגוורון. JH הוא גם ממציא שותף של קניין רוחני המורשה Longeveron. Longeveron LLC ו- Vestion Inc. לא השתתפו במימון עבודה זו. הקשרים של JH נחשפים לאוניברסיטת מיאמי, ותוכנית ניהול קיימת.
Acknowledgements
אנו מודים ל-Penncore ול-NHLBI Gene Therapy Resource Program (GTRP) על מימון הדור של הנגיף הקשור לאדנו המשמש בפרויקט זה. מחקר זה מומן על ידי מענקים מהמכון הלאומי לבריאות (NIH) (1R01HL140468) והמכון לחקר הלב במיאמי ל-LS. MW זכתה בפרס תוספת הגיוון של NIH בין השנים 2020 - 2022 (R01HL140468- 03S1). JH ממומן על ידי 1R01 HL13735, 1R01 HL107110, 5UM1 HL113460, 1R01 HL134558, 5R01 CA136387 (מה-NIH), W81XWH-19-PRMRPCTA (ממשרד ההגנה), והקרנות המשפחתיות סטאר, ליפסון וסופר.
Materials
| Name | Company | Catalog Number | Comments |
| Adeno-associated virus 9-cardiac troponin T-LDLR (AAV9-cTnT-LDLR) | U. Penn Vector Core, funded by the NHLBI Gene Therapy Program (GTRP) | Transgene plasmids and AAVs particles were generated by the U. Penn Vector Core, funded by the NHLBI Gene Therapy Program (GTRP). AAV were provided in Dulbecco’s phosphate-buffered saline (PBS) with 0.001% Pluronic F68. The Core determined AAV titers by digital droplet polymerase chain reaction (ddPCR) and assessed all preparations for capsid protein ratio by SDS-PAGE and for the presence of endotoxin. Constructs include the human (h) transcripts tagged by 3X HA, Penn Vector Core (RRID: SCR_022432). AAV9-cTNT-hLDLR plasmid encodes the full human LDLR protein (2664bp). | |
| Imaging systems with a high frequency transducer probe MS400 | (VisualSonics, Toronto, ON, Canada) | Vevo 2100 or 3100 | |
| Isoflurane | Akorn Animal Health, Inc. | NDC: 59399-106-01 | |
| LabChart software | ADInstruments | Pro version 8.1.5 | |
| Poloxamer 407 | Sigma-Aldrich | 16758 | |
| PV catheter | Millar Instrument | PVR 1035 | |
| Ultrasound analysis software | Vevo Lab | ||
| Wild-type (WT) mice on 129J background | Jackson Laboratory |
References
- Roger, V. L. Epidemiology of heart failure: A contemporary perspective. Circ Res. 128 (10), 1421-1434 (2021).
- Kosiborod, M. N., et al. Design and baseline characteristics of step-HFpEF program evaluating semaglutide in patients with obesity hfpef phenotype. JACC Heart Fail. 11 (8), 1000-1010 (2023).
- Borlaug, B. A. Evaluation and management of heart failure with preserved ejection fraction. Nat Rev Cardiol. 17 (9), 559-573 (2020).
- Badrov, M. B., Mak, S., Floras, J. S. Cardiovascular autonomic disturbances in heart failure with preserved ejection fraction. Can J Cardiol. 37 (4), 609-620 (2021).
- Wu, C. K., et al. Myocardial adipose deposition and the development of heart failure with preserved ejection fraction. Eur J Heart Fail. 22 (3), 445-454 (2020).
- Hahn, V. S., et al. Myocardial gene expression signatures in human heart failure with preserved ejection fraction. Circulation. 143 (2), 120-134 (2021).
- Korolenko, T. A., et al. Early-stage atherosclerosis in poloxamer 407-induced hyperlipidemic mice: Pathological features and changes in the lipid composition of serum lipoprotein fractions and subfractions. Lipids Health Dis. 15, 16 (2016).
- Patel, M., et al. Osteopontin and ldlr are upregulated in hearts of sudden cardiac death victims with heart failure with preserved ejection fraction and diabetes mellitus. Front Cardiovasc Med. 7, 610282 (2020).
- Williams, M., et al. Mouse model of heart failure with preserved ejection fraction driven by hyperlipidemia and enhanced cardiac low-density lipoprotein receptor expression. J Am Heart Assoc. 11 (17), e027216 (2022).
- Colly, A., Marquette, C., Courtial, E. J. Poloxamer/poly(ethylene glycol) self-healing hydrogel for high-precision freeform reversible embedding of suspended hydrogel. Langmuir. 37 (14), 4154-4162 (2021).
- Kanashiro-Takeuchi, R. M., et al. Efficacy of a growth hormone-releasing hormone agonist in a murine model of cardiometabolic heart failure with preserved ejection fraction. Am J Physiol Heart Circ Physiol. 324 (6), H739-H750 (2023).
- Dulce, R. A., et al. Synthetic growth hormone-releasing hormone agonist ameliorates the myocardial pathophysiology characteristic of heart failure with preserved ejection fraction. Cardiovasc Res. 118 (18), 3586-3601 (2023).
- Borlaug, B. A., et al. Obesity and heart failure with preserved ejection fraction: New insights and pathophysiological targets. Cardiovasc Res. 118 (18), 3434-3450 (2023).
- Noll, N. A., Lal, H., Merryman, W. D. Mouse models of heart failure with preserved or reduced ejection fraction. Am J Pathol. 190 (8), 1596-1608 (2020).
- Guarnieri, M. Considering the risks and safety of intraperitoneal injections. Lab Anim (NY). 45 (4), 131 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved