Трехмерная томография всего органа с высоким разрешением при микробных инфекциях
In This Article
Summary
В этой статье мы опишем процедуру, которая позволяет обнаруживать патогенные бактерии во время инфекции в масштабах всего органа и количественно оценивать активность флуоресцентных репортеров.
Abstract
Большинство инфекций происходит в трехмерных тканях хозяина со сложной анатомией и локально изменяющейся физиологией хозяина. Расположение клеток патогена в этой разнообразной среде значительно влияет на уровень их стресса, реакции, судьбу и вклад в общее прогрессирование заболевания и неудачу лечения. Тем не менее, из-за технических трудностей в обнаружении клеток патогена размером мкм в органах-хозяевах, эта область исследований была относительно неизученной. В этой статье мы представляем метод решения этой проблемы. Мы используем серийную двухфотонную томографию и анализ изображений с помощью искусственного интеллекта для обнаружения отдельных клеток сальмонеллы по всей селезенке, долям печени и целым лимфатическим узлам инфицированных мышей. С помощью флуоресцентных репортеров и введения антител in vivo можно определить скорость репликации отдельных клеток сальмонеллы , их местное взаимодействие со специфическими иммунными клетками и бактериальные реакции на антибиотики. Эти методологии открывают возможности для всестороннего изучения инфекций, их профилактики и лечения в трехмерном тканевом контексте.
Introduction
Инфекции возникают в тканях со сложной анатомией и компартментализированной физиологией. Различные микросреды, которые сосуществуют в инфицированной ткани, могут определять судьбу местных подгрупп патогенов и их вклад в общий исход заболевания 1,2,3. Тем не менее, всестороннее 3D-картирование микробных патогенов в тканях размером в см остается сложной задачей4. Визуализация мозга и других органов является высокоактивной областью исследований с постоянно совершенствующимися экспериментальнымистратегиями, но многим методам все еще не хватает разрешения в пределах менее мкм, которое потребовалось бы для уверенной идентификации бактериальных патогенов размером мкм. В отличие от этого, серийная двухфотонная (STP) томография6 позволяет автоматически получать многоцветную визуализацию целых тканей без деформаций с разрешением менее μм в плоскости, что позволяет получать полные объемные наборы данных. Этот метод сочетает в себе повторное физическое срез ткани с помощью вибратома с прерывистой двухфотонной визуализацией возникающих граней блока инфракрасным светом. STP-томография широко используется для картирования тонких аксонов в мозге для установления карт связей 7,8,9,10.
STP-томография также позволяет 3D-картирование отдельных клеток микробного патогена (сальмонеллы, токсоплазмы) во всех инфицированных тканях11,12 с помощью томографа. Генерация второй гармоники выявляет коллагеновые оболочки вокруг артерий и в фиброзных полосах, таких как трабекулы селезенки, тем самым обеспечивая анатомический контекст. Введенные флуоресцентные антитела in vivo могут быть использованы для окрашивания клеток хозяина, чтобы выявить взаимодействия между отдельными клетками патогена и инфильтрирующими иммунными клетками, такими как нейтрофилы. В данной работе описывается процесс, включающий обработку ткани, визуализацию, сшивание изображений с коррекцией освещенности, наложение изображений в трех измерениях и сегментацию с использованием инструментов машинного обучения. Этот конвейер дает 3D-положение отдельных патогенов, клеток и микроколоний в контексте хозяина. Подсчет количества отдельных клеток в микроколониях остается сложным из-за пределов разрешения, но такие числа могут быть оценены на основе интегрированной яркости микроколонии. Конвейер может быть легко адаптирован к другим моделям инфекции при наличии рекомбинантных GFP- или YFP-экспрессирующих патогенов.
Protocol
Все описанные здесь эксперименты на животных одобрены государственными органами (лицензия 2239, Kantonales Veterinäramt Basel) и соответствуют местным директивам (Tierschutz-Verordnung, Базель) и швейцарскому закону о защите животных (Tierschutz-Gesetz).
1. Подготовка и хранение инфицированных тканей
- Используйте модель заражения по своему выбору. Здесь мыши в возрасте от 10 до 16 недель обоего пола заражаются ~1000 колониеобразующими единицами (КОЕ) путем внутривенной инъекции или 5 x 107 КОЕ путем внутрижелудочного введения иглой с круглым концом. Подходящие линии мышей включают BALB/c и C57BL/6.
Примечание: Тот же подход может быть легко адаптирован для других видов-хозяев. - Убедитесь, что патогены экспрессируют флуоресцентные белки для обеспечения идентификации в неокрашенных тканях. Патогены, экспрессирующие GFP.mut213, YPet14, TIMERbac15 или mWasabi16 , могут быть визуализированы с использованием возбуждения 940 нм17. Сальмонеллы , экспрессирующие mCherry18 на уровнях, легко обнаруживаемых с помощью проточной цитометрии19 , могут быть визуализированы с использованием возбуждения 800 нм, но имеют плохое отношение сигнал/фон в инфицированной селезенке и печени, которые демонстрируют значительную автофлуоресценцию.
- Убедитесь, что все флуоресцентные белки сохраняют >70% от интенсивности флуоресценции после фиксации параформальдегидом при нейтральном pH на основе количественного определения с помощью проточной цитометрии. Здесь используются инфицированные ткани мыши, а именно селезенка, печень, лимфатические узлы, пейеровы пластыри.
- Окрашивание маркеров поверхности клеток хозяина in vivo путем инъекции антител, меченных фикоэритрином (ПЭ), за 10 минут до перфузии. Для окрашивания нейтрофилов следует ввести внутривенно 4 мкг анти-Ly-6G-PE в 100 мкл PBS. Чтобы окрашивать макрофаги маргинальной зоны в селезенке, введите 4 мкг анти-CD169-PE в 100 мкл PBS (см. Таблицу материалов).
- Фиксация инфицированных тканей с помощью стандартной транскардиальной перфузии20 с 15 мл ледяного 50 мМ фосфатного буфера (PB; 10 мМ2PO4, 40 мМНа2HPO4, pH 7,4) с последующим добавлением 35 мл 4% параформальдегида (PFA; фиксатора) в PB (рис. 1A).
- Вкратце, ввести инфицированному животному глубокую анестезию путем внутрибрюшинного введения 100 мг/кг кетамина и 16 мг/кг ксилазина. Обеспечьте надлежащую анестезию, подтвердив потерю рефлекса защемления пальца ноги.
- Продезинфицируйте мех с помощью 70% этанола, высушите его стерильным бумажным полотенцем, а также хирургическим путем вскройте грудную клетку пинцетом и ножницами. Поместите стерильную иглу в левый желудочек сердца, откройте правое предсердие стерильными ножницами и пропустите первый буфер, а затем фиксирующее средство через иглу, левый желудочек и всю сосудистую систему с помощью насоса. Это быстро и равномерно фиксирует все ткани и вызывает эвтаназию.
- Соберите ткань после перфузии, инкубируйте ее в 20-кратном объеме 4% холодного параформальдегида в буфере PB и поместите на шейкер при температуре 4 °C на ночь (рис. 1B). Визуализация возможна для тканей в диапазоне размеров от 0,05 до 2 см3 . Для более крупных тканей нарезать подходящими кусочками.
- На следующий день промойте салфетку 3 раза по 10 минут с PB-буфером с встряхиванием при 40 об/мин при комнатной температуре для удаления PFA.
ПРИМЕЧАНИЕ: Из-за токсичности PFA эти действия необходимо выполнять внутри вытяжного шкафа. Утилизируйте отходы PFA в соответствии с руководящими принципами учреждения. - Удалите излишки буфера PB и добавьте в образец 20x объем криопротекторного буфера21 (876 мМ сахарозы, 0,25 мМ поливинилпирролидона, 40% (v/v) этиленгликоля, растворенного в 50 мМ PB буфере) с встряхиванием при 40 об/мин при 4 °C в течение 6-8 ч или до тех пор, пока ткани не опустятся на дно. Образцы инкубируют при -20 °C в течение не менее 3 дней, чтобы обеспечить эффективное снижение аутофлуоресценции тканей11. Образцы можно использовать до 5 лет при хранении при температуре -20 °C.
ПРИМЕЧАНИЕ: Погружение ткани указывает на правильное проникновение буфера для хранения в ткань.
2. Встраивание образцов
- Встройте ткань в агарозный блок для ровного среза с помощью вибратома. Предварительно активируйте агарозу химически путем окисления периодатом, а затем восстановите борогидридом для образования поперечной сшивки с тканью для улучшения стабильности в процессе резки. Выполните действия, описанные ниже.
- Приготовьте 4% окисленную агарозу весом 2,25 г агарозы и добавьте 0,21 г NaIO4. Добавьте 100 мл PB к агарозе и NaIO4. Размешать при комнатной температуре в вытяжном шкафу в течение 2-3 ч с защитой от света.
ПРИМЕЧАНИЕ: Критический этап: Не превышайте перемешивание более 3 часов, иначе агароза будет плохо полимеризоваться. - Агарозу можно извлечь методом мембранной фильтрации в стандартном вакуумном фильтре с мембраной 0,2 мкм. Удалите остатки NaIO4 , промыв 3 раза 50 мл PB буфера. Ресуспендируйте окисленную агарозу в 50 мл PB-буфера.
ПРИМЕЧАНИЕ: Не расплавляйте агарозу на этом этапе. Агарозу можно хранить при температуре 4 °C до 2-3 недель в защищенном от света месте. - Приготовьте раствор борогидрида, добавив в 1 л воды 19 г буры и 3 г борной кислоты. Перемешайте до полного растворения и отрегулируйте pH до 9-9,5 с 1 М NaOH. На перемешивающей пластине в вытяжном шкафу нагрейте 100 мл боратного буфера до 40 °C. Добавьте 0,2 г NaBH4 и перемешивайте 15-30 минут, защищая от света.
ПРИМЕЧАНИЕ: Раствор борогидрида можно хранить в течение нескольких недель при комнатной температуре в темноте. Критический этап: При добавлении NaBH4 в боратный буфер образуется газ, поэтому проведите этот этап внутри вытяжного шкафа. Не выполняйте этот шаг в плотно закрытом контейнере, так как это может привести к взрыву. - Достаньте салфетку из морозильной камеры после достаточной инкубации для снижения автофлуоресценции (≥ 3 дня), удалите избыток буфера для хранения криопротектора и промойте ткань 3 раза в течение 10 минут с PB-буфером с встряхиванием при 40 об/мин при комнатной температуре (RT).
- Растопите примерно 20 мл окисленной агарозной суспензии (приготовленной на шаге 1) в микроволновой печи (700 Вт в течение ~30 с), дайте ей остыть достаточно для обработки (~45 °C) и вылейте в пластиковую форму.
ПРИМЕЧАНИЕ: Критический шаг: Не добавляйте агарозу сразу после нагрева в микроволновой печи на образец, это может привести к разрушению ткани. - С помощью пинцета аккуратно возьмите салфетку и быстро введите ее в нижнюю часть центра агарозы. Инкубируйте форму при температуре RT в течение 15 минут, чтобы агароза полимеризовалась.
- После полимеризации агарозы откройте пластиковую форму скальпелем с четырех ее углов и осторожно поднимите кубик агарозы пальцами в перчатках.
- Погрузите образец в раствор борогидрида (приготовленный на этапе 2) на 2-3 ч при 4 °С, чтобы инициировать сшивание окисленной агарозы и ткани. Это предотвращает отслоение ткани во время секции.
ПРИМЕЧАНИЕ: Критический этап: Погруженный образец в борогидрид должен инкубироваться в защищенном от света месте при температуре 4 °C. - Промойте агарозный кубик с PB буфером 2x в течение 10 минут. Поверните агарозный кубик так, чтобы ткань оказалась с верхней стороны и прикрепите блок к магнитному предметному стеклу (предметному стеклу микроскопа с двумя магнитами, прикрепленному к обратной стороне) с помощью нескольких капель мгновенного клея. Для затвердевания клея требуется 10-20 минут, поэтому поместите бумажную салфетку с каплями буфера PB поверх агарозы, гарантируя, что образец остается достаточно увлажненным (Рисунок 1C).
3. Подготовка микротома и подготовка сцены
- Поместите магнитное стекло на металл в центр коробки с образцами томографа.
- Наполните коробку буфером PB и осторожно расположите ее на предметном столике и затяните винт слева, чтобы закрепить коробку с образцами на столике томографа.
ПРИМЕЧАНИЕ: Не затягивайте винты слишком сильно, иначе это повредит пластиковую коробку. - Поместите лезвие на микротом и осторожно сместите положение образца рядом с микротомом и под ним. Верхняя поверхность агарозы должна находиться на одном уровне с лезвием микротома.
ПРИМЕЧАНИЕ: Слишком низкое расположение приведет к потере времени на резку, в то время как слишком высокое расположение приведет к удалению большого куска блока при первом разрезе. - Переместите сцену, чтобы расположить агарозный куб к центру цели, и нажимайте несколько раз на кнопку «Разрезать » в программе томографа, пока не получите неповрежденный кусок всего агарозного куба.
4. Выделение поверхности и получение 2D изображений
- Центрируйте линзу объектива на образце ткани по осям X и Y.
- Откройте программу для работы с лазером и включите ее в программе. Услышав тикающий звук, включите лазерный выключатель и отрегулируйте длину волны на 800 нм.
ПРИМЕЧАНИЕ: Перед получением изображения лазерный источник необходимо прогреть не менее 30 минут, в идеале 1 час. - Закройте дверцы шкафа микроскопа, выключите все источники света в комнате, включите ФЭУ и установите напряжение на 750 В.
ПРИМЕЧАНИЕ: Критический шаг: ФЭУ очень чувствительны к свету, держите его выключенным, если дверцы шкафа не закрыты и все источники света в комнате не выключены. - Отрегулируйте параметры протокола программного обеспечения томографа, как указано выше, и установите автоматический режим затвора микроскопа, а напряжение — на 20 и 3 для V1 и V2 соответственно.
- Нажмите на кнопку 2D в программном обеспечении томографа, чтобы сделать снимок образца.
- Как только появится изображение с видимой автофлуоресценцией, отрегулируйте z-пьезо, чтобы установить фокальную плоскость на поверхности агарозного куба. Первое сканирование будет проведено на глубине 20 мкм под поверхностью, чтобы получить стабильное изображение образца.
- Если автофлуоресцентный фон не виден, увеличивайте контрастность до тех пор, пока не появится сигнал. Может случиться так, что видимого сигнала нет (т.е. из-за агарозы сверху ткани). В этом случае отрегулируйте ось Z с помощью z-пьезоустройства до тех пор, пока она не достигнет поверхности агарозы. Ручное перемещение объектива может потребоваться, если нужное положение находится за пределами диапазона z-пьезоустройства.
- Разрежьте несколько срезов размером 50 мкм после нахождения поверхности образца и получайте 2D-изображения после каждого разреза, чтобы убедиться, что фокальная плоскость правильно установлена на поверхности блока.
5. Нахождение краев образцов и установка лазера в начальную точку
- На основе xy-координат области лазерного сканирования (4 угловые координаты) ограничить область визуализации тканью с минимальной визуализацией окружающего агарозного блока.
- Выключите ФЭУ, установите длину волны лазера на 800 нм, переключите лазерный затвор в положение открытия. Положение лазерного света, входящего в агарозный блок, видно в виде красного пятна рассеянного света (рис. 2A, B).
Критический шаг: Будьте особенно осторожны с лазером класса 4. Он может быстро повредить ткани и глаза человека. Персонал нуждается в специальной подготовке для безопасной работы с таким прибором. - Используйте лазерное пятно при перемещении рабочей области, чтобы найти координаты краев тканей в последовательности назад, вправо, спереди и влево.
- Перепроверьте координаты и расположите лазерное пятно в правом переднем углу, который по умолчанию является отправной точкой для визуализации ткани.
- Преобразуйте координаты из окна консоли в распознаваемые машиной размеры блоков, которые определяются шагами xy. Занесите эти пошаговые измерения в протокол программного обеспечения. Закройте дверцы шкафа.
6. 3D сканирование / резирование
- Измените длину волны на 940 нм, чтобы возбудить GFP, mWasabi или YPet и PE.
ПРИМЕЧАНИЕ: Лазер невидим для человеческого глаза на этой длине волны. Чтобы улучшить соотношение сигнал/фон для GFP, mWasabi и зеленого излучающего компонента TIMERbac, установите узкополосный фильтр 510/20 нм перед PMT 2. Это снижает интерференцию за счет зелено-желтой автофлуоресценции тканей. - Переключите затвор микроскопа в автоматический режим, а настройки напряжения затвора на 20 для V1 и 1,71 для V2.
- Отрегулируйте следующие три параметра в программном обеспечении: Толщина сечения - для большинства целей установите значение 50 мкм. Для печени установите значение 30 мкм из-за ограниченной глубины визуализации. Количество физических срезов - это определяет общую глубину ткани, которая будет визуализирована, установленную соответствующим образом. Количество плоскостей для захвата для каждой секции - это определит разрешение z. Используйте 5 плоскостей (с разрешением по вертикали 10 мкм) для большинства целей. Для печени используют 3 или менее плоскостей.
- Установите усиление лазера. Это должно быть эмпирически проверено для различных тканей и глубины сканирования.
- Определите путь к папке и имя для хранения полученных изображений и предоставьте соответствующую информацию для метафайла изображений.
- Перепроверьте все введенные значения.
- Нажмите на настройку 3D-мозаики , чтобы начать процесс сканирования (Рисунок 1D).
- После завершения визуализации тщательно соберите срезы тканей из резервуара для воды и храните их в буфере для хранения при температуре -20 °C до дальнейшего использования (Рисунок 1E; Рисунок 2C, D).
7. Обработка изображений и анализ данных
- Загрузите скрипты MATLAB на компьютер с Linux с https://github.com/BumannLab/Li_BumannLab_2020. Скопируйте скрипты в папку, например, /home/user/Program/.
ПРИМЕЧАНИЕ: Дополнение Computer Vision Toolbox для MATLAB и Fiji (или ImageJ) должно быть установлено на компьютерах Linux, чтобы скрипт был полностью функциональным. - Сшейте изображения плитки, как описано ниже.
- Передача данных с сервера томографа на компьютер с Linux.
- Откройте скрипт MATLAB StepOneStitchingAndArchive.m и найдите исходную папку, содержащую необработанные данные. Определите исходную и конечную папки в скрипте.
- Переключитесь на вкладку Редактор и нажмите Выполнить. Информация о ходе выполнения отображается в командном окне. Обработка включает в себя считывание информации из файла Mosaic, генерацию индекса плитки перед сшивкой изображения, коррекцию освещенности фона с помощью Cidre22 (рис. 3), а также коррекцию освещенности между оптическими слоями, полученными на разной глубине. Найдите сшитые изображения во вложенной папке stitchedImages_100 в исходной папке. Сожмите необработанные данные для долгосрочного хранения с помощью команды tar и сохраните их в виде одного файла с расширением tar.bz2 (Рисунок 1F).
- Выполняйте обучение модели и сегментацию с помощью метода опорных векторов. Чтобы обучить метод опорных векторов и выполнить сегментацию, выполните следующие действия.
ПРИМЕЧАНИЕ: Сшитые изображения для каждого из трех флуоресцентных каналов хранятся в 3 подпапках (именах 1, 2 и 3, соответствующих красной, оранжевой и зеленой флуоресценции) stitchedImages_100. Каждая подпапка содержит все сшитые изображения из одного канала.- Просмотрите сшитые изображения. Откройте одно изображение с одинаковым именем файла из каждой подпапки с Fiji (или ImageJ). Объедините три канала в одно цветное изображение. Регулируйте яркость каждого канала до тех пор, пока не будут видны четкие сигналы от бактерий и автофлуоресценции тканей. Обратите внимание на скорректированный максимальный уровень интенсивности каждого канала для следующего шага.
- Откройте скрипт MATLAB StepTwoSegmentationAndAnalysis.m и перейдите к источнику. Определите исходную папку и имена образов для обучения. Например
sourceD = '/' ;
red_name = [исходный D '1/section_020_01.tif']; green_name = [исходный D '2/section_020_01.tif'];
blue_name = [исходныйD '3/section_020_01.tif']; - Перейдите на вкладку «Редактор» и нажмите «Выполнить».
- Появится диалоговое окно с запросом цветовых порогов, заполните его на основе предыдущей ручной проверки с помощью Fiji (шаг 7.3.1).
- Выберите области для фона и области интереса (например, бактерии) в соответствии с диалоговыми окнами. Появятся графики, показывающие, насколько хорошо модель была обучена, и спрашивают, нужно ли добавить дополнительные регионы. Добавляйте больше областей интереса и фона до тех пор, пока бактерии не будут четко сегментированы (рис. 4A, B).
- Присвойте имя и сохраните модель. Скрипт автоматически загрузит изображения и применит медианный фильтр (радиус 2 пикселя).
- Процесс сегментации запускается автоматически, а информация о ходе выполнения отображается в командном окне. Следите за ходом сегментации. Если сегментация плохо работает с моделью на других сшитых изображениях, повторите обучение модели, чтобы включить больше фоновых и бактериальных областей.
- Чтобы увидеть результаты сегментации, проверьте файл с именем Allpositions_filter3D.txt. Этот файл содержит координаты центра тяжести для каждой бактерии или бактериальной микроколонии и соответствующую интегральную интенсивность флуоресценции (рис. 1G).
- Удалите дополнительные артефакты с помощью сверточной нейронной сети, как описано ниже.
ПРИМЕЧАНИЕ: Для некоторых бактерий простая сегментация с помощью метода опорных векторов все еще включает в себя некоторые артефакты визуализации. Это особенно верно для бактерий, экспрессирующих YPet. Сегментация на основе нейронных сетей может эффективно удалять эти артефакты (рис. 4C). Дополнение Computer Vision Toolbox для MATLAB и Fiji (или ImageJ) должно быть установлено на компьютерах с Windows, чтобы скрипт был полностью функциональным. Для получения информации о базовой нейронной сети см.: https://ch.mathworks.com/help/deeplearning/ug/create-simple-deep-learning-network-for-classification.html- Подготовьте изображения. Конвертируйте файлы tif в файлы jpg с различными настройками яркости с помощью Fiji. Определите с помощью ручной обработки не менее 600 бактерий и 600 артефактов и безопасные обрезанные изображения этих объектов в соответствующих папках.
- Откройте скрипт MATLAB CNNtestV4.m и перейдите к исходным файлам, содержащим изображения объектов шага 7.4.1.
- Определите папку с изображением для обучения. Например
digitDatasetPath = fullfile ('D:\20200602_CNN','fortrainingPixel12Folder2');
Определите количество изображений для обучения, например, numTrainFiles = 600. - Перейдите на вкладку «Редактор» и нажмите «Выполнить». После обучения файл модели CNN сохраняется как gregnet1.mat в исходной папке.
- Определите папку с тестовыми изображениями. Например
digitDatasetPathTest = fullfile('D:\20200602_CNN\fortrainingPixel12Folder2\R2500G550B450yfp').
Результаты сохраняются в файле YourFile.txt, который содержит информацию о названии изображения и классификации как бактерии или артефакты. - Определите папку с тестовыми изображениями. Например
digitDatasetPathTest = fullfile('D:\20200602_CNN\fortrainingPixel12Folder2\R2500G550B450yfp').
Результаты будут сохранены в файле YourFile.txt, который содержит информацию о названии изображения и классификации как бактерии или артефакты.
- Оцените размер микроколоний на основе интенсивности флуоресценции отдельных бактерий, как описано ниже.
Примечание: Пространственное разрешение томографа недостаточно для определения отдельных бактериальных клеток в плотно упакованных микроколониях. Тем не менее, количество бактерий в каждой микроколонии может быть оценено на основе общей флуоресценции микроколонии по отношению к флуоресценции отдельных бактерий. Точность этой оценки зависит от однородности интенсивности флуоресценции в популяции бактерий.- Подтвердите идентичность GFP-положительных событий на STP-томографии путем окрашивания бактериальных компонентов, таких как липополисахарид, с использованием иммуногистохимии полученных срезов из томографа (рис. 1H; Рисунок 5).
- Определите не менее 30 отдельных бактерий и извлеките их интенсивность флуоресценции из соответствующих результатов сегментации. Используйте медианное значение интенсивности в качестве эталона для одной бактерии. Рассчитайте бактериальное число каждой микроколонии, разделив общую интенсивность флуоресценции микроколонии на эталонное значение для одной бактерии (рис. 1I).
- Выполните 3D-реконструкцию с помощью программного обеспечения для визуализации, как описано ниже.
- Подготовка изображения
- Сделайте снимки синего канала, которые содержат сигналы второй гармоники коллагена, обеспечивающие полезную анатомическую информацию, включая тканевые капсулы, артерии и трабекулы. Используйте изображения, сегментированные по бактериям, в качестве2-го канала .
- Уменьшите изображения из1-го канала в 10 раз по осям X и Y и сохраните уменьшенные изображения в новой папке. Сделайте 3 репликации уменьшенных изображений в одной папке. Имена новых репликантов должны оставаться в той же последовательности. Например: section_001_01.tif, повторите 1 с именем section_001_01-copy.tif, section_001_01-copy-copy.tif. Примените эти действия также к изображениям со2-го канала. Уменьшение размера позволяет увеличить размер файлов. Тройные изображения сгладят ось z.
- Объедините изображения из каждого канала, чтобы сформировать стеки изображений с Фиджи. Нажмите Изображение > Стопки > Инструменты > Сортировщик стопок > Сортировать по меткам.
- Выполните 3D-фильтрацию. Нажмите Обработать > Фильтры > 3D-фильтр и установите размер Z-фильтра равным 6. Сохраните стеки изображений.
- Выполните 3D-визуализацию, как описано ниже.
- Откройте пакет программного обеспечения для визуализации в окне Арена (настройка по умолчанию). Используйте значок «Папка с часами», чтобы добавить папки в вид арены. Дважды щелкните мышью, чтобы открыть файл *.ims или *.tif (подготовленный в версии 7.6.1).
- С помощью команды «Правка>Свойства изображения» настройте цветовые представления (LUT) различных каналов в окне «Настройка отображения».
- Нажмите « Дополнительно », чтобы вручную установить минимальные/максимальные значения и значение для гамма-коррекции.
Нажмите на названия каналов, чтобы изменить имена и таблицы LUT. - После настройки внешнего вида изображения экспортируйте текущий вид с помощью инструмента «Снимок».
- Используйте значок «Анимация», чтобы представить 3D-данные в виде фильма. Используйте указатель навигации для поиска перспективы/вида и масштабирования, а также нажмите + Добавить для добавления ключевых кадров. Перейдите в другую позицию и добавьте следующий ключевой кадр. Нажмите кнопку «Красная запись », чтобы создать фильм. Сохраните его в нужной папке назначения и типе файла (рисунок 1J).
- Подготовка изображения
Representative Results
Описанная процедура позволяет обнаруживать отдельные клетки сальмонеллы во всех органах мыши, таких как селезенка, печень, брыжеечные лимфатические узлы и пейеровы пятна11 (рис. 5 и рис. 6). Он также обнаруживает паразитов Toxoplasma gondii в мозге мышей12. Некоторые инфицированные ткани, включая печень, пейеровы пятна и селезенку, выделяют значительную автофлуоресценцию в зелено-желтом диапазоне. Автофлуоресценция дополнительно усиливается за счет фиксации параформальдегидом, что необходимо для сохранения структуры ткани. Обнаружение зеленой флуоресценции от GFP, mWasabi и зеленого компонента TIMERbac на этом фоне автофлуоресценции улучшается за счет установки узкополосового фильтра 510/20 нм (пропускающего большую часть излучения GFP, но блокирующего большую часть спектра автофлуоресценции) перед фотоумножителем 2 (который собирает зеленые излучения) и снижением автофлуоресценции тканей путем хранения неподвижных тканей в течение 3 или более дней в криопротекторе11. Тем не менее, бактерии все равно должны экспрессировать, по крайней мере, несколько тысяч копий GFP или других флуоресцентных белков на клетку. С другой стороны, следует избегать чрезмерного уровня флуоресцентного белка, чтобы свести к минимуму затраты на физическую подготовку, которые могут привести к ослаблению вирулентности.
Правильная сегментация флуоресцентных бактерий в тканях может быть подтверждена иммуногистохимическим методом полученных участков тканей после визуализации. В частности, объекты, окрашенные антителом к бактериальным поверхностным компонентам, таким как липополисахарид, могут быть совмещены с флуоресцентным изображением, полученным с помощью STP-томографии (рис. 5). Важно отметить, что у некоторых окрашенных клеток сальмонеллы отсутствуют флуоресцентные белки и, таким образом, обнаруживаемая флуоресценция как при конфокальной микроскопии, так и при STP-томографии. Эти клетки представляют собой сальмонеллы , которые были убиты иммунной системой хозяина, что продемонстрировано проточной цитометрической сортировкой и выращиванием культур из отдельных отсортированных клеток, а также тесной корреляцией между числом колониеобразующих единиц на агаровых планшетах и количеством флуоресцентных клеток сальмонеллы , как определено с помощью проточной цитометрии24. Кроме того, потеря плазмиды может привести к образованию нефлуоресцентных жизнеспособных клеток, и это необходимо проверить путем нанесения на среду с соответствующими антибиотиками и без них, соответствующих маркеру выбора на плазмиде. Для плазмид, полученных из pSC101, потеря плазмид in vivo составляетредкость 19. Для большинства хромосомно интегрированных кассет с экспрессией, таких как sifB::gfp , используемых в11, потеря экспрессии не обнаруживается in vivo. Если сегментация не согласуется с данными иммуногистохимии, конвейер сегментации необходимо модифицировать.
Разрешение STP-томографии недостаточно для разлучения отдельных бактериальных клеток в плотно упакованных микроколониях. Тем не менее, общая интенсивность флуоресценции микроколонии позволяет оценить количество клеток сальмонеллы . Для этого требуется флуоресцентный штамм с высокооднородными уровнями флуоресценции, такой как Salmonella sifB::gfp11. Объединение расчетного количества клеток сальмонеллы для всех микроколоний и отдельных клеток дает общую бактериальную нагрузку на ткани, которая согласуется с альтернативными методами, такими как гальванизация или проточная цитометрия тканевых гомогенатов. Гальваническое покрытие и проточная цитометрия не могут быть выполнены непосредственно из одних и тех же тканей, потому что они должны быть зафиксированы перфузией для STP-томографии. Вместо этого их приходится делать с дополнительными животными, которые не закреплены. Если медиана бактериальной нагрузки, определяемая различными подходами, отличается более чем в 3 раза, жизнеспособность флуоресцентных бактерий может быть нарушена (в случае более низких колониеобразующих единиц) или некоторые бактерии могут потерять флуоресцентную репортерную конструкцию (в случае более высоких колониеобразующих единиц). Для выявления источника таких расхождений потребуется провести контрольный эксперимент.
STP-томография обеспечивает локализацию бактериальных клеток в трехмерной структуре инфицированных тканей. Вторые гармонические сигналы коллагена обеспечивают анатомические ориентиры, такие как артерии и трабекулы. Кроме того, клетки-хозяева могут быть окрашены in vivo путем введения антитела к поверхностным маркерам перед перфузией (рисунок 5 и рисунок 6). Это окрашивание обеспечивает дополнительные ориентиры для тканевых компартментов и специфического микроокружения, включая очаги воспаления (внутриклеточные маркеры и некоторые компартменты с диффузионными барьерами, такие как белая пульпа селезенки или мозг, не являются легкодоступными, подходят для этого окрашивания in vivo). Этот подход показал, что белая пульпа селезенки является тканевым компартментом, обеспечивающим долгосрочную выживаемость сальмонеллы во время антимикробной химиотерапии.
Наконец, сальмонеллы, реплицирующиеся с умеренной или медленной скоростью, могут быть идентифицированы и локализованы в трехмерной структуре тканей с использованием штаммов, экспрессирующих таймерbac, одноклеточный репортер для скорости репликации11,15.
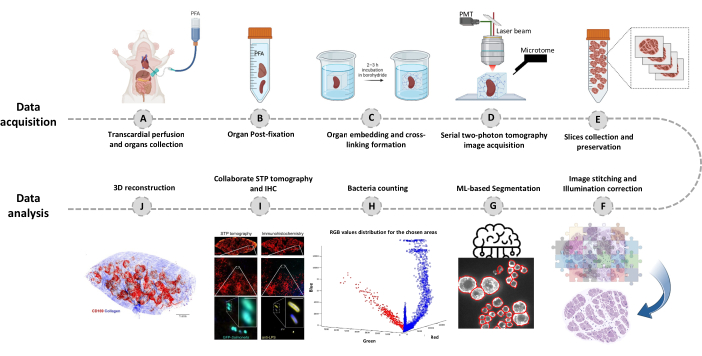
Рисунок 1: Процедура визуализации всего органа с помощью серийной двухфотонной томографии (STP). (A-B) Орган извлекают после транскардиальной перфузии и хранят в течение ночи в 4% параформальдегиде (PFA) при 4 °C. (C-E) Орган погружают в окисленную агарозу и сшивают, затем ткань сканируют и срезают с помощью STP-томографии. Срезы собирают для последующей иммуногистохимии. (Ф-Дж) Конвейеры вычислительного анализа для количественной оценки численности бактерий, подтверждения флуоресцентных бактерий и 3D-реконструкции положения бактерий. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Установка последовательной двухфотонной томографии (STP). (A) Томограф, который включает в себя (B) 2-фотонную визуализацию с (C) автоматизированным последовательным срезом ткани. (D) Собранные срезы тканей для последующих исследований. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
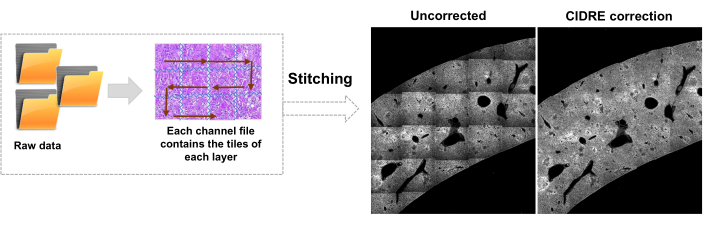
Рисунок 3: Сшивка плитки и коррекция освещенности. Плитка сшивается, а неравномерное освещение корректируется с помощью скорректированного распределения интенсивности с использованием регуляризированной минимизации энергии (CIDRE). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
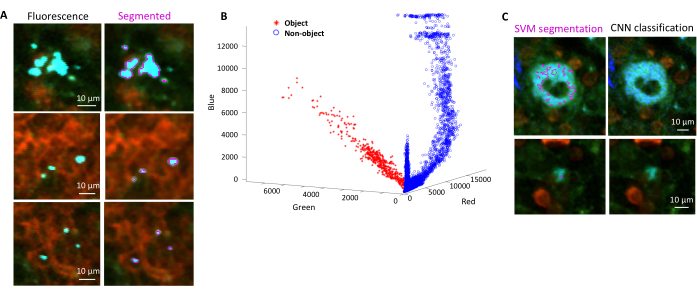
Рисунок 4: Сегментация сальмонеллы , экспрессирующей зеленый флуоресцентный белок (GFP), с помощью метода опорных векторов (SVM) и сверточной нейронной сети (CNN). (A) Репрезентативные изображения объектов GFP, сегментированные SVM (слева) и соответствующие изображения (справа) с областями, сегментированными SVM (масштабная линейка: 10 мкм). (B) Кластеризованное распределение значений красного-зеленого-синего (RGB) для сегментированных областей. (C) Репрезентативные изображения объектов, не относящихся к GFP, ошибочно идентифицированных SVM как бактерии (слева). CNN правильно принимает их за фон (справа, масштабная линейка: 10 мкм). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
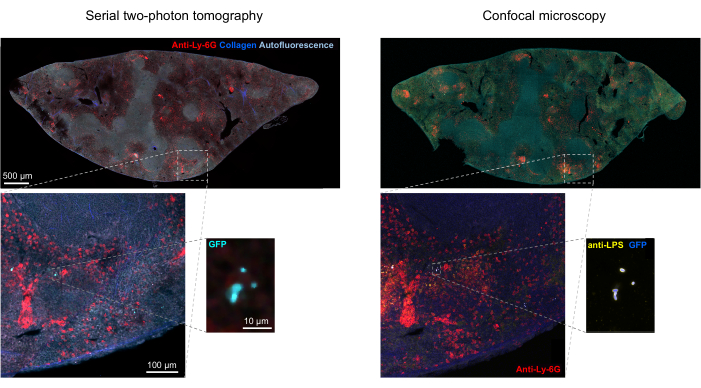
Рисунок 5: Обнаружение сальмонеллы , экспрессирующей зеленый флуоресцентный белок (GFP), с помощью томографии и подтверждения с помощью иммуногистохимии. Снимки того же среза, полученные с помощью томографии (слева) или конфокальной микроскопии после окрашивания антителом к липополисахариду сальмонеллы (справа). Нейтрофилы (красного цвета) окрашивали путем инъекции in vivo меченного ПЭ антитела против Ly-6G перед перфузией. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
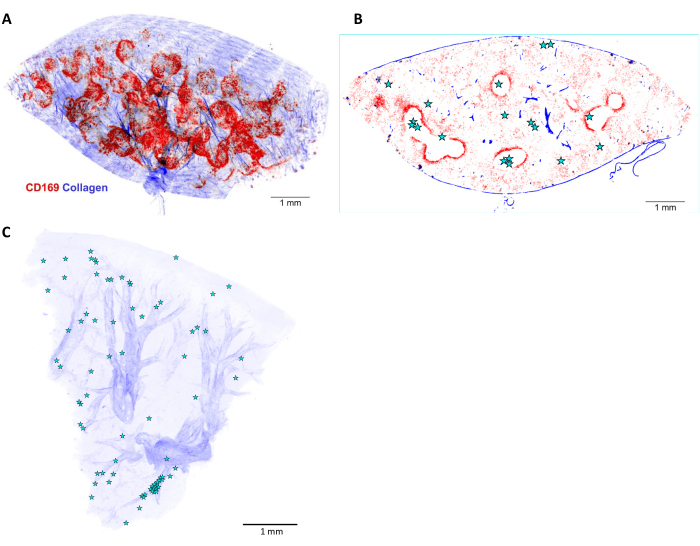
Рисунок 6: 3D-реконструкция и локализация сальмонеллы в инфицированной селезенке мыши. (A) Трехмерная (3D) реконструкция среза селезенки толщиной 5 мм, окрашенного in vivo до перфузии антителом к CD169 (красным). Синий сигнал представляет собой коллаген, обнаруженный вторыми гармониками. (B) Одна оптическая плоскость 3D-стека, показанного на рисунке (A). Положение клеток сальмонеллы или микроколоний обозначено звездочками. (C) 3D-реконструкция позиций сальмонелл (звездочек) в инфицированной печени. Артерии видны на основе их коллагеновых оболочек (синего цвета). Масштабная линейка: 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой фигуры.
Discussion
Локальный тканевый контекст бактериальных патогенов имеет решающее значение для определения локальных атак хозяина, бактериальной адаптации, локального исхода взаимодействия патогена хозяина и антимикробной химиотерапии, а также индивидуального вклада в общий исход заболевания. Визуализация бактерий микрометрового размера в органах размером в сантиметр была сложной задачей. Серийная двухфотонная томография (STP) обеспечивает достаточное пространственное разрешение для обнаружения отдельных бактериальных клеток в целых органах, автоматизированное срезирование и визуализацию, а также достаточную пропускную способность (~1 орган в день)11. В то время как антигены хозяина могут быть окрашены in vivo, клетки патогена должны экспрессировать подходящие флуоресцентные белки для обеспечения всестороннего обнаружения внутриклеточных клеток патогена. Полученные наборы данных (0,5-1,5 терабайта на орган) создают существенные проблемы для ИТ-инфраструктур по анализу и хранению данных.
В этом методе есть несколько важных этапов. Во-первых, требуется штамм патогена с обнаруживаемой и гомогенной экспрессией флуоресцентного белка GFP или YFP. В идеале для минимизации гетерогенности флуоресценции из-за вариации числа копий плазмид используется кассета25 для хромосомной экспрессии. Требуется достаточная интенсивность флуоресценции, но следует избегать чрезмерного уровня флуоресцентного белка, чтобы избежать ухудшения приспособленности патогена23. Соответствующие уровни экспрессии могут быть получены путем выбора соответствующего промотора и тонкой настройки рибосомального сайтасвязывания 25 или всей 5'-нетранслируемой области (UTR)26. Во-вторых, перфузионная фиксация должна включать в себя первоначальную промывку буфером для удаления как можно большего количества эритроцитов из кровообращения. Особенно это критично для селезенки и печени (хотя полное удаление эритроцитов из этих органов затруднено). Оставшиеся эритроциты поглощают свет в видимой части спектра, ухудшая качество изображения27. В-третьих, хранение неподвижных тканей в криопротекторе имеет решающее значение для снижения аутофлуоресценции тканей, которая особенно высока в воспаленных тканях и может затмевать сравнительно слабую флуоресценцию клеток патогена. В-четвертых, эффективная сшивка ткани с окружающим агарозным блоком имеет решающее значение для плавного вибратомного разрезания без выскакивания ткани из агарозного блока. В-пятых, флуоресцентные сигналы и их идентификация в качестве клеток патогена должны быть независимо проверены с использованием ортогональных подходов, таких как окрашивание антителами к компонентам патогена (например, липополисахарид для грамотрицательных бактерий) и конфокальная микроскопия срезов, полученных из томографа11. Некоторые инфицированные ткани содержат автофлуоресцентные частицы с аналогичной формой и перекрывающимися флуоресцентными спектрами, которые могут быть легко ошибочно интерпретированы как клетки патогена. В-шестых, количество клеток патогена в микроколониях следует сравнивать с ортогональными подходами, такими как конфокальная микроскопия, для оценки точности. Общая бактериальная нагрузка на основе этих расчетов должна быть проверена путем сравнения с ортогональными подходами, такими как проточная цитометрия и гальваническое покрытие.
Важными изменениями широко используемого протокола STP являются размещение узкополосового фильтра с длиной волны 510/20 нм перед фотоумножителем 211 для уменьшения интерференции зелено-желтой автофлуоресценции, которая особенно сильна в инфицированной и воспаленной печени, селезенке и пятнах Пейера. Сильная аутофлуоресценция и повышенное рассеяние света в таких органах по сравнению с мозгом (которое доминирует в других приложениях STP) также порождают потребность в более эффективной коррекции неравномерного освещения. В качестве еще одной модификации в этом протоколе используется подход22 CIDRE (рисунок 3) и сегментация бактерий на основе искусственного интеллекта. Наконец, предварительную обработку тканей изменяли путем включения стадии инкубации в криопротектор при -20 °С, что снижает аутофлуоресценцию тканей и, таким образом, облегчает обнаружение мелких клеток патогена с относительно слабой флуоресценцией11.
Устранение неполадок может быть необходимо, если сигналы патогена не могут быть обнаружены или сегментация приводит к недостаточной чувствительности (пропускается слишком много клеток патогена) или недостаточной точности (слишком много фоновых частиц сегментируется как клетки патогена). Если фоновая аутофлуоресценция тканей обнаруживается, но сигналов патогенов слишком мало, патогены могут содержать недостаточное количество флуоресцентных белков. Это может быть проверено с помощью конфокальной микроскопии срезов тканей из той же инфицированной ткани или проточной цитометрии тканевых гомогенатов19,28. Основными причинами могут быть недостаточный уровень сцеживания или нестабильность кассеты для сцеживания. Стратегии смягчения могут включать альтернативные промоторы для стимулирования экспрессии, адаптацию кодонов генов, кодирующих флуоресцентный белок для патогенного вида, использование эписомальных конструкций с более высоким числом копий или стабилизацию экспрессионных кассет путем хромосомной интеграции или сбалансированной летальной комплементации. Выбор флуоресцентного белка также важен, но обнаружение возможно с помощью GFP.mut2, mWasabi, YPet и TIMERbac. Если сегментация неточна, это может быть вызвано слишком слабой флуоресценцией патогена, которую можно было бы решить, как описано выше, или слишком высоким фоном аутофлуоресценции тканей. Обширная перфузия промывочного раствора или длительная инкубация в буфере для хранения непосредственно перед внедрением в агарозный блок и томографию могут решить эти проблемы. Наконец, для точной классификации требуется достаточное обучение нейронной сети, но чрезмерное обучение может привести к переобучению, что ухудшит производительность для новых образцов.
В настоящее время ни один другой метод не может получить изображение целых органов с достаточным пространственным разрешением в 3D для обнаружения отдельных бактерий. Будущие усовершенствования в очистке тканей и микроскопии световых листов могут достичь аналогичного разрешения. Это может обеспечить визуализацию с более высокой скоростью и с большим количеством флуоресцентных каналов.
Важным ограничением STP является разрешение в плоскости ~0,5 мкм и разрешение по вертикали от 5 до 10 мкм, что недостаточно для разрешения близко расположенных бактерий, например, в пределах плотно упакованной микроколонии. Тем не менее, после томографии можно получить срезы тканей для вторичной конфокальной микроскопии выбранных участков ткани с высоким разрешением. Еще одним ограничением STP является наличие только трех флуоресцентных каналов, что ограничивает количество флуорофоров, которые могут быть визуализированы одновременно. Опять же, вторичный анализ полученных срезов ткани с помощью методов мультиплексирования может выявить расположение и интенсивность гораздо большего количества маркеров для выбранных частей ткани. Эта информация может быть интегрирована в общую 3D-структуру окружающей ткани, определенную с помощью STP.
В заключение следует отметить, что этот протокол позволяет проводить детальные исследования взаимодействий хозяина и патогена на локальном и общеорганном уровне. Протокол должен быть легко адаптируемым к другим патогенам (при условии, что они могут быть получены в виде флуоресцентных штаммов), другим органам и различным видам хозяев.
Disclosures
Авторам нечего раскрывать.
Acknowledgements
Работа выполнена при поддержке Швейцарского национального научного фонда 310030_156818, 310030_182315 и NCCR_ 180541 AntiResist (to DB).
Materials
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Agarose Low Melt | Roth | Art. 6351.5 25g | |
| Boric acid | Sigma-Aldrich | 6768-500G | |
| Instant adhesive Loctite 435 | Henkel | ||
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Poly(ethylene glycol) | Sigma-Aldrich | P5413-1kg | |
| Polyvinylpyrrolidone | Sigma-Aldrich | PVP-100G | |
| Sodium borohydride | Sigma-Aldrich | 71321-25g | |
| Sodium hydroxide | Merck | 106453 | |
| Sodium periodate | Sigma-Aldrich | 311448-100G | |
| Sodium phosphate dibasic | Sigma-Aldrich | 71640-250G | |
| Sodium phosphate monobasic dihydrate | Sigma-Aldrich | 71500-1KG | |
| Sodium tetraborate | Sigma-Aldrich | 221732-100g | |
| Sucrose | AppliChem | A4734,1000 | |
| Tris-buffered saline (TBS) | Merck | T5912-1L | |
| Triton X-100 | Sigma-Aldrich | 9002-93-1 | |
| Vacuum filtration 500 | TPP | TPP99250 | |
| Equipment | |||
| Blade | Campden Instruments Limited | 01-01-4692 | |
| MAITAI Laser | Spectra-Physics | ||
| Peel away plastic mold | Sigma-Aldrich | E6032-1CS | |
| TissueCyte 1000 tomograph | TissueVision | ||
| Antibody/dyes | |||
| DAPI | Merck | D9542-5MG | |
| Primary antibodies | |||
| anti-LPS Salmonella, rabbit | Sifin | REF TS 1624 | |
| anti-CD169-PE, clone 3D6.112 | Biolegend | 142403 | |
| anti-Ly-6G-PE, clone 1A8 | Biolegend | 127608 | |
| Secondary antibodies | Invitrogen | ||
| chicken anti-rabbit Alexa 647 | Invitrogen | A-21443 | |
| Software | Company | Version | |
| Fiji | Image J | 1.54g or later | |
| MATLAB | MathWorks | 2017b/2018b or later | |
| Orchestrator (tomograph) | TissueVision | ||
| Visualization software Imaris | Oxford Instruments | 9.9.0 or later |
References
- Bjarnsholt, T., et al. The importance of understanding the infectious microenvironment. Lancet Infect Dis. 22 (3), e88-e92 (2022).
- Azimi, S., Lewin, G. R., Whiteley, M. The biogeography of infection revisited. Nat Rev Microbiol. 20 (10), 579-592 (2022).
- Bumann, D., Cunrath, O. Heterogeneity of Salmonella-host interactions in infected host tissues. Curr Opin Microbiol. 39, 57-63 (2017).
- Hofmann, J., Keppler, S. J. Tissue clearing and 3D imaging - putting immune cells into context. J Cell Sci. 134 (15), jcs258494 (2021).
- Blain, R., et al. A tridimensional atlas of the developing human head. Cell. 186 (26), 5910-5924.e17 (2023).
- Ragan, T., et al. Serial two-photon tomography for automated ex vivo mouse brain imaging. Nat Meth. 9 (3), 255-258 (2012).
- Oh, S. W., et al. A mesoscale connectome of the mouse brain. Nature. 508 (7495), 207-214 (2014).
- Kim, Y., et al. Brain-wide maps reveal stereotyped cell-type-based cortical architecture and subcortical sexual dimorphism. Cell. 171 (2), 456-469.e422 (2017).
- Matho, K. S., et al. Genetic dissection of the glutamatergic neuron system in cerebral cortex. Nature. 598 (7879), 182-187 (2021).
- Muñoz-Castañeda, R., et al. Cellular anatomy of the mouse primary motor cortex. Nature. 598 (7879), 159-166 (2021).
- Li, J., et al. Tissue compartmentalization enables Salmonella persistence during chemotherapy. Proc Natl Acad Sci U S A. 118 (51), e2113951118 (2021).
- Dogga, S. K., et al. Importance of aspartyl protease 5 in the establishment of the intracellular niche during acute and chronic infection of Toxoplasma gondii. Mol Microbiol. 118 (6), 601-622 (2022).
- Cormack, B. P., Valdivia, R. H., Falkow, S. FACS-optimized mutants of the green fluorescent protein (GFP). Gene. 173 (1 Spec No), 33-38 (1996).
- Nguyen, A. W., Daugherty, P. S. Evolutionary optimization of fluorescent proteins for intracellular FRET. Nat Biotechnol. 23 (3), 355-360 (2005).
- Claudi, B., et al. Phenotypic variation of Salmonella in host tissues delays eradication by antimicrobial chemotherapy. Cell. 158 (4), 722-733 (2014).
- Ai, H. W., Olenych, S. G., Wong, P., Davidson, M. W., Campbell, R. E. Hue-shifted monomeric variants of Clavularia cyan fluorescent protein: identification of the molecular determinants of color and applications in fluorescence imaging. BMC Biol. 6, 13 (2008).
- Drobizhev, M., Makarov, N. S., Tillo, S. E., Hughes, T. E., Rebane, A. Two-photon absorption properties of fluorescent proteins. Nat Methods. 8 (5), 393-399 (2011).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat Biotechnol. 22 (12), 1567-1572 (2004).
- Burton, N. A., et al. Disparate impact of oxidative host defenses determines the fate of Salmonella during systemic infection in mice. Cell Host&Microbe. 15 (1), 72-83 (2014).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio Protoc. 11 (5), e3988 (2021).
- de Olmos, J., Hardy, H., Heimer, L. The afferent connections of the main and the accessory olfactory bulb formations in the rat: an experimental HRP-study. J Comp Neurol. 181 (2), 213-244 (1978).
- Smith, K., et al. CIDRE: an illumination-correction method for optical microscopy. Nat Methods. 12 (5), 404-406 (2015).
- Wendland, M., Bumann, D. Optimization of GFP levels for analyzing Salmonella gene expression during an infection. FEBS Lett. 521 (1-3), 105-108 (2002).
- Barat, S., et al. Immunity to intracellular Salmonella depends on surface-associated antigens. PLoS Pathog. 8 (10), e1002966 (2012).
- Rollenhagen, C., Sorensen, M., Rizos, K., Hurvitz, R., Bumann, D. Antigen selection based on expression levels during infection facilitates vaccine development for an intracellular pathogen. Proc Natl Acad Sci U S A. 101 (23), 8739-8744 (2004).
- Chen, F., Cocaign-Bousquet, M., Girbal, L., Nouaille, S. 5'UTR sequences influence protein levels in Escherichia coli by regulating translation initiation and mRNA stability. Front Microbiol. 13, 1088941 (2022).
- Weissleder, R. A clearer vision for in vivo imaging. Nat Biotechnol. 19 (4), 316-317 (2001).
- Bumann, D. Examination of Salmonella gene expression in an infected mammalian host using the green fluorescent protein and two-colour flow cytometry. Mol.Microbiol. 43 (5), 1269-1283 (2002).
- Nakayama, K., Kelly, S. M., Curtiss III, R. J. B. t. Construction of an Asd+ expression-cloning vector: stable maintenance and high level expression of cloned genes in a Salmonella. vaccine strain. 6 (6), 693-697 (1988).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved