Medindo o potencial de biometano de resíduos de restos de alimentos co-digeridos anaerobicamente com lodo ativado por resíduos usando respirometria
In This Article
Summary
Este protocolo descreve uma prática recomendada para determinar a produção de metano e parâmetros cinéticos microbianos usando respirometria para microbiota anaeróbica co-digerindo resíduos de restos de comida e lodo ativado por resíduos.
Abstract
O uso da respirometria para estudar a biocinética da microbiota no tratamento de águas residuais ou na digestão de lodos de águas residuais tornou-se mais prevalente nas últimas décadas. O uso da respirometria para examinar a biocinética da microbiota anaeróbica co-digerindo fluxos de resíduos orgânicos, como lodo de águas residuais e restos de comida, é uma área de pesquisa ativa. Até o momento, nenhum protocolo visualizado foi publicado sobre o tema. Assim, neste protocolo, configuramos um respirômetro para medir a produção e a vazão de metano ao longo do tempo usando três proporções diferentes de alimentos para microrganismos (F:M) e resíduos de restos de comida e lodo ativado por resíduos como substratos. Os dados resultantes, juntamente com as medições de utilização do substrato, fornecem a base para entender como diferentes concentrações de substrato influenciam a taxa na qual a microbiota anaeróbica produz metano. Além disso, este protocolo apresenta um método para desenvolver parâmetros biocinéticos (por exemplo, constante de taxa de produção de metano e rendimento). Outros podem usar este protocolo de respirometria para examinar a degradação orgânica em condições anaeróbicas e desenvolver parâmetros microbianos.
Introduction
Os pesquisadores estudam a atividade microbiana em escala de bancada usando uma variedade de abordagens, incluindo estudos em lote, microcosmos e respirometria, entre outros. Os respirômetros podem ser usados para medir a respiração celular durante as fases de crescimento e/ou decaimento de uma comunidade microbiana, observando o consumo de substrato e a produção do produto final sob condições controladas1. Os resultados de estudos de respirômetro em escala de bancada também podem ser usados para estimar parâmetros biocinéticos para a construção do modelo de processo2. Respirômetros têm sido usados para examinar a atividade microbiana aeróbica e anaeróbica; no entanto, estudos utilizando a respirometria para medir o potencial de biometano (BMP), especialmente de substratos orgânicos mistos, é uma área de pesquisa em andamento 3,4.
Os orgânicos em águas residuais domésticas são reconhecidos como uma fonte renovável viável de energia química5. A digestão anaeróbica de lodos de águas residuais (ou seja, lodo primário e lodos ativados por resíduos, WAS) tem sido usada para produzir biogás rico em metano em estações de tratamento de águas residuais (ETEs) por mais de um século6. No entanto, a digestão de vários fluxos de resíduos orgânicos, como resíduos de restos de comida com WAS, tornou-se prevalente apenas nos últimos anos e ainda é uma área ativa de pesquisa. Os resíduos de restos de alimentos são um fluxo consistente de resíduos de material orgânico de alta densidade em muitos países desenvolvidos, representando aproximadamente 25% da massa de aterros sanitários nos EUA7. Além de desviar uma parte dos restos de comida do descarte em aterros sanitários, a combinação de restos de comida e WAS em um cenário de co-digestão é vantajosa devido ao aumento do volume de biogás produzido (em relação a um único fluxo de resíduos orgânicos). O biogás normalmente contém 60% a 70% de metano, 30% a 40% de dióxido de carbono e vestígios de outros gases (por exemplo, sulfeto de hidrogênio) 8. O biogás pode ser limpo e queimado no local nas ETAR usando uma tecnologia combinada de calor e energia para compensar alguns dos requisitos de energia elétrica e térmica9.
Vários estudos examinaram o potencial de biometanação e os parâmetros biocinéticos da microbiota anaeróbica que co-digere resíduos orgânicos1. Os estudos disponíveis na literatura usaram ensaios em batelada em frascos de soro onde a produção de metano é medida em pontos discretos ao longo do experimento, enquanto outros mediram a produção de metano usando medidores de vazão conectados diretamente a biorreatores em escala de bancada ou piloto 2,10,11. A medição contínua da produção de metano usando um respirômetro, como o descrito neste protocolo, pode fornecer medições contínuas e precisas de metano a partir de um grande número de amostras executadas sob uma variedade de condições experimentais 1,12. Embora vários estudos tenham medido a produção de metano a partir da codigestão de WAS acoplada a outros substratos orgânicos, como biorresíduos, gorduras, óleos, graxas e resíduos agrícolas 10,13,14, ainda há um trabalho significativo para identificar as taxas de produção de metano a partir da grande variedade de cenários de codigestão. Além disso, até o momento, nenhum protocolo disponível fornece uma abordagem passo a passo aprofundada usando representações visuais para a medição da produção de metano a partir da co-digestão de restos de comida e WAS. Assim, este estudo apresenta um protocolo de respirômetro para medir a produção de metano e derivar parâmetros biocinéticos usando uma mistura de águas residuais diluídas, WAS e resíduos de restos de comida como substratos. Diferentes proporções de alimentos para microrganismos (F:M) foram usadas para ajudar a elucidar mudanças na produção de metano. Outras medições incluem sólidos suspensos voláteis (VSS), demanda química de oxigênio (DQO) e pH de cada amostra. Este protocolo descreve a configuração do respirômetro, a criação de amostras e as medições críticas.
Protocol
1. Preparação do substrato
- Coletar ~1,5 L de efluente primário, ~1 L de lodo ativado por resíduos (WAS).
NOTA: As amostras de WAS devem ser colhidas imediatamente antes do experimento; no entanto, o WAS pode ser armazenado por até 48 h a 4 ° C antes do experimento, sem impacto perceptível em seu uso como substrato15 , 16 , 17 . - Adquirir 2 L de cultura anaeróbia imediatamente antes da experiência e manter a cultura a 35 °C. Limite o contato com o ar o máximo possível durante a transferência do digestor anaeróbico para o frasco de coleta.
NOTA: A cultura anaeróbia utilizada neste estudo foi obtida a partir de uma ETE que tratava 8,5 MGD (38.640 m3/d) com digestão anaeróbia de lodo primário de água residuária. Uma boa prática é manter as condições anaeróbias lavando o frasco de coleta com gás nitrogênio antes de adquirir uma cultura anaeróbica13 e mantendo as condições anaeróbicas durante o transporte e armazenamento. - Recolher os resíduos alimentares e armazená-los até 48 h antes da experiência a 4 °C.
NOTA: dependendo do desenho experimental, deve-se ter o cuidado de identificar desperdícios alimentares com as proporções alvo de carboidratos, proteínas, etc. As proporções-alvo de orgânicos no desperdício de alimentos provavelmente variam de acordo com o experimento. A fração de carboidratos, proteínas e gorduras nos alimentos coletados pode ser estimada a partir da literatura publicada ou avaliada usando protocolos estabelecidos (por exemplo, cromatografia gasosa).
2. Preparação de suplementos nutricionais
- Prepare a solução de base mineral # 1 misturando 800 mL de água deionizada (DI) com CoCl2 · 6H2O (0,25 g), FeCl3 ·6H2O (5 g), MnCl2·4H2O (0,05 g), NaMoO4·2H2O (0,005 g), NiCl2·6H2O (0,025 g), CuCl2·2H2O (0,007 g), ZnCl2 (0,025 g), H3BO3 (0,025 g) e Na2SeO4 (0,025 g). Diluir até 1 L com água deionizada (DI).
- Prepare a solução de base mineral # 2 misturando 800 mL de água DI com CaCl2 (27,7 g) e MgCl2 ·4H2O (101 g). Diluir até 1 L com água DI.
- Prepare uma base de nutrientes misturando 800 mL de água DI com NH4Cl (38,2 g) e Na2SO4 (15 g). Ajuste o pH para 7,0 usando NaOH 3,64 N em água DI e dilua até 1 L com água DI.
3. Preparação da amostra
- Combine os resíduos alimentares (Tabela 2) num liquidificador (Figura 1) para criar uma mistura. Certifique-se de que a mistura esteja livre de grandes partículas de resíduos alimentares. Dilua os resíduos alimentares com água DI para ajudar na mistura. Anote a quantidade de água de diluição a utilizar no cálculo das medições da carência química de oxigénio (CQO). Esse desperdício de alimentos diluídos é conhecido como 'desperdício de trabalho'. Coloque os resíduos de trabalho em uma garrafa de plástico de 1 L e armazene-os a 4 °C.
- Rotule quatro copos de 2 L de acordo com a Tabela 1. Coloque os copos em uma placa de agitação e adicione uma barra de agitação grande. Combine resíduos alimentares, WAS e diluição (água DI para controle e efluente primário para tratamentos) conforme Tabela 1 nos copos de 2 L.
- Adicione 12 mL de solução de base mineral # 1, solução de base mineral # 2 e base de nutrientes.
- Adicione 2,4 g de NaHCO3 (pó) a cada copo e mexa por 30 s. Rotule oito frascos de respirometria de acordo com a Tabela 1 e adicione uma barra de agitação magnética.
NOTA: Isso criará duplicatas do controle e três tratamentos em diferentes proporções F:M. - Adicionar cultura anaeróbia a cada copo de 2 L de acordo com a Tabela 1 e agitar. Meça imediatamente 500 mL de uma mistura do béquer com um cilindro graduado e transfira-a para um frasco de respirômetro rotulado, lave com gás nitrogênio e tampe imediatamente.
NOTA: Deve-se tomar cuidado para limitar o contato da microbiota anaeróbica com o oxigênio atmosférico (se disponível, uma câmara anaeróbica deve ser usada para a transferência).
4. Quantificação das condições iniciais
- Use a amostra restante da seção 3 (~ 200 mL) para medir pH, DQO total (tDQO), DQO solúvel (sCOD), sólidos suspensos totais (TSS) e sólidos suspensos voláteis (VSS) para cada amostra18.
- Se necessário, diluir as amostras com água DI com base nos limites de detecção do equipamento de medição.
NOTA: Os procedimentos do fabricante foram usados para medições de DQO.
- Se necessário, diluir as amostras com água DI com base nos limites de detecção do equipamento de medição.
5. Configuração do respirômetro
- Ajuste o respirômetro (Figura 2) para a configuração anaeróbica baixa.
- Pressione o botão de reinicialização e o botão de ligar simultaneamente.
NOTA: Isso é específico para o modelo usado neste estudo. - Defina o chiller (Figura 3) a 35.5 °C.
- Encha cada CO2 e purificador de umidade (Figura 4 e Figura 5) com uma mistura 50/50 de pellets de CaSO4 e KOH no centro, cercados por lã de vidro de cada lado.
- Conecte os tubos e agulhas dos frascos de amostra ao depurador e, em seguida, do depurador à entrada de gás (figura 6).
- No laptop do respirômetro, execute o programa do respirômetro RSA-8-v2.0.
NOTA: Esta etapa é específica para o modelo usado neste estudo. - Selecione todas as garrafas no programa e selecione Editar > rótulos de dados. Nomeie todas as garrafas.
NOTA: Esta etapa é específica para o modelo usado neste estudo. - Comece a medir a produção de gás ativando o botão Iniciar no programa. Defina o programa para medir dados no final de cada meia hora. Monitore a produção de gás selecionando Gráfico de taxas ou Gráfico de volume.
NOTA: Esta etapa é específica para o modelo usado neste estudo. - Após o experimento (~7 dias), pare a execução no programa, desligue o chiller e desligue o módulo RSPF. Salve o arquivo de dados como um arquivo CSV e converta-o em um documento do MS Excel.
NOTA: Esta etapa é específica para o modelo usado neste estudo.
6. Medições pós-respiração
- Meça o pH, TSS, VSS e DQO nas amostras finais, conforme feito na seção 4.
Representative Results
Composição do desperdício de alimentos
O desperdício de alimentos usado neste estudo consistiu em cinco tipos diferentes de alimentos normalmente servidos em um refeitório universitário. Cada amostra de alimento continha quantidades variadas de gorduras, carboidratos e proteínas, que estão listadas na Tabela 2. 19 O desperdício de restos de comida misturados era 44% de carboidratos, 36% de proteínas, 16% de gorduras e 4% de outros materiais. Uma massa aproximadamente igual de cada tipo de alimento (56 g a 86 g) foi usada para fornecer um substrato orgânico representativo para co-digestão anaeróbica. A massa de resíduos de restos alimentares foi posteriormente variada para atingir o F:M desejado para cada cenário examinado (0,3, 0,7 e 1,1).
Medições de sólidos suspensos voláteis e orgânicos
Os resultados da VSS inicial e final e da demanda inicial e final de oxigênio encontram-se na Tabela 3. A demanda de oxigênio é apresentada como DBO5, que foi convertida de DQO usando a taxa de conversão aceita (DQO = 1,6DBO5)8. Como mostrado, as concentrações iniciais de VSS (também representadas pela massa na Tabela 3) aumentaram do controle para a maior relação F:M (1,1). Cada F:M examinado exibiu destruição VSS, ou conversão anaeróbica de orgânicos em produtos finais gasosos de metano e dióxido de carbono. Devido à conversão, a concentração de VSS diminuiu das medições iniciais para as medições finais feitas no final do experimento. A quantidade de VSS destruída aumentou do controle para maiores razões F:M. Inesperadamente, a destruição do VSS para o cenário F:M = 0,7 excedeu o cenário F:M = 1,1, talvez devido à inibição no cenário F:M de 1,1.
As concentrações de demanda inicial de oxigênio medidas seguiram a mesma tendência da VSS, ou seja, aumentaram do controle para a maior relação F:M (Tabela 3). Semelhante à destruição do VSS, as concentrações de DBO5 diminuíram entre as concentrações inicial e final, com exceção do controle. A demanda de oxigênio aumentou no controle, provavelmente devido ao decaimento endógeno. Ao contrário da destruição do VSS, a redução da demanda de oxigênio da medição inicial para a final foi relativamente baixa para cada amostra, variando entre 1 e 3%, e não mostrando tendência pela relação F:M. Uma possível razão para essa tendência é a conversão de matéria orgânica particulada em orgânicos solúveis, que ocorre em longos períodos de tempo e geralmente é uma etapa limitante da taxa no metabolismo dos consórcios microbianos anaeróbios20.
Produção de metano
As quantidades e taxas de produção de metano variaram na faixa de razões F: M durante o período de estudo de 190 horas. Os resultados experimentais revelaram que relações F:M mais altas produziram maiores volumes gerais de metano (Figura 7). O controle, ao qual nenhum substrato foi adicionado, produziu uma pequena quantidade de metano (~ 72 mL) provavelmente devido à quantidade relativamente pequena de DBO5 solúvel no lodo e / ou decaimento endógeno. Como previsto, a adição de substrato em outros cenários aumentou a produção de metano em relação ao controle. O cenário F:M de 0,3 produziu cinco vezes mais metano, em volume (~ 354 mL), do que o controle. Aumentar a razão F: M para 0,7 produziu 1,6 vezes mais metano (~ 574 mL) do que o cenário F : M de 0,3. Da mesma forma, aumentar a razão F: M para 1,1 produziu 1,9 vezes mais metano (~ 1098 mL) do que o cenário F: M de 0,7. Os valores máximos de produção volumétrica de metano observados (Ymax) para cada relação F:M examinado estão listados na Tabela 4. A taxa de metano produzido ao longo do tempo também mudou com as razões F: M examinadas. Conforme mostrado na Figura 8, a taxa de produção de metano, bem como o período de tempo durante o estudo em que o metano foi produzido, aumentou à medida que o F:M aumentou. Por exemplo, no cenário F:M de 0,3, não houve produção de metano observada após 129 h de estudo (com um máximo de 354 mL), enquanto o cenário F:M de 1,1 ainda estava produzindo uma pequena quantidade de metano no final do estudo. Em todos os cenários, a taxa de metano produzida diminuiu ao longo do tempo devido à redução da disponibilidade de substrato. Embora ainda houvesse demanda abundante de oxigênio disponível no final do estudo (Tabela 3), ela pode não ter sido em uma forma biodisponível, ou pode ter havido um aceptor de elétrons remanescente limitado (por exemplo, dióxido de carbono) para a microbiota anaeróbica. Por fim, uma comparação do metano produzido (mL) por VSS destruído observado (mg) mostra que os valores de F:M de 0,3 e 0,7 forneceram uma faixa de 1,3 a 1,6 mL/mg, enquanto o F:M de 1,1 produziu mais metano por unidade de VSS destruída (3,7 mL/mg) (Tabela 4). Tchobanoglous et al. (2014) fornecem faixas típicas para rendimento de gás por unidade de sólidos destruídos para matérias-primas comuns, para incluir gorduras (~ 1,4 mL / mg), graxa (~ 1,1 mL / mg) e proteína (~ 0,7 mL / mg) 8. Mata-Alvarez et al. (2014) revisaram estudos de co-digestão de lodo de águas residuais com uma variedade de substratos e diferentes proporções de substrato (por exemplo, diferentes proporções de WAS e FOG), em escala de bancada e piloto Eles descobriram que a produção de metano relatada por unidade VSS destruída variou substancialmente com os substratos co-digeridos, bem como a proporção de substratos, variando de 0,2 mL a 1,1 mL de biogás por mg VS destruído. Os resultados representativos deste estudo, especialmente para F:M de 0,3 e 0,7, comparam-se favoravelmente aos resultados de estudos comparativos.
Parâmetros biocinéticos
A produção de metano ao longo do tempo pode ser usada para determinar vários parâmetros biocinéticos importantes. Esses parâmetros biocinéticos podem ser aproveitados para prever a produção de metano em cenários semelhantes sem o uso do respirômetro. A constante de taxa de produção de metano, k, pode ser derivada usando um ajuste logarítmico de mínimos quadrados aos dados do respirômetro observados para cada razão F: M examinada (ou seja, aqueles mostrados na Figura 8). Uma função logarítmica representativa para o cenário F:M de 0,3 é y = 93,465ln(X) - 175,91. Aqui, o valor de 93,465 está em unidades de horas, que devem ser convertidas em dias e depois invertidas, dando um k = 0,257. As constantes de taxa (k) e o coeficiente de determinação (R2) para cada relação F:M examinado encontram-se na Tabela 4.
A constante de taxa pode então ser aproveitada para determinar o rendimento de metano a qualquer momento para cada relação F:M. A taxa de metano produzida ao longo do tempo a partir do substrato orgânico pode ser modelada usando a seguinte equação [1]21:
(1)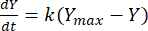
Integrando a equação acima entre os limites t = 0 a t = t, obtém-se o seguinte [2]:
(2)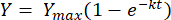
Onde, Y = rendimento de metano em qualquer momento [mL]; Ymax = rendimento máximo de metano observado no estudo do respirômetro [mL]; k = constante de taxa de produção de metano [d-1]; t = tempo [d]
Embora a abordagem de primeira ordem usada para desenvolver parâmetros biocinéticos apresentada acima forneça um ajuste muito razoável aos dados experimentais (conforme indicado pelos valores de R2 na Tabela 4), outros estudos relataram o uso de outros modelos para ajustar os dados de produção de metano, incluindo o modelo de Gompertz modificado, o modelo de dois substratos e o modelo de cone2.

Figura 1: Liquidificador de resíduos alimentares. Liquidificador padrão usado para combinar resíduos alimentares. Clique aqui para ver uma versão maior desta figura.

Figura 2: Respirômetro. Configuração completa do respirômetro para medir a produção de metano. Clique aqui para ver uma versão maior desta figura.

Figura 3: Frasco de amostra no resfriador do respirômetro. Vista interna do resfriador do respirômetro com oito frascos de amostra. Clique aqui para ver uma versão maior desta figura.

Figura 4: Purificador do respirômetro. Vista próxima do purificador do respirômetro. Clique aqui para ver uma versão maior desta figura.
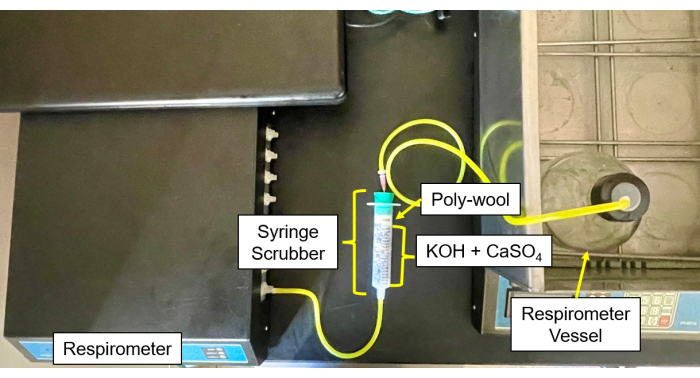
Figura 5: Purificador de respirômetro para módulo de controle. Imagem do respirômetro do módulo de controle e da configuração do depurador. Clique aqui para ver uma versão maior desta figura.

Figura 6: Configuração da linha de depuração do respirômetro. Vista aproximada da configuração da linha de depuração entre os frascos de amostra e o respirômetro. Clique aqui para ver uma versão maior desta figura.
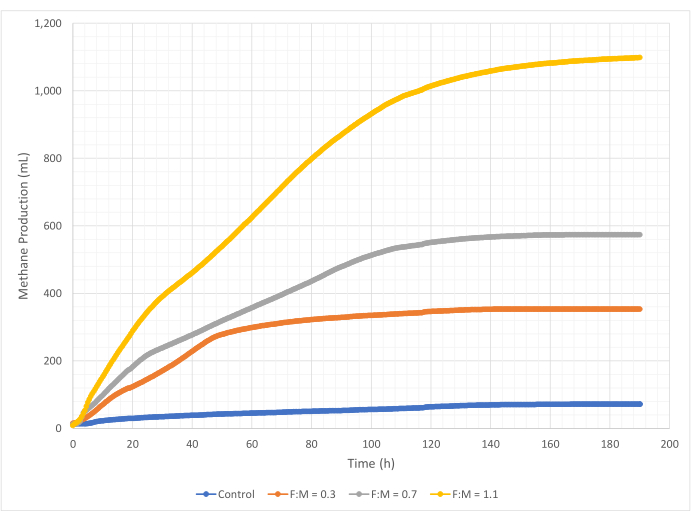
Figura 7: Produção total de metano usando diferentes razões F:M. A produção de metano para cada F:M (0,3, 0,7, 1,1) é representada ao longo do tempo (0 h a 190 h). Clique aqui para ver uma versão maior desta figura.
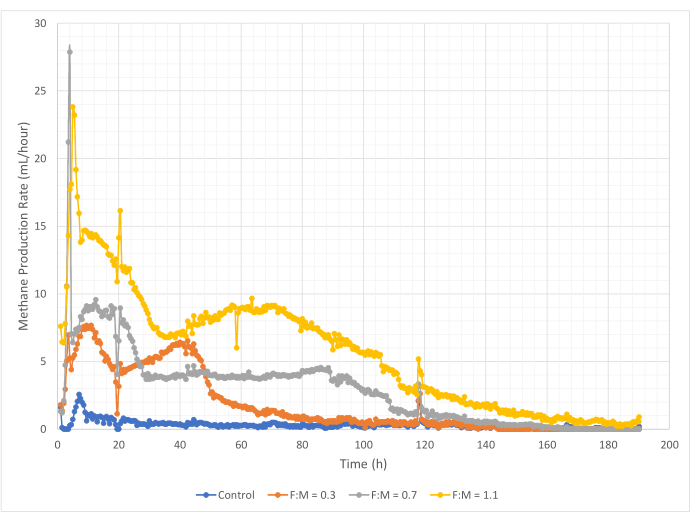
Figura 8: Taxa de produção de metano usando diferentes razões F:M. A taxa de produção de metano para cada F:M (0,3, 0,7, 1,1) é representada ao longo do tempo (0 h a 190 h). Clique aqui para ver uma versão maior desta figura.
Tabela 1: Constituintes de garrafas de amostra com proporções de alimentos para micróbios. Massa, concentração e volume constituintes para cada F:M (0,3, 0,7, 1,1) e os frascos em branco. Clique aqui para baixar esta tabela.
Tabela 2: Composição do substrato orgânico da amostra. Massa de desperdício de alimentos e composição percentual por alimento e proporção de carboidratos, proteínas e gorduras. Clique aqui para baixar esta tabela.
Tabela 3: Sólido suspenso volátil da amostra e resultado da demanda de oxigênio (desvio padrão ±). VSS e COD para cada F:M (0,3, 0,7, 1,1). Clique aqui para baixar esta tabela.
Tabela 4: Parâmetros cinéticos da amostra. Parâmetros cinéticos calculados com base no rendimento de metano. Clique aqui para baixar esta tabela.
Discussion
Os métodos fornecidos neste protocolo podem ajudar pesquisadores e profissionais a determinar o potencial de biometano da digestão anaeróbia de fluxos de resíduos orgânicos usando respirometria. Neste protocolo, demonstramos a geração de metano a partir da co-digestão de um fluxo típico de resíduos de restos de comida, juntamente com WAS de uma ETAR em uma faixa de proporções F: M. Este protocolo contribui para a literatura, fornecendo uma abordagem de respirometria passo a passo para medição contínua da produção de metano e determinação de parâmetros biocinéticos usando modelagem cinética de primeira ordem. Vários outros estudos empregaram experimentos de microcosmo que medem a produção de metano em pontos discretos no tempo10,22, enquanto outros mediram o metano usando medidores de vazão conectados a biorreatores de bancada ou escala piloto de fluxo contínuo de longa duração14,23. A respirometria oferece a vantagem de medir a produção de metano de forma contínua em uma variedade de condições experimentais. Como os experimentos de respirometria não requerem a construção de um biorreator, as condições experimentais podem ser modificadas com frequência relativa em comparação com alguns experimentos em escala de bancada ou piloto. Devido a essa vantagem, os experimentos de respirometria podem ser usados para determinar a produção de metano a partir da co-digestão de inúmeras combinações de resíduos orgânicos em um período de tempo relativamente curto. Por exemplo, como próximo passo para o protocolo apresentado neste estudo, gorduras, óleos e graxas, que são muito densos em energia química em relação ao WAS, podem ser co-digeridos com restos de comida para quantificar prováveis aumentos na geração de metano ao longo do tempo. A aplicação dessa abordagem pode continuar a construir o corpo da literatura sobre taxas de geração de metano e parâmetros biocinéticos em várias combinações de substratos em esquemas de codigestão. Além disso, além de determinar as combinações ideais de substratos, os resultados da produção de metano e os parâmetros biocinéticos podem ser usados para informar a modelagem de desempenho em programas existentes, como aqueles projetados para tratamento de águas residuais, ou para prever como os esquemas de codigestão funcionarão quando ampliados de bancada ou escala piloto para escala real24,25.
Além disso, este protocolo pode ser alterado para aplicar um substrato personalizado para o consórcio microbiano anaeróbio. Por exemplo, se um pesquisador quisesse examinar os impactos de fornecer apenas carboidratos ou apenas proteínas para a microbiota anaeróbica, a matéria-prima neste protocolo poderia ser alterada de acordo. Alternativamente, se um pesquisador quisesse testar o impacto da adição de uma fração específica de DQO (por exemplo, apenas DQO solúvel ou apenas DQO particulado) ou altas concentrações de um substrato específico (por exemplo, acetato, ácido graxo volátil e produto intermediário do metabolismo anaeróbico) na produção de metano, uma variação deste protocolo poderia ser usada. Uma boa prática observada ao modificar o substrato ou alternar o F:M de um substrato específico é manter a mesma massa de microbiota anaeróbica para cada amostra, ajustando apenas a massa do substrato (devem ser empregadas razões massa-massa). Além de modificar substratos, os pesquisadores podem usar este protocolo com outras análises para obter uma melhor compreensão do uso do substrato e da produção de metano. Por exemplo, um pesquisador pode usar este protocolo em conjunto com análises da comunidade microbiana (por exemplo, sequenciamento do gene 16S rRNA ou metagenômica) para relacionar melhor a estrutura da comunidade com a função.
Apesar da utilidade dessa metodologia, existem várias limitações. Respirômetros e testes de potencial de biometano são mais frequentemente configurados como reatores em batelada; No entanto, os codigestores anaeróbicos em escala real são normalmente operados como sistemas de fluxo contínuo com tempos de retenção de lodo acima de 10 dias1. Assim, os dados obtidos em experimentos de respirometria são úteis para estimar as taxas de geração de metano e desenvolver parâmetros biocinéticos, mas esses dados devem ser validados em campo usando digestores de maior escala operados ao longo do tempo, quando viável.
Além disso, deve-se ter cuidado na seleção e preparação de amostras antes da respirometria. Grandes partículas de restos de comida distorcem as medições de VSS e COD e podem fornecer resultados imprecisos. Se resíduos de restos de comida forem usados como substrato, a mistura deve ser bem macerada e livre de grandes partículas de alimentos - uma abordagem semelhante à maceração em poços de recebimento de restos de comida em digestores em escala real. A diluição com água DI pode ajudar no processo de mistura e é semelhante à adição de água comumente usada quando restos de comida são macerados em uma escala maior. No entanto, devem ser envidados todos os esforços para garantir que as diluições sejam medidas correctamente e que o teor de humidade pretendido seja atingido. A diluição pode ser facilmente uma fonte de erro, especialmente se alunos inexperientes estiverem executando este protocolo.
Como os consórcios microbianos existentes na co-digestão contêm anaeróbios obrigatórios, deve-se tomar cuidado especial para eliminar (ou reduzir significativamente) a exposição ao oxigênio durante os processos de transferência e preparação da amostra. O oxigênio pode ser removido dos frascos de amostra por meio de lavagem com nitrogênio. Além disso, se disponível, o trabalho de transferência de cultura anaeróbica entre frascos de coleta e frascos de amostra do respirômetro deve ser realizado em uma câmara anaeróbica. Como o respirômetro fornece resultados consistentes (volumes e taxas de produção de metano), qualquer desvio dos resultados esperados, por exemplo, um consórcio microbiano inviável, pode ser facilmente identificado no início do teste. O uso de uma amostra duplicada ou triplicada pode ajudar ainda mais a identificar testes defeituosos.
Disclosures
Os autores não têm nada a divulgar.
Acknowledgements
Agradecemos ao Dr. Jim Young, da Respirometer Systems and Applications, pela discussão sobre o desenvolvimento deste protocolo.
Materials
| Name | Company | Catalog Number | Comments |
| 103 °C Oven Isotemp | Fisher Scientific | 13-247-737F | Model: 737F, Force Air Oven |
| 550 °C Vulcan Oven | Neytech (Manufacturer) / Cole Palmer (Vendor) | 9493308 | Model: 3-550 |
| Aerobic/Anaerobic Respirometer | Respirometer System and Applications (RSA) | PF-8000 | Model: PF-8000 |
| Analytical Balance | Mettler Toledo | 30029075 | Model: ME204E, Detection Limit: 0.1 mg |
| Smoothie Blender with 56 oz Plastic Jar | Hamilton Beach | 50190F | Model: 50190F |
| COD Vials TNT Plus Vial Test | HACH | TNT821 | TNT 821, 3–150 mg/L COD |
| COD Vials TNT Plus Vial Test | HACH | TNT822 | TNT 822, 20–1500 mg/L COD |
| Dessicator | SP Bel-Art | 942070050 | Model: SP Scienceware |
| Dionized Water System | Milli-Q | ZIQ7010T0C | IQ 7010 Pure & Ultrapure Water Purification System |
| Anhydrous CaSO4 | W.A. Hammond Drierite Company | 13001 | 8 Mesh, 1 lb |
| Glass Fiber Filters | Whatman (Manufacturer) / Cole-Parmer (Vendor) | 1827-150 | Model: 934-AH |
| Heat Digestor Block | HACH | DRB200-02 | DRB 200 |
| Hot Plate Stirrer | Corning | 6795-620D | Model: PC-620D |
| Industrial-Grade Nitrogen (Compressed Cylinder) | Air Gas | NI UHP300 | 300 cubic feet |
| Pellets (KOH) | Fisher Scientific | AC134062500 | 500 g |
| pH Meter | Fisher Scientific | 13-636-AP115 | AP115, Accumet pH meter |
| UV Spectrophotometer | HACH | LPV400.99.00012 | DR 3900 |
| Vaccum Pump | GAST | 1HAB-25-M100X |
References
- Mainardis, M., Buttazzoni, M., Cottes, M., Moretti, A., Goi, D. Respirometry tests in wastewater treatment: Why and how? A critical review. Sci Total Environ. 793, 148607 (2021).
- Pan, Y., et al. Synergistic effect and biodegradation kinetics of sewage sludge and food waste mesophilic anaerobic co-digestion and the underlying stimulation mechanisms. Fuel. 253, 40-49 (2019).
- Argiz, L., et al. Assessment of a fast method to predict the biochemical methane potential based on biodegradable COD obtained by fractionation respirometric tests. J Environ Manage. 269, 110695 (2020).
- Carucci, A., et al. Aerobic storage by activated sludge on real wastewater. Water Res. 35 (16), 3833-3844 (2001).
- McCarty, P. L., Bae, J., Kim, J. Domestic wastewater treatment as a net energy producer-Can this be achieved. Environ Sci Technol. 45 (17), 7100-7106 (2011).
- McCarty, P. The development of anaerobic treatment and its future. Water Sci Technol. 44 (8), 149-156 (2001).
- From farm to kitchen: The environmental impacts of U.S. food waste Part 1. United States Environmental Protection Agency Available from: https://www.epa.gov/system/files/documents/2021-11/from-farm-to-kitchen-the-environmental-impacts-of-u.s.-food-waste_508-tagged.pdf (2021)
- Tchobanoglous, G., Burton, F. L., Stensel, H. D. . WastewaterEngineering:TreatmentandReuse. 5th ed. , (2014).
- Pfluger, A., et al. Anaerobic digestion and biogas beneficial use at municipal wastewater treatment facilities in Colorado: A case study examining barriers to widespread implementation. J Clean Prod. 206, 97-107 (2019).
- Mata-Alvarez, J., Dosta, J., Romero-Güiza, M. S., Fonoll, X., Peces, M., Astals, S. A critical review on anaerobic co-digestion achievements between 2010 and 2013. Renew Sust Energ Rev. 36, 412-427 (2014).
- Pfluger, A. R., Hahn, M. J., Hering, A. S., Munakata-Marr, J., Figueroa, L. Statistical exposé of a multiple-compartment anaerobic reactor treating domestic wastewater. Water Environ Res. 90 (6), 530-542 (2018).
- Razaviarani, V., Buchanan, I. D. Calibration of the Anaerobic Digestion Model No. 1 (ADM1) for steady-state anaerobic co-digestion of municipal wastewater sludge with restaurant grease trap waste. Chem Eng J. 266, 91-99 (2015).
- Zhu, H., et al. Biohydrogen production by anaerobic co-digestion of municipal food waste and sewage sludges. Int J Hydrog Energy. 33 (14), 3651-3659 (2008).
- Serna-García, R., Ruiz-Barriga, P., Noriega-Hevia, G., Serralta, J., Pachés, M., Bouzas, A. Maximising resource recovery from wastewater grown microalgae and primary sludge in an anaerobic membrane co-digestion pilot plant coupled to a composting process. J Environ Manage. 281, 111890 (2021).
- Gossett, J. M., Belser, R. L. Anaerobic digestion of waste activated sludge. J Environ. 108 (6), 1101-1120 (1982).
- Yi, H., Han, Y., Zhuo, Y. Effect of combined pretreatment of waste activated sludge for anaerobic digestion process. Procedia Environ Sci. 18, 716-721 (2013).
- Nah, I. W., Kang, Y. W., Hwang, K. Y., Song, W. K. Mechanical pretreatment of waste activated sludge for anaerobic digestion process. Water Res. 34 (8), 2362-2368 (2000).
- American Public Health Association. . Standard Methods for the Examination of Water and Wastewater. Vol. 10. American Public Health Association. , (2012).
- Food Data Central. US Department of Agriculture Available from: https://fdc.nal.usda.gov/ (2024)
- Vanzin, G., Pfluger, A., Almstrand, R., Figueroa, L., Munakata-Marr, J. Succession of founding microbiota in an anaerobic baffled bioreactor treating low-temperature raw domestic wastewater. Environ Sci Water Res Technol. 8 (4), 792-806 (2022).
- Negi, S., Dhar, H., Hussain, A., Kumar, S. Biomethanation potential for co-digestion of municipal solid waste and rice straw: a batch study. Bioresour Technol. 254, 139-144 (2018).
- Rostkowski, K. H., Pfluger, A. R., Criddle, C. S. Stoichiometry and kinetics of the PHB-producing Type II methanotrophs Methylosinus trichosporium OB3b and Methylocystis parvus OBBP. Bioresour Technol. 132, 71-77 (2014).
- Pfluger, A., Vanzin, G., Munakata-Marr, J., Figueroa, L. An anaerobic hybrid bioreactor for biologically enhanced primary treatment of domestic wastewater under low temperatures. Environ Sci Water Res Technol. 4 (11), 1851-1866 (2018).
- Callahan, J. L., Pfluger, A. R., Figueroa, L. A., Munakata-Marr, J. BioWin® modeling of anaerobic sludge blanket treatment of domestic wastewater. Bioresour Technol Rep. 20, 101231 (2022).
- Linvill, C., Butkus, M., Bennett, E., Wait, M., Pytlar, A., Pfluger, A. Energy balances for proposed complete full-scale anaerobic wastewater treatment facilities. Environ Eng Sci. 40 (11), 482-493 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved