Живая визуализация и характеристика динамики микроглии у эмбриона данио-рерио
In This Article
Summary
Мы демонстрируем метод, который использует преимущества быстрой сканирующей конфокальной микроскопии для выполнения визуализации клеток микроглии в развивающемся тектуме зрительного нерва рыбки данио, что позволяет анализировать динамику этих клеток in vivo.
Abstract
Микроглия является высокодинамичной клеткой, и ее миграция и колонизация паренхимы мозга является важным этапом для правильного развития и функционирования мозга. Внешне развивающиеся эмбрионы данио-рерио обладают оптической прозрачностью, что наряду с хорошо охарактеризованными трансгенными репортерными линиями, флуоресцентно помечающими микроглию, делает данио-рерио идеальной моделью позвоночных для таких исследований. В этой статье мы используем уникальные особенности модели рыбок данио-рерио для визуализации динамики клеток микроглии in vivo и в физиологических условиях. С помощью конфокальной микроскопии мы регистрируем таймлапс клеток микроглии в тектуме зрительного нерва эмбриона рыбки данио, а затем извлекаем данные слежения с помощью программного обеспечения IMARIS 10.0 для получения информации о пути миграции клеток, средней скорости и распределении в тектуме зрительного нерва на разных стадиях развития. Этот протокол может быть полезным инструментом для выяснения физиологического значения поведения микроглии в различных контекстах, способствуя более глубокой характеристике этих высокоподвижных клеток.
Introduction
Будучи резидентными макрофагами в центральной нервной системе (ЦНС), микроглии представляют собой отдельную ненейрональную популяцию, на долю которой приходится до 15% всех глиальных клеток мозга взрослого человека. Изучение биологии микроглии привлекает все большее внимание в последние годы в связи с ее установленной важностью в развитии, физиологии и болезнях1. В физиологических условиях клетки микроглии обладают высокой динамикой, непрерывно исследуя паренхиму мозга 2,3. Такое поведение позволяет микроглии колонизировать мозг и играть ключевую роль в его развитии, например, в формировании нейронных цепей4, синаптической обрезке5 и васкулогенезе. Кроме того, эта присущая ей динамическая природа позволяет микроглии постоянно контролировать ЦНС на предмет признаков инфекции, травмы или любых отклонений от гомеостаза. Чтобы проанализировать эту сложную клеточную динамику, необходимо получить живую визуализацию микроглии в пространстве и времени. К счастью, оптическая прозрачность внешне развивающихся эмбрионов данио-рерио в сочетании с наличием хорошо охарактеризованных трансгенных репортерных линий, которые флуоресцентно помечают микроглию, позиционируют рыбок данио как идеальную модель позвоночных для таких исследований. Живая визуализация эмбрионов рыбок данио предлагает неинвазивный подход, который не требует хирургического вмешательства или обширных манипуляций с тканями, сводя к минимуму потенциальные нарушения состояния ЦНС. Это критически важный фактор при изучении микроглиальных клеток, поскольку они очень чувствительны даже к незначительным изменениям во внеклеточной среде8.
В этой статье мы предоставляем рекомендации по успешному отслеживанию движений 3D-клеток микроглии в эмбрионе рыбки данио, что позволяет получить беспрецедентное представление о поведении микроглии в неповрежденной архитектуре развивающейся паренхимы мозга (графический обзор протокола см. на рисунке 1). В этом пошаговом протоколе подробно описано, как настроить и визуализировать микроглию рыбок данио на разных стадиях развития, а также как извлечь данные с высоким разрешением о подвижности клеток микроглии, чтобы получить ценную информацию об их миграционных моделях и реакциях на сигналы окружающей среды. Мы также демонстрируем, что этот протокол может быть адаптирован для выполнения многоцветной визуализации в реальном времени, тем самым расширяя его применимость для изучения микроглии в сочетании с трансгенными линиями, которые маркируют соседние клетки, включая нейроны3, олигодендроциты9 и эндотелиальные клетки10 (как показано на рисунке 2). Добавляя к набору инструментов, который позволяет напрямую наблюдать и характеризовать динамику поведения микроглии в режиме реального времени и в ее естественной среде, этот протокол, вероятно, будет способствовать лучшему выяснению функциональности микроглии на ранних стадиях, как в физиологии, так и в болезнях.
Protocol
Рыбки данио-рерио содержались в стандартных условиях, согласно FELASA42 и институциональным (Свободный университет Брюсселя, Брюссель, Бельгия; ULB) руководящие принципы и правила. Все экспериментальные процедуры были одобрены Этическим комитетом по благополучию животных ULB (CEBEA) от ULB.
1. Разведение рыбок данио и подготовка эмбрионов
ПРИМЕЧАНИЕ: Трансгенная линия рыбок данио Tg(mpeg1:eGFP)gl22 , которая экспрессирует флуоресцентный белок eGFP в макрофагах, включая микроглию, была использована для получения данных слежения, показанных в этом протоколе. Другие репортерные линии макрофагов доступны в ZIRC и также могут быть использованы. При выборе трансгенной линии важно учитывать, что высокая интенсивность сигнала будет способствовать получению изображений и сегментации клеток.
- Содержать данио рерио (Danio rerio) при температуре 28 °C и управлять ими в соответствии с установленными протоколами11.
- Стимулируйте спаривание, помещая самок и самцов рыб вместе в аквариум для разведения с сетчатым дном и сепаратором ближе к вечеру перед датой рождения желаемых эмбрионов. Снимите сепаратор на следующее утро, чтобы рассчитать время спаривания рыб.
- Соберите оплодотворенные яйца с помощью сетки и перенесите их в чашку Петри диаметром 100 мм, содержащую среду E3 (5 мМ NaCl, 0,17 мМ KCl, 0,33 мМ CaCl2, 0,33 мМ MgSO4) с 0,01% метиленового синего. В зависимости от генетического фона используемой трансгенной линии данио-рерио, если образование пигмента должно быть ингибировано для облегчения визуализации, добавьте 0,003% N-фенилтиомочевины (PTU) в буфер E3, в котором развиваются эмбрионы, начиная через 6 часов после оплодотворения (HPF) и обновляя раствор каждые 2 дня до достижения желаемой стадии развития.
Примечание: Во избежание длительного воздействия ПТУ, которое может повлиять на эмбриональное развитие12, рекомендуется использовать, если это возможно, трансгенную линию на фоне дефицита пигмента, такую как Casperw2, которая позволяет получить четкую визуализацию без необходимости подвергать эмбрионы воздействию ПТУ в течение длительного периода времени. - Если эмбрионы, подлежащие визуализации, моложе 3 дней после оплодотворения (dpf), дехорионате их при 24 hpf. Используйте стереомикроскоп, чтобы подтвердить, что все эмбрионы были дехорионированы и не повреждены ферментативным лечением (см. шаг 1.4.2).
- В случае ограниченного количества яйцеклеток сделайте это вручную, используя тонкие рассекающие щипцы, чтобы зажать хорион и вытянуть наружу, осторожно освобождая каждый эмбрион от хориона.
- В случае большого количества яиц проведите ферментативную дехорионацию путем инкубации яиц в массовом объеме при комнатной температуре (ОТ) в растворе проназы 1 мг/мл в среде Е3 в течение короткого периода времени (обычно 5-10 минут, пока хорионы не раскроются при легком полоскании мочи). Затем раствор проназы отбрасывают, а эмбрионы тщательно промывают 3 раза свежим Е3, чтобы удалить оставшийся хорион и остаточный фермент.
2. Крепление данио-рерио
- Приготовьте 1% низкоплавкий раствор агарозы в буфере Е3. Охладите агарозу до 37 °C в настольном нагревательном блоке и добавьте свежеприготовленный раствор трикаина метансульфоната (160 мг/л), который поможет сохранить эмбрионы под наркозом во время визуализации. Вортексируйте раствор для его полной гомогенизации.
- Обезболите эмбрионы, добавив 160 мг/л трикаина метансульфоната в чашку Петри, содержащую эмбрионы в буфере Е3. Убедитесь, что движение остановилось, и выберите эмбрионы данио-рерио с желаемой флуоресценцией. Проверьте здоровье эмбриона, визуализировав его сердцебиение с помощью светлопольного стереомикроскопа. С помощью трансферной пипетки с широким наконечником возьмите один или до трех отобранных эмбрионов и перенесите их на нижнюю стеклянную рентгенографическую пластину.
- Под стереомикроскопом используйте пипетку, чтобы удалить как можно больше среды, стараясь не прикасаться к эмбрионам и не повреждать их; Затем замените среду на ранее приготовленный 1% раствор агарозы с низким уровнем плавления. Затем с помощью пластикового тонко конического наконечника, закрепленного на конце дразнящей иглы, осторожно прижмите каждый эмбрион к нижней части рентгенографической пластины, ориентируя его так, чтобы его дорсальная сторона была обращена к стеклу, чтобы обеспечить хороший обзор оптического тектума и минимальное количество низкоплавящейся агарозы между эмбрионом и стеклом.
- Быстро визуализируйте установленный эмбрион с помощью инвертированного конфокального микроскопа с высококачественным объективом Plan Apo (10x/0,45 Plan Apo или 20x/0,75 Plan Apo, используемый здесь). Если таймлапс будет длиться в течение длительного периода времени (более часа), добавьте одну или две капли буфера E3 с трикаиновым метансульфонатом (160 мг/л) в нижнюю стеклянную пластину для визуализации, чтобы предотвратить чрезмерное высыхание низкоплавкой агарозы.
ПРИМЕЧАНИЕ: Крайне важно дождаться полного затвердевания агарозы, прежде чем добавлять буфер E3 и трикаин метансульфонат в диск для визуализации; В противном случае рыба может медленно двигаться в горизонтальном и осевом направлениях, что приведет к дрейфу образца в таймлапсе. - Перейдите к настройке съемки таймлапса за нужное время: установите разрешение изображения 1 024 x 1 024 с размером пикселя 0,49 мкм. Собирайте оптические срезы с шагом 2-3 мкм, чтобы обеспечить приемлемое разрешение по оси z. У эмбриона данио-рерио поместите тектум зрительного нерва в z-стек размером 100-150 мкм, в зависимости от используемой стадии развития. Чтобы обеспечить успешное отслеживание ячеек, сохраняйте временной интервал между кадрами от 30 с до 60 с.
3. Отслеживание, анализ и экспорт данных
- Преобразуйте файл таймлапса в формат IMS с помощью программы конвертера файлов Imaris (см. Таблицу материалов). После запуска программного обеспечения либо перетащите файлы в область ввода, либо воспользуйтесь функцией «Добавить файлы...» , чтобы выбрать их вручную. В меню «Вывод » укажите место для преобразованных файлов, выбрав либо ту же папку, что и входные файлы, либо указав конкретную папку. Убедитесь, что отображаемый размер воксела правильный, нажав кнопку «Установить размер воксела », и как только размер воксела будет проверен, нажмите кнопку « Начать все », чтобы начать преобразование файла (см. Дополнительный файл 1 для пошагового руководства по анализу всех данных).
ПРИМЕЧАНИЕ: Если таймлапс проводился на двух или более эмбрионах параллельно, файл будет автоматически разделен на отдельные позиции, разделяя каждый эмбрион на разные файлы. Есть возможность использовать программное обеспечение в пакетном режиме и загружать и конвертировать несколько файлов одновременно. Файлы IMS будут созданы и сохранены в выбранной папке назначения или в папке, где находятся входные файлы. - После запуска запустите программное обеспечение для анализа на Арене; нажмите на кнопку «Наблюдать за папкой », чтобы открыть ранее преобразованный файл. После того, как файл будет загружен в программу, используйте представление «Срез » для прокрутки z-стека с помощью ползунка на панели инструментов «Срез », расположенной слева от области просмотра, и измерьте некоторые диаметры ячеек, нарисовав диаметр выбранных ячеек с помощью указателя. Щелкните и перетащите мышь, чтобы нарисовать сегмент, охватывающий ядро ячейки; обратите внимание на длину сегмента, нарисованного на панели инструментов измерения, расположенной справа от зоны обзора.
ПРИМЕЧАНИЕ: Используя настройки визуализации на шаге 2.5, можно ожидать, что диаметр тела клетки составит от 6 мкм до 8 мкм. - Чтобы автоматически обнаружить ячейки, вернитесь в 3D-вид и нажмите на иконку пятна на панели инструментов объекта , чтобы добавить новый объект пятен в список объектов, и откройте мастер автоматического создания пятен. На первом шаге мастера отметьте галочкой опцию сегментации только интересующей вас области. Затем включите опцию Трек точек (по времени) для вычисления данных трекинга, а также Объект-Объектная статистика для сравнения между пятнами и расширения диапазона данных, которые будут доступны позже в анализе. Наконец, продолжите работу мастера, нажав кнопку «Далее» в правом нижнем углу окна мастера.
- На втором шаге перейдите к определению области интереса (ROI), которая охватывает оптический тектум эмбриона. Измените размер ROI, щелкнув и перетащив маленькие белые стрелки, присутствующие на каждой его грани. После определения размера ROI распространите его на все записанные кадры, настроив временной интервал.
- Затем выберите в качестве исходного канала канал, используемый для обнаружения ячеек, и установите измерение диаметра ячейки, полученное ранее на шаге 3.2, в качестве расчетного диаметра XY. Включите опцию «Вычитание фона » и нажмите « Далее».
- На этом этапе мастера создания пятен программное обеспечение включает в себя этап качественной фильтрации, в котором пятна фильтруются по интенсивности сигнала, измеренной в центре каждого пятна; в русле, где были обнаружены пятна. Отрегулируйте порог интенсивности , введя значение непосредственно в поле данных для нижнего и верхнего пороговых полей или перетащив соответствующие цветные линии на гистограмме, показанной в нижней части мастера создания, чтобы были обнаружены все клетки, в том числе локализованные глубже в ткани, которые обычно показывают меньшую интенсивность сигнала. Все эти изменения одновременно видны в области просмотра.
ПРИМЕЧАНИЕ: На этом этапе можно наблюдать несколько пятен, маркирующих одну клетку, но это может быть исправлено позже в анализе.
В более длинных таймлапсах, если наблюдается некоторое фотообесцвечивание, проверьте область обзора нескольких кадров перед установкой порогового значения, чтобы убедиться, что все ячейки также обнаруживаются в самых последних и, следовательно, более тусклых кадрах. - Когда все будет удовлетворено, нажмите кнопку «Далее », чтобы проверить выбранный порог качества. Все пятна, удовлетворяющие параметру Quality thresholding и имеющие диаметр, соответствующий Estimated XY Diameter, будут помечены как пятна. Визуализируйте это в виде предварительного просмотра в области просмотра, где пятна, удовлетворяющие этим двум параметрам, будут наложены на исходный канал.
- На следующем шаге выберите авторегрессионное движение в качестве алгоритма отслеживания для отслеживания ячеек, которые имеют более или менее непрерывное движение. Оцените наибольшее расстояние, на которое ячейка перемещается между двумя временными точками, внимательно наблюдая за движением пятен между двумя кадрами, и введите предполагаемое число в поле «Максимальное расстояние ». Это расстояние, на которое пятно может отклоняться от прогнозируемого будущего положения.
- Установите Максимальный размер промежутка на наименьшее количество временных точек, в которых пятно может исчезнуть, не прерывая трек. Если интервал между кадрами меньше 60 с, используйте размер 3. Если временной интервал между кадрами больше, увеличьте максимально допустимый размер зазора, чтобы уменьшить фрагментацию трека.
- Включите опцию Заполнить промежутки всеми обнаруженными объектами , чтобы снизить порог обнаружения вблизи ожидаемого положения, прогнозируемого алгоритмом отслеживания, и соединить треки, которые прерываются из-за сбоя обнаружения пятна. Наконец, нажмите на кнопку «Далее » и позвольте программному обеспечению автоматически сгенерировать треки для всех ранее сгенерированных спотов.
- Если полученных треков оказалось слишком много или фрагментировано, вернитесь в мастер создания, нажав на кнопку Назад , и отрегулируйте максимальное расстояние, заданное ранее, увеличивая или уменьшая количество до тех пор, пока большинство полученных треков не станут репрезентативными для движений ячеек.
Примечание: Количество следов должно примерно соответствовать количеству клеток микроглии, следовательно, в диапазоне от 30 до 50, в зависимости от возраста эмбриона. Однако до завершения анализа ожидается большее число из-за ошибочных треков. - После того, как треки были подсчитаны, программное обеспечение включает в себя этап фильтрации, чтобы отфильтровать все очень короткие треки, поскольку они часто неточны или неинформативны. Исключите треки короче 3-8 минут (мин), введя значение непосредственно в поле данных для нижнего предела фильтра длительности трека, или перетащив соответствующие цветные линии на гистограмме, показанной в нижней части мастера создания. Нажмите « Далее », чтобы проверить фильтр и перейти к мастеру создания.
ПРИМЕЧАНИЕ: Как упоминалось ранее, изменяя порог максимальной (максимальной) и минимальной (минимальной) длительности трека, можно предварительно просмотреть треки, которые будут отфильтрованы и исключены из анализа. Отфильтрованные треки затем могут быть продублированы в новом объекте для дальнейшего анализа. Точный порог времени для фильтрации может варьироваться в зависимости от результатов предыдущего шага мастера создания . Мы рекомендуем выполнить тонкую настройку этих параметров фильтра, просмотрев предварительный просмотр в области просмотра для получения оптимальных результатов. - Поскольку трансгенная линия Tg(mpeg1:eGFP) помечает все мононуклеарные фагоциты, макрофаги кожи в дополнение к микроглии также будут обнаружены в таймлапс-фильмах. Вручную удалите следы, полученные из макрофагов кожи из анализа, чтобы сосредоточиться на паренхиматозной микроглии мозга (рис. 3).
- Вручную исправьте другие потенциальные ошибки в треках в редакторе треков, где каждая точка данных отображается как объект в треке. Активируйте кнопку выбора режима круга справа от области обзора и выделите треки, требующие модификации или корректировки. После выбора проблемного трека с помощью кнопок подключения и отключения отредактируйте его, чтобы правильно отобразить движения ячеек. Используйте редактор треков для выбора и удаления дубликатов отдельных пятен или небольших фрагментов трека, которые ошибочно представляют одну и ту же ячейку, выделив их в режиме выбора круга и нажав Canc или Delete для их удаления.
ПРИМЕЧАНИЕ: Если настройки отслеживания верны, этот шаг должен быть обязательным только для небольшого процента отслеживаемых ячеек. - Если репортерная линия микроглии используется в сочетании с флуоресцентными трансгенными линиями, маркирующими другие типы клеток в паренхиме, выполните сегментацию как новый поверхностный объект или точечный объект для их визуализации. Для этого повторите описанные выше шаги (с шагов 3.2 по 3.14), изменив входной канал источника на шаге 3.5, чтобы он использовался для отображения второй популяции клеток, и позаботьтесь об адаптации описательных параметров, специфичных для интересующих клеток, таких как Расчетный диаметр XY (шаг 3.5), Максимальное расстояние (шаг 3.8) к новой популяции клеток. Остальные шаги можно повторить без изменений.
ПРИМЕЧАНИЕ: В случае создания новой поверхности, Расчетный диаметр XY заменяется параметром порогового значения, основанным на Вычитании фона, где вводимым параметром является диаметр самой большой сферы, которая помещается в объекте. Это значение можно оценить в виде Срез с помощью панели инструментов Измерить , как описано в шаге 3.2. - После того, как вы будете удовлетворены полученными треками, извлеките желаемую статистику трекинга из вкладки «Статистика ». Нажав на кнопку настроек , выберите, какая статистика будет рассчитываться для каждого ранее созданного точечного объекта или объекта поверхности. Если в одном и том же анализе было создано несколько объектов, два точечных объекта или пятно и поверхностный объект, статистика, отображающая относительное положение одного объекта относительно другого, например, кратчайшее расстояние между ними, также будет доступна для экспорта.
ПРИМЕЧАНИЕ: Все желаемые значения могут быть как конкретными, так и средними, а все исходные данные можно загрузить в виде файла с разделителями-запятыми (CSV) с помощью кнопок в нижней части вкладки «Статистика ». При условии, что анализ включает и другие типы ячеек, также станет доступна дополнительная статистика об относительном расстоянии одного объекта от другого.
Representative Results
Микроглиальные клетки, экспрессирующие зеленый флуоресцентный белок (eGFP), и эндотелиальные клетки, экспрессирующие DsRed в Tg(mpeg1:eGFPgl22; KDRL:CRES898; actb2:loxP-STOP-loxP-DsRedexpress,sd5) тройные трансгенные эмбрионы14 были визуализированы с частотой 3 dpf, в соответствии с описанным протоколом. Один эмбрион рыбки данио был помещен в агарозу с низкой температурой 1% на нижнюю стеклянную пластину, и процесс визуализации не препятствовал росту эмбриона во время приобретения. Таймлапс был зарегистрирован с помощью коммерческой системы точечной сканирующей конфокальной микроскопии, оснащенной 10-кратной линзой сухого объектива 0,45 НК, а для визуализации микроглии и эндотелиальных клеток использовались возбуждающие лазеры с длиной волны 488 нм и 561 нм соответственно. Кроме того, временной интервал, разрешение изображения, размер пикселя и шаг z составили 30 секунд (с), 1024x1024, 0,49 мкм и 2,5 мкм соответственно. Покадровая съемка длилась 3,5 часа (ч).
Приобретенное поле зрения охватывало всю голову эмбриона, но анализ был сосредоточен именно на тектуме зрительного нерва, так как в течение первой недели развития микроглия в основном ограничена нейрональным слоем сомы этой области дорсального среднего мозга, что позволило исследователям визуализировать всю популяциюодновременно. Анализ 3D-трекинга был выполнен с использованием Imaris 10.0, как описано выше. Как показано на рисунке 4, отслеживание было успешным, в результате чего было получено 25 треков, что соответствует ожидаемому количеству клеток микроглии, присутствующих в тектуме зрительного нерва при 3 dpf16. Требовалась минимальная ручная коррекция треков. На рисунке 5 показан пример данных, которые можно извлечь из успешного эксперимента по отслеживанию. Одновременное мечение макрофагов и эндотелиальных клеток позволяет количественно оценить положение микроглии относительно последних, что позволяет исследователям визуализировать относительное расстояние каждой клетки до ближайшей эндотелиальной клетки во времени и изучить частоту и количество потенциальных взаимодействий (рис. 5).
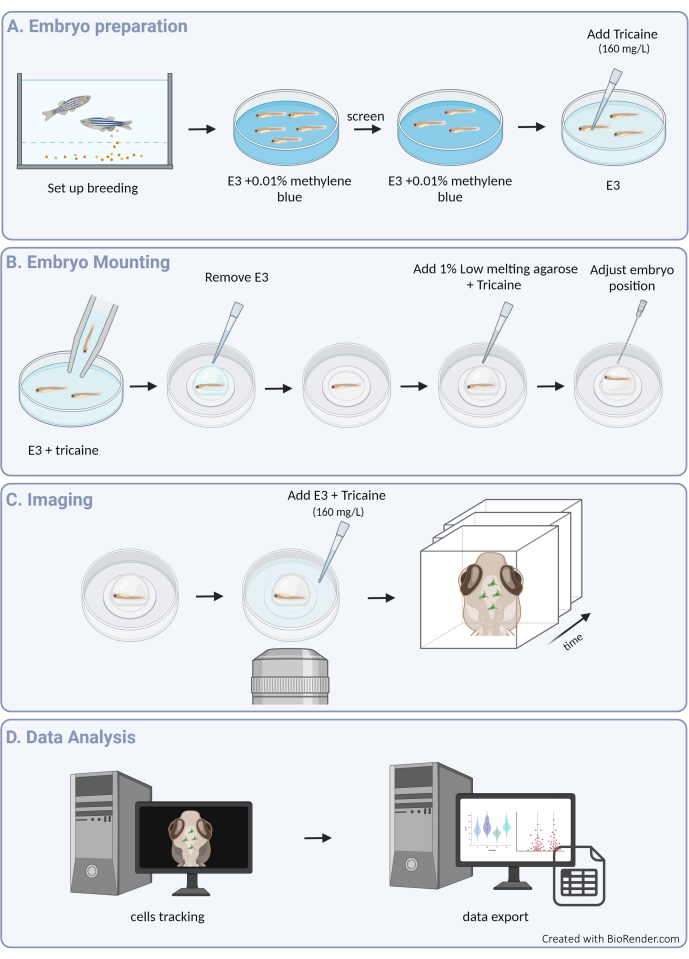
Рисунок 1: Обзор экспериментальной процедуры. (A) Подготовка эмбрионов рыбок данио-рерио и анестезия. (B) Монтаж и позиционирование образца. (C) Получение изображений. (D) Обработка изображений и извлечение данных о подвижности. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
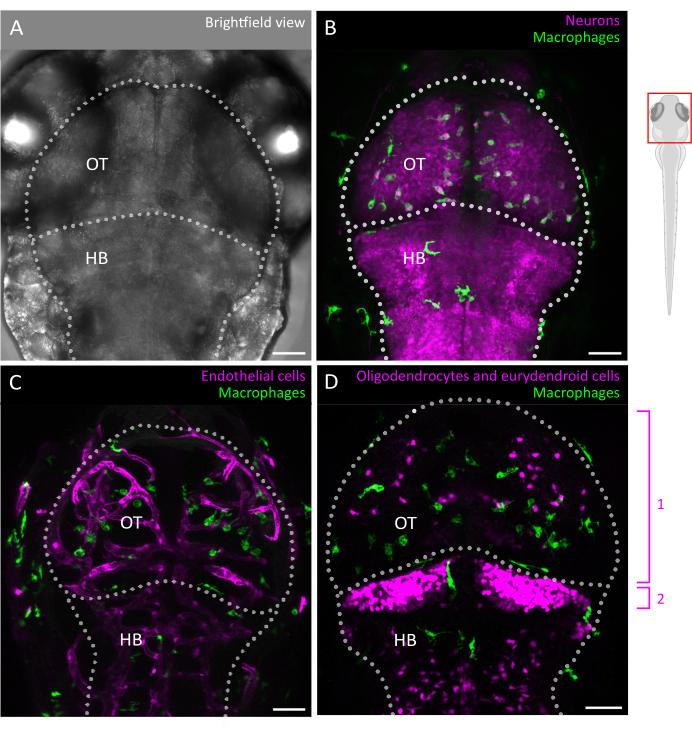
Рисунок 2: Визуализация микроглии и взаимодействие с клеточной средой мозга у эмбриона рыбки данио. (A) Светлопольное изображение головы и мозга эмбриона данио-рерио размером 3 dpf (дорсальный вид), обозначающее тектум зрительного нерва и задний мозг. Мозг эмбриональной рыбки данио может быть полностью визуализирован на этом этапе благодаря его небольшому размеру и оптической прозрачности. (Б-Г) Расположение и поведение микроглии можно визуализировать с помощью трансгенных линий, таких как (B,C) Tg(mpeg1:eGFP)gl22 и (D) Tg(mpeg1:mcherry)gl23, и сосредоточившись на OT. (B) Нейроны и их клеточные тела могут быть идентифицированы с помощью репортерной линии Tg(XlTubb:D sRed)zf148 , а взаимодействия микроглии и нейронов могут быть визуализированы путем слияния двух каналов в линии, которые совместно экспрессируют оба трансгена. Видимым является слияние зеленого (микроглия) и красного (нейроны, пурпурный) сигналов. (К,Г) Репортерные линии также могут пролить свет на взаимодействие микроглии (зеленым) с эндотелиальными клетками, здесь помеченные красным цветом с помощью (C) двойного Tg(kdrl:cres898; actb2:LOXP-STOP-LOXP-Dsredexpress, sd5) или с глиальными клетками, такими как олигодендроциты и их предшественники, с использованием (D) двойного Tg(olig2:EGFP; mpeg1:mcherry ) трансгенная линия. 1: олигодендроциты и клетки-предшественники в ОТ, 2: эвридендроидные нейроны в мозжечке. Масштабные линейки = 50 μм. Сокращения: dpf = дни после оплодотворения; OT = оптический тектум; HB = задний мозг. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
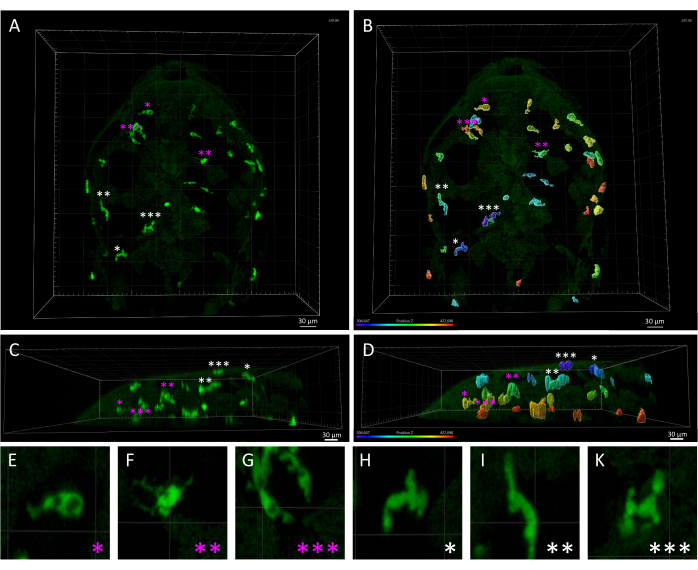
Рисунок 3: Морфологическое и пространственное несоответствие между макрофагами кожи и микроглией у эмбриона данио-рерио размером 3 dpf. (A,B) Дорсальный вид эмбриона Tg(mpeg1:eGFP)gl22 при 3 dpf, изображающий (A) клетки паренхиматозной микроглии (отмеченные пурпурными звездочками) и кожные макрофаги (белые звездочки), идентифицированные на основе их взаимного расположения вдоль оси z, как видно на рисунке (B), в котором отображается монохромное 3D-изображение, визуализированное с помощью цветового кодирования по оси Z. (К,Г) Вид сбоку (C) A и (D) B, демонстрирующий z-глубины клеток mpeg1:eGFP+ в голове эмбриона и подчеркивающий поверхностную локализацию макрофагов кожи по сравнению с микроглиальными клетками. (Э-К) Высокое увеличение каждой клетки, обозначенное звездочкой в точках А и В, обеспечивает детальную визуализацию различных морфологий между амебоидной микроглией (E-G) и макрофагами удлиненной кожи (H-K). Масштабные линейки = 30 μм. Сокращение: dpf = дни после оплодотворения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
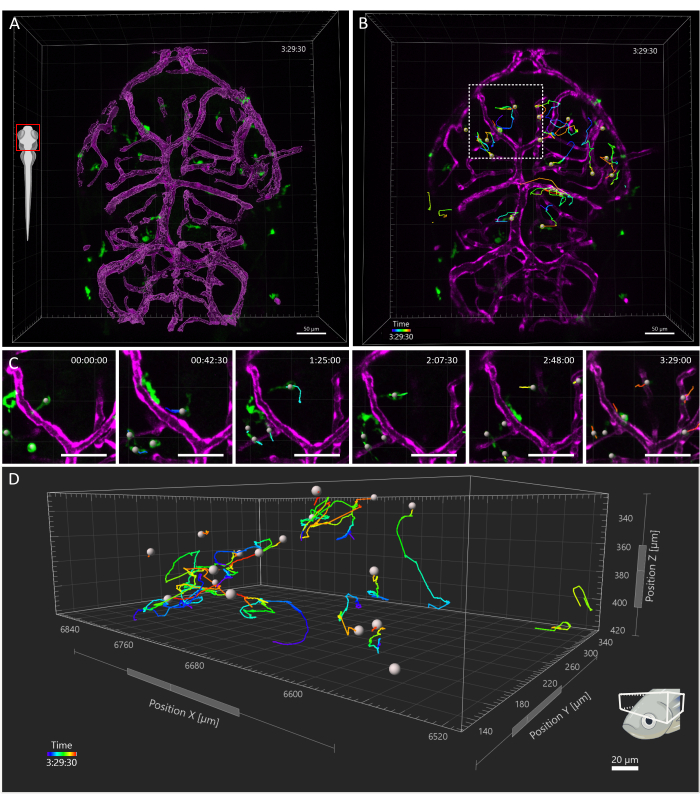
Рисунок 4: Отслеживание клеток микроглии в эмбрионе данио-рерио размером 3 dpf. (A) Дорсальный вид головы 3 dpf Tg(kdrl:cres898; actb2:LOXP-STOP-LOXP-Dsredexpress,sd5; mpeg1:eGFPgl22) тройной трансгенный эмбрион, показывающий микроглию (зеленый) и поверхностную визуализацию сосудов (пурпурный). (Б-Г) Репрезентативное отслеживание движений микроглии в течение (B) 3,5 часового временного окна. Видно, что отдельные клетки следуют сложным траекториям. (C) Деталь из таймлапса, показывающая увеличенное изображение области в B , заключенной в пунктирный квадрат. Представлены шесть кадров из фильма (с интервалом в 45 минут), документирующих микроглию, устанавливающую транзиторные контакты с эндотелиальными клетками в их микроокружении. (D) Траектории миграции отдельных микроглиальных клеток в пределах оптического тектума, где оси X, Y и Z представляют пространственные размеры. Масштабная линейка = 50 мкм. Сокращение: dpf = дни после оплодотворения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
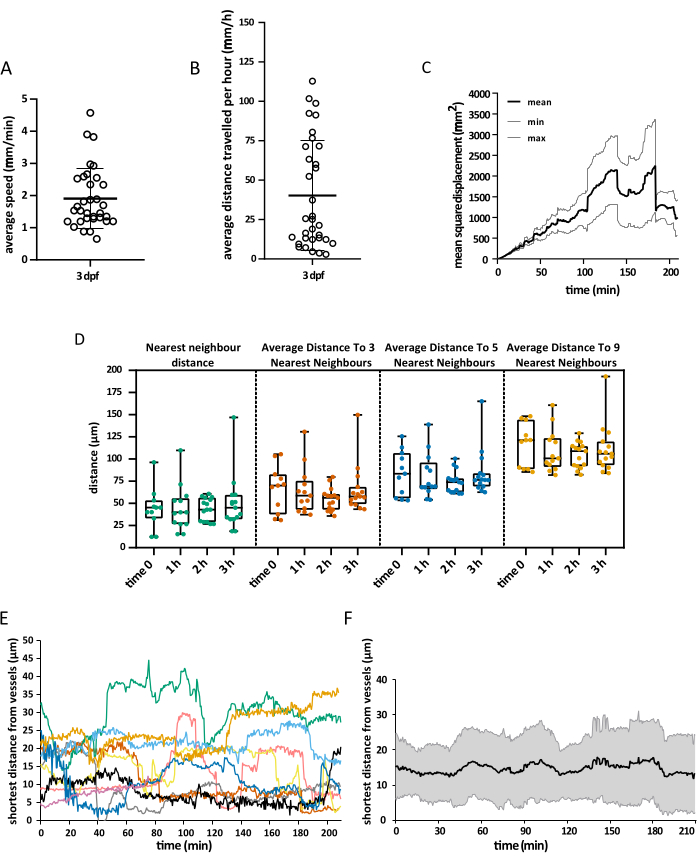
Рисунок 5: Визуализация полученных данных. Пример пространственных данных, которые могут быть получены с помощью описанного протокола. Графики отображают (А) среднюю скорость микроглиальных клеток, (В) среднее расстояние, которое они преодолевают за 1 ч, (В) их среднее квадратное смещение и (Г) их распределение в пространстве в разное время. Визуализация поверхности сосуда также позволила измерить кратчайшее расстояние между микроглией и эндотелиальными клетками в любой момент времени, как на уровне (E) одиночных клеток, так и в среднем по миру (F). Для A, B и D каждая точка представляет отдельную клетку. N = один эмбрион. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительный файл 1: Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Discussion
Текущий протокол позволяет in vivo визуализировать динамику микроглии у эмбриона позвоночного и визуализировать полученные данные о подвижности. Колонизация развивающегося мозга микроглией происходит на очень ранних этапах эмбриогенеза и предшествует критическим событиям, таким как пики нейрогенеза, астроглиогенеза, олигодендрогенеза и многие другие клеточныепроцессы. Поэтому неудивительно, что микроглия играет важную роль в формировании специфических аспектов развития мозга18, например, посредством регуляции дифференцировки, миграции и выживания нейронов 19,20,21, а также синаптической обрезки5 и миелинизации 22,23,24.
Вклад дисфункциональной микроглии в патогенез и/или прогрессирование нарушений развития нервной системытакже получает все большее признание. Действительно, раннее присутствие микроглии в формирующемся мозге подвергает эти клетки различным физиологическимсостояниям и изменениям окружающей среды. Это может оказать значительное влияние, учитывая, что микроглия является долгоживущими клетками как у грызунов, так и у человека, и сохраняется на протяжении всей жизни за счет самообновления местных предшественников 27,28,29. Мы считаем, что этот протокол может послужить мощным инструментом для лучшей характеристики поведения микроглии в этих различных физиологических состояниях, когда они развиваются, созревают и устанавливают свою сеть на последовательных этапах морфогенеза мозга.
Используя описанную здесь установку, мы успешно визуализировали и получили данные о личинках данио-рерио возрастом до 6 dpf. Распространение анализа на более поздние стадии разработки, скорее всего, увенчается успехом, но потребует корректировки установки визуализации с учетом увеличенного размера выборки, особенно вдоль оси z. При попытке сделать это мы предлагаем сосредоточиться на поддержании низкого соотношения сигнал/шум и быстром времени сканирования, поскольку они являются ключевыми параметрами для успешного анализа.
Мы рекомендуем минимальное время визуализации 1 час для отслеживания микроглии; Самое длинное окно визуализации, которое было протестировано с помощью этого протокола, составляет 8 часов. Кроме того, при анализе слежения важно, чтобы интервал времени между кадрами был как можно короче, в идеале от 30 до 60 секунд. Это позволит получать более точные и подробные данные отслеживания при последующем анализе. Таким образом, особенно при обнаружении более одного флуорофора, принципиально важно избегать наложения спектров спектра и обеспечить достаточное расстояние между двумя спектрами излучения флуорофора, чтобы обеспечить одновременный сбор данных без просвечивания сигнала.
Доступны и другие протоколы для высококачественной покадровой записи мозга рыбок данио-рерио, но это первый, показывающий, как успешно отслеживать все движения микроглии во время эмбрионального развития в течение длительного периода времени. Несмотря на то, что представленный здесь рабочий процесс был сосредоточен на отслеживании микроглии в физиологическом контексте, его можно легко применить к анализу микроглии при патологии. Действительно, у рыбок данио было создано несколько моделей расстройств развития нервной системы, таких как аутизм31, эпилепсия32 и шизофрения33, а также нейродегенерация34 и рак35, которые предоставляют уникальные возможности для определения микроглиальной реакции и поведения при заболеваниях.
Примечательно, что этот протокол отслеживания очень универсален и также может быть полезен для того, чтобы пролить свет на модели миграции различных типов клеток в различных анатомических областях эмбриона данио-рерио, тем самым потенциально открывая возможности для дополнительных применений, выходящих за рамки микроглиальных исследований, описанных в этой статье. Более того, используя возможность комбинировать несколько флуоресцентных трансгенных линий, мы получаем возможность различать пространственные отношения между микроглией и другими типами клеток микроокружения мозга, с возможностью визуализации клеточных взаимодействий и перекрестных помех на протяжении временных записей неинвазивным способом. Это может сыграть важную роль в выяснении физиологического значения поведения микроглии и способствовать более глубокому описанию этих высокоподвижных клеток.
Disclosures
Авторы заявляют об отсутствии конфликта интересов.
Acknowledgements
Авторы хотели бы выразить искреннюю благодарность профессору Николасу Байенсу за щедрый доступ к конфокальному микроскопу, необходимому для этого исследования. Эта работа была частично профинансирована Фондами научных исследований (FNRS) в рамках грантов No F451218F и UG03019F, Фондом исследования болезни Альцгеймера (SAO-FRA) (V.W.), A.M. поддерживается исследовательской стипендией FNRS. Рисунок 1 был создан biorender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 1 L Breeding tanks | Tecniplast | ZB10BTE | |
| 1-phenyl-2-thiourea (PTU) | Sigma-Aldrich | P7629 | Diluted to 0.2 mM in E3 to prevent embryo pigmentation |
| Bottom glass imaging dish | FluoroDish | FD3510-100 | |
| Disposable Graduated transfer pipette | avantor | 16001-188 | |
| Dry block heater | Novolab | Grant QBD4 | To keep low melting agarose at 37 °C |
| Ethyl 3-aminobenzoate methanesulfonate (Tricaine) | Sigma-Aldrich | E10521-50G | |
| Imaris 10.0 | Oxford Instruments | analysis software | |
| Imaris File Converter | Oxford Instruments | https://imaris.oxinst.com/big-data | |
| Laser-scanning confocal microscope | Nikon | Eclipse Ti2-E | |
| Methylene blue | Sigma-Aldrich | M9140-25G | |
| microloader tips | Eppendorf | 5242956003 | |
| NuSieve GTG Agarose | Lonza | 50081 | |
| Petri dishes (90 mm) | avantor | 391-0559 | |
| Pronase | Sigma-Aldrich | 11459643001 | |
| Stainless Steel Forceps Dumont No. 5 | FineScienceTools | 11254-20 | |
| Stereo microscope | Leica | Leica M80 | To mount the embryos |
| teasing needle | avantor | 76549-024 |
References
- Wolf, S. A., Boddeke, H. W., Kettenmann, H. Microglia in physiology and disease. Annu Rev Physiol. 79, 619-643 (2017).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Sci Rep. 308 (5726), 1314-1318 (2005).
- Peri, F., Nusslein-Volhard, C. Live imaging of neuronal degradation by microglia reveals a role for v0-ATPase a1 in phagosomal fusion in vivo. Cell. 133 (5), 916-927 (2008).
- Marın-Teva, J. L., et al. Microglia promote the death of developing Purkinje cells. Neuron. 41 (4), 535-547 (2004).
- Paolicelli, R. C., et al. Synaptic pruning by microglia is necessary for normal brain development. Science. 333 (6048), 1456-1458 (2011).
- Hattori, Y. The microglia-blood vessel interactions in the developing brain. Neurosci Res. 187, 58-66 (2023).
- Colonna, M., Butovsky, O. Microglia function in the central nervous system during health and neurodegeneration. Annu Rev Immunol. 35, 441-468 (2017).
- Xu, H. -. T., Pan, F., Yang, G., Gan, W. -. B. Choice of cranial window type for in vivo imaging affects dendritic spine turnover in the cortex. Nat Neurosci. 10 (5), 549-551 (2007).
- Shin, J., Park, H. -. C., Topczewska, J. M., Mawdsley, D. J., Appel, B. Neural cell fate analysis in zebrafish using olig2 BAC transgenics. Methods Cell Sci. 25 (1), 7-14 (2003).
- Chi, N. C., et al. Foxn4 directly regulates tbx2b expression and atrioventricular canal formation. Genes Dev. 22 (6), 734-739 (2008).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: An introduction. J Vis Exp. (69), e4196 (2012).
- Bohnsack, B. L., Gallina, D., Kahana, A. Phenothiourea sensitizes zebrafish cranial neural crest and extraocular muscle development to changes in retinoic acid and IGF signaling. PLoS ONE. 6 (8), e22991 (2011).
- Ariga, J., Walker, S. L., Mumm, J. S. Multicolor time-lapse imaging of transgenic zebrafish: visualizing retinal stem cells activated by targeted neuronal cell ablation. J Vis Exp. (43), e2093 (2010).
- Ferrero, G., et al. Embryonic microglia derive from primitive macrophages and are replaced by cmyb-dependent definitive microglia in zebrafish. Cell Rep. 24 (1), 130-141 (2018).
- Xu, J., Wang, T., Wu, Y., Jin, W., Wen, Z. Microglia colonization of developing zebrafish midbrain is promoted by apoptotic neuron and lysophosphatidylcholine. Dev Cell. 38 (2), 214-222 (2016).
- Svahn, A. J., et al. Development of ramified microglia from early macrophages in the zebrafish optic tectum. Dev Neurobiol. 73 (1), 60-71 (2013).
- Thion, M. S., Garel, S. Microglial ontogeny, diversity and neurodevelopmental functions. Curr Opin Genet Dev. 65, 186-194 (2020).
- Bohlen, C. J., Friedman, B. A., Dejanovic, B., Sheng, M. Microglia in brain development, homeostasis, and neurodegeneration. Annu Rev Genet. 53, 263-288 (2019).
- Squarzoni, P., et al. Microglia modulate wiring of the embryonic forebrain. Cell Rep. 8 (5), 1271-1279 (2014).
- Schafer, D. P., et al. Microglia sculpt postnatal neural circuits in an activity and complement-dependent. Neuron. 74 (4), 691-705 (2012).
- Parkhurst, C. N., et al. Microglia promote learning-dependent synapse formation through brain-derived neurotrophic factor. Cell. 155 (7), 1596-1609 (2013).
- Green, L. A., O'Dea, M. R., Hoover, C. A., DeSantis, D. F., Smith, C. J. The embryonic zebrafish brain is seeded by a lymphatic-dependent population of mrc1+ microglia precursors. Nat. Neurosci. 25 (7), 849-864 (2022).
- Hughes, A. N., Appel, B. Microglia phagocytose myelin sheaths to modify developmental myelination. Nat Neurosci. 23 (9), 1055-1066 (2020).
- Yu, Q., et al. C1q is essential for myelination in the central nervous system (CNS). iScience. 26 (12), 108518 (2023).
- Zengeler, K. E., Lukens, J. R. Innate immunity at the crossroads of healthy brain maturation and neurodevelopmental disorders. Nat Rev Immunol. 21 (7), 454-468 (2021).
- Paolicelli, R. C., et al. Microglia states and nomenclature: A field at its crossroads. Neuron. 110 (21), 3458-3483 (2022).
- Réu, P., et al. The lifespan and turnover of microglia in the human brain. Cell Rep. 20 (4), 779-784 (2017).
- Ajami, B., Bennett, J. L., Krieger, C., Tetzlaff, W., Rossi, F. M. V. Local self-renewal can sustain CNS microglia maintenance and function throughout adult life. Nat Neurosci. 10 (12), 1538-1543 (2007).
- Mildner, A., et al. Microglia in the adult brain arise from Ly-6ChiCCR2+ monocytes only under defined host conditions. Nat Neurosci. 10 (12), 1544-1553 (2007).
- Cook, Z. T., Brockway, N. L., Weissman, T. A. Visualizing the developing brain in living zebrafish using Brainbow and time-lapse confocal imaging. J Vis Exp. (157), e60593 (2020).
- Tayanloo-Beik, A., et al. Zebrafish modeling of autism spectrum disorders, current status and future prospective. Front Psychiatry. 13, 911770 (2022).
- D'Amora, M., et al. Zebrafish as an innovative tool for epilepsy modeling: State of the art and potential future directions. Int J Mol Sci. 24 (9), 7702 (2023).
- Langova, V., Vales, K., Horacek, J. The role of zebrafish and laboratory rodents in schizophrenia research. Front Psychiatry. 11, 549232 (2020).
- Chia, K., Klingseisen, A., Sieger, D., Priller, J. Zebrafish as a model organism for neurodegenerative disease. Front Mol Neurosci. 15, 940484 (2022).
- Astell, K. R., Sieger, D. Zebrafish in vivo models of cancer and metastasis. Cold Spring Harb Perspect Med. 10 (8), 037077 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved