Quantificação não destrutiva baseada em SPE-UPLC de aflatoxinas e fitoalexinas estilbenóides em amendoim único (Arachis spp.) Sementes
In This Article
Summary
Demonstramos um método de médio rendimento para quantificação de aflatoxinas e fitoalexinas estilbenóides em sementes individuais de amendoim usando cromatografia líquida de ultra eficiência. Este método foi desenvolvido especificamente para as análises de espécies selvagens de Arachis desafiadas pelas espécies aflatoxigênicas de Aspergillus .
Abstract
As aflatoxinas são metabólitos secundários altamente cancerígenos de algumas espécies de fungos, particularmente Aspergillus flavus. As aflatoxinas frequentemente contaminam commodities agrícolas economicamente importantes, incluindo amendoim, representando um alto risco para a saúde humana e animal. Devido à estreita base genética, as cultivares de amendoim demonstram resistência limitada a patógenos fúngicos. Portanto, numerosas espécies de amendoim selvagem com tolerância ao Aspergillus receberam consideração substancial pelos cientistas como fontes de resistência a doenças.
Explorar o germoplasma de plantas quanto à resistência às aflatoxinas é difícil, pois o acúmulo de aflatoxinas não segue uma distribuição normal, o que dita a necessidade de análises de milhares de sementes de amendoim individuais. Sementes de amendoim (Arachis spp.) suficientemente hidratadas, quando infectadas por espécies de Aspergillus , são capazes de produzir estilbenos (estilbenóides) biologicamente ativos que são considerados fitoalexinas defensivas. Os estilbenos de amendoim inibem o desenvolvimento de fungos e a produção de aflatoxinas. Portanto, é crucial analisar as mesmas sementes para estilbenóides de amendoim para explicar a natureza da resistência/suscetibilidade das sementes à invasão de Aspergillus . Nenhum dos métodos publicados oferece análises de semente única para aflatoxinas e/ou fitoalexinas de estilbeno.
Tentamos atender à demanda por um método que seja ecologicamente correto, use consumíveis baratos e seja sensível e seletivo. Além disso, o método não é destrutivo, pois utiliza apenas metade da semente e deixa intacta a outra metade contendo o eixo embrionário. Tal técnica permite a germinação e o crescimento da planta de amendoim até a maturidade total a partir da mesma semente utilizada para a análise de aflatoxina e estilbenóide. A parte integrada deste método, o desafio manual das sementes com Aspergillus, é uma etapa limitante que requer mais tempo e trabalho em comparação com outras etapas do método. O método tem sido usado para a exploração de germoplasma selvagem de Arachis para identificar espécies resistentes a Aspergillus e para determinar e caracterizar novas fontes de resistência genética a esse patógeno fúngico.
Introduction
O amendoim (Arachis hypogaea L.) é uma das principais culturas alimentares do mundo. É cultivada em mais de 100 países, com uma produção total superior a 45 milhões de toneladas1. Commodities agrícolas, como amendoim, milho e caroço de algodão, são frequentemente invadidas por espécies de Aspergillus, fungos nascidos no solo que produzem aflatoxinas2. Essas commodities são particularmente suscetíveis à contaminação por aflatoxina pré-colheita quando as condições ambientais são caracterizadas por altas temperaturas e secas. As aflatoxinas estão entre os carcinógenos mais potentes conhecidos3. Eles contaminam um quarto das commodities agrícolas do mundo4 , tornando cerca de metade da população mundial cronicamente exposta a aflatoxinas5. Devido à sua alta carcinogenicidade e toxicidade, a presença de aflatoxina nos alimentos é regulada nos limites mais baixos praticamente aceitáveis na maioria dos países do mundo6.
A União Europeia (UE) legislou um nível máximo de 2 ng/g para aflatoxina B1 e 4 ng/g para aflatoxinas totais (B1, B2, G1 e G2) em produtos para consumo humano7. Esses limites baixos colocam uma pressão substancial sobre a agricultura e a indústria de alimentos que processa commodities contaminadas com aflatoxinas. O monitoramento e o reprocessamento de aflatoxinas de amendoins contaminados podem ser considerados uma estratégia passiva e dispendiosa para evitar que as aflatoxinas entrem na cadeia alimentar. É por isso que todos os principais segmentos da indústria de amendoim experimentam enormes perdas de lucro devido à contaminação por aflatoxina das cultivares de amendoim atuais, que muitas vezes demonstram resistência limitada a doenças fúngicas. Uma abordagem prospectiva para resolver o problema da aflatoxina é a obtenção de cultivares de amendoim resistentes a fungos por meio de introgressão gênica, ou seja, a transferência de informações genéticas de espécies de amendoim selvagem resistentes para cultivares de elite. Nos últimos anos 8,9, as espécies de amendoim selvagem receberam consideração substancial como fontes de resistência a doenças genéticas porque a estreita base genética do amendoim cultivado não pode mais fornecer o nível necessário de características de resistência à planta de amendoim10,11. A introgressão bem-sucedida de espécies de amendoim selvagem requer a análise de milhares de sementes pequenas, escassas e escassas (Figura 1A) 12.
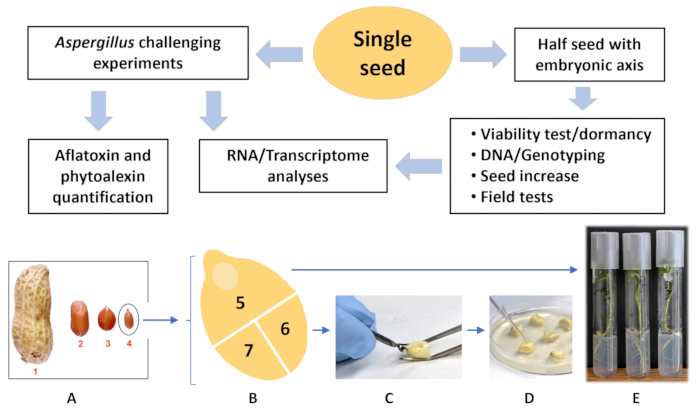
Figura 1: Fluxograma de análise de semente única. (A) Tamanho comparativo de diferentes cultivares de amendoim do tipo mercado vs. Arachis spp. selvagem (1) Virgínia; (2) corredor; (3) espanhol; (4) Arachis spp. selvagem (B) Arachis spp. selvagem (placa A, semente 4) cortada em três partes, (5) meia semente com eixo embrionário; esta parte da semente é usada para cultivar uma planta (E). (C) As partes (6) e (7) são perfuradas com uma broca e (D) inoculadas com esporos de fungos. Após incubação por 72h a 30 °C, uma das partes da semente, (6) ou (7) é usada para análises de aflatoxina e fitoalexina, e outra é usada para sequenciamento de RNA/transcriptoma. Clique aqui para ver uma versão maior desta figura.
A resistência do amendoim a patógenos fúngicos está fortemente associada às fitoalexinas 13,14,15,16,17. As fitoalexinas do amendoim são representadas por estilbenóides antimicrobianos que são biossintetizados e acumulados nos tecidos vegetais após exposição a estímulos exógenos, particularmente, à invasão fúngica 16,17,18. O rápido acúmulo de concentrações suficientes de fitoalexinas no local da invasão fúngica é inibitório do crescimento fúngico e é crítico para a defesa da planta 19,20,21. O patógeno para de crescer quando as fitoalexinas se acumulam em concentrações inibitórias16,22. O papel dos estilbenóides como compostos defensivos contra fungos aflatoxigênicos no amendoim foi avaliado há mais de 30 anos em experimentos de campo13. Esses experimentos apoiaram claramente a hipótese de que os estilbenóides do amendoim são um fator de resistência crucial na contaminação por aflatoxina pré-colheita. Tal evidência é baseada no fato de que os estilbenos são produzidos naturalmente em amendoins danificados no campo; estilbenos demonstram atividade biológica apreciável contra fungos aflatoxigênicos; e a contaminação por aflatoxina nas sementes foi detectada apenas quando o amendoim perdeu a capacidade de síntese de fitoalexinas devido à desidratação das sementes induzida pela seca. Outro conjunto de experimentos de campo confirmou a associação entre a produção de fitoalexina e a resistência do genótipo do amendoim a doenças do amendoim importantes para a agricultura17.
Uma melhor compreensão do mecanismo natural de resistência do amendoim à invasão fúngica baseado em fitoalexina é uma estratégia promissora para o controle da contaminação por aflatoxinas15,17.Portanto, além das análises de aflatoxinas, é importante analisar quantitativamente as mesmas sementes para fitoalexinas. Embora esse mecanismo de resistência não seja totalmente pesquisado e compreendido, é crucial para o melhoramento e modificação genética de plantas de amendoim para novas cultivares resistentes a fungos23. Apesar da existência de vários procedimentos analíticos para determinação de aflatoxinas em diferentes commodities, ainda há necessidade de métodos simples para pesquisas específicas, principalmente quando os métodos tradicionais não atendem aos requisitos analíticos e econômicos. A maioria dos métodos modernos de limpeza usados pela indústria de amendoim, agricultura e laboratórios privados são dispositivos baseados em anticorpos24 e imunoensaio 25,26,27. Eles são seletivos e sensíveis, mas substancialmente mais caros do que as minicolunas repletas de adsorventes comuns. Além disso, nenhum desses métodos foi projetado para a análise de amostras com poucos miligramas. Com base em nossa pesquisa anterior sobre o uso analítico de minicolunas embaladas com gel de sílica de magnésio (Florisil)28, modificamos esse procedimento para atender às necessidades de programas de pré-reprodução e melhoramento em andamento e futuros.
O objetivo deste trabalho foi desenvolver um método não destrutivo, de médio rendimento e ecologicamente correto para a determinação quantitativa de aflatoxinas e fitoalexinas em sementes individuais de amendoim. Esse método foi desenvolvido. Suas vantagens sobre os métodos publicados são maior sensibilidade, capacidade de analisar aflatoxinas e fitoalexinas em um extrato de semente única, falta de necessidade de pesar amostras e menor custo graças a menores volumes de consumíveis. O fluxograma do método integrado é mostrado na Figura 1. As análises genéticas e outras etapas são mencionadas neste texto e demonstradas na figura para mostrar a importância do método sugerido e como ele se integra a todo o procedimento.
Protocol
1. Preparação de sementes para desafio fúngico
- Incubar o Aspergillus flavus NRRL 3357 aflatoxigênico em uma inclinação de ágar Batata Dextrose (PDA) em um tubo de ensaio por 6 dias a 30 ° C. Colha esporos de fungos do tubo de ensaio com 10 mL de água com Tween 20 (100 μL de Tween em 1 L de água estéril destilada), filtre através de lã de vidro colocada em um funil e conte os esporos com um hemocitômetro consultando o manual do usuário.
- Dilua a suspensão de esporos com água estéril até a concentração de 1.000 esporos/μL. Confirme a concentração com um hemocitômetro.
NOTA: Prepare a suspensão de esporos não antes de 2 h antes dos experimentos desafiadores. - Quebre suavemente as vagens de amendoim e remova as cascas. Coloque as sementes em um béquer estéril para que o volume das sementes não exceda 1/5 do volume do copo, adicione solução de peróxido de hidrogênio a 0,05% a aproximadamente 70% do volume do béquer e deixe as sementes beberem água por 3 h.
- Transvase a solução de peróxido de hidrogênio das sementes e adicione aproximadamente 3x a quantidade de mistura de etanol e água a 80% (v/v) ao béquer para cobrir as sementes. Deixe repousar por 1 min e depois enxágue as sementes 2x com volumes iguais de água destilada estéril.
- Adicione 5 vezes o volume de peróxido de hidrogênio a 3% ao copo com as sementes esterilizadas com etanol e deixe repousar por 5 min, depois decanta o líquido e enxágue as sementes duas vezes com volumes iguais de água estéril (Figura 2A).
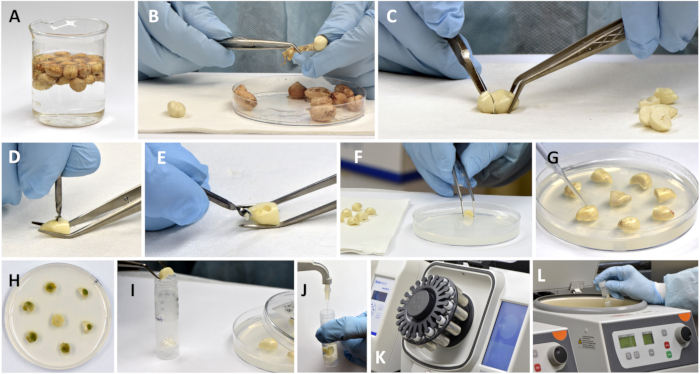
Figura 2: Preparação de sementes de amendoim para inoculação, incubação e extração das frações aflatoxina e fitoalexina. (A) Esterilização de sementes embebidas com peróxido de hidrogênio a 3%; (B) remoção de testa (pele) das sementes; (C) cortar a parte do eixo embrionário; (D,E) cavidade de perfuração em meio cotilédone com broca; (F) colocar partes perfuradas de sementes em ágar; (G) aplicar esporos de fungos na cavidade perfurada. (H) Placa de Petri com sementes após a incubação; (I) colocar sementes individuais incubadas (foto de amostras de controle) em tubos de esferas reforçados; (J) adicionar o volume medido do solvente de extração; (K) pulverizar amostras em um ruptor de esferas; (L) centrifugação de chorume pulverizado. Clique aqui para ver uma versão maior desta figura.
- Coloque as sementes em uma toalha de papel estéril, remova a testa da semente com uma pinça e corte cerca de 1/3 da semente contendo o eixo embrionário com um bisturi (Figura 2B, C).
- Descarte esta parte da semente ou use-a para cultivar uma planta em um tubo de ensaio com meio de crescimento (Figura 1B, E).
- Divida a porção restante da semente em dois cotilédones, coloque-os em uma placa de Petri, cubra as partes da semente com papel de filtro estéril úmido, recoloque a tampa para evitar a desidratação e prossiga imediatamente para a etapa de inoculação.
- Antes de realizar os experimentos desafiadores, prepare um número suficiente de placas de Petri com meio de incubação de sementes, despejando 26 mL de ágar estéril a 1,5% em água nas placas de 100 x 15 mm e deixe-as solidificar durante a noite.
- No meio do lado externo de cada cotilédone restante, faça uma cavidade de 1,5-2 mm de profundidade perfurando manualmente a semente com uma broca afiada estéril de 1,6-2,34 mm de diâmetro. Leva ~ 2-5 s para fazer uma cavidade (Figura 2D, E).
- Coloque 4 a 6 pedaços "perfurados" das sementes em uma placa de Petri com ágar e aplique 2 μL dos 1.000 esporos / μL de suspensão na cavidade perfurada de cada pedaço de meio cotilédone com uma pipetadora de 10 μL. Em vez da suspensão de esporos, aplique água estéril nas sementes de controle ( Figura 2F, G ).
- Cobrir todas as placas de Petri com tampas e incubar a 30 °C sem luz durante 72 h.
2. Amostragem e preparação dos pedaços de sementes incubadas para análise de aflatoxinas e fitoalexinas
- Colete os pedaços de sementes em 72 h, removendo-os do ágar com uma pinça e colocando cada um deles em frascos de esferas de 7 mL rotulados com 13 esferas de cerâmica de zircônio (12 de 2,8 mm de diâmetro e 1 de 6,5 mm de diâmetro) (Figura 2H, I).
NOTA: Neste ponto, se não forem processados imediatamente, os frascos podem ser colocados em um freezer a -80 ° C e mantidos por até 2 meses antes do processamento posterior. - As fitoalexinas e as aflatoxinas são determinadas no mesmo extrato de semente. Para a extração, dependendo do tamanho visual da semente (pequena, média ou grande), adicione 2 ou 4 mL de mistura de metanol e água medida com precisão (90:10, v / v) aos frascos de esferas e pulverize a 5,5 m / s por 45 s. Coloque os frascos com sementes pulverizadas em uma centrífuga e centrifugue a 1.860 × g por 3 min (Figura 2J - L).
NOTA: Os seguintes derivados importantesde 17,22 estilbenóides são determinados (todos em transconfiguração): resveratrol, araquidina-1, araquidina-2, araquidina-3, 3′-isopentadienil-3,5,4′-trihidroxiestilbno (IPD) e SB-1. - Para análises de aflatoxina, antes de executar os experimentos desafiadores, prepare um número suficiente de colunas de limpeza da seguinte forma. Coloque uma frita porosa de polietileno correspondente (20 μL) em uma coluna de polipropileno de 1,5 mL com a ajuda de uma haste de vidro cortada em um ângulo de 90o . Coloque 50 mg de gel de sílica de magnésio (100-200 mesh) na coluna com uma colher feita sob medida e cubra a coluna com uma frita idêntica empurrando-a para baixo com uma haste de vidro (Figura 3A - E).
NOTA: Esta quantidade de sílica gel de magnésio ocupa um volume de 75 μL e a altura da camada adsorvente é de 3 mm.

Figura 3: Preparação de colunas e filtros de limpeza. (A,B) Colocação de uma frita porosa no barril; (C,D) barril de enchimento com sílica gel de magnésio; (E) embalar o adsorvente e inserir uma frita porosa superior no barril. (F) Colocar um círculo de fibra de vidro de 11,5 mm de diâmetro em cima de uma pipeta Pasteur. (G, H) Empurrando o centro do círculo com uma haste de plástico ou madeira até o fundo do cilindro da pipeta Pasteur e compactando firmemente a fibra de vidro. Clique aqui para ver uma versão maior desta figura.
- Neste ponto, prepare um número correspondente de filtros personalizados, conforme mostrado na Figura 3F - H.
- Para análises de aflatoxina, meça com precisão até 0,5 mL de alíquota do sobrenadante (obtida conforme descrito na etapa 2.2), transfira-a para a minicoluna embalada sob medida e deixe o extrato escorrer por gravidade para um frasco de vidro de 4 mL. Transfira 1,0 mL de mistura de metanol-água (90:10, v / v) para a coluna para lavar as impurezas por gravidade no mesmo frasco de 4 mL ( Figura 4A ).

Figura 4: Purificação de extratos de sementes e preparação para as análises de UPLC. (A) Rack com colunas compactadas. (B) Solvente de evaporação com gás N2 de seis frascos de 4 mL com extrato purificado eluído de colunas de limpeza. (C) Levar frascos e filtros a uma temperatura abaixo de zero em recipientes de espuma (1 e 2) com gelo antes e depois da adição do solvente de injeção (MeOH-H2O 9: 1, v / v) aos frascos de 4 mL. (D) Filtrando o extrato resfriado de um frasco de 4 mL para um frasco de amostrador automático de 400 μL. Clique aqui para ver uma versão maior desta figura.
- Descarte os eluatos combinados. Eluir a fração de aflatoxina por gravidade da coluna para um frasco de vidro limpo de 4 mL com 1,2 mL de acetona-acetonitrila-água-88% de mistura de ácido fórmico (65:31:3,5:0,5, v/v) (Figura 4A).
- Em alternativa, eluir as aflatoxinas da coluna com 2,0 ml de mistura de acetonitrila-água-ácido fórmico a 88% (96:3,5:0,5, v/v) e injectar uma alíquota do eluído, até 2 μL, directamente no sistema de cromatografia líquida de ultra-eficiência (UPLC) (sem evaporação do solvente com N2).
NOTA: Neste caso, espere um limite de quantificação até 10 vezes menor para aflatoxinas; Na maioria dos casos, essa queda de sensibilidade é aceitável, uma vez que as concentrações de aflatoxina em sementes desafiadas são frequentemente altas. - Remover o solvente dos frascos para injetáveis numa corrente de N2 num bloco aquecido a 45 °C. Tampe o frasco e coloque-o em um recipiente com gelo picado por 30-45 s para minimizar a evaporação do solvente adicionado na etapa seguinte. Coloque filtros feitos sob medida em tubos de ensaio descartáveis e insira os tubos no gelo em outro recipiente para minimizar a evaporação do solvente após a filtração (Figura 4B, C).
- Após a evaporação do solvente, dissolva o resíduo seco em 0,25-1,0 mL de mistura metanol-água medida com precisão (90:10, v / v) e vórtice por 1-2 s. Coloque frascos com extratos purificados no amostrador automático UPLC e injete 0,1 a 3,0 μL no sistema UPLC (Figura 5A, B).
NOTA: Se houver suspeita de que a solução após o vórtice tenha algumas partículas suspensas, filtre a solução através do filtro resfriado (Figura 4D).
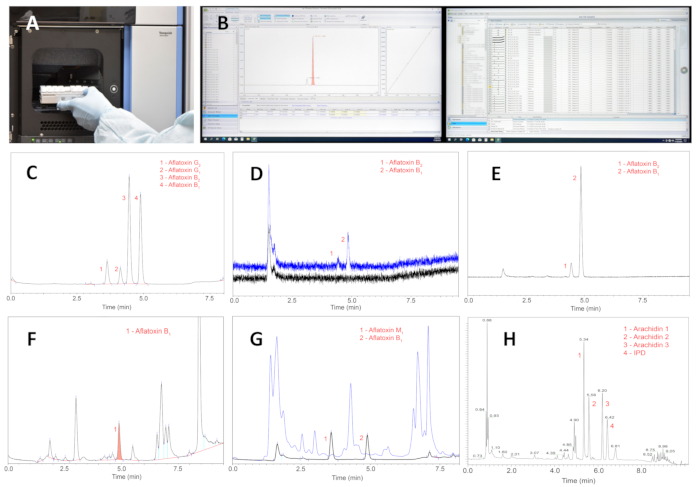
Figura 5: O processo e os resultados das análises UPLC de extratos purificados. (A) Colocação de um rack com extratos de amostras purificados no amostrador automático UPLC. (B) Realizar as análises instrumentais, obter dados e interpretar os resultados. (C) UPLC de quatro aflatoxinas principais; os principais picos de interesse, as aflatoxinas B1 e B2 representam 0,04 e 0,004 ng, respectivamente. (D) UPLC das aflatoxinas B1 e B2; o pico 2 representa a aflatoxina B1 em um nível de 2 pg (com uma célula de fluxo de 8 μL). (E) UPLC de extrato purificado de uma semente colhida de um campo de amendoim local com uma espécie selvagem de Arachis . (F) UPLC do extrato de uma semente de amendoim desafiada purificada com uma minicoluna básica de óxido de alumínio. (G) UPLC do extrato de semente de amendoim desafiada purificada com uma coluna Florisil; cromatograma azul apresenta impurezas que são lavadas da coluna com 1 mL de mistura metanol-água (90:10 v/v); o cromatograma preto mostra picos de aflatoxinas M1 e B1. O nível de aflatoxina B1 é de 48 ng/g. (H) Um cromatograma típico de estilbenóides de amendoim de uma semente desafiada; abreviatura: IPD = 3′-isopentadienil-3,5,4′-trihidroxiestilbeno. Nota: Todos os estilbenóides em extratos de sementes estão em transconfiguração. Clique aqui para ver uma versão maior desta figura.
- Para análises de fitoalexina, de cada frasco de esfera, transfira 200 μL de sobrenadante para o filtro de pipeta Pasteur acima. Use gás N2 de um tanque de nitrogênio comprimido para agilizar a filtração em um frasco de amostrador automático UPLC de 400 μL e tampe o frasco com uma tampa correspondente com um septo de PTFE (Figura 4D).
3. Análises de aflatoxinas
- Para separações de aflatoxinas em extratos de sementes, use um sistema UPLC equipado com um amostrador automático, uma bomba quaternária, um detector fluorescente, uma coluna UPLC BEH C18 de 3,0 mm x 100 mm, coluna de 1,7 μm com uma pré-coluna correspondente e um reator fotoquímico pós-coluna (PHRED) com uma bobina de PTFE tricotada padrão de 0,25 diâmetro interno cortado em 25% de seu comprimento original.
NOTA: O instrumento UPLC e o equipamento associado usado pelos autores estão listados na Tabela de Materiais. - Use água (A), metanol (B) e acetonitrila (C) no seguinte gradiente: condições iniciais, 62,7% A, 24% B, 13,3% C, alterado linearmente para 30% A, 45% B, 25% C em 3,75 min, alterado para 0% A, 64,4% B, 35,6% C em 3,751 min, mantido isocrático por 3,249 min, depois alterado para condições iniciais em 0,01 min e mantido isocrático por 2,499 min antes da próxima injeção. Defina a taxa de fluxo para 0.45 mL/min e o tempo de execução para 9.5 min. Mantenha a coluna a 40 °C no aquecedor de coluna do sistema. Use 362 nm e 440 nm como comprimentos de onda de excitação e emissão, respectivamente, para quantificação de aflatoxinas B1, B2, G1, G2 e M1 . As estruturas das principais aflatoxinas são mostradas na Figura 6A.
NOTA: Nas condições experimentais, espera-se que apenas as aflatoxinas B1 e B2 sejam produzidas por A. flavus NRRL 3357; se uma cepa de A. parasiticus for usada para desafio de sementes, espera-se a produção de aflatoxinas B1, B2, G1 e G2 . - Determine as concentrações de aflatoxinas por referência às áreas de pico dos padrões autênticos correspondentes (curva de calibração), conforme descrito no manual do usuário do software.
NOTA: Como o procedimento UPLC exibe ruído de linha de base nas configurações de alta sensibilidade para o detector fluorescente, o Limite de Detecção (LOD) e o Limite de Quantificação (LOQ) para aflatoxinas são avaliados usando a relação sinal-ruído amplamente aceita de 3:1 para LOD e 10:1 para LOQ. Na configuração experimental de rotina para análise de sementes de amendoim, descrita nas seções 2 e 3, espera-se que os limites de quantificação para as aflatoxinas G1 e B1 sejam menores ou iguais a 0,8 e 0,08 ng/g para as aflatoxinas G2 e B2, respectivamente.
4. Análises de fitoalexina estilbenóide
- Para a separação dos estilbenóides, utilizar água (A), metanol (B) e ácido fórmico a 88% (C) no seguinte gradiente: condições iniciais, 53% A, 42% B, 5% C, alterado linearmente para 35% A, 60% B, 5% C em 2,0 min, mantido isocrático durante 4 min, alterado para 0% A, 95% B, 5% C em 0,5 min, mantido isocrático durante 2,5 min, em seguida, mudou para as condições iniciais em 0,1 min e manteve isocrático por 2,9 min antes da próxima injeção. Defina a taxa de fluxo para 0.5 mL/min e o tempo de execução para 12.0 min.
- Determine as concentrações de estilbenóides por referência às áreas de pico dos padrões autênticos correspondentes (curva de calibração) e/ou aos coeficientes de extinções molares publicados, conforme descrito no manual do usuário do software. As estruturas das principais fitoalexinas derivadas do estilbeno são mostradas na Figura 6B.
NOTA: A separação das fitoalexinas é obtida usando o mesmo sistema, mas sem um detector fluorescente e um reator PHRED. Em vez disso, um detector de matriz de diodos é usado para a detecção e quantificação de estilbenóides de amendoim. O Limite de Quantificação (LOQ) para as principais fitoalexinas estilbenóides não tem um significado prático, pois as concentrações de estilbenóides excedem as concentrações de aflatoxinas no mesmo extrato em algumas ordens de magnitude; Após 3 dias de incubação, os estilbenóides são quantificados de forma confiável.
Representative Results
O método desenvolvido para quantificação de aflatoxinas em sementes é o núcleo de todo o procedimento de avaliação de espécies de amendoim selvagem quanto à resistência ao acúmulo de aflatoxinas. Minicolunas e filtros personalizados proporcionam economias substanciais e simplificam o procedimento geral devido à falta de grandes volumes de solventes, filtros comerciais caros e desnecessários de 0,22 ou 0,45 μm e dispositivos de bombeamento. O método para análises de aflatoxinas fornece altas recuperações, exatidão e precisão dentro da faixa testada de 1,0-50,0 ng/g de aflatoxinas de sementes moídas, conforme visto na Tabela 1. Amostras altamente contaminadas foram diluídas até o valor linear testado. A Figura 5C mostra uma separação basal de quatro aflatoxinas principais, B1, B2, G1 e G2 dentro de 5 minutos de tempo de eluição, o que é aceitável, uma vez que o desafio fúngico das sementes de amendoim é o estágio limitante do procedimento e não as análises de UPLC.
O método proposto é suficientemente sensível, com um limite de quantificação de 2 pg para a aflatoxina B1 (figura 5D). A alta pureza dos extratos permite a quantificação inequívoca de aflatoxinas, como visto em um UPLC (Figura 5E) de extrato purificado de sementes colhidas em um campo com uma espécie selvagem de Arachis . Um método de minicoluna publicado anteriormente29 não é capaz de alcançar pureza satisfatória para sementes de amendoim desafiadas por fungos ( Figura 5F ) em comparação com o método proposto ( Figura 5G ). A partir da Figura 5F , é óbvio que as aflatoxinas B2, G1 e G2 não podem ser detectadas e quantificadas de forma confiável devido à presença de altas concentrações de impurezas interferentes, muitas das quais, eluídas após as aflatoxinas, são fitoalexinas estilbenóides e metabólitos fúngicos. Em contraste, a Figura 5G demonstra a alta eficiência da coluna de sílica gel de magnésio na remoção de impurezas da fração de aflatoxina. O cromatograma azul apresenta impurezas interferentes que são lavadas da coluna com 1 mL de mistura metanol-água (90:10); o cromatograma preto mostra picos não obscurecidos das aflatoxinas M1 e B1. Este cromatograma representa o extrato de uma semente de espécie selvagem desafiada. O nível de aflatoxina B1 é de 48 ng/g.
A quantificação de fitoalexinas de amendoim é uma adição valiosa às análises de aflatoxinas na mesma semente, que pode ser uma semente natural de um campo ou uma semente com fungos. A Figura 5H mostra um cromatograma típico de estilbenóides defensivos de amendoim de uma semente desafiada. A separação dos compostos é obtida usando a mesma coluna analítica usada para análises de aflatoxinas. A coluna e as condições cromatográficas escolhidas proporcionam uma separação satisfatória dos picos, permitindo uma quantificação fiável dos estilbenóides. A avaliação da relação aflatoxina-fitoalexina em sementes desafiadas está fora do escopo desta apresentação e o método é sugerido aqui como uma potencial ferramenta de pesquisa, que tem sido usada no laboratório dos autores há vários anos e provou ser útil.
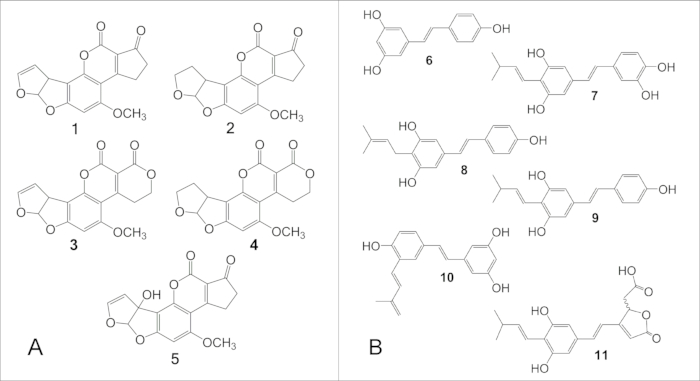
Figura 6: Estruturas das principais aflatoxinas e fitoalexinas de amendoim derivadas do estilbeno. (A) Estruturas das principais aflatoxinas: 1, B1; 2, B2; 3, G1; 4, G2. (B) Estruturas das principais fitoalexinas de amendoim derivadas do estilbeno: 6, resveratrol; 7, araquidina-1; 8, araquidina-2; 9, araquidina-3; 10, IPD (3′-isopentadienil-3,5,4′-trihidroxiestilbeno); 11, SB-1. Clique aqui para ver uma versão maior desta figura.
| Nívelde pico a (ng/g) | Aflatoxinas | |||
| B1 | B2 | G1 | G2 | |
| 50 | 85.87 (0.97) | 82.33 (0.67) | 86.63 (2.89) | 84.01 (0.86) |
| 5 | 91.43 (2.76) | 87.32 (0.47) | 88.08 (2.08) | 87.73 (0.77) |
| 1 | 81.21 (3.16) | 85.33 (1.98) | 81.76 (4.66) | 88.46 (3.24) |
Tabela 1: Recuperação de aflatoxinas de sementes de amendoim usando a coluna Florisil e 1,2 mL da mistura de eluição da fração de aflatoxina. [média (DP), %; n = 5]. Amostras moídas livres de aflatoxina (50 g) da cultivar de amendoim Georgia 06G foram uniformemente enriquecidas com a ajuda de uma microseringa com solução estoque de aflatoxina no nível de 50, 5 ou 1 ng/g e deixadas em temperatura ambiente por 16 h. a Os níveis de pico são dados para as aflatoxinas B1 e G1; para as aflatoxinas B2 e G2 , deve ser utilizado o factor de multiplicação de 0,33.
Discussion
Com base em nossa experiência anterior28, desenvolvemos um procedimento químico simples, barato, ecológico e adequado para a exploração de coleções de germoplasma de Arachis selvagens para identificar espécies resistentes a Aspergillus e determinar e caracterizar novas fontes de resistência genética a esse fungo oportunista. Este método é baseado na purificação do extrato de sementes por uma técnica de extração em fase sólida (SPE) e quantificação de aflatoxinas por cromatografia líquida de ultra eficiência (UPLC) e é caracterizado por recuperação, precisão e exatidão suficientemente altas. O método "Florisil" proposto é uma modificação do procedimento de limpeza de minicoluna única que se baseia na propriedade única do Florisil (gel de sílica de magnésio) de reter forte e seletivamente as aflatoxinas28. Como no método original, as amostras de sementes foram extraídas com a mistura MeOH-H2O, mas em uma proporção diferente de 90:10 (v/v) em comparação com os 80:20 (v/v) publicados. Essa mudança aumentou a taxa de fluxo de solventes através da coluna de limpeza em até 2,5 vezes com a mesma taxa de recuperação de aflatoxina. Esta mistura de metanol-água 90:10 (v/v) proporcionou quase 100% de recuperação dos padrões de aflatoxinas B1, B2, G1 e G2 adicionados ao solvente de extração em níveis de pico equivalentes a 5-50 ng de concentrações de aflatoxina em 1 g de substrato, bem como proporcionou recuperações suficientemente altas das amostras de sementes de amendoim enriquecidas (Tabela 1).
Foi demonstrado que as aflatoxinas podem ser eluídas a partir do adsorvente Florisil apenas com grandes volumes de acetona30, acetona-metanol31,32 e misturas de acetona-água 33,34,35,36. No decorrer da presente pesquisa, descobrimos que a acetonitrila acidificada se comporta de maneira semelhante à acetona em sua capacidade de eluir aflatoxinas de Florisil. Até onde sabemos, essa propriedade da acetonitrila não foi relatada na literatura. A descoberta desta propriedade permite injetar extrato purificado diretamente no sistema UPLC, omitindo a etapa de evaporação do solvente, o que reduz substancialmente o tempo de preparação. Mesmo quando a acetonitrila foi misturada com acetona (acetona-acetonitrila-água-ácido fórmico a 88% (65:31:3.5:0.5, v/v)), ela proporcionou uma remoção suave, completa e rápida da água dos eluatos purificados, reduzindo substancialmente o tempo de evaporação do solvente. A presença de acetonitrila permitiu o uso de uma única mistura de solvente, metanol-água (90:10, v/v) para remover efetivamente as impurezas da coluna Florisil em comparação com um método publicado, onde dois solventes de lavagem adicionais, metanol e mistura de clorofórmio-metanol, foram necessários. 28
Em média, a recuperação padrão da aflatoxina B1 foi de ~ 98% ao usar 1,2 mL para a eluição de aflatoxinas. A quantidade de 50 mg de Florisil foi selecionada de forma que 1,2 mL do solvente de eluição preenchesse a minicoluna até o topo do barril e, ao mesmo tempo, proporcionasse recuperação satisfatória (Tabela 1). Essa abordagem agiliza o procedimento de limpeza, pois o barril da coluna precisa ser preenchido apenas uma vez. Nos estágios iniciais deste projeto, não estava claro se uma fração comercial de Florisil com um tamanho de partícula relativamente grande, 100-200 mesh, seria apropriada para uma pequena coluna contendo apenas uma camada de 3 mm do adsorvente. Portanto, exploramos diferentes frações de Florisil obtidas de um produto comercial de malha 100-200 usando as peneiras de teste padrão dos EUA 120-140, 140-170, 170-200, 200-270, 270-400 e >400 mesh. Todas essas frações forneceram resultados reprodutíveis, quase correspondentes com recuperação satisfatória. Embora frações menores de tamanho de partícula tenham demonstrado bandas de aflatoxina mais estreitas na coluna sob luz UV, essas frações não foram superiores em nenhum aspecto ao produto comercial de malha 100-200. Além disso, a fração de malha 100-200 demonstrou os menores tempos de eluição (8-12 min) para todo o procedimento.
A entrega de solvente de gradiente UPLC permitiu a separação satisfatória de aflatoxinas, bem como a remoção completa de impurezas não polares da coluna (Figura 5G). Essa abordagem levou a uma operação de coluna impecável e resultados reprodutíveis das análises de centenas de amostras. A identidade das aflatoxinas eluídas da coluna Florisil foi confirmada conforme descrito anteriormente. 28 A coluna analítica UPLC de 3 mm de diâmetro usada aqui demonstrou maior seletividade e separação mais confiável das aflatoxinas B1, B2, G1 e G2 em concentrações mais altas em comparação com a coluna de 2,1 mm de diâmetro da mesma química. Além disso, a longevidade da coluna de 3 mm (mais de 1.200 injeções) foi substancialmente maior do que a da coluna de 2,1 mm (até 800 injeções). Embora a coluna de 3 mm exigisse uma taxa mais alta da fase móvel (40% a mais), essa desvantagem foi superada pelas vantagens acima da coluna.
A minicoluna Florisil foi eficaz para a purificação de extratos de sementes de amendoim fortemente contaminadas com metabólitos de Aspergillus (Figura 5G); Essas sementes também continham altos níveis de fitoalexinas estilbenóides que foram produzidas pelas sementes em resposta à invasão fúngica. Todas essas impurezas podem exceder a concentração de aflatoxina nas sementes em até 106 vezes22, o que torna essas sementes objetos desafiadores para análises de aflatoxina. A Figura 5G mostra a falta de picos interferentes no cromatograma dentro dos tempos de retenção de aflatoxinas, o que tornou a detecção e quantificação de aflatoxinas incomprometidas em todos os níveis testados (Tabela 1). Como visto na Tabela 1, a exatidão e a precisão do método foram suficientemente altas dentro da faixa testada de 1,0-50,0 ng / g, que também é a faixa mais crítica para a detecção de aflatoxinas. As recuperações em diferentes níveis para vários genótipos de amendoim selvagem foram uniformes e os desvios-padrão para cinco diferentes extrações foram essencialmente baixos.
O método também foi testado em sementes de amendoim, algodão, milho e arroz naturalmente contaminadas de zero a níveis extremamente altos - acima de 10.000 ng/g de aflatoxinas totais. A recuperação de aflatoxinas B1, B2, G1 e G2 do milho, caroço de algodão e arroz na dose de 5 ng/g variou de 76,1% a 93,7%, 77,1% a 86,6% e 90,5% a 96,2%, respectivamente. A maior recuperação de aflatoxinas do arroz foi acompanhada pela "pureza" do eluente, ou seja, praticamente a ausência de quaisquer impurezas. Além disso, o arroz representou o menor objeto único testado, em média, 19 mg / semente.
O tempo total de preparação de uma única semente de amendoim (incluindo descasque, pesagem, extração, centrifugação e purificação) usando uma coluna Florisil não excedeu 20 min. O custo da minicoluna Florisil é >10 vezes menor do que o das colunas de limpeza comercial. Economias adicionais derivam do uso de volumes menores de adsorventes, solventes e gás nitrogênio em comparação com o procedimento publicado28. A minicoluna não requer dispositivos de bombeamento ou vácuo para operar e tem uma vida útil indefinida.
Explorar o germoplasma de plantas quanto à resistência às aflatoxinas é excepcionalmente difícil porque o acúmulo de micotoxinas não segue uma distribuição normal37,38; Um grande número de análises de aflatoxinas em sementes individuais é necessário para superar esse fenômeno. Além do teor de aflatoxina, as informações sobre a composição quantitativa das fitoalexinas são altamente valiosas à luz de um grande conjunto de informações que podem ser obtidas de uma única semente (Figura 1A) e rastreadas para uma planta específica (Figura 1E). O método tem sido usado com sucesso para rastrear centenas de acessos, incluindo variedades locais, linhas de reprodução avançadas e variedades de amendoim de elite. O método é sugerido para uso em programas de pesquisa de pré-reprodução e melhoramento de amendoim e pode ajudar na caracterização de genes de amendoim para resistência a fungos.
Disclosures
Os autores não têm conflitos de interesse a divulgar.
Acknowledgements
Este trabalho recebeu o apoio financeiro do projeto USDA-ARS CRIS 6044-42000-011-00D e do projeto CRIS 6044-21000-005-000-D. Agradecemos a Dan Todd por fazer o rack de suporte de minicoluna. A menção de nomes comerciais ou produtos comerciais neste artigo é exclusivamente para fins de fornecer informações específicas e não implica recomendação ou endosso do Departamento de Agricultura dos EUA.
Materials
| Name | Company | Catalog Number | Comments |
| Acetone, Optima | Fisher Scientific | A929-4 | |
| Acetonitrile, Optima | Fisher Scientific | A996-4 | |
| Acquity BEH C18 2.1 x 5mm Van-Guard pre-column | Waters Corporation | 186003975 | |
| Acquity BEH C18 3 x 100mm column | Waters Corporation | 186004661 | |
| Acquity BEH C18 2.1 x 100mm column | Waters Corporation | 186002352 | |
| Aflatoxins B1, B2, G1, and G2 | Sigma-Aldrich | A9441-1VL | Dissolve the contents of the commercial vial in 5 mL of methanol to obtain 5 µg/mL for aflatoxins B1 and G1 and 1.5 µg/mL for B2 and G2 |
| Aflatoxin B1 (1mg) | Sigma-Aldrich | A6636-1MG | |
| Aflatoxin B2 (1mg) | Sigma-Aldrich | A9887-1MG | |
| Aflatoxin G1 (1mg) | Sigma-Aldrich | A0138-1MG | |
| Aflatoxin G2 (1mg) | Sigma-Aldrich | A0263-1MG | |
| Aflatoxin M1 (10 µg) | Sigma-Aldrich | CRM46319 | |
| Agar, Granulated (2kg) | Becton Dickinson | BD214510 | |
| Alumina oxide basic (60-325 mesh) | Fisher Scientific | A941-500 | |
| Basal medium | Murashige and Skoog | M5519 | |
| Bead Ruptor 24 | Omni International | 19-042E | |
| Beaker (1000mL) | Corning (Pyrex) | 10001L | |
| Beaker (250mL) | Corning (Pyrex) | 1000250 | |
| Beaker (400mL) | Corning (Pyrex) | 1000400 | |
| Beaker (600mL) | Corning (Pyrex) | 1000600 | |
| Blade, scalpel | Feather | #10 | |
| Centrifuge (LSE Compact) | Corning | Model: 6755 | |
| Centrifuge, micro | Corning | Model: 6770 | |
| Ceramic beads (2.8 mm) | Omni International | 19-646 | |
| Ceramic beads (6.5 mm) | Omni International | 19-682 | |
| Chromeleon 7 series Software | Thermo Scientific | ||
| Drill bit | Kyocera | 07896 | 1.6 mm |
| Drill bit | Kyocera | 07357 | 2.0 mm |
| Drill bit | Kyocera | 07985 | 2.34 mm |
| Ethanol (200 proof) | Decon Labs | 2805M | |
| Evaporator, nitrogen | organimation | 11106 | 6-position |
| Excel, Microsoft | Microsoft | Office 365 | |
| Filter paper (#4) | Cytiva Whatman | 1004-090 | |
| Filter paper cutter, stainless steel (ID 11.5mm) | Unknown | ||
| Filter paper, glass fibre | Cytiva Whatman | 934-AH | |
| Flask (2800mL) | Corning (Pyrex) | 44202XL | |
| Florisil (100-200 mesh) | Fisher Scientific | F101-500 | |
| Forceps | Integra Lifescience (Miltex) | PM-0300 | |
| Formic acid (88%, ACS) | Fisher Scientific | A118P-500 | |
| Freezer (-80oC) | Fisher Scientific | TSX70086D | |
| Funnel (15 x 80mm) | DWK Life Sciences (Kimax) | 2902060 | |
| Gelzan (medium) | Caisson Labs | G024 | |
| Glass rod (custom) | Custom made | ||
| Glass wool | Corning (Pyrex) | 3950 | |
| Handle, scalpel | Feather | #7 | |
| Hemocytometer | Hausser Scientific | 3100 | |
| Hydrogen peroxide | Fisher Scientific | H325-4 | 30%, Certified ACS |
| Ice bucket, round with lid | Corning | 432122 | |
| Incubator | Percival | 136VL | |
| Kimtech SCIENCE Brand Kimwipes | Kimtech | 34120 | 8.2" x 4.39" |
| Kimtech SCIENCE Brand Kimwipes | Kimtech | 34256 | 16.4" x 14.43" |
| Lab coat | Cenmed | B113660SBXL | |
| Methanol, Optima | Fisher Scientific | A454-4 | |
| Mini column rack (custom) | Custom made | ||
| Mixer, touch (maxi mix II) | Thermolyne | 37600 (model 231) | |
| Nitrile gloves | Microflex | XC310M | |
| Nitrogen gas, compressed (ultra high purity) | Jones Welding | ||
| Paper towel | Georgia-Pacific | 20023 (D400) | |
| pH meter | Fisher Scientific (Accumet) | 13-636-AB15 | |
| pH/ATC electrode | Fisher Scientific (Accumet) | 13-620-111 | |
| PhCR Photochemical Reactor | Waters (Vicam) | 600001222 | |
| Pipette, pasteur | Fisher Scientific | 13-678-20D | 9" |
| Pipettor (1 mL) (Reference 2) | Eppendorf | 4924000088 | |
| Pipettor (10 μL) (Reference) | Eppendorf | 022470051D | |
| Pipette tips: 10 μL, 200 μL, 1 mL | Eppendorf | F144054M | |
| Pipettor (200 µL)(Ergofit) | Fisher Scientific | 12-146-679 | |
| Plates, petri (100x15mm) | Fisher Scientific | FB0875713 | |
| Potato Dextrose Agar (500g) | Becton Dickinson | BD213400 | |
| Reinforced bead tube (2 mL) | Omni International | 19-660 | |
| Reinforced bead tube (7 mL) | Omni International | 19-651 | |
| Repipettor, Dispensette III (10mL) | Brandtech | 4701141 | |
| Resveratrol | Sigma-Aldrich | R5010-100MG | |
| Scoop (custom) | Custom made | ||
| screwcap jar (250 mL) | Corning (Pyrex) | 1395250 | |
| Silica gel, spherical (200-400 mesh) | Supelco | 97727-U | 100 g |
| Sodium Hydroxide | Fisher Scientific | S318-500 | |
| SPE extract clean 1.5-mL polypropylene column | American Chromotography Supplies | SP-5122382 | |
| SPE extract clean PP frits (for 1.5 mL minicolumn) | American Chromotography Supplies | SP-3119414 | |
| Spectrophotometer, UV-visible | Fisher Scientific | 14-385-351 (Genesys 50) | |
| Test tube | Corning (Pyrex) | 982516X | 16x125mm |
| Test tube (Disposable)(16x125mm) | Fisher Scientific | 14-961-31 | |
| Test tube (Disposable)(150x250mm) | Fisher Scientific | 14-961-34 | |
| Thermo Vanquish DAD detector (UPLC) | Thermo Scientific | VF-D11-A-01 | |
| Thermo Vanquish Fluourescense detector (UPLC) | Thermo Scientific | VF-D51-A | |
| Thermo Vanquish quaternary pump F (UPLC) | Thermo Scientific | VF-P20-A | |
| Thermo Vanquish Split Sampler FT (UPLC) | Thermo Scientific | VF-A10-A-02 | |
| Tween 20 (polysorbate 20) (enzyme grade) | Fisher Scientific | BP337-500 | |
| Vial caps (4mL) | Fisher Scientific | C4015-75A | |
| Vial caps (autosampler) | Fisher Scientific | C4010-60A | |
| Vials & caps (16 mL) | Thermo Scientific | B7800-4 | |
| Vials, glass (4mL) | Fisher Scientific | C4015-1 | |
| Vials, polypropylene (autosampler) (400mL) | Fisher Scientific | C4010-11 | |
| Water, Optima | Fisher Scientific | W6-4 |
References
- Janila, P., et al. Molecular breeding for introgression of fatty acid desaturase mutant alleles (ahFAD2A and ahFAD2B) enhances oil quality in high and low oil containing peanut genotypes. Plant Sci. 242, 203-213 (2016).
- Rasooly, R., Hernlem, B., He, X., Friedman, M. Non-linear relationships between aflatoxin B1 levels and the biological response of monkey kidney vero cells. Toxins (Basel). 5 (8), 1447-1461 (2013).
- American Association for Cancer Research: AACR. An evaluation of chemicals and industrial processes associated with cancer in humans based on human and animal data: IARC Monographs Volumes 1 to 20. Cancer Res. 40 (1), 1-12 (1980).
- Turner, P. C. The molecular epidemiology of chronic aflatoxin driven impaired child growth. Scientifica. , 21 (2013).
- Williams, J. H., et al. Human aflatoxicosis in developing countries: a review of toxicology, exposure, potential health consequences, and interventions. Am. J. Clin. Nutr. 80 (5), 1106-1122 (2004).
- van Egmond, H. P., Jonker, M. A., Abbas, H. K. Worldwide regulations on aflatoxins. Aflatoxinandfood safety. , 77-93 (2005).
- European Commission. Commission Regulation (EC) 1525/98. Off. J. Eur. Comm. L. 201, 43-46 (1998).
- Bressano, M., et al. Introgression of peanut smut resistance from landraces to elite peanut cultivars (Arachis hypogaea L). PLoS ONE. 14 (2), e0211920 (2019).
- de Blas, F. J., et al. Identification of smut resistance in wild Arachis species and its introgression into peanut elite lines. Crop Sci. 59 (4), 1657-1665 (2019).
- Mallikarjuna, N., Pande, S., Jadhav, D. R., Sastri, D. C., Rao, J. N. Introgression of disease resistance genes from Arachis kempff-mercadoi into cultivated groundnut. Plant Breeding. 123 (6), 573-576 (2004).
- Moretzsohn, M. C., et al. Genetic diversity of peanut (Arachis hypogaea L.) and its wild relatives based on the analysis of hypervariable regions of the genome. BMC Plant Biol. 4, 1-10 (2004).
- Arias, R. S., et al. New tools to screen wild peanut species for aflatoxin accumulation and genetic fingerprinting. BMC Plant Biol. 18 (1), 170 (2018).
- Dorner, J. W., Cole, R. J., Sanders, T. H., Blankenship, P. D. Interrelationship of kernel water activity, soil temperature, maturity, and phytoalexin production in preharvest aflatoxin contamination of drought-stressed peanuts. Mycopathologia. 105 (2), 117-128 (1989).
- Paxton, J. D., Sharma, R. P., Salunkhe, D. K. Biosynthesis and accumulation of legume phytoalexins. Mycotoxins and phytoalexins. , 485-499 (1991).
- Cole, R. J., Dorner, J. W., Sharma, R. P., Salunkhe, D. K. Peanut phytoalexins. Mycotoxins and phytoalexins. , 501-509 (1991).
- Subba Rao, P. V., Strange, R. N., Daniel, M., Purkayastha, R. P. Chemistry, biology, and role of groundnut phytoalexins in resistance to fungal attack. Handbook of phytoalexin metabolism and action. , 199-227 (1995).
- Sobolev, V. S., Guo, B. Z., Holbrook, C. C., Lynch, R. E. Interrelationship of phytoalexin production and disease resistance in selected peanut genotypes. J. Agric. Food. Chem. 55 (6), 2195-2200 (2007).
- Paxton, J. Phytoalexins: a working redefinition. J. Phytopathol. 101, 106-109 (1981).
- Mansfield, J. W., Bailey, J. A., Mansfield, J. W. The role of phytoalexins in disease resistance. Phytoalexins. , 153-288 (1982).
- Strange, R. N., Ayers, P. G. Resistance: the role of the hypersensitive response and phytoalexins. Plant response to foliar pathogens. , 39-56 (1992).
- Sobolev, V. S., et al. Biological activity of peanut (Arachis hypogaea) phytoalexins and selected natural and synthetic stilbenoids. J. Agric. Food Chem. 59 (5), 1673-1682 (2011).
- Sobolev, V. S. Localized production of phytoalexins by peanut (Arachis hypogaea) kernels in response to invasion by Aspergillus Species. J. Agric. Food Chem. 56 (6), 1949-1954 (2008).
- Sobolev, V. S., Neff, S. A., Gloer, J. B. New stilbenoids from peanut (Arachis hypogaea) seeds challenged by an Aspergillus caelatus strain. J. Agric. Food Chem. 57 (1), 62-68 (2009).
- Trucksess, M. W., et al. Immunoaffinity column coupled with solution fluorometry or liquid chromatography postcolumn derivatization for determination of aflatoxins in corn, peanuts, and peanut butter: collaborative study. J. AOAC Int. 74 (1), 81-88 (1991).
- Dorner, J. W., Blankenship, P. D., Cole, R. J. Performance of two immunochemical assays in the analysis of peanuts for aflatoxin at 37 field laboratories. J. AOAC Int. 76 (3), 637-643 (1993).
- Stroka, J., Anklam, E. Immunoaffinity column cleanup with liquid chromatography using post-column bromination for determination of aflatoxins in peanut butter, pistachio paste, fig paste, and paprika powder: collaborative study. J. AOAC Int. 83 (2), 320-340 (2000).
- Pal, A., Acharya, D., Saha, D., Roy, D., Dhar, T. K. In situ sample cleanup during immunoassay: a simple method for rapid detection of aflatoxin B1 in food samples. J. Food Prot. 68 (10), 2169-2177 (2005).
- Sobolev, V. S. Simple, rapid, and inexpensive cleanup method for quantitation of aflatoxins in important agricultural products by HPLC. J. Agric. Food Chem. 55 (6), 2136-2141 (2007).
- Sobolev, V. S., Dorner, J. W. Cleanup procedure for determination of aflatoxins in major agricultural commodities by liquid chromatography. J. AOAC Int. 85 (3), 642-645 (2002).
- Levi, C. P., Borker, E. Survey of green coffee for potential aflatoxin contamination. J. AOAC. 51 (3), 600-602 (1968).
- Levi, C. P. Collaborative study on a method for detection of aflatoxins B1 in green coffee beans. J. AOAC. 52 (6), 1300-1303 (1969).
- Scott, P. M. Note on analysis of aflatoxins in green coffee. J. AOAC. 51, 609 (1968).
- Bicking, M. K. L., Kniseley, R. N., Svec, H. J. Coupled-column system for quantitating low levels of aflatoxins. J. AOAC. 66 (4), 905-908 (1983).
- Kamimura, H., et al. Simple, rapid cleanup method for analysis of aflatoxins and comparison with various methods. J. AOAC. 68 (3), 458-461 (1985).
- Hoogenboom, L. A., et al. Genotoxicity testing of extracts from aflatoxin-contaminated peanut meal, following chemical decontamination. Food Addit. Contam. 18 (4), 329-341 (2001).
- Castro, L., Vargas, E. A. Determining aflatoxins B1, B2, G1 and G2 in maize using Florisil clean up with thin layer chromatography and visual and densitometric Quantitation. Cienc. Tecnol. Ailment. Campinas. 21, 115-122 (2001).
- Arias, R. S., Dang, P. M., Sobolev, V. S. RNAi-mediated Control of Aflatoxins in Peanut: Method to Analyze Mycotoxin Production and Transgene Expression in the Peanut/Aspergillus Pathosystem. J. Vis. Exp. (106), e53398 (2015).
- Whitaker, T. B., Dorner, J. W., Giesbrecht, F. G., Slate, A. B. Variability among aflatoxin test results on runner peanuts harvested from small field plots. Peanut Sci. 31 (1), 59-63 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved