Неразрушающее количественное определение афлатоксинов и стильбеноидных фитоалексинов в одном арахисе (Arachis spp.) на основе SPE-UPLC Семена
In This Article
Summary
Мы демонстрируем среднепроизводительный метод количественного определения афлатоксинов и стильбеноидных фитоалексинов в одиночных семенах арахиса с использованием ультраэффективной жидкостной хроматографии. Этот метод был специально разработан для анализа диких видов арахисов , которым угрожает афлатоксигенный вид Aspergillus .
Abstract
Афлатоксины являются высококанцерогенными вторичными метаболитами некоторых видов грибов, в частности Aspergillus flavus. Афлатоксины часто загрязняют экономически важные сельскохозяйственные товары, включая арахис, представляя высокий риск для здоровья человека и животных. Из-за узкой генетической базы сорта арахиса демонстрируют ограниченную устойчивость к грибковым патогенам. Таким образом, многочисленные виды дикого арахиса с устойчивостью к аспергилляциям получили значительное внимание ученых в качестве источников устойчивости к болезням.
Изучение устойчивости зародышевой плазмы растений к афлатоксинам затруднено, поскольку накопление афлатоксина не имеет нормального распределения, что диктует необходимость анализа тысяч отдельных семян арахиса. Достаточно увлажненные семена арахиса (Arachis spp.) при заражении видами Aspergillus способны продуцировать биологически активные стильбены (стильбеноиды), которые считаются защитными фитоалексинами. Стильбены арахиса подавляют развитие грибков и выработку афлатоксина. Поэтому крайне важно проанализировать те же семена на стильбеноиды арахиса, чтобы объяснить природу устойчивости/восприимчивости семян к инвазии аспергилл. Ни один из опубликованных методов не предлагает анализ на афлатоксины и/или фитоалексины стильбена.
Мы постарались удовлетворить спрос на такой метод, который был бы экологически чистым, использовал недорогие расходные материалы, был бы чувствительным и избирательным. Кроме того, этот метод является неразрушающим, поскольку он использует только половину семени, а другую половину, содержащую эмбриональную ось, оставляет нетронутой. Такой метод позволяет проращивать и выращивать растение арахиса до полной зрелости из тех же семян, которые использовались для анализа афлатоксина и стильбеноидов. Неотъемлемая часть этого метода, ручная протравливание семян с помощью Aspergillus, является ограничивающим этапом, который требует больше времени и труда по сравнению с другими этапами метода. Этот метод был использован для исследования зародышевой плазмы дикого арахиса с целью идентификации видов, устойчивых к Aspergillus , а также для определения и характеристики новых источников генетической устойчивости к этому грибковому патогену.
Introduction
Арахис (Arachis hypogaea L.) является одной из основных продовольственных культур в мире. Его культивируют более чем в 100 странах мира с общим объемом производства более 45 миллионовтонн1. Сельскохозяйственные товары, такие как арахис, кукуруза и семена хлопчатника, часто подвергаются вторжению видов Aspergillus, почвенных грибов, которые продуцируют афлатоксины2. Эти товары особенно восприимчивы к загрязнению афлатоксином перед сбором урожая, когда условия окружающей среды характеризуются высокими температурами и засухой. Афлатоксины относятся к числу самых мощных канцерогенов из известных3. Они загрязняют четверть сельскохозяйственной продукциив мире4, в результате чего около половины населения мира хронически подвергается воздействию афлатоксинов5. Из-за их высокой канцерогенности и токсичности присутствие афлатоксинов в продуктах питания регулируется на минимально практически допустимых уровнях в большинстве стран мира6.
Европейский союз (ЕС) законодательно установил максимальный уровень афлатоксинаВ1 в 2 нг/г и 4 нг/г общего содержания афлатоксинов (В1,В2, G1 и G2) в продуктах для потребления человеком7. Такие низкие лимиты оказывают существенное давление на сельское хозяйство и пищевую промышленность, которые перерабатывают товары, загрязненные афлатоксинами. Мониторинг афлатоксина и переработка зараженного арахиса можно рассматривать как пассивную и дорогостоящую стратегию предотвращения попадания афлатоксинов в пищевую цепь. Именно поэтому все основные сегменты арахисовой промышленности испытывают огромные потери прибыли из-за загрязнения афлатоксинами современных сортов арахиса, которые часто демонстрируют ограниченную устойчивость к грибковым заболеваниям. Перспективным подходом к решению проблемы афлатоксина является получение устойчивых к грибку сортов арахиса путем генной интрогрессии, то есть передачи генетической информации от устойчивых диких видов арахиса к элитным сортам. В последние годы 8,9 дикие виды арахиса стали широко рассматриваться в качестве источников генетической устойчивости к болезням, поскольку узкая генетическая база культивируемого арахиса больше не может обеспечить необходимый уровень устойчивости к растению арахиса10,11. Успешная интрогрессия диких видов арахиса требует анализа тысяч отдельных мелких и редких семян (Рисунок 1А) 12.
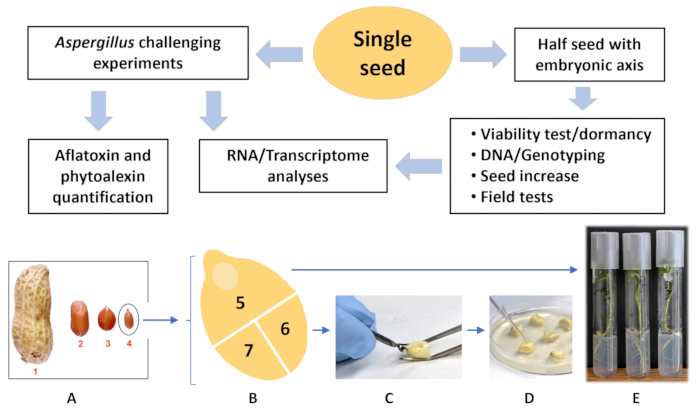
Рисунок 1: Блок-схема анализа одного семени. (A) Сравнительный размер различных сортов арахиса рыночного типа по сравнению с диким Arachis spp. (1) Вирджиния; (2) бегунок; (3) Испанский; (4) дикий Arachis spp. (B) дикий Arachis spp. (пластина А, семя 4) разрезанный на три части, (5) полусеменной с зародышевой осью; эта часть семян используется для выращивания растения (E). (C) Детали (6) и (7) просверливаются сверлом и (D) инокулируются спорами грибов. После инкубации в течение 72 часов при 30 °C одну из частей семени, (6) или (7), используют для анализа афлатоксина и фитоалексина, а другую используют для секвенирования РНК/транскриптома. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Устойчивость арахиса к грибковым патогенам тесно связана с фитоалексинами 13,14,15,16,17. Фитоалексины арахиса представлены антимикробными стильбеноидами, которые биосинтезируются и накапливаются в тканях растений после воздействия экзогенных раздражителей, в частности, грибковой инвазии 16,17,18. Быстрое накопление достаточных концентраций фитоалексинов в месте грибковой инвазии ингибирует рост грибов и имеет решающее значение для защиты растений 19,20,21. Возбудитель прекращает рост при накоплении фитоалексинов до ингибирующих концентраций16,22. Роль стильбеноидов в качестве защитных соединений против афлатоксигенных грибов арахиса была оценена более 30 лет назад в полевых экспериментах13. Эти эксперименты ясно подтвердили гипотезу о том, что стильбеноиды арахиса являются решающим фактором устойчивости к загрязнению афлатоксином перед сбором урожая. Такие доказательства основаны на фактах того, что стильбены естественным образом образуются в поврежденном полями арахисе; стильбены проявляют заметную биологическую активность в отношении афлатококсигенных грибов; А загрязнение афлатоксинами семян было обнаружено только тогда, когда арахис потерял способность к синтезу фитоалексина из-за обезвоживания семян, вызванного засухой. Еще одна серия полевых экспериментов подтвердила связь между продукцией фитоалексина и устойчивостью генотипа арахиса к сельскохозяйственным заболеваниям арахиса17.
Лучшее понимание основанного на фитоалексине механизма устойчивости арахиса к грибковой инвазии является перспективной стратегией для борьбы с загрязнением афлатоксином 15,17.Поэтому, помимо анализов на афлатоксины, важно количественно проанализировать те же семена на фитоалексины. Хотя этот механизм устойчивости до конца не изучен и понят, тем не менее, он имеет решающее значение для селекции и генетической модификации растений арахиса для новых сортов, устойчивых к грибкам. Несмотря на существование различных аналитических процедур для определения афлатоксина в различных товарах, все еще существует потребность в простых методах для конкретных исследований, особенно в тех случаях, когда традиционные методы не удовлетворяют аналитическим и экономически эффективным требованиям. Наиболее современными методами очистки, используемыми в арахисовой промышленности, сельском хозяйстве и частных лабораториях, являются устройства на основе антител24 и иммуноферментные анализы 25,26,27. Они селективны и чувствительны, но значительно дороже миниколонок, наполненных обычными адсорбентами. Кроме того, ни один из этих методов не был разработан для анализа образцов весом в несколько миллиграммов. Основываясь на наших предыдущих исследованиях по аналитическому использованию миниколонок28, упакованных в силикагель магния (Флорисил), мы модифицировали эту процедуру в соответствии с потребностями текущих и перспективных программ предварительного разведения и разведения.
Целью данной работы явилась разработка неразрушающего, среднепроизводительного, экологически чистого метода количественного определения афлатоксинов и фитоалексинов в отдельных семенах арахиса. Такой метод уже разработан. Его преимущества перед опубликованными методами заключаются в более высокой чувствительности, возможности анализа афлатоксинов и фитоалексинов в экстракте одного семени, отсутствии необходимости взвешивать образцы и более низкой стоимости благодаря меньшим объемам расходных материалов. Блок-схема интегрированного метода представлена на рисунке 1. Генетический анализ и другие этапы упоминаются в этом тексте и показаны на рисунке, чтобы показать важность предлагаемого метода и то, как он интегрирован со всей процедурой.
Protocol
1. Подготовка семян к грибковому вызову
- Инкубировать афлатококсигенный Aspergillus flavus NRRL 3357 на наклонной основе агара с картофельной декстрозой (PDA) в пробирке в течение 6 дней при температуре 30 °C. Соберите споры грибов из пробирки с 10 мл воды с Tween 20 (100 μл Tween на 1 л дистиллированной стерильной воды), профильтруйте через стекловату, помещенную в воронку, и подсчитайте споры гемоцитометром, ссылаясь на инструкцию пользователя.
- Разбавьте споровую суспензию стерильной водой до концентрации 1000 спор/мкл. Подтвердите концентрацию с помощью гемоцитометра.
ПРИМЕЧАНИЕ: Приготовьте споровую суспензию не ранее, чем за 2 ч до сложных экспериментов. - Аккуратно разбейте стручки арахиса и удалите шелуху. Поместите семена в стерильный стакан так, чтобы объем семян не превышал 1/5 объема стакана, добавьте 0,05% раствор перекиси водорода примерно на 70% объема стакана и дайте семенам впитать воду в течение 3 часов.
- Сцедите раствор перекиси водорода из семян и добавьте примерно в 3 раза больше 80% смеси этанола и воды (v/v) в стакан, чтобы покрыть семена. Дайте постоять 1 минуту, а затем промойте семена 2 раза равными объемами стерильной дистиллированной воды.
- Добавьте в стакан с этанолом 5-кратный объем 3% перекиси водорода и дайте постоять 5 минут, затем сцедите жидкость и дважды промойте семена равными объемами стерильной воды (рис. 2А).
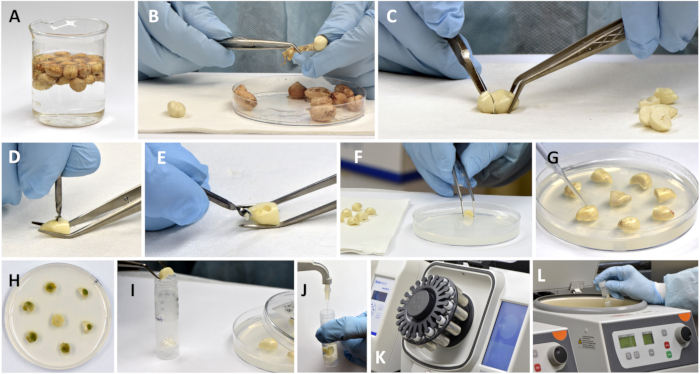
Рисунок 2: Подготовка семян арахиса к инокуляции, инкубации и экстракции фракций афлатоксина и фитоалексина. (А) Стерилизация пропитанных семян 3% перекисью водорода; (В) удаление семен (кожицы) из семян; (В) отрезание части оси эмбриона; (D,E) полость сверления в полусемядоле с помощью сверла; (Е) размещение просверленных частей семян на агаре; (G) введение спор грибка в просверленную полость. (H) чашка Петри с семенами после инкубации; (I) помещение инкубированных одиночных семян (фото контрольных образцов) в армированные бусинные трубки; (J) добавление измеренного объема экстрагирующего растворителя; (К) измельчение образцов в разрыве швов; (L) центрифугирование пылевидной суспензии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Поместите семена на стерильное бумажное полотенце, удалите семенные семена щипцами и отрежьте скальпелем около 1/3 семени, содержащего эмбриональную ось (рис. 2B, C).
- Выбросьте эту часть семени или используйте ее для выращивания растения в пробирке со средой для выращивания (рисунок 1B, E).
- Разделите оставшуюся часть посевного материала на две семядоли, поместите их в чашку Петри, накройте семенные части влажной стерильной фильтровальной бумагой, закройте крышкой во избежание обезвоживания и сразу приступайте к этапу инокуляции.
- Перед проведением сложных экспериментов приготовьте достаточное количество чашек Петри с инкубационной средой для семян, насыпав 26 мл 1,5% стерильного агара в воду в чашки размером 100 x 15 мм и дайте им застыть в течение ночи.
- В середине наружной стороны каждой оставшейся семядоли сделайте полость глубиной 1,5-2 мм, вручную просверлив посевной материал стерильным острым сверлом диаметром 1,6-2,34 мм. Для создания полости требуется ~2-5 секунд (рисунок 2D,E).
- Поместите от 4 до 6 «просверленных» кусочков семян в чашку Петри с агаром и нанесите 2 мкл суспензии 1000 спор/мкл в просверленную полость каждого полусемядолевого кусочка с помощью пипеттера объемом 10 мкл. Вместо споровой суспензии нанесите на контрольные семена стерильную воду (рис. 2F, G).
- Накройте все чашки Петри крышками и выдерживайте при температуре 30 °C без света в течение 72 часов.
2. Отбор проб и подготовка инкубированных семенных кусочков для анализа на афлатоксин и фитоалексин
- Соберите кусочки семян через 72 ч, вынув их из агара с помощью щипцов и поместив каждый из них в промаркированные флаконы объемом 7 мл с 13 циркониевыми керамическими шариками (12 диаметром 2,8 мм и 1 диаметром 6,5 мм) (рис. 2H, I).
ПРИМЕЧАНИЕ: На этом этапе, если флаконы не обрабатываются немедленно, их можно поместить в морозильную камеру при температуре -80 °C и хранить до 2 месяцев перед дальнейшей обработкой. - В этом же экстракте семян определяются фитоалексины и афлатоксины. Для экстракции, в зависимости от визуального размера семян (маленькие, средние или крупные), добавьте 2 или 4 мл точно отмеренной смеси метанола и воды (90:10, v/v) в флаконы с шариками и измельчите со скоростью 5,5 м/сек в течение 45 с. Поместите флаконы с измельченными семенами в центрифугу и центрифугируйте при давлении 1 860 × г в течение 3 минут (рис. 2J - L).
Примечание: Определены следующиеважные производные 17,22 стильбеноидов (все в трансконфигурации): ресвератрол, арахидин-1, арахидин-2, арахидин-3, 3'-изопентадиенил-3,5,4'-тригидроксистильбен (IPD) и SB-1. - Для анализа афлатоксинов, прежде чем проводить сложные эксперименты, подготовьте достаточное количество столбцов для очистки следующим образом. Поместите соответствующую полиэтиленовую пористую (20 мкл) фритту в полипропиленовую колонну объемом 1,5 мл с помощью стеклянного стержня, разрезанного под углом 90° . Поместите 50 мг силикагеля магния (100-200 меш) в колонку с помощью специально изготовленного совка и закройте колонку идентичной фриттой, надавливая на нее стеклянным стержнем (рисунок 3A - E).
ПРИМЕЧАНИЕ: Это количество силикагеля магния занимает объем 75 μл, а высота слоя адсорбента составляет 3 мм.

Рисунок 3: Подготовка очистных колонок и фильтров. (A,B) Помещение пористой фритты в бочку; (C,D) наполнение бочки магниевым силикагелем; (E) Упаковка адсорбента и вставка верхней пористой фритты в цилиндр. (F) Поместите круг из стекловолокна диаметром 11,5 мм на вершину пипетки Пастера. (Г,Н) Продавливаем центр круга пластиковым или деревянным стержнем вниз на дно бочки пипетки Пастера и плотно уплотняем стекловолокно. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- На этом этапе подготовьте соответствующее количество пользовательских фильтров, как показано на рисунке 3F - H.
- Для анализа афлатоксина необходимо точно измерить до 0,5 мл аликвоты надосадочной жидкости (полученной, как описано на шаге 2.2), переложить ее в специально упакованную миниколонку и дать экстракту стечь под действием силы тяжести в стеклянный флакон объемом 4 мл. Перенесите 1,0 мл смеси метанол и вода (90:10, v/v) в колонну для вымывания примесей под действием силы тяжести в тот же флакон объемом 4 мл (рис. 4A).

Рисунок 4: Очистка экстрактов семян и подготовка к анализам UPLC. (А) Стеллаж с насадочными колоннами. (В) Испарительный растворитель с газом N2 из шести флаконов объемом 4 мл с очищенным экстрактом, элюированным из очистных колонок. (В) Доведение флаконов и фильтров до минусовой температуры в емкостях из пенопласта (1 и 2) со льдом до и после добавления растворителя для инъекций (MeOH-H2O 9:1, v/v) в флаконы объемом 4 мл. (D) Фильтрация охлажденного экстракта из флакона объемом 4 мл в флакон автосэмплера объемом 400 мкл. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Выбросьте комбинированные элюаты. Разбавьте фракцию афлатоксина под действием силы тяжести из колонки в чистом стеклянном флаконе объемом 4 мл со смесью 1,2 мл ацетона-ацетонитрила-воды-88% муравьиной кислоты (65:31:3,5:0,5, v/v) (рис. 4A).
- В качестве альтернативы можно вымыть афлатоксины из колонки с 2,0 мл смеси ацетонитрил-вода-88% муравьиной кислоты (96:3,5:0,5, v/v) и ввести аликвоту элюата, до 2 μл, непосредственно в систему ультраэффективной жидкостной хроматографии (UPLC) (без испарения растворителя сN2).
ПРИМЕЧАНИЕ: В этом случае ожидайте до 10-кратного снижения предела количественного определения афлатоксинов; В большинстве случаев такое снижение чувствительности приемлемо, так как концентрации афлатоксина в пораженных семенах часто высоки. - Удалить растворитель из флаконов струей N2 в нагретом блоке при 45 °С. Закройте флакон крышкой и поместите его в емкость с колотым льдом на 30-45 с, чтобы свести к минимуму испарение растворителя, который добавляется на следующем этапе. Поместите изготовленные на заказ фильтры в одноразовые пробирки и вставьте пробирки в лед в другом контейнере, чтобы свести к минимуму испарение растворителя при фильтрации (рис. 4B, C).
- После испарения растворителя сухой остаток растворить в точно отмеренных 0,25-1,0 мл смеси метанола и воды (90:10, v/v) и сделать вихрем в течение 1-2 с. Поместите флаконы с очищенными экстрактами в автоподатчик UPLC и введите от 0,1 до 3,0 мкл в систему UPLC (рис. 5A, B).
ПРИМЕЧАНИЕ: Если есть подозрение, что в растворе после вортексирования есть взвешенные частицы, отфильтруйте раствор через охлажденный фильтр (Рисунок 4D).
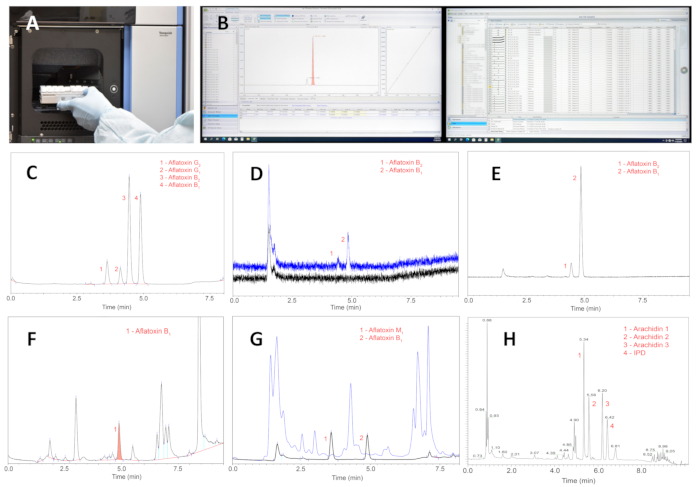
Рисунок 5: Процесс и результаты анализа очищенных экстрактов методом UPLC. (A) Помещение штатива с очищенными экстрактами проб в автоподатчик UPLC. (B) Проведение инструментального анализа, получение данных и интерпретация результатов. (В) УПЛХ четырех основных афлатоксинов; основные пики интереса, афлатоксиныВ1 иВ2 представляют 0,04 и 0,004 нг соответственно. (D) УПЛХ афлатоксиновВ1 иВ2; пик 2 представляет собой афлатоксин B1 на уровне 2 пг (с проточной ячейкой объемом 8 мкл). (E) UPLC очищенного экстракта семян, собранных на местном арахисовом поле с диким видом Арачис . (F) UPLC экстракта оспариваемого арахисового семени, очищенного с помощью основной миниколонки из оксида алюминия. (G) UPLC экстракта оспариваемых семян арахиса, очищенных с помощью колонки Florisil; на синей хроматограмме представлены примеси, которые смываются из колонки 1 мл смеси метанол-вода (90:10 об/об); черная хроматограмма показывает пики афлатоксиновМ1 иВ1. Уровень афлатоксинаВ1 составляет 48 нг/г. (H) Типичная хроматограмма стильбеноидов арахиса из проблемных семян; сокращение: IPD = 3'-изопентадиенил-3,5,4′-тригидроксистильбен. Примечание: Все стильбеноиды в экстрактах семян находятся в трансконфигурации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Для анализа фитоалексина из каждого флакона с шариками перенесите 200 мкл надосадочной жидкости в указанный выше фильтр для пипеток Пастера. Используйте газ N2 из баллона со сжатым азотом для ускорения фильтрации в пробирку автосамплера UPLC объемом 400 мкл и закройте флакон соответствующей крышкой с перегородкой из ПТФЭ (Рисунок 4D).
3. Анализы на афлатоксины
- Для разделения афлатоксинов в экстрактах семян используют систему UPLC, оснащенную автосэмплером, четвертичным насосом, флуоресцентным детектором, колонкой UPLC BEH C18 3,0 мм x 100 мм, 1,7 мкм с соответствующей предварительной колонкой, а также постколоночным фотохимическим реактором (PHRED) со стандартной трикотажной катушкой из ПТФЭ внутреннего диаметра 0,25, обрезанной до 25% от ее первоначальной длины.
ПРИМЕЧАНИЕ: Прибор UPLC и сопутствующее оборудование, использованное авторами, перечислены в Таблице материалов. - Используйте воду (А), метанол (В) и ацетонитрил (С) в следующем градиенте: начальные условия, 62,7% А, 24% В, 13,3% С, линейно изменялись до 30% А, 45% В, 25% С через 3,75 мин, изменялись до 0% А, 64,4% В, 35,6% С за 3,751 мин, удерживались изократическим в течение 3,249 мин, затем изменялись до исходных условий через 0,01 мин и удерживались изократическими в течение 2,499 мин перед следующей инъекцией. Установите скорость потока на 0,45 мл/мин и время выполнения на 9,5 мин. Поддерживайте температуру колонны на уровне 40 °C в нагревателе системной колонны. Используйте 362 нм и 440 нм в качестве длин волн возбуждения и излучения, соответственно, для количественного определения афлатоксинов B1, B2, G1, G2 и M1 . Структура основных афлатоксинов показана на рисунке 6А.
Примечание: В экспериментальных условиях ожидается, что A. flavus NRRL 3357 продуцирует только афлатоксиныВ1 иВ2; если штамм A. parasiticus используется для борьбы с семенами, ожидается выработка афлатоксиновB1,B2,G1 иG2. - Определение концентраций афлатоксинов по пиковым областям соответствующих достоверных стандартов (калибровочная кривая), как описано в руководстве пользователя программного обеспечения.
ПРИМЕЧАНИЕ: Поскольку процедура UPLC демонстрирует исходный шум при высоких настройках чувствительности флуоресцентного детектора, предел обнаружения (LOD) и предел количественной оценки (LOQ) для афлатоксинов оцениваются с использованием широко принятого отношения сигнал/шум 3:1 для LOD и 10:1 для LOQ. В рутинной экспериментальной установке для анализа семян арахиса, описанной в разделах 2 и 3, ожидается, что пределы количественного определения афлатоксинов G1 и B1 будут меньше или равны 0,8 и 0,08 нг/г афлатоксинов G2 и B2 соответственно.
4. Анализы на стильбеноидный фитоалексин
- Для выделения стильбеноидов используют воду (А), метанол (В) и 88% муравьиную кислоту (С) в следующем градиенте: исходные условия, 53% А, 42% В, 5% С, линейно изменяются до 35% А, 60% В, 5% С за 2,0 мин, выдерживают изократический 4 мин, изображают 0%, 95% В, 5% С за 0,5 мин, выдерживают изократический 2,5 мин, Затем переходили в исходные состояния через 0,1 мин и удерживали изократический в течение 2,9 мин перед следующей инъекцией. Установите расход на 0,5 мл/мин и время выполнения на 12,0 мин.
- Определение концентраций стильбеноидов по пиковым площадям соответствующих достоверных стандартов (калибровочная кривая) и/или по опубликованным коэффициентам молярных экстинкций, как описано в руководстве пользователя программного обеспечения. Структура основных фитоалексинов, полученных из стильбена, показана на рисунке 6B.
Примечание: Разделение фитоалексинов достигается с помощью той же системы, но без флуоресцентного детектора и реактора PHRED. Вместо этого для обнаружения и количественного определения стильбеноидов арахиса используется детектор с диодной матрицей. Количественный предел (LOQ) для основных стильбеноидных фитоалексинов не имеет практического значения, так как концентрации стильбеноидов превышают концентрации афлатоксинов в том же экстракте на несколько порядков; После 3 дней инкубации стильбеноиды надежно количественно определяются.
Representative Results
Разработанная методика количественного определения афлатоксина в семенах является ядром всей методики оценки диких видов арахиса на устойчивость к накоплению афлатоксина. Изготовленные по индивидуальному заказу миниколонки и фильтры обеспечивают существенную экономию и упрощают общую процедуру из-за отсутствия больших объемов растворителей, дорогостоящих и ненужных коммерческих фильтров 0,22 или 0,45 мкм и насосных устройств. Метод анализа афлатоксинов обеспечивает высокую степень извлечения, точность и прецизионность в пределах 1,0-50,0 нг/г афлатоксинов из измельченных семян, как показано в таблице 1. Сильно загрязненные образцы разбавляли до линейного исследуемого значения. На рисунке 5C показано исходное разделение четырех основных афлатоксинов,B1,B2, G1 иG2 в течение 5 минут элюирования, что приемлемо, поскольку грибковая продукция семян арахиса является предельным этапом процедуры, а не анализом UPLC.
Предложенный метод является достаточно чувствительным с пределом количественного определения 2 пг для афлатоксинаВ1 (рисунок 5D). Высокая чистота экстрактов позволяет однозначно количественно определить содержание афлатоксинов, как видно из UPLC (рис. 5E) очищенного экстракта семян, собранных с поля с диким видом арачиса . Ранее опубликованный метод29 миниколонок не способен обеспечить удовлетворительную чистоту семян арахиса, подверженных воздействию грибка (фиг.5F) по сравнению с предложенным способом (фиг.5G). Из рисунка 5F видно, что афлатоксиныВ2, G1 и G2 не могут быть надежно обнаружены и количественно определены из-за присутствия высоких концентраций интерферирующих примесей, многие из которых, элюированные после афлатоксинов, являются стильбеноидными фитоалексинами и метаболитами грибов. В отличие от этого, рисунок 5G демонстрирует высокую эффективность колонки с силикагелем магния в удалении примесей из фракции афлатоксина. На синей хроматограмме представлены мешающие примеси, которые смываются из колонки 1 мл смеси метанол и воды (90:10); На черной хроматограмме видны незатемненные пики афлатоксиновМ1 иВ1. Эта хроматограмма представляет собой экстракт семян диких видов, находящихся под угрозой. Уровень афлатоксинаВ1 составляет 48 нг/г.
Количественное определение фитоалексинов арахиса является ценным дополнением к анализу афлатоксинов в одном и том же семени, которое может быть натуральным семенем с поля или семенем, пораженным грибком. На рисунке 5H показана типичная хроматограмма защитных стильбеноидов арахиса из проблемных семян. Разделение соединений достигается с помощью той же аналитической колонки, которая используется для анализа афлатоксинов. Колонка и выбранные хроматографические условия обеспечивают удовлетворительное разделение пиков, что позволяет надежно количественно определить количество стильбеноидов. Оценка взаимосвязи афлатоксина и фитоалексина в семенах с проблемами выходит за рамки данной презентации, и метод предлагается здесь в качестве потенциального исследовательского инструмента, который использовался в лаборатории авторов в течение нескольких лет и доказал свою эффективность.
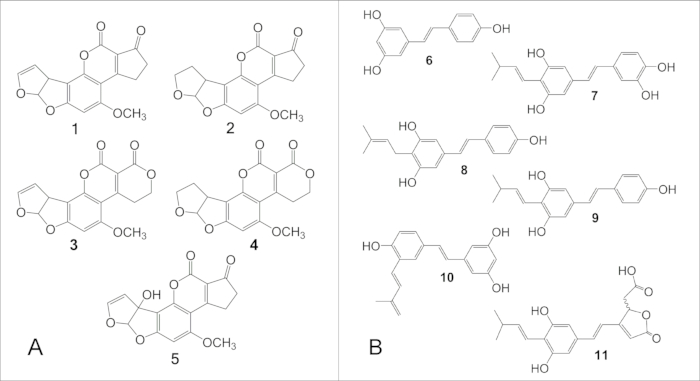
Рисунок 6: Структура основных афлатоксинов и фитоалексинов арахиса, полученных из стильбена. (A) Структура основных афлатоксинов: 1, B1; 2, В2; 3, Г1; 4, Г2. (B) Структура основных фитоалексинов арахиса, полученных из стильбена: 6, ресвератрол; 7, арахидин-1; 8, арахидин-2; 9, арахидин-3; 10, ИПД (3'-изопентадиенил-3,5,4'-тригидроксистильбен); 11, СБ-1. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Шип уровняа (нг/г) | Афлатоксины | |||
| В1 | В2 | Г1 | Г2 | |
| 50 | 85.87 (0.97) | 82.33 (0.67) | 86.63 (2.89) | 84.01 (0.86) |
| 5 | 91.43 (2.76) | 87.32 (0.47) | 88.08 (2.08) | 87.73 (0.77) |
| 1 | 81.21 (3.16) | 85.33 (1.98) | 81.76 (4.66) | 88.46 (3.24) |
Таблица 1: Извлечение афлатоксинов из семян арахиса с помощью колонки Флоризил и 1,2 мл смеси элюирования фракции афлатоксина. [среднее (SD), %; n = 5]. Не содержащие афлатоксина измельченные образцы (50 г) сорта арахиса Georgia 06G равномерно подсыпали с помощью микрошприца с исходным раствором афлатоксина в концентрации 50, 5 или 1 нг/г и оставляли при комнатной температуре на 16 ч. a Уровни спайка давали для афлатоксиновВ1 и G1; для афлатоксиновВ2 иГ2 следует использовать коэффициент размножения 0,33.
Discussion
Основываясь на нашемпредыдущем опыте, мы разработали простую, недорогую, экологически чистую, химическую процедуру, подходящую для исследования коллекций зародышевой плазмы дикого арахиса с целью идентификации видов, устойчивых к Aspergillus , а также для определения и характеристики новых источников генетической устойчивости к этому условно-патогенному грибу. Этот метод основан на очистке экстракта семян методом твердофазной экстракции (SPE) и количественном определении афлатоксина с помощью Ultra Performance Liquid Chromatography (UPLC) и характеризуется достаточно высоким извлечением, прецизионностью и аккуратностью. Предложенный метод «Флорисил» представляет собой модификацию процедуры очистки одной миниколонки, основанной на уникальном свойстве флоризила (силикагель магния) сильно и избирательно удерживать афлатоксины28. Как и в оригинальном методе, образцы семян экстрагировали смесью MeOH-H2O, но в другой пропорции 90:10 (v/v) по сравнению с опубликованными 80:20 (v/v). Это изменение увеличило скорость потока растворителей через очистительную колонну до 2,5 раз при той же скорости восстановления афлатоксина. Эта смесь метанола и воды в соотношении 90:10 (v/v) обеспечила почти 100% извлечение афлатоксинов стандартовB1, B2,G1 иG2 , добавленных в экстракционный растворитель при пиковых концентрациях, эквивалентных 5-50 нг концентраций афлатоксина в 1 г субстрата, а также обеспечила достаточно высокие извлечения из образцов семян арахиса с шипами (Таблица 1).
Показано, что афлатоксины могут быть элюированы из адсорбента Флоризил только большими объемами ацетона30, ацетона-метанола31,32 и ацетон-водных смесей 33,34,35,36. В ходе настоящего исследования было обнаружено, что подкисленный ацетонитрил ведет себя аналогично ацетону в своей способности вымывать афлатоксины из флорисила. Насколько нам известно, об этом свойстве ацетонитрила в литературе не сообщалось. Открытие этого свойства позволяет вводить очищенный экстракт непосредственно в систему УПЛК, минуя стадию испарения растворителя, что существенно сокращает время приготовления. Даже когда ацетонитрил смешивали с ацетоном (ацетон-ацетонитрил-вода-88% муравьиной кислоты (65:31:3.5:0,5, v/v)), он обеспечивал плавное, полное и быстрое удаление воды из очищенных элюатов, значительно сокращая время испарения растворителя. Присутствие ацетонитрила позволило использовать смесь одного растворителя, метанола и воды (90:10, v/v) для эффективного удаления примесей из колонки Флорисила по сравнению с опубликованным методом, где требовались два дополнительных промывочных растворителя, метанол и смесь хлороформа-метанола. 28
В среднем, стандартное восстановление афлатоксинаВ1 составило ~98% при использовании 1,2 мл для элюирования афлатоксинов. Количество 50 мг Флорисила подбирали таким образом, чтобы 1,2 мл элюирующего растворителя заполняли миниколонку до верха бочки и, в то же время, обеспечивали удовлетворительное извлечение (табл. 1). Такой подход ускоряет процедуру очистки, так как бочку колонны необходимо заполнить только один раз. На ранних стадиях этого проекта было неясно, будет ли подходить коммерческая фракция Florisil с относительно большим размером частиц, 100-200 меш, для небольшой колонны, содержащей всего 3-миллиметровый слой адсорбента. Поэтому мы исследовали различные фракции Флорисила, полученные из коммерческого продукта размером 100-200 меш, используя США стандартные тестовые сита 120-140, 140-170, 170-200, 200-270, 270-400 и >400 меш. Все эти фракции обеспечили воспроизводимые, почти совпадающие результаты с удовлетворительным извлечением. Несмотря на то, что фракции меньшего размера частиц демонстрировали более узкие полосы афлатоксина в колонке под действием ультрафиолетового излучения, эти фракции не превосходили их в любом отношении по сравнению с коммерческим продуктом размером 100-200 меш. Кроме того, фракция 100-200 меш продемонстрировала самое короткое время элюирования (8-12 мин) за всю процедуру.
Градиентная подача растворителя UPLC позволила обеспечить удовлетворительное отделение афлатоксинов, а также полное удаление неполярных примесей из колонки (рис. 5G). Такой подход привел к безупречной работе колонны и воспроизводимым результатам анализов сотен образцов. Идентичность афлатоксинов, элюированных из колонки Флорисила, была подтверждена так, как описано ранее. 28 Использованная здесь аналитическая колонка UPLC диаметром 3 мм продемонстрировала более высокую селективность и более надежное разделение афлатоксинов B1, B2, G1 и G2 в более высоких концентрациях по сравнению с колонкой диаметром 2,1 мм того же химического состава. Более того, долговечность 3-миллиметровой колонки (более 1200 инъекций) была значительно выше, чем у 2,1-мм колонки (до 800 инъекций). Несмотря на то, что колонна диаметром 3 мм требовала более высокой скорости подвижной фазы (на 40% больше), этот недостаток был перекрыт вышеуказанными преимуществами колонны.
Миниколонка Florisil была эффективна для очистки экстрактов семян арахиса, сильно загрязненных метаболитами Aspergillus (рис. 5G); Такие семена также содержали высокий уровень стильбеноидных фитоалексинов, которые вырабатывались семенами в ответ на грибковое вторжение. Концентрация афлатоксина в семенах может превышать концентрацию афлатоксина в семенах до 10в 6 раз22, что делает эти семена сложными объектами для анализа афлатоксинов. На рисунке 5G показано отсутствие мешающих пиков на хроматограмме в течение времени удержания афлатоксина, что сделало обнаружение и количественное определение афлатоксина бескомпромиссным на всех испытуемых уровнях (Таблица 1). Как видно из таблицы 1, точность и прецизионность метода были достаточно высокими в пределах исследуемого диапазона 1,0-50,0 нг/г, который также является наиболее критическим диапазоном для обнаружения афлатоксина. Восстановление на разных уровнях для различных генотипов дикого арахиса было равномерным, а стандартные отклонения для пяти различных экстракций были в основном низкими.
Метод также был протестирован на семенах арахиса, хлопка, кукурузы и риса, загрязненных естественным образом от нуля до чрезвычайно высоких уровней - более 10 000 нг/г общего афлатоксина. Извлечение афлатоксиновВ1,В2, Г1 иГ2 из кукурузы, хлопчатника и риса в концентрации 5 нг/г варьировало от 76,1% до 93,7%, от 77,1% до 86,6% и от 90,5% до 96,2% соответственно. Высочайшее восстановление афлатоксинов из риса сопровождалось «чистотой» элюента, то есть практически отсутствием каких-либо примесей. Кроме того, рис представлял собой самый маленький из протестированных объектов, в среднем 19 мг/семя.
Общее время подготовки одного зернышка арахиса (включая шелушение, взвешивание, экстракцию, центрифугирование и очистку) с использованием колонки Florisil не превышало 20 минут. Стоимость миниколонки Florisil в >10 раз меньше, чем у коммерческих колонок для очистки. Дополнительная экономия достигается за счет использования меньших объемов адсорбентов, растворителей и газообразного азота по сравнению с опубликованной методикой28. Миниколонка не требует для работы насосных или вакуумных устройств и имеет неограниченный срок годности.
Изучение устойчивости зародышевой плазмы растений к афлатоксинам исключительно затруднено, поскольку накопление микотоксинов не следует нормальному распределению37,38; Для преодоления этого явления необходимо большое количество анализов афлатоксина в отдельных семенах. В дополнение к содержанию афлатоксина, информация о количественном составе фитоалексина очень ценна в свете большого объема информации, которая может быть получена из одного семени (рисунок 1A) и отслежена до конкретного растения (рисунок 1E). Этот метод был успешно использован для скрининга сотен образцов, включая местные сорта, передовые селекционные линии и элитные сорта арахиса. Метод предлагается для использования в программах исследований по предварительному разведению и селекции арахиса и может помочь в характеристике генов арахиса на устойчивость к грибкам.
Disclosures
У авторов нет конфликта интересов, который можно было бы раскрыть.
Acknowledgements
Данная работа получила финансовую поддержку проекта USDA-ARS CRIS 6044-42000-011-00D и проекта CRIS 6044-21000-005-000-D. Мы благодарим Дэна Тодда за создание стеллажа для миниколонн. Упоминание торговых наименований или коммерческих продуктов в этой статье осуществляется исключительно с целью предоставления конкретной информации и не подразумевает рекомендации или одобрения со стороны Министерства сельского хозяйства США.
Materials
| Name | Company | Catalog Number | Comments |
| Acetone, Optima | Fisher Scientific | A929-4 | |
| Acetonitrile, Optima | Fisher Scientific | A996-4 | |
| Acquity BEH C18 2.1 x 5mm Van-Guard pre-column | Waters Corporation | 186003975 | |
| Acquity BEH C18 3 x 100mm column | Waters Corporation | 186004661 | |
| Acquity BEH C18 2.1 x 100mm column | Waters Corporation | 186002352 | |
| Aflatoxins B1, B2, G1, and G2 | Sigma-Aldrich | A9441-1VL | Dissolve the contents of the commercial vial in 5 mL of methanol to obtain 5 µg/mL for aflatoxins B1 and G1 and 1.5 µg/mL for B2 and G2 |
| Aflatoxin B1 (1mg) | Sigma-Aldrich | A6636-1MG | |
| Aflatoxin B2 (1mg) | Sigma-Aldrich | A9887-1MG | |
| Aflatoxin G1 (1mg) | Sigma-Aldrich | A0138-1MG | |
| Aflatoxin G2 (1mg) | Sigma-Aldrich | A0263-1MG | |
| Aflatoxin M1 (10 µg) | Sigma-Aldrich | CRM46319 | |
| Agar, Granulated (2kg) | Becton Dickinson | BD214510 | |
| Alumina oxide basic (60-325 mesh) | Fisher Scientific | A941-500 | |
| Basal medium | Murashige and Skoog | M5519 | |
| Bead Ruptor 24 | Omni International | 19-042E | |
| Beaker (1000mL) | Corning (Pyrex) | 10001L | |
| Beaker (250mL) | Corning (Pyrex) | 1000250 | |
| Beaker (400mL) | Corning (Pyrex) | 1000400 | |
| Beaker (600mL) | Corning (Pyrex) | 1000600 | |
| Blade, scalpel | Feather | #10 | |
| Centrifuge (LSE Compact) | Corning | Model: 6755 | |
| Centrifuge, micro | Corning | Model: 6770 | |
| Ceramic beads (2.8 mm) | Omni International | 19-646 | |
| Ceramic beads (6.5 mm) | Omni International | 19-682 | |
| Chromeleon 7 series Software | Thermo Scientific | ||
| Drill bit | Kyocera | 07896 | 1.6 mm |
| Drill bit | Kyocera | 07357 | 2.0 mm |
| Drill bit | Kyocera | 07985 | 2.34 mm |
| Ethanol (200 proof) | Decon Labs | 2805M | |
| Evaporator, nitrogen | organimation | 11106 | 6-position |
| Excel, Microsoft | Microsoft | Office 365 | |
| Filter paper (#4) | Cytiva Whatman | 1004-090 | |
| Filter paper cutter, stainless steel (ID 11.5mm) | Unknown | ||
| Filter paper, glass fibre | Cytiva Whatman | 934-AH | |
| Flask (2800mL) | Corning (Pyrex) | 44202XL | |
| Florisil (100-200 mesh) | Fisher Scientific | F101-500 | |
| Forceps | Integra Lifescience (Miltex) | PM-0300 | |
| Formic acid (88%, ACS) | Fisher Scientific | A118P-500 | |
| Freezer (-80oC) | Fisher Scientific | TSX70086D | |
| Funnel (15 x 80mm) | DWK Life Sciences (Kimax) | 2902060 | |
| Gelzan (medium) | Caisson Labs | G024 | |
| Glass rod (custom) | Custom made | ||
| Glass wool | Corning (Pyrex) | 3950 | |
| Handle, scalpel | Feather | #7 | |
| Hemocytometer | Hausser Scientific | 3100 | |
| Hydrogen peroxide | Fisher Scientific | H325-4 | 30%, Certified ACS |
| Ice bucket, round with lid | Corning | 432122 | |
| Incubator | Percival | 136VL | |
| Kimtech SCIENCE Brand Kimwipes | Kimtech | 34120 | 8.2" x 4.39" |
| Kimtech SCIENCE Brand Kimwipes | Kimtech | 34256 | 16.4" x 14.43" |
| Lab coat | Cenmed | B113660SBXL | |
| Methanol, Optima | Fisher Scientific | A454-4 | |
| Mini column rack (custom) | Custom made | ||
| Mixer, touch (maxi mix II) | Thermolyne | 37600 (model 231) | |
| Nitrile gloves | Microflex | XC310M | |
| Nitrogen gas, compressed (ultra high purity) | Jones Welding | ||
| Paper towel | Georgia-Pacific | 20023 (D400) | |
| pH meter | Fisher Scientific (Accumet) | 13-636-AB15 | |
| pH/ATC electrode | Fisher Scientific (Accumet) | 13-620-111 | |
| PhCR Photochemical Reactor | Waters (Vicam) | 600001222 | |
| Pipette, pasteur | Fisher Scientific | 13-678-20D | 9" |
| Pipettor (1 mL) (Reference 2) | Eppendorf | 4924000088 | |
| Pipettor (10 μL) (Reference) | Eppendorf | 022470051D | |
| Pipette tips: 10 μL, 200 μL, 1 mL | Eppendorf | F144054M | |
| Pipettor (200 µL)(Ergofit) | Fisher Scientific | 12-146-679 | |
| Plates, petri (100x15mm) | Fisher Scientific | FB0875713 | |
| Potato Dextrose Agar (500g) | Becton Dickinson | BD213400 | |
| Reinforced bead tube (2 mL) | Omni International | 19-660 | |
| Reinforced bead tube (7 mL) | Omni International | 19-651 | |
| Repipettor, Dispensette III (10mL) | Brandtech | 4701141 | |
| Resveratrol | Sigma-Aldrich | R5010-100MG | |
| Scoop (custom) | Custom made | ||
| screwcap jar (250 mL) | Corning (Pyrex) | 1395250 | |
| Silica gel, spherical (200-400 mesh) | Supelco | 97727-U | 100 g |
| Sodium Hydroxide | Fisher Scientific | S318-500 | |
| SPE extract clean 1.5-mL polypropylene column | American Chromotography Supplies | SP-5122382 | |
| SPE extract clean PP frits (for 1.5 mL minicolumn) | American Chromotography Supplies | SP-3119414 | |
| Spectrophotometer, UV-visible | Fisher Scientific | 14-385-351 (Genesys 50) | |
| Test tube | Corning (Pyrex) | 982516X | 16x125mm |
| Test tube (Disposable)(16x125mm) | Fisher Scientific | 14-961-31 | |
| Test tube (Disposable)(150x250mm) | Fisher Scientific | 14-961-34 | |
| Thermo Vanquish DAD detector (UPLC) | Thermo Scientific | VF-D11-A-01 | |
| Thermo Vanquish Fluourescense detector (UPLC) | Thermo Scientific | VF-D51-A | |
| Thermo Vanquish quaternary pump F (UPLC) | Thermo Scientific | VF-P20-A | |
| Thermo Vanquish Split Sampler FT (UPLC) | Thermo Scientific | VF-A10-A-02 | |
| Tween 20 (polysorbate 20) (enzyme grade) | Fisher Scientific | BP337-500 | |
| Vial caps (4mL) | Fisher Scientific | C4015-75A | |
| Vial caps (autosampler) | Fisher Scientific | C4010-60A | |
| Vials & caps (16 mL) | Thermo Scientific | B7800-4 | |
| Vials, glass (4mL) | Fisher Scientific | C4015-1 | |
| Vials, polypropylene (autosampler) (400mL) | Fisher Scientific | C4010-11 | |
| Water, Optima | Fisher Scientific | W6-4 |
References
- Janila, P., et al. Molecular breeding for introgression of fatty acid desaturase mutant alleles (ahFAD2A and ahFAD2B) enhances oil quality in high and low oil containing peanut genotypes. Plant Sci. 242, 203-213 (2016).
- Rasooly, R., Hernlem, B., He, X., Friedman, M. Non-linear relationships between aflatoxin B1 levels and the biological response of monkey kidney vero cells. Toxins (Basel). 5 (8), 1447-1461 (2013).
- American Association for Cancer Research: AACR. An evaluation of chemicals and industrial processes associated with cancer in humans based on human and animal data: IARC Monographs Volumes 1 to 20. Cancer Res. 40 (1), 1-12 (1980).
- Turner, P. C. The molecular epidemiology of chronic aflatoxin driven impaired child growth. Scientifica. , 21 (2013).
- Williams, J. H., et al. Human aflatoxicosis in developing countries: a review of toxicology, exposure, potential health consequences, and interventions. Am. J. Clin. Nutr. 80 (5), 1106-1122 (2004).
- van Egmond, H. P., Jonker, M. A., Abbas, H. K. Worldwide regulations on aflatoxins. Aflatoxinandfood safety. , 77-93 (2005).
- European Commission. Commission Regulation (EC) 1525/98. Off. J. Eur. Comm. L. 201, 43-46 (1998).
- Bressano, M., et al. Introgression of peanut smut resistance from landraces to elite peanut cultivars (Arachis hypogaea L). PLoS ONE. 14 (2), e0211920 (2019).
- de Blas, F. J., et al. Identification of smut resistance in wild Arachis species and its introgression into peanut elite lines. Crop Sci. 59 (4), 1657-1665 (2019).
- Mallikarjuna, N., Pande, S., Jadhav, D. R., Sastri, D. C., Rao, J. N. Introgression of disease resistance genes from Arachis kempff-mercadoi into cultivated groundnut. Plant Breeding. 123 (6), 573-576 (2004).
- Moretzsohn, M. C., et al. Genetic diversity of peanut (Arachis hypogaea L.) and its wild relatives based on the analysis of hypervariable regions of the genome. BMC Plant Biol. 4, 1-10 (2004).
- Arias, R. S., et al. New tools to screen wild peanut species for aflatoxin accumulation and genetic fingerprinting. BMC Plant Biol. 18 (1), 170 (2018).
- Dorner, J. W., Cole, R. J., Sanders, T. H., Blankenship, P. D. Interrelationship of kernel water activity, soil temperature, maturity, and phytoalexin production in preharvest aflatoxin contamination of drought-stressed peanuts. Mycopathologia. 105 (2), 117-128 (1989).
- Paxton, J. D., Sharma, R. P., Salunkhe, D. K. Biosynthesis and accumulation of legume phytoalexins. Mycotoxins and phytoalexins. , 485-499 (1991).
- Cole, R. J., Dorner, J. W., Sharma, R. P., Salunkhe, D. K. Peanut phytoalexins. Mycotoxins and phytoalexins. , 501-509 (1991).
- Subba Rao, P. V., Strange, R. N., Daniel, M., Purkayastha, R. P. Chemistry, biology, and role of groundnut phytoalexins in resistance to fungal attack. Handbook of phytoalexin metabolism and action. , 199-227 (1995).
- Sobolev, V. S., Guo, B. Z., Holbrook, C. C., Lynch, R. E. Interrelationship of phytoalexin production and disease resistance in selected peanut genotypes. J. Agric. Food. Chem. 55 (6), 2195-2200 (2007).
- Paxton, J. Phytoalexins: a working redefinition. J. Phytopathol. 101, 106-109 (1981).
- Mansfield, J. W., Bailey, J. A., Mansfield, J. W. The role of phytoalexins in disease resistance. Phytoalexins. , 153-288 (1982).
- Strange, R. N., Ayers, P. G. Resistance: the role of the hypersensitive response and phytoalexins. Plant response to foliar pathogens. , 39-56 (1992).
- Sobolev, V. S., et al. Biological activity of peanut (Arachis hypogaea) phytoalexins and selected natural and synthetic stilbenoids. J. Agric. Food Chem. 59 (5), 1673-1682 (2011).
- Sobolev, V. S. Localized production of phytoalexins by peanut (Arachis hypogaea) kernels in response to invasion by Aspergillus Species. J. Agric. Food Chem. 56 (6), 1949-1954 (2008).
- Sobolev, V. S., Neff, S. A., Gloer, J. B. New stilbenoids from peanut (Arachis hypogaea) seeds challenged by an Aspergillus caelatus strain. J. Agric. Food Chem. 57 (1), 62-68 (2009).
- Trucksess, M. W., et al. Immunoaffinity column coupled with solution fluorometry or liquid chromatography postcolumn derivatization for determination of aflatoxins in corn, peanuts, and peanut butter: collaborative study. J. AOAC Int. 74 (1), 81-88 (1991).
- Dorner, J. W., Blankenship, P. D., Cole, R. J. Performance of two immunochemical assays in the analysis of peanuts for aflatoxin at 37 field laboratories. J. AOAC Int. 76 (3), 637-643 (1993).
- Stroka, J., Anklam, E. Immunoaffinity column cleanup with liquid chromatography using post-column bromination for determination of aflatoxins in peanut butter, pistachio paste, fig paste, and paprika powder: collaborative study. J. AOAC Int. 83 (2), 320-340 (2000).
- Pal, A., Acharya, D., Saha, D., Roy, D., Dhar, T. K. In situ sample cleanup during immunoassay: a simple method for rapid detection of aflatoxin B1 in food samples. J. Food Prot. 68 (10), 2169-2177 (2005).
- Sobolev, V. S. Simple, rapid, and inexpensive cleanup method for quantitation of aflatoxins in important agricultural products by HPLC. J. Agric. Food Chem. 55 (6), 2136-2141 (2007).
- Sobolev, V. S., Dorner, J. W. Cleanup procedure for determination of aflatoxins in major agricultural commodities by liquid chromatography. J. AOAC Int. 85 (3), 642-645 (2002).
- Levi, C. P., Borker, E. Survey of green coffee for potential aflatoxin contamination. J. AOAC. 51 (3), 600-602 (1968).
- Levi, C. P. Collaborative study on a method for detection of aflatoxins B1 in green coffee beans. J. AOAC. 52 (6), 1300-1303 (1969).
- Scott, P. M. Note on analysis of aflatoxins in green coffee. J. AOAC. 51, 609 (1968).
- Bicking, M. K. L., Kniseley, R. N., Svec, H. J. Coupled-column system for quantitating low levels of aflatoxins. J. AOAC. 66 (4), 905-908 (1983).
- Kamimura, H., et al. Simple, rapid cleanup method for analysis of aflatoxins and comparison with various methods. J. AOAC. 68 (3), 458-461 (1985).
- Hoogenboom, L. A., et al. Genotoxicity testing of extracts from aflatoxin-contaminated peanut meal, following chemical decontamination. Food Addit. Contam. 18 (4), 329-341 (2001).
- Castro, L., Vargas, E. A. Determining aflatoxins B1, B2, G1 and G2 in maize using Florisil clean up with thin layer chromatography and visual and densitometric Quantitation. Cienc. Tecnol. Ailment. Campinas. 21, 115-122 (2001).
- Arias, R. S., Dang, P. M., Sobolev, V. S. RNAi-mediated Control of Aflatoxins in Peanut: Method to Analyze Mycotoxin Production and Transgene Expression in the Peanut/Aspergillus Pathosystem. J. Vis. Exp. (106), e53398 (2015).
- Whitaker, T. B., Dorner, J. W., Giesbrecht, F. G., Slate, A. B. Variability among aflatoxin test results on runner peanuts harvested from small field plots. Peanut Sci. 31 (1), 59-63 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved