שיפור מפות צפיפות על ידי הסרת רוב החלקיקים בערימות סופיות של מיקרוסקופ אלקטרונים קריוגני של חלקיק יחיד
* These authors contributed equally
In This Article
Summary
שיטת בחירת חלקיקים מתקדמת עבור cryo-EM, כלומר CryoSieve, משפרת את רזולוציית מפת הצפיפות על ידי הסרת רוב החלקיקים בערימות סופיות, כפי שהודגם באמצעות היישום שלה על מערך נתונים בעולם האמיתי.
Abstract
במהלך העשור האחרון, התקדמות הטכנולוגיה והמתודולוגיה בתחום מיקרוסקופ אלקטרונים קריוגני (cryo-EM) ניתוח חלקיק יחיד (SPA) שיפרו באופן משמעותי את יכולתנו לבחינה מבנית ברזולוציה גבוהה של מקרומולקולות ביולוגיות. התקדמות זו הובילה לעידן חדש של תובנות מולקולריות, שהחליפו את קריסטלוגרפיית קרני הרנטגן כשיטה השלטת וסיפקו תשובות לשאלות ותיקות בביולוגיה. מכיוון ש- cryo-EM אינו תלוי בהתגבשות, שהיא מגבלה משמעותית של קריסטלוגרפיה של קרני רנטגן, הוא לוכד חלקיקים באיכות משתנה. כתוצאה מכך, בחירת החלקיקים היא קריטית, שכן איכות החלקיקים שנבחרו משפיעה ישירות על הרזולוציה של מפת הצפיפות המשוחזרת. גישה איטרטיבית חדשנית לבחירת חלקיקים, המכונה CryoSieve, משפרת באופן משמעותי את האיכות של מפות צפיפות משוחזרות על ידי הפחתה יעילה של מספר החלקיקים בערימה הסופית. ראיות ניסיוניות מראות כי שיטה זו יכולה לחסל את רוב החלקיקים בערימות הסופיות, וכתוצאה מכך שיפור ניכר באיכות מפות הצפיפות. מאמר זה מתאר את זרימת העבודה המפורטת של גישה זו ומציג את היישום שלה על מערך נתונים בעולם האמיתי.
Introduction
מיקרוסקופ אלקטרונים קריוגני (cryo-EM) ניתוח חלקיק יחיד (SPA) הפך לשיטה דומיננטית לקביעת מפות צפיפות תלת-ממדיות ברזולוציה גבוהה של מקרומולקולות ביולוגיות. בשל סדרה של חידושים טכנולוגיים 1,2,3,4,5,6, בשם מהפכת רזולוציה 7, ל- cryo-EM יש את היכולת לקבוע את המבנים של מקרומולקולות ביולוגיות ברזולוציה אטומית בקצב חסר תקדים. פריצת דרך זו מסמנת את תחילתו של עידן חדש בתובנות מולקולריות, תוך עקיפת קריסטלוגרפיית קרני רנטגן כטכניקה השלטת ומענה על שאלות ביולוגיות ותיקות.
Cryo-EM SPA סוטה מקריסטלוגרפיה של קרני רנטגן בכך שאינו דורש התגבשות של מקרומולקולות ביולוגיות. במקום זאת, תמיסה המכילה את המקרומולקולות הביולוגיות של המטרה קופאת במהירות בקרח זגוגית. לאחר מכן הוא מצולם עם קרן אלקטרונים כדי לייצר סדרה של מיקרוגרפים, תוך עקיפת הצורך בהתגבשות8. לאחר מכן, אלגוריתמים לקטיף חלקיקים משמשים לחילוץ חלקיקים גולמיים בודדים ממיקרוגרפים אלה 4,9,10,11,12. מכיוון ש- cryo-EM אינו תלוי בהתגבשות, טבעי שחלקיקים שחולצו ניזוקו בעיקר או במצבים קונפורמטיביים לא רצויים, מה שמחייב סבבים מרובים של בחירת חלקיקים כדי להשיג מפת צפיפות ברזולוציה גבוהה. בעיבוד תמונה cryo-EM SPA, בחירת חלקיקים חיונית לקבלת מפות צפיפות ברזולוציה גבוהה13.
ב- cryo-EM SPA, שיטות בחירת חלקיקים סטנדרטיות כוללות סיווג דו-ממדי (2D) ותלת ממדי (3D)14. סיווג דו-ממדי מסווג חלקיקים למספר מוגדר מראש של קבוצות, ומניב תמונה ממוצעת ורזולוציה דו-ממדית משוערת עבור כל מחלקה. לאחר מכן חוקרים יכולים לבחון חזותית את המחלקות האלה, ולהסיר חלקיקים מקבוצות ברזולוציה נמוכה יותר כדי להשתמש בשאר החלקיקים בשחזורים שמטרתם להשיג רזולוציה גבוהה יותר. לאחר קביעת תנוחות החלקיקים באמצעות אלגוריתמי עידון, החוקרים ימשיכו בסיווג תלת-ממדי, ויקבצו חלקיקים למספר מחלקות. זה מאפשר בדיקה חזותית של מפת הצפיפות המשוחזרת עבור כל מחלקה, ומאפשר הרחקה של חלקיקים לא רצויים, כגון אלה מקונפורמציות לא רצויות. לאחר מספר סבבי סיווג, מתקבלת ערימה סופית המורכבת מחלקיקים באיכות גבוהה יחסית. ערימות סופיות אלה מסייעות בהפקת מפות צפיפות ברזולוציה אטומית או כמעט אטומית.
ג'ו ועמיתיה הוכיחו כי ניתן לבצע בחירת חלקיקים נוספת בערימות הסופיות האלה15. CryoSieve15, שיטה איטרטיבית חדשנית לבחירת חלקיקים, ניתנת ליישום כדי לשפר את איכות מפת הצפיפות הסופית על ידי הפחתה משמעותית במספר החלקיקים. בעוד שקריטריונים ותוכנות אחרות למיון חלקיקים, כגון שיטת המתאם הצולב המנורמל (NCC)16, גישת עקביות הגרף הזוויתי (AGC)17 וסיווג אי-יישור5, נמצאים כיום בשימוש בתחום, שיטה זו הוכחה כבעלת ביצועים טובים יותר מאלגוריתמים אלה במונחים של יעילות.
במחקר זה אנו מציגים מדריך מפורט לתהליך כולו. כמקרה בוחן, יישמנו שיטה חדשה זו על מערך הנתונים של טרימר המגלוטינין לשפעת (ערך EMPIAR: 10097)18, הכולל 130,000 חלקיקים בערימה הסופית שלו. ההליך שלנו השליך בהצלחה כ-73.8% מהחלקיקים מהערימה הסופית של מערך נתונים זה, ושיפר את הרזולוציה של מפת הצפיפות המשוחזרת מ-4.11 Å ל-3.62 Å. בנוסף לטרימר המגלוטינין שפעת, תוצאות ממערכי נתונים מרובים מוצגות בפרסום מוקדם יותר15, המציגות מגוון רזולוציות ומשקלים מולקולריים של ביומולקולות.
Protocol
1. התקנה
- בדיקה והגדרה של סביבת האצת GPU
- פתח את המסוף והזן את הפקודה: nvidia-smi. ודא שהפקודה מציגה בהצלחה את כל המידע אודות כרטיסי המעבד הגרפי ושגרסת CUDA גבוהה מ- 10.2. בצעו את הפקודה: conda -V כדי לבדוק אם Conda מותקנת (איור משלים 1).
- קביעת תצורה של סביבה וירטואלית
- הזן את הפקודה הבאה כדי להגדיר את הסביבה הווירטואלית, ולהחליף CRYOSIEVE_ENV בשם הסביבה הרצוי: Conda Create -n CRYOSIEVE_ENV python=3.8 cudatoolkit=10.2 cupy=10.0 pytorch=1.10 -c pytorch -c conda-forge. המתינו כמה דקות עד שהסביבה מוגדרת בהצלחה (איור משלים 2).
הערה: למשתמשים יש את הגמישות לשנות את שם הסביבה לפי הצורך. הפקודה שסופקה היא ספציפית ל- CUDA 10.2. אם דרושה גרסת CUDA אחרת, התאם את מספר הגרסה עבור cudatoolkit.
- הזן את הפקודה הבאה כדי להגדיר את הסביבה הווירטואלית, ולהחליף CRYOSIEVE_ENV בשם הסביבה הרצוי: Conda Create -n CRYOSIEVE_ENV python=3.8 cudatoolkit=10.2 cupy=10.0 pytorch=1.10 -c pytorch -c conda-forge. המתינו כמה דקות עד שהסביבה מוגדרת בהצלחה (איור משלים 2).
- התקן את CryoSieve
- הפעל את הסביבה על-ידי ביצוע הפקודה: conda activate CRYOSIEVE_ENV. התקן את התוכנה על-ידי הפעלה: pip install cryosieve או conda install -c mxhulab cryosieve (איור משלים 3). הזן cryosieve -h וודא שמידע העזרה מוצג כראוי (איור משלים 4).
2. ניפוי חלקיקים
- אחזור הנתונים
- הורד את ערכת הנתונים של המחסנית הסופית EMPIAR-10097 מ- EMPIAR (ראה טבלת חומרים). הורד את קובץ הכוכבים, את קובץ המסיכה (mask.mrc) ואת המודל הראשוני (לשלב הערכה מחדש; initial.mrc) מ- Github (ראה טבלת חומרים). מקם את כל הקבצים האלה בתיקייה יחד (איור משלים 5).
הערה: המאגר ב- https://github.com/mxhulab/cryosieve-demos משתמש באחסון קבצים גדולים של Git (Git LFS). התקנת Git LFS חיונית לשכפול המאגר כולו. לחלופין, גש לקובץ דרך הקישור GitHub ולחץ על הורד קובץ גולמי כפתור להורדת קובץ בודד.
- הורד את ערכת הנתונים של המחסנית הסופית EMPIAR-10097 מ- EMPIAR (ראה טבלת חומרים). הורד את קובץ הכוכבים, את קובץ המסיכה (mask.mrc) ואת המודל הראשוני (לשלב הערכה מחדש; initial.mrc) מ- Github (ראה טבלת חומרים). מקם את כל הקבצים האלה בתיקייה יחד (איור משלים 5).
- מסננת חלקיקי תהליך
- פתח את המסוף והשתמש בפקודה: cd FILEPATH כדי לנווט לתיקייה שבה ממוקם ערכת הנתונים. הפעל את סביבת Conda על ידי: Conda הפעל CRYOSIEVE_ENV.
- הזן את הפקודה הבאה כדי להתחיל את ניסוי סינון החלקיקים שלנו: cryosieve --reconstruct_software relion_reconstruct --postprocess_software relion_postprocess --i T40_HA_130K-Equalized_run-data_CryoSPARC_refined.star --o פלט/ --mask mask.mrc --angpix 1.3099979 --num_iters 10 --frequency_start 40 --frequency_end 3 --retention_ratio 0.8 --sym C3 --num_gpus 1 --איזון (איור משלים 5). במהלך הביצוע, המסוף יציג את יומני הפלט עבור כל איטרציה.
הערה: הוראות מפורטות עבור כל אפשרות ניתן למצוא בקובץ משלים 1. זמן הטיפול ודרישות המינימום לביצוע מפורטים בקובץ משלים 2. T40_HA_130K-Equalized_run-data_CryoSPARC_refined.star שוכלל על ידי CryoSPARC מ-T40_HA_130K-Equalized_run-data.star (הורד מ-EMPIAR) כדי למתן את ההשפעות הנגרמות על ידי התקדמות בטכניקות הערכת התמצאות.
3. מציאת האיטרציה האופטימלית
- בדיקת רזולוציות
- השתמש בפקודה: grep "+ FINAL RESOLUTION:" פלט/_postprocess*.txt כדי להדפיס תוצאות רזולוציה עבור 10 איטרציות של מסננת (איור 1). מכיוון שלערימת החלקיקים המסוננתבאיטרציה 7 יש את הרזולוציה הגבוהה ביותר עם הכי פחות חלקיקים, סביר להניח שהיא תספק את התוצאה האופטימלית.
הערה: כדי למנוע העברת מידע לא מכוונת מחלקיקים שהושלכו לחלקיקים שמורים15 וכדי להבטיח שמערום החלקיקים מפרסם את האיטרציה השביעית אכן אופטימלית, המשתמשים נדרשים לבצע שלב הערכה מחדש עבור חזרות סמוכות. בפרוטוקול זה, חזרות 4, 5, 6, 7 ו- 8 כפופות לאימות.
- השתמש בפקודה: grep "+ FINAL RESOLUTION:" פלט/_postprocess*.txt כדי להדפיס תוצאות רזולוציה עבור 10 איטרציות של מסננת (איור 1). מכיוון שלערימת החלקיקים המסוננתבאיטרציה 7 יש את הרזולוציה הגבוהה ביותר עם הכי פחות חלקיקים, סביר להניח שהיא תספק את התוצאה האופטימלית.
- ייבוא חלקיקים מסוננים
- פתח את ממשק האינטרנט CryoSPARC ובצע את השלבים הבאים: הזן סביבת עבודה ולחץ על כפתור בונה בפינה השמאלית העליונה של החלונית. בחלונית, בחרו באפשרות 'ייבוא אוסף חלקיקים ' ולחצו עליה. באזור 'פרמטרים' בחלונית 'ייבוא אוסף חלקיקים', ציין את נתיב המטא Particle כקובץ _iter{n}.star הממוקם בתיקיית הפלט של התוצאות שהושלמו ואת נתיב נתוני החלקיקים לתיקייה שבה מאוחסן קובץ MRCS. לחץ/י על הכפתור ״משימת תור ״ ולאחר מכן לחץ/י על הכפתור ״ תור ״ כדי להתחיל בתהליך. השתמש באותו אופן כדי לייבא את שאר האיטרציות הדורשות הערכה מחדש (איור משלים 6A).
- ייבוא מודל ראשוני
- לחצו על כפתור Builder בפינה השמאלית העליונה של החלונית. בחלונית, בחר ולחץ על האפשרות Import 3D Volumes .
- ציין את נתיב נתוני אמצעי האחסון כקובץ initial.mrc. לחץ/י על הכפתור ״משימת תור ״ ולאחר מכן לחץ/י על הכפתור ״ תור ״ כדי להתחיל את התהליך (איור משלים 6B).
הערה: ניתן ליצור את המודל הראשוני גם באמצעות שחזור ab initio (קובץ משלים 3).
- עידון הומוגני (בניית עבודה)
- לחצו על כפתור Builder בפינה השמאלית העליונה של החלונית. בחלונית, בחרו באפשרות 'עידון הומוגני ' ולחצו עליה.
הערה: חל גם עידון לא אחיד.
- לחצו על כפתור Builder בפינה השמאלית העליונה של החלונית. בחלונית, בחרו באפשרות 'עידון הומוגני ' ולחצו עליה.
- עידון הומוגני (ייבוא חלקיקים)
- בחלונית הראשית משמאל, פתח את המשימה לייבוא ערימת החלקיקים של האיטרציההחמישית (או האיטרציה הרצויה). גררו את מודול החלקיקים המיובאים מצד ימין של החלונית הראשית ושחררו אותו באזור 'ערימות חלקיקים' של הבונה מימין. סגור את המשימה Import Particle Stack על-ידי לחיצה על ה-X האדום בפינה הימנית העליונה של החלונית הראשית.
- פתח את המשימה לייבוא אמצעי אחסון תלת-ממדיים. גרור את מודול אמצעי האחסון המיובאים מצד ימין של החלונית הראשית ושחרר אותו במקטע אמצעי אחסון ראשוני של הבונה מימין.
- עידון הומוגני (שינוי הפרמטרים)
- תחת קיפול הפרמטרים, אתר את האפשרות סימטריה והגדר אותה ל- C3. מצא את האפשרות Force re-do GS split והשבת אותה. לחץ/י על הכפתור ״משימת תור ״ ולאחר מכן לחץ/י על הכפתור ״ תור ״ כדי להתחיל את המיקוד ההומוגני. בצעו עידון הומוגני עבור שאר האיטרציות באותה שיטה (איור משלים 6C-D).
הערה: האפשרות Force re-do GS split היא קריטית. השבתת אפשרות זו מבטיחה כי CryoSPARC שומר על הפיצול בתקן הזהב שניתן על ידי קובץ הכוכבים, תוך הימנעות מהתאמת יתר. נימוק מפורט לנטרול Force Re-do GS Split ניתן למצוא בקובץ משלים 4.
- תחת קיפול הפרמטרים, אתר את האפשרות סימטריה והגדר אותה ל- C3. מצא את האפשרות Force re-do GS split והשבת אותה. לחץ/י על הכפתור ״משימת תור ״ ולאחר מכן לחץ/י על הכפתור ״ תור ״ כדי להתחיל את המיקוד ההומוגני. בצעו עידון הומוגני עבור שאר האיטרציות באותה שיטה (איור משלים 6C-D).
- המתן עד שכל העבודות יסיימו לפעול כדי להשיג את התוצאות. בהתבסס על התוצאות, אושר כי ערימת החלקיקים המסוננת באיטרציה ה- 6 היא התוצאה האופטימלית בפועל.
הערה: זה נורמלי שלתוצאות המתקבלות יהיו סטיות אקראיות קלות מהתוצאות המפורטות בפרוטוקול זה. סטיות אלה אינן משפיעות על המסקנה הכוללת.
Representative Results
בפרוטוקול זה, השתמשנו בערכת הנתונים של טרימר השפעת המגלוטינין (ערך EMPIAR: 10097) כהדגמה של יעילות תהליך זה. בשל הכיוון המועדף של המדגם, איסוף הנתונים דרש הטיה של 40°. החלבון מציג סימטריה C3 ויש לו משקל מולקולרי של 150 kDa.
יישמנו את הפרוטוקול שתואר קודם לכן כדי לעבד את ערימת החלקיקים הסופית. הוא הסיר בהדרגה 20% מהחלקיקים בכל איטרציה, וכתוצאה מכך יחס שימור של 80.0%, 64.0%, 51.2% וכן הלאה. כפי שמתואר באיור 1 ובאיור 2, הרזולוציה של החלקיקים השמורים השתפרה בתחילה, אך בסופו של דבר ירדה. בין האיטראציות, האיטרציהה-6 זוהתה כתת-הקבוצה האופטימלית ביותר, המכילה הכי פחות חלקיקים אך משיגה את הרזולוציה הגבוהה ביותר. האלגוריתם שלנו זיהה בהצלחה תת-קבוצה של חלקיקים המהווים רק 26.2% מהערימה המקורית, וכתוצאה מכך רזולוציה משופרת מ-4.19 Å ל-3.62 Å (הערכה מחדש על-ידי CryoSPARC), כפי שמוצג באיור 2. יתר על כן, מפות צפיפות לפני ואחרי השימוש ב-CryoSieve הושוו באיור 3. עקומת מתאם מעטפת פורייה (FSC) מדגם למפה ועקומת FSC של חצי מפות של מפות הצפיפות המשוחזרות לפני ואחרי השיטה מוצגות גם הן (איור 3A-B). כמו כן הושוו מפות צפיפות גולמית ומפות צפיפות חדות שהתקבלו, כאשר רמת קווי המתאר המקבילה יושמה (איור 3C). הושוו שרשראות הצד של מפות צפיפות חדות, המראות שיפור של מפות צפיפות משוחזרות. גורם B המשוער רוזנטל-הנדרסון אומץ גם עבור הקריטריונים של איכות חלקיקים19. לאחר הסרת רוב החלקיקים בערימה הסופית, פקטור B של רוזנטל-הנדרסון עלה מ-226.9 Å2 ל-146.2 Å2 (איור 3D). רזולוציה מקומית, גורם B מקומי20 ו-ResLog21 שימשו גם הם להשוואה, מה שמצביע על כך ש-CryoSieve אכן משפר הן את איכות מפות הצפיפות והן את איכות החלקיקים (איור 4).
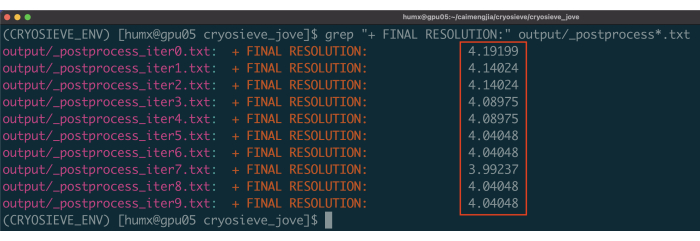
איור 1: רזולוציות של כל איטרציה. החלטות שדווחו מסומנות בתיבות אדומות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
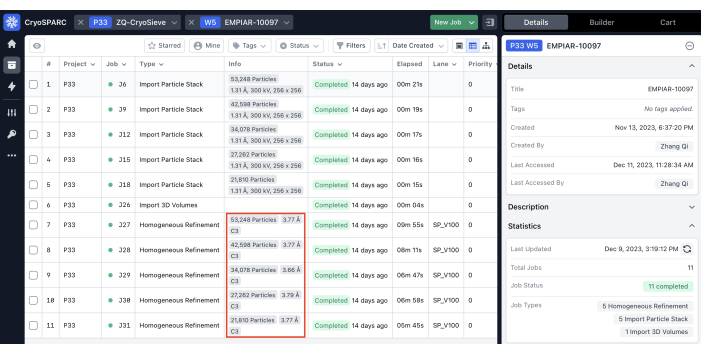
איור 2: רזולוציות של כל איטרציה. רזולוציות המזוהות על-ידי משימות עידון הומוגניות מודגשות בתיבות אדומות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
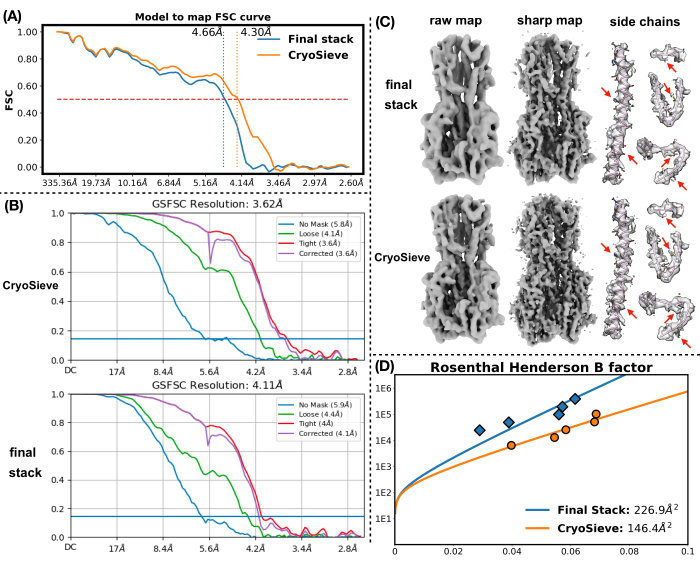
איור 3: מפות צפיפות. (A) השוואה של עקומת FSC מדגם למפה של מפות צפיפות משוחזרות לפני ואחרי השימוש ב- CryoSieve. ציר y מייצג FSC, ואילו ציר x מייצג רזולוציה. הקו המקווקו האדום מסמן את הסף של 0.5 עבור FSC. הקו המקווקו האנכי ממחיש את הרזולוציה של מפות הצפיפות המתקבלות מתחת לסף של 0.5. (B) עקומת FSC של חצאי מפות התקבלו ממפות צפיפות משוחזרות לפני ואחרי השימוש ב- CryoSieve באמצעות CryoSPARC. ציר y מייצג FSC, ואילו ציר x מייצג רזולוציה. (C) מפות צפיפות גולמית ומפות צפיפות חדות הוצגו הן עבור החלקיקים שנשמרים ב-CryoSieve והן עבור קבוצת החלקיקים המלאה בערימות הסופיות. רמת קווי המתאר המקבילה של 0.65 הוחלה על מפות צפיפות גולמית. רמת קווי המתאר המקבילה של 0.84 הוחלה על מפות צפיפות חדות. מפות צפיפות חדות התקבלו ישירות על ידי CryoSPARC. מפות הצפיפות החדות עובדו אוטומטית, תחילה משוקללות FSC (בהתבסס על FSCs שניתנו על ידי CryoSPARC). לאחר מכן, גורם B חודד באמצעות פקטורי B שנקבעו באופן אוטומטי (232.0 Å2 עבור כל החלקיקים בערימה הסופית ו- 160.8 Å2 עבור CryoSieve). הושוו שרשראות הצד במפות הצפיפות החדות, תוך שילוב מודלים אטומיים לייחוס. חצים אדומים מדגישים את האזורים המשופרים. (D) פקטור B המשוער של רוזנטל-הנדרסון הוצג הן עבור החלקיקים שנשמרים ב-CryoSieve והן עבור קבוצת החלקיקים המלאה בערימות הסופיות. ציר y מייצג את מספר החלקיקים שנעשה בהם שימוש, וציר x מייצג את הגומלין של ריבוע הרזולוציה. במעבר מלמעלה למטה, כל נקודה מייצגת מחצית מהחלקיקים של הקודמת. ההחלטות נקבעו על ידי עידון. גורמי B נקבעו באמצעות קירוב הכי פחות ריבועי של הנקודות הנמדדות, כפי שמוצג על ידי עקומות ההתאמה. גורמי B המשוערים של רוזנטל והנדרסון מצוינים באגדות: כתום מייצג חלקיקים שנשמרו על ידי CryoSieve, בעוד כחול מציין את כל החלקיקים בערימה הסופית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
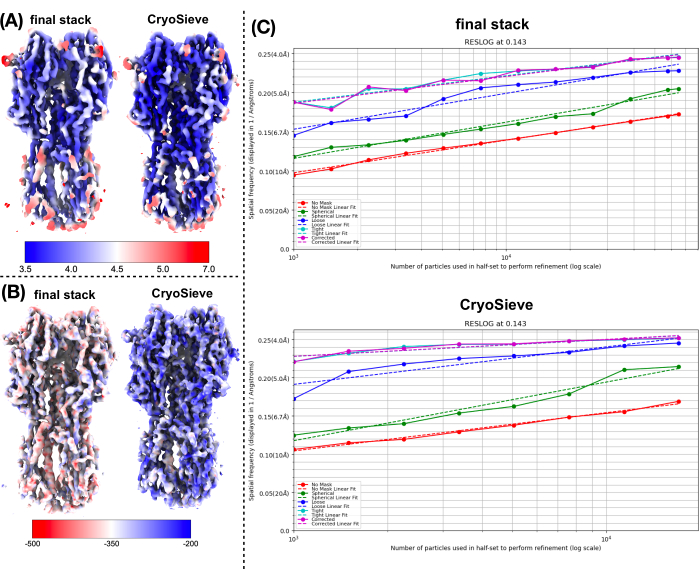
איור 4: השוואה בין מדדים שונים של מפות צפיפות. (A) השוואה של מפות ברזולוציה מקומית לפני ואחרי השימוש ב- CryoSieve המתקבלת על ידי CryoSPARC. הרזולוציה המקומית נעה בין 7 Å (אדום) ל- 3.5 Å (כחול). (B) השוואה של מפות צפיפות לפני ואחרי השימוש ב- CryoSieve, צבועות עם מפת גורם B המקומית המתקבלת על ידי LocBFactor באמצעות טווח רזולוציה של [20-3.5] Å. (C), השוואה של חלקות ResLog לפני ואחרי השימוש ב- CryoSieve שהושגה על ידי CryoSPARC. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
איור משלים 1: שימוש בפקודות nvidia-smi ו- conda -V כדי לאמת את התנאים המוקדמים. אם התנאים המוקדמים מתקיימים, הקלדת הפקודה nvidia-smi תציג את גירסת מנהל ההתקן של המעבד הגרפי, את גרסת CUDA ואת המצב של כרטיסי GPU. באופן דומה, הזנת הפקודה conda -V אמורה להציג כראוי את הגרסה המותקנת של Conda. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים 2: התהליך של יצירת סביבות חדשות של האצת GPU. המסך מציג את הפלט שנוצר על ידי הפקודה ששימשה ליצירת סביבת Conda. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים 3: התקנת CryoSieve בסביבת האצת GPU. לאחר הפעלת סביבת Conda החדשה שנוצרה, המסך מציג את הפלט הנובע מביצוע הפקודה להתקנת CryoSieve באמצעות Pip. אנא לחץ כאן להורדת קובץ זה.
תרשים משלים 4: מידע עזרה. אנא לחץ כאן כדי להוריד קובץ זה.
תרשים משלים 5: תהליך הריצה. עם ביצוע CryoSieve דרך שורת הפקודה, המסך מציג מידע לגבי תהליך הריצה. אנא לחץ כאן כדי להוריד קובץ זה.
תרשים משלים 6: תצורת המשרות של CryoSPARC. (A) ייבוא מחסנית חלקיקים. (ב) ייבוא אמצעי אחסון תלת-ממדיים. (ג-ד) עידון הומוגני. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 1: אפשרויות של CryoSieve. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 2: זמן עיבוד ודרישה מינימלית להפעלת Cryosieve. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 3: יצירת מודל ראשוני על ידי CryoSPARC. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 4: רציונל השבתת הכוח מחדש לבצע פיצול GS. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 5: אפשרויות של cryosieve-csrefine. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 6: אפשרויות של cryosieve-csrhbfactor. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
Cryo-EM עומד כטכניקה מרכזית להבהרת המבנים של מולקולות ביולוגיות. בתהליך זה, לאחר איסוף נתונים באמצעות מיקרוסקופיה, חילוץ חלקיקים ממיקרוגרפים הוא חיוני, ולאחר מכן סיווגם במספר שלבים כדי להרכיב את הערימה הסופית. אתגר נפוץ הוא הדומיננטיות של חלקיקים פגומים או לא רצויים, מה שמדגיש את הצורך בבחירת חלקיקים חוזרת ונשנית כדי להשיג מפות צפיפות ברזולוציה גבוהה. זה הופך את בחירת החלקיקים לשלב קריטי ב- cryo-EM SPA להשגת מפות צפיפות באיכות גבוהה. טכניקות קיימות לבחירת חלקיקים כוללות את אלגוריתם האימות הסטטיסטי ללא הטיה22, הגישה מבוססת z-score23 ושיטת הערכת הדיוק הזוויתי24.
CryoSieve מתגלה ככלי רב ערך בהקשר זה, המיומן בסילוק מספר משמעותי של חלקיקים חיצוניים מהערימה הסופית. הפחתה זו לא רק משפרת את היעילות החישובית של השחזור אלא גם מייעלת את התהליך. הוא מציע חבילה מקיפה לבחירת חלקיקים, שבה מידת השלכת החלקיקים והשיפור ברזולוציה כתוצאה מכך תלויים במידה רבה באיכות הנתונים הראשונית ובמתודולוגיות המשמשות בעיבוד נתונים.
בכתב יד זה, הצגנו תהליך עבודה מלא של סינון חלקיקים באמצעות מערך הנתונים במקרה האמיתי של טרימר המגלוטינין שפעת (ערך EMPIAR: 10097). ניתן לסכם את השלבים המכוסים והנדונים כאן כסינון חלקיקים והערכה מחדש של תנוחות. הנפח המשוחזר הסופי בתלת-ממד השיג רזולוציה של 3.62 Å, ושרשראות הצד בסלילי אלפא היו ברורות יותר בנפח שלאחר העיבוד בהשוואה למפת הצפיפות שפורסמה.
CryoSieve היא שיטת קוד פתוח הזמינה ב- GitHub (https://github.com/mxhulab/cryosieve). הדרכה מפורטת ניתן למצוא גם בדף הבית שלה. משתמשים יכולים להתקין אותו ולהשתמש בו על-ידי ביצוע ערכת הלימוד. בנוסף, שני מודולים, cryosieve-csrefine ו cryosieve-csrhbfactor, מסופקים. מודול cryosieve-csrefine נוצר במיוחד כדי להפוך את הביצוע הרציף של פעולות שונות בתוך CryoSPARC (קובץ משלים 5). פעולות אלה כוללות ייבוא ערימות חלקיקים וביצוע עבודות ab initio, עידון הומוגני או עבודות עידון לא אחידות. מצד שני, מודול cryosieve-csrhbfactor נועד להפוך את הקביעה של גורם B רוזנטל-הנדרסון לאוטומטית על ידי מינוף היכולות של cryosieve-csrefine (קובץ משלים 6).
כיום, היישום של שיטה זו מוגבל לתרחישי קונפורמציה יחידים. כתוצאה מכך, במקרים שבהם חלקיקים מייצגים קונפורמציות מרובות, יכולותיהם מוגבלות. מומלץ למשתמשים לעסוק תחילה בסיווג תלת-ממדי כדי להפריד חלקיקים בעלי קונפורמציות שונות לפני השימוש בו לבחירת חלקיקים מעודנים. יתר על כן, למרות שהשיטה מפגינה מיומנות בסינון מעל 50% מהחלקיקים מהערימה הסופית, מקורם של חלקיקים אלה שהושלכו והסיבות העומדות בבסיסם לתרומתם הזניחה לאיכות השחזור עדיין אינם ברורים. פער זה בהבנה מחייב מחקר נוסף כדי לטפל באופן מקיף ואולי לתקן מגבלה זו.
קיימות שלוש שיטות אפשריות למיון חלקיקים או לסינון חלקיקים. ראשית, cisTEM4 יכול לדווח על ציון עבור כל תמונת חלקיק בודד לאחר עידון תלת-ממדי. משתמשים יכלו למיין חלקיקים באמצעות ציון cisTEM כדי להיפטר מחלקיקים. גישת עקביות הגרף הזוויתי (AGC)17 היא גם שיטה להשלכת חלקיקים שאינם מיושרים. יתר על כן, סיווג אי-יישור5 הוא דרך מסורתית להיפטר מחלקיקים באמצעות סיווג תלת-ממדי. השווינו את איכות החלקיקים שנשמרו בשיטות אלה עם CryoSieve ומצאנו שהחלקיקים השמורים של CryoSieve הם באיכות גבוהה יותר15. השיטה המוצגת כאן עולה באופן משמעותי על שיטות חלופיות ומשיגה את המספר הקטן ביותר של חלקיקים באותה רזולוציה.
כפי שהודגם בתוצאה, רוב החלקיקים במחסנית הסופית של cryo-EM אינם תורמים לשחזור מפת צפיפות. במילים אחרות, מבין כל החלקיקים שנאספו במהלך רכישת התמונה, רק מעטים נבחרים, כלומר תת-הקבוצה המשובחת ביותר, תורמים בפועל לשחזור הסופי. כתוצאה מכך, היחס בין תת-קבוצה סופית זו למספר הכולל של חלקיקים שנאספו יכול לשמש כמדד כמותי להערכת איכות הדגימה. ככל שיחס זה גבוה יותר, כך איכות המדגם טובה יותר. למרות ההתקדמות הטכנית שהפכה את cryo-EM לנגיש יותר לביולוגים מבניים, הכנת הדגימות נותרה צוואר בקבוק מרכזי בתהליך העבודה. מדענים ומהנדסים ממקדים אפוא את מאמציהם באתגר זה25 . בניתוח חלקיק יחיד (SPA), הכנת הדגימה מורכבת משני שלבים מכריעים: אופטימיזציה של הדגימה והכנת הרשת. הראשון כרוך בטיהור הדגימה תוך שמירה על מצבה הביוכימי האופטימלי. זה האחרון כרוך בהכנת הדגימה לניתוח במיקרוסקופ, כולל טיפול כימי או פלזמה של הרשת, תצהיר הדגימה, ויטריפיקציה. טכניקות רבות הוצעו כדי להתמודד עם חוסר יציבות מקרומולקולרית, אבל היעילות של גישה אחת על פני אחרת תלויה במאפייני המדגם25,26. נכון לעכשיו, תוצאות הכנת הרשת מושפעות מאוד מהמומחיות והניסיון של המשתמש, מה שיכול להפוך את התהליך לגוזל זמן ומאתגר27,28. המשתנים הרבים בהם נתקלים בהכנת הדגימה והרשת מציבים אתגרים ביצירת יחסי סיבה ותוצאה, שכן החוקרים יכולים להעריך את הדגימה רק ברמה המולקולרית באמצעות המיקרוסקופ. כתוצאה מכך, סטטיסטיקה כמותית מהשוואות של פרוטוקולי הכנת מדגם ורשת שונים עדיין חסרה, ויש צורך בגישה שיטתית כדי לחקור מגמות ולהבין את המנגנונים הבסיסיים של התנהגות המדגם29.
Disclosures
כל שאר המחברים מצהירים שאין אינטרסים מתחרים.
Acknowledgements
עבודה זו נתמכה על ידי האקדמיה למחקר ותרגום של שנזן (ל- M.H.), מרכז החדשנות המתקדמת לביולוגיה מבנית (ל- M.H.), מרכז המחקר של גבול בייג'ינג למבנה ביולוגי (ל- M.H.), תוכנית המו"פ הלאומית של סין (No.2021YFA1001300) (ל- C.B.), הקרן הלאומית למדעי הטבע של סין (No.12271291) (ל- C.B.), והקרן הלאומית למדעי הטבע של סין (מס' 12071244) (לז.ס.).
Materials
| Name | Company | Catalog Number | Comments |
| CryoSPARC | Structura Biotechnology Inc. Toronto, Canada | CryoSPARC (Cryo-EM Single Particle Ab-Initio Reconstruction and Classification) is a state of the art HPC software solution for complete processing of single-particle cryo-electron microscopy (cryo-EM) data. CryoSPARC is useful for solving cryo-EM structures of membrane proteins, viruses, complexes, flexible molecules, small particles, phase plate data and negative stain data. | |
| EMPIAR-10097 Dataset | https://ftp.ebi.ac.uk/empiar/world_availability/10097/data/Particle-Stack/T40_HA_130K-Equalized-Particle-Stack.mrcs | This dataset comprises single-particle cryo-EM data of the Influenza Hemagglutinin trimer, characterized by its highly preferred orientation, collected using a 40-degree tilted collection strategy. | |
| initial.mrc | https://github.com/mxhulab/cryosieve-demos/tree/master/EMPIAR-10097 | ||
| mask.mrc | https://github.com/mxhulab/cryosieve-demos/tree/master/EMPIAR-10097 | ||
| RELION | 4.0-beta-2 | RELION (REgularised LIkelihood OptimisatioN) is an open-source software for cryo-electron microscopy (cryo-EM) data processing, particularly for refining macromolecular structures. Utilizing a Bayesian approach, it excels in separating signal from noise, enabling high-resolution structure determination. RELION supports single-particle analysis, tomography, and sub-tomogram averaging, and has become widely used in structural biology due to its effectiveness and user-friendly interface. | |
| T40_HA_130K-Equalized_run-data_CryoSPARC_refined.star | https://github.com/mxhulab/cryosieve-demos/tree/master/EMPIAR-10097 | Metadata file for the final stack of particles from EMPIAR-10097 |
References
- Bai, X. C., Fernandez, I. S., Mcmullan, G., Scheres, S. H. Ribosome structures to near-atomic resolution from thirty thousand cryo-em particles. elife. 2, 00461 (2013).
- Campbell, M. G., et al. Movies of ice-embedded particles enhance resolution in electron cryo-microscopy. Structure. 20 (11), 1823-1828 (2012).
- Li, X., et al. Electron counting and beam-induced motion correction enable near-atomic-resolution single-particle cryo-em. Nat Meth. 10 (6), 584-590 (2013).
- Grant, T., Rohou, A., Grigorieff, N. Cis tem, user-friendly software for single-particle image processing. eLife. 7, e35383 (2018).
- Scheres, S. H. Relion: Implementation of a bayesian approach to cryo-em structure determination. J Str Biol. 180 (3), 519-530 (2012).
- Punjani, A., Rubinstein, J. L., Fleet, D. J., Brubaker, M. A. Cryosparc: Algorithms for rapid unsupervised cryo-em structure determination. Nat Meth. 14 (3), 290-296 (2017).
- Kühlbrandt, W. The resolution revolution. Science. 343 (6178), 1443-1444 (2014).
- Dubochet, J., et al. Cryo-electron microscopy of vitrified specimens. Quart Rev Biophys. 21 (2), 129-228 (1988).
- Wagner, T., et al. Sphire-cryolo is a fast and accurate fully automated particle picker for cryo-EM. Comm Biol. 2 (1), 218 (2019).
- Bepler, T., et al. Positive-unlabeled convolutional neural networks for particle picking in cryo-electron micrographs. Nat Meth. 16 (11), 1153-1160 (2019).
- Wang, F., et al. Deeppicker: A deep learning approach for fully automated particle picking in cryo-em. J Str Biol. 195 (3), 325-336 (2016).
- Heimowitz, A., Andén, J., Singer, A. Apple picker: Automatic particle picking, a low-effort cryo-em framework. J Str Biol. 204 (2), 215-227 (2018).
- Glaeser, R. M. How good can single-particle cryo-em become? What remains before it approaches its physical limits. Ann Rev Biophys. 48, 45-61 (2019).
- Diiorio, M. C., Kulczyk, A. W. A robust single-particle cryo-electron microscopy (cryo-em) processing workflow with cryosparc, relion, and scipion. J Vis Exp. (179), e63387 (2022).
- Zhu, J., et al. A minority of final stacks yields superior amplitude in single-particle cryo-em. Nat Comm. 14 (1), 7822 (2023).
- Zhou, Y., Moscovich, A., Bendory, T., Bartesaghi, A. Unsupervised particle sorting for high-resolution single-particle cryo-em. Inv Probl. 36 (4), 044002 (2020).
- Méndez, J., Garduno, E., Carazo, J. M., Sorzano, C. O. S. Identification of incorrectly oriented particles in cryo-em single particle analysis. J Str Biol. 213 (3), 107771 (2021).
- Tan, Y. Z., et al. Addressing preferred specimen orientation in single-particle cryo-em through tilting. Nat Meth. 14 (8), 793-796 (2017).
- Rosenthal, P. B., Henderson, R. Optimal determination of particle orientation, absolute hand, and contrast loss in single-particle electron cryomicroscopy. J Mol Biol. 333 (4), 721-745 (2003).
- Kaur, S., et al. Local computational methods to improve the interpretability and analysis of cryo-em maps. Nat Comm. 12 (1), 1240 (2021).
- Stagg, S. M., Noble, A. J., Spilman, M., Chapman, M. S. Reslog plots as an empirical metric of the quality of cryo-em reconstructions. J Str Biol. 185 (3), 418-426 (2014).
- Vargas, J., Otón, J., Marabini, R., Carazo, J. M., Sorzano, C. Particle alignment reliability in single particle electron cryomicroscopy: A general approach. Sci Rep. 6 (1), 21626 (2016).
- Vargas, J., et al. Particle quality assessment and sorting for automatic and semiautomatic particle-picking techniques. J Str Biol. 183 (3), 342-353 (2013).
- Vargas, J., Melero, R., Gomez-Blanco, J., Carazo, J. -. M., Sorzano, C. O. S. Quantitative analysis of 3d alignment quality: Its impact on soft-validation, particle pruning and homogeneity analysis. Sci Rep. 7 (1), 6307 (2017).
- Carragher, B., et al. Current outcomes when optimizing 'standard'sample preparation for single-particle cryo-em. J Microsc. 276 (1), 39-45 (2019).
- Drulyte, I., et al. Approaches to altering particle distributions in cryo-electron microscopy sample preparation. Acta Crystallographica Sec D: Str Biol. 74 (6), 560-571 (2018).
- Glaeser, R. M. How good can cryo-em become. Nat Meth. 13 (1), 28-32 (2016).
- Kim, L. Y., et al. Benchmarking cryo-em single particle analysis workflow. Front Mol Biosci. 5, 50 (2018).
- Weissenberger, G., Henderikx, R. J., Peters, P. J. Understanding the invisible hands of sample preparation for cryo-em. Nat Meth. 18 (5), 463-471 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved