תרבית פרוסה אורגנוטיפית של חוט השדרה של עכבר לטווח ארוך כפלטפורמה לאימות השתלת תאים בפגיעה בחוט השדרה
In This Article
Summary
במאמר זה, אנו מספקים שיטה ניתנת לשחזור ליצירה ותחזוקה של פרוסות אורגנוטיפיות ארוכות טווח של חוט השדרה שהושתלו בתאי גזע עצביים כמודל ex vivo לבדיקת טיפולים תחליפיים תאיים.
Abstract
תרופות נחושות לפגיעות בעמוד השדרה (SCIs) עדיין חסרות, בשל הפתופיזיולוגיה המורכבת. אחת הגישות הרגנרטיביות המבטיחות ביותר מבוססת על השתלת תאי גזע כדי להחליף רקמות שאבדו ולקדם התאוששות תפקודית. יש להמשיך ולחקור גישה זו טוב יותר במבחנה ובאקס ויו לבטיחות ויעילות לפני שנמשיך בניסויים יקרים יותר וגוזלים זמן רב יותר בבעלי חיים. בעבודה זו, אנו מראים את הקמתה של פלטפורמה ארוכת טווח המבוססת על פרוסות אורגנוטיפיות של חוט השדרה של עכבר (SC) שהושתלו בתאי גזע עצביים אנושיים כדי לבחון טיפולים תחליפיים תאיים עבור SCIs.
תרביות אורגנוטיפיות סטנדרטיות של SC נשמרות במשך כשבועיים או שלושה במבחנה. כאן, אנו מתארים פרוטוקול ממוטב לתחזוקה לטווח ארוך (≥30 יום) למשך עד 90 יום. המדיום המשמש לגידול ארוך טווח של פרוסות SC הותאם גם להשתלת תאי גזע עצביים במודל האורגנוטיפי. תאי גזע נוירואפיתל אנושיים שמקורם ב-SC (H-SC-NES) הנושאים חלבון פלואורסצנטי ירוק (GFP) הושתלו בפרוסות SC של עכבר. שלושים יום לאחר ההשתלה, התאים עדיין מראים ביטוי GFP וקצב אפופטוטי נמוך, דבר המצביע על כך שהסביבה האופטימלית שמרה על הישרדותם והשתלבותם בתוך הרקמה. פרוטוקול זה מייצג התייחסות חזקה לבדיקה יעילה של טיפולים בתחליפי תאים ברקמת SC. פלטפורמה זו תאפשר לחוקרים לבצע סינון מקדים ex vivo של טיפולים שונים להשתלת תאים, ותסייע להם לבחור את האסטרטגיה המתאימה ביותר לפני שהם ממשיכים בניסויי in vivo .
Introduction
לפגיעה טראומטית בחוט השדרה (SCI) יש השלכות פיזיות, פסיכולוגיות וכלכליות הרסניות על מטופלים ומטפלים1. ניסיונות רבים נעשו לקדם התחדשות אקסונלית ב- SCI בגישות שונות 2,3,4 וכמה השפעות מועילות הודגמו על ידי היווצרות ממסרים עצביים בין נוירונים פרוקסימליים ודיסטליים באתר הפציעה באמצעות טיפולים בתחליפי תאים. העניין בטיפולים תאיים עדיין גדל5 מכיוון שתאים מושתלים יכולים למלא תפקידים רבים, כולל מתן תמיכה טרופית, אפנון חיסוני, חידוש מעגלים עצביים אבודים באמצעות השראת פלסטיות, החלפת תאים ורמיאלינציה של אקסונים6.
לאחרונה, המאמץ העיקרי בתחום התמקד בתאי גזע/אב עצביים אנושיים (NSCs/NPCs)7. מספר מחקרים מראים כי NSCs/NPCs מווסתים את תגובת האסטרוציטים8, מקדמים את הפרשת הגורמים הפרוגנרטיביים 9,10, ומחליפים תאים עצביים חסרים ב-SCI11,12. עם זאת, מחקרים התומכים בהתמיינות של תאים מושתלים לנוירונים פונקציונליים עדיין גרועים. יתר על כן, הישרדות התאים המושתלים וההתמיינות בחוט השדרה הפגוע (SC) הם נמוכים13, אולי משום שלתאים מושתלים לוקח מספר שבועות, אפילו חודשים, להתמיין in vivo. בנוסף, מחקרים עכשוויים לא הבהירו לחלוטין היבטים ביוכימיים, מולקולריים, תאיים ותפקודיים רבים של טיפולים בתחליפי תאים. בהקשר זה, נדרשים מודלים פשוטים, מהירים וחסכוניים כדי לחקור את מנגנוני קליטת התא, את יכולתם של תאים מושתלים להתרבות, להתמיין לסוגים או תת-אוכלוסיות ספציפיות של תאים, וליצור סינפסות עם תאי עצב שוכנים.
שילוב מחקרים היסטולוגיים ברישום אלקטרופיזיולוגי ובפרופיל שעתוק ופרוטאום הכרחי להבנה מלאה של המפל המולקולרי המתרחש לאחר השתלת תאים. זה בהחלט יאיץ את התכנון והאימות של טיפולים חדשים לתחליפי תאים במודלים פרה-קליניים ובמחקרים קליניים. ואכן, עד כה, השימוש במכרסמים, בעלי חיים גדולים ופרימטים לא אנושיים היה כדאי להבהרת תהליכים תאיים רבים לאחר השתלה14. עם זאת, בשל העלות הגבוהה, ההשפעה האתית הגבוהה, כמו גם את המורכבות של האורגניזם, השימוש בהם הוא לעתים קרובות לא פשוט או לא מספיק כדי לפענח תהליכים ביוכימיים ומולקולריים. בנוסף, הם עשויים להציג חסרונות רבים בקורלציה עם הבדלים ביולוגיים, הן בין מינים (מטבוליזם) ושונות תוך מינית (מין, גיל). גורמים אלה, יחד עם גורמים חיצוניים כגון מצבים מלחיצים, יכולים לשנות את תוצאות הניסוי ואת יכולת החיזוי שלהם במונחים של תרגום טיפולי לבני אדם 15,16,17.
לפיכך, קבוצות רבות משתמשות בתרביות תאים דו-ממדיות במבחנה ובפרוסות אורגנוטיפיות ex vivo (תרביות ex vivo) בנוסף למודלים של בעלי חיים. תרבית תאים דו-ממדית היא המערכת הנפוצה ביותר לחקר תהליכים ביולוגיים ספציפיים ברמת תא בודד ו/או אוכלוסיית תאים. עם זאת, תרביות תאים חד-שכבתיות אינן משקפות את המורכבות המצויה באורגניזם שלם. היעדר מבני רקמה וסביבה פיזיולוגית אינו מאפשר למערכות התרבית הדו-ממדיות לחקות לחלוטין היבטים מבניים, מורפולוגיים ותפקודיים מרכזיים של הרקמה הנחקרת 18,19,20.תרבויות אורגנוטיפיות יכולות להתגבר על חלק מהבעיות הללו. מודלים אורגנוטיפיים מבוססים על שתילת שבר של רקמה או איבר ותחזוקתו ex vivo לתקופה מוגבלת21,22. בפרט, פרוסות של רקמה נטוע נוצרים עם עובי מדויק המאפשר חומרים מזינים להגיע בקלות כמעט לכל התאים בפרוסות. הם יכולים להיווצר מאזורים שונים של מערכת העצבים המרכזית, כגון ההיפוקמפוס, ההיפותלמוס, המוח הקטן, התלמוס, קליפת המוח, substantia nigra וסטריאטום, וחוט השדרה23. תרביות אורגנוטיפיות שומרות על ארכיטקטורת הרקמות, על ההתפלגות המרחבית של התאים, על המגוון התאי ועל הסביבה (כלומר, הרכב המטריצות החוץ-תאיות) של איבר המוצא. יתר על כן, הם משמרים את הפעילות העצבית המקורית, קשרים בין תאים, ובפרט, מעגלים למרחקים קצרים לאחר explant.
היבטים אלה מספקים כמה יתרונות לתרבויות ex vivo ביחס הן לתרבויות חד-שכבתיות והן למודלים של בעלי חיים. הם שומרים על תכונות רקמה מרכזיות שנמצאו in vivo אך עם הפחתת העלויות והאפשרות לבצע סוגים שונים של ניסויים מולקולריים, תאיים ופונקציונליים עם ויסות מדויק של הפרמטרים הסביבתיים של התרבית 24,25,26,27,28,29. פרוסות אורגנוטיפיות יכולות להיות מנוצלות גם לפיתוח מודלים להפרעות נוירולוגיות שונות על ידי הדמיית תכונות היסטופתולוגיות מרכזיות של מצבים ספציפיים30. יתר על כן, השמירה על סביבת הרקמה הרב-תאית המקורית הופכת אותם לפלטפורמות מתאימות לבדיקת תרופות ולבדיקת מולקולות וחומרים נוירו-פרוטקטיביים ונוירו-רגנרטיביים.
בעבודה זו אנו מציעים שימוש בתרביות אורגנוטיפיות SC כמודל לייעול השתלות מל"ל. זה לא טריוויאלי מכיוון שתנאי גידול אופטימליים נדרשים כדי להבטיח את הישרדותם של המאכסן (רקמת SC) וההשתלה (NSCs) במשך שבועות. קבוצות מחקר שונות המושתלות בתרביות אורגנוטיפיות, מוחיות ונגזרות SC, סוגים שונים של תאים. רוב העבודות הראו השתלה של תאי גזע מזנכימליים31,32,33, תאי מעטפת ריח34, או NSCs35,36,37,38,39,40 והעריכו את האינטראקציות של תאים מושתלים עם התאים המארחים, הישרדות המערכת כולה, והאם התאים המושתלים התמינו לנוירונים או לתאים דמויי נוירון בתוך סביבת הרקמה Ex Vivo 32,33,41. חלקם העריכו את פוטנציאל ההתחדשות של תאים לאחר ההשתלה, והתבוננו בגדילה האקסונלית שלהם בתוך הרקמה 37,40,41, ביכולת המיאלינציה של מבשרי אוליגודנדרוציטים מושתלים 42, בנדידת התאים המושתלים לרקמה המארחת43, והאם התאים המושתלים שחררו גורמים שדחפו לסביבה מתחדשת31. מגבלה אחת של המחקרים הנוכחיים היא שהם אינם חוקרים את ההשתלה במשך תקופה ארוכת טווח.
בהתחשב בכך שנראה כי NSCs דורשים מספר שבועות כדי להבדיל in vivo 44,45, מחקר זה מתמקד כיצד ליצור ולתחזק פרוסות SC עכבר לטווח ארוך (≥30 ימים) למשך עד 90 יום. נמצא כי פרוסות שומרות על המבנה האנטומי המקורי שלהן ושומרות על קצב אפופטוטי נמוך ויציב לאורך זמן ועל כדאיות גבוהה של תאים. נצפו ביטוי מפוזר של סמנים עצביים RNA קושר שועל-1 הומולוג 3 (RBFOX3) ושרשרת אור נוירופילמנט (NFL), כאשר האחרונים הראו מגמה הולכת וגוברת של נביטה אקסונלית סביב הפרוסות לאורך זמן, המעידה על מצבן הבריא. יתר על כן, השתלנו בהצלחה בתאי גזע נוירואפיתל אנושיים המבטאים GFP (h-SC-NES) בשלבים הראשונים של התמיינות עצבית. השתל נשמר במשך 30 יום לאחר ההשתלה והתאים הראו ביטוי GFP במשך כל התקופה בתרבית. שיעור אפופטוטי של תאים ביום שלאחר ההשתלה (DPT) 30 נמצא גם הוא בקנה אחד ביחס לערך קצב אפופטוטי שנצפה ב- DPT 7 באותם תאים40. נראה כי התאים השתלבו בסביבת הרקמה ושרדו עד מספר שבועות.
לסיכום, הנתונים שלנו מראים כי ניתן לשמור בתרבית פרוסות אורגנוטיפיות SC במשך 3 חודשים מבלי לפגוע בציטוארכיטקטורה המקורית שלהן ובסביבת הרקמות. והכי חשוב, ניתן לנצל אותם כדי לבחון טיפולים תאיים לפני שממשיכים בניסוי in vivo , ובכך להפחית את העלויות ואת זמן הניסוי. כאן, אנו ממחישים בפירוט את כל הקטעים ליצירת פרוסות אורגנוטיפיות של עכבר SC וכיצד לשמור עליהם לתקופות ארוכות טווח (≥30 יום). יתר על כן, אנו מסבירים לעומק כיצד לבצע השתלת NPC לתוך הפרוסות וכיצד לשמור אותם לניתוח במורד הזרם.
Protocol
הליכים בבעלי חיים בוצעו תוך ציות קפדני לפרוטוקולים שאושרו על ידי משרד בריאות הציבור האיטלקי והוועדה האתית המקומית של אוניברסיטת פיזה, בהתאם להנחיה 2010/63/EU (רישיון פרויקט מס '39E1C. N.5Q7 פורסם בתאריך 30/10/2021). עכברי C57BL/6J הוחזקו בסביבה מווסתת (23 ± 1°C, 50 ± 5% לחות) עם מחזור אור-חושך של 12 שעות עם מזון ומים עד ליביטום.
כל העבודה הקשורה לתאי h-SC-NES בוצעה על פי הנחיות NIH לרכישה והפצה של רקמות אנושיות למטרות מחקר ביו-רפואי ובאישור ועדות החקירה האנושית וועדות האתיקה המוסדיות של כל מכון שממנו נלקחו דגימות. האישור הסופי התקבל מהוועדה לביואתיקה של אוניברסיטת פיזה (סקירה מס '29/2020). דגימות אנושיות ללא זיהוי סופקו על ידי מענק משותף MRC/Wellcome Trust (099175/Z/12/Z), Human Developmental Biology Resource (www.hdbr.org). התקבלה הסכמה מדעת מתאימה, וכל המידע הזמין שאינו מזהה נרשם עבור כל דגימה. הרקמה טופלה בהתאם להנחיות אתיות ותקנות לשימוש מחקרי ברקמת מוח אנושית שנקבעו על ידי ה- NIH (http://bioethics.od.nih.gov/humantissue. html) והצהרת WMA של הלסינקי (http://www.wma.net/en/30publications/10policies/b3/index.html).
1. הכנת תמיסות וציוד לבידוד וטיפוח חוט השדרה (SC)
- תמיסת ציפוי לתוספות ממברנה
- הכינו את תמיסת הציפוי (טבלה 1): תמיסה מימית עם 0.1 מ"ג מ"ג קולגן-1, 0.01 מ"ג מ"ג פולי-ל-ליזין ו-0.01 מ"ג מ"ל-1 למינין.
- הכניסו כל קרום לצלחת בקוטר 35 מ"מ או לצלחת בעלת 6 בארות.
- מוסיפים לחלק העליון של הממברנה 1 מ"ל של תמיסת ציפוי: לדגור על התמיסה במשך 4 שעות בטמפרטורת החדר (RT); לאחר מכן, הסר אותו ותן לממברנה להחדיר להתייבש למשך הלילה (ON). אחסנו את תוספות הממברנה בטמפרטורה של 4°C עד לשימושן.
הערה: יש לבצע את כל המעברים בתנאים סטריליים. יש לשמר את ציפוי הממברנה למשך שבוע אחד לכל היותר בטמפרטורה של 4°C לפני השימוש, כדי למנוע התפרקות חלבונים והיצמדות לא אופטימלית של פרוסה לממברנה.
- הכנת מדיה: מדיום אורגנוטיפי, מדיום דיסקציה, מדיום השתלה
- הכינו מדיום אורגנוטיפי (OM, טבלה 1).
- הכן את אמצעי הנתיחה כמתואר בטבלה 1.
- הכן את מדיום השתל (GM, אופטימיזציה מ Onorati et al.46, טבלה 1).
הערה: יש להכין תמיסות בתנאים סטריליים וממש לפני השימוש בהן (יום לפני או באותו יום של הניסוי).
- הכנת חומר לניתוח
- בארון הבטיחות הביולוגית, יש להכין לשימוש את הפריטים הבאים: סטריאומיקרוסקופ הדיסקציה וכלי הניתוח: שני זוגות מיקרו-מספריים, שני זוגות פינצטה ישרה ושני זוגות פינצטה מעוקלת.
- בארון הבטיחות הביולוגית, הכינו את מכשיר המסוק על ידי הצטיידות בלהב כדי לחתוך את ה-SC לפרוסות. סובב בורג של המסוק כדי להרים את הזרוע המתכתית במקום שבו יש למקם את הלהב. הניחו את הלהב במקום המיועד, הורידו את הזרוע המתכתית עם הלהב עד שהיא באה במגע עם סיפון החיתוך, וקבעו אותו על ידי הידוק הבורג המאובטח עם מפתח משושה עד שהלהב מאובטח היטב. סובבו את הבורג המיקרומטרי לעובי הפרוסה הרצוי (בדרך כלל 350 מיקרומטר). בדוק אם הלהב ממוקם בניצב מדויק לסיפון החיתוך.
הערה: מיקום מאונך מדויק של הלהב ביחס לסיפון החיתוך נחוץ כדי לבצע את החיתוך כראוי. - מכינים בארון הבטיחות הביולוגית: שתי פיפטות פסטר מפלסטיק (הכרחיות להזזת SC מבודד והפרוסות), לפחות ארבע צלחות 35 מ"מ ושתי צלחות 60 מ"מ, וקופסת קרח טרי.
- יש לעקר את כל המכשירים עם 70% אתנול ו-UV (מחזור אחד של 20 דקות) ממש לפני השימוש בהם כדי לשמר את עקרות התרבית.
2. בידוד של עכבר SC ויצירת פרוסות
- בידוד של עכבר SC
- להקריב גורי עכברים לאחר יום 3 (P3) בהתאם לרישיון הפרויקט.
- באמצעות לפרוטומיה בקו האמצע עם המיקרו-מספריים, בודדו את האזור המותני של עמוד השדרה משאר גוף העכבר והכניסו אותו למדיום דיסקציה קר בצלחת 35 מ"מ.
- באמצעות סטריאומיקרוסקופ דיסקציה והמיקרו-מספריים, חתכו את עמוד השדרה לאורך ציר הקשת, והשתמשו בפינצטה ישרה כדי להסיר בעדינות את ה-SC מחלל עמוד השדרה.
- יש לקלף בזהירות את קרומי המוח מהאזור המותני המבודד של ה-SC באמצעות פינצטה ישרה.
- מעבירים ודגרים על האזור המותני SC המבודד בתווך דיסקציה קר וטרי למשך 10-15 דקות לפני שממשיכים לשלב הבא.
- יצירת פרוסות
- על ידי שימוש בפיפט פסטר פלסטיק אחד, קחו את האזור המותני המבודד SC ממדיום הדיסקציה והניחו אותו על סיפון החיתוך של מכשיר המסוקים, בניצב ללהב.
הערה: מיקום נכון של ה-SC ביחס ללהב (מאונך) חיוני ליצירה נכונה של פרוסות SC. - הסר את מדיום הדיסקציה השיורי על הסיפון סביב SC בעזרת פיפטת פסטר ונייר סופג סטרילי. המשך עם חתכים אוטומטיים של SC.
- לאחר יצירת הפרוסות, הניחו מעט מדיום דיסקציה טרי עם פיפטה של פסטר על סיפון החיתוך עם הפרוסות. לאחר מכן, לאסוף את הפרוסות לתוך צלחת 35 מ"מ עם מדיום דיסקציה טרי לדגור אותם במשך 15 דקות.
- במהלך הדגירה פורסים, שוטפים את פני השטח של הממברנה מוסיף 3x עם OM באמצעות פיפטה פסטר פלסטיק. לאחר מכן, השאר 1 מ"ל של OM בתחתית כל תוספת ממברנה.
- בדקו את הפרוסות מתחת לסטריאומיקרוסקופ הדיסקציה. זרעו את מספר הפרוסות הרצוי על תוספות הממברנה המותנות על ידי העברתן עם פיפטת פסטר מפלסטיק.
- מעבירים את הפרוסות בכיוון הרצוי ובמיקום הרצוי על תוספות הממברנה בעזרת הפינצטה הישרה. מוציאים את עודפי המדיום בעזרת פיפטת פסטר כדי לאפשר לפרוסות להיצמד טוב יותר למשטח הממברנה.
הערה: הזזת וכיוון הפרוסות בפינצטה הישרה צריכה להתבצע בעדינות כדי למנוע נזק לרקמות או לממברנה. - לאחר דגירה של 30 דקות ב-37°C, מעבירים את האינסרט לצלחת פטרי חדשה.
הערה: גע בטבעת הפלסטיק אך לא בקרומים במהלך שינוי בינוני. - הוסף 1 מ"ל של OM טרי בתוספת גורם נוירוטרופי נגזר קו תאי גליה (GDNF) 100 מ"ג מ"ל-1 בתחתית תוספת הממברנה.
- לדגור את הפרוסות ב 37 °C. התייחס ליום הראשון בתרבות כיום ex vivo (DEV) 0.
- על ידי שימוש בפיפט פסטר פלסטיק אחד, קחו את האזור המותני המבודד SC ממדיום הדיסקציה והניחו אותו על סיפון החיתוך של מכשיר המסוקים, בניצב ללהב.
3. טיפוח ארוך טווח של פרוסות אורגנוטיפיות
- שומרים על הפרוסות בתרבית בטמפרטורה של 37 מעלות צלזיוס עד לנקודות הזמן הרצויות.
- החלף את המדיום ב- OM טרי ב- DEV 1 כמתואר בשלבים 2.2.7-2.2.8.
- ב- DEV 3, העבר את המדיום ל- GM כדי ליצור את הסביבה המתאימה להשתלת תאי גזע ביום שאחרי. החלף את המדיום ב- GM טרי כל 48 שעות (לדוגמה, DEV 5, DEV 7...).
- הוסף GDNF טרי (ריכוז סופי 100 מיקרוגרם mL-1) למדיום כל יום עד DEV 7. לאחר DEV 7, הוסף אותו רק כאשר המדיום משתנה (שלב 3.3).
4. גידול תאי h-SC-NES
הערה: תאי H-SC-NES נשמרים בתרבית בנוכחות גורמי גדילה (מדיום NES, שלב 4.1.1). לפני ההשתלה, התאים מצופים במצב טרום התמיינות במשך 7 ימים על ידי הסרת גורמי הגדילה מהמדיום (מדיום קדם-התמיינות (מדיום NES ללא גורם גדילה פיברובלסטי 2 (FGF-2) וגורם גדילה אפידרמלי (EGF), שלב 4.1.2). לאחר מכן, התאים מצופים במצב התמיינות (מדיום התמיינות שלב 4.1.3) במשך יומיים לפני ההשתלה. ההבחנה נתמכת על ידי הוספת תוספים נוירוטרופיים (גורם נוירוטרופי מוחי, BDNF) למדיום הדיפרנציאציה. התחזוקה, הפיצול, קדם-התמיינות וההתמיינות של תאי h-SC-NES12,46 מתוארים בפירוט להלן.
- הכנת מדיה: NES, מדיה טרום בידול ובידול
- הכנת אמצעי תחזוקת תאי h-SC-NES (מדיום NES, טבלה 1).
- הכן מדיום קדם-התמיינות של תאי h-SC-NES (מדיום קדם-התמיינות, טבלה 1).
- הכינו מדיום התמיינות תאי h-SC-NES (מדיום התמיינות, טבלה 1). הוסף BDNF טרי כאשר המדיום משתנה או כאשר התאים מצופים בפעם הראשונה בתנאי ההתמיינות.
הערה: כל המדיה צריכה להיות מוכנה בתנאים סטריליים ויש לסנן אותה עם מסננים של 0.22 מיקרומטר.
- פתרון ציפוי לתאי h-SC-NES
הערה: תאי h-SC-NES נשמרים בתמיכות תרבית מצופות POLFN (POLFN = Poly-L-Ornithine, Laminin, Fibronectin).- הכינו את תמיסת הציפוי בצינור: תמיסת Poly-L-Ornithine עם למינין (5 מיקרוגרם מ"ל−1) ופיברונקטין (1 מיקרוגרם מ"ל−1).
- העבירו את תמיסת הציפוי המוכנה לתמיכה בתרבית התא, תוך הקפדה להוסיף מספיק כדי לכסות את כל פני השטח של תמיכת תרבית התא. לדגור על הציפוי במשך 1 שעה ב 37 ° C או לילה ב 4 ° C.
- הסר את תמיסת הציפוי מתומכי תרבית התא.
הערה: ניתן למחזר את תמיסת POLFN פעמיים נוספות, אך יש להוסיף למינין ופיברונקטין טריים בכל פעם. - שטפו את הציפוי 3x במים סטריליים בדרגת תרבית תאים. אחסנו את הציפויים בטמפרטורה של 4°C או השתמשו בהם.
הערה: יש להשתמש בציפויים תוך שבוע. לאחר מכן, הציפויים נחשבים פגי תוקף בגלל תהליכי פירוק של החלבונים המוספים.
- תחזוקת תאי h-SC-NES
- לשמור על תאי h-SC-NES בתרבית בתווך NES. בדוק את התאים כל יום תחת המיקרוסקופ כדי לפקח כאשר הם מגיעים למפגש.
- החליפו חצי מדיום כל יומיים: הסירו מחצית מהתווך המותנה והוסיפו את התווך הטרי (קחו בחשבון 20% אידוי).
- אם התאים מגיעים למפגש, המשך בפיצול, כמתואר בשלב 4.4.
- מעבר תאי h-SC-NES
הערה: התאים מפוצלים באופן הבא12:- הסר את המדיום המותנה ושטוף תאים פעם אחת עם מלח חוצץ פוספט (DPBS) של Dulbecco ללא Ca2+/Mg2+.
- הסר את DPBS והוסף תמיסת טריפסין/EDTA לתאים כדי לבצע ניתוק אנזימטי. לדגור על תאים בטמפרטורה של 37°C למשך 30 שניות עד 1 דקות.
- לאחר הדגירה, בדקו את התאים מתחת למיקרוסקופ: אם הם אינם מנותקים, הקישו מעט על תמיכת תרבית התאים כדי לבצע ניתוק מכני ודגרו עליהם בטמפרטורה של 37 מעלות צלזיוס למשך 30 שניות נוספות.
- לאחר הדגירה, יש להשבית את טריפסין/EDTA על ידי הוספת 4 נפחים של DPBS/תמיסת סרום בקר עוברי (FBS) (10% vol/vol) לתמיכה בתרבית תאים עם תאים וטריפסין/EDTA. יש לקלף בעדינות את התמיסה על גבי השטח התומך בתרבית תאים למעלה ולמטה כדי לעזור לכל התאים להתנתק. אספו את תרחיף התא בצינור.
- צנטריפוגה את מתלה התא ב 200 × גרם במשך 3 דקות. יש להשליך את הסופרנאטנט ולתלות מחדש את הגלולה בתווך NES טרי.
- ספרו את התאים והניחו אותם על כל תרבית חדשה מצופה POLFN בצפיפות של ̴0.5-1 × 105 תאים לסמ"ק2.
- הוסף Y-27632 (10 מיקרומטר) ומקם את התאים ב 37 ° C. בדוק אותם כל יום עד למפגש ואז פצל אותם שוב לתחזוקה/הרחבה או בנקאות סלולרית.
- התמיינות מוקדמת של תאי h-SC-NES
- פצל את התאים כמתואר בשלב 4.4.
- לוחית את התאים על תרבית תאים מצופה POLFN תומך בצפיפות של ̴0.5-1 × 105 תאים / ס"מ2 בתווך התמיינות. הוסף Y-27632 (10 מיקרומטר) לאחר הפיצול. התקשר ליום הראשון ביום טרום דיפרנציאציה במבחנה (DIV) 0.
- שנה מחצית מהמדיום כל 2-3 ימים (ראה שלב 4.3.2).
- שמור על התאים במצב קדם-התמיינות עד DIV 7 ולאחר מכן המשך לשלב 4.6.
- התמיינות תאי h-SC-NES
- ב- DIV 7 של קדם-הבחנה, פצל את התאים כמתואר בשלב 4.4.
- לוחית את התאים על תרבית תאים מצופה POLFN תומך בצפיפות של ̴1-1.5 × 105תאים / ס"מ2בתווך התמיינות. הוסף Y-27632 (10 μM) ו- BDNF (30 ng mL−1) לאחר הפיצול.
- לאחר יומיים של התמיינות (DIV 10), לפצל את התאים להשתלה לפרוסות.
5. התמרה של תאי h-SC-NES עם וקטורים לנטי-ויראליים נושאי GFP
הערה: התמרה של תאים מתבצעת בשלב התחזוקה של תאי h-SC-NES. כאשר תאים מומרים כראוי, ניתן להרחיב אותם וליישם פרוטוקולי קדם-התמיינות והתמיינות שתוארו קודם לכן (שלבים 4.5 ו-4.6).
- הכנת מדיום התמרה התא
הערה: תווך התמרה של תאים מוכן על ידי ערבוב נפח מסוים של תווך NES ונפח מדויק של הכנת מלאי וקטורי לנטיויראלי (LVS) על פי פרמטרים שונים: MOI הרצוי (ריבוי זיהום = יחס בין מספר החלקיקים הנגיפיים למספר התאים המארחים בתווך זיהום נתון); מספר התאים המצופים; הריכוז הראשוני של הכנת LVS (=LVS PFU, יחידה יוצרת-פלאק); שטח הפנים של כלי התרבות המשומש.- חשב את הנפח הנכון של הכנת LVS שיש להוסיף למדיום NES, בהתאם ל- MOI שנבחר באמצעות משוואות (1) ו- (2).
(n תאים לצלחת/ס"מ2) × ס"מ2 תמיכה בתרבית תאים × MOI = LVS PFU עבור MOI שנבחר (1)
LVS PFU : Tot Initial LVS Vol (μL) = LVS PFU עבור MOI : LVS Vol להוספה בינונית (μL)(2)
הערה: ה-PFU של LVS (PFU ראשוני של LVS) ונפח ה-LVS הראשוני הכולל ניתנים על-ידי היצרן. ה- PFU של LVS עבור MOI שנבחר מחושב כמתואר במשוואה (1). לפיכך, אנו יכולים לקבל את נפח הכנת LVS שיש להוסיף לנפח הכולל של תווך NES (בהתבסס על תמיכה בתרבית תאים) עבור MOI שנבחר, כמתואר במשוואה (2).
דוגמה: השתמשנו ב-MOI 3, בהתבסס על ניסיון מעבדה קודם (MOI יכול להשתנות בהתאם לקו התאים המשומשים ולתכשיר הנגיפי). אם MOI הרצוי הוא 3, מספר התאים שיש לצפות הוא 0.5 × 105/cm2, ותמיכת התרבית היא 1 באר-MW24 (2 ס"מ2), בהנחה שה- LVS PFU/TU (יחידה יוצרת/יחידת מתמר) הראשונית היא 25 × 106 PFU ב- 1 מ"ל (1,000 μL = כרך LVS ראשוני), החישובים הם כדלקמן:
תאים מצופים בבאר 1 MW24 (2 ס"מ2) = 0.5 × 105 תאים × 2 ס"מ2 = 1 × 105 תאים
1 × 105 תאים × 3 (MOI) = 3 × 105 PFU = LVS PFU עבור MOI 3
25 × 106 PFU:1,000 μL = 3 × 105 PFU:x μL
x μL = 12 μL = נפח LVS להוסיף למדיום
לכן, כדי להתמיר את התאים עם תווך התמרה התא עם MOI 3 ב 1 באר MW24, להוסיף 12 μL של הכנה ראשונית LVS למדיום NES (238 μL) מוכן עבור 1 באר של MW24. הנפח הכולל הסופי הוא 250 μL.
הערה: המדיום מוכן בדרך כלל טרי ביום ההתמרה בתנאים סטריליים.
- חשב את הנפח הנכון של הכנת LVS שיש להוסיף למדיום NES, בהתאם ל- MOI שנבחר באמצעות משוואות (1) ו- (2).
- פרוטוקול התמרה h-SC-NES
- לוחות h-SC-NES במעבר נמוך על צלחת 24-multi well מצופה POLFN (או בכל תמיכת תרבית אחרת) בצפיפות של 0.5 × 105/cm2 בתווך NES.
- למחרת, אספו את תווך ה-NES המותנה מהבארות שבהן צופו התאים. בהתאם לתמיכה בתרבית שנבחרה, הוסף לתאים את הנפח הנמוך ביותר של אמצעי התמרה של תאים טריים הדרוש לכיסוי אחיד של משטח הזריעה (למשל, 250 מיקרוליטר / באר של צלחת 24 רב-באר).
- לאחר מכן, לדגור על תאי h-SC-NES במשך 6 שעות ב 37 ° C. לאחר מכן, הוסף את המדיום המותנה שנאסף בעבר לתאים (200 μL / באר של צלחת 24-multiwell) ודגר את התאים ON ב 37 ° C.
- למחרת, שטפו את תאי h-SC-NES פעם אחת עם DPBS ובצעו שינוי בינוני כולל (NES medium).
- בימים שלאחר מכן, בדוק את התאים תחת מיקרוסקופ פלואורסצנטי כדי לצפות בביטוי GFP.
- הרחבת תאי h-SC-NES לבנקאות תאים והשתלות.
6. השתלת תאים בפרוסות SC וגידול משותף
- הכנת מיקרו-מחטים מזכוכית
- השתמש במושך כדי להשיג מחטים עדינות מנימי זכוכית בורוסיליקט. הגדר את המושך באופן הבא: חום 990, PULL 350.
הערה: מנימים אחד, ניתן להשיג שתי מחטים עדינות.
- השתמש במושך כדי להשיג מחטים עדינות מנימי זכוכית בורוסיליקט. הגדר את המושך באופן הבא: חום 990, PULL 350.
- הכנת תאים להשתלה
- פצל את התאים כמתואר בשלב 4.4.
הערה: אם התאים אינם מבטאים כתב פלואורסצנטי, תייגו אותם בצבע מעקב אחר תאים כדי לפקח עליהם באמצעות מיקרוסקופ פלואורסצנטי לאחר ההשתלה ובמהלך תרבית ארוכת טווח. בצע את פרוטוקול היצרן שנבחר לשלב התוויה. - ספרו את התאים לאחר הפיצול והצנטריפוגה ב 200 × גרם במשך 3 דקות. להשעות את הגלולה המתקבלת עם מדיום טרי + Y-27632 (10 מיקרומטר) כדי לקבל את הריכוז הרצוי של תאים (בדרך כלל טווח בין 30,000-50,000 תאים μL-1).
- מעבירים את תרחיף התא לתוך צינור של 500 μL או 1.5 מ"ל ומניחים אותו על קרח. התאים מוכנים להשתלה.
- פצל את התאים כמתואר בשלב 4.4.
- השתלת תאים בפרוסות אורגנוטיפיות
הערה: בצע השתלות תאי H-SC-NES בפרוסות אורגנוטיפיות של עכבר SC באמצעות מיקרו-מזרק אוויר ומחטי זכוכית.- טען מיקרו-מחט זכוכית עם 4 μL של תרחיף תאים באמצעות micropipette וקצוות micro-loader.
הערה: הימנע היווצרות בועות אוויר במחט מכיוון שזה עלול לעכב את תהליך המיקרו-הזרקה. אם נוצרות בועות, הסר אותן עם המיקרופיפטה. - הניחו את המחט בתמיכה שהוקצתה למיקרו-מזרק ושברו את קצה המחט באמצעות הפינצטה הישרה.
הערה: שברו את מחט הזכוכית קרוב יותר לקצה כדי למנוע היווצרות חורים גדולים. - לפני ההשתלה לתוך פרוסות, להגדיר את הפרמטרים microinjection. הגדר את הלחץ על 10 psi.
הערה: ניתן לשנות את ערך הלחץ בהתבסס על המיקרו-מזרק ותצפיות המפעיל: הלחץ צריך להספיק כדי להזריק במיקרו את מתלה התא, ובכך להימנע מנזק לרקמות. - על מגלשת זכוכית מכוילת, לשים טיפה של שמן מינרלי עם פיפט פסטר מיקרו להזריק את תרחיף התא לתוך הטיפה. קוטר הכדור המתקבל של השעיית התא בטיפת השמן מתואם עם נפח מיקרו-הזרקה ספציפי. שנה את פרמטרי המיקרו-הזרקה לפי הצורך כדי להגיע לקוטר כדור תרחיף התא של 0.2 מ"מ להזרקת 4nL.
- לאחר הגדרת עוצמת הקול הנכונה, הזריקו את תרחיף התא במהירות לתוך הפרוסות. בדוק תחת סטריאומיקרוסקופ פלואורסצנטי את נוכחות התאים בפרוסות כדי לוודא שהמיקרו-הזרקה/השתלה הצליחה.
הערה: מתלה התא עלול לפעמים לחסום את המחט: במקרה זה, נסה להסיר את הסתימה של תרחיף התא על ידי שינוי פרמטרי ההזרקה או לטעון מחט חדשה עם תרחיף תא טרי. - לאחר ההשתלה מניחים את הפרוסות בטמפרטורה של 37°C ו-5%CO2עד לנקודת הזמן הרצויה ומבצעים שינוי בינוני אחת ליומיים כמתואר בשלבים 2.2.7-2.2.8.
- טען מיקרו-מחט זכוכית עם 4 μL של תרחיף תאים באמצעות micropipette וקצוות micro-loader.
7. צביעה immunofluorescence
- יום 1
- מוציאים את המדיום מתחתית הממברנה ושוטפים את הפרוסות 3x עם DPBS שחומם מראש.
- תקן את הפרוסות עם 4% פורמלדהיד שחומם מראש (FA): הסר את DPBS והוסף 1.5 מ"ל של 4% FA בתחתית הממברנה להוסיף עם הפרוסות. לאחר דגירה של 15 דקות ב- RT, הוסף 1 מ"ל יותר של 4% FA על פני השטח העליונים של החדרת הממברנה ודגר במשך 15 דקות ב- RT. זמן קיבוע כולל: 30 דקות ב- RT
- הסר את 4% FA ושטוף את הפרוסות במשך 3 x 10 דקות עם DPBS.
- חותכים את הממברנה של הכנס באופן היקפי עם סכין כירורגית, להפריד את הממברנה עם פרוסות מן הרכיב הפלסטי של העלון, ולהמשיך עם השלבים immunofluorescence.
הערה: לאחר שלב זה, הקרום עם הפרוסות צף ב- DPBS בצלחת. - חדיר עם 1 מ"ל/ממברנה של תמיסה עם 0.7% טריטון ב-DPBS למשך 10 דקות ב-RT.
- הסר את תמיסת החדירה ודגר על הדגימות במשך 4 שעות ב 4 ° C עם 1 מ"ל / ממברנה של פתרון חוסם המורכב 0.5% טריטון, 10% FBS ב DPBS.
- הסר את הפתרון החוסם והוסף לפרוסות את הנוגדנים העיקריים בדילול העבודה שלהם, למשל, נוגדן נגד נוירופילמנט עכבר (NFL), 1:500; ארנב נגד NFL, 1:500; נוגדן ארנב נגד RBFOX3 (NeuN), 1:400; ארנב אנטי פעיל קספאז-3 (aCASP3), 1:400; גרעינים אנטי-אנושיים של עכברים, (Hu-Nu), 1:400; ארנב אנטי-הו-נו, 1:400; עכבר אנטי GFP, 1:400 (כפי שדווח טבלה 1) ב 1 מ"ל של תמיסת נוגדנים המורכבת 0.5% טריטון, 1% FBS ב DPBS. לדגור על ב 4 ° C.
- יום 2
- שטפו את הממברנות במשך 3 x 10 דקות עם 1-2 מ"ל של DPBS.
- לדגור על הממברנה עם נוגדנים משניים (למשל, נוגדן משני מסוג IgG (H+L) נגד עכבר, Alexa Fluor 488, 1:500; נוגדן משני מסוג IgG (H+L) נגד ארנב, Alexa Fluor 568, 1:500; נוגדן משני מסוג IgG (H+L) נגד עכבר, Alexa Fluor 647, 1:500; נוגדן משני נגד ארנב מסוג IgG (H+L), Alexa Fluor 647, 1:500 כפי שדווח טבלה 1) ו-Hoechst/DAPI עבור גרעינים מדוללים ב-1 מ"ל/ממברנה של תמיסת נוגדנים (טריטון 0.5% + FBS 1% ב-DPBS) למשך 3 שעות ב-RT.
הערה: יש להגן בזהירות על הדגימות מפני האור כדי למנוע הלבנת נוגדנים משנית במהלך הדגירה ובשלבים הבאים. - הסר את תמיסת הנוגדנים ושטוף במשך 3 x 10 דקות עם DPBS (1-2 מ"ל).
- החלף את ה-DPBS ב-DPBS טרי ואחסן בטמפרטורה של 4°C בתנאים מוגנים מפני אור.
- בסוף פרוטוקול immunofluorescence, להרכיב את הממברנות על שקופיות זכוכית. שים טיפה של 200 μL של פתרון הרכבה על מגלשת זכוכית. בעזרת פינצטה ישרה, להעביר את הקרום הצף מן צלחת 35 מ"מ על החלקה כיסוי ולאחר מכן, להעביר את הממברנה על מגלשת זכוכית עם פתרון הרכבה.
- שים טיפה של 100 μL של פתרון הרכבה על כיסוי חדש לכסות עם זה, לתקן אותו על שקופית זכוכית. הניחו לו להתייבש למשך הלילה מתחת למכסה המנוע הכימי בתנאים מוגנים מפני אור.
- אחסנו את הדגימות בטמפרטורה של 4°C בחושך או בצעו ניתוח הדמיה.
8. בדיקה חי/מת
- הכן את פתרון העבודה על ידי ציטוט של 700 μL לכל צלחת של מדיום טרי והוסף בדילול העבודה הנכון את Sytox (למשל, רכיב B, 1:2,000) ואת Calcein AM (למשל, רכיב A, 1:2,000).
הערה: מכיוון שהריאגנטים רגישים לאור, הגן על פתרון העבודה מפני אור. - הערך את הנפח הבינוני בתחתית הממברנה והוסף את Sytox ואת Calcein AM באותו דילול עבודה המתואר בשלב 8.1.
- הוסף 2 טיפות של 30 μL כל אחת בחלק העליון של כל פרוסה של פתרון העבודה מוכן בשלב 8.1.
הערה: הגנו על הכלי מפני אור על ידי הנחתו בתנאים חשוכים. - דוגרים על הפרוסות במשך 30 דקות ב-RT.
- לאחר הדגירה, לחתוך את הממברנה היקף מן הכנס עם סכין כירורגית: לאחר מכן, הקרום עם פרוסות צף בתמיסת העבודה.
- הניחו את הממברנה ללא תמיסת הרכבה הפוכה על כיסוי בעזרת פינצטה ישרה והוסיפו 100 מיקרוליטר של DPBS על גבי הממברנות כדי לשמור עליהן רוויות לחות.
- קבל תמונות חיות באמצעות המיקרוסקופ הקונפוקלי מהר ככל האפשר.
הערה: הוסף 2 טיפות של 40 μL כל אחת של DPBS בחלק העליון של הממברנה כל 30 דקות במהלך רכישת התמונה כדי למנוע את התייבשות הממברנה.
9. הדמיה
- הדמיה קונפוקלית של דגימות קבועות
- לניתוח איכותני, רכשו תמונות באמצעות מיקרוסקופ קונפוקלי עם פרמטרי הרכישה הבאים: הגדר את אפשרות התמונה הגדולה (בחר: 4 x 4), השתמש ב- 10 x objective, ללא ערימות ורזולוציה של 3,634 x 3,634 פיקסלים.
- לניתוח כמותי (aCASP3, Calcein ו-Sytox לפרוסות ו-aCASP3 לתאים), רכשו תמונות באמצעות המיקרוסקופ הקונפוקלי עם פרמטרי הרכישה הבאים: 20 x אובייקטיבי, רזולוציה של 1,024 x 1,024 פיקסלים עם Z-step של 3 מיקרומטר.
- הדמיה חיה של פרוסות מושתלות באמצעות הסטריאומיקרוסקופ
הערה: צלם תמונות באמצעות הסטריאומיקרוסקופ במצבי brightfield ו-epifluorescence.- בעזרת הגדרת שדה בהיר , קבלו תמונות של הפרוסות (1 x מטרה עם זום של 3x המשמש כאן).
הערה: שנה את האור בהתאם למיקרוסקופ המשומש והשתמש בסיבים האופטיים במידת הצורך. - באמצעות הגדרת הפלואורסצנטיות , קבל תמונות של התאים המושתלים עם אותה מטרה וזום המשמשים לפרוסות (ראה שלב 9.2.1). השתמש בפרמטרים הבאים עבור הרכישה: רווח 1, חשיפה 200-500 ms, קיזוז -10.
- בעזרת הגדרת שדה בהיר , קבלו תמונות של הפרוסות (1 x מטרה עם זום של 3x המשמש כאן).
- הדמיה חיה לאחר בדיקת Live/Dead באמצעות מיקרוסקופ קונפוקלי
- קבל תמונות באמצעות מיקרוסקופ קונפוקלי עם פרמטרי הרכישה הבאים: 20x אובייקטיבי, רזולוציה 1,024 x 1,024 פיקסלים עם Z-step של 3 מיקרומטר.
10. ניתוח תמונה על ידי ImageJ
- ניתוח אזורי NFL, RBFOX3 ו- DAPI
- פתח את תוכנת ImageJ (https://imagej.net/software/imagej/).
- פתח את תמונת הקובץ על-ידי לחיצה על קובץ | פתח | בחר קובץ | פתוח.
- בחלון המוקפץ, בחר Stack viewing | מצב Hyperstack וצבע | ברירת מחדל (עם קנה מידה אוטומטי).
- בסרגל הכלים, בחר תמונה | צבע | ערוצים מפוצלים.
- בחר את הערוצים הרצויים לניתוח: ערוץ ירוק עבור NFL (סמן אקסונלי), ערוץ אדום עבור RBFOX 3 (סמן עצבי), וערוץ כחול עבור DAPI (צביעה גרעינית).
- לניתוח NFL, המשך בשלבים הבאים: בסרגל הכלים בחר תמונה | התאמה | סף | בחר את הפרמטרים (רקע כהה, אלגוריתם, למשל, ברירת מחדל) והזז את הסמן בשורת הערכים (מתחת/מעל) כדי לכסות ולהקיף את כל אזור הנוריט (נוירוטים מודגשים בלבן ברקע כהה) | סט | החל.
- בחר מסרגל הכלים את כלי העקיבה שרביט והשתמש בו כדי להגדיר אוטומטית את האזור הלבן המכוסה על-ידי NFL. ניתוח עיתונות | מדידה | ערך שטח במיקרומטר2.
- עבור ניתוח DAPI ו- RBFOX3, המשך בשלבים הבאים: בסרגל הכלים, בחר תמונה | התאמה | סף | בחר את הפרמטרים (רקע לבן, אלגוריתם, למשל, ברירת מחדל) והזז את הסמן בסרגל הערכים (מתחת/מעל) כדי לכסות ולהקיף את כל אזור RBFOX3 או DAPI | סט | החל.
- בסרגל הכלים, בחר תהליך | מניית FFT | מסנן פסים. השתמש בסרגל ערכי הסף כדי להתאים את האזור הלבן המכוסה על-ידי RBFOX3 או DAPI, בהתאם לאות הפלואורסצנטיות שלהם.
- בסרגל הכלים, בחר בכלי העקיבה שרביט והשתמש בו כדי להגדיר אוטומטית את האזור המכוסה על-ידי RBFOX3 או DAPI. ניתוח עיתונות | מדידה | ערך שטח במיקרומטר2.
- ניתוח אפופטוזיס על ידי ImageJ
- פתח את תוכנת ImageJ (https://imagej.net/software/imagej/).
- פתח את תמונת הקובץ Z-stack על-ידי לחיצה על קובץ | פתח | בחר קובץ | פתוח.
- בחלון המוקפץ, בחר Stack viewing | מצב Hyperstack וצבע | ברירת מחדל (עם קנה מידה אוטומטי).
- בסרגל הכלים, בחר תמונה | צבע | ערוצים מפוצלים.
- בחר את הערוצים הרצויים: ערוץ אדום עבור aCASP3 (סמן אפופטוזיס לניתוח) וכחול או ציאן עבור DAPI או Hu-Nu עבור גרעינים. לאחר מכן, שכבו-על את הערוצים על-ידי בחירה בסרגל הכלים תמונה | צבע | מיזוג ערוצים | צור מורכב.
- גררו את סרגל Z בתחתית התמונה כדי לדפדף בערימת Z של התמונה ולזהות ערימות באזור המרכזי של הפרוסות עם aCASP3 חיובי.
- בסרגל הכלים, בחר תוספים | ניתוח | מונה תאים.
- בחלון הנפתח שנפתח, בחר Initialize כדי להכין את התמונה לספירה; לאחר מכן, בחר סוג מונה (לדוגמה, Type 1) ושנה את שמו כאובייקט שיש לספור (לדוגמה, תאי aCASP3+ ). שנה שמות של סוגי מונים אחרים כמתואר לעיל כדי לספור אובייקטים אחרים (לדוגמה, תאי DAPI+ או Hu-Nu+ עבור מספר התאים הכולל).
- בחלון הקופץ, בחרו את סוג המונה המתאים לעצם שיש לספור (לדוגמה, תאי aCASP3+ ), לאחר מכן בחרו בכלי נקודה בסרגל הכלים והתחילו לספור ידנית את מספר התאים האפופטוטיים, חיוביים ל-aCASP3, תוך לחיצה על כל אחד מהם בתמונה שנפתחה.
- בחר סוג מונה אחר בחלון מונה התאים והתחל לספור את מספר התאים הכולל (תאי DAPI+ , לפרוסות; תאי Hu-Nu+ , לתאים מושתלים).
- ניתוח של בדיקת Live/Dead על ידי ImageJ
- פתח את תוכנת ImageJ (https://imagej.net/software/imagej/).
- פתח את תמונת הקובץ Z-stack על ידי לחיצה על קובץ | פתוח | בחר קובץ | פתוח.
- בחלון המוקפץ, בחר Stack viewing | מצב Hyperstack וצבע | ברירת מחדל (עם קנה מידה אוטומטי).
- בסרגלי הכלים, בחר תמונה | צבע | ערוצים מפוצלים.
- בחר את הערוצים הרצויים: ערוץ ירוק עבור Calcein (סמן חיוניות לנתח) וערוץ ציאן עבור Sytox (סמן מת). לאחר מכן, שכבו-על את הערוצים על-ידי בחירה בסרגל הכלים תמונה | צבע | מיזוג ערוצים | בחר צור ללא הפרדות צבע.
- גררו את סרגל Z בתחתית התמונה כדי לדפדף בערימת Z של התמונה ולזהות ערימות באזור המרכזי של הפרוסות עם חיוביות של Calcein ו-Sytox.
- בסרגל הכלים, בחר תוספים | ניתוח | מונה תאים.
- בחלון הנפתח שנפתח, בחר Initialize כדי להכין את התמונה לספירה; לאחר מכן בחר סוג מונה (לדוגמה, Type 1) ושנה את שמו כאובייקט שיש לספור (לדוגמה, תאי Calcein+ ). שנה שמות של סוגי מונים אחרים כמתואר לעיל אם יש צורך לספור אובייקט אחר (לדוגמה, תאי Sytox+ ).
- בחלון המוקפץ, בחר את סוג המונה המתאים לאובייקט שברצונך לספור; לאחר מכן בחר בכלי נקודה בסרגל הכלים והתחל לספור ידנית את מספר תאי Calcein+ , תוך לחיצה על כל אחד חיובי בתמונה שנפתחה.
- בחר סוג מונה אחר בחלון מונה התאים וספור את תאי Sytox+ כמתואר עבור Calcein.
11. גרפים וניתוח סטטיסטי
- בצע את כל הניתוחים הסטטיסטיים והגרפים העלילה באמצעות התוכנה הנבחרת.
Representative Results
השיטות המתוארות מאפשרות הקמת פרוסות אורגנוטיפיות SC מעכברים בשלב P3 ותחזוקתן בתרבית למשך זמן ממושך בתנאים בריאים. יתר על כן, אנו מראים פרוטוקול להשתלת תאים בפרוסות ולגידול משותף שלהן למשך עד 30 יום (איור 1). ראשית, אנו מראים אופטימיזציה של תנאי התרבית ופרוטוקול המתאים לגידול ממושך של פרוסות SC עם תאים מושתלים (איור 2A). פרוסות נוצרות ומתוחזקות מ-DEV 0 עד DEV 2 ב-OM, שהוצע במקור כמדיום אופטימלי לתחזוקת פרוסות SC47. עם זאת, בשל נוכחותם של חלבונים בסרום, מדיום זה יכול להיות suboptimal כדי לקיים את ההתמיינות העצבית ואת ההתבגרות של תאים מבשר עצבי מושתל. ואכן, ב-DEV 3 בדקנו את המעבר מ-OM ל-GM, פורמולציה המכילה Neurobasal בתוספת B27, התומכת בהישרדות עצבית, וללא סרום, המעכב את ההתמיינות העצבית הנכונה, ומקדם במקום זאת גורל גלייה 48,49.
איור 2B מראה את התוצאות שהושגו על-ידי החלפת המדיום ב-DEV 3 מ-OM ל-GM, בהשוואה לפרוסות SC שלא קיבלו את המתג (פרוסות הבקרה גודלו בתרבית ב-OM). השתמשנו בפיזור אות ה-NFL בתוך הפרוסות כסמן לשלמות עצבית (איור 2B,C). פרוסות ב-DEV 7 היו בריאות בשני תנאי הגידול, והראו את ההתפלגות המפוזרת של נוירופילמנט (NFL, בירוק) בתוכם. ב-DEV 10, פרוסות שתורבתו ב-GM נראו בריאות יותר ביחס לפרוסות הבקרה שתורבתו ב-OM, כפי שתועד על ידי הפצת כתמים ב-NFL. הערכנו גם את שטח NFL+ (% NFL+ Area/DAPI+ Area) של הפרוסות שמוצגות בתמונות המייצגות של איור 2B. אזור ה-NFL+ המשוער מיוצג בהיסטוגרמות באיור 2C, מה שמאשר שאות ה-NFL מפוזר באופן מפוזר בפרוסות ב-DEV 7 בשני התנאים. עם זאת, ב-DEV 10, השטח המשוער המכוסה על ידי צביעת NFL פוחת עבור מצב התרבות OM.
נתונים אלה מצביעים על כך שהמעבר ל-GM ב-DEV 3 נסבל היטב לגידול ממושך של פרוסות SC (DEV 10). בשלב הבא, בדקנו את GM בנקודות זמן ממושכות יותר: DEV 30, DEV 60 ו-DEV 90. כפי שניתן לראות באיור 3A,B, פרוסות נשמרו בריאות בתרבית עד DEV 90. צביעת NFL נמצאה באופן נרחב בפרוסות בכל נקודת זמן, עם נביטה מפוזרת סביב פרוסות הנוירוטים היוצאות מאזור המרכז. ואכן, הערכנו את שטח ה-NFL+ של הפרוסות שמוצגות באיור 3A, והוא גדל עם הזמן כפי שמוצג בהיסטוגרמות של איור 3B. ראינו גם חיוביות לסמן העצבי RBFOX3, מה שסיפק קו נוסף של ראיות להתמיינות העצבית של הפרוסות. בכל נקודת זמן, בדקנו גם את קצב האפופטוזיס על-ידי הערכה בפרוסות שונות של מספר התאים החיוביים ל-aCASP3 (איור 4A,B). הניתוח בוצע כמתואר בסעיף 10.2 לפרוטוקול. שיעור אפופטוטי (% תאי aCASP3+ / המספר הכולל של תאי DAPI+) נמצא נמוך מאוד בכל נקודת זמן (0.85 ± 0.52%, 0.71 ± 0.27%, 0.66 ± 0.45% עבור DEV 30, 60 ו- 90, בהתאמה) ללא הבדלים משמעותיים בין שלוש נקודות הזמן הנחשבות (ערך p > 0.05, איור 4B). נתונים אלה מצביעים על כך שהקצב האפופטוטי הקשור ל-aCASP3 נשאר יציב לאורך זמן, ויחד עם הפיזור הרחב של NFL בפרוסות (איור 4A), מאשרים את הישרדות הפרוסות בכל נקודת זמן.
כתמיכה לנתונים קודמים, ביצענו גם בדיקה חיה/מתה כדי להעריך את הכדאיות של הפרוסות בשלוש נקודות הזמן השונות. השתמשנו בקלצין (צביעה ירוקה) כדי לתייג את התאים הפעילים מבחינה מטבולית ובסיטוקס (צביעת ציאן) כדי להעריך מוות תאי. כפי שניתן לראות בהיסטוגרמות באיור 4C, אחוז התאים הפעילים מטבולית עולה מעט מ-DEV 30 ל-DEV 90 (93.17 ±-5.21%, 96.43 ±-3.02%, 96.33 ±-3.10% עבור DEV 30, 60 ו-90, בהתאמה), ומתייצב בין שתי נקודות הזמן האחרונות (DEV 30 לעומת DEV 60 p-value = 0.018; DEV 30 לעומת DEV 90 p-value = 0.027; DEV 60 לעומת DEV 90 p-value = 0.99). מצאנו רמות נמוכות של מוות תאי שירדו עם הזמן (6.83 ±-5.21%, 3.57 ±-3.02%, 3.66 ±-3.10% עבור DEV 30, 60 ו-90, בהתאמה) ונמצא הבדל משמעותי בין DEV 30 לבין נקודות זמן מאוחרות יותר, DEV 60 ו-DEV 90 (DEV 30 לעומת DEV 60 p-value = 0.018; DEV 30 לעומת DEV 90 p-value = 0.027; DEV 60 לעומת DEV 90 p-value = 0.99). נתונים אלה, בשילוב עם שיעור האפופטוזיס, מאשרים את הישרדות הפרוסה לאורך זמן ותומכים ביעילות פרוטוקול הטיפוח ארוך הטווח המבוצע.
לאחר שנקבעה ההיתכנות של תרבית ממושכת של פרוסות SC, אתגרנו את המערכת על ידי השתלת תאי h-SC-NES בשלבים הראשונים של התמיינות עצבית. בדקנו את תאי h-SC-NES מכיוון שהם הראו תוצאות מבטיחות לטיפול ב-SCI12. הליך ההשתלה של תאי h-SC-NES בפרוסות SC של העכבר מתואר בסעיף 6 של הפרוטוקול. פרוסות SC ותאי h-SC-NES שהושתלו נשמרו עד DPT 30. תאים הושתלו ב-DIV 10 של התמיינות (שלב מקדים עצבי) לפרוסות אורגנוטיפיות של DEV 4, כפי שמוצג בסכמת הפרוטוקולים של איור 5A. התאים המושתלים נוטרו לביטוי GFP בתרבית במשך עד 30 יום. איור 5B מציג תמונות חיות מייצגות, ב-DPT שונה, של פרוסת SC עם תאי GFP+ מושתלים. הביטוי היציב של GFP לאורך זמן (איור 5B ואיור 6A) מצביע על כך שתאים שרדו לתוך רקמת SC בתנאי התרבית שעברו אופטימיזציה בעבר. בדקנו גם את שיעור האפופטוטי של תאים מושתלים כמתואר בסעיף 10.2 לפרוטוקול. שיעור האפופטוטי (% aCASP3+ תאים/המספר הכולל של תאי Hu-Nu+ ) נמצא נמוך מאוד (0.44 ± 0.34%) לאחר 30 DPT (איור 6B). יתר על כן, שיעור אפופטוטי ב DPT 30 נמצא בקנה אחד עם זה שנמצא עבור אותו סוג של תאים ב DPT 7, כפי שדווח בעבר40, תיעוד כי התרביות מתייצבים לאורך זמן.
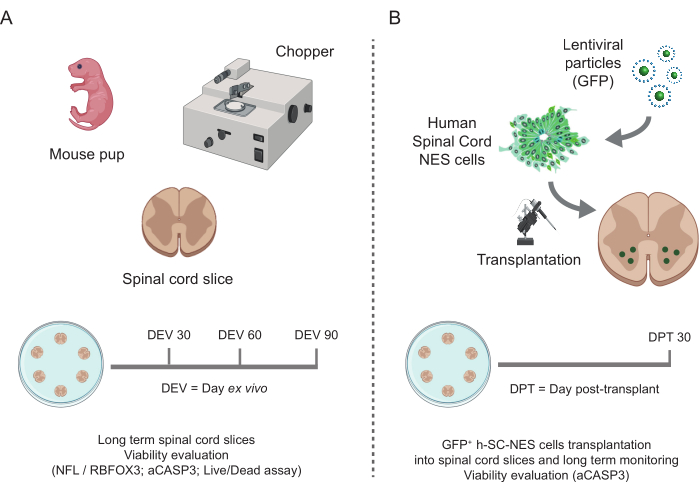
איור 1: זרימת העבודה של הפרוטוקול. סכימה מייצגת המציגה את זרימת העבודה הכללית של הפרוטוקול שבוצע. (A) משמאל, סכימה המסכמת יצירת פרוסות SC-פרוסות עכבר מ-SC מבודד של גורי עכברים ב-P3 וטיפוח ארוך טווח של פרוסות אורגנוטיפיות SC. (B) מימין, סכימה המסכמת השתלה של תאי h-SC-NES המבטאים GFP בפרוסות SC-organotypic של עכבר. תאים מושתלים נשמרים במשך 30 יום לאחר ההשתלה. קיצורים: h-SC-NES = גזע נוירואפיתל הנגזר מחוט השדרה האנושי; GFP = חלבון פלואורסצנטי ירוק; DEV = יום ex vivo; DPT = יום לאחר ההשתלה; NFL = שרשרת אור נוירופילמנט; RBFOX3= RNA קושר פוקס-1 הומולוג 3; aCASP3 = קספאז-3 פעיל; SC= חוט השדרה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
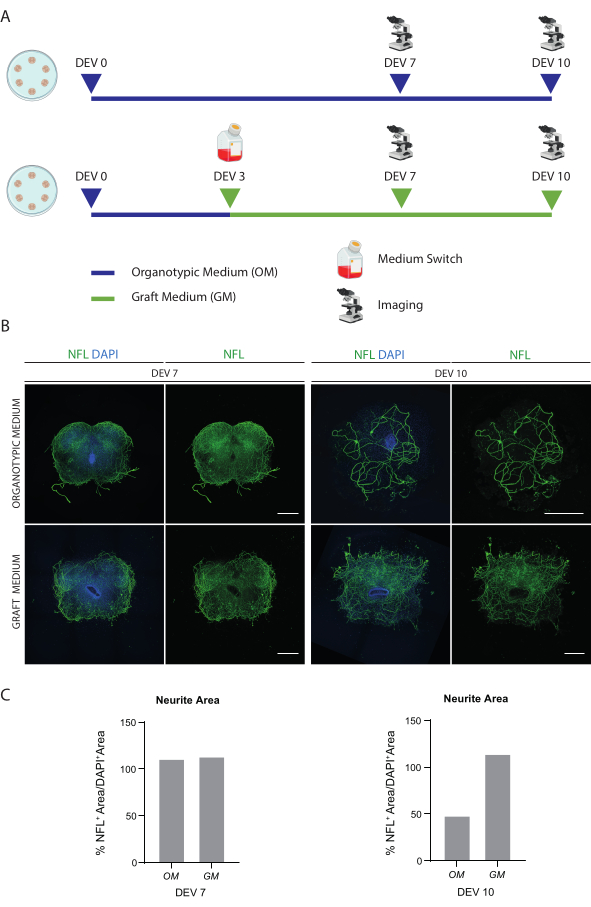
איור 2: אופטימיזציה של תנאי גידול ארוכי טווח. (A) תוכנית מייצגת של הפרוטוקול לבדיקת OM ו- GM. OM נשמר עד DEV 7-10 עבור קבוצת הביקורת. המדיום עובר ל-GM ב-DEV 3 עבור הפרוסות המטופלות; לאחר מכן, הם קבועים ב- DEV 7-10 להשוואה לבקרות. (B) תמונות מייצגות המשוות פרוסות אורגנוטיפיות של עכבר SC ב-DEV 7 ו-10 בתרבית בתנאים שונים. פרוסות מוכתמות עבור הסמן cytoskeletal סמן neurofilament (NFL, ירוק). התפוצה הרחבה של כתמי NFL בפרוסות שתורבתו עם GM מצביעה על הישרדות כללית ובידול. גרעינים מוכתמים ב-DAPI. סרגל קנה מידה = 500 מיקרומטר. (C) היסטוגרמות מייצגות של אומדן השטח המכוסה על-ידי NFL בפרוסות המוצגות באיור 1B. ב-DEV 10, שטח הפנים של ה-NFL יורד בתנאי התרבות של OM. קיצורים: DEV = day ex vivo; DAPI = 4',6-diamidino-2-phenylindole; NFL = שרשרת אור neurofilament.; OM = מדיום אורגנוטיפי; GM = מדיום השתל; SC = חוט השדרה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
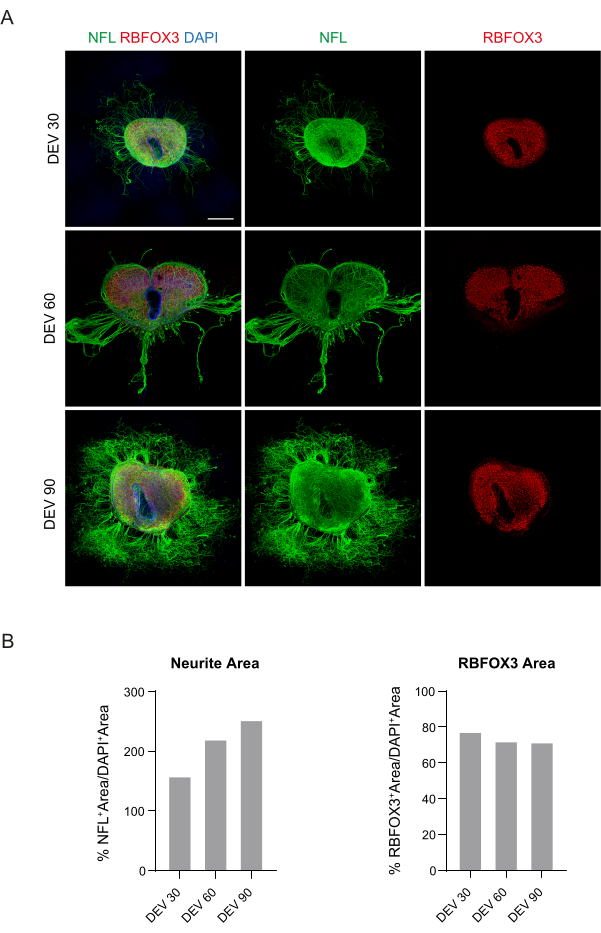
איור 3: פרוסות אורגנוטיפיות של עכבר מתורבת לטווח ארוך. (A) פרוסות נשמרות בתרבית עד DEV 90. בדיקת אימונופלואורסנציה מגלה תפוצה רחבה של הסמן הציטו-שלד נוירופילמנט (NFL, ירוק) והסמן העצבי הגרעיני RBFOX3 (אדום), המעידים על מצבם הבריא וזהותם העצבית לאחר תרבית ארוכת טווח. יש לציין כי אקסונים מסוג NFL+ נובטים החוצה באופן מפוזר סביב הפרוסות לאורך זמן. גרעינים מוכתמים ב-DAPI. סרגל קנה מידה = 500 מיקרומטר. (B) היסטוגרמות מייצגות של אומדן השטח והזמן של NFL+ ושטח RBFOX3+ של הפרוסות המוצגות בלוח A. שטח הנוירוט NFL+ גדל עם הזמן. קיצורים: DEV = day ex vivo; DAPI = 4',6-diamidino-2-phenylindole; NFL = שרשרת אור נוירופילמנט; SC = חוט השדרה; RBFOX3= RNA קושר פוקס-1 הומולוג 3. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
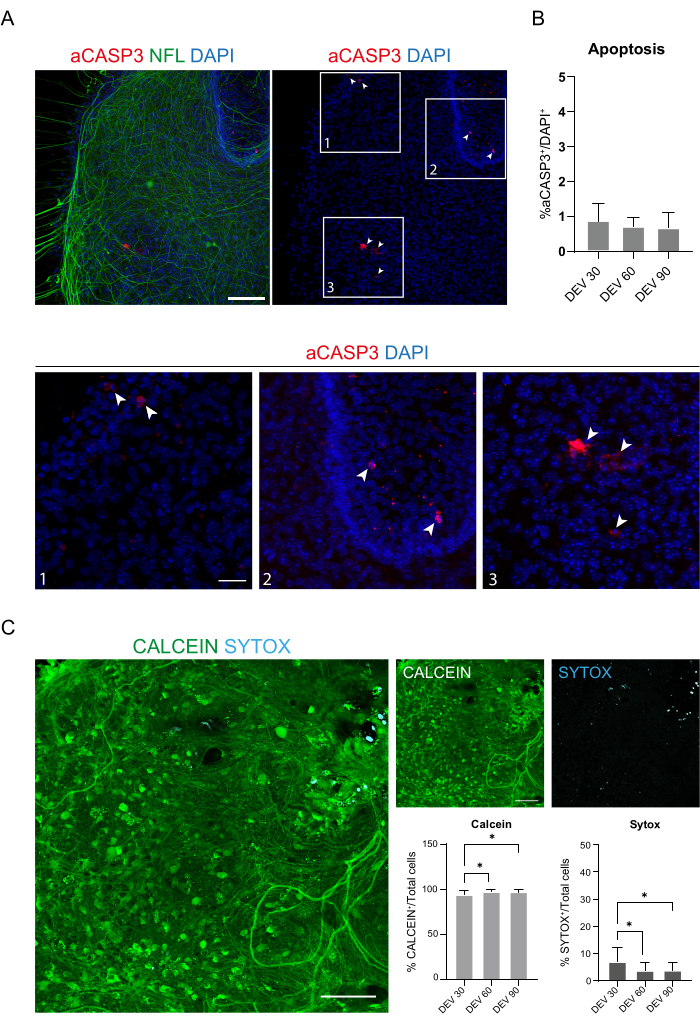
איור 4: הערכת כדאיות התא בפרוסות SC לאורך זמן. (A) תמונות מייצגות של פרוסות אורגנוטיפיות ב-DEV 60 מוכתמות עבור aCASP3 (אדום) ו-NFL (ירוק). סרגל קנה מידה = 100 מיקרומטר. NFL מראה תבנית מפוזרת. תאים נדירים חיוביים לסמן אפופטוטי aCASP3 (כניסה: 1-2-3). (B) ניתוח קצב האפופטוזיס בפרוסות בנקודות זמן שונות. ממוצע ± SD, N (משוכפל) = 6 פרוסות, n (סה"כ תאים) > 1,000 עבור כל פרוסה, מבחן Kruskal-Wallis, השוואה מרובה, ערך p > 0.05. קצב האפופטוטי יציב לאורך זמן. בכניסות 1-2-3 של לוח A, ניתן לצפות בפרטים של תאים חיוביים עבור aCASP3 (צביעה אדומה, חצים לבנים). נקודות אדומות קטנות מסמנות פסולת תאים וגרעינים פיקנוטיים. סרגל קנה מידה = 50 מיקרומטר. (C) תמונות מייצגות של בדיקה חיה/מתה המבוצעת על פרוסות SC ב-DEV 90: תאים פעילים מטבולית מסומנים בירוק עם Calcein, בעוד תאים מתים ופגועים מסומנים בכחול בהיר (ציאן) עם Sytox. שתי ההיסטוגרמות מראות את % התאים החיוביים עבור קלצאין (משמאל) וסיטוקס (מימין) במספר התאים הכולל. עבור שניהם ממוצע ± SD, N (משוכפל) = 6 פרוסות, n (סה"כ תאים) > 1,000 עבור כל פרוסה, מבחן Kruskal-Wallis, השוואה מרובה, DEV 30 לעומת DEV 60 p-value = 0.018; DEV 30 לעומת DEV 90 p-value = 0.027; DEV 60 לעומת DEV 90 ערך p > 0.99. קיצורים: DEV = day ex vivo; DAPI = 4',6-diamidino-2-phenylindole; NFL = שרשרת אור נוירופילמנט; SC = חוט השדרה; aCASP3 = קספאז-3 פעיל. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
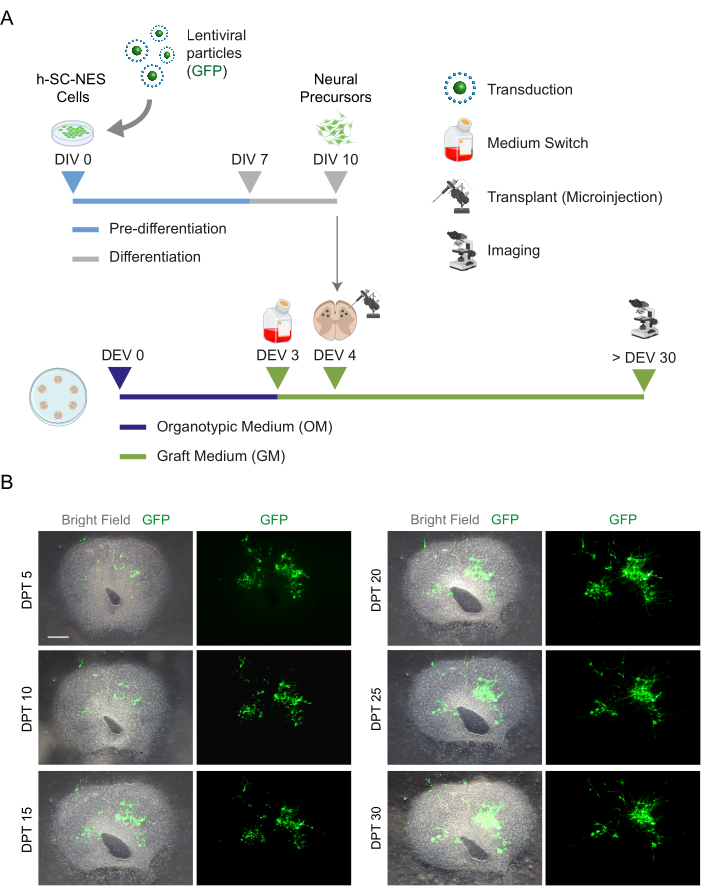
איור 5: השתלת תאי h-SC-NES בפרוסות אורגנוטיפיות של עכבר. (A) תכנית מייצגת של פרוטוקול ההשתלה. תאים מושתלים כמבשרים עצביים ב-DIV 10 של התמיינות לפרוסות אורגנוטיפיות של DEV 4. (B) תמונות מייצגות של פרוסות אורגנוטיפיות של עכברים שהושתלו בתאי h-SC-NES המבטאים GFP לאורך זמן עד DPT 30. תאים מומרים עם וקטור lentiviral הנושא את הגן GFP . ביטוי GFP לאורך זמן מאשר את הכדאיות וההתאמה שלהם לסביבת הפרוסה. סרגל קנה מידה = 500 מיקרומטר. קיצורים: DIV = היום הראשון לפני ההבחנה; h-SC-NES = גזע נוירואפיתל הנגזר מחוט השדרה האנושי; GFP = חלבון פלואורסצנטי ירוק; DEV = יום ex vivo; OM = מדיום אורגנוטיפי; GM = מדיום השתל; DPT = ימים לאחר ההשתלה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
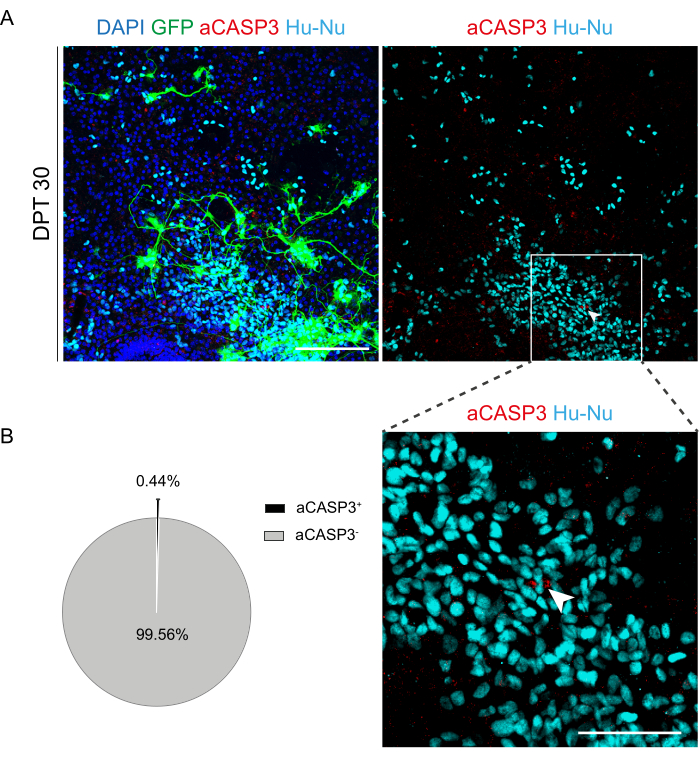
איור 6: הערכת שיעור אפופטוזיס של תאי h-SC-NES מושתלים לאחר 30 יום מההשתלה. (A) תמונה מייצגת של פרוסה אורגנוטיפית של עכבר שהושתלה בה תאי h-SC-NES המבטאים GFP. התאים מומרים עם וקטור לנטיויראלי הנושא את הגן GFP לניטור שלהם לתוך הפרוסות לאחר ההשתלה. ביטוי GFP לאורך זמן מאשר את הכדאיות וההתאמה שלהם לסביבת הפרוסה. נקודת הזמן המוצגת היא DPT 30; תאים מוכתמים עבור גרעינים אנושיים (ציאן) ו aCASP3 (אדום). סרגל קנה מידה = 150 מיקרומטר. (B) משמאל, תרשים עוגה מייצג של ניתוח אפופטוזיס של תאים שהושתלו בפרוסות ב- DPT 30 (N (משוכפל) = 5 פרוסות, n (תאים) = 5,000), ומימין, כניסה של תאי Hu-Nu+ ופרט של תא חיובי ל- aCASP3 (חץ לבן). סרגל קנה מידה = 75 מיקרומטר. נקודות אדומות קטנות מסמנות פסולת תאים וגרעינים פיקנוטיים. קיצורים: h-SC-NES = גזע נוירואפיתל הנגזר מחוט השדרה האנושי; GFP = חלבון פלואורסצנטי ירוק; DPT = יום לאחר ההשתלה; DAPI = 4',6-diamidino-2-phenylindole; NFL = שרשרת אור נוירופילמנט; aCASP3 = קספאז-3 פעיל; Hu-Nu = גרעינים אנושיים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: הרכב הפתרונות המשמשים בפרוטוקול זה. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
עדיין אין טיפול יעיל לחולים עם SCI. גישות שונות נבדקו ואחת המבטיחות ביותר מבוססת על החלפת תאי אסטרטגיה רגנרטיבית. כיום, ההתקדמות בתחום הרפואה הרגנרטיבית מבקשת פלטפורמות חדשניות לבדיקת היעילות והבטיחות של השתלות תאים, לבד או בשילוב עם גישות אחרות. האימות הפרה-קליני שלהם חיוני כדי להמשיך במחקרים קליניים נוספים. תרביות אורגנוטיפיות של SC הן פלטפורמה שימושית לחקר היבטים שונים של ניוון עצבי, התחדשות עצבית והתפתחות עצבית, ולחקירת יעילותן של גישות טיפוליות חדשניות23. בפרט, מאפיינים ספציפיים של תרבויות אורגנוטיפיות כגון שמירה על היסטוארכיטקטורה מקורית והרכב תאים ומיקרו-סביבה הם יתרון לפענוח דינמיקת השתלות, כגון קליטת תאים, אינטגרציה, התמיינות והתבגרות.
באופן עקבי עם פרוטוקולים שפורסמו, פרוסות אורגנוטיפיות SC יכולות להישמר בתרבית במשך כ 2-3 שבועות בתנאים בריאים, מה שמגביל את השימוש בהן לחקירות ארוכות טווח וסינון פונקציונלי הנדרש לתוכניות בדיקה של טיפול תאי. חקירת תהליכים חשובים כגון התמיינות והבשלה לקראת גורלם הנכון של תאים מושתלים בתוך רקמת SC דורשת ניטור ארוך טווח. תהליכים תאיים אלה הם קריטיים במהלך השתלות נפוצות במודלים של בעלי חיים. הזמינות של מערכת ex vivo המחקה תכונות רבות הקיימות in vivo תהיה מועילה בשלב הסינון הפרה-קליני.
מסיבה זו, בעבודה זו, אנו מציעים שיטת תרבות אורגנוטיפית אופטימלית לטווח ארוך (≥30 יום) SC המאפשרת לשמור על פרוסות SC קיימא עד 90 יום, תוך שילוש מסגרת הזמן הרגילה שלהם בתרבית. יתר על כן, אנו מראים קליטה יציבה של תאי h-SC-NES בתוך פרוסות SC ושמירה על תרבית ההשתלה למשך עד 30 יום. עקבנו אחר קליטת התאים לאורך זמן על ידי התבוננות בביטוי GFP כדי לאמת את הישרדות התאים עד DPT 30. לאחר 30 DPT, הערכנו את קצב אפופטוזיס התא. בספרות, הערכה של אפופטוזיס של תאי h-SC-NES מושתלים בפרוסות SC ב 7 DPT דווח40. כאן, הרחבנו את ניתוח אפופטוזיס התא ב- DPT 30 כדי להשוות את קצב האפופטוטי ביחס לנקודת הזמן הקודמת (DPT 7). גילינו שהנתונים שלנו עולים בקנה אחד עם הספרות, מה שמצביע על כך שתאי h-SC-NES מושתלים שורדים גם בנקודת זמן מאוחרת יותר אם הם נשמרים בתנאי התרבית האופטימליים בעבודתנו. פלטפורמת ex vivo משופרת זו לטווח ארוך לבדה ובתצורת ההשתלה תסייע לחוקרים בבדיקות פרה-קליניות להשתלות מבוססות תאי גזע עבור SCI. זה יאפשר להם לזהות את המועמד הטוב ביותר לתאים למחקרי in vivo נוספים המקדמים את הצלחת ההשתלות. יתר על כן, לאחר סינון ראשוני, פרוסות אורגנוטיפיות SC יכולות לשמש גם במקביל למחקרי in vivo כדי לאשר ולאמת דינמיקה תאית ארוכת טווח והתנהגויות שנצפו במודלים של בעלי חיים או לתמוך במחקרים מכניסטיים.
הפרוטוקול שלנו מתאר בפירוט כיצד ליצור מודל אורגנוטיפי ארוך טווח זה, אך יש לדון גם בכמה צעדים קריטיים. לגבי הדור של תרבויות אורגנוטיפיות SC, ישנם כמה אתגרים במהלך הניתוח ואת השלבים הראשונים של התרבות. הליך ניתוח המבוצע היטב חיוני ליצירת פרוסות השומרות על ההיסטוארכיטקטורה המקורית. אם SC נהרס במהלך הבידוד, פרוסות יכולות לאבד את המבנה האנטומי האופייני שלהן ונזק לרקמות יכול לגרום לעלבון פרו-דלקתי מוגזם המוביל לתנאים לא בריאים ומוות תאי. השלב המאתגר ביותר במהלך הניתוח הוא עקירת ה-SC מעמוד השדרה והסרת קרומי המוח מה-SC המבודד. ההצלחה של צעדים אלה תלויה בניסיון של המפעיל; לכן, מומלץ תקופת הכשרה לפני תחילת הניסויים.
חתך קורונלי של SC באמצעות מסוק הוא גם שלב מאתגר. את ה-SC המבודד יש למקם על סיפון החיתוך בדיוק בניצב ללהב. המפעיל צריך גם למקם את הלהב בניצב לסיפון החיתוך. אמצעי זהירות אלה נחוצים כדי להבטיח את הדור של פרוסות לשחזור בין ניסויים זהים ושונים. נושא חשוב נוסף הוא שזמן הניתוח מוגבל: כל הליך יצירת הפרוסה חייב להימשך ~30 דקות. אם המפעיל משקיע זמן רב יותר בניתוח וחיתוך, רקמת SC תסבול וזה יכול לפגוע בהצלחת התרבית ובשלבים הבאים של הניסוי.
לאחר שמניחים פרוסות על קרום התרבית, חשוב להאכיל אותן נכון. GDNF נחוץ כדי לשמור על התאוששות רקמות והישרדות. חיתוך עם מסוק הוא טראומטי עבור הרקמה, ומסיבה זו, פרוסות ממוקמות זמן קצר לאחר החיתוך לתוך מדיום דיסקציה קר כקרח כדי לנקות את עודף של מולקולות פרו דלקתיות ומעודדות מוות. לאחר מכן, פרוסות מונחות על קרומי התרבית (תוספות תרבית תאים) עם מדיום טרי שונה עם GDNF כדי לקדם התאוששות מהירה יותר הידבקות פרוסה לממברנה. GDNF צריך להתווסף למדיום כל יום בשבוע הראשון בתרבות בגלל מחצית החיים הקצרה שלו50,51. ראינו כי פרוסות זקוקות לנוכחות רציפה של GDNF במהלך הימים הראשונים בתרבית כדי לקדם התאוששות רקמות וכדאיות. בכל מקרה, מכיוון שנוכחות GDNF חשובה לכל תקופת הטיפוח, מומלץ מאוד להפריע לניהול GDNF בנקודות זמן נוספות.
במהלך השבוע הראשון בתרבית, חשוב גם לבדוק את הפרוסות באופן מקרוסקופי בעין ובמיקרוסקופ. רקמה שקופה ושקיפות של הגבולות הם סימנים להידבקות נכונה של הפרוסות לממברנה ולרקמה בת קיימא. הרקמה הנמקית תיראה לבנה מאוד במבט מאקרוסקופי ראשון והאזורים הנמקיים ייראו אפורים כהים במיקרוסקופ. לאחר מספר שבועות בתרבית, המורפולוגיה של הרקמה עשויה להשתנות: תנועות התאים והיצמדות הרקמה לממברנה יכולות להשפיע על תהליך זה. ראינו, למשל, את אובדן הלומן המרכזי בכמה פרוסות מלאות תאים ואת אובדן המורפולוגיה של הקרן הגבית והגחון. זה קורה בעיקר עם פרוסות קטנות יותר, בעוד רובם ישמרו על מבנה אנטומי קרוב למקור. פרוסות נוצרות בדרך כלל מאזורי המותניים או החזה מכיוון שבדרך זו הם יכולים לקבל את הגודל המתאים כדי לשמור על ההיסטוארכיטקטורה המקורית שלהם לאורך זמן: אם הם קטנים מדי, הם מאבדים את הארכיטקטורה שלהם בעוד שאם גדולים מדי, האזור המרכזי יכול לעבור נמק. לכן, השתמשנו באזור המותני של גורי עכברים כדי ליצור פרוסות בגודל המתאים לגידול אופטימלי לטווח ארוך, אבל, באופן עקרוני, ניתן לשקול מקטעים אחרים. יתר על כן, בחרנו להשתמש באזור המותני, מכיוון שאזורי הגחון והגב נבדלים יותר זה מזה. בנוסף, אזור זה מציג אזורי רקמה עם אחוז גבוה יותר של נוירונים מוטוריים וחומר אפור, שהם אתרי עניין לטיפולים בתחליפי תאים ב- SCI. לגבי השתלת תאים בפרוסות, הבעיה העיקרית קשורה לשבירת קצה מיקרו-מחט הזכוכית. אם החור למעבר התאים גדול מדי, הוא עלול לגרום נזק לרקמת SC במהלך המיקרו-הזרקה. אם הוא קטן מדי, ערימת תאים יכולה לחסום את המחט, ולעכב את תהליך ההשתלה. הליך ההשתלה צריך להסתיים בתוך 1 שעה כדי למזער סבל תאים ומוות.
הפרוטוקול המוצע מספק כלי אופטימלי ורב-תכליתי לסוגים שונים של חקירות. כאן, אנו מיישמים את הפלטפורמה ארוכת הטווח שלנו כדי לאמת את ההשתלה של תאי h-SC-NES בשלבים הראשונים של התמיינות בתוך רקמת SC של עכבר למשך 30 יום. החידוש העיקרי של הגישה המוצעת הוא אופטימיזציה של פרוטוקול התרבות המשותפת. מרכיבי GM שומרים על הישרדות עצבית ארוכת טווח של פרוסות SC ותאי h-SC-NES המושתלים. ואכן, GM, בהיותו מדיום נטול סרום, מקיים את התמיינות התאים המושתלים לעבר הגורל העצבי ביחס למדיום ששימש בעבר לתרבית פרוסות אורגנוטיפית47.
לגבי המודלים המוצעים עבור SCI, ניסויים מבוצעים בדרך כלל על עכברים בוגרים. עד כה, ההבדלים החשובים ביותר בין SC יילודים ובוגרים קשורים לפוטנציאל ההתחדשות הגבוה יותר שנמצא בילוד ביחס לעכברים בוגרים52. עם זאת, להבדלים כאלה אין השפעה על סוג הפרוטוקול שאנו מציעים, שכן כאן אנו מתמקדים בתגובה של תאים מושתלים לסביבת הרקמה המארחת ולא ביכולות ההתחדשות של תאי העצב השוכנים. הבדל נוסף בין עכברים ילודים לעכברים בוגרים לאחר SCI קשור להיווצרות צלקת גליה המתרחשת אצל מבוגרים. היבט זה אינו נלקח בחשבון במודל המוצע, שאינו מתחשב בתהליכים הפיזיולוגיים המורכבים הנובעים מפגיעות ראשוניות ומשניות.
לגבי היישומים, הפלטפורמה יכולה לשמש גם כדי לחקור את האינטגרציה בין התאים המושתלים עם מעגלים תושבים הקיימים במודל האורגנוטיפי SC. כלי הנדסה גנטית כבר שימשו במערכת העצבים המרכזית להערכת קישוריות סינפטית וניתן היה לנצל אותם בהקשר זה 53,54,55. בפרט, ניתן לחקור ולאמת את האינטגרציה על ידי הערכת היווצרות הסינפסות בין התאים המושתלים לבין רקמת SC ex vivo. תרבויות אורגנוטיפיות ארוכות טווח אלה יכולות להיות מנוצלות גם לבדיקת חומרים נוירופרוטקטיביים ונוירורגנרטיביים או מולקולות/חומרים חדשים או לחקר הפרעות נוירודגנרטיביות המערבות את ה-SC. כדי לחקור הפרעות נוירודגנרטיביות ספציפיות, יש להתאים את הפרוטוקול לגידול פרוסות SC שנוצרו ממודלים רלוונטיים, כגון עכברים טרנסגניים הנושאים מוטציות ספציפיות הקשורות לפתולוגיה, בשלב הרלוונטי לפתולוגיה (כלומר, יילודים, נוער, מבוגרים). לסיכום, הפרוטוקול שלנו ותרביות אורגנוטיפיות בכלל, בהיותן צמחים של איבר מסוים, מציגות תכונות המגשרות על הפער בין תרביות תאים דו-ממדיות לבין מודלים in vivo, המאשרות אותם ככלי רב ערך הן למחקר בסיסי והן לבדיקות פרה-קליניות.
Disclosures
למחברים אין ניגודי עניינים להצהיר.
Acknowledgements
המחקר נתמך על ידי קרן Wings for Life (WFL-IT- 20/21), תוכנית ההתאוששות והחוסן הלאומית של האיחוד האירופי מהדור הבא (NRRP)-משימה 4 רכיב 2, השקעה n. 1.4-CUP N. B83C22003930001 (Tuscany Health Ecosystem-THE, Spoke 8), ומרינה רומולי אונלוס. כתב יד זה משקף רק את השקפותיהם ודעותיהם של המחברים, לא האיחוד האירופי ולא הנציבות האירופית יכולים להיחשב אחראים להם. נתונים ומטה-נתונים זמינים ב-Zenodo 10.5281/zenodo.10433147. התמונות נוצרו באמצעות Biorender https://www.biorender.com/.
Materials
| Name | Company | Catalog Number | Comments |
| anti-cleaved Caspase-3, (Asp175) (5A1E) (Rabbit) | Cell Signaling Technology | 9661S | 1:400 |
| anti-GFP (Mouse) - monoclonal | Sigma/Merck | G6539 | 1:400 |
| anti-Human Nuclei (Mouse) - monoclonal, clone 235-1 | Sigma/Merck | MAB1281 | 1:400 |
| anti-Human Nuclei (Rabbit) | NeoBiotechnologies | RBM5-346-P1 | 1:400 |
| anti-NeuN (RBFOX3) (Rabbit) - polyclonal | Sigma/Merck | ABN78 | 1:400 |
| anti-NFL (Mouse) | Sigma/Merck | MAB1615 | 1:400 |
| anti-NFL H-Phospho (Rabbit) -polyclonal | Biologend | 840801 | 1:500 |
| Aqua Polymount | Poly-sciences | 18606-20 | |
| B-27 | Gibco | 17504-044 | |
| BDNF | Gibco | PHC7074 | |
| Blades | Leica | 118364227 | |
| Cell culture graded water | Sigma/Merck | W3500-500ML | |
| Collagen from rat tail | Sigma/Merck | C7661 | |
| Confocal microscope - A1 Confocal Microscope (Eclipse Ti) | Nikon | ||
| D(+)-Glucose | Sigma/Merck | G7021 | |
| Dissecting Forceps | World Precision Instruments | 15915 | |
| DMEM/F12 | Gibco | 31330 | |
| DPBS | Sigma/Merck | D8537 | |
| EGF | Sigma/Merck | gf144 | |
| FBS | Gibco | 10270-106 | |
| FGF-2 | Stemgent | 03-0002 | |
| GDNF | Sigma/Merck | SRP3200 | |
| Glass capillaries, 3.5" | Drummond Scientific Company | 3-000-203-G/X | |
| Glutamax | Gibco | 35050-038 | |
| Goat-anti Mouse IgG Alexa Fluor 488 | Thermo Fisher Scientific | A11029 | |
| Goat-anti Mouse IgG Alexa Fluor 647 | Thermo Fisher Scientific | A21236 | 1:500 |
| Goat-anti Rabbit IgG Alexa Fluor 568 | Thermo Fisher Scientific | A11011 | 1:500 |
| Goat-anti Rabbit IgG Alexa Fluor 647 | Thermo Fisher Scientific | A21244 | 1:500 |
| Graph Pad-Prism | Dotmatics | Software for Statistical Analysis | |
| HBSS | Gibco | 14025-050 | 1:500 |
| HEPES | Gibco | 15630-056 | |
| Hoechst 33342 | Thermo Fisher Scientific | H3570 | |
| Horse Serum | Gibco | 16050-122 | |
| Insulin | Sigma/Merck | I9278 | |
| Laminin | Sigma/Merck | L2020 | |
| Lentiviral prep | Addgene | 17446-LV | |
| L-Glutamine | Thermo Fisher Scientific | 25030024 | |
| LIVE/DEAD Viability/Cytotoxicity assay kit | Thermo Fisher Scientific | L32250 | |
| McIlwain Tissue Chopper | World Precision Instruments | ||
| MEM | Gibco | 11090-081 | |
| Microloader tips | Eppendorf | 5242956003 | to load cells in the needle for transplantation |
| Microscope slides | VWR | 631-0909 | |
| Millicell cell culture membrane | Sigma/Merck | PICM0RG50 | |
| Miscroscope cover glasses | VWR | ECN 631-1572 | |
| N-2 | Gibco | 17502-048 | |
| Neurobasal | Gibco | 21103-049 | |
| Penicillin/Streptomycin | Thermo Fisher Scientific | 15140122 | |
| Petri dish (35mm) | VWR | 734-2317 | |
| PFA | Sigma/Merck | P6148-500G | |
| Plastic pasteur pipette | Sarstedt | 86.1171.010 | |
| Pneumatic PicoPump | World Precision Instruments | PV830 | Microinjector for transplantation |
| Poly-L-lysine | Sigma/Merck | P4707 | |
| Scalpel blade No 10 Sterile Stainless Steel | VWR International | SWAN3001 | |
| Scalpel handle #3 | World Precision Instruments | 500236 | |
| Spring Scissors | World Precision Instruments | 501235 | |
| Stereomicroscope for imaging and acquisition | Nikon | SMZ18 | |
| Stereomicroscope for surgery | VWR | ||
| Triton X-100 | Merck | T8787 | |
| Tweezers-Dumont #5-inox | World Precision Instruments | 501985 | |
| Vannas Scissors, 8.5 cm | World Precision Instruments | 500086 | |
| Vertical micropipette puller | Shutter Instrument | P-30 | |
| Y-27632 | R&D Systems | 1254/50 |
References
- Ding, W., et al. Spinal cord injury: The global incidence, prevalence, and disability from the Global Burden of Disease Study 2019. Spine. 47 (21), 1532-1540 (2022).
- Yang, B., et al. Strategies and prospects of effective neural circuits reconstruction after spinal cord injury. Cell Death Dis. 11 (6), 439 (2020).
- Liu, K., et al. PTEN deletion enhances the regenerative ability of adult corticospinal neurons. Nat Neurosci. 13 (9), 1075-1081 (2010).
- Anderson, M. A., et al. Required growth facilitators propel axon regeneration across complete spinal cord injury. Nature. 561 (7723), 396-400 (2018).
- de Freria, C. M., Van Niekerk, E., Blesch, A., Lu, P. Neural stem cells: promoting axonal regeneration and spinal cord connectivity. Cells. 10 (12), 3296 (2021).
- Badner, A., Siddiqui, A. M., Fehlings, M. G. Spinal cord injuries: how could cell therapy help. Expert Opin Biol Ther. 17 (5), 529-541 (2017).
- Assinck, P., Duncan, G. J., Hilton, B. J., Plemel, J. R., Tetzlaff, W. Cell transplantation therapy for spinal cord injury. Nat Neurosci. 20 (5), 637-647 (2017).
- Ishii, K., et al. Neutralization of ciliary neurotrophic factor reduces astrocyte production from transplanted neural stem cells and promotes regeneration of corticospinal tract fibers in spinal cord injury. J Neurosci Res. 84 (8), 1669-1681 (2006).
- Zhang, Y. W., Denham, J., Thies, R. S. Oligodendrocyte progenitor cells derived from human embryonic stem cells express neurotrophic factors. Stem Cells Dev. 15 (6), 943-952 (2006).
- Faulkner, J., Keirstead, H. S. Human embryonic stem cell-derived oligodendrocyte progenitors for the treatment of spinal cord injury. Transpl Immunol. 15 (2), 131-142 (2005).
- Kadoya, K., et al. Spinal cord reconstitution with homologous neural grafts enables robust corticospinal regeneration. Nat Med. 22 (5), 479-487 (2016).
- Dell' Anno, M. T., et al. Human neuroepithelial stem cell regional specificity enables spinal cord repair through a relay circuit. Nat Commun. 9 (1), 3419 (2018).
- Wu, S., FitzGerald, K. T., Giordano, J. On the viability and potential value of stem cells for repair and treatment of central neurotrauma: overview and speculations. Front Neurol. 9, 602 (2018).
- Nardone, R., et al. Rodent, large animal and non-human primate models of spinal cord injury. Zoology. 123, 101-114 (2017).
- Hartung, T. Thoughts on limitations of animal models. Parkinsonism Relat Disord. 14, (2008).
- Shanks, N., Greek, R., Greek, J. Are animal models predictive for humans. Philosophy, Ethics, and Humanities in Medicine. 4 (1), 2 (2009).
- Dawson, T. M., Golde, T. E., Lagier-Tourenne, C. Animal models of neurodegenerative diseases. Nat Neurosci. 21 (10), 1370-1379 (2018).
- Hayden, P. J., Harbell, J. W. Special review series on 3D organotypic culture models: Introduction and historical perspective. In Vitro Cell Dev Biol Anim. 57 (2), 95 (2021).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Front Mol Biosci. 7, 33 (2020).
- Mirbagheri, M., et al. Advanced cell culture platforms: a growing quest for emulating natural tissues. Materials Horizons. 6 (1), 45-71 (2019).
- Gähwiler, B. H. Organotypic monolayer cultures of nervous tissue. J Neurosci Methods. 4 (4), 329-342 (1981).
- Stoppini, L., Buchs, P. -. A., Muller, D. A simple method for organotypic cultures of nervous tissue. J Neurosci Methods. 37 (2), 173-182 (1991).
- Pandamooz, S., Nabiuni, M., Miyan, J., Ahmadiani, A., Dargahi, L. Organotypic spinal cord culture: a proper platform for the functional screening. Mol Neurobiol. 53 (7), 4659-4674 (2016).
- Fuller, L., Dailey, M. E. Preparation of rodent hippocampal slice cultures. CSH Protoc. 2007, (2007).
- Gertz, C. C., Lui, J. H., LaMonica, B. E., Wang, X., Kriegstein, A. R. Diverse behaviors of outer radial glia in developing ferret and human cortex. J Neurosci. 34 (7), 2559-2570 (2014).
- Ballerini, L., Galante, M. Network bursting by organotypic spinal slice cultures in the presence of bicuculline and/or strychnine is developmentally regulated. Eur J Neurosci. 10 (9), 2871-2879 (1998).
- Avossa, D., Rosato-Siri, M. D., Mazzarol, F., Ballerini, L. Spinal circuits formation: a study of developmentally regulated markers in organotypic cultures of embryonic mouse spinal cord. Neuroscience. 122 (2), 391-405 (2003).
- Lossi, L., Merighi, A. The use of ex vivo rodent platforms in neuroscience translational research with attention to the 3RS philosophy. Front Vet Sci. 5, 164 (2018).
- Nogueira, G. O., Garcez, P. P., Bardy, C., Cunningham, M. O., Sebollela, A. Modeling the human brain with ex vivo slices and in vitro organoids for translational neuroscience. Front Neurosci. 16, 838594 (2022).
- Qi, X. R., et al. Human brain slice culture: a useful tool to study brain disorders and potential therapeutic compounds. Neurosci Bull. 35 (2), 244 (2019).
- Park, H. W., et al. Human mesenchymal stem cell-derived Schwann cell-like cells exhibit neurotrophic effects, via distinct growth factor production, in a model of spinal cord injury. Glia. 58 (9), 1118-1132 (2010).
- Charrière, K., Risold, P. Y., Fellmann, D. In vitro interactions between bone marrow stromal cells and hippocampal slice cultures. C R Biol. 333 (8), 582-590 (2010).
- Jeong, D. K., Taghavi, C. E., Song, K. J., Lee, K. B., Kang, H. W. Organotypic human spinal cord slice culture as an alternative to direct transplantation of human bone marrow precursor cells for treating spinal cord injury. World Neurosurg. 75 (3-4), 533-539 (2011).
- Riggio, C., et al. Generation of magnetized olfactory ensheathing cells for regenerative studies in the central and peripheral nervous tissue. Int J Mol Sci. 14 (6), 10852-10868 (2013).
- Kamei, N., et al. Neural progenitor cells promote corticospinal axon growth in organotypic co-cultures. Neuroreport. 15 (17), 2579-2583 (2004).
- Kamei, N., et al. NGF released from transplanted neural progenitor cells promote corticospinal axon growth in organotypic cocultures. Spine. 32 (12), 1272-1278 (2007).
- Hamasaki, T., et al. Magnetically labeled neural progenitor cells, which are localized by magnetic force, promote axon growth in organotypic cocultures. Spine. 32 (21), 2300-2305 (2007).
- Kim, H. M., Lee, H. J., Lee, M. Y., Kim, S. U., Kim, B. G. Organotypic spinal cord slice culture to study neural stem/progenitor cell microenvironment in the injured spinal cord. Exp Neurobiol. 19 (2), 106-113 (2010).
- Liu, X., Chu, T. H., Su, H., Guo, A., Wu, W. Neural progenitor cell apoptosis and differentiation were affected by activated microglia in spinal cord slice culture. Neurol Sci. 35 (3), 415-419 (2014).
- De Vincentiis, S., et al. Low forces push the maturation of neural precursors into neurons. Small. 19 (30), 2205871 (2023).
- Abouelfetouh, A., Kondoh, T., Ehara, K., Kohmura, E. Morphological differentiation of bone marrow stromal cells into neuron-like cells after co-culture with hippocampal slice. Brain Res. 1029 (1), 114-119 (2004).
- Sypecka, J., Koniusz, S., Kawalec, M., Sarnowska, A. The organotypic longitudinal spinal cord slice culture for stem cell study. Stem Cells Int. 2015, 471216 (2015).
- Tanvig, M., et al. A brain slice culture model for studies of endogenous and exogenous precursor cell migration in the rostral migratory stream. Brain Res. 1295, 1-12 (2009).
- Tennstaedt, A., et al. Human neural stem cell intracerebral grafts show spontaneous early neuronal differentiation after several weeks. Biomaterials. 44, 143-154 (2015).
- Vogel, S., et al. The in vivo timeline of differentiation of engrafted human neural progenitor cells. Stem Cell Res. 37, 101429 (2019).
- Onorati, M., et al. Zika virus disrupts phospho-TBK1 localization and mitosis in human neuroepithelial stem cells and radial glia. Cell Rep. 16 (10), 2576-2592 (2016).
- Vyas, A., et al. An in vitro model of adult mammalian nerve repair. Exp Neurol. 223 (1), 112-118 (2010).
- Brewer, G. J., Torricelli, J. R., Evege, E. K., Price, P. J. Optimized survival of hippocampal neurons in B27-supplemented neurobasal, a new serum-free medium combination. J Neurosci Res. 35 (5), 567-576 (1993).
- De Vries, G. H., Boullerne, A. I. Glial cell lines: an overview. Neurochem Res. 35 (12), 1978-2000 (2010).
- Ziv-Polat, O., et al. The role of neurotrophic factors conjugated to iron oxide nanoparticles in peripheral nerve regeneration: in vitro studies. Biomed Res Int. 2014, 267808 (2014).
- Mesa-Infante, V., Afonso-Oramas, D., Salas-Hernández, J., Rodríguez-Núñez, J., Barroso-Chinea, P. Long-term exposure to GDNF induces dephosphorylation of Ret, AKT, and ERK1/2, and is ineffective at protecting midbrain dopaminergic neurons in cellular models of Parkinson's disease. Mol Cell Neurosci. 118, 103684 (2022).
- Montero, A. M., Huang, A. H. The regenerative capacity of neonatal tissues. Development. 149 (12), (2022).
- Feng, L., Kwon, O., Lee, B., Oh, W. C., Kim, J. Using mammalian GFP reconstitution across synaptic partners (mGRASP) to map synaptic connectivity in the mouse brain. Nat Protoc. 9 (10), 2425-2437 (2014).
- Il Choi, D., Kaang, B. -. K. Interrogating structural plasticity among synaptic engrams. Curr Opin Neurobiol. 75, 102552 (2022).
- Choi, J. -. H., et al. Interregional synaptic maps among engram cells underlie memory formation. Science. 360 (6387), 430-435 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved