Долгосрочная органотипическая культура срезов спинного мозга мышей в качестве платформы для валидации трансплантации клеток при травме спинного мозга
In This Article
Summary
В этой статье мы представляем воспроизводимый метод создания и поддержания долгосрочных органотипических срезов спинного мозга, трансплантированных с нейральными стволовыми клетками, в качестве модели ex vivo для тестирования клеточной заместительной терапии.
Abstract
Резолутивные методы лечения травм спинного мозга (ТСМ) до сих пор отсутствуют из-за сложной патофизиологии. Один из наиболее перспективных регенеративных подходов основан на трансплантации стволовых клеток для замены утраченных тканей и содействия функциональному восстановлению. Этот подход должен быть дополнительно изучен in vitro и ex vivo на предмет безопасности и эффективности, прежде чем приступать к более дорогостоящим и трудоемким испытаниям на животных. В этой работе мы демонстрируем создание долгосрочной платформы на основе органотипических срезов спинного мозга (СК) мыши, трансплантированных с нервными стволовыми клетками человека, для тестирования клеточной заместительной терапии ТСМ.
Стандартные органотипические культуры СК сохраняют в течение 2 или 3 недель in vitro. В этой статье мы опишем оптимизированный протокол для долгосрочного обслуживания (≥30 дней) на срок до 90 дней. Среда, используемая для долгосрочного культивирования срезов SC, также была оптимизирована для трансплантации нейральных стволовых клеток в органотипическую модель. Клетки нейроэпителиального ствола человека (h-SC-NES), полученные из СК человека, несущие репортер зеленого флуоресцентного белка (GFP), были трансплантированы в срезы СК мыши. Через тридцать дней после трансплантации клетки все еще демонстрируют экспрессию GFP и низкую частоту апоптоза, что позволяет предположить, что оптимизированная среда поддерживала их выживание и интеграцию внутрь ткани. Этот протокол представляет собой надежный эталон для эффективного тестирования клеточной заместительной терапии в тканях СК. Эта платформа позволит исследователям проводить предварительный скрининг ex vivo различных методов трансплантации клеток, помогая им выбрать наиболее подходящую стратегию, прежде чем приступать к экспериментам in vivo .
Introduction
Травматическое повреждение спинного мозга (ТСМ) имеет разрушительные физические, психологические и экономические последствия для пациентов и лиц, осуществляющих уход1. Было предпринято много попыток стимулировать регенерацию аксонов при ТСМ с помощью различных подходов 2,3,4, и некоторые положительные эффекты были продемонстрированы за счет формирования нейрональных реле между проксимальными и дистальными нейронами в месте повреждения с помощью клеточной заместительной терапии. Интерес к клеточной терапии все ещерастет5, поскольку трансплантированные клетки могут играть множество ролей, включая обеспечение трофической поддержки, иммунную модуляцию, регенерацию утраченных нейронных цепей путем индукции пластичности, замену клеток и ремиелинизацию аксонов.
В последнее время основные усилия в этой области сосредоточены на нейронных стволовых/прогениторных клетках человека (НСК/НПК)7. Несколько исследований показывают, что НСК/НПК модулируют ответ астроцитов8, способствуют секреции прорегенеративных факторов 9,10 и заменяют недостающие нейрональные клетки при ТСМ11,12. Тем не менее, исследования, которые поддерживают дифференцировку трансплантированных клеток в функциональные нейроны, все еще слабы. Более того, выживаемость и дифференцировка трансплантированных клеток в поврежденном спинном мозге (СК)низки13, возможно, потому, что трансплантированным клеткам требуется несколько недель и даже месяцев для дифференцировки in vivo. Кроме того, современные исследования не полностью прояснили многие биохимические, молекулярные, клеточные и функциональные аспекты клеточной заместительной терапии. В этом контексте необходимы простые, быстрые и экономически эффективные модели для изучения механизмов приживления клеток, способности привитых клеток к пролиферации, дифференцировке в определенные типы или субпопуляции клеток, а также образованию синапсов с резидентными нейронами.
Интеграция гистологических исследований в электрофизиологическую запись и профилирование транскриптома и протеома необходима для полного понимания молекулярного каскада, происходящего после трансплантации клеток. Это, безусловно, ускорит разработку и валидацию новых методов заместительной клеточной терапии в доклинических моделях и клинических исследованиях. Действительно, на сегодняшний день использование грызунов, крупных животных и нечеловекообразных приматов имеет смысл для выяснения многих клеточных процессов послетрансплантации. Однако из-за высокой стоимости, высокого этического воздействия, а также сложности организма, их использование часто не является простым или недостаточным для разгадки биохимических и молекулярных процессов. Кроме того, они могут иметь множество недостатков, коррелирующих с биологическими различиями, как межвидовыми (метаболизм), так и внутривидовой изменчивостью (пол, возраст). Эти факторы, вместе с внешними факторами, такими как стрессовые ситуации, могут изменить исход эксперимента и их предсказуемость с точки зрения терапевтического воздействия на человека 15,16,17.
Таким образом, многие группы используют 2D клеточные культуры in vitro и органотипические срезы ex vivo (культуры ex vivo) в дополнение к животным моделям. Двумерная клеточная культура является наиболее часто используемой системой для изучения специфических биологических процессов на уровне отдельных клеток и/или клеточной популяции. Тем не менее, монослойные клеточные культуры не отражают сложность, обнаруженную в организме в целом. Отсутствие тканевых структур и физиологической среды не позволяет системам 2D-культивирования в полной мере имитировать ключевые структурные, морфологические и функциональные аспекты исследуемой ткани 18,19,20.Органотипические культуры могут преодолеть некоторые из этих проблем. Органотипические модели основаны на эксплантации фрагмента ткани или органа и поддержании его ex vivo в течение ограниченного периодавремени 21,22. В частности, срезы эксплантированной ткани генерируются с точной толщиной, что позволяет питательным веществам легко достигать почти всех клеток в срезах. Они могут генерироваться из различных областей центральной нервной системы, таких как гиппокамп, гипоталамус, мозжечок, таламус, кора головного мозга, черная и стриатумная субстанции, а также спинной мозг23. Органотипические культуры сохраняют тканевую архитектуру, пространственное распределение клеток, клеточное разнообразие и среду обитания (т.е. состав внеклеточного матрикса) органа происхождения. Более того, они сохраняют первоначальную нейронную активность, связи между клетками и, в частности, цепи на короткие расстояния после экспланта.
Эти аспекты обеспечивают некоторые преимущества для культур ex vivo по отношению как к монослойным культурам, так и к животным моделям. Они сохраняют ключевые особенности тканей, обнаруженные in vivo, но с уменьшением затрат и возможностью проведения различных видов молекулярных, клеточных и функциональных экспериментов с точной регуляцией параметров культуры окружающей среды 24,25,26,27,28,29. Органотипические срезы также могут быть использованы для разработки моделей различных неврологических расстройств путем имитации ключевых гистопатологических особенностейконкретных состояний. Кроме того, сохранение исходной многоклеточной тканевой среды делает их подходящими платформами для скрининга лекарств и тестирования нейропротекторных и нейрорегенеративных молекул и материалов.
В данной работе мы предлагаем использовать СК органотипические культуры в качестве модели для оптимизации трансплантаций НСК. Это нетривиально, поскольку требуются оптимальные условия культивирования, чтобы гарантировать выживание как хозяина (ткани СК), так и трансплантата (НСК) в течение нескольких недель. Различные исследовательские группы прививали к органотипическим культурам, полученным от мозга и SC-производным, различные типы клеток. В большинстве работ была показана трансплантация мезенхимальных стволовых клеток 31,32,33, обонятельных клетокоболочки 34 или НСК 35,36,37,38,39,40 и оценивались взаимодействия приживленных клеток с клетками-хозяевами, выживаемость всей системы, а также дифференцировались ли трансплантированные клетки в нейроны или нейроноподобные клетки Внутри тканевой среды ex vivo 32,33,41. Некоторые из них оценивали регенеративный потенциал клеток после трансплантации, наблюдая за их аксональным ростом внутри ткани 37,40,41, миелинизирующей способностью привитых предшественников олигодендроцитов 42, миграцией привитых клеток в ткань хозяина43 и высвобождением ли трансплантированные клетки факторов, подталкивающих к прорегенеративной среде31. Одним из ограничений текущих исследований является то, что они не изучают приживление в течение долгосрочного периода.
Учитывая, что НСК, по-видимому, требуется несколько недель для дифференцировки in vivo 44,45, данное исследование сосредоточено на том, как генерировать и поддерживать долгосрочные (≥30 дней) мышиные срезы СК в течение 90 дней. Было обнаружено, что срезы сохраняют свою первоначальную анатомическую структуру и поддерживают низкую и стабильную скорость апоптоза с течением времени и высокую жизнеспособность клеток. Мы наблюдали диффузную экспрессию нейрональных маркеров РНК-связывающих fox-1 гомолога 3 (RBFOX3) и легкой цепи нейрофиламентов (NFL), причем последняя демонстрирует тенденцию к увеличению аксонального прорастания вокруг срезов с течением времени, что свидетельствует об их здоровом состоянии. Кроме того, мы успешно трансплантировали в SC-срезы GFP-экспрессирующие человеческие SC-производные нейроэпителиальные стволовые клетки (h-SC-NES) человека на первых этапах дифференцировки нейронов. Трансплантат НСК сохраняли в течение 30 дней после трансплантации, и клетки демонстрировали экспрессию GFP в течение всего периода в культуре. Также было обнаружено, что скорость апоптотического нахождения клеток на следующий день после трансплантации (DPT) 30 соответствует значению скорости апоптоза, наблюдаемому при DPT 7 в тех же клетках40. Клетки, казалось, приживались в тканевой среде и выживали до нескольких недель.
Таким образом, наши данные показывают, что можно сохранять в культуре SC-органотипические срезы в течение 3 месяцев без нарушения их исходной цитоархитектоники и тканевой среды. Самое главное, что их можно использовать для тестирования клеточной терапии, прежде чем приступать к эксперименту in vivo , что снижает затраты и время эксперимента. Здесь мы подробно проиллюстрируем все этапы создания органотипических срезов мышиного SC и способы их хранения в течение длительных периодов (≥30 дней). Кроме того, мы подробно объясняем, как выполнять трансплантацию NPC в срезы и как поддерживать их для последующего анализа.
Protocol
Процедуры с животными проводились в строгом соответствии с протоколами, утвержденными Министерством здравоохранения Италии и местным Этическим комитетом Университета Пизы, в соответствии с Директивой 2010/63/ЕС (проектная лицензия No 39E1C). N.5Q7 от 30/10/2021). Мышей C57BL/6J содержали в регулируемой среде (23 ± 1 °C, 50 ± 5% влажности) с 12-часовым циклом «свет-темнота» с пищей и водой в неограниченном количестве.
Вся работа, связанная с клетками h-SC-NES, выполнялась в соответствии с рекомендациями NIH по получению и распределению тканей человека для целей биомедицинских исследований и с одобрения комитетов по исследованию на людях и комитетов по институциональной этике каждого института, из которого были получены образцы. Окончательное одобрение было получено от Комитета по биоэтике Пизанского университета (Отзыв No 29/2020). Обезличенные образцы человека были предоставлены за счет совместного гранта MRC/Wellcome Trust (099175/Z/12/Z), Ресурса биологии развития человека (www.hdbr.org). Было получено соответствующее информированное согласие, и вся доступная неидентифицирующая информация была зарегистрирована для каждого образца. С тканями обращались в соответствии с этическими принципами и правилами использования тканей человеческого мозга в научных целях, изложенными в NIH (http://bioethics.od.nih.gov/humantissue. html) и Хельсинкской декларации WMA (http://www.wma.net/en/30publications/10policies/b3/index.html).
1. Приготовление растворов и оборудования для изоляции и культивирования спинного мозга (СК)
- Решение для покрытия мембранных вставок
- Приготовьте раствор для покрытия (табл. 1): водный раствор с 0,1 мг мл-1 коллагена, 0,01 мг мл-1 поли-L-лизина и 0,01 мг мл-1 ламинина.
- Поместите каждую мембранную вставку в чашку диаметром 35 мм или в 6-луночную тарелку.
- Добавьте в верхнюю часть мембраны 1 мл лакирующего раствора: инкубируйте раствор в течение 4 ч при комнатной температуре (RT); затем снимите его и дайте мембранной вставке высохнуть в течение ночи (ВКЛ). Храните мембранные вставки при температуре 4 °C до их использования.
ПРИМЕЧАНИЕ: Все пассажи должны выполняться в стерильных условиях. Мембранное покрытие следует сохранять не более 1 недели при температуре 4 °C перед использованием, чтобы избежать деградации белка и неоптимальной адгезии среза к мембране.
- Подготовка сред: органотипическая среда, среда для препарирования, привитая среда
- Готовят органотипическую среду (ОМ, табл. 1).
- Приготовьте среду для рассечения, как описано в таблице 1.
- Подготовьте прививочную среду (GM, оптимизированная по Onorati et al.46, табл. 1).
Примечание: Растворы должны быть приготовлены в стерильных условиях и непосредственно перед их применением (за 1 день до или в тот же день эксперимента).
- Подготовка материала к операции
- В шкафу биобезопасности держите наготове: диссекционный стереомикроскоп и хирургические инструменты: две пары микроножниц, две пары прямых пинцетов и две пары изогнутых пинцетов.
- В шкафу биобезопасности подготовьте измельчитель инструмента, оснастив его лезвием для нарезки СК на ломтики. Поверните винт измельчителя, чтобы поднять металлический рычаг в том месте, где должно быть установлено лезвие. Поместите лезвие в отведенное для этого место, опустите металлический рычаг вместе с лезвием до тех пор, пока он не соприкоснется с режущей декой, и зафиксируйте его, затянув фиксирующий винт шестигранным ключом до тех пор, пока лезвие не будет надежно закреплено. Поверните микрометрический винт до желаемой толщины ломтика (обычно 350 мкм). Проверьте, правильно ли расположено лезвие перпендикулярно режущей деке.
ПРИМЕЧАНИЕ: Точное перпендикулярное расположение лезвия по отношению к режущей деке необходимо для правильного выполнения резки. - Подготовьте в шкафу биобезопасности: две пластиковые пастеровские пипетки (необходимы для перемещения изолированных СК и срезов), не менее четырех тарелок диаметром 35 мм и двух тарелок диаметром 60 мм, а также коробку со свежим льдом.
- Стерилизуйте все инструменты с помощью 70% этанола и ультрафиолета (один цикл по 20 минут) непосредственно перед их использованием, чтобы сохранить стерильность культуры.
2. Выделение СК мыши и генерация срезов
- Изоляция мышиного СК
- Принесите в жертву детенышей мыши на 3-й день (P3) в соответствии с лицензией проекта.
- С помощью лапаротомии по срединной линии с помощью микроножниц изолируйте поясничный отдел позвоночника от остального тела мыши и поместите его в среду для холодного рассечения в чашке диаметром 35 мм.
- С помощью диссекционного стереомикроскопа и микроножниц разрежьте позвоночник вдоль сагиттальной оси, а прямым пинцетом аккуратно удалите СК из полости позвоночника.
- Осторожно отклейте мозговые оболочки от изолированной поясничной области СК с помощью прямого пинцета.
- Перенесите и инкубируйте изолированную область поясничного отдела СК в холодной и свежей среде для рассечения в течение 10-15 минут, прежде чем приступить к следующему этапу.
- Генерация срезов
- С помощью одной пластиковой пипетки Пастера возьмите изолированную поясничную область SC из среды для рассечения и поместите ее на режущую деку измельчителя перпендикулярно лезвию.
ПРИМЕЧАНИЕ: Правильное расположение SC по отношению к лезвию (перпендикулярно) имеет важное значение для правильного создания срезов SC. - Удалите остаточную среду для рассечения на палубе вокруг СК с помощью пастеровской пипетки и стерильной абсорбирующей бумаги. Приступайте к автоматизированному секционированию SC.
- Как только срезы будут получены, нанесите немного свежей среды для препарирования с помощью пастеровской пипетки на режущую деку с ломтиками. Затем соберите ломтики в чашку диаметром 35 мм со свежей средой для препарирования и инкубируйте их в течение 15 минут.
- Во время инкубации срезов промойте поверхность мембранных вставок 3 раза ОМ с помощью пластиковой пипетки Пастера. Затем оставьте 1 мл ОМ на дне каждой мембранной вставки.
- Проверьте срезы под рассекающим стереомикроскопом. Засейте нужное количество ломтиков на кондиционированные мембранные вставки, переложив их пластиковой пастеровской пипеткой.
- Переместите срезы в желаемой ориентации и желаемом положении на мембранные вставки с помощью прямого пинцета. Удалите излишки среды с помощью пастеровской пипетки, чтобы срезы лучше прилегли к поверхности мембраны.
ПРИМЕЧАНИЕ: Перемещение и ориентация срезов с помощью прямого пинцета должны выполняться осторожно, чтобы избежать повреждения тканей или мембранного вкладыша. - После 30 минут инкубации при 37 °C переложите вкладыш в новую чашку Петри.
ПРИМЕЧАНИЕ: Прикасайтесь к пластиковому кольцу, но не к мембранам во время смены среды. - Добавьте 1 мл свежего ОМ, дополненного нейротрофическим фактором глиальной клеточной линии (GDNF) 100 мкл-1 на дно мембранной вставки.
- Инкубируйте ломтики при температуре 37 °C. Относитесь к первому дню в культуре как день ex vivo (DEV) 0.
- С помощью одной пластиковой пипетки Пастера возьмите изолированную поясничную область SC из среды для рассечения и поместите ее на режущую деку измельчителя перпендикулярно лезвию.
3. Долгосрочное культивирование органотипических срезов
- Выдерживайте срезы в культуре при температуре 37 °C до желаемых временных точек.
- Замените носитель на свежий ОМ в DEV 1, как описано в шагах 2.2.7-2.2.8.
- В DEV 3 переключите среду на GM, чтобы создать подходящую среду для трансплантации стволовых клеток на следующий день. Заменяйте носитель на свежий GM каждые 48 часов (например, DEV 5, DEV 7...).
- Добавляйте свежий GDNF (конечная концентрация 100 мкг мл-1) в среду каждый день до DEV 7. После DEV 7 добавляйте его только при смене носителя (шаг 3.3).
4. Культивирование клеток h-SC-NES
Примечание: h-SC-NES-клетки поддерживаются в культуре в присутствии факторов роста (среда NES, шаг 4.1.1). Перед трансплантацией клетки помещаются в предифференцировочное состояние в течение 7 дней путем удаления факторов роста из среды (Среда для предварительной дифференцировки: среда NES без фактора роста фибробластов 2 (FGF-2) и эпидермального фактора роста (EGF), шаг 4.1.2). Затем клетки помещают в состояние дифференцировки (Среда для дифференцировки, шаг 4.1.3) за 2 дня до трансплантации. Дифференцировка поддерживается добавлением нейротрофических добавок (нейротрофический фактор мозга, BDNF) в среду дифференцировки. Поддержание, расщепление, предварительная дифференцировка и дифференцировка клеток h-SC-NES12,46 подробно описаны ниже.
- Подготовка сред: НЭС, среды предварительной дифференцировки и дифференцировки
- Приготовьте среду для поддержания клеток h-SC-NES (среда NES, табл. 1).
- Приготовьте среду для предифференцировки клеток h-SC-NES (среда для предварительной дифференцировки, табл. 1).
- Приготовьте среду для дифференцировки клеток h-SC-NES (Среда для дифференцировки, табл. 1). Добавляйте BDNF в свежем виде при смене среды или при первом покрытии клеток в состоянии дифференцировки.
ПРИМЕЧАНИЕ: Все среды должны быть подготовлены в стерильных условиях и отфильтрованы фильтрами 0,22 мкм.
- Решение для нанесения покрытий на ячейки h-SC-NES
Примечание: клетки h-SC-NES поддерживаются в культуральных носителях, покрытых POLFN (POLFN = поли-L-орнитин, ламинин, фибронектин).- Приготовьте в пробирке раствор для покрытия: раствор поли-L-орнитина с ламинином (5 мкг/мл−1) и фибронектином (1 мкг/мл−1).
- Перенесите приготовленный раствор покрытия в подложку для клеточной культуры, стараясь добавить достаточно, чтобы покрыть всю поверхность подложки для клеточной культуры. Инкубируйте покрытие в течение 1 часа при 37 °C или в течение ночи при 4 °C.
- Удалите покрывающий раствор с опор для клеточных культур.
ПРИМЕЧАНИЕ: Раствор POLFN можно переработать еще два раза, но ламинин и фибронектин каждый раз следует добавлять свежими. - Промойте покрытие 3 раза стерильной водой для клеточных культур. Храните покрытия при температуре 4 °C или используйте его.
ПРИМЕЧАНИЕ: Покрытия следует использовать в течение 1 недели. После этого покрытия считаются просроченными из-за процессов деградации добавленных белков.
- Обслуживание клеток h-SC-NES
- Поддерживайте клетки h-SC-NES в культуре в среде NES. Проверяйте клетки каждый день под микроскопом, чтобы отслеживать, когда они достигают места слияния.
- Меняйте половину среды каждые 2 дня: удалите половину кондиционированной среды и добавьте свежую (учитывайте скорость испарения 20%).
- Если клетки достигли места слияния, приступайте к разделению, как описано в шаге 4.4.
- h-SC-NES клеточный пассаж
ПРИМЕЧАНИЕ: Ячейки разбиваются следующим образом: 12:- Удалите кондиционированную среду и промойте клетки один раз фосфатно-солевым буфером Дульбекко (DPBS) без Ca2+/Mg2+.
- Удалите DPBS и добавьте в клетки раствор трипсина/ЭДТА, чтобы выполнить ферментативную отслойку. Инкубировать клетки при 37 °C в течение от 30 с до 1 минуты.
- После инкубации проверьте клетки под микроскопом: если они не отделены, слегка постучите по подложке клеточной культуры, чтобы выполнить механическую отделку, и инкубируйте их при температуре 37 °C еще 30 с.
- После инкубации инактивируйте трипсин/ЭДТА, добавив 4 объема раствора DPBS/фетальной бычьей сыворотки (FBS) (10% об/об.) к поддержке клеточной культуры клетками и трипсином/ЭДТА. Аккуратно наносите раствор на опорную поверхность клеточной культуры вверх и вниз, чтобы помочь всем клеткам отделиться. Соберите клеточную суспензию в пробирку.
- Центрифугируйте клеточную суспензию при 200 × г в течение 3 мин. Выбросьте надосадочную жидкость и повторно суспендируйте гранулу в свежей среде NES.
- Подсчитайте клетки и нанесите их на каждую новую культуральную подложку, покрытую POLFN, с плотностью ̴0,5-1 × 105 клеток/см2.
- Добавьте Y-27632 (10 μM) и поместите элементы при температуре 37 °C. Проверяйте их каждый день до слияния, а затем снова разделяйте их для обслуживания/расширения или хранения сот.
- Преддифференцировка клеток h-SC-NES
- Разделите ячейки, как описано в шаге 4.4.
- Пластинчатую обработку клеток на клеточных носителях, покрытых покрытием POLFN, при плотности ̴0,5-1 × 105 кл/см2 в среде предварительной дифференцировки. Добавьте Y-27632 (10 μM) после разделения. Назовите день первого дня до дифференцировки in vitro (DIV) 0.
- Меняйте половину носителя каждые 2-3 дня (см. шаг 4.3.2).
- Поддерживайте клетки в состоянии предварительной дифференцировки до DIV 7, а затем приступайте к шагу 4.6.
- Дифференцировка клеток h-SC-NES
- При DIV 7 предифференцировки разделите клетки, как описано на шаге 4.4.
- Пластинчатую обработку клеток на клеточных культурах, покрытых покрытием POLFN, при плотности ̴1-1,5 ×10 5клеток/см2в среде для дифференцировки. Добавьте Y-27632 (10 мкМ) и BDNF (30 нг мл-1) после разделения.
- После 2 дней дифференцировки (DIV 10) разделите клетки для трансплантации на срезы.
5. Клеточная трансдукция h-SC-NES лентивирусными векторами, несущими GFP
ПРИМЕЧАНИЕ: Клеточная трансдукция выполняется во время фазы поддержания клеток h-SC-NES. Когда клетки правильно трансдуцируются, они могут быть расширены и применены ранее описанные протоколы предифференцировки и дифференцировки (шаги 4.5 и 4.6).
- Приготовление среды для клеточной трансдукции
ПРИМЕЧАНИЕ: Клеточную трансдукционную среду получают путем смешивания определенного объема среды NES и определенного объема препарата лентивирусного вектора (LVS) в соответствии с различными параметрами: желаемый MOI (кратность инфекции = отношение количества вирусных частиц к числу клеток-хозяев в данной инфекционной среде); количество пластинчатых ячеек; начальная концентрация препарата ЛЖ (=ЛЖ БОЕ, бляшонообразующая единица); площадь поверхности используемого сосуда для культивирования.- Рассчитайте правильный объем препарата ЛЖВ, который должен быть добавлен в среду NES, в соответствии с выбранным MOI, используя уравнения (1) и (2).
(n клеток к планшету/см2) × см2 поддержки клеточной культуры × MOI = LVS PFU для выбранного MOI (1)
LVS PFU : Tot Initial LVS Vol (μL) = LVS PFU для MOI : LVS Vol для добавления в среду (μL)(2)
ПРИМЕЧАНИЕ: LVS PFU (начальный PFU LVS) и общий начальный объем LVS указываются производителем. LVS PFU для выбранного MOI рассчитывается так, как описано в уравнении (1). Таким образом, мы можем получить объем препарата LVS, который должен быть добавлен к общему объему среды NES (на основе поддержки клеточной культуры) для выбранного MOI, как описано в уравнении (2).
Пример: Мы использовали MOI 3, основываясь на предыдущем лабораторном опыте (MOI может варьироваться в зависимости от используемой клеточной линии и вирусного препарата). Если желаемый MOI равен 3, то количество клеток, которые должны быть покрыты, составляет 0,5 × 105/см2, а культуральная поддержка составляет 1 лунку-MW24 (2 см2), предполагая, что начальная LVS PFU/TU (бляшка-образующая единица/преобразующая единица) составляет 25 × 106 PFU в 1 мл (1 000 μL = начальный объем LVS), расчеты имеют следующий результат:
Ячейки покрытые в 1 лунку MW24 (2 см2) = 0,5 × 105 ячеек × 2 см2 = 1 ×10 5 ячеек
1 × 105 ячеек × 3 (MOI) = 3 × 105 PFU = LVS PFU для MOI 3
25 × 106 PFU:1,000 μL = 3 × 105 PFU:x μL
x μL = 12 μL = объем LVS для добавления в среду
Таким образом, для трансдукции клеток средой для клеточной трансдукции с MOI 3 в 1 лунку MW24 добавляют 12 мкл исходного препарата LVS в среду NES (238 мкл), приготовленную для 1 лунки MW24. Итоговый общий объем составляет 250 μл.
ПРИМЕЧАНИЕ: Среда обычно готовится свежей в день трансдукции в стерильных условиях.
- Рассчитайте правильный объем препарата ЛЖВ, который должен быть добавлен в среду NES, в соответствии с выбранным MOI, используя уравнения (1) и (2).
- Протокол трансдукции h-SC-NES
- Пластинчатые ячейки h-SC-NES в низком проходе на 24-многолуночной пластине с покрытием POLFN (или в любой другой культуральной подложке) с плотностью 0,5 × 105/см2 в среде NES.
- На следующий день соберите кондиционированную среду NES из лунок, где были залиты клетки. В зависимости от выбранной опоры для культивирования добавьте в ячейки наименьший объем свежей среды для трансдукции клеток, необходимый для равномерного покрытия поверхности посева (например, 250 мкл/лунка 24-луночного планшета).
- Затем инкубируйте клетки h-SC-NES в течение 6 ч при 37 °C. После этого в клетки добавляют предварительно собранную кондиционированную среду (200 мкл/лунку 24-луночного планшета) и инкубируют клетки ON при 37 °С.
- На следующий день один раз промойте клетки h-SC-NES с помощью DPBS и проведите полную смену среды (NES medium).
- В последующие дни проверьте клетки под флуоресцентным микроскопом, чтобы наблюдать за экспрессией GFP.
- Расширьте клетки h-SC-NES для хранения и трансплантации клеток.
6. Трансплантация клеток в срезы SC и совместное культивирование
- Подготовка стеклянных микроигл
- Используйте пуллер для получения тонких игл из капилляров боросиликатного стекла. Установите съемник следующим образом: НАГРЕВ 990, ТЯНИ 350.
ПРИМЕЧАНИЕ: Из одного капилляра можно получить две тонкие иглы.
- Используйте пуллер для получения тонких игл из капилляров боросиликатного стекла. Установите съемник следующим образом: НАГРЕВ 990, ТЯНИ 350.
- Подготовка клеток к трансплантации
- Разделите ячейки, как описано в шаге 4.4.
Примечание: Если клетки не экспрессируют флуоресцентный репортер, пометьте их клеточным красителем, чтобы контролировать их с помощью флуоресцентного микроскопа после трансплантации и во время длительного культивирования. Следуйте протоколу выбранного производителя для этапа маркировки. - Подсчитайте ячейки после разделения и центрифугируйте при 200 × г в течение 3 мин. Полученную гранулу суспендировать со свежей средой + Y-27632 (10 μM) для получения желаемой концентрации клеток (обычно в пределах 30 000-50 000 клеток μL-1).
- Переложите клеточную суспензию в пробирку объемом 500 μл или 1,5 мл и поместите ее на лед. Клетки готовы к трансплантации.
- Разделите ячейки, как описано в шаге 4.4.
- Трансплантация клеток в органотипические срезы
ПРИМЕЧАНИЕ: Выполняйте трансплантацию клеток h-SC-NES в органотипические срезы мышей с помощью воздушного микроинъектора и стеклянных микроигл.- Загрузите стеклянную микроиглу с 4 μл клеточной суспензии с помощью микропипетки и наконечников микрозагрузчика.
ПРИМЕЧАНИЕ: Избегайте образования пузырьков воздуха в игле, так как это может затруднить процесс микроинъекции. Если образовались пузырьки, удалите их с помощью микропипетки. - Поместите иглу в назначенную опору микроинъектора и сломайте кончик иглы с помощью прямого пинцета.
ПРИМЕЧАНИЕ: Разбейте стеклянную иглу ближе к кончику, чтобы избежать образования больших отверстий. - Перед пересадкой в срезы задайте параметры микроинъектирования. Установите давление на 10 фунтов на квадратный дюйм.
ПРИМЕЧАНИЕ: Значение давления может быть изменено на основе микроинъектора и наблюдений оператора: давление должно быть достаточным для микроинъекции клеточной суспензии, избегая повреждения тканей. - На калиброванное предметное стекло нанесите каплю минерального масла с помощью пастеровской пипетки и внесите в каплю клеточную суспензию. Диаметр полученной сферы клеточной суспензии в масляной капле коррелирует с конкретным объемом микровпрыска. Изменяйте параметры микроинъекции по мере необходимости, чтобы достичь диаметра сферы клеточной суспензии 0,2 мм для введения 4 нл.
- После набора нужного объема быстро введите клеточную суспензию в срезы. Проверьте под флуоресцентным стереомикроскопом наличие клеток в срезах, чтобы убедиться, что микроинъекция/трансплантация прошла успешно.
ПРИМЕЧАНИЕ: Клеточная суспензия иногда может препятствовать введению иглы: в этом случае попытайтесь устранить закупорку клеточной суспензии, изменив параметры инъекции, или загрузите новую иглу свежей клеточной суспензией. - После трансплантации поместите срезы при температуре 37 °C и 5%CO2до желаемого момента времени и выполняйте смену среды через день, как описано в шагах 2.2.7-2.2.8.
- Загрузите стеклянную микроиглу с 4 μл клеточной суспензии с помощью микропипетки и наконечников микрозагрузчика.
7. Иммунофлуоресцентное окрашивание
- День 1
- Удалите среду со дна мембраны вкладыша и промойте ломтики 3 раза подогретым DPBS.
- Зафиксируйте ломтики предварительно подогретым 4% формальдегидом (FA): удалите DPBS и добавьте 1,5 мл 4% FA на дно мембранной вставки с ломтиками. После 15-минутной инкубации при ЛТ добавьте еще 1 мл 4% ЖК на верхнюю поверхность мембранного вкладыша и инкубируйте в течение 15 мин при ЛТ. Общее время фиксации: 30 мин при ЛТ
- Удалите 4% FA и промойте ломтики в течение 3 x 10 минут с помощью DPBS.
- Разрежьте мембрану вкладыша по окружности хирургическим ножом, отделите мембрану с срезами от пластиковой составляющей вкладыша и приступайте к этапам иммунофлюоресценции.
ПРИМЕЧАНИЕ: После этого шага мембрана с ломтиками плавает в DPBS в чашке. - Пермеабилизируйте 1 мл/мембрану раствора с 0,7% Тритоном в DPBS в течение 10 мин при РТ.
- Раствор для пермеабилизации удалить и инкубировать образцы в течение 4 ч при 4 °C с концентрацией 1 мл/мембрана блокирующего раствора, состоящего из 0,5% Тритона, 10% FBS в DPBS.
- Удалить блокирующий раствор и добавить к срезам первичные антитела при их рабочем разведении, например, антитело мыши к нейрофиламенту (NFL), 1:500; кролик против НФЛ, 1:500; антитело кролика к RBFOX3 (NeuN), 1:400; кроличья антиактивная каспазаза-3 (aCASP3), 1:400; мышиные античеловеческие ядра, (Hu-Nu), 1:400; кролик анти-Ху-Ну, 1:400; мышиный анти-GFP, 1:400 (как указано в таблице 1) в 1 мл раствора антитела, состоящего из 0,5% тритона, 1% FBS в DPBS. Инкубировать при температуре 4 °C.
- День 2
- Промывайте мембраны в течение 3 х 10 минут 1-2 мл DPBS.
- Инкубируйте мембрану с вторичными антителами (например, вторичным антителом Goat anti-Mouse IgG (H+L), Alexa Fluor 488, 1:500; вторичное антитело Goat anti-Rabbit IgG (H+L), Alexa Fluor 568, 1:500; вторичное антитело Goat anti-Mouse IgG (H+L), Alexa Fluor 647, 1:500; Козье вторичное антитело против кролика IgG (H+L), Alexa Fluor 647, 1:500, как показано в таблице 1) и Hoechst/DAPI для ядер, разведенных в 1 мл/мембрана раствора антитела (Triton 0,5% + FBS 1% в DPBS) в течение 3 ч в режиме ЛТ.
ПРИМЕЧАНИЕ: Тщательно защищайте образцы от света, чтобы избежать вторичного обесцвечивания антител во время инкубации и на следующих этапах. - Удалите раствор антитела и промывайте в течение 3 x 10 минут DPBS (1-2 мл).
- Замените DPBS свежим DPBS и храните при температуре 4 °C в защищенных от света условиях.
- По окончании протокола иммунофлюоресценции закрепите мембраны на предметных стеклах. Нанесите каплю 200 мкл монтажного раствора на предметное стекло. С помощью прямого пинцета перенесите плавающую мембрану с чашки диаметром 35 мм на защитный стебель, а затем перенесите мембрану на предметное стекло с помощью монтажного раствора.
- Нанесите каплю в 100 мкл монтажного раствора на новый покровный стекло и накройте им мембрану, закрепив ее на предметном стекле. Дайте ему высохнуть в течение ночи под химическим колпаком в защищенных от света условиях.
- Храните образцы при температуре 4 °C в темноте или проведите визуальный анализ.
8. Живой/мертвый анализ
- Приготовьте рабочий раствор, выделив 700 мкл на чашку свежей среды, и добавьте при правильном рабочем разведении Sytox (например, компонент В, 1:2000) и кальцеин АМ (например, компонент А, 1:2000).
ПРИМЕЧАНИЕ: Поскольку реагенты светочувствительны, защищайте рабочий раствор от света. - Оцените объем среды в нижней части мембраны и добавьте Sytox и Calcein AM в том же рабочем разведении, описанном в шаге 8.1.
- Добавьте по 2 капли по 30 мкл каждая сверху на каждый срез рабочего раствора, приготовленного на шаге 8.1.
ПРИМЕЧАНИЕ: Защищайте блюдо от света, ставя его в темные условия. - Инкубируйте ломтики в течение 30 минут при RT.
- После инкубации хирургическим ножом вырезаем мембрану по окружности от вкладыша: после этого мембрана с дольками плавает в рабочем растворе.
- Поместите мембрану без монтажного раствора вверх ногами на покровное стекло с помощью прямого пинцета и добавьте 100 μL DPBS поверх мембран, чтобы они оставались увлажненными.
- Получайте изображения в реальном времени с помощью конфокального микроскопа как можно быстрее.
ПРИМЕЧАНИЕ: Добавляйте 2 капли по 40 мкл DPBS на верхнюю часть мембраны каждые 30 минут во время получения изображения, чтобы предотвратить высыхание мембраны.
9. Визуализация
- Конфокальная визуализация неподвижных образцов
- Для качественного анализа получите изображения с помощью конфокального микроскопа со следующими параметрами съемки: установите вариант большого изображения (выберите: 4 x 4), используйте объектив 10 x, без стеков и разрешение 3 634 x 3 634 пикселей.
- Для количественного анализа (aCASP3, Calcein и Sytox для срезов и aCASP3 для клеток) получают изображения с помощью конфокального микроскопа со следующими параметрами захвата: объектив 20, разрешение 1,024 x 1,024 пикселя с Z-шагом 3 мкм.
- Живая визуализация пересаженных срезов с помощью стереомикроскопа
ПРИМЕЧАНИЕ: Получение изображений с помощью стереомикроскопа в режимах светлого поля и эпифлуоресценции.- Используя настройку светлого поля , получите изображения срезов (здесь используется 1-кратный объектив с 3-кратным зумом ).
ПРИМЕЧАНИЕ: Изменяйте свет в зависимости от используемого микроскопа и при необходимости используйте оптические волокна. - Используя настройку флуоресценции , получить изображения трансплантированных клеток с тем же объективом и зумом, которые использовались для срезов (см. шаг 9.2.1). Используйте следующие параметры для захвата: усиление 1, экспозиция 200-500 мс, смещение -10.
- Используя настройку светлого поля , получите изображения срезов (здесь используется 1-кратный объектив с 3-кратным зумом ).
- Визуализация в реальном времени после анализа живого/мертвого с помощью конфокального микроскопа
- Получение изображений с помощью конфокального микроскопа со следующими параметрами съемки: объектив 20x, разрешение 1,024 x 1,024 пикселей с шагом Z-3 мкм.
10. Анализ изображений с помощью ImageJ
- Анализ областей NFL, RBFOX3 и DAPI
- Откройте программу ImageJ (https://imagej.net/software/imagej/).
- Откройте изображение файла, нажав Файл | открыть | выбрать файл | открыть.
- Во всплывающем окне выберите Просмотр стопки | Гиперстек и цветовой режим | По умолчанию (с автомасштабированием).
- На панели инструментов выберите Изображение | Цвет | Раздельные каналы.
- Выберите нужные каналы для анализа: зеленый канал для NFL (аксональный маркер), красный канал для RBFOX 3 (нейронный маркер) и синий канал для DAPI (ядерное окрашивание).
- Для анализа НФЛ выполните следующие действия: на панели инструментов выберите Изображение | Настройка | Порог | Выберите параметры (темный фон, алгоритм, например, по умолчанию) и переместите курсор по шкале значений (под/над), чтобы покрыть и описать всю область нейритов (нейриты выделяются белым цветом на темном фоне) | Набор | Подайте заявку.
- Выберите на панели инструментов инструмент трассировки Wand и используйте его для автоматического определения белой области, покрытой NFL. Нажмите «Анализ» | Мера | Площадь вмкм2.
- Для анализа DAPI и RBFOX3 выполните следующие действия: на панели инструментов выберите Изображение | Настройка | Порог | Выберите параметры (белый фон, алгоритм, например, по умолчанию) и переместите курсор по шкале значений (под/над), чтобы покрыть и описать всю область RBFOX3 или DAPI | Набор | Подайте заявку.
- На панели инструментов выберите Процесс | БПФ | Полосовой фильтр. Используйте полосу порогового значения для настройки белой области, покрываемой RBFOX3 или DAPI, в соответствии с их сигналом флуоресценции.
- На панели инструментов выберите инструмент трассировки Wand и используйте его для автоматического определения области, охватываемой RBFOX3 или DAPI. Нажмите «Анализ» | Мера | Площадь вмкм2.
- Анализ апоптоза с помощью ImageJ
- Откройте программу ImageJ (https://imagej.net/software/imagej/).
- Откройте образ файла Z-stack, нажав Файл | открыть | выбрать файл | открыть.
- Во всплывающем окне выберите Просмотр стопки | Гиперстек и цветовой режим | По умолчанию (с автомасштабированием).
- На панели инструментов выберите Изображение | Цвет | Раздельные каналы.
- Выберите нужные каналы: красный канал для aCASP3 (маркер апоптоза для анализа) и синий или голубой для DAPI или Hu-Nu для ядер. Затем наложите каналы, выбрав на панели инструментов Изображение | Цвет | Объединение каналов | Создать композит.
- Перетащите Z-полосу в нижней части изображения, чтобы просмотреть Z-стек изображения и определить стеки в центральной области срезов с положительным результатом aCASP3.
- На панели инструментов выберите Плагины | Анализ | Счетчик ячеек.
- В открывшемся всплывающем окне выберите Инициализировать , чтобы подготовить изображение к подсчету; затем выберите тип счетчика (например, Тип 1) и переименуйте его в качестве объекта для подсчета (например, ячейки aCASP3+ ). Переименуйте другие типы счетчиков, как описано выше, чтобы подсчитать другие объекты (например, ячейки DAPI+ или Hu-Nu+ для общего количества ячеек).
- Во всплывающем окне выберите тип счетчика, соответствующий объекту для подсчета (например, ячейки aCASP3+ ), затем выберите на панели инструментов инструмент «Точка » и начните вручную подсчитывать количество ячеек апоптоза, положительных для aCASP3, кликая по каждой положительной на открывшемся изображении.
- Выберите другой тип счетчика в окне счетчика ячеек и начните подсчитывать общее количество ячеек (DAPI+ ячеек, для срезов; Hu-Nu+ клетки, для трансплантированных клеток).
- Анализ живых/мертвых проб с помощью ImageJ
- Откройте программу ImageJ (https://imagej.net/software/imagej/).
- Откройте образ файла Z-stack, нажав на Файл | открыть | выбрать файл | открыть.
- Во всплывающем окне выберите Просмотр стопки | Гиперстек и цветовой режим | По умолчанию (с автомасштабированием).
- На панелях инструментов выберите Изображение | Цвет | Раздельные каналы.
- Выберите нужные каналы: зеленый канал для кальцеина (маркер живучести для анализа) и голубой канал для Sytox (маркер мертвости). Затем наложите каналы, выбрав на панели инструментов Изображение | Цвет | Объединение каналов | Выберите Создать составной.
- Перетащите Z-полосу в нижней части изображения, чтобы просмотреть Z-стек изображения и определить стеки в центральной области срезов с положительным эффектом кальцеина и Sytox.
- На панели инструментов выберите Плагины | Анализ | Счетчик ячеек.
- В открывшемся всплывающем окне выберите Инициализировать , чтобы подготовить изображение к подсчету; затем выберите тип счетчика (например, Тип 1) и переименуйте его в объект для подсчета (например, ячейки Calcein+ ). Переименуйте другие типы счетчиков, как описано выше, если необходимо подсчитать другой объект (например, ячейки Sytox+ ).
- Во всплывающем окне выберите тип счетчика, соответствующий объекту для подсчета; затем выберите на панели инструментов инструмент «Точка » и начните вручную подсчитывать количество ячеек Calcein+ , нажимая на каждую положительную на открывшемся изображении.
- Выберите другой тип счетчика в окне счетчика ячеек и подсчитайте ячейки Sytox+ , как описано для Calcein.
11. Графики и статистический анализ
- Выполняйте весь статистический анализ и стройте графики с помощью выбранного программного обеспечения.
Representative Results
Описанные методы позволяют создавать СК-органотипические срезы от мышей на стадии Р3 и поддерживать их в культуре в течение длительного времени в здоровых условиях. Кроме того, мы показываем протокол трансплантации клеток в срезы и их совместного культивирования в течение 30 дней (рис. 1). Во-первых, мы показываем оптимизацию условий культивирования и протокол, подходящий для длительного культивирования срезов SC с трансплантированными клетками (рис. 2A). Срезы генерируются и поддерживаются с DEV 0 до DEV 2 в OM, которая первоначально была предложена в качестве оптимальной среды для обслуживания SCсрезов 47. Однако из-за присутствия сывороточных белков эта среда может быть неоптимальной для поддержания дифференцировки нейронов и созревания трансплантированных нейральных клеток-предшественников. Действительно, на DEV 3 мы протестировали переход с ОМ на GM, состав, содержащий нейробазал плюс B27, который поддерживает выживание нейронов, и без сыворотки, которая ингибирует правильную дифференцировку нейронов, способствуя вместо этого глиальной судьбе48,49.
На рисунке 2B показаны результаты, достигнутые при переключении среды в DEV 3 с ОМ на ГМ, по сравнению с срезами СК, не получавшими переключение (контрольные срезы культивировались в ОМ). Мы использовали распределение сигнала NFL внутри срезов в качестве маркера целостности нейронов (рис. 2B, C). Срезы в DEV 7 были здоровыми в обоих условиях культивирования, демонстрируя диффузное распределение нейрофиламентов (NFL, зеленым цветом) внутри них. В DEV 10 срезы, культивированные в GM, казались более здоровыми по сравнению с контрольными срезами, культивированными в OM, что было задокументировано в распределении окрашивания NFL. Мы также оценили площадь NFL+ (% NFL+ Area/DAPI+ Area) срезов, показанных на репрезентативных изображениях на рисунке 2B. Оцененная зона NFL+ представлена на гистограммах на рисунке 2C, подтверждая, что сигнал NFL диффузно распределяется в срезах на DEV 7 при обоих условиях. Однако в DEV 10 расчетная площадь, покрываемая окрашиванием NFL, уменьшается для условий культивирования ОМ.
Эти данные свидетельствуют о том, что переход на GM в DEV 3 хорошо переносится при длительном культивировании срезов SC (DEV 10). В качестве следующего шага мы протестировали GM на более длительных временных точках: DEV 30, DEV 60 и DEV 90. Как показано на рисунках 3A, B срезы сохраняли здоровыми в культуре до DEV 90. Окрашивание НФЛ было обнаружено широко присутствующим в срезах в каждый момент времени, с диффузным прорастанием вокруг срезов нейритов, отходящих из центральной области. Действительно, мы оценили площадь NFL+ срезов, показанных на рисунке 3A , и со временем она увеличивалась, как показано на гистограммах рисунка 3B. Мы также наблюдали положительное отношение к нейронному маркеру RBFOX3, что является еще одним доказательством нейронной дифференцировки срезов. В каждый момент времени мы также проверяли частоту апоптоза, оценивая в разных срезах количество клеток, положительных к aCASP3 (рис. 4A, B). Анализ проводили, как описано в разделе 10.2 протокола. Частота апоптотических колебаний (% aCASP3+ клеток/общее количество DAPI+ клеток) была очень низкой в каждый момент времени (0,85 ± 0,52%, 0,71 ± 0,27%, 0,66 ± 0,45% для DEV 30, 60 и 90 соответственно) без существенных различий между тремя рассматриваемыми временными точками (p-значение > 0,05, рисунок 4B). Эти данные свидетельствуют о том, что скорость апоптоза, связанная с aCASP3, остается стабильной во времени и, вместе с широким распределением NFL в срезах (рис. 4A), подтверждают выживаемость срезов в каждой временной точке.
В поддержку предыдущих данных мы также провели анализ живого/мертвого времени, чтобы оценить жизнеспособность срезов в трех разных временных точках. Мы использовали кальцеин (зеленое окрашивание) для маркировки жизнеспособных и метаболически активных клеток и Sytox (голубое окрашивание) для оценки гибели клеток. Как показано на гистограммах на рисунке 4C, процент метаболически активных клеток незначительно увеличивается с DEV 30 до DEV 90 (93,17 ± 5,21%, 96,43 ± 3,02%, 96,33 ± 3,10% для DEV 30, 60 и 90 соответственно), стабилизируясь между последними двумя временными точками (DEV 30 против p-значения DEV 60 = 0,018; p-значение DEV 30 против DEV 90 = 0,027; p-значение DEV 60 против DEV 90 = 0,99). Мы обнаружили низкие уровни гибели клеток, которые снижались с течением времени (6,83 ± 5,21%, 3,57 ± 3,02%, 3,66 ± 3,10% для DEV 30, 60 и 90 соответственно), и была обнаружена значительная разница между DEV 30 и более поздними временными точками, DEV 60 и DEV 90 (p-значение DEV 30 против DEV 60 = 0,018; p-значение DEV 30 против DEV 90 = 0,027; p-значение DEV 60 против DEV 90 = 0,99). Эти данные, в сочетании с частотой апоптоза, подтверждают выживаемость среза с течением времени и поддерживают эффективность выполненного протокола долгосрочного культивирования.
После того, как была установлена возможность длительного культивирования срезов SC, мы поставили перед нами задачу провести трансплантацию клеток h-SC-NES на первых этапах дифференцировки нейронов. Мы протестировали клетки h-SC-NES, поскольку они показали многообещающие результаты при лечении ТСМ12. Процедура трансплантации клеток h-SC-NES в мышиные срезы SC описана в разделе 6 протокола. Срезы SC и трансплантированные клетки h-SC-NES поддерживали до DPT 30. Клетки были привиты на стадии дифференцировки DIV 10 (нейронный предшественник) в органотипические срезы DEV 4, как показано на схеме протокола на рисунке 5А. Трансплантированные клетки контролировали на экспрессию GFP в культуре в течение 30 дней. На рисунке 5B показаны репрезентативные живые изображения СК-среза с трансплантированными GFP+ клетками в реальном времени при различном DPT. Стабильная экспрессия GFP с течением времени (рис. 5B и рис. 6A) позволяет предположить, что клетки выжили в ткани SC в ранее оптимизированных условиях культивирования. Мы также проверили частоту апоптоза трансплантированных клеток, как описано в разделе 10.2 протокола. Частота апоптоза (% aCASP3+ клеток/общее количество Hu-Nu+ клеток) была очень низкой (0,44 ± 0,34%) после 30 DPT (рис. 6B). Более того, было обнаружено, что скорость апоптоза при DPT 30 соответствует частоте апоптоза для того же типа клеток при DPT 7, как сообщалось ранее40, что свидетельствует о том, что культуры стабилизируются с течением времени.
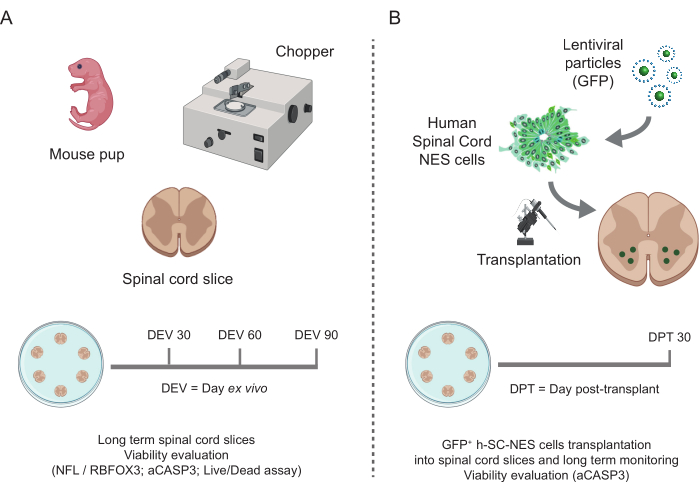
Рисунок 1: Рабочий процесс протокола. Репрезентативная схема, показывающая общий документооборот выполняемого протокола. (A) Слева схема, обобщающая генерацию SC-срезов мыши из изолированных SC детенышей мыши в точке P3 и долгосрочное культивирование SC-органотипических срезов. (B) Справа схема, обобщающая трансплантацию клеток h-SC-NES, экспрессирующих GFP, в мышиные SC-органотипические срезы. Привитые клетки сохраняются в течение 30 дней после трансплантации. Сокращения: h-SC-NES = нейроэпителиальный ствол спинного мозга человека; GFP = зеленый флуоресцентный белок; DEV = день ex vivo; АКДС = сутки после трансплантации; NFL = легкая цепь нейрофиламентов; RBFOX3 = РНК-связывающий гомолог fox-1 3; aCASP3 = активная каспаза-3; SC = спинной мозг. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
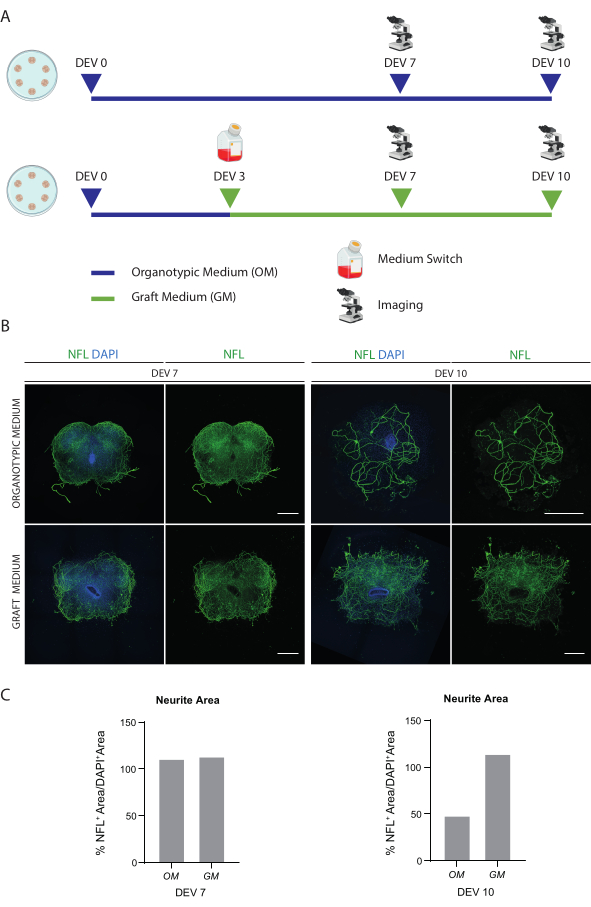
Рисунок 2: Оптимизация долгосрочных условий культивирования. (A) Репрезентативная схема протокола тестирования ОМ и ГМ. ОМ сохраняется до DEV 7-10 для контрольной группы. Среда переключается на GM на DEV 3 для обработанных срезов; затем они фиксируются на уровне DEV 7-10 для сравнения с контрольными элементами. (B) Репрезентативные изображения, сравнивающие органотипические срезы мышей SC на DEV 7 и 10, культивируемые в различных условиях. Срезы окрашиваются для цитоскелетного маркера нейрофиламента (NFL, зеленого цвета). Широкое распространение окрашивания NFL в срезах, культивированных с помощью GM, предполагает общую выживаемость и дифференциацию. Ядра окрашиваются с помощью DAPI. Масштабная линейка = 500 мкм. (C) Репрезентативные гистограммы оценки площади, покрытой НФЛ, в срезах, показанных на рисунке 1B. В DEV 10 площадь поверхности NFL уменьшается в состоянии культивирования ОМ. Сокращения: DEV = день ex vivo; DAPI = 4',6-диамидино-2-фенилиндол; NFL = легкая цепь нейрофиламентов; ОМ = органотипическая среда; GM = привитая среда; SC = спинной мозг. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
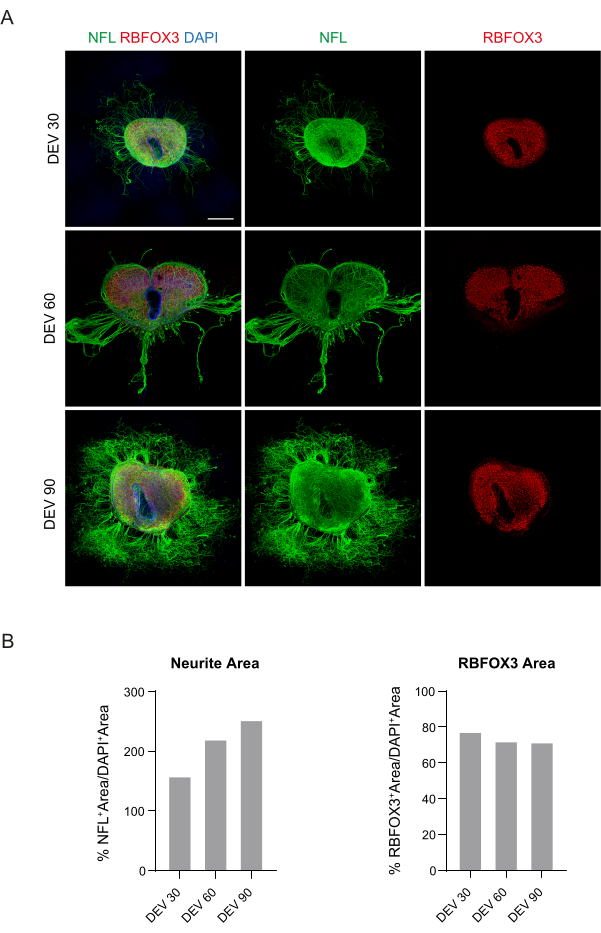
Рисунок 3: Долгосрочно культивируемые SC органотипические срезы. (A) Срезы сохраняются в культуре до DEV 90. Иммунофлуоресцентный анализ показывает широкое распределение нейрофиламента цитоскелетного маркера (NFL, зеленый) и ядерного нейронального маркера RBFOX3 (красный), что свидетельствует об их здоровом состоянии и нейронной идентичности после длительного культивирования. Следует отметить, что аксоны NFL+ со временем диффузно прорастают вокруг срезов. Ядра окрашиваются с помощью DAPI. Масштабная линейка = 500 мкм. (B) Репрезентативные гистограммы оценки площади и времени NFL+ и, RBFOX3+ площади срезов, показанных на панели A. Площадь нейритов NFL+ со временем увеличивается. Сокращения: DEV = день ex vivo; DAPI = 4',6-диамидино-2-фенилиндол; NFL = легкая цепь нейрофиламентов; SC = спинной мозг; RBFOX3 = РНК-связывающий гомолог fox-1 3. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
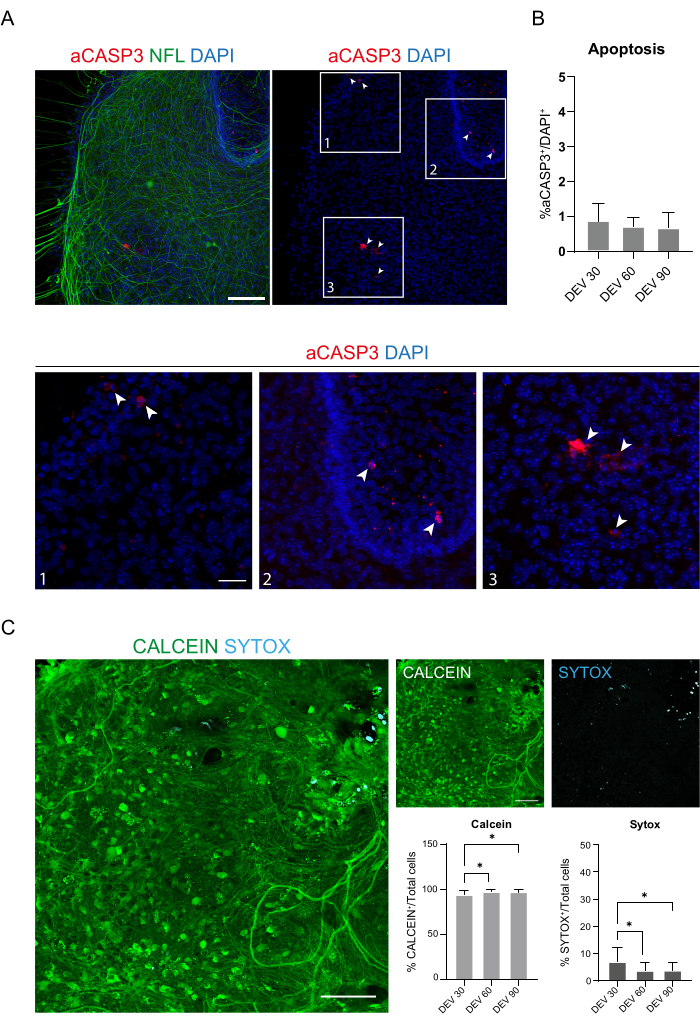
Рисунок 4: Оценка жизнеспособности клеток в срезах SC с течением времени. (A) Репрезентативные изображения органотипических срезов в DEV 60, окрашенных для aCASP3 (красный) и NFL (зеленый). Масштабная линейка = 100 мкм. НФЛ демонстрирует диффузную картину. Редкие клетки положительны на маркер апоптоза aCASP3 (Inset: 1-2-3). (Б) Анализ скорости апоптоза в срезах в разные моменты времени. Среднее значение ± SD, N (повторяется) = 6 срезов, n (общее количество клеток) > 1000 для каждого среза, критерий Краскела-Уоллиса, многократное сравнение, p-значение > 0,05. Скорость апоптоза стабильна с течением времени. На врезках 1-2-3 панели А можно наблюдать детали клеток, положительных на aCASP3 (красное окрашивание, белые стрелки). Маленькими красными точками обозначены клеточный мусор и пикнотические ядра. Масштабная линейка = 50 мкм. (C) Репрезентативные изображения анализа живых/мертвых клеток, выполненного на срезах SC при DEV 90: метаболически активные клетки помечены зеленым цветом с помощью кальцеина, в то время как мертвые и поврежденные клетки помечены светло-голубым (голубым) с помощью Sytox. Две гистограммы показывают процент клеток, положительных на кальцеин (слева) и Sytox (справа) от общего количества клеток. Для обоих средних значений ± SD, N (повторяется) = 6 срезов, n (общее количество ячеек) > 1 000 для каждого среза, критерий Краскела-Уоллиса, многократное сравнение, p-значение DEV 30 против DEV 60 = 0,018; p-значение DEV 30 против DEV 90 = 0,027; p-значение DEV 60 против DEV 90 > 0,99. Сокращения: DEV = день ex vivo; DAPI = 4',6-диамидино-2-фенилиндол; NFL = легкая цепь нейрофиламентов; SC = спинной мозг; aCASP3 = активная каспараза-3. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
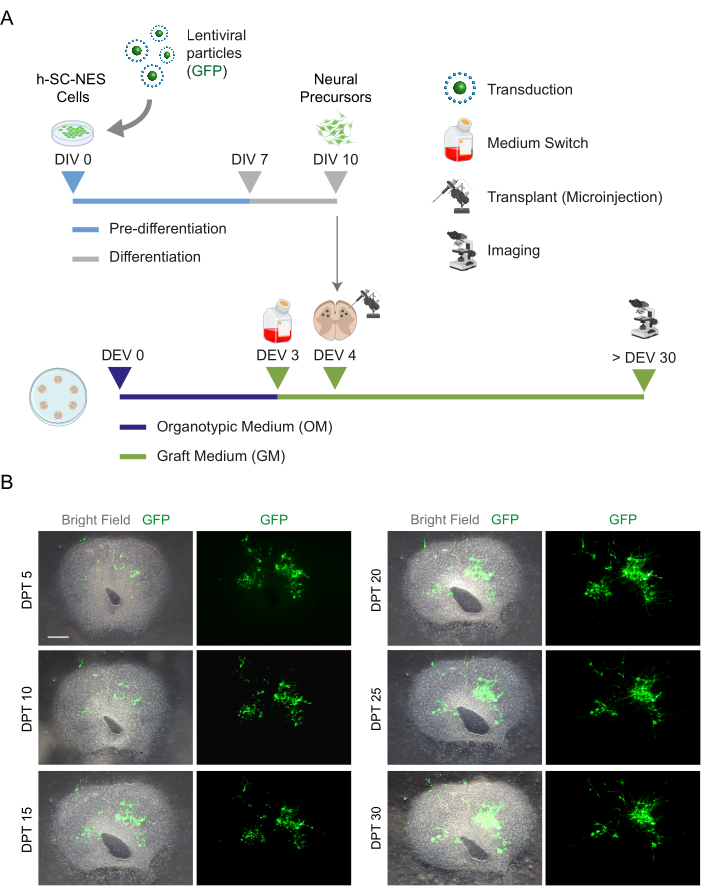
Рисунок 5: Трансплантация клеток h-SC-NES в органотипические срезы мыши. (A) Репрезентативная схема протокола трансплантации. Клетки трансплантируются в качестве нейронных предшественников в DIV 10 дифференцировки в органотипические срезы DEV 4. (B) Репрезентативные изображения органотипических срезов мышей, трансплантированных с помощью GFP-экспрессирующих h-SC-NES клеток с течением времени до DPT 30. Клетки трансдуцируются лентивирусным вектором, несущим ген GFP . Экспрессия GFP с течением времени подтверждает их жизнеспособность и адаптацию к среде среза. Масштабная линейка = 500 мкм. Сокращения: DIV = первый день в предварительной дифференцировке; h-SC-NES = нейроэпителиальный ствол спинного мозга человека; GFP = зеленый флуоресцентный белок; DEV = день ex vivo; ОМ = органотипическая среда; GM = привитая среда; АКДС = дни после трансплантации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
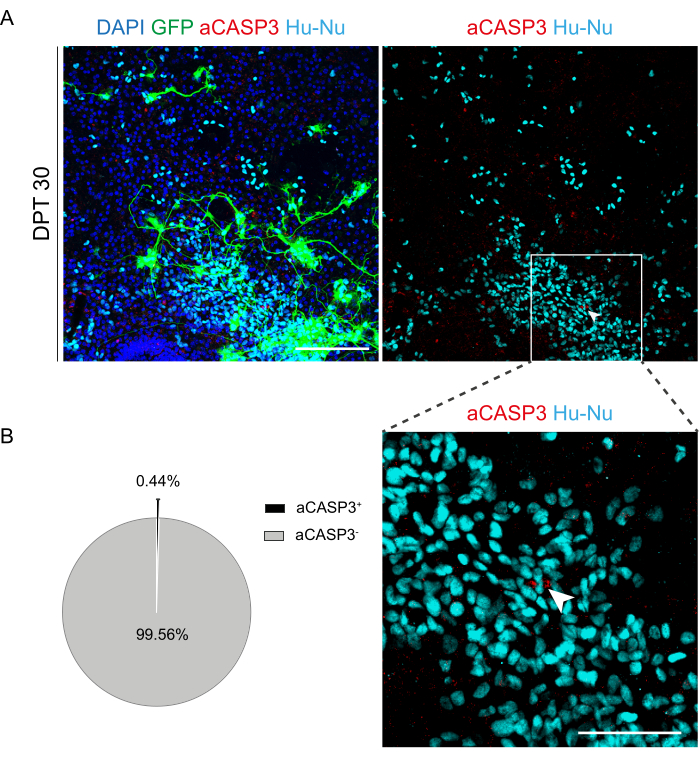
Рисунок 6: Оценка скорости апоптоза трансплантированных клеток h-SC-NES через 30 дней после трансплантации. (A) Репрезентативное изображение органотипического среза мыши, трансплантированного GFP-экспрессирующими h-SC-NES-клетками. Клетки трансдуцируются лентивирусным вектором, несущим ген GFP , для мониторинга их в срезы после трансплантации. Экспрессия GFP с течением времени подтверждает их жизнеспособность и адаптацию к среде среза. Показанная временная точка — DPT 30; клетки окрашиваются для ядра человека (голубой) и aCASP3 (красный). Масштабная линейка = 150 мкм. (B) Слева репрезентативная круговая диаграмма анализа апоптоза клеток, трансплантированных в срезы при DPT 30 (N (репликации) = 5 срезов, n (клетки) = 5000), а справа вставка из клеток Hu-Nu+ и деталь клетки, положительной к aCASP3 (белая стрелка). Масштабная линейка = 75 мкм. Маленькими красными точками обозначены клеточный мусор и пикнотические ядра. Сокращения: h-SC-NES = нейроэпителиальный ствол спинного мозга человека; GFP = зеленый флуоресцентный белок; АКДС = сутки после трансплантации; DAPI = 4',6-диамидино-2-фенилиндол; NFL = легкая цепь нейрофиламентов; aCASP3 = активная каспаза-3; Hu-Nu = ядра человека. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Таблица 1: Состав растворов, используемых в данном протоколе. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Discussion
До сих пор не существует эффективного лечения пациентов с ТСМ. Были опробованы различные подходы, и один из наиболее перспективных основан на регенеративной стратегии – замене клеток. В настоящее время достижения в области регенеративной медицины требуют новых платформ для проверки эффективности и безопасности клеточных трансплантатов, отдельно или в сочетании с другими подходами. Их доклиническая валидация имеет важное значение для проведения дальнейших клинических исследований. Органотипические культуры СК являются полезной платформой для изучения различных аспектов нейродегенерации, нейронной регенерации и нейроразвития, а также для исследования эффективности новых терапевтических подходов23. В частности, специфические особенности органотипических культур, такие как сохранение исходной гистоархитектуры и состава клеток и микроокружения, являются полезными для разгадки динамики трансплантации, такой как приживление клеток, интеграция, дифференцировка и созревание.
В соответствии с опубликованными протоколами, органотипические срезы СК могут сохраняться в культуре в течение примерно 2-3 недель в здоровых условиях, что ограничивает их использование для долгосрочных исследований и функционального скрининга, необходимых для тестирования схем клеточной терапии. Изучение важных процессов, таких как дифференцировка и созревание для правильной судьбы трансплантированных клеток внутри ткани СК, требует долгосрочного мониторинга. Эти клеточные процессы имеют решающее значение при обычной трансплантации на животных моделях. Наличие системы ex vivo , которая имитирует многие функции, присутствующие in vivo , было бы полезно на этапе доклинического скрининга.
По этой причине в данной работе мы предлагаем оптимальный долгосрочный (≥30 дней) метод органотипического культивирования СК, позволяющий сохранять жизнеспособность СК срезов до 90 дней, втрое превышая их обычные сроки культивирования. Кроме того, мы демонстрируем стабильное приживление клеток h-SC-NES внутри срезов SC и поддержание культуры трансплантата в течение 30 дней. Мы контролировали приживление клеток с течением времени, наблюдая за экспрессией GFP, чтобы проверить выживаемость клеток до DPT 30. После 30 DPT мы оценивали частоту апоптоза клеток. Влитературе сообщалось об оценке апоптоза трансплантированных клеток h-SC-NES в SC-срезах при 7 DPT. В данной работе мы расширили анализ клеточного апоптоза при DPT 30, чтобы сравнить частоту апоптоза по отношению к более ранней временной точке (DPT 7). Мы обнаружили, что наши данные согласуются с литературой, предполагающей, что трансплантированные h-SC-NES клетки выживают и в более поздний момент времени, если они поддерживаются в культуральных условиях, оптимизированных в нашей работе. Эта усовершенствованная долгосрочная платформа ex vivo сама по себе и в конфигурации трансплантации поможет исследователям в доклиническом скрининге трансплантаций стволовых клеток на ТСМ. Это позволит им определить наилучших кандидатов на клетки для дальнейших исследований in vivo , способствующих успеху трансплантаций. Более того, после первоначального скрининга органотипические срезы СК также могут быть использованы параллельно с исследованиями in vivo для подтверждения и подтверждения долгосрочной клеточной динамики и поведения, наблюдаемых на животных моделях, или для поддержки механистических исследований.
В нашем протоколе подробно описано, как создать эту долгосрочную органотипическую модель, но также следует обсудить некоторые важные шаги. Что касается создания органотипических культур СК, то во время операции и на первых этапах культивирования возникают некоторые проблемы. Хорошо выполненная хирургическая процедура необходима для создания срезов, которые сохраняют исходную гистоархитектуру. Если СК разрушается во время изоляции, срезы могут потерять свою типичную анатомическую структуру, а повреждение тканей может вызвать чрезмерное провоспалительное повреждение, приводящее к нездоровым условиям и гибели клеток. Наиболее сложным этапом операции является извлечение СК из позвоночника и удаление мозговых оболочек из изолированного СК. Успех этих этапов зависит от опыта оператора; Поэтому рекомендуется провести период обучения перед началом экспериментов.
Корональное сечение СК с помощью измельчителя также является сложным этапом. Изолированный SC должен быть размещен на режущей деке точно перпендикулярно лезвию. Оператор также должен расположить лезвие перпендикулярно режущей деке. Эти меры предосторожности необходимы для обеспечения генерации воспроизводимых срезов в одних и тех же и разных экспериментах. Еще одним важным моментом является то, что время на операцию ограничено: вся процедура генерации среза должна занимать ~30 минут. Если оператор потратит больше времени на хирургию и разрез, ткань СК пострадает, и это может нарушить успех посева и следующие этапы эксперимента.
После того, как срезы размещены на пленке культуры, важно правильно их подкормить. GDNF необходим для поддержания восстановления и выживания тканей. Резка измельчителем травматична для ткани, и по этой причине срезы помещаются вскоре после разреза в ледяную среду для препарирования, чтобы очистить избыток провоспалительных и способствующих смерти молекул. Затем срезы помещают на мембраны культур (вставки для клеточных культур) со свежей средой, модифицированной GDNF, чтобы способствовать более быстрому восстановлению и адгезии среза к мембране. GDNF следует добавлять в среду каждый день в течение первой недели в культуре из-за его короткого периода полураспада50,51. Мы заметили, что срезы нуждаются в постоянном присутствии GDNF в течение первых дней в культуре, чтобы способствовать восстановлению и жизнеспособности тканей. В любом случае, поскольку присутствие GDNF важно в течение всего периода культивирования, настоятельно не рекомендуется прерывать введение GDNF в последующие моменты времени.
В течение первой недели в культуре также важно проверить срезы макроскопически на глаз и под микроскопом. Полупрозрачная ткань и прозрачность границ являются признаками правильного сцепления срезов с мембраной и жизнеспособной ткани. Некротизированная ткань будет казаться чрезвычайно белой на первый макроскопический взгляд, а некротические участки будут казаться темно-серыми под микроскопом. После нескольких недель в культуре морфология ткани может измениться: на этот процесс могут влиять движения клеток и адгезия тканей к мембране. Мы наблюдали, например, потерю центрального просвета в некоторых срезах, заполненных клетками, и потерю морфологии дорсального и вентрального рога. Это происходит в основном с более мелкими срезами, при этом большинство из них сохраняют анатомическую структуру, близкую к исходной. Срезы обычно образуются из поясничного или грудного отделов, потому что таким образом они могут иметь размер, соответствующий для сохранения своей первоначальной гистоархитектуры с течением времени: если они слишком малы, они теряют свою архитектуру, в то время как если они слишком большие, центральная область может подвергнуться некрозу. Таким образом, мы использовали поясничный отдел мышиных детенышей для создания срезов с подходящим размером для оптимального долгосрочного культивирования, но, в принципе, можно рассмотреть и другие сегменты. Более того, мы выбрали поясничный отдел, потому что вентральный и дорсальный отделы более различимы друг от друга. Кроме того, в этой области представлены участки тканей с более высоким процентом моторных нейронов и серого вещества, которые представляют интерес для клеточной заместительной терапии при ТСМ. Что касается трансплантации клеток в срезы, основная проблема связана с поломкой стеклянного кончика микроиглы. Если отверстие для прохождения клеток слишком большое, это может привести к повреждению ткани СК во время микроинъекции. Если она слишком мала, накопление клеток может затруднить введение иглы, затрудняя процесс трансплантации. Процедура трансплантации должна быть завершена в течение 1 часа, чтобы свести к минимуму страдания и гибель клеток.
Предложенный протокол является оптимальным и универсальным инструментом для проведения различных видов исследований. Здесь мы применяем нашу долгосрочную платформу для валидации трансплантации клеток h-SC-NES на первых этапах дифференцировки внутрь мышиной ткани SC в течение 30 дней. Основной новизной предложенного подхода является оптимизация протокола совместной культуры. Компоненты GM поддерживают долгосрочную выживаемость нейронов SC-срезов и трансплантированных клеток h-SC-NES. Действительно, ГМ, будучи средой, не содержащей сыворотки, поддерживает дифференцировку трансплантированных клеток в сторону нейронной судьбы по отношению к среде, ранее использованной для органотипической культуры срезов47.
Что касается предложенных моделей для ТСМ, то эксперименты обычно проводятся на взрослых мышах. До сих пор наиболее существенные различия между неонатальным и взрослым СК связаны с более высоким регенеративным потенциалом, обнаруженным у новорожденных по сравнению со взрослыми мышами52. Тем не менее, такие различия никак не влияют на тип протокола, который мы предлагаем, поскольку здесь мы фокусируемся на реакции трансплантированных клеток на среду принимающей ткани, а не на способности резидентных нейронов к регенерации. Еще одно различие между новорожденными и взрослыми мышами после ТСМ связано с формированием глиального рубца, который возникает у взрослых. Этот аспект не учтен в предлагаемой модели, которая не учитывает сложные физиопатологические процессы, возникающие в результате первичных и вторичных травм.
Что касается приложений, платформа также может быть использована для исследования интеграции между трансплантированными клетками с резидентными цепями, присутствующими в органотипической модели SC. Инструменты генной инженерии уже использовались в ЦНС для оценки синаптической связности и могут быть использованы в этом отношении 53,54,55. В частности, интеграция может быть исследована и валидирована путем оценки формирования синапсов между привитыми клетками и тканью SC ex vivo. Эти долгосрочные органотипические культуры также могут быть использованы для тестирования нейропротекторных и нейрорегенеративных агентов или новых молекул/материалов, а также для изучения нейродегенеративных заболеваний, связанных с СК. Для изучения специфических нейродегенеративных расстройств протокол должен быть адаптирован для культивирования срезов СК, полученных из соответствующих моделей, таких как трансгенные мыши, несущие специфические мутации, связанные с патологией, на соответствующей стадии патологии (т.е. неонатальная, ювенильная, взрослая). В заключение следует отметить, что наш протокол и органотипические культуры в целом, являясь эксплантамтами конкретного органа, обладают особенностями, которые устраняют разрыв между 2D-культурами клеток и моделями in vivo, подтверждая их как бесценный инструмент как для фундаментальных исследований, так и для доклинических испытаний.
Disclosures
У авторов нет конфликта интересов, о котором можно было бы заявить.
Acknowledgements
Исследование было поддержано Фондом Wings for Life (WFL-IT-20/21), Европейским союзом Next Generation EU-National Recovery and Resilience Plan (NRRP) - миссия 4 компонент 2, инвестиции n. 1.4-CUP N. B83C22003930001 (Tuscany Health Ecosystem-THE, Spoke 8) и Marina Romoli Onlus. Данная рукопись отражает только взгляды и мнения авторов, ни Европейский Союз, ни Европейская комиссия не могут считаться ответственными за них. Данные и метаданные доступны на Zenodo 10.5281/zenodo.10433147. Изображения были сгенерированы с помощью Biorender https://www.biorender.com/.
Materials
| Name | Company | Catalog Number | Comments |
| anti-cleaved Caspase-3, (Asp175) (5A1E) (Rabbit) | Cell Signaling Technology | 9661S | 1:400 |
| anti-GFP (Mouse) - monoclonal | Sigma/Merck | G6539 | 1:400 |
| anti-Human Nuclei (Mouse) - monoclonal, clone 235-1 | Sigma/Merck | MAB1281 | 1:400 |
| anti-Human Nuclei (Rabbit) | NeoBiotechnologies | RBM5-346-P1 | 1:400 |
| anti-NeuN (RBFOX3) (Rabbit) - polyclonal | Sigma/Merck | ABN78 | 1:400 |
| anti-NFL (Mouse) | Sigma/Merck | MAB1615 | 1:400 |
| anti-NFL H-Phospho (Rabbit) -polyclonal | Biologend | 840801 | 1:500 |
| Aqua Polymount | Poly-sciences | 18606-20 | |
| B-27 | Gibco | 17504-044 | |
| BDNF | Gibco | PHC7074 | |
| Blades | Leica | 118364227 | |
| Cell culture graded water | Sigma/Merck | W3500-500ML | |
| Collagen from rat tail | Sigma/Merck | C7661 | |
| Confocal microscope - A1 Confocal Microscope (Eclipse Ti) | Nikon | ||
| D(+)-Glucose | Sigma/Merck | G7021 | |
| Dissecting Forceps | World Precision Instruments | 15915 | |
| DMEM/F12 | Gibco | 31330 | |
| DPBS | Sigma/Merck | D8537 | |
| EGF | Sigma/Merck | gf144 | |
| FBS | Gibco | 10270-106 | |
| FGF-2 | Stemgent | 03-0002 | |
| GDNF | Sigma/Merck | SRP3200 | |
| Glass capillaries, 3.5" | Drummond Scientific Company | 3-000-203-G/X | |
| Glutamax | Gibco | 35050-038 | |
| Goat-anti Mouse IgG Alexa Fluor 488 | Thermo Fisher Scientific | A11029 | |
| Goat-anti Mouse IgG Alexa Fluor 647 | Thermo Fisher Scientific | A21236 | 1:500 |
| Goat-anti Rabbit IgG Alexa Fluor 568 | Thermo Fisher Scientific | A11011 | 1:500 |
| Goat-anti Rabbit IgG Alexa Fluor 647 | Thermo Fisher Scientific | A21244 | 1:500 |
| Graph Pad-Prism | Dotmatics | Software for Statistical Analysis | |
| HBSS | Gibco | 14025-050 | 1:500 |
| HEPES | Gibco | 15630-056 | |
| Hoechst 33342 | Thermo Fisher Scientific | H3570 | |
| Horse Serum | Gibco | 16050-122 | |
| Insulin | Sigma/Merck | I9278 | |
| Laminin | Sigma/Merck | L2020 | |
| Lentiviral prep | Addgene | 17446-LV | |
| L-Glutamine | Thermo Fisher Scientific | 25030024 | |
| LIVE/DEAD Viability/Cytotoxicity assay kit | Thermo Fisher Scientific | L32250 | |
| McIlwain Tissue Chopper | World Precision Instruments | ||
| MEM | Gibco | 11090-081 | |
| Microloader tips | Eppendorf | 5242956003 | to load cells in the needle for transplantation |
| Microscope slides | VWR | 631-0909 | |
| Millicell cell culture membrane | Sigma/Merck | PICM0RG50 | |
| Miscroscope cover glasses | VWR | ECN 631-1572 | |
| N-2 | Gibco | 17502-048 | |
| Neurobasal | Gibco | 21103-049 | |
| Penicillin/Streptomycin | Thermo Fisher Scientific | 15140122 | |
| Petri dish (35mm) | VWR | 734-2317 | |
| PFA | Sigma/Merck | P6148-500G | |
| Plastic pasteur pipette | Sarstedt | 86.1171.010 | |
| Pneumatic PicoPump | World Precision Instruments | PV830 | Microinjector for transplantation |
| Poly-L-lysine | Sigma/Merck | P4707 | |
| Scalpel blade No 10 Sterile Stainless Steel | VWR International | SWAN3001 | |
| Scalpel handle #3 | World Precision Instruments | 500236 | |
| Spring Scissors | World Precision Instruments | 501235 | |
| Stereomicroscope for imaging and acquisition | Nikon | SMZ18 | |
| Stereomicroscope for surgery | VWR | ||
| Triton X-100 | Merck | T8787 | |
| Tweezers-Dumont #5-inox | World Precision Instruments | 501985 | |
| Vannas Scissors, 8.5 cm | World Precision Instruments | 500086 | |
| Vertical micropipette puller | Shutter Instrument | P-30 | |
| Y-27632 | R&D Systems | 1254/50 |
References
- Ding, W., et al. Spinal cord injury: The global incidence, prevalence, and disability from the Global Burden of Disease Study 2019. Spine. 47 (21), 1532-1540 (2022).
- Yang, B., et al. Strategies and prospects of effective neural circuits reconstruction after spinal cord injury. Cell Death Dis. 11 (6), 439 (2020).
- Liu, K., et al. PTEN deletion enhances the regenerative ability of adult corticospinal neurons. Nat Neurosci. 13 (9), 1075-1081 (2010).
- Anderson, M. A., et al. Required growth facilitators propel axon regeneration across complete spinal cord injury. Nature. 561 (7723), 396-400 (2018).
- de Freria, C. M., Van Niekerk, E., Blesch, A., Lu, P. Neural stem cells: promoting axonal regeneration and spinal cord connectivity. Cells. 10 (12), 3296 (2021).
- Badner, A., Siddiqui, A. M., Fehlings, M. G. Spinal cord injuries: how could cell therapy help. Expert Opin Biol Ther. 17 (5), 529-541 (2017).
- Assinck, P., Duncan, G. J., Hilton, B. J., Plemel, J. R., Tetzlaff, W. Cell transplantation therapy for spinal cord injury. Nat Neurosci. 20 (5), 637-647 (2017).
- Ishii, K., et al. Neutralization of ciliary neurotrophic factor reduces astrocyte production from transplanted neural stem cells and promotes regeneration of corticospinal tract fibers in spinal cord injury. J Neurosci Res. 84 (8), 1669-1681 (2006).
- Zhang, Y. W., Denham, J., Thies, R. S. Oligodendrocyte progenitor cells derived from human embryonic stem cells express neurotrophic factors. Stem Cells Dev. 15 (6), 943-952 (2006).
- Faulkner, J., Keirstead, H. S. Human embryonic stem cell-derived oligodendrocyte progenitors for the treatment of spinal cord injury. Transpl Immunol. 15 (2), 131-142 (2005).
- Kadoya, K., et al. Spinal cord reconstitution with homologous neural grafts enables robust corticospinal regeneration. Nat Med. 22 (5), 479-487 (2016).
- Dell' Anno, M. T., et al. Human neuroepithelial stem cell regional specificity enables spinal cord repair through a relay circuit. Nat Commun. 9 (1), 3419 (2018).
- Wu, S., FitzGerald, K. T., Giordano, J. On the viability and potential value of stem cells for repair and treatment of central neurotrauma: overview and speculations. Front Neurol. 9, 602 (2018).
- Nardone, R., et al. Rodent, large animal and non-human primate models of spinal cord injury. Zoology. 123, 101-114 (2017).
- Hartung, T. Thoughts on limitations of animal models. Parkinsonism Relat Disord. 14, (2008).
- Shanks, N., Greek, R., Greek, J. Are animal models predictive for humans. Philosophy, Ethics, and Humanities in Medicine. 4 (1), 2 (2009).
- Dawson, T. M., Golde, T. E., Lagier-Tourenne, C. Animal models of neurodegenerative diseases. Nat Neurosci. 21 (10), 1370-1379 (2018).
- Hayden, P. J., Harbell, J. W. Special review series on 3D organotypic culture models: Introduction and historical perspective. In Vitro Cell Dev Biol Anim. 57 (2), 95 (2021).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Front Mol Biosci. 7, 33 (2020).
- Mirbagheri, M., et al. Advanced cell culture platforms: a growing quest for emulating natural tissues. Materials Horizons. 6 (1), 45-71 (2019).
- Gähwiler, B. H. Organotypic monolayer cultures of nervous tissue. J Neurosci Methods. 4 (4), 329-342 (1981).
- Stoppini, L., Buchs, P. -. A., Muller, D. A simple method for organotypic cultures of nervous tissue. J Neurosci Methods. 37 (2), 173-182 (1991).
- Pandamooz, S., Nabiuni, M., Miyan, J., Ahmadiani, A., Dargahi, L. Organotypic spinal cord culture: a proper platform for the functional screening. Mol Neurobiol. 53 (7), 4659-4674 (2016).
- Fuller, L., Dailey, M. E. Preparation of rodent hippocampal slice cultures. CSH Protoc. 2007, (2007).
- Gertz, C. C., Lui, J. H., LaMonica, B. E., Wang, X., Kriegstein, A. R. Diverse behaviors of outer radial glia in developing ferret and human cortex. J Neurosci. 34 (7), 2559-2570 (2014).
- Ballerini, L., Galante, M. Network bursting by organotypic spinal slice cultures in the presence of bicuculline and/or strychnine is developmentally regulated. Eur J Neurosci. 10 (9), 2871-2879 (1998).
- Avossa, D., Rosato-Siri, M. D., Mazzarol, F., Ballerini, L. Spinal circuits formation: a study of developmentally regulated markers in organotypic cultures of embryonic mouse spinal cord. Neuroscience. 122 (2), 391-405 (2003).
- Lossi, L., Merighi, A. The use of ex vivo rodent platforms in neuroscience translational research with attention to the 3RS philosophy. Front Vet Sci. 5, 164 (2018).
- Nogueira, G. O., Garcez, P. P., Bardy, C., Cunningham, M. O., Sebollela, A. Modeling the human brain with ex vivo slices and in vitro organoids for translational neuroscience. Front Neurosci. 16, 838594 (2022).
- Qi, X. R., et al. Human brain slice culture: a useful tool to study brain disorders and potential therapeutic compounds. Neurosci Bull. 35 (2), 244 (2019).
- Park, H. W., et al. Human mesenchymal stem cell-derived Schwann cell-like cells exhibit neurotrophic effects, via distinct growth factor production, in a model of spinal cord injury. Glia. 58 (9), 1118-1132 (2010).
- Charrière, K., Risold, P. Y., Fellmann, D. In vitro interactions between bone marrow stromal cells and hippocampal slice cultures. C R Biol. 333 (8), 582-590 (2010).
- Jeong, D. K., Taghavi, C. E., Song, K. J., Lee, K. B., Kang, H. W. Organotypic human spinal cord slice culture as an alternative to direct transplantation of human bone marrow precursor cells for treating spinal cord injury. World Neurosurg. 75 (3-4), 533-539 (2011).
- Riggio, C., et al. Generation of magnetized olfactory ensheathing cells for regenerative studies in the central and peripheral nervous tissue. Int J Mol Sci. 14 (6), 10852-10868 (2013).
- Kamei, N., et al. Neural progenitor cells promote corticospinal axon growth in organotypic co-cultures. Neuroreport. 15 (17), 2579-2583 (2004).
- Kamei, N., et al. NGF released from transplanted neural progenitor cells promote corticospinal axon growth in organotypic cocultures. Spine. 32 (12), 1272-1278 (2007).
- Hamasaki, T., et al. Magnetically labeled neural progenitor cells, which are localized by magnetic force, promote axon growth in organotypic cocultures. Spine. 32 (21), 2300-2305 (2007).
- Kim, H. M., Lee, H. J., Lee, M. Y., Kim, S. U., Kim, B. G. Organotypic spinal cord slice culture to study neural stem/progenitor cell microenvironment in the injured spinal cord. Exp Neurobiol. 19 (2), 106-113 (2010).
- Liu, X., Chu, T. H., Su, H., Guo, A., Wu, W. Neural progenitor cell apoptosis and differentiation were affected by activated microglia in spinal cord slice culture. Neurol Sci. 35 (3), 415-419 (2014).
- De Vincentiis, S., et al. Low forces push the maturation of neural precursors into neurons. Small. 19 (30), 2205871 (2023).
- Abouelfetouh, A., Kondoh, T., Ehara, K., Kohmura, E. Morphological differentiation of bone marrow stromal cells into neuron-like cells after co-culture with hippocampal slice. Brain Res. 1029 (1), 114-119 (2004).
- Sypecka, J., Koniusz, S., Kawalec, M., Sarnowska, A. The organotypic longitudinal spinal cord slice culture for stem cell study. Stem Cells Int. 2015, 471216 (2015).
- Tanvig, M., et al. A brain slice culture model for studies of endogenous and exogenous precursor cell migration in the rostral migratory stream. Brain Res. 1295, 1-12 (2009).
- Tennstaedt, A., et al. Human neural stem cell intracerebral grafts show spontaneous early neuronal differentiation after several weeks. Biomaterials. 44, 143-154 (2015).
- Vogel, S., et al. The in vivo timeline of differentiation of engrafted human neural progenitor cells. Stem Cell Res. 37, 101429 (2019).
- Onorati, M., et al. Zika virus disrupts phospho-TBK1 localization and mitosis in human neuroepithelial stem cells and radial glia. Cell Rep. 16 (10), 2576-2592 (2016).
- Vyas, A., et al. An in vitro model of adult mammalian nerve repair. Exp Neurol. 223 (1), 112-118 (2010).
- Brewer, G. J., Torricelli, J. R., Evege, E. K., Price, P. J. Optimized survival of hippocampal neurons in B27-supplemented neurobasal, a new serum-free medium combination. J Neurosci Res. 35 (5), 567-576 (1993).
- De Vries, G. H., Boullerne, A. I. Glial cell lines: an overview. Neurochem Res. 35 (12), 1978-2000 (2010).
- Ziv-Polat, O., et al. The role of neurotrophic factors conjugated to iron oxide nanoparticles in peripheral nerve regeneration: in vitro studies. Biomed Res Int. 2014, 267808 (2014).
- Mesa-Infante, V., Afonso-Oramas, D., Salas-Hernández, J., Rodríguez-Núñez, J., Barroso-Chinea, P. Long-term exposure to GDNF induces dephosphorylation of Ret, AKT, and ERK1/2, and is ineffective at protecting midbrain dopaminergic neurons in cellular models of Parkinson's disease. Mol Cell Neurosci. 118, 103684 (2022).
- Montero, A. M., Huang, A. H. The regenerative capacity of neonatal tissues. Development. 149 (12), (2022).
- Feng, L., Kwon, O., Lee, B., Oh, W. C., Kim, J. Using mammalian GFP reconstitution across synaptic partners (mGRASP) to map synaptic connectivity in the mouse brain. Nat Protoc. 9 (10), 2425-2437 (2014).
- Il Choi, D., Kaang, B. -. K. Interrogating structural plasticity among synaptic engrams. Curr Opin Neurobiol. 75, 102552 (2022).
- Choi, J. -. H., et al. Interregional synaptic maps among engram cells underlie memory formation. Science. 360 (6387), 430-435 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved