小鼠幼稚 CD4+ T 细胞体外分化为致病性 Th17 细胞
* These authors contributed equally
In This Article
Summary
该方案描述了幼稚 CD4 + T 细胞 在体外分化为致病性 Th17 细胞。具体来说,当与基于多参数流式细胞术的方法结合使用时,使用这种分化方法可以从初始 CD4+ T 细胞中获得 90% 纯度的致病性 Th17 细胞。
Abstract
体外 T 细胞分化技术对于 CD4+ T 细胞的功能和机制研究都是必不可少的。近年来,致病性 Th17 细胞与多种疾病有关,包括多发性硬化症 (MS)、类风湿性关节炎、急性呼吸窘迫综合征 (ARDS)、败血症和其他自身免疫性疾病。然而,目前已知的 体外 分化方案难以实现致病性 Th17 细胞的高纯度,诱导效率通常低于 50%,这是 体外 实验中的一个关键挑战。在该方案中,我们提出了一种针对致病性 Th17 细胞的增强型 体外 培养和分化方案,用于将从小鼠脾脏中分离的幼稚 CD4 + T 细胞直接分化为致病性 Th17 细胞。该方案提供了有关脾细胞分离、初始 CD4 + T 细胞纯化和致病性 Th17 细胞分化的详细说明。通过该方案,我们可以实现致病性 Th17 细胞约 90% 的分化纯度,这满足了许多细胞实验的基本需求。
Introduction
离开胸腺后,幼稚的 CD4+ T 淋巴细胞穿过次级淋巴器官。将同源抗原传递到初始 CD4+ T 细胞的抗原呈递细胞会激活它们,启动一系列分化程序,最终产生高度专业化的辅助性 T 细胞 (Th) 细胞谱系1。白细胞介素 17 (IL-17) 的产生是 Th17 细胞的特征,Th17 细胞是促炎性 Th 细胞的一个亚群2。Th17 细胞在宿主对细胞外病原体的防御和许多自身免疫性疾病(如自身免疫性葡萄膜炎和多发性硬化症)的发病机制中发挥作用。来自 T 细胞受体和细胞因子 IL-6 和转化生长因子-β (TGF-β) 的信号通过信号转导和转录激活因子 (STAT) 的磷酸化诱导初始 T 细胞分化为 Th17 细胞33。STAT3 通过 IL-23 和 IL-21 介导的信号转导在正反馈环中进一步扩增 4,5。STAT3 的磷酸化可诱导转录因子 RORγt 和 RORα 的表达,它们作为调节 Th17 细胞中 IL-17A、IL-17F、IL-21 和 IL-22 细胞因子谱的主开关6。然而,据报道,IL-6 和 TGF β诱导的 Th17 细胞不足以引发自身免疫性疾病,这需要 IL-23 的共刺激或在不存在 TGF β的情况下单独共刺激 IL-6、IL-1β 和 IL-23 7,8。
不能有效诱导实验性自身免疫性脑脊髓炎 (EAE) 的 Th17 亚群有时被称为非致病性 Th17,而可以诱导 EAE 的 Th17 亚群被称为致病性 Th179。目前的研究表明,虽然致病性 Th17 和非致病性 Th17 共同表达核心转录因子 RORγt,但在产生 IL-17A 的能力以及促炎和抗炎特性方面存在很大差异10。除了 Th17 的常见特征转录因子 RORγt、CCR6、STAT4 和 RUNX4 的高表达外,致病性 Th17 细胞还表现出与疾病相关的其他基因信号表达特征,例如具有 Th1 细胞亚群特征的 TBX21、IFN-γ 和 CXCR3。致病性 Th17 细胞可分泌高水平的粒细胞-巨噬细胞集落刺激因子 (GM-CSF)、IFN-γ、TNF-α 和其他细胞因子11,12。非致病性 Th17 细胞的表型不稳定,只有在 CD3 和细胞因子 IL-2 的刺激下,这些细胞中的一部分才能分化为致病性 Th17 细胞。因此,在类风湿性关节炎、多发性硬化症和急性呼吸窘迫综合征等常见临床疾病模型中,致病性 Th17 细胞主要发挥致病作用。
致病性和非致病性 Th17 细胞可以在不同细胞因子的影响下体外分化。近年来,一些研究提出了使用不同类型和浓度的细胞因子诱导 Th17 细胞分化的方法。Th17 细胞受 IL-6、IL-1β 和 IL-23 的组合刺激 13,14,15,16。已经证明,IL-6 和 TGF-β 是 Th17 细胞分化所必需的两种细胞因子,通过与 Rorc 基因位点17 的两个不同的保守非编码 DNA 序列相互作用,协同调节 RORγt 和 Th17 细胞分化的表达。致病性 Th17 细胞的稳定期主要由 IL-23维持 18,19。IL-23 与其受体结合并激活 JAK-STAT 信号通路20,从而导致 Jak2 和 Tyk2 磷酸化,并促进 STAT1、STAT3、STAT4 和 STAT5 的磷酸化。IL-4 和 IFN-γ 是该通路的负调节因子。然而,研究表明,IL-1β 可能通过 mTOR 通路正向调节 Rorα 和 Rorγt 的转录,以维持 Th17 细胞表型的稳定性21。
由于大量研究的异质性,我们从最新研究中选择了致病性和非致病性 Th17 细胞的诱导方案作为对照22。结果表明,假设一切都按照该方案进行,在产生致病性 Th17 的条件下培养 5 天后,超过 90% 的存活细胞可以是致病性 Th17 细胞。
Protocol
东南大学动物研究机构审查委员会批准了本研究中详述的所有动物研究,这些研究是按照当地和机构办公室的标准进行的。脾脏样本取自 C57BL6/J 小鼠。本研究包括年龄在 5 至 8 周之间的雌性和雄性小鼠。将培养基和缓冲液在 4 °C 下储存长达 1 个月。手术器械在使用前进行高压灭菌。戴乳胶手套和口罩,以避免皮肤、眼睛和衣服被试剂污染;使用大量水或盐水冲洗皮肤和眼睛。
1. 用抗 CD3 抗体预涂 24 孔组织培养板
- 在无菌 1x 磷酸盐缓冲盐水 (PBS) 或 RPMI 1640 培养基中将抗 CD3 稀释至终浓度为 1 μg/mL。
- 用 1 mL 抗 CD3 溶液 (1 μg/mL) 填充 24 孔组织培养板孔;然后,用封口膜盖住孔。
- 将抗CD3包被板置于冰箱(2°C-8°C)中16小时,或在细胞培养箱中于37°C下保存2-3小时。
2. 小鼠脾脏分离及脾单细胞悬液制备
- 在含有 3% 异氟醚的 C57BL/6J 中诱导完全麻醉,并通过吸入 100% 二氧化碳 2 分钟实施安乐死。小鼠死亡后,立即将它们浸泡在 75% 乙醇中进行消毒,以防止污染。
- 将鼠标仰卧放在干净的工作台上,沿腹部中线切开,将腹部结构逐层分离。用镊子轻轻打开大网膜和胃,用胃脾韧带轻轻拉出脾脏,钝性地将脾与周围组织和韧带分开,获得完整的脾脏(注意避免脾压碎或破裂)。
注:为了保持无菌状态,在无菌 super clean bench 中进行以下操作。 - 将 70 μm 细胞过滤器放入 100 mm 无菌培养皿中,将脾脏加入细胞过滤器中,然后用注射器柱塞将其压碎。同时,加入 5-8 mL 匀浆冲洗液,将所有细胞通过过滤器推入培养皿中。
注:淋巴细胞分离液试剂盒的成分可在 材料表中查看。 - 在室温下将滤液以 450 × g 离心 5 分钟。丢弃上清液。
- 使用淋巴细胞分离试剂盒提供的样品稀释剂或 PBS 或 RPMI 1640 培养基重悬细胞沉淀。将细胞悬液的细胞浓度调整为 2 × 108-1 × 109 个细胞/mL。
注:通常,一个脾脏需要 4-6 mL 样品稀释剂。 - 在离心管中,取与组织单细胞悬液相同量的淋巴细胞分离溶液。小心地将单细胞悬液移液到淋巴细胞分离溶液的表面,并在 800 × g、25 °C 下离心 30 分钟。将离心机的 Acceleration and Deceleration 设置到适当的范围(例如,如果有通常的 3 到 1 个档位,则设置为 9)。
注:淋巴细胞分离液应不少于 3 mL。 - 离心后,从上到下观察离心管中的四层。第一层对应于样品稀释剂,然后是环形乳白色淋巴细胞层。第三层是分离液,第四层由红细胞组成。
- 使用移液管小心地将第二层环形乳白色淋巴细胞层吸入另一个离心管中,并向离心管中加入 10 mL 清洁溶液以混合细胞。
- 在室温下以 250 × g 离心 5 分钟。丢弃上清液。使用 10 mL RPMI 1640 培养基重悬细胞沉淀以进行细胞计数。
3. 基于磁珠阴性选择的幼稚 CD4+ T 细胞纯化
注:通过免疫磁阴性选择从小鼠脾细胞中分离未接触且高度纯化的幼稚 CD4 + T 细胞 (CD4 + CD44lowCD62Lhigh)。
- 制备样品,使其体积范围为 0.1-2 mL,为 1 × 108 个细胞/mL。
- 加入 50 μL/mL 大鼠血清,将样品转移至 5 mL 聚苯乙烯圆底管中。
注:初始 CD4 T 细胞分选试剂盒的组成可在 材料表中查看。 - 向样品中加入 50 μL/mL 分离混合物,充分混合,并在室温下孵育 7.5 分钟。
- 向样品中加入 50 μL/mL 去除混合物,充分混合,并在室温下孵育 2.5 分钟。
- 涡旋磁珠以确保均匀分散。向样品中加入 75 μL/mL 磁珠,充分混匀,并在室温下孵育 2.5 分钟。
注意:颗粒应均匀分散;涡旋时间不应少于 30 秒。 - 用 RPMI 1640 培养基加注样品,至最终体积为 2.5 mL。轻轻上下吹打,混合数次。
- 将试管(无盖)放入磁力架中,并在室温下孵育 2.5 分钟。
- 拿起磁铁,以一个连续的运动倒置磁铁和试管,然后将富集的细胞悬液倒入新试管中。
注意:在将它们直立之前,将管子和磁铁倒置 2-3 秒。不要打扰可能残留在管口上的任何液滴。 - 使用血细胞计数器确定细胞数量。
- 在分离前后对初始 CD4 + T 细胞进行流式细胞术分析(图 1)。
- 将细胞转移到新的离心管中,在室温下以 400 × g 离心 5 分钟,并弃去上清液。
- 将细胞重悬于 200-500 μL RPMI 1640 培养基(补充有 10% 胎牛血清)中。对于每 1 mL 细胞培养物(例如,~106 个细胞/mL),加入 2 μL 白细胞活化混合物并混合。将细胞在 37 °C 和饱和湿度的 CO 2 培养箱中培养 4-6 小时。
注意:细胞每 1-2 小时涡旋一次。 - 将细胞在 400 × g、4 °C 下离心 5 分钟。小心丢弃上清液,将细胞重悬于 200 μL PBS 中。向细胞中加入 1 μL Fc 阻滞剂(例如,~106 个细胞/mL)。将细胞在 4 °C 下孵育 10 分钟。
- 在 4 °C 下以 400 × g 离心 5 分钟,用 1 mL PBS 洗涤细胞一次。 弃去上清液,将细胞重悬于 200 μL PBS 中。
- 加入抗体混合物(可固定活力染料,1:1,000;抗CD4,1:200;抗CD44,1:200;抗CD62L,1:200),并在4°C下避光孵育细胞15-20分钟。
- 用 2 x 1 mL PBS 洗涤细胞,然后在 4 °C 下以 400 × g 离心 5 分钟。
- 弃去上清液,将细胞重悬于 250 μL 固定缓冲液中,并在 4 °C 下避光孵育 40-60 分钟。
注:固定缓冲液随 Foxp3/转录因子染色缓冲液一起提供,这是一种 4x 储备溶液,必须用透化稀释剂稀释。 - 加入 1 mL 的 1x 透化缓冲液,通过在 300 × g、4 °C 下离心细胞 5 分钟来洗涤细胞 2 次。
- 弃去上清液,将细胞重悬于 200 μL 透化缓冲液中,并将抗体(Foxp3 [核],1:200)添加到细胞中。固定和膜破裂后,将细胞 - 抗体混合物在黑暗中孵育 40-60 分钟,偶尔在 4 °C 下短暂摇晃。
注:透化/洗涤溶液是 10x 储备液,在与 PBS 一起使用之前必须稀释。
4. 体外诱导致病性 Th17 细胞
- 使用前从预包被的 24 孔板中取出无菌 PBS。
- 使用 Th17 细胞培养基(表 1)和造影剂进行培养,包括 Th0 细胞培养基(表 1)、经典非致病性 Th17 培养基(表 1)和经典致病性 Th17 培养基(表 1)。重悬富集的幼稚 CD4 + T 细胞,并分配到同一 24 孔板(预涂有抗 CD3)的不同孔中,将浓度调节至 4 × 105 个细胞/mL,每个孔中含有 1 mL 培养基。
- 向每个孔中加入 1 μL/mL 的抗 CD28 溶液(终浓度:用培养基稀释至 2 μg/mL)。将细胞在 37 °C 的 5% CO2 培养箱中培养 5 天。
- 通过小心移液以均匀分布细胞,用培养基(Th0、非致病性 Th17、经典致病性 Th17 和客观 Th17)替换细胞培养上清液,丢弃一半含有细胞的培养基,然后加入与第 2 天丢弃体积相等的新培养基。在第 4 天重复。
- 第 5 天在光学显微镜下观察细胞(图 2)。从每组收集细胞上清液,并在-80°C下冷冻保存。
5. 流式细胞术分析致病性 Th17 和 Th0 细胞分化
- 培养开始 5 天后收获所有细胞(每孔)。执行步骤 3.12-3.15。
- 加入抗体混合物(可固定活力染料,1:1,000;抗CD4,1:200),并将细胞在4°C下避光孵育15-20分钟。
- 执行步骤 3.17-3.19。
- 弃去上清液,将细胞重悬于 200 μL 透化缓冲液中,并加入抗体混合物(IL-17A [细胞内],1:200;RORγT [核],1:200)添加到细胞中。固定和膜破裂后,将细胞 - 抗体混合物在黑暗中孵育 40-60 分钟,偶尔在 4 °C 下短暂摇晃。
- 加入 1 mL 的 1x 透化/洗涤溶液以洗涤细胞 2 次,在 4 °C 下以 400 × g 离心细胞 5 分钟;然后,弃去上清液。
- 在流式细胞仪上检查细胞并使用软件分析数据(图 3)。
- 打开流式细胞仪,然后打开自启动清洁和校准过程。
- 选择本实验中使用的激光通道,并设置空管、单染管和样品管。
- 单击 空管 选项并在机器上 进行测试 ;调整电压,使 Cell 事件尽可能位于收集箱的中心。
- 收集单染色的试管细胞,并对相应通道进行光谱检测,以确认荧光抗体添加正确。
- 单击 unmix 按钮,让机器自动调整光谱补偿。使用其他流式细胞术仪器,正常调整荧光补偿。
- 收集每个样品管单元,将数据格式保存为 FCS 文件,然后导出。在相关的流式细胞术数据分析软件中进行分析和绘图。
- 环绕主要细胞群并通过 FSC-H 和 FSC-A 的对角线圆圈门去除可能的细胞粘附。
- 根据 FVS 负圆圈面积圈活细胞;接下来,圈出 CD4 + 细胞群。
- 构建横轴为 IL-17 A,纵轴为 RORγT 的交叉门;Q2 区域中的双阳性选择是 Th17 细胞群。
6. 酶联免疫吸附测定 (ELISA) 检测不同培养基诱导的 IL-17A 分泌
- 解冻第 4.5 节中收集的冷冻细胞上清液。
- 将 100 μL 稀释的标准品、空白样品和样品加入指定的孔中。使用密封剂盖住板并在 37 °C 下孵育 90 分钟。
注:将溶液充分添加到 micro-ELISA 板的底部,不要接触内壁或产生任何泡沫。 - 从每个孔中倒出液体,并立即加入 100 μL 生物素化检测抗体工作溶液。使用新的密封剂盖住板并在 37 °C 下孵育 1 小时。
- 倒出溶液并向每个孔中加入 350 μL 洗涤缓冲液。1 分钟后,从每个孔中吸出或倒出溶液,并用干净的吸水纸拍干。重复此洗涤步骤 3 次。
- 向每个孔中加入 100 μL 辣根过氧化物酶偶联物工作溶液。使用新的密封剂盖住板并在 37 °C 下孵育 30 分钟。
- 从每个孔中倒出溶液,并按照步骤 6.4 中的说明重复洗涤过程 5 次。
- 向每个孔中加入 90 μL 底物试剂,并在 37 °C 下用新的密封剂孵育约 15 分钟,保护板避光。
注意:反应时间可以根据实际颜色变化进行更改,但不应超过 30 分钟。在 OD 测量之前,让酶标仪预热 ~15 分钟。 - 按照与底物溶液相同的顺序添加 50 μL/孔的终止液。
- 使用设置为 450 nm 的酶标仪一次测定每个孔的光密度(OD 值)。
- 获取标准样品和样品的重复孔的 OD 值,然后减去空白孔的 OD 值以获得校正后的值。然后,以浓度作为横坐标,以 OD 值作为纵坐标进行线性拟合。根据拟合方程,计算样品孔的 IL-17A 浓度值。
注意:分化 4 天后,每组上清液中 IL-17A 的含量如图 4 所示。拟合方法可以参考 Orgin21 软件。从该实验中获得的标准曲线的 R2 值为 0.9946。
7. 通过定量 PCR (qPCR) 通过特征基因表达测定进行 T 细胞分化
注意:为了排除由于染料和固定/破裂的影响而导致流式细胞术不稳定的可能性,我们通过 qPCR 检测特征基因的表达,以阐明致病性 Th17 在转录水平上的分化作用。
- 测量 T 细胞培养结束时的细胞数。将细胞收集在 1.5 mL 离心管中,并以 400 × g 离心 5 分钟。小心丢弃所有上清液。
- RNA 提取
注:提取过程必须在通风橱或超净工作台中进行,以避免 RNA 酶污染。- 向样品管中加入 500 μL 裂解缓冲液(例如,向 1-2 × 106 个细胞中加入)(步骤 7.1),立即摇动并混合,直到没有细胞团,然后静置 1 分钟。
- 将混合物加入置于收集管中的吸附柱中,以 13,400 × g 离心 30 秒,弃去滤液。
- 首次使用前,将指定量的无水乙醇加入洗涤缓冲液瓶中。向吸附柱中加入 500 μL 洗涤缓冲液,以 13,400 × g 离心 30 秒,然后弃去滤液。
- 重复步骤 7.2.3 中的洗涤。
- 将吸附柱 RA 放入空收集管中,以 13,400 × g 离心 2 分钟以除去冲洗液。
注:必须去除冲洗液,以防止冲洗液中残留的乙醇抑制下游反应。 - 取出吸附柱 RA 并将其置于干净的无 RNase 离心管中。在吸附膜中间加入 50 μL 不含 RNase 的 H2O,在室温下静置 1 分钟,然后以 9,600 × g 离心 1 分钟。
- 测量 RNA 的纯度和浓度。
- 按照试剂盒制造商的说明合成第一链 cDNA。
- 去除基因组 DNA。在不含 RNase 的离心管中取 500 ng 提取的模板 RNA;加入不含 RNase 的 ddH2O 和 4x gDNA 混合物以形成混合物。用移液管轻轻混合,并置于 42 °C 水浴中 2 分钟。
注:反应混合物的量和添加量与 RNA 浓度有关;请详细参阅说明。本实验使用 20 μL 反应系统。 - 在上一步的反应管中直接加入 5x 逆转录反应系统。取 4 μL 逆转录反应系统和 16 μL 上一步的混合物,用移液管轻轻混合。
注:逆转录系统包括所有必需的逆转录酶,这是一个直接配置的逆转录系统。 - 设置逆转录反应:37°C 15分钟,85°C,5秒,最后冷却至4°C。
- 去除基因组 DNA。在不含 RNase 的离心管中取 500 ng 提取的模板 RNA;加入不含 RNase 的 ddH2O 和 4x gDNA 混合物以形成混合物。用移液管轻轻混合,并置于 42 °C 水浴中 2 分钟。
- 按照制造商的说明设置 PCR 反应。
- 在 qPCR 管中加入 10 μL 2x PCR 反应酶混合物、0.4 μL 引物 1、0.4 μL 引物 2、0.4 μL 50x ROX 参比染料 1、2 μL 模板 cDNA 和 6.8 μL ddH2O,制备 20 μL 混合物。
- 使用以下设置在实时荧光定量 PCR 仪器中进行 PCR:阶段 1,95 °C,30 秒,重复 x 1;第 2 阶段,首先 95 °C,10 秒,然后是 60 °C,30 秒,重复 x 40;第 3 阶段,第一次 95 °C,15 秒,接下来 60 °C,60 秒,最后 95 °C,15 秒,重复 x 1。
注:分化 4 天后,初始 CD4 + T 细胞中 Il17a、Il17f、Rola 和 Il23r 的相对表达水平如图 5 所示。
Representative Results
我们的方案是基于对致病性 Th17 细胞分化的早期研究开发的。实验的第一步是通过磁珠分选检测从脾脏分离的幼稚 CD4+ T 细胞的纯度,这是我们后续致病性 Th17 细胞分化成功的基础。使用表面标志物 CD62L23 和 CD4424 检测初始 CD4+ T 细胞的纯度,而 FOXP325 用作 Treg 细胞的标志物。我们发现分选后 Treg 细胞的含量显著降低,初始 CD4+ T 细胞的纯度至少可达 95%(图 1)。为了比较致病性 Th17 细胞的分化,将初始 CD4+ T 细胞与 Th0 培养基(表 1)和 Th17 分化培养基(表 1)一起培养总共 5 天。发现 T 细胞在 Th0 和 Th17 培养基中均显示簇状生长(图 2)。
接下来,根据流式细胞术对分化的 CD4+ T 细胞中细胞进行固定、透化并用针对几种细胞因子的抗体标记细胞。我们检测了 IL17A26 和 RORγT27 作为 Th17 细胞分化的标志性细胞因子,发现 90% 的幼稚 CD4+ T 细胞在新的 Th17 细胞培养基的刺激下成功分化为致病性 Th17 细胞(图 3)。 图 5 显示了 PCR 检测到的 Th17 细胞的特征基因,证明我们通过分化获得的致病性 Th17 细胞是稳定表达的。
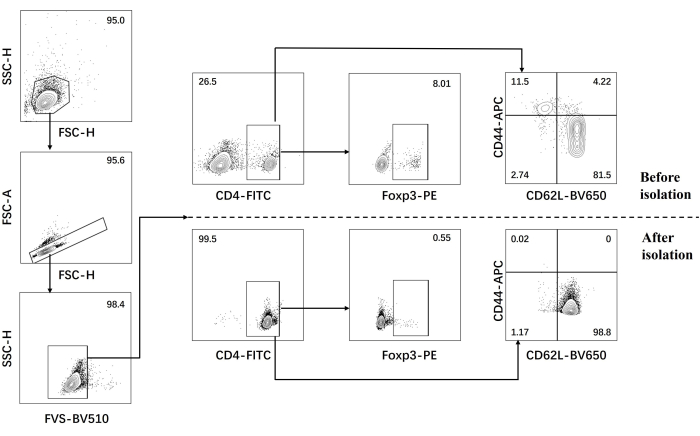
图 1:幼稚 CD4+ T 细胞分离前后分析 C57BL/6J 小鼠特征细胞因子的门控策略。 缩写:FSC-H = 前向散射峰高;SSC-H = 侧散-豌豆高度;FSC-A = 前向散射峰面积;FITC = 异硫氰酸荧光素;PE = 藻红蛋白。 请单击此处查看此图的较大版本。
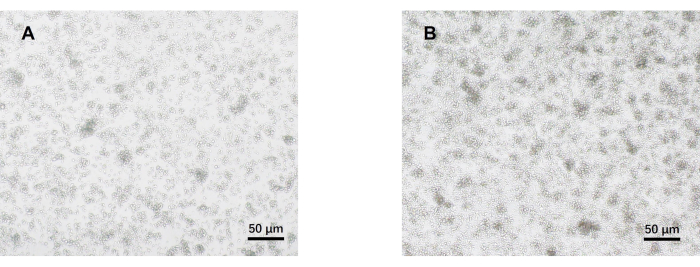
图 2:在致病性 Th17 和 Th0 条件下培养 5 天的小鼠初始 CD4+ T 细胞的代表性图像。 (A) Th0 细胞;(B) 致病性 Th17 细胞。比例尺 = 50 μm。 请点击此处查看此图的较大版本。
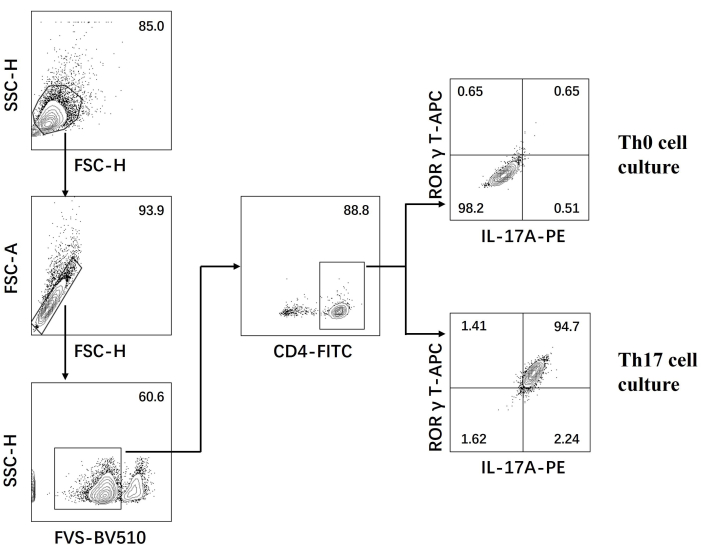
图 3:Th0 细胞培养基和 Th17 细胞培养基诱导分化后的流式细胞术分析。 缩写:FSC-H = 前向散射峰高;SSC-H = 侧散-豌豆高度;FSC-A = 前向散射峰面积;FITC = 异硫氰酸荧光素;PE = 藻红蛋白。 请单击此处查看此图的较大版本。
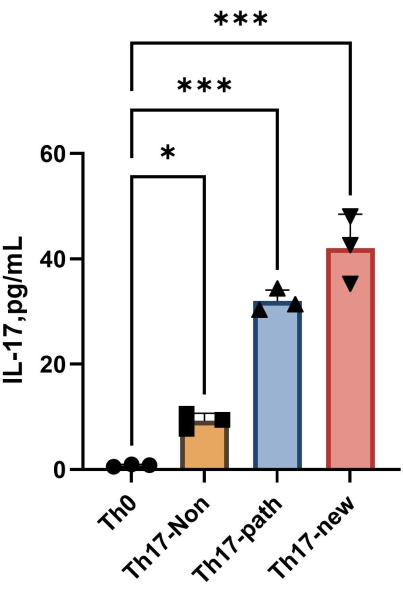
图 4:诱导分化后 Th0 细胞培养基和 Th17 细胞培养基上清液中 IL-17A 的含量。请点击此处查看此图的较大版本。
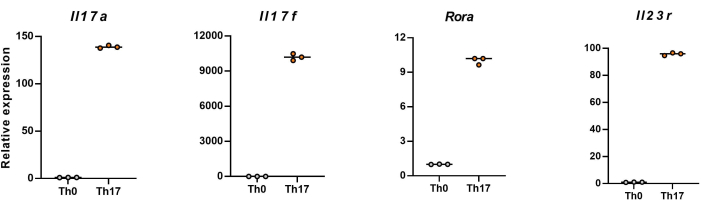
图 5:C57BL/6J 小鼠分化的 CD4+ T 细胞中特征细胞因子表达水平的代表性结果。请单击此处查看此图的较大版本。
| 靶标致病性 Th17 细胞培养基 | Th0 细胞培养基 | 经典非致病性 Th17 细胞培养基 | 经典致病性 Th17 细胞培养基。 | |||||||||||
| 试剂 | 最终浓度 | 量 | 最终浓度 | 量 | 最终浓度 | 量 | 最终浓度 | 量 | ||||||
| 青霉素 - 链霉素 (100x) | 1 倍 | 500 微升 | 1 倍 | 500 微升 | 1 倍 | 500 微升 | 1 倍 | 500 微升 | ||||||
| 胎牛血清 | 10% | 5 毫升 | 10% | 5 毫升 | 10% | 5 毫升 | 10% | 5 毫升 | ||||||
| β-巯基乙醇 | 50 微米 | 50 微升 | 50 微米 | 50 微升 | 50 微米 | 50 微升 | 50 微米 | 50 微升 | ||||||
| GlutaMAXTM 添加剂 (100x) | 1 倍 | 500 微升 | 1 倍 | 500 微升 | 1 倍 | 500 微升 | 1 倍 | 500 微升 | ||||||
| 丙酮酸钠溶液 (100x) | 1 毫米 | 500 微升 | 1 毫米 | 500 微升 | 1 毫米 | 500 微升 | 1 毫米 | 500 微升 | ||||||
| 抗小鼠 IFN γ (1 mg/mL) | 5 微克/毫升 | 250 微升 | 10 微克/毫升 | 500 微升 | 10 微克/毫升 | 500 微升 | ||||||||
| 抗小鼠 IL-4 (2 mg/mL) | 5 微克/毫升 | 125 微升 | 5 微克/毫升 | 250 微升 | 10 微克/毫升 | 250 微升 | ||||||||
| 小鼠 rIL-1 β (20 μg) | 20 纳克/毫升 | 那 | ||||||||||||
| 小鼠 rIL-6 (20 μg) | 20 纳克/毫升 | 那 | 50 纳克/毫升 | 那 | 50 纳克/毫升 | 那 | ||||||||
| 小鼠 rIL-23 (50 μg) | 50 纳克/毫升 | 那 | 10 纳克/毫升 | 那 | ||||||||||
| 小鼠 TGF β (100 μg) | 3 纳克/毫升 | 那 | 1 纳克/毫升 | 那 | 1 纳克/毫升 | 那 | ||||||||
| 鼠 IL-2 (5 μg) | 20 纳克/毫升 | 那 | ||||||||||||
| RPMI 1640 系列 | 那 | 至 50 mL | 那 | 至 50 mL | 那 | 至 50 mL | ||||||||
| 总 | 那 | 50 毫升 | 那 | 50 毫升 | 那 | 50 毫升 | ||||||||
表 1:靶标致病性 Th17 细胞培养物、Th0 细胞培养物、经典非致病性和致病性 Th17 细胞培养基。
Discussion
该程序提供了一种有效的方法来增加小鼠脾幼稚 CD4 + T 细胞的数量,用于 体外 产生致病性 Th17 细胞。尽管我们比其他已报道的 Th17 细胞培养基使用更多的细胞因子,但我们致力于优化致病性 Th17 细胞的生长条件。我们正在考虑进一步优化我们的诱导分化方案。
在这里,我们简单地使用流式细胞术和 qPCR 来检查标志性细胞因子的产生。通过一些细微的修改,这种方法也可用于其他功能测试,例如细胞增殖。
我们使用中国生产的淋巴细胞分离试剂盒来分离小鼠脾脏淋巴细胞,因为它既有效又省时。基于其他品牌的淋巴细胞分离液也可以通过不同的步骤达到分离小鼠脾淋巴细胞的目的。另一种方法是直接裂解所得脾细胞悬液的红细胞;然而,我们发现脾脏红细胞通常不能一次裂解。
在执行此协议期间可能会出现一些问题。首先,通过磁珠分选获得的幼稚 CD4 + T 细胞的数量可能非常少(方案步骤 3)。这可能是由于粉碎器官的过程不足。确保器官适当均质很重要。在均质过程中增加漂洗频率将提高回收率。为了获得更多数量的脾幼稚 CD4+ T 细胞,我们建议使用较年轻的小鼠 (6-10 周龄)。有多种方法可用于分离脾淋巴细胞,产量可能因所使用的分离液而异。建议使用普遍认证的分离液,并尝试尽可能多地提取淋巴细胞层。
其次,流式细胞术中 CD4 + T 细胞的比例可能为 <80%(方案步骤 5)。此问题的一个可能原因可能是脾细胞计数不准确,导致细胞计数大于额外的抗体混合物和磁珠计数。为了提高初始 CD4+ T 细胞纯化的有效性,细胞计数必须精确。此外,与该方案推荐的抗体混合物和磁珠相比,可以使用多 10% 的抗体混合物和磁珠。最后,可以在对初始 CD4 + T 细胞进行分选后立即进行流式细胞术。
第三,在培养过程中可能没有很多 T 细胞簇形成,并且大多数细胞可能在 T 细胞分化过程中死亡(方案步骤 4)。此问题的潜在原因可能是接种前未准确测定初始 CD4+ T 细胞的细胞数量,导致细胞密度低。建议采用更准确的计数方法,以在 48 孔板中实现所需的细胞密度,即大约 4 × 105 个细胞 /mL。另一个可能的原因可能是 CO2 培养箱的技术问题,例如温度或 CO2 浓度不正确。最后,更换细胞培养基时用力过大可能会导致细胞死亡。
第四,特征细胞因子基因的相对表达水平可能较低(方案步骤 7)。为确保提取的 RNA 的真实性,建议使用超过 100 ng/mL 的纳米液滴检测浓度。浓度降低的潜在原因可能是培养细胞的不健康性质,例如收集的大部分细胞已经死亡或正在死亡。为了获得真正的 RNA 浓度,必须解决细胞培养过程中可能导致生长不良的情况。这种担忧背后的另一个原因可能是 RNA 提取过程中的最终细胞计数过低,这可能是由于上清液处理过程中的意外细胞损失。采用先进的 RNA 提取技术(例如一步法 RNA 提取试剂盒)可能被证明是有利的。通过 Nanodrop 测量的理想 OD260/OD280 比率应在 1.9-2.1 的范围内。如果比率过低,则可能会造成蛋白质污染。增加不含 RNase 的缓冲液洗涤频率可能有助于缓解此问题。相反,异常低的比率意味着潜在的 RNA 降解。为了解决这个问题,建议使用不含 RNase 的水,并使用 1.5 mL 试管进行 RNase 去污。
总之,目前的方案描述了使用新的细胞培养基在体外直接诱导幼稚的 CD4 + T 细胞分化为致病性 Th17 细胞。与直接分离相比,毫无疑问,这种方法更直接、更便宜、效率更高。培养基的配置也非常简单,使得构建的 Th17 细胞可以更直观地用于后续实验,为许多疾病的研究提供了非常好的细胞模型。
Disclosures
作者声明,本文的发布不存在利益冲突。
Acknowledgements
这项工作得到了国家重点研发计划(No.2022YFC2304604)、国家自然科学基金(No.81971812)、国家自然科学基金(No.82272235)、江苏省卫生委员会科学基金(No.822235)的支持。ZDB2020009)、江苏省重点研发计划(社会发展)专项项目(No.BE2021734)、科技部国家重点研发计划(No.2020YFC083700)、江苏省重症医学重点实验室(BM2020004)、国家自然科学基金重点项目(81930058)、国家自然科学基金(82171717)、中央高校基本科研业务费(2242022K4007)、 江苏省自然科学基金面上项目 (BK20211170)。
Materials
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Rat anti-mouse CD62L, BV650, clone MEL-14, 1:200 dilution | BD | Cat# 564108; RRID: AB_2738597 | |
| Rat monoclonal anti-CD4, FITC, clone RM4-5, 1:200 dilution | BioLegend | Cat#100509; RRID: AB_312712 | |
| Rat monoclonal anti-IL-17A, PE, clone TC11-18H10.1, 1:200 dilution | BioLegend | Cat#506903; RRID: AB_ 315463 | |
| Rat monoclonal anti mouse/human CD44, APC, clone IM&, 1:200 dilution | BioLegend | Cat#103012; RRID: AB_312963 | |
| Rat monoclonal anti-RORγT, APC, clone B2D, 1:200 dilution | Invitrogen | Cat#17-6981-80; RRID: AB_2573253 | |
| Rat monoclonal FOXP3 antibody, PE, clone FJK-16s, 1:200 dilution | Invitrogen | Cat#12-5773-82; RRID: AB_465936 | |
| Chemicals, peptides, and recombinant proteins | |||
| Anti-Mouse CD3 SAFIRE purified | biogems | Cat#05112-25 | |
| Anti-Mouse CD28 SAFIRE purified | biogems | Cat#10312-25 | |
| Anti-Mouse IFN gamma | biogems | Cat#80822-25 | |
| Anti-Mouse IL-4 | biogems | Cat#81112-25 | |
| Ethanol | Xilong scientific | Cat#64-17-5 | |
| Fetal bovine serum | Gibco | Cat#10437-028 | |
| FcR Blocking reagent | Miltenyi Biotec | Cat#130-092-575 | |
| GlutaMAX supplement | gibco | Cat#35050079 | |
| Mouse rIL-1 beta | Sino Biological | Cat#50101-MNAE | |
| Mouse rIL-6 | Sino Biological | Cat#50136-MNAE | |
| Mouse rIL-23 | Sino Biological | Cat#CT028-M08H | |
| Mouse TGF beta 1 | Sino Biological | Cat#50698-M08H | |
| PBS | Procell | Cat#PB180327 | |
| Recombinant Murine IL-2 | peprotech | Cat#212-12 | |
| RPMI 1640 with L-glutamine | Gibco | Cat#11875-119 | |
| Penicillin-streptomycin solution | Gibco | Cat#15070063 | |
| β-mercaptoethanol | Sigma-Aldrich | Cat#M6250-100ML | |
| Critical commercial assays | |||
| Animal Organ Lymphocyte Separation Solution Kit | Tbdscience | Cat#TBD0018SOP | Contains animal spleen tissue lymphocyte separation liquid, tissue sample diluent (cat no. 2010C1119), sample cleaning solution (cat no. 2010X1118), sample washing solution (cat no. TBTDM-W), tissue homogenate flushing liquid (F2013TBD) |
| ChamQ SYBR qPCR Master Mix (High ROX Premixed) | Vazyme | Cat#Q341-02 | https://www.vazymebiotech.com/product-center/chamq-sybr-qpcr-master-mix-high-rox-premixed-q341.html. |
| Fixation/permeabilization Concentrate | invitrogen | Cat#00-5123-43 | |
| Fixation / Permeabilization Diluent | invitrogen | Cat#00-5223-56 | |
| Fixable Viability Dye EF506 | invitrogen | Cat#65-0866 | |
| HiScript II Q RT SuperMix for qPCR (+gDNA wiper) | Vazyme | Cat#R223-01 | https://www.vazymebiotech.com/product-center/hiscript-ii-q-rt-supermix-for-qpcr-gdna-wiper-r223.html. |
| Leukocyte Activation Cocktail | BD | Cat#550583 | |
| Mouse IL-17A (Interleukin 17A) ELISA Kit | Elabscience® | Cat#E-EL-M0047 | |
| Naïve CD4+ T cells isolation kit, mouse | STEMCELL | Cat#19765 | EasySep kit contains mouse CD4+ T cell isolation cocktail [cat no. 19852C.1], mouse memory T cell depletion cocktail [cat no. 18766C], streptavidin RapidSphered 50001 [cat no. 50001], normal rat serum [cat no. 13551]); only store rat serum at -20 °C; other components to be stored at 2-8 °C. |
| Permeabilization Buffer | invitrogen | Cat#00-8333-56 | |
| SPARKeasy Cell RNA Kit | Sparkjade | Cat#AC0205-B | https://www.sparkjade.com/product/detail?id=85 |
| Experimental models: Organisms/strains | |||
| Mouse: C57BL/6 | Gempharmatech | Cat#000013 | |
| Oligonucleotides | |||
| Mouse Il17a TaqMan primers with probe | ribobio | NA | |
| Mouse Il17f TaqMan primers with probe | ribobio | NA | |
| Mouse Il23r TaqMan primers with probe | ribobio | NA | |
| Mouse Rora TaqMan primers with probe | ribobio | NA | |
| β-actin TaqMan primers with probe | ribobio | NA | |
| Software and algorithms | |||
| Cytek Aurora | Cytek | https://spectrum.cytekbio.com/ | |
| FlowJo v10.8.1 | Tree Star | https://www.flowjo.com | |
| GraphPad prism 9 | GraphPad Software | https://www.graphpad-prism.cn | |
| Other | |||
| 1 mL syringe | Kindly | NA | |
| 1.5 mL Centrifuge tubes | Eppendorf | Cat#MCT-150-C | |
| 5 mL Round-bottom tubes | Corning | Cat#352235 | |
| 15 mL Centrifuge tubes | NEST | Cat#601052 | |
| 48-Well tissue culture plate (flatten bottom) | Corning | Cat#3548 | |
| 50 mL Centrifuge tubes | NEST | Cat#602052 | |
| 70 µm Cell strainer | Biosharp | Cat#BS-70-XBS | |
| 96-well Unskirted qPCR Plates | VIOX scientific | Cat#V4801-M | |
| 100 mm Petri dish | Corning | Cat#430167 | |
| Centrifuge | Eppendorf | 5425R | |
| Cell culture CO2 incubator | Thermo Fisher | HEPA Class100 | |
| Cytek Aurora | Cytek | NA | |
| dissecting scissors | RWD | S12003-09 | |
| Hemocytometer | AlphaCell | Cat#J633201 | |
| NanoDrop 2000 Spectrophotometer | Thermo Fisher | ND-2000 | |
| Real-time PCR System | Roche | LightCycler96 | |
| Surgical tweezers | RWD | F12005-10 | |
| Thermal cycler | Bio-Rad | C1000 Touch |
References
- Korn, T., Bettelli, E., Oukka, M., Kuchroo, V. K. IL-17 and Th17 cells. Annu Rev Immunol. 27, 485-517 (2009).
- Bhaumik, S., Basu, R. Cellular and molecular dynamics of Th17 differentiation and its developmental plasticity in the intestinal immune response. Front Immunol. 8, 254 (2017).
- Bettelli, E., Korn, T., Oukka, M., Kuchroo, V. K. Induction and effector functions of T(H)17 cells. Nature. 453 (7198), 1051-1057 (2008).
- Korn, T., et al. IL-21 initiates an alternative pathway to induce proinflammatory T(H)17 cells. Nature. 448 (7152), 484-487 (2007).
- Bettelli, E., et al. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells. Nature. 441 (7090), 235-238 (2006).
- Yang, X. O., et al. T helper 17 lineage differentiation is programmed by orphan nuclear receptors ROR alpha and ROR gamma. Immunity. 28 (1), 29-39 (2008).
- Ghoreschi, K., et al. Generation of pathogenic T(H)17 cells in the absence of TGF-β signalling. Nature. 467 (7318), 967-971 (2010).
- Lee, Y., et al. Induction and molecular signature of pathogenic TH17 cells. Nat Immunol. 13 (10), 991-999 (2012).
- McGeachy, M. J., et al. The interleukin 23 receptor is essential for the terminal differentiation of interleukin 17-producing effector T helper cells in vivo. Nat Immunol. 10 (3), 314-324 (2009).
- Wu, B., et al. The TGF-β superfamily cytokine Activin-A is induced during autoimmune neuroinflammation and drives pathogenic Th17 cell differentiation. Immunity. 54 (2), 308-323 (2021).
- Ramesh, R., et al. Pro-inflammatory human Th17 cells selectively express P-glycoprotein and are refractory to glucocorticoids. J Exp Med. 211 (1), 89-104 (2014).
- Basdeo, S. A., et al. Ex-Th17 (nonclassical Th1) cells are functionally distinct from classical Th1 and Th17 cells and are not constrained by regulatory T cells. J Immunol. 198 (6), 2249-2259 (2017).
- Cua, D. J., et al. Interleukin-23 rather than interleukin-12 is the critical cytokine for autoimmune inflammation of the brain. Nature. 421 (6924), 744-748 (2003).
- Awasthi, A., et al. Cutting edge: IL-23 receptor gfp reporter mice reveal distinct populations of IL-17-producing cells. J Immunol. 182 (10), 5904-5908 (2009).
- Jäger, A., Dardalhon, V., Sobel, R. A., Bettelli, E., Kuchroo, V. K. Th1, Th17, and Th9 effector cells induce experimental autoimmune encephalomyelitis with different pathological phenotypes. J Immunol. 183 (11), 7169-7177 (2009).
- Lee, Y., Collins, M., Kuchroo, V. K. Unexpected targets and triggers of autoimmunity. J Clin Immunol. 34, S56-S60 (2014).
- Chang, D., et al. The conserved non-coding aequences CNS6 and CNS9 control cytokine-induced Rorc transcription during T helper 17 cell differentiation. Immunity. 53 (3), 614-626 (2020).
- Bunte, K., Beikler, T. Th17 cells and the IL-23/IL-17 axis in the pathogenesis of periodontitis and immune-mediated inflammatory diseases. Int J Mol Sci. 20 (14), 3394 (2019).
- Zhao, Y., Liu, Z., Qin, L., Wang, T., Bai, O. Insights into the mechanisms of Th17 differentiation and the Yin-Yang of Th17 cells in human diseases. Mol Immunol. 134, 109-117 (2021).
- Berghmans, N., et al. Interferon-γ orchestrates the number and function of Th17 cells in experimental autoimmune encephalomyelitis. J Interferon Cytokine Res. 31 (7), 575-587 (2011).
- Wu, B., Wan, Y. Molecular control of pathogenic Th17 cells in autoimmune diseases. Int Immunopharmacol. 80, 106187 (2020).
- Du, L., et al. Growth hormone releasing hormone signaling promotes Th17 cell differentiation and autoimmune inflammation. Nat Commun. 14 (1), 3298 (2023).
- Ernst, D. N., Weigle, W. O., Noonan, D. J., McQuitty, D. N., Hobbs, M. V. The age-associated increase in IFN-gamma synthesis by mouse CD8+ T cells correlates with shifts in the frequencies of cell subsets defined by membrane CD44, CD45RB, 3G11, and MEL-14 expression. J Immunol. 151 (2), 575-587 (1993).
- Radtke, A. J., et al. IBEX: an iterative immunolabeling and chemical bleaching method for high-content imaging of diverse tissues. Nat Protoc. 17 (2), 378-401 (2022).
- El-Hindi, K., et al. T-cell-specific CerS4 depletion prolonged inflammation and enhanced tumor burden in the AOM/DSS-induced CAC model. Int J Mol Sci. 23 (3), 1866 (2022).
- Cooney, L. A., Towery, K., Endres, J., Fox, D. A. Sensitivity and resistance to regulation by IL-4 during Th17 maturation. J Immunol. 187 (9), 4440-4450 (2011).
- Zhu, X., et al. A novel interleukin-2-based fusion molecule, HCW9302, differentially promotes regulatory T cell expansion to treat atherosclerosis in mice. Front Immunol. 14, 1114802 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved