Дифференцировка in vitro наивных CD4+ Т-клеток в патогенные клетки Th17 у мышей
* These authors contributed equally
In This Article
Summary
Этот протокол описывает дифференцировку наивных CD4+ Т-клеток в патогенные клетки Th17 in vitro. В частности, в сочетании с подходом, основанным на многопараметрической проточной цитометрии, 90% чистота патогенных клеток Th17 может быть получена из наивных CD4+ Т-клеток с использованием этого метода дифференцировки.
Abstract
In vitro Методы дифференцировки Т-клеток имеют важное значение как для функциональных, так и для механистических исследований CD4+ Т-клеток. В последнее время патогенные клетки Th17 были связаны с широким спектром заболеваний, включая рассеянный склероз (РС), ревматоидный артрит, острый респираторный дистресс-синдром (ОРДС), сепсис и другие аутоиммунные расстройства. Тем не менее, известные в настоящее время протоколы дифференцировки in vitro испытывают трудности с достижением высокой чистоты патогенных клеток Th17, при этом эффективность индукции часто ниже 50%, что является ключевой проблемой в экспериментах in vitro . В этом протоколе мы предлагаем расширенный протокол культивирования и дифференцировки in vitro для патогенных клеток Th17, который используется для прямой дифференцировки наивных CD4+ Т-клеток, выделенных из селезенки мышей, в патогенные клетки Th17. Этот протокол содержит подробные инструкции по выделению спленоцитов, очистке наивных CD4+ Т-клеток и дифференцировке патогенных клеток Th17. Благодаря этому протоколу мы можем достичь чистоты дифференцировки примерно 90% для патогенных клеток Th17, что удовлетворяет основные потребности многих клеточных экспериментов.
Introduction
После выхода из тимуса наивные CD4+ Т-лимфоциты проходят через вторичные лимфоидные органы. Антигенпрезентирующие клетки, которые передают гомологичные антигены наивным CD4+ Т-клеткам, активируют их, запуская серию программ дифференцировки, которые в конечном итоге приводят к производству высокоспециализированных линий Т-хелперов (Th)1. Продукция интерлейкина 17 (IL-17) характеризует клетки Th17, субпопуляцию провоспалительных Th-клеток2. Клетки Th17 играют роль в защите хозяина от внеклеточных патогенов и в патогенезе многих аутоиммунных заболеваний, таких как аутоиммунный увеит и рассеянный склероз. Сигналы от Т-клеточных рецепторов и цитокинов IL-6 и трансформирующего фактора роста-β (TGF-β) индуцируют дифференцировку наивных Т-клеток в клетки Th17 путем фосфорилирования сигнального преобразователя и активатора транскрипции (STAT)33. STAT3 дополнительно усиливается в петле положительной обратной связи через сигнализацию, опосредованную IL-23 и IL-21 4,5. Фосфорилирование STAT3 может индуцировать экспрессию транскрипционных факторов RORγt и RORα, которые действуют как главные переключатели, регулирующие цитокиновый профиль IL-17A, IL-17F, IL-21 и IL-22 в клетках Th176. Тем не менее, сообщалось, что IL-6- и TGF-β-индуцированные клетки Th17 недостаточны для запуска аутоиммунных заболеваний, которые требуют костимуляции IL-23 или отдельной костимуляции IL-6, IL-1β и IL-23 в отсутствие TGF-β 7,8.
Субпопуляции Th17, которые не могут эффективно индуцировать экспериментальный аутоиммунный энцефаломиелит (ЭАЭ), иногда называют непатогенными Th17, в то время как субпопуляции Th17, которые могут индуцировать EAE, известны как патогенные Th179. Современные исследования показали, что, хотя патогенный Th17 и непатогенный Th17 совместно экспрессируют основной фактор транскрипции RORγt, существуют большие различия в способности продуцировать IL-17A и провоспалительныхи противовоспалительных свойствах. В дополнение к высокой экспрессии RORγt, CCR6, STAT4 и RUNX4, которые являются общими характерными факторами транскрипции Th17, патогенные клетки Th17 также демонстрируют дополнительные характеристики экспрессии сигналов генов, связанные с заболеванием, такие как TBX21, IFN-γ и CXCR3, которые обладают характеристиками субпопуляций клеток Th1. Патогенные клетки Th17 могут секретировать высокие уровни гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), ИФН-γ, TNF-α и других цитокинов11,12. Фенотип непатогенных клеток Th17 нестабилен, и только при стимуляции CD3 и цитокина IL-2 часть этих клеток может дифференцироваться в патогенные клетки Th17. Таким образом, в распространенных клинических моделях заболеваний, таких как ревматоидный артрит, рассеянный склероз и острый респираторный дистресс-синдром, патогенные клетки Th17 в первую очередь оказывают патогенное действие.
Патогенные и непатогенные клетки Th17 могут дифференцироваться in vitro под влиянием различных цитокинов. В последние годы в нескольких исследованиях были предложены методы индуцирования дифференцировки клеток Th17 с использованием различных типов и концентраций цитокинов. Клетки Th17 стимулируются комбинацией IL-6, IL-1β и IL-23 13,14,15,16. Доказано, что IL-6 и TGF-β, два цитокина, необходимые для дифференцировки клеток Th17, синергетически регулируют экспрессию дифференцировки клеток RORγt и Th17, взаимодействуя с двумя различными консервативными некодирующими последовательностями ДНК в локусе гена Rorc 17. Стабильная фаза патогенных клеток Th17 в основном поддерживается IL-2318,19. IL-23 связывается со своим рецептором и активирует сигнальный путь20 JAK-STAT, тем самым вызывая фосфорилирование Jak2 и Tyk2 и способствуя фосфорилированию STAT1, STAT3, STAT4 и STAT5. IL-4 и ИФН-γ являются негативными регуляторами этого пути. Тем не менее, исследования показали, что IL-1β может положительно регулировать транскрипцию Rorα и Rorγt через путь mTOR для поддержания стабильности фенотипа клеток Th1721.
В связи с гетерогенностью многочисленных исследований в качестве контроля были выбраны протоколы индукции патогенных и непатогенных клеток Th17 из последних исследований22. Полученные результаты свидетельствуют о том, что, если предположить, что все проводится по этому протоколу, после 5 дней культивирования при условии генерации патогенного Th17 более 90% выживших клеток могут быть патогенными клетками Th17.
Protocol
Институциональный комитет по обзору исследований на животных при Юго-Восточном университете одобрил все исследования на животных, подробно описанные в этом исследовании, которые были проведены в соответствии как с местными, так и с институциональными стандартами. Образцы селезенки были взяты у мышей C57BL6/J. В исследование были включены как самки, так и самцы мышей в возрасте от 5 до 8 недель. Питательную среду и буфер хранили при температуре 4 °С до 1 месяца. Хирургические инструменты перед использованием были автоклавированы. Надевайте латексные перчатки и маски, чтобы избежать загрязнения кожи, глаз и одежды реагентами; Используйте много воды или солевого ополаскивателя для кожи и глаз.
1. Предварительное покрытие 24-луночного тканевого планшета анти-CD3
- Разбавьте анти-CD3 до конечной концентрации 1 мкг/мл в стерильном 1x фосфатно-солевом буфере (PBS) или среде RPMI 1640.
- Заполните 24-луночный тканевой планшет 1 мл раствора анти-CD3 (1 мкг/мл); Затем накройте лунку парапленкой.
- Поместите пластину с анти-CD3-покрытием в холодильник (2-8 °C) на 16 часов или держите ее при температуре 37 °C в камерном инкубаторе в течение 2-3 часов.
2. Выделение селезенки мыши и приготовление суспензии селезенки из одноклеточных клеток
- Вызвать полную анестезию в C57BL/6J с 3% изофлураном и усыпить путем вдыхания 100% углекислого газа в течение 2 мин. Сразу после смерти мышей замочите их в 75% этаноле для дезинфекции, чтобы предотвратить заражение.
- Поместите мышь в лежачем положении на чистую скамейку, разрежьте ее по средней линии живота и разделите структуры брюшной полости слой за слоем. Аккуратно вскройте пинцетом большой сальник и желудок, аккуратно вытяните селезенку с гастроселезеночной связкой и тупо отделите селезенку от окружающих тканей и связок, чтобы получить неповрежденную селезенку (будьте осторожны, чтобы избежать раздавливания селезенки или разрыва).
ПРИМЕЧАНИЕ: Для поддержания стерильного состояния в стерильном супер чистом скамейке проводится следующая операция. - Поместите клеточный фильтр 70 мкм в 100-миллиметровую стерильную чашку для культур, добавьте селезенку в клеточное ситечко и раздавите его поршенем шприца. В это же время добавьте 5-8 мл гомогенатной промывочной жидкости, чтобы протолкнуть все клетки через фильтр в чашку для культивирования.
ПРИМЕЧАНИЕ: Состав набора жидкостей для разделения лимфоцитов можно увидеть в Таблице материалов. - Центрифугируйте фильтрат при 450 × г в течение 5 мин при комнатной температуре. Выбросьте надосадочную жидкость.
- Ресуспендируйте клеточную гранулу с помощью разбавителя образца, входящего в комплект для разделения лимфоцитов, или среды PBS или RPMI 1640. Отрегулируйте клеточную концентрацию клеточной суспензии до 2 ×10 8-1 × 109 клеток/мл.
ПРИМЕЧАНИЕ: Как правило, требуется 4-6 мл разбавителя образца на одну селезенку. - В пробирку для центрифуги возьмите такое же количество раствора для разделения лимфоцитов, как и для тканевой суспензии одиночных клеток. Осторожно нанесите суспензию одиночных клеток на поверхность раствора для разделения лимфоцитов и центрифугируйте при 800 × г, 25 °C в течение 30 мин. Установите ускорение и замедление центрифуги в соответствующий диапазон (например, установите значение 3, если есть обычные передачи от 1 до 9).
ПРИМЕЧАНИЕ: Раствор для разделения лимфоцитов должен быть не менее 3 мл. - После центрифугирования наблюдайте за четырьмя слоями в центрифужной пробирке сверху донизу. Первый слой соответствует разбавителю образца, за ним следует кольцевой молочно-белый слой лимфоцитов. Третий слой представляет собой разделительную жидкость, а четвертый слой состоит из эритроцитов.
- С помощью пипетки осторожно втяните второй слой кольцевого молочно-белого слоя лимфоцитов в другую центрифужную пробирку и добавьте 10 мл чистящего раствора в центрифужную пробирку, чтобы перемешать клетки.
- Центрифугировать при 250 × г в течение 5 мин при комнатной температуре. Выбросьте надосадочную жидкость. Используйте 10 мл среды RPMI 1640 для ресуспендирования клеточной гранулы для подсчета клеток.
3. Очищение наивных CD4+ Т-клеток на основе отрицательного отбора магнитных шариков
Примечание: Изолируйте нетронутые и высокоочищенные наивные CD4+ Т-клетки (CD4+CD44lowCD62Lhigh) из спленоцитов мышей путем иммуномагнитного отрицательного отбора.
- Подготовьте образец так, чтобы в нем было от 1 ×до 10 8 клеток/мл в диапазоне объема 0,1-2 мл.
- Добавьте 50 л/мл сыворотки крови крысы и перенесите образец в полистирольную пробирку с круглым дном объемом 5 мл.
ПРИМЕЧАНИЕ: С составом наивного набора для сортировки CD4 Т-клеток можно ознакомиться в Таблице материалов. - Добавьте в образец 50 мкл/мл изоляционного коктейля, хорошо перемешайте и инкубируйте в течение 7,5 минут при комнатной температуре.
- Добавьте в образец 50 мкл/мл коктейля Depletion, хорошо перемешайте и инкубируйте в течение 2,5 минут при комнатной температуре.
- Сделайте магнитные шарики вихревыми для обеспечения равномерного дисперсии. Добавьте в образец 75 л/мл магнитных шариков, хорошо перемешайте и инкубируйте в течение 2,5 минут при комнатной температуре.
ПРИМЕЧАНИЕ: Частицы должны казаться равномерно диспергированными; Время вортекса должно быть не менее 30 с. - Долейте образец со средой RPMI 1640 до конечного объема 2,5 мл. Перемешайте несколько раз, аккуратно пипетируя вверх и вниз.
- Поместите пробирку (без крышки) в магнит и выдерживайте 2,5 минуты при комнатной температуре.
- Взяв в руки магнит, переверните магнит и трубку одним непрерывным движением и вылейте обогащенную клеточную суспензию в новую пробирку.
ПРИМЕЧАНИЕ: Держите трубку и магнит перевернутыми в течение 2-3 секунд, прежде чем поворачивать их в вертикальном положении. Не тревожьте капли, которые могут остаться на горловине трубки. - Определяют номер клеток с помощью гемоцитометра.
- Проведите проточный цитометрический анализ наивных CD4+ Т-клеток до и после выделения (рис. 1).
- Переложите клетки в новую центрифужную пробирку, центрифугируйте при 400 × г в течение 5 минут при комнатной температуре и выбросьте надосадочную жидкость.
- Ресуспендируйте клетки в 200-500 мкл среды RPMI 1640 (с добавлением 10% фетальной бычьей сыворотки). На каждый 1 мл клеточной культуры (например, ~106 клеток/мл) добавьте 2 мкл коктейля для активации лейкоцитов и перемешайте. Культивировать клетки в CO2-инкубаторе при температуре 37 °C и насыщенной влажности в течение 4-6 часов.
ПРИМЕЧАНИЕ: Камеры подвергались вихревому ремонту один раз в 1-2 ч. - Центрифугируйте ячейки при 400 × г, 4 °C в течение 5 минут. Осторожно выбросьте надосадочную жидкость и повторно суспендируйте клетки в 200 мкл PBS. Добавьте в клетки 1 мкл блокатора Fc (например, ~106 клеток/мл). Инкубируйте клетки в течение 10 минут при температуре 4 °C.
- Промойте клетки один раз 1 мл PBS центрифугированием при 400 × г в течение 5 минут при 4 °C. Выбросьте надосадочную жидкость и повторно суспендируйте клетки в 200 мкл PBS.
- Добавьте коктейль антител (Fixable Viability Dye, 1:1000; анти-CD4, 1:200; анти-CD44, 1:200; анти-CD62L, 1:200) и инкубируйте клетки в течение 15-20 мин в темноте при 4 °C.
- Промойте ячейки 2 x 1 мл PBS, а затем центрифугируйте при 400 × г в течение 5 минут при 4 °C.
- Выбросьте надосадочную жидкость, повторно суспендируйте клетки в 250 мкл фиксированного буфера и инкубируйте их в течение 40-60 мин в темноте при температуре 4 °C.
ПРИМЕЧАНИЕ: Фикс-буфер поставляется с буфером для окрашивания Foxp3/транскрипционного фактора, который представляет собой 4-кратный стоковый раствор, который должен быть разбавлен разбавителем для пермеабилизации. - Добавьте 1 мл 1x пермеабилизационного буфера, чтобы промыть клетки 2 раза, центрифугируя клетки при 300 × г, 4 °C в течение 5 минут.
- Выбросьте надосадочную жидкость, повторно суспендируйте клетки в 200 мкл буфера для пермеабилизации и добавьте антитело (Foxp3 [ядерный], 1:200) к клеткам. После фиксации и разрыва мембраны смеси клеток-антител инкубировать в темноте в течение 40-60 мин, периодически встряхивая в течение коротких периодов времени при температуре 4 °C.
ПРИМЕЧАНИЕ: Раствор для пермеабилизации/промывки представляет собой 10-кратный исходный раствор, который необходимо разбавить перед использованием PBS.
4. Индукция патогенных клеток Th17 in vitro
- Перед использованием удалите стерильный PBS с предварительно покрытых 24-луночных планшетов.
- Для культивирования используют среду для культивирования клеток Th17 (Таблица 1) и контрастное вещество, включая среду для культивирования клеток Th0 (Таблица 1), классическую непатогенную среду для культур Th17 (Таблица 1) и классическую патогенную среду для культур Th17 (Таблица 1). Ресуспендируют обогащенные наивные CD4+ Т-клетки и дозируют в разные лунки в том же 24-луночном планшете (предварительно покрытом анти-CD3), регулируя концентрацию до 4 × 105 клеток/мл, по 1 мл среды в каждой лунке.
- Добавьте по 1 мкл/мл раствора анти-CD28 (конечная концентрация: разбавленная средой до 2 мкг/мл) в каждую лунку. Культивируйте клетки в инкубаторе с 5% содержаниемCO2 при 37 °C в течение 5 дней.
- Замените надосадочную среду для клеточных культур питательной средой (Th0, непатогенный Th17, классический патогенный Th17 и объективный Th17) путем тщательного пипетирования для равномерного распределения клеток, отбросьте половину среды, содержащей клетки, а затем добавьте новую среду, равную объему отбраковки на 2-й день. Повторите на 4 день.
- Наблюдайте за клетками под оптическим микроскопом на 5-й день (рис. 2). Соберите надосадочную жидкость из каждой группы и криоконсервируйте их при температуре -80 °C.
5. Проточный цитометрический анализ на патогенную дифференцировку клеток Th17 и Th0
- Соберите все клетки (в лунку) через 5 дней после начала культивирования. Выполните шаги 3.12-3.15.
- Добавьте коктейль антител (Fixable Viability Dye, 1:1000; anti-CD4, 1:200) и инкубируйте клетки в течение 15-20 минут в темноте при 4 °C.
- Выполните шаги 3.17-3.19.
- Выбросьте надосадочную жидкость, повторно суспендируйте клетки в 200 мкл буфера для пермеабилизации и добавьте коктейль антител (IL-17A [внутриклеточный], 1:200; RORγT [ядерный], 1:200) к клеткам. После фиксации и разрыва мембраны смеси клеток-антител инкубировать в темноте в течение 40-60 мин, периодически встряхивая в течение коротких периодов времени при температуре 4 °C.
- Добавьте 1 мл 1x раствора для промывки клеток 2 раза, центрифугируя клетки при 400 × г в течение 5 минут при 4 °C; Затем выбросьте надосадочную жидкость.
- Исследуйте клетки на проточном цитометре и проанализируйте данные с помощью программного обеспечения (рис. 3).
- Включите проточный цитометр и включите самозапускающийся процесс очистки и калибровки.
- Выберите лазерный канал, используемый в этом эксперименте, и установите чистую пробирку, одинарно окрашенные пробирки и пробирки для образцов.
- Нажмите на опцию «Пустая трубка » и проверьте на машине; Отрегулируйте напряжение таким образом, чтобы событие ячейки находилось, насколько это возможно, в центре ящика для сбора.
- Соберите одинарно окрашенные ячейки трубки и выполните спектральное обнаружение соответствующих каналов, чтобы подтвердить, что флуоресцентное антитело добавлено правильно.
- Нажмите кнопку «Отменить микширование » и позвольте машине автоматически настроить спектральную компенсацию. С помощью других приборов для проточной цитометрии отрегулируйте компенсацию флуоресценции в нормальном режиме.
- Соберите каждую ячейку для образца пробирки, сохраните формат данных в виде файлов FCS и экспортируйте. Анализируйте и стройте графики в соответствующем программном обеспечении для анализа данных проточной цитометрии.
- Обведите вокруг основной популяции клеток и удалите возможные клеточные адгезии через диагональные круговые ворота FSC-H и FSC-A.
- Обведите живые клетки в соответствии с областью отрицательного круга FVS; затем обведите популяцию клеток CD4+.
- Построить поперечные ворота с горизонтальной осью как ИЛ-17 А и вертикальной осью как RORγT; двойной положительный отбор в области Q2 представляет собой популяцию клеток Th17.
6. Иммуноферментный анализ (ИФА) для выявления секреции IL-17A, индуцированной различными средами
- Разморозьте надосадочную жидкость замороженных клеток, собранные в разделе 4.5.
- Добавьте 100 мкл разбавленного стандарта, бланк и образец в предназначенные для этого лунки. Используйте герметик, чтобы накрыть планшет, и инкубируйте в течение 90 минут при 37 °C.
ПРИМЕЧАНИЕ: Добавьте растворы в нижнюю часть микро-ИФА лунки, не касаясь внутренней стенки и не вызывая пенообразования. - Сцедите жидкость из каждой лунки и немедленно добавьте 100 мкл рабочего раствора Biotinylated Detection Antibody. Используйте новый герметик, чтобы накрыть планшет, и инкубируйте в течение 1 часа при 37 °C.
- Сцедите раствор и добавьте в каждую лунку по 350 мкл промывочного буфера. Через 1 минуту отасуньте или сцедите раствор из каждой лунки и промокните его насухо на чистой впитывающей бумаге. Повторите этот шаг стирки 3 раза.
- Добавьте в каждую лунку по 100 мкл рабочего раствора конъюгата пероксидазы хрена. С помощью нового герметика накройте планшет и инкубируйте в течение 30 минут при температуре 37 °C.
- Сцедите раствор из каждой лунки и повторите процесс промывки 5 раз, как описано в шаге 6.4.
- Добавьте 90 μL реагента Substrate в каждую лунку и инкубируйте около 15 минут при 37 °C с помощью нового герметика, защищающего планшет от света.
ПРИМЕЧАНИЕ: Время реакции может быть изменено в зависимости от фактического изменения цвета, но не должно превышать 30 минут. Дайте считывателю микропланшетов прогреться в течение ~15 минут перед измерением внешнего диаметра. - Добавьте 50 μл/лунку Stop Solution в том же порядке, что и раствор для субстрата.
- Определите оптическую плотность (значение OD) каждой лунки сразу с помощью считывателя микропланшетов, установленного на 450 нм.
- Получите значения наружного диаметра для стандартных образцов и повторите лунки образцов, а также вычтите значения наружного диаметра пустых лунок для получения скорректированных значений. Затем выполните линейную аппроксимацию с концентрацией в качестве абсциссы и значением OD в качестве ординаты. На основе подогнанного уравнения рассчитать значения концентрации Ил-17А для пробных скважин.
Примечание: После 4 дней дифференцировки содержание IL-17A в надосадочной жидкости каждой группы показано на рисунке 4. Метод подгонки можно использовать в программном обеспечении Orgin21. Стандартная кривая, полученная в результате этого эксперимента, имеет значение R2 0,9946.
7. Дифференцировка Т-клеток с помощью анализов экспрессии сигнатурных генов с помощью количественной ПЦР (кПЦР)
Примечание: Чтобы исключить возможность нестабильности проточной цитометрии из-за эффектов красителей и фиксации/разрыва, мы обнаружили экспрессию характерных генов с помощью количественной ПЦР для выяснения эффекта дифференцировки патогенного Th17 на уровне транскрипции.
- Измерьте количество клеток в конце культивирования Т-клеток. Соберите клетки в центрифужные пробирки объемом 1,5 мл и центрифугируйте при давности 400 × г в течение 5 минут. Тщательно выбросьте все надосадочные жидкости.
- Экстракция РНК
ПРИМЕЧАНИЕ: Процесс экстракции должен проводиться в вытяжном шкафу или на сверхчистом столе, чтобы избежать загрязнения ферментами РНК.- Добавьте 500 мкл буфера для лизиса (например, до 1-2 ×10 6 клеток) в пробирку с образцом (шаг 7.1), немедленно встряхните и перемешайте до тех пор, пока не останется клеточная масса, и дайте постоять 1 минуту.
- Добавьте смесь в адсорбционную колонну, помещенную в сборную пробирку, центрифугируйте при 13 400 × г в течение 30 с и выбросьте фильтрат.
- Добавьте указанное количество абсолютного этанола в бутылку Wash Buffer перед первым использованием. Добавьте 500 μL промывочного буфера в адсорбционную колонну, центрифугируйте при 13 400 × г в течение 30 с и выбросьте фильтрат.
- Повторите стирку в шаге 7.2.3.
- Поместите адсорбционную колонку RA в пустую сборную пробирку и центрифугируйте при температуре 13 400 × г в течение 2 минут, чтобы удалить раствор для промывки.
ПРИМЕЧАНИЕ: Раствор для полоскания необходимо удалить, чтобы остатки этанола в растворе для промывки не ингибировали реакцию на последующих этапах. - Снимите адсорбционную колонку RA и поместите ее в чистую центрифужную пробирку без РНКазы. Добавьте 50 мкл не содержащего РНКазы H2O в середину адсорбционной мембраны, дайте ей постоять 1 минуту при комнатной температуре и центрифугируйте при 9600 × г в течение 1 минуты.
- Измерьте чистоту и концентрацию РНК.
- Синтезируйте первую цепь кДНК, следуя инструкциям производителя набора.
- Удалите геномную ДНК. Возьмите 500 нг экстрагированной матричной РНК в центрифужную пробирку без РНКазы; добавьте смесь ddH,2O и 4x gDNA, не содержащую РНКазы, чтобы получить смесь. Аккуратно взбейте пипеткой и поставьте на водяную баню при температуре 42 °C на 2 минуты.
ПРИМЕЧАНИЕ: Количество реакционной смеси и количество добавляемой зависят от концентрации РНК; Обратитесь к подробной инструкции. В эксперименте использовалась реакционная система объемом 20 μл. - Непосредственно добавьте 5-кратную реакционную систему обратной транскрипции в реакционную пробирку предыдущего этапа. Возьмите 4 мкл реакционной системы обратной транскрипции и 16 мкл смеси с предыдущего этапа и аккуратно перемешайте пипеткой.
ПРИМЕЧАНИЕ: Система обратной транскрипции включает в себя все необходимые системы обратной транскрипции, которая представляет собой систему обратной транскрипции с прямой конфигурацией. - Установите реакцию обратной транскрипции: 37 °C 15 мин, 85 °C, 5 с и, наконец, охладите до 4 °C.
- Удалите геномную ДНК. Возьмите 500 нг экстрагированной матричной РНК в центрифужную пробирку без РНКазы; добавьте смесь ddH,2O и 4x gDNA, не содержащую РНКазы, чтобы получить смесь. Аккуратно взбейте пипеткой и поставьте на водяную баню при температуре 42 °C на 2 минуты.
- Настройте реакцию ПЦР в соответствии с инструкциями производителя.
- Добавьте 10 мкл смеси ферментов реакции ПЦР 2x в пробирку для количественной ПЦР, 0,4 мкл праймера 1, 0,4 мкл праймера 2, 0,4 мкл 50x референсного красителя ROX 1, 2 мкл матричной кДНК и 6,8 мкл ddH2O для получения смеси объемом 20 мкл.
- Провести ПЦР в приборе для флуоресцентной количественной ПЦР в реальном времени с использованием следующих настроек: стадия 1, 95 °C, 30 с, Rep x 1; ступень 2, сначала 95 °C, 10 с, затем 60 °C, 30 с, Rep x 40; стадия 3, первая 95 °C, 15 с, следующая 60 °C, 60 с, наконец 95 °C, 15 с, Rep x 1.
Примечание: После 4 дней дифференцировки относительные уровни экспрессии Il17a, Il17f, Rora и Il23r в наивных CD4+ Т-клетках показаны на рисунке 5.
Representative Results
Наш протокол был разработан на основе более ранних исследований патогенной дифференцировки клеток Th17. Первым шагом эксперимента является обнаружение чистоты наивных CD4+ Т-клеток, выделенных из селезенки, с помощью магнитной сортировки шариков, что является основой для успешной нашей последующей патогенной дифференцировки клеток Th17. Чистоту наивных CD4+ Т-клеток определяли с помощью поверхностных маркеров CD62L23 и CD4424 , в то время как FOXP325 использовали в качестве маркера Treg-клеток. Мы обнаружили, что содержание Treg-клеток значительно снижается после сортировки, а чистота наивных CD4+ Т-клеток может достигать не менее 95% (рис. 1). Для сравнения дифференцировки патогенных Th17-клеток наивные CD4+ Т-клетки культивировали со средой Th0 (Таблица 1) и средой дифференцировки Th17 (Таблица 1) в общей сложности в течение 5 дней. Было обнаружено, что Т-клетки демонстрируют кластерный рост как в средах Th0, так и в среде Th17 (рис. 2).
Затем клетки фиксировали, пермеабилизировали и мечили антителами против нескольких цитокинов в дифференцированных CD4+ Т-клетках на основе проточной цитометрии. Мы рассмотрели IL17A26 и RORγT27 в качестве отличительных цитокинов дифференцировки клеток Th17 и обнаружили, что 90% наивных CD4+ Т-клеток успешно дифференцировались в патогенные клетки Th17 под воздействием новой среды для культивирования клеток Th17 (рис. 3). На рисунке 5 представлены сигнатурные гены клеток Th17, обнаруженные методом ПЦР, которые доказали, что патогенные клетки Th17, полученные нами путем дифференцировки, стабильно экспрессируются.
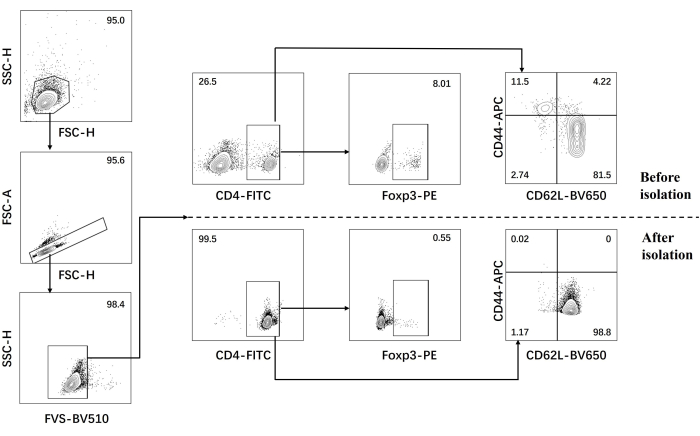
Рисунок 1: Стратегия гейтирования для анализа сигнатурных цитокинов у мышей C57BL/6J до и после выделения CD4+ Т-клеток ранее. Сокращения: FSC-H = высота пика прямого рассеяния; SSC-H = высота бокового рассеивания; FSC-A = область прямого пика рассеяния; FITC = флуоресцеин изотиоцианат; ПЭ = фикоэритрин. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
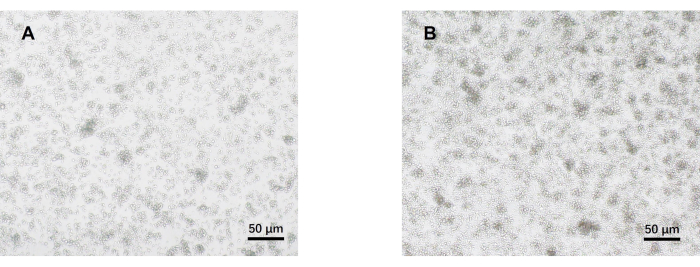
Рисунок 2: Репрезентативные изображения наивных CD4+ Т-клеток мышей, культивируемых в патогенных условиях Th17 и Th0 в течение 5 дней. (A) клетки Th0; (В) патогенные клетки Th17. Масштабные линейки = 50 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
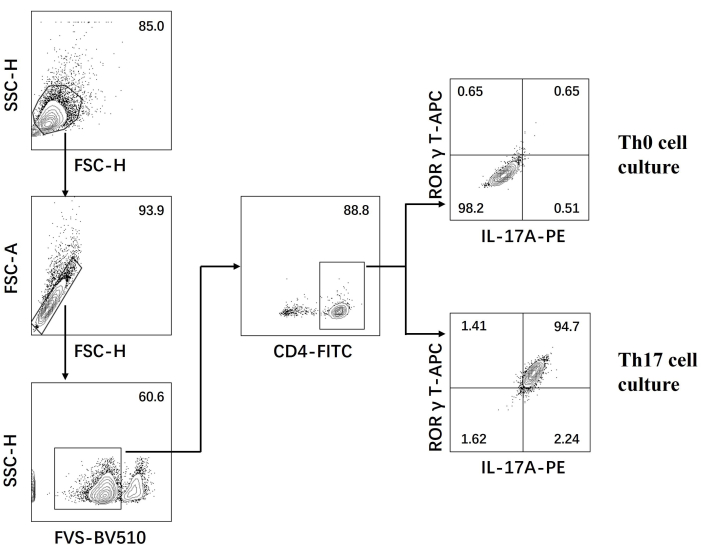
Рисунок 3: Анализ проточной цитометрии после дифференцировки, индуцированной средой для культуры клеток Th0 и средой для культуры клеток Th17. Сокращения: FSC-H = высота пика прямого рассеяния; SSC-H = высота бокового рассеивания; FSC-A = область прямого пика рассеяния; FITC = флуоресцеин изотиоцианат; ПЭ = фикоэритрин. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
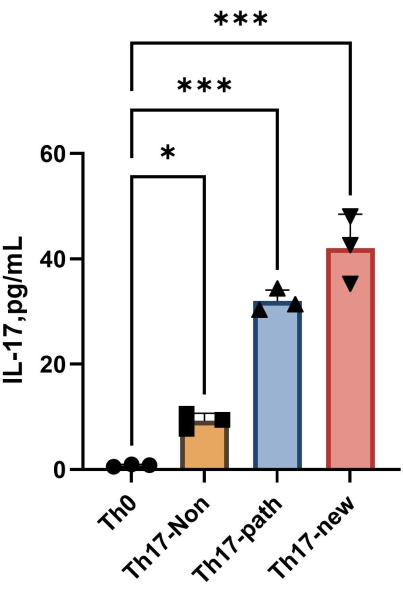
Рисунок 4: Содержание IL-17A в надосадочной жидкости клеточной культуры Th0 и клеточной культуральной среде Th17 после индукции дифференцировки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
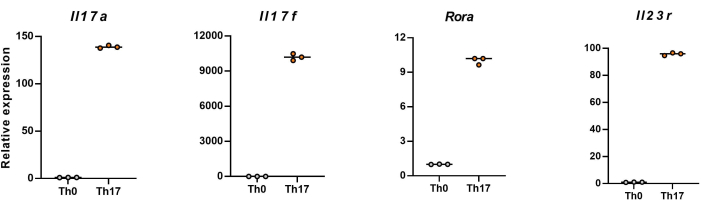
Рисунок 5: Репрезентативные результаты измерения уровней экспрессии сигнатурных цитокинов в дифференцированных CD4+ Т-клетках мыши C57BL/6J. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Целевая среда для культивирования патогенных клеток Th17 | Среда для культивирования клеток Th0 | Классическая непатогенная среда для культивирования клеток Th17 | Классическая патогенная среда для культивирования клеток Th17. | |||||||||||
| Реагент | Конечная концентрация | Количество | Конечная концентрация | Количество | Конечная концентрация | Количество | Конечная концентрация | Количество | ||||||
| Пенициллин-стрептомицин (100x) | 1x | 500 мкл | 1x | 500 мкл | 1x | 500 мкл | 1x | 500 мкл | ||||||
| Фетальная бычья сыворотка | 10% | 5 мл | 10% | 5 мл | 10% | 5 мл | 10% | 5 мл | ||||||
| β-меркаптоэтанол | 50 мкМ | 50 μл | 50 мкМ | 50 μл | 50 мкМ | 50 μл | 50 мкМ | 50 μл | ||||||
| Добавка GlutaMAXTM (100x) | 1x | 500 мкл | 1x | 500 мкл | 1x | 500 мкл | 1x | 500 мкл | ||||||
| Раствор пирувата натрия (100x) | 1 мМ | 500 мкл | 1 мМ | 500 мкл | 1 мМ | 500 мкл | 1 мМ | 500 мкл | ||||||
| Антимышиный ИФН гамма (1 мг/мл) | 5 мкг/мл | 250 мкл | 10 мкг/мл | 500 мкл | 10 мкг/мл | 500 мкл | ||||||||
| Антимышиный IL-4 (2 мг/мл) | 5 мкг/мл | 125 μл | 5 мкг/мл | 250 мкл | 10 мкг/мл | 250 мкл | ||||||||
| Мышь rIL-1 бета (20 мкг) | 20 нг/мл | NA | ||||||||||||
| Мышь rIL-6 (20 μг) | 20 нг/мл | NA | 50 нг/мл | NA | 50 нг/мл | NA | ||||||||
| Мышь rIL-23 (50 μг) | 50 нг/мл | NA | 10 нг/мл | NA | ||||||||||
| Мышь TGF beta (100 мкг) | 3 нг/мл | NA | 1 нг/мл | NA | 1 нг/мл | NA | ||||||||
| Мышиный ИЛ-2 (5 мкг) | 20 нг/мл | NA | ||||||||||||
| РПМИ 1640 | NA | До 50 мл | NA | До 50 мл | NA | До 50 мл | ||||||||
| Итог | NA | 50 мл | NA | 50 мл | NA | 50 мл | ||||||||
Таблица 1: Целевая патогенная культура клеток Th17, культура клеток Th0, классические непатогенные и патогенные среды для культивирования клеток Th17.
Discussion
Эта процедура предложила продуктивный способ увеличения количества CD4+ Т-клеток селезенки у мышей для производства in vitro патогенных Th17-клеток. Несмотря на то, что мы используем больше цитокинов, чем другие зарегистрированные среды для культивирования клеток Th17, мы стремимся оптимизировать условия роста патогенных клеток Th17. Мы рассматриваем дальнейшую оптимизацию нашего протокола индуцированной дифференцировки.
В данном случае мы просто использовали проточную цитометрию и кПЦР для изучения продукции цитокинов отличительного признака. С некоторыми незначительными изменениями этот подход также может быть использован для других функциональных тестов, таких как пролиферация клеток.
Мы использовали набор для выделения лимфоцитов китайского производства для выделения лимфоцитов селезенки мыши, потому что он эффективен и экономит время. Решения для разделения лимфоцитов на основе других брендов также могут достигать цели разделения лимфоцитов селезенки мыши с помощью различных этапов. Другой метод заключается в непосредственном лизировании эритроцитов полученной суспензии клеток селезенки; Тем не менее, мы обнаружили, что эритроциты селезенки часто не могут быть лизированы за один раз.
Во время выполнения этого протокола могут возникнуть некоторые проблемы. Во-первых, количество наивных CD4+ Т-клеток, полученных с помощью магнитной сортировки шариков, может быть очень низким (шаг протокола 3). Это может быть связано с тем, что процесс дробления органов является недостаточным. Важно следить за тем, чтобы орган был правильно гомогенизирован. Увеличение частоты промывки в процессе гомогенизации улучшит скорость восстановления. Для получения большего количества CD4+ Т-клеток, не относящихся к селезенке, мы предлагаем использовать более молодых мышей (в возрасте 6-10 недель). Существуют различные методы разделения лимфоцитов селезенки, и выход может варьироваться в зависимости от используемой жидкости для разделения. Рекомендуется использовать универсально сертифицированную разделительную жидкость и стараться максимально извлечь слой лимфоцитов.
Во-вторых, доля CD4+ Т-клеток в проточной цитометрии может составлять <80% (этап протокола 5). Одной из возможных причин этой проблемы может быть неточный подсчет спленоцитов, в результате чего количество клеток превышает количество клеток дополнительного коктейля антител и магнитных шариков. Чтобы повысить эффективность наивной очистки CD4+ Т-клеток, подсчет клеток должен быть точным. Кроме того, можно использовать на 10% больше коктейля антител и магнитных шариков сверх того, что рекомендует этот протокол. Наконец, проточная цитометрия может быть выполнена сразу после сортировки наивных CD4+ Т-клеток.
В-третьих, во время культивирования может образоваться не так много кластеров Т-клеток, и большинство клеток могло погибнуть во время дифференцировки Т-клеток (шаг 4 протокола). Потенциальной причиной этой проблемы может быть неточное определение количества клеток для наивных CD4+ Т-клеток до посева, что приводит к низкой плотности клеток. Рекомендуется использовать более точный метод подсчета для достижения желаемой плотности ячеек приблизительно 4 × 105 клеток/мл для каждой лунки в 48-луночном планшете. Другой возможной причиной могут быть технические проблемы с инкубатором CO2 , такие как неправильная температура или концентрация CO2 . Наконец, чрезмерное усилие при смене среды для культивирования клеток потенциально может привести к гибели клеток.
В-четвертых, относительные уровни экспрессии генов сигнатурных цитокинов могут быть низкими (этап протокола 7). Чтобы обеспечить подлинность экстрагированной РНК, рекомендуется использовать концентрацию нанокапельного детектирования более 100 нг/мл. Потенциальной причиной снижения концентрации может быть нездоровый характер культивируемых клеток, например, большая часть собранных клеток мертва или находится в процессе гибели. Чтобы получить истинную концентрацию РНК, необходимо разрешить ситуацию, которая может привести к плохому росту во время культивирования клеток. Альтернативной причиной этого беспокойства может быть чрезмерно низкое конечное количество клеток, достигнутое во время экстракции РНК, возможно, из-за непреднамеренной потери клеток во время утилизации надосадочной жидкости. Использование передовых методов экстракции РНК, таких как наборы для одношаговой экстракции РНК, может оказаться выгодным. Идеальное соотношение OD260/OD280, измеренное с помощью Nanodrop, должно находиться в диапазоне 1,9-2,1. В случае чрезмерно низкого соотношения становится возможным заражение белков. Увеличение частоты промывки буфера без РНКазы может помочь смягчить эту проблему. И наоборот, нехарактерно низкое соотношение подразумевает потенциальную деградацию РНК. Чтобы противодействовать этой проблеме, рекомендуется использовать воду, не содержащую РНКазы, и использовать пробирки объемом 1,5 мл для обеззараживания РНКазы.
В заключение, текущий протокол описывает использование новой среды для культивирования клеток для непосредственного индуцирования наивных CD4+ Т-клеток к дифференцировке в патогенные клетки Th17 in vitro. По сравнению с прямым сепарированием, нет никаких сомнений в том, что этот метод является более прямым, недорогим и более эффективным. Конфигурация среды также очень проста, так что сконструированные клетки Th17 можно более интуитивно использовать для последующих экспериментов, обеспечивая очень хорошую модель клетки для изучения многих заболеваний.
Disclosures
Авторы заявляют об отсутствии конфликта интересов в связи с публикацией данной статьи.
Acknowledgements
Работа выполнена при поддержке Национальной программы ключевых исследований и разработок Китая (No2022YFC2304604), Национального фонда естественных наук Китая (No81971812), Национального фонда естественных наук Китая (No82272235), Научного фонда Комиссии по здравоохранению провинции Цзянсу (No. ZDB2020009), Специальный проект Программы ключевых исследований и разработок (социальное развитие) провинции Цзянсу (No BE2021734), Национальная ключевая программа исследований и разработок Министерства науки и технологий (No 2020YFC083700), Ключевая лаборатория медицины интенсивной терапии провинции Цзянсу (BM2020004), Ключевой проект Национального фонда естественных наук Китая (81930058), Национальный фонд естественных наук Китая (82171717), Фонды фундаментальных исследований центральных университетов (2242022K4007), и Общий проект Фонда естественных наук провинции Цзянсу (BK20211170).
Materials
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Rat anti-mouse CD62L, BV650, clone MEL-14, 1:200 dilution | BD | Cat# 564108; RRID: AB_2738597 | |
| Rat monoclonal anti-CD4, FITC, clone RM4-5, 1:200 dilution | BioLegend | Cat#100509; RRID: AB_312712 | |
| Rat monoclonal anti-IL-17A, PE, clone TC11-18H10.1, 1:200 dilution | BioLegend | Cat#506903; RRID: AB_ 315463 | |
| Rat monoclonal anti mouse/human CD44, APC, clone IM&, 1:200 dilution | BioLegend | Cat#103012; RRID: AB_312963 | |
| Rat monoclonal anti-RORγT, APC, clone B2D, 1:200 dilution | Invitrogen | Cat#17-6981-80; RRID: AB_2573253 | |
| Rat monoclonal FOXP3 antibody, PE, clone FJK-16s, 1:200 dilution | Invitrogen | Cat#12-5773-82; RRID: AB_465936 | |
| Chemicals, peptides, and recombinant proteins | |||
| Anti-Mouse CD3 SAFIRE purified | biogems | Cat#05112-25 | |
| Anti-Mouse CD28 SAFIRE purified | biogems | Cat#10312-25 | |
| Anti-Mouse IFN gamma | biogems | Cat#80822-25 | |
| Anti-Mouse IL-4 | biogems | Cat#81112-25 | |
| Ethanol | Xilong scientific | Cat#64-17-5 | |
| Fetal bovine serum | Gibco | Cat#10437-028 | |
| FcR Blocking reagent | Miltenyi Biotec | Cat#130-092-575 | |
| GlutaMAX supplement | gibco | Cat#35050079 | |
| Mouse rIL-1 beta | Sino Biological | Cat#50101-MNAE | |
| Mouse rIL-6 | Sino Biological | Cat#50136-MNAE | |
| Mouse rIL-23 | Sino Biological | Cat#CT028-M08H | |
| Mouse TGF beta 1 | Sino Biological | Cat#50698-M08H | |
| PBS | Procell | Cat#PB180327 | |
| Recombinant Murine IL-2 | peprotech | Cat#212-12 | |
| RPMI 1640 with L-glutamine | Gibco | Cat#11875-119 | |
| Penicillin-streptomycin solution | Gibco | Cat#15070063 | |
| β-mercaptoethanol | Sigma-Aldrich | Cat#M6250-100ML | |
| Critical commercial assays | |||
| Animal Organ Lymphocyte Separation Solution Kit | Tbdscience | Cat#TBD0018SOP | Contains animal spleen tissue lymphocyte separation liquid, tissue sample diluent (cat no. 2010C1119), sample cleaning solution (cat no. 2010X1118), sample washing solution (cat no. TBTDM-W), tissue homogenate flushing liquid (F2013TBD) |
| ChamQ SYBR qPCR Master Mix (High ROX Premixed) | Vazyme | Cat#Q341-02 | https://www.vazymebiotech.com/product-center/chamq-sybr-qpcr-master-mix-high-rox-premixed-q341.html. |
| Fixation/permeabilization Concentrate | invitrogen | Cat#00-5123-43 | |
| Fixation / Permeabilization Diluent | invitrogen | Cat#00-5223-56 | |
| Fixable Viability Dye EF506 | invitrogen | Cat#65-0866 | |
| HiScript II Q RT SuperMix for qPCR (+gDNA wiper) | Vazyme | Cat#R223-01 | https://www.vazymebiotech.com/product-center/hiscript-ii-q-rt-supermix-for-qpcr-gdna-wiper-r223.html. |
| Leukocyte Activation Cocktail | BD | Cat#550583 | |
| Mouse IL-17A (Interleukin 17A) ELISA Kit | Elabscience® | Cat#E-EL-M0047 | |
| Naïve CD4+ T cells isolation kit, mouse | STEMCELL | Cat#19765 | EasySep kit contains mouse CD4+ T cell isolation cocktail [cat no. 19852C.1], mouse memory T cell depletion cocktail [cat no. 18766C], streptavidin RapidSphered 50001 [cat no. 50001], normal rat serum [cat no. 13551]); only store rat serum at -20 °C; other components to be stored at 2-8 °C. |
| Permeabilization Buffer | invitrogen | Cat#00-8333-56 | |
| SPARKeasy Cell RNA Kit | Sparkjade | Cat#AC0205-B | https://www.sparkjade.com/product/detail?id=85 |
| Experimental models: Organisms/strains | |||
| Mouse: C57BL/6 | Gempharmatech | Cat#000013 | |
| Oligonucleotides | |||
| Mouse Il17a TaqMan primers with probe | ribobio | NA | |
| Mouse Il17f TaqMan primers with probe | ribobio | NA | |
| Mouse Il23r TaqMan primers with probe | ribobio | NA | |
| Mouse Rora TaqMan primers with probe | ribobio | NA | |
| β-actin TaqMan primers with probe | ribobio | NA | |
| Software and algorithms | |||
| Cytek Aurora | Cytek | https://spectrum.cytekbio.com/ | |
| FlowJo v10.8.1 | Tree Star | https://www.flowjo.com | |
| GraphPad prism 9 | GraphPad Software | https://www.graphpad-prism.cn | |
| Other | |||
| 1 mL syringe | Kindly | NA | |
| 1.5 mL Centrifuge tubes | Eppendorf | Cat#MCT-150-C | |
| 5 mL Round-bottom tubes | Corning | Cat#352235 | |
| 15 mL Centrifuge tubes | NEST | Cat#601052 | |
| 48-Well tissue culture plate (flatten bottom) | Corning | Cat#3548 | |
| 50 mL Centrifuge tubes | NEST | Cat#602052 | |
| 70 µm Cell strainer | Biosharp | Cat#BS-70-XBS | |
| 96-well Unskirted qPCR Plates | VIOX scientific | Cat#V4801-M | |
| 100 mm Petri dish | Corning | Cat#430167 | |
| Centrifuge | Eppendorf | 5425R | |
| Cell culture CO2 incubator | Thermo Fisher | HEPA Class100 | |
| Cytek Aurora | Cytek | NA | |
| dissecting scissors | RWD | S12003-09 | |
| Hemocytometer | AlphaCell | Cat#J633201 | |
| NanoDrop 2000 Spectrophotometer | Thermo Fisher | ND-2000 | |
| Real-time PCR System | Roche | LightCycler96 | |
| Surgical tweezers | RWD | F12005-10 | |
| Thermal cycler | Bio-Rad | C1000 Touch |
References
- Korn, T., Bettelli, E., Oukka, M., Kuchroo, V. K. IL-17 and Th17 cells. Annu Rev Immunol. 27, 485-517 (2009).
- Bhaumik, S., Basu, R. Cellular and molecular dynamics of Th17 differentiation and its developmental plasticity in the intestinal immune response. Front Immunol. 8, 254 (2017).
- Bettelli, E., Korn, T., Oukka, M., Kuchroo, V. K. Induction and effector functions of T(H)17 cells. Nature. 453 (7198), 1051-1057 (2008).
- Korn, T., et al. IL-21 initiates an alternative pathway to induce proinflammatory T(H)17 cells. Nature. 448 (7152), 484-487 (2007).
- Bettelli, E., et al. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells. Nature. 441 (7090), 235-238 (2006).
- Yang, X. O., et al. T helper 17 lineage differentiation is programmed by orphan nuclear receptors ROR alpha and ROR gamma. Immunity. 28 (1), 29-39 (2008).
- Ghoreschi, K., et al. Generation of pathogenic T(H)17 cells in the absence of TGF-β signalling. Nature. 467 (7318), 967-971 (2010).
- Lee, Y., et al. Induction and molecular signature of pathogenic TH17 cells. Nat Immunol. 13 (10), 991-999 (2012).
- McGeachy, M. J., et al. The interleukin 23 receptor is essential for the terminal differentiation of interleukin 17-producing effector T helper cells in vivo. Nat Immunol. 10 (3), 314-324 (2009).
- Wu, B., et al. The TGF-β superfamily cytokine Activin-A is induced during autoimmune neuroinflammation and drives pathogenic Th17 cell differentiation. Immunity. 54 (2), 308-323 (2021).
- Ramesh, R., et al. Pro-inflammatory human Th17 cells selectively express P-glycoprotein and are refractory to glucocorticoids. J Exp Med. 211 (1), 89-104 (2014).
- Basdeo, S. A., et al. Ex-Th17 (nonclassical Th1) cells are functionally distinct from classical Th1 and Th17 cells and are not constrained by regulatory T cells. J Immunol. 198 (6), 2249-2259 (2017).
- Cua, D. J., et al. Interleukin-23 rather than interleukin-12 is the critical cytokine for autoimmune inflammation of the brain. Nature. 421 (6924), 744-748 (2003).
- Awasthi, A., et al. Cutting edge: IL-23 receptor gfp reporter mice reveal distinct populations of IL-17-producing cells. J Immunol. 182 (10), 5904-5908 (2009).
- Jäger, A., Dardalhon, V., Sobel, R. A., Bettelli, E., Kuchroo, V. K. Th1, Th17, and Th9 effector cells induce experimental autoimmune encephalomyelitis with different pathological phenotypes. J Immunol. 183 (11), 7169-7177 (2009).
- Lee, Y., Collins, M., Kuchroo, V. K. Unexpected targets and triggers of autoimmunity. J Clin Immunol. 34, S56-S60 (2014).
- Chang, D., et al. The conserved non-coding aequences CNS6 and CNS9 control cytokine-induced Rorc transcription during T helper 17 cell differentiation. Immunity. 53 (3), 614-626 (2020).
- Bunte, K., Beikler, T. Th17 cells and the IL-23/IL-17 axis in the pathogenesis of periodontitis and immune-mediated inflammatory diseases. Int J Mol Sci. 20 (14), 3394 (2019).
- Zhao, Y., Liu, Z., Qin, L., Wang, T., Bai, O. Insights into the mechanisms of Th17 differentiation and the Yin-Yang of Th17 cells in human diseases. Mol Immunol. 134, 109-117 (2021).
- Berghmans, N., et al. Interferon-γ orchestrates the number and function of Th17 cells in experimental autoimmune encephalomyelitis. J Interferon Cytokine Res. 31 (7), 575-587 (2011).
- Wu, B., Wan, Y. Molecular control of pathogenic Th17 cells in autoimmune diseases. Int Immunopharmacol. 80, 106187 (2020).
- Du, L., et al. Growth hormone releasing hormone signaling promotes Th17 cell differentiation and autoimmune inflammation. Nat Commun. 14 (1), 3298 (2023).
- Ernst, D. N., Weigle, W. O., Noonan, D. J., McQuitty, D. N., Hobbs, M. V. The age-associated increase in IFN-gamma synthesis by mouse CD8+ T cells correlates with shifts in the frequencies of cell subsets defined by membrane CD44, CD45RB, 3G11, and MEL-14 expression. J Immunol. 151 (2), 575-587 (1993).
- Radtke, A. J., et al. IBEX: an iterative immunolabeling and chemical bleaching method for high-content imaging of diverse tissues. Nat Protoc. 17 (2), 378-401 (2022).
- El-Hindi, K., et al. T-cell-specific CerS4 depletion prolonged inflammation and enhanced tumor burden in the AOM/DSS-induced CAC model. Int J Mol Sci. 23 (3), 1866 (2022).
- Cooney, L. A., Towery, K., Endres, J., Fox, D. A. Sensitivity and resistance to regulation by IL-4 during Th17 maturation. J Immunol. 187 (9), 4440-4450 (2011).
- Zhu, X., et al. A novel interleukin-2-based fusion molecule, HCW9302, differentially promotes regulatory T cell expansion to treat atherosclerosis in mice. Front Immunol. 14, 1114802 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved