Лабораторное обслуживание нижнекрылой мухи Bradysia (Sciara) coprophila: новый/старый формирующийся модельный организм
In This Article
Summary
В этой статье описывается лабораторное обслуживание (включая спаривание и кормление) низшего двукрылого мухи Bradysia (Sciara) coprophila.
Abstract
Лабораторные запасы нижнекрылой мухи, Bradysia (Sciara) coprophila, поддерживаются на протяжении более ста лет. Здесь представлены протоколы лабораторного ведения B. coprophila . Эти протоколы будут полезны для быстро растущего числа лабораторий, изучающих B. coprophila , чтобы воспользоваться ее уникальными биологическими особенностями, которые включают в себя: (1) монополярное веретено при мужском мейозе I; (2) недизъюнкция Х-диады при мужском мейозе II; (3) импринтинг хромосом для различения материнских и отцовских гомологов; (4) хромосомы, ограниченные зародышевой линией (L); (5) элиминация хромосом (отцовские хромосомы при мужском мейозе I; одна-две Х-хромосомы у ранних эмбрионов; L-хромосомы из сомы у ранних эмбрионов); (6) определение пола матерью (отсутствует Y-хромосома); и (7) регулируемая в развитии амплификация ДНК в пухлых локусах ДНК в политенных хромосомах личиночных слюнных желез.
Теперь стало возможным исследовать эти многочисленные уникальные особенности механики хромосом, используя последние достижения в секвенировании и сборке генома B. coprophila и разработку методологии трансформации для геномной инженерии. Растущее научное сообщество, использующее B. coprophila для исследований, получит пользу от описанных здесь протоколов спаривания мух (фенотипические маркеры для матерей, у которых будут только сыновья или только дочери; детали массового спаривания для биохимических экспериментов), проверки вылупления эмбрионов, кормления личинок и других комментариев по его выращиванию.
Introduction
Полное понимание биологических принципов требует изучения многих разнообразных организмов, охватывающих Древо Жизни. Несмотря на то, что до конца19-го века был описан широкий спектр организмов, к середине20-го века экспериментальные исследования стали ограничены горсткой из менее чем дюжины модельных организмов. С наступлением эры генома и целью секвенирования геномов всех видов в Древе Жизни1 мы теперь в состоянии расширить типы организмов, используемых для лабораторных экспериментов, и извлечь выгоду из их разнообразия. Такое расширение новых модельных организмов для экспериментов имеет предпосылку для возможности поддерживать их в лаборатории. Здесь описываются протоколы для выращивания одного из таких появляющихся новых/старых модельных организмов.
Большая часть животной жизни на Земле приходится на четыре сверхизлучения насекомых2. Среди насекомых насчитывается около 158 000 видов двукрылых (настоящих мух)3, из которых около 3000 видов входят в семейство Sciaridae (черные грибные комары)4. Плодовая муха дрозофила является наиболее тщательно изученной из двукрылых мух. Низшая двукрылая муха (Nematocera), Bradysia (ранее называвшаяся Sciara) coprophila, 200 миллионов лет назад отделилась от дрозофилы, которая является «высшей двукрылой» мухой (Brachycera). Таким образом, B. coprophila находится в выгодном таксономическом положении для сравнительных исследований с D. melanogaster (рис. 1). Кроме того, B. coprophila обладает многими уникальными биологическими особенностями, которые сами по себе заслуживают изучения 5,6,7. Многие из этих особенностей нарушают правило постоянства ДНК, согласно которому все клетки организма имеют одинаковое содержание ДНК. У B. coprophila (i) отцовский геном элиминируется на монополярном веретене при мужском мейозе I; (ii) при мужском мейозе II наблюдается недизъюнкция диады X; (iii) хромосомы, ограниченные зародышевой линией (L), элиминируются из сомы; и (iv) одна или две Х-хромосомы элиминируются на ранних стадиях развития эмбриона в зависимости от пола особи. Импринтинг хромосом для различения материнских и отцовских гомологов был впервые обнаружен у B. coprophila и играет роль во многих из этих событий элиминации хромосом. В дополнение к элиминации хромосом, еще один обход постоянства ДНК происходит посредством регулируемой в развитии, локус-специфичной амплификации ДНК в локусах затяжки ДНК в политенных хромосомах личиночных слюнных желез. Изучение этих уникальных особенностей требует лабораторного сопровождения B.coprophila; Подробности его содержания представлены здесь для облегчения таких исследований.
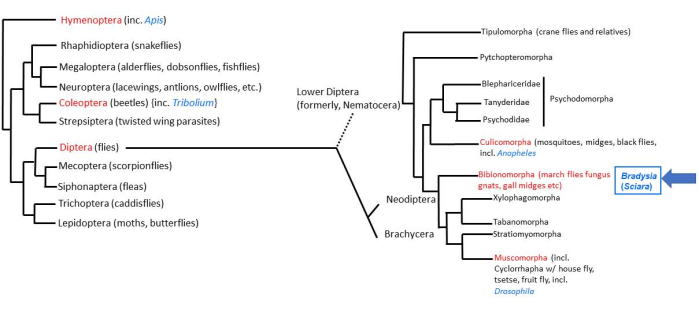
Рисунок 1: Филогения Bradysia (Sciara) coprophila. Популярные модельные организмы обозначены синим шрифтом, а их таксономический порядок — красным. Bradysia и другие комары Sciarid, а также комары относятся к низшим двукрылым (ранее подотряд Nematocera), тогда как виды дрозофил относятся к высшим двукрылым (подотряд: Brachysera). Информация в левой части рисунка взята из Misof et al.33; информация справа взята из Bertone et al.34 и Wiegmann et al.2. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Ранее род Sciara имел самое большое количество (700) видов среди всех эукариот, что побудило Стеффана разделить ихна 8. Впоследствии Шин предложил разделить семейство Sciaridae на подсемейство Sciarinae (с шестью родами, включающими Sciara, Trichosia и Leptosciarella), семейство Megalosphyinae (включая род Bradysia) и три другие группы (включая Pseudolycoriella)9. Филогения Sciaridae была дополнительно изучена несколькими группами в последние годы 9,10,11. За последние несколько десятилетий названия многих организмов семейства Sciaridae изменились12. Хотя большая часть литературы, охватывающей более ста лет, называет организм, который мы изучаем, Sciara coprophila, его нынешнее таксономическое название теперь Bradysia coprophila (син. Bradysia tilicola и другие синонимы)10. Они встречаются по всему миру и широко известны как грибные комары, поскольку едят грибы и другие грибы. Впервые они были описаны в 1804 году Мейгеном13 в Европе, а затем Иогансеном 14,15 в Северной Америке. B. coprophila была собрана в лаборатории Колд-Спринг-Харбор, а лабораторные запасы были созданы Чарльзом Метцем в начале 1900-х годов, когда он был аспирантом Колумбийского университета вместе с Томасом Хантом Морганом. Таким образом, нынешние поголовья отражают столетие инбридинга. Аналогичным образом, биология B. coprophila была дополнительно прояснена в результате десятилетий цитогенетических исследований Хелен Крауз (которая работала над докторской диссертацией вместе с Барбарой Мак-Клинток).
В 1930-х годах Bradysia (Sciara) конкурировала с Drosophila melanogaster в качестве модельной системы для генетических исследований. Несмотря на множество уникальных биологических особенностей, B. coprophila затмила D. melanogaster в качестве популярного модельного организма, поскольку радиационно-индуцированные фенотипические мутации были необходимы для генетических исследований и их было легче достичь в последнем, даже несмотря на то, что B. coprophila лишь немного более устойчива к гамма-облучению, чем D. melanogaster16. В современную эпоху геномики это уже не вызывает беспокойства. С тех пор как последовательность генома 17,18,19 (Урбан, Герби и Спрэдлинг, данные не показаны) и методы трансформации 20,21 (Ямамото и Герби, данные не показаны) для B. coprophila стали недавно, настало время использовать ее в качестве новой/старой модельной системы, как это видит растущее сообщество ученых, которые приняли ее в своих исследованиях. В данной статье описаны процедуры его лабораторного обслуживания.
У B. coprophila отсутствует Y-хромосома, а пол потомства определяется по матери. У самок с X' («Х-прайм») хромосомой с длинной парацентрической инверсией будут только дочери, тогда как у самок, гомозиготных по стандартной (неинвертированной) Х-хромосоме, будет только 5 сыновей(рис. 2). Информация о последовательностях доступна для19-й Х-хромосомы, но молекулярный механизм еще предстоит выяснить, как Х-хромосома определяет, что потомство будет самкой. Самцы никогда не имеют X'-хромосомы, а после оплодотворения самки становятся X'X (гетерозиготными по X') или XX. Взрослых самок X'X можно отличить от самок XX по фенотипическим маркерам на крыле (рис. 3). Самки X'X (у которых будут только дочери) могут быть распознаны по доминирующему маркеру волнистого (W) крыла на X' (как у популяции HoLo2)22. В качестве альтернативы, самки XX (у которых будут только сыновья) могут быть распознаны по рецессивному миниатюрному (p) маркеру крыла на X, как в 91S stock23. В этом случае самки X'Xp будут иметь полноразмерные (не миниатюрные) крылья и будут иметь только дочерей. Сток 6980 несет рецессивный маркер на Х-хромосоме для опухших (sw) вен24, а также доминантный маркер Wavy на X', позволяющий использовать два маркера для отбора для скрещивания. Степень экспрессии волнистого может варьироваться и кажется слабее в переполненных флаконах, где количество пищи ограничено или если температура становится слишком высокой. Фенотип волнистого крыла особенно силен, если личинки содержатся в холодном помещении (4°-8 °C) вместо обычных 21 °C. Несмотря на то, что рецессивный маркер малого крыла не является изменчивым и его очень легко идентифицировать, стаи 91S используются реже, поскольку они менее здоровы, чем стадо HoLo2. Схемы спаривания B. coprophila представлены здесь (Рисунок 2) и подробно описаны для популяций HoLo2, 7298 и W14 (Дополнительный файл 1), 91S (Дополнительная папка 1), 6980 (Дополнительная папка 1) и транслокационных популяций (Дополнительный файл 1). Запасы транслокаций больше не сохранились; они представляли собой реципрокные транслокации гетерохромомеров (H1, H2 и H3) на коротком плече X-хромомера, содержащем гены рибосомной РНК 25,26,27.
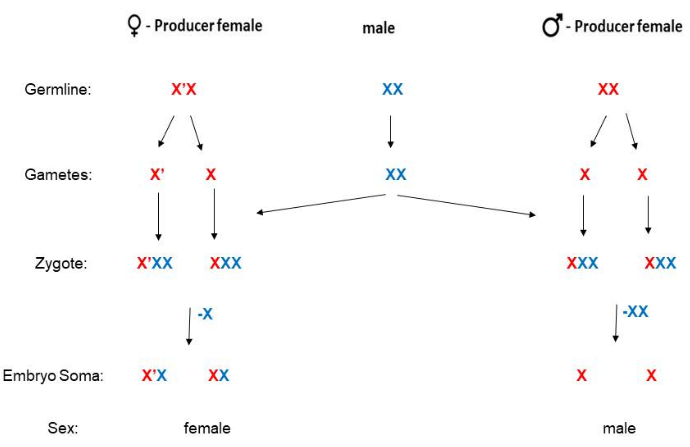
Рисунок 2: Схема спаривания B. coprophila. У этого организма нет Y-хромосомы (у самца сомы есть одна X); Матери определяют пол своего потомства. У матерей XX только сыновья, а у женщин X'X только дочери. Х-хромосома имеет длинную парацентрическую инверсию по сравнению с Х-хромосомой. Отцовская или материнская линия Х-хромосомы (или Х') на этом рисунке обозначена синим или красным цветом соответственно. Сперматозоиды гаплоидны для аутосом, но имеют две копии Х-хромосомы из-за нерасхождения при мейозе II. Соматическая линия ранних эмбрионов исключает одну или две копии Х-хромосом, полученных по отцовской линии, если они будут женского или мужского пола соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Фенотипы крыльев B. coprophila. Взрослые самки мух показаны с различными фенотипами крыльев: (А) прямокрылые (XX), (В) волнистые (X'WX), (В) экстремальные волнистые крылья (X'WX) фенотипы, которые имеют сморщенный вид после накопления личинок в холодном room, (D) миниатюрные крылы (XpXp), которые являются рудиментарными, (E) прямое крыло с диким типом (XX) и не вздутыми жилками, (F) прямое крыло с вздутыми прожилками (XswXsw), где маленькие пузырьки (черные стрелки) появляются на верхнем крае крыла и/или возле кончика обоих крыльев, (G) крайний пример вздутия, когда волдырь (белая стрелка) встречается на одном или обоих крыльях. У самцов отсутствует X-хромосома, и поэтому у них никогда не будет волнистых крыльев, но у них есть миниатюрные или опухшие крылья у 91S или 6980 соответственно. Масштабная линейка = 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Цель содержания поголовья состоит в том, чтобы проводить скрещивания, в которых половина скрещиваний происходит от матерей-самок, а половина скрещивания от матерей-производителей-самцов, чтобы иметь равное количество взрослых самок и самцов в следующем поколении для последующих скрещиваний. Однако это также включает в себя планирование, поскольку жизненный цикл у самцов короче, чем у самок, а взрослые самцы появляются на неделю раньше взрослых самок. Природа приспосабливается к этой асинхронности между полами, заставляя мужские эмбрионы появляться в виде личинок через 1-2 дня после женских личинок от скрещивания в ту же дату. Тем не менее, чтобы гарантировать, что взрослые особи самцов и самки доступны одновременно для лабораторных скрещиваний, развитие самок может быть несколько ускорено, если оставлять флаконы с личинками самок при комнатной температуре, а не при 21 °C, или размещать флаконы с личинками самцов при несколько более низких температурах (например, 16 °C). Другой способ, который является более надежным, - это скрещивание с матерями-женщинами-производителями в понедельник и скрещивание с матерями-мужчинами-производителями в пятницу на той же неделе. Самый простой путь, который мы используем, заключается в том, чтобы проводить скрещивание с самками-производителями и самцами-производителями в один и тот же день каждую неделю и выполнять скрещивание в этот день в течение каждой последующей недели. При таком подходе взрослые самки от скрещивания на 1-й неделе могут быть спарены со взрослыми самцами, которые появились от скрещивания на 2-й неделе.
Жизненный цикл самки B. coprophila составляет 5 недель при выращивании при 21 °C (Таблица 1). Продолжительность их жизненного цикла несколько увеличивается при более низких температурах или при недостаточном кормлении. Жизненный цикл самцов B. coprophila составляет ~4-4,5 недели, так как они окукливаются на 0,5-1 неделю раньше самок. Окончание каждой личиночной стадии отмечается сбрасыванием кутикулы, которое провоцируется всплеском уровня стероидного гормона экдизона. В отличие от D. melanogaster, у которого три личиночных возраста, у B. coprophila четыре личиночных возраста.
| Стадия развития | Количество дней после вязки (dpm) | Продолжительность этапа (дней) |
| Снесенное яйцо | 1-2 | |
| Эмбрион | С 1-2 по 7-8 | ~7 дней |
| Личинка | ||
| Возрасты личинок 1, 2 и 3 | с 7-8 по 16-19 | ~10 |
| Предглазное пятно 4-го личиночного возраста | с 16-19 по 21-24 | 5 |
| 4-я стадия пятен глазного пятна личиночного возраста | с 21-24 по 25-28 | 4 |
| Куколка | с 25-28 по 30-33 | 5 |
| Взрослый | живет 1-2 дня при 21 °C при спаривании или 2-3 недели при 16 °C при отсутствии спаривания. | |
Таблица 1: Жизненный цикл самок B. coprophila при 21 °C.
B. coprophila может содержаться в любом месте в диапазоне от 15 °C до 25 °C, при этом развитие протекает медленнее при более низких температурах. Это насекомое предпочитает влажную среду (находящееся в почве комнатных растений или грибных грядок), поэтому мы держим в инкубаторе стакан с деионизированной водой. B. coprophila можно хранить при комнатной температуре в металлической хлебнице со слабо прилегающей крышкой, содержащей стакан с водой, но они подвергаются тепловому шоку при 37 °C28, что представляет опасность в жарком климате. Майкл Эшбернер и другие безуспешно пытались хранить D. melanogaster в холоде, чтобы сократить время, необходимое для хранения запасов. В отличие от этого, основным преимуществом B. coprophila является то, что флаконы с личинками средней стадии могут храниться до 3 месяцев на открытой полке в холодном помещении (4-8 °C) с минимальным уходом, кормлением только один раз в месяц. Они развиваются чрезвычайно медленно на холоде вплоть до стадии куколки и становятся фертильными взрослыми особями, когда флаконы возвращаются к температуре 21 °C. Предположительно, это имитирует их зимовку в дикой природе. Эта задержка развития, вызванная холодом, может быть сравнима с той, которая наблюдается после гамма-облучения личинок B. coprophila 16 на средней стадии, но задержка развития не наблюдается у личинок поздних стадий, которые прошли точку невозврата для их нормального прогресса в развитии.
Protocol
Описанные здесь протоколы представляют собой столетний опыт работы в животноводческих центрах Bradysia (Sciara), которыми последовательно руководили Чарльз Метц, Хелен Крауз и Сьюзан Герби, а также вклад других специалистов.
1. Спаривание скрещиваний
- Используйте одну взрослую самку и двух взрослых самцов на стеклянный флакон диаметром 28 мм. Как только будет достигнут 100% успех в распознавании фенотипов крыльев у матерей, у которых будут только дочери или сыновья, используйте двух самок и двух самцов на флакон, чтобы увеличить количество личинок на флакон. Добавьте самок в каждый флакон перед добавлением самцов, которые быстрее просыпаются от анестезии, чем самки.
ПРИМЕЧАНИЕ: Приведенное ниже описание предполагает, что у вас есть CO2; В качестве альтернативы, эфир может быть использован для обезболивания взрослых мух. - Если вы используете эфир для обезболивания взрослых мух, прикрепите скотчем к круглой стеклянной крышке банки Coplin пластырь из сложенных лабораторных салфеток (например, кимвайпов) и с помощью пипетки передайте немного эфира из флакона, чтобы увлажнить салфетку для лабораторных салфеток (но не насыщенных и настолько влажных, что эфирная жидкость упадет с нее и рискует утопить мух). Для шага 1.6 ниже поместите увлажненную эфирную подушечку на верхнюю часть открытого флакона на ~1 минуту, пока взрослые особи не перестанут двигаться. После того, как взрослые особи были переложены на белую керамическую плитку (используемую вместо белой подкладки для мух), периодически (когда ноги мух начинают дергаться) держите только что смоченную эфиром подушечку над мухами (не касаясь) в течение ~1 минуты.
ВНИМАНИЕ: Эфир легко воспламеняется и его следует хранить в вытяжке, а не в холодильнике. - Разложите на расстоянии вытянутой руки лоток с флаконами взрослых самок, лоток со взрослыми самцами и лоток с пустыми флаконами, содержащими 2,2% (масс./об.) агара. На лабораторном столе разместите таблички с надписью «самка» или «самец» и фенотип крыла матери так, чтобы флакон со взрослыми особями, выбранными для скрещивания, был помещен в правильную группу, где все флаконы в одной группе будут иметь только мужское потомство, а все флаконы в другой группе будут иметь только женское потомство.
ПРИМЕЧАНИЕ: Убедитесь, что во флаконе нет капель конденсации, так как взрослые особи прилипнут к каплям. Если флаконы хранились в пластиковой коробке, перед использованием поместите флаконы на лабораторный стол при комнатной температуре не менее чем на 1 ч, чтобы конденсат испарился. - Включите газ CO2 и лампу для препарирующего микроскопа.
ПРИМЕЧАНИЕ: Предпочтительным является источник света с волоконной оптикой, так как он выделяет меньше тепла, что заставляет мух под наркозом быстрее просыпаться. - Энергично постучите по флакону со взрослыми по резиновой прокладке, чтобы взрослые особи упали на дно флакона, и снимите пробку; Вставьте сопло пистолета CO2 и вставьте обратно пробку.
- Нажмите на спусковой крючок сопла так, чтобы CO2 поступал во флакон в течение ~1 минуты, чтобы обезболить взрослых.
- Поставьте ногу на ножную педаль так, чтобы CO2 стекал на белую накладку, а не на сопло пистолета. Держите ножную педаль нажатой все время, пока мухи находятся на белой подкладке (или периодически нажимайте на ножную педаль, когда ноги мух начинают дергаться).
- Выньте насадку и пробку из флакона и переверните флакон над белой мухой под препарирующим микроскопом.
- Постучите по дну перевернутого флакона по микроскопу так, чтобы взрослые особи упали из флакона на белую подушечку для мух.
- Выберите самых толстых взрослых (недавно закрытых белым брюшком) и с помощью щипцов с тонкими наконечниками осторожно возьмите взрослого за среднюю или заднюю ногу. Не травмируйте передние ноги, которые используются для брачного танца. Не используйте взрослых особей, которые только что закрылись и чьи тела полностью белые и еще не почернели, потому что их крылья будут короткими и не полностью развитыми, так что фенотип крыльев не может быть оценен. Взрослые особи с более стройным животом все еще могут использоваться, хотя у них снижена фертильность. Не используйте тощих взрослых особей, чьи крылья подняты вертикально в сторону от тела, так как они мертвы.
- Другой рукой выньте пробку из флакона с агаром 2,2% (масс./об.). Держа щипцы рукой вместе со взрослым, энергично постучите щипцами по верхней внутренней стенке флакона так, чтобы взрослый упал на дно флакона. Установите на место пробку во флаконе.
- Повторите шаги 1.5-1.11 выше, чтобы настроить каждый флакон, содержащий взрослых женщин. С помощью кисти смахните неиспользованных мух с белой подушечки от мух обратно в их родительский флакон. Поставьте галочку на этикетке родительского флакона, указывающую, что он был использован для спаривания (хотя при необходимости его можно использовать снова).
- Для планового поддержания запасов установите 6-8 флаконов с матерями-производителями и 6-8 флаконов с матерями-производителями-самцами (Рисунок 4). Установите половину флаконов с матерями (или отцами) из одного флакона для взрослых, а другую половину новых флаконов используйте для другого флакона для взрослых, чтобы свести к минимуму генетические узкие места.
- Иногда в результате неправильной сегрегации в флаконах, производящих самок, появляется исключительный самец. Если во флаконе со взрослыми самками есть исключительный самец, удалите и раздавите, чтобы убить этого самца. Если возможно, выбросьте всех самок из этого флакона и подождите несколько дней, пока более взрослые самки не приблизятся и их можно будет безопасно использовать для скрещивания.
ПРИМЕЧАНИЕ: Предпочтительно не использовать самок в этом флаконе для скрещивания, потому что они могут спариваться с исключительным самцом и не дать фертильного скрещивания.
- Иногда в результате неправильной сегрегации в флаконах, производящих самок, появляется исключительный самец. Если во флаконе со взрослыми самками есть исключительный самец, удалите и раздавите, чтобы убить этого самца. Если возможно, выбросьте всех самок из этого флакона и подождите несколько дней, пока более взрослые самки не приблизятся и их можно будет безопасно использовать для скрещивания.
- После того как взрослые самки будут добавлены во все флаконы, повторите шаги 1.5-1.11, чтобы добавить двух взрослых самцов (рис. 4) в каждый флакон, уже содержащий самок мух. Постучите флаконом с самками по резиновой прокладке, чтобы они не сбежали при последовательном добавлении двух самцов.
ПРИМЕЧАНИЕ: Работайте быстро и не обезболивайте взрослых мух, так как это убьет их. - Добавьте этикетку к каждому флакону с указанием запаса, креста (для потомства самки или самца), произошла ли мать от взрослого флакона #1 или #2, а также даты спаривания. Также занесите приведенную выше информацию в блокнот и укажите количество флаконов, установленных для каждого крестика.
ПРИМЕЧАНИЕ: Удобно добавить бумажное полотенце, чтобы отделить флаконы, производящие самку, от пробирок женского в лотке. - Оставьте флаконы нетронутыми на столешнице на ~15 минут, чтобы убедиться, что взрослые проснутся и полетят вокруг. Понаблюдайте, спариваются ли они (вскоре после пробуждения), когда самка и самец ориентированы сзади на заднюю (самец класпера будет хватать самку за заостренный яйцеклад) (Рисунок 4, внизу).
ПРИМЕЧАНИЕ: Взрослая самка принимает взрослого самца только один раз, поэтому не толкайте флаконы после спаривания, так как это может отделить самца от самки в процессе спаривания, и эта самка не будет повторно спариваться. - Поместите лоток со спаренными флаконами в инкубатор (например, при температуре 21 °C). Пометьте лоток с указанием названия заготовки (например, HoLo2) и недели 5-недельного цикла (недели 1, 2, 3, 4 или 5).
ПРИМЕЧАНИЕ: Храните лоток с только что спаренными мухами в отдельной части инкубатора или другого инкубатора в качестве напоминания о том, что нельзя кормить флаконы до тех пор, пока не появятся личинки (описано ниже).
2. Массовое спаривание
Примечание: Как правило, одна мать B. coprophila имеет в своем выводке 60 потомков. Когда для экспериментов требуется большее количество потомства, можно провести массовое спаривание вместо описанного выше спаривания одной пары. Массовое спаривание может быть проведено в стандартных стеклянных флаконах диаметром 28 см, когда матери будут собраны через день для индуцированной яйцекладки и сбора эмбрионов. Однако, если необходимо большее количество личинок, массовое спаривание производится в банке с большей поверхностью, чтобы не допустить скученности. Проделайте несколько небольших отверстий в крышке банки, чтобы личинки могли получить немного воздуха для дыхания.
- Следуйте шагам, описанным выше в разделе 1, но с помощью щипцов с тонкими наконечниками переместите всех матерей-женщин (или всех матерей-мужчин-производителей) в передний угол белой подушечки для мух. Используйте 10-15 обезболенных толстых взрослых самок и сметайте эту группу кистью в пузырек или банку с небольшими отверстиями, пробитыми в крышке.
ПРИМЕЧАНИЕ: Выполните шаги 2.1 и 2.2. быстро для массового спаривания во избежание чрезмерной анестезии, которая препятствовала бы фертильным скрещиваниям. - Выберите 20-25 толстых взрослых самцов под наркозом и переместите их с помощью щипцов с тонкими наконечниками к переднему углу белой подушечки.
- Энергично постучите по флакону или банке с самками по резиновой прокладке, чтобы они не сбежали при снятии пробки или крышки, чтобы смести обезболенное скопление взрослых самцов с белой подушечки с помощью кисти.
3. Сбор эмбрионов после массового спаривания
- Через сутки (24 ч) после спаривания выполнить шаги 1.5-1.11 для обезболивания взрослых мух (смесь самок и самцов) и переложить их на белую площадку для мух.
ПРИМЕЧАНИЕ: Оогенез еще не завершен, когда взрослая муха спаривается, что запускает завершающий мейоз; Зрелые яйцеклетки оплодотворяются сперматозоидами, хранящимися в сперматеке при высвобождении яйцеклеток 29. Завершение оогенеза может занять 1-2 дня, именно поэтому после спаривания допускается 1 день, прежде чем начнется откладка яиц. - С помощью щипцов с тонкими наконечниками возьмите взрослую самку за крылья и поместите ее на чашку Петри диаметром 100 мм, содержащую 2,2% (масс./об.) агара, вставив крылья в агар. Повторите этот шаг последовательно для каждой взрослой самки на белой подушечке. Выбросьте взрослых самцов на площадку для мух.
- Как только все самки мух будут насажены на агар, стимулируйте откладывание яиц, осторожно сжимая голову щипцами до тех пор, пока у самки мухи не появятся судорожные движения. Как вариант, аккуратно сожмите ее грудную клетку. Затем она отложит гроздь оплодотворенных яиц в течение 30-60 минут. Накройте чашку Петри крышкой, которая смочена смоченной в воде лабораторной салфеткой, чтобы предотвратить электростатическое притяжение яиц к крышке.
4. Проверка «вывода» личинок
- Проверка на «вылупление» личинок через 1 неделю после спаривания; Выньте пробку из флакона и с помощью препарирующего микроскопа забейте личинок. Их черная челюсть будет неоднократно открываться и закрываться, и они будут медленно продвигаться вперед. Если личинок всего несколько, напишите «несколько» на этикетке флакона, чтобы напомнить о том, что нужно кормить флакон меньше. Осмотрите каждый флакон в лотке с этим крестиком и запишите количество флаконов с личинками в блокнот в столбец рядом с количеством флаконов, которые были установлены при этом спаривании.
ПРИМЕЧАНИЕ: Темно-желтые яйца не развиваются. Белые яйца могут развиваться, и за 1 день до появления личинок черный пигмент (будущая челюсть) разовьется на переднем конце яйца. Не стоит путать плесень с белой нитью, заканчивающейся на ее конце черной сферой – плесень не сдвинется с места, в отличие от личинок, которые ползут вперед по агару. - Добавьте небольшой кусочек соломы (всего один раз) в каждый флакон с личинками, чтобы контролировать избыточную влажность и обеспечить укрытие для личинок.
- Переместите лоток в инкубатор (например, при температуре 21 °C) с лотками с личинками от спаривающихся крестов предыдущих недель и начните кормить флаконы вновь появившимися личинками (см. раздел о кормлении ниже).
ПРИМЕЧАНИЕ: Как правило, личинки собираются в кучу рядом со своей мертвой матерью и начинают ее поедать; Предположительно, это переносит дрожжи из кишечника матери в кишечник личинок. Вы можете начать кормление в день появления личинок или в течение 2 дней после этого. ВНИМАНИЕ: Если кормление откладывается, личинки будут поедать друг друга, при этом в одном флаконе останется только одна жирная личинка! - Продолжайте проверять флаконы, в которых еще не было личинок, 3 дня в неделю. Если через 7-10 дней личинки не появились, выбросьте флакон или сохраните его для промывки флакона.
5. Приготовление еды
ПРИМЕЧАНИЕ: Все пищевые ингредиенты не должны содержать пестицидов!
- Используйте столовую ложку, чтобы отмерить следующие ингредиенты по объему и положите их в металлическую или стеклянную сковороду (например, металлическую форму для выпечки размером 8 x 8 дюймов): 4 части овсяной соломы (8 столовых ложек), 2 части порошка грибов шиитаке (4 столовые ложки), 1 часть порошка шпината (2 столовые ложки), 1 часть порошка крапивы (2 столовые ложки). Используйте столовую ложку, чтобы хорошо перемешать ингредиенты на сковороде.
ПРИМЕЧАНИЕ: В качестве альтернативы, можно использовать 2 части только порошка шпината или только порошка крапивы вместо 1 части каждого. - Накройте сковороду алюминиевой фольгой и запустите в режиме сушки на 20-30 минут. Дайте остыть до комнатной температуры на ночь или дольше.
- Снимите фольгу со сковороды и разбейте запекшуюся стерилизованную пищевую смесь, используя растирающие движения столовой ложкой, чтобы получить порошкообразную смесь.
- Добавьте 1 часть (2 ст. л. с горкой) пивных дрожжей и хорошо перемешайте с автоклавной пищевой смесью.
ПРИМЕЧАНИЕ: Пивные дрожжи не автоклавируются, так как это убьет дрожжи. - Переложите пищевую смесь в стерильную банку с крышкой.
ПРИМЕЧАНИЕ: Можно использовать тот же тип банки объемом 240 мл, который используется для массового спаривания, и приведенный выше рецепт заполнит банку. Точно так же такая же стерилизованная банка с крышкой должна быть заполнена только соломой, которая была автоклавирована в сковороде, покрытой фольгой.
6. Кормление
ПРИМЕЧАНИЕ: Регулируйте количество даваемого корма в соответствии с возрастом и количеством личинок. Давайте много корма в банки с большим количеством личинок от массового спаривания. Слегка посыпьте кормом тарелки Петри с личинками, которые хранятся в течение нескольких дней для стадии развития. Описанный ниже метод кормления был разработан в лаборатории Чарльза Меца 29 лет и успешно используется его лабораторией, а также Хелен Крауз, Сьюзан Герби и другими на протяжении столетия.
- Вымойте руки и хорошо ополосните, чтобы удалить мыло.
ПРИМЕЧАНИЕ: Перчатки не рекомендуются, так как они уменьшают чувствительность пальцев для регулирования количества пищи, подаваемой в каждый флакон. - Храните закрытую стерильную банку с молотой соломой и стерильную банку с кормом в инкубаторе (например, при температуре 21 °C), где содержатся личинки. Снимите крышку с банки и насыпьте немного продуктов в чистую миску (например, форму для конфет) для более удобного доступа; Закройте крышкой банку с оставшимся продуктом. Храните открытую миску с едой в металлическом или стеклянном небольшом подносе; Это будет препятствовать клещам или другим насекомым переползать через стенку лотка, чтобы попасть в миску с едой.
- Возьмите немного пищи между вторым и третьим пальцами (или между большим и вторым пальцами). Другой рукой достаньте флакон из лотка и выньте пробку, придерживая ее пальцами во время кормления. Осмотрите флакон на предмет возраста и количества личинок и положите в него соответствующее количество пищи, вращая двумя пальцами, удерживающими пищу друг против друга. Флаконы с вновь появившимися личинками достаточно всего лишь нескольких крупинок корма. Флаконы с более старыми личинками должны иметь тонкий слой корма, покрывающий верхнюю часть агара.
- Если во флаконе есть белая плесень, используйте 70% этанол, распыленный на лабораторную салфетку, чтобы протереть длинный металлический зонд (например, с деревянной ручкой), выньте пробку и вставьте чистый зонд во флакон, чтобы постучать по плесени по поверхности агара. Если плесени много, покрутите щуп, чтобы обернуть форму вокруг щупа, чтобы извлечь ее из флакона. Не тревожьте верхнюю часть агара, так как там живут личинки; Добавьте совсем небольшое количество пищи и установите на место пробку во флаконе. Протрите зонд лабораторной салфеткой, смоченной в 70% этаноле, прежде чем хранить зонд или использовать его для очистки другого флакона.
- После того, как все флаконы в лотке будут заполнены, установите лоток в инкубаторе на место и снимите следующий лоток для кормления, как описано в шаге 6.3.
- После того, как кормление будет завершено, пересыпьте оставшийся корм из миски в предварительно простерилизованную банку, закройте банку крышкой, и уберите на хранение в инкубатор.
7. Сбор личинок или куколок на пластинах Петри
- Для небольшого количества личинок используйте металлический зонд или шпатель, протертый 70% этанолом, чтобы вкопаться в верхний слой агара в пробирке, чтобы перенести прилипший агар с некоторыми личинками в стерильную чашку Петри диаметром 100 мм, наполовину заполненную 2,2% (масс./об.) агара.
- Для большего количества личинок вставьте шпатель вдоль стенки на дно флакона, чтобы облегчить агаровую пробку из флакона, и положите ее лицевой стороной вверх в пустую чашку Петри. С помощью препарирующего микроскопа найдите личинки в верхней части агаровой пробки и перенесите их с помощью щипцов с тонким наконечником в стерильную чашку Петри диаметром 100 мм, наполовину заполненную 2,2% (масс./об.) агара.
- С помощью препарирующего микроскопа отсортируйте личинки с помощью щипцов с тонкими наконечниками по группам одной стадии развития.
ПРИМЕЧАНИЕ: Из-за небольшой асинхронности развития на пластине Петри будет несколько различных кластеров сортированных личинок с 2,2% (масс./об.) агара. - Добавьте крошечную посыпку корма и поместите в инкубатор чашку Петри с личинками. Ежедневно снимайте его для наблюдения с помощью препарирующего микроскопа для выбора желаемой стадии развития.
ПРИМЕЧАНИЕ: Для исследований ДНК ранние личинки глазных пятен проходят через стадии 10x5, 12x6, 14x7 и краевые стадии глаза/отвисшей челюсти с ~1 днем на каждой из этих стадий 30,31. Выбирайте куколок, чьи глаза на 1/4-1/2 заполнены пигментом, чтобы иметь I и II стадии мейоза в яичках куколки.
8. Хранение личинок в холодильной камере
- В качестве резерва держите в холодном помещении около четырех флаконов личинок самок и четырех флаконов личинок самцов от 2 недель подряд скрещиваний.
- Для резервного хранения накормить личинок, которые находятся в начале4-го возраста (до стадии глазного пятна) и поместить их в открытый лоток на полке в холодильной камере; Кормите этими флаконами всего один раз в месяц.
- Уберите из холода 16 флаконов из 2 недель подряд спаривания кроссов через 2-3 месяца (отметьте это в календаре в качестве напоминания); поместите их в инкубатор (например, при температуре 21 °C), чтобы кормить их нормально и дать им вырасти во взрослых особей, чтобы использовать их для скрещивания.
- Когда флаконы будут извлечены из холодильной камеры, положите в холодную камеру свежий набор флаконов с личинками раннего4-го возраста, чтобы эти флаконы всегда были под рукой в качестве резерва для запасов.
Примечание: Жизнеспособность после хранения в холодильной камере не проверялась систематически для различных стадий развития, но наш опыт показывает, что хранение в холодильнике личинок раннего4-го возраста работает хорошо.
9. Промывка флаконов
- После того, как взрослые особи умрут (~2-3 недели после эклозации), извлеките флаконы из инкубатора и поместите их при температуре 60-70 °C на 1 час, чтобы убить все оставшиеся организмы.
- Выньте ватные пробки и храните их в пластиковой коробке.
- С помощью шпателя соскребите агаровую пробку из флакона в мусорное ведро.
- Замочите флаконы на ночь или дольше, погрузите в воду в кастрюлю.
- Используйте щетку для пробирки, сохраненную специально для этой цели (никогда не используйте для сосудов с химикатами или мылом), и протрите флакон вверх и вниз под проточной водой из-под крана. Поместите очищенный флакон открытой стороной вниз в металлическую корзину. Наполните корзину очищенными флаконами.
ПРИМЕЧАНИЕ: Никогда не используйте мыло во флаконах, так как любое остаточное мыло может убить B. coprophila. - Добавьте в корзину крышку из проволочной сетки и, удерживая крышку на месте, переверните корзину, чтобы наполнить все флаконы деионизированной водой. Все еще удерживая крышку на месте, переверните корзину, чтобы слить деионизированную воду из флаконов. Повторите полоскания деионизированной водой 4 раза.
- Поместите корзины с очищенными флаконами на бумажные полотенца или открытую сетчатую платформу (например, лабораторную тележку) для сушки на ночь или дольше. Храните сухие флаконы в ящике.
ПРИМЕЧАНИЕ: Не оставляйте флаконы с мертвыми взрослыми особями слишком долго перед их мытьем, так как это может привести к заражению клещами.
10. Заливка агаром
- Наполните большую емкость (металлическую корзину или металлический лоток) чистыми флаконами и добавьте к каждому флакону ватную пробку. Повторно используйте пробки, взятые из старых флаконов во время промывки флаконов, и используйте пробки до тех пор, пока они не испортятся и не развалятся, и их следует выбросить. Простерилизуйте контейнер с закрытыми флаконами в сухом цикле в течение ~30 минут и дайте им остыть до комнатной температуры, чтобы хранить их в автоклавном контейнере. Всегда держите под рукой два контейнера (один активно используется, а другой запасной) с автоклавными купорочными флаконами.
- Поместите 11,0 г порошка агара в колбу Эрленмейера объемом 1 л и добавьте 500 мл дистиллированной воды, чтобы получить 2,2% (масс./об.) раствор агара, достаточный для заливки ~24 флаконов (~21 мл/флакон). Переверните колбу и поставьте ее в микроволновую печь.
ПРИМЕЧАНИЕ: С этого момента для работы с колбой используйте термостойкую автоклавную перчатку. Тот же 2,2% (масс./об.) раствор агара можно заливать в тарелки Петри (для собранных личинок) или банки (для массовых спариваний), если они необходимы. - Разогрейте в микроволновой печи 1 минуту, снимите колбу, чтобы закрутить ее, поставьте в микроволновую печь и снова поставьте в микроволновую печь на 1 минуту. Повторите это несколько раз.
- Следите за колбой через стеклянную дверцу микроволновой печи. Когда агаровый раствор начнет пениться и закипать, сразу же воспользуйтесь кнопкой ручной остановки. Не переворачивайте колбу на этом этапе (она может выкипеть), осторожно выньте ее из духовки на прилавок и дайте ей отдохнуть несколько минут.
- Выньте пробку из стерилизованного флакона и держите ее одной рукой; Другой рукой налейте в стерилизованный флакон 2,2% агара высотой ~2,5 см. Затем установите вилку на место во флаконе. Повторяйте это до тех пор, пока весь агар не будет залит.
ПРИМЕЧАНИЕ: Если во флакон налить слишком мало агара, он быстрее высохнет во время использования и даст усадку от стенок флакона. Если во флакон налито слишком много агара, то при надрезе «малыша-вывода» личинок с помощью препарирующего микроскопа трудно сфокусироваться на верхнем слое. - Дайте налитым флаконам постоять на прилавке при комнатной температуре 1-2 дня, чтобы агар застыл и влага полностью испарилась. Используйте флаконы для спаривания кроссов или храните их лежа на боку в пластиковом ящике с плотно закрывающейся крышкой; Сверху флаконов положите смоченное в воде бумажное полотенце, прежде чем закрывать коробку крышкой (это предотвратит высыхание агара и его усадку от стенки флакона). Храните коробку с налитыми флаконами при комнатной температуре в течение нескольких дней или в холодильнике или холодном помещении при температуре 4 °C до 2 недель. Перед использованием хранящихся флаконов выньте их из коробки и оставьте на прилавке при комнатной температуре на час или два, чтобы конденсат испарился изнутри флаконов (взрослые мухи прилипнут к конденсату и утонут).
11. Изготовление заглушек для флаконов
- Поместите чистый флакон в держатель для пробирок из пенополистирола объемом 50 мл (с усилием вставьте пробирку, чтобы она стояла прямо). Вырежьте квадрат из марли (толщиной в 2-4 слоя) и положите его поверх флакона.
- Сверху на марлю положите обрезки марли от ранее сделанных пробок, чтобы получился более толстый слой. Положите вату на марлю и вдавите в флакон, плотно заполнив верхний дюйм флакона.
- Сведите верхнюю часть концов марли вместе и перевяжите ее шпагатом. Отрежьте лишнюю веревку и лишнюю марлю (оставьте достаточно хвостиков веревки, чтобы она оставалась завязанной, и достаточно марли, чтобы удобно держать пробку).
ПРИМЕЧАНИЕ: Установите вилки так, чтобы они плотно прилегали. Вы должны иметь возможность вытягивать их указательным и указательным пальцами, держа их в одной руке. Если вы возьмете флакон за пробку и он выпадет, он слишком ослаблен. Если при вытягивании он издает громкий хлопающий звук, возможно, он слишком тугой. Если пробка слишком плотная или если на пробке есть слой твердого сухого агара, мухи могут задохнуться. Если пробка слишком ослаблена или соскальзывает по стенкам флакона, ее можно постучать по столешнице, чтобы раздавить ее до немного большего размера.
12. Типовой недельный график (для наибольшей эффективности выполняйте задачи в указанном порядке)
- Понедельник (~30 мин)
- Кормите флаконы личинками.
- Разлить агар в стерильные чистые флаконы с пробками.
- Среда (~2 ч)
- Поместите флаконы с мертвыми взрослыми особями в духовку на 1 час и храните для мытья.
- Проверяем наличие личинок "бэби-люк".
- Кормите флаконы личинками.
- Выполняйте еженедельные брачные скрещивания.
- Другие обязанности по мере необходимости: автоклавирование чистых флаконов с пробками, чтобы иметь резервный запас по мере необходимости; готовьте новый корм и автоклавную солому по мере необходимости; Автоклавные банки по мере необходимости для еды и соломы.
- Пятница (~30 мин)
- Проверяем наличие личинок "бэби-люк".
- Кормите флаконы личинками.
Representative Results
Описанные здесь протоколы привели к доказанному успеху в выращивании B. coprophila. Когда для спаривания выбирают недавно закрытых жирных взрослых особей (Рисунок 4), более 90% скрещиваний могут быть фертильными и давать потомство. Успех фертильности варьируется в зависимости от популяции (Таблица 2). Акция 7298 (X'-хромосома с волнистым маркером) была самой здоровой из акций, но пережила период снижения, по-видимому, из-за активации мобильных элементов ДНК, создающих перестройки генома32. Запас HoLo2 представляет собой здоровый штамм, полученный от 7298, где, по-видимому, перестройки генома стабилизировались, и он заменил родительский запас 7298 в центре запаса. Материал HoLo2 был использован для секвенирования генома B. coprophila и наиболее широко используется различными лабораторными группами. Недавно мутагенез мух HoLo2 методом CRISPR был использован для создания стаи W14 с фенотипом белого глаза, который будет использоваться для трансформации с флуоресцентными маркерами глаз (Ямамото и Герби, данные не показаны). Штамм W14 отличается исключительной устойчивостью. Приклад 6980 (маркеры волнистого крыла и вздутых вен) несколько менее прочный, а приклад 91S (маркер миниатюрного крыла) еще менее надежен.
Успешные скрещивания приводят к рождению эмбрионов (Рисунок 5). Эмбрионы подвергаются элиминации отцовских Х-хромосом на 7-9-м делении расщепления. Кроме того, ограниченные зародышевой линией L-хромосомы элиминируются из соматической линии у эмбрионов на 5-6-м делении расщепления. Эмбрионы появляются в виде личинок, которые не следует путать с плесенью, которая также может присутствовать (Рисунок 6). Глазные пятна (по отношению к глазам взрослой особи) появляются во второй половине4-го личиночного возраста (рис. 7). Размер глазных пятен является удобным фенотипическим маркером для начала и прогрессирования амплификации ДНК-слоев, которая является одним из двух известных примеров естественно происходящей в процессе развития регулируемой сайт-специфической интрахромосомной амплификации (генов). Впоследствии развиваются куколки, и количество пигмента, заполняющего их глаза, может служить маркером развития мейоза I и II в сперматогенезе (рис. 8) с его уникальным хромосомным поведением в этих отделах.

Рисунок 4: Спаривание взрослых мух B. coprophila . На верхней панели показаны три типа взрослых мух в популяции HoLo2: самки-производящие самки с волнистыми крыльями (X'WX взрослые самки), самцы-производящие матери с прямыми крыльями (XX взрослых самок) и самцы с прямыми крыльями (X0 взрослых самцов). Обратите внимание на заостренный яйцеклад на заднем конце у самок мух и крючкообразный класпер на заднем конце у самцов. На нижней панели показано спаривание самца и самки, где самец класпера схватил яйцеклад самки. Сперматозоиды будут храниться в сперматеке самки и будут оплодотворять яйцеклетки, когда они будут выведены наружу. Длина взрослых особей составляет 2,0 мм (самцы), 2,5 мм (самки). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
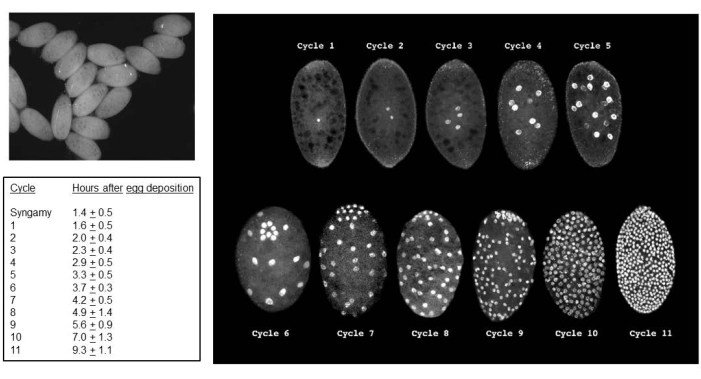
Рисунок 5: Эмбрионы B. coprophila . Верхняя левая панель представляет собой вид эмбрионов с использованием стандартного света в рассекающем микроскопе; Ядра в синцитиальной цитоплазме выглядят как черные точки. На панели справа используется флуоресцентная микроскопия для визуализации ядер эмбрионов, окрашенных йодидом пропидиума. Эмбрионы имеют среднюю длину 200 микрон и среднюю ширину 150 микрон. Ядра половых клеток группируются на заднем полюсе эмбриона, как видно на циклах 6 (эмбрион наклонен вперед) и 7-9, после чего они перемежаются с соматическими ядрами. Элиминация L-хромосомы в соматической линии происходит в 5-м или 6-м отделе расщепления; Элиминация Х-хромосомы в соматической линии происходит в7-м,8-м или9-м делении расщепления. Клеточная клетка происходит во время интерфазы цикла 11. В таблице слева показана средняя продолжительность каждого цикла деления при температуре 22 °C. Стол слева и панель справа адаптированы с разрешения de Saint Phalle and Sullivan35. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
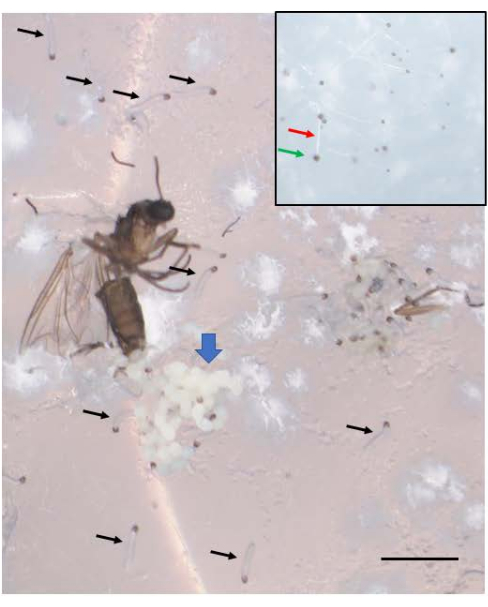
Рисунок 6: Эмбрионы B. coprophila проявляются в виде личинок. Скопление эмбрионов (синяя толстая стрелка) видно рядом с яйцекладом взрослой самки, погибшей после откладки яиц. Через неделю после откладки яиц зародыши становятся молодыми личинками, на некоторых из которых указывают черные стрелки. Только что появившиеся личинки имеют черную челюсть на переднем конце и полупрозрачное тело. Они перемещаются по поверхности агара и их не следует путать с плесенью, которая не движется. На вставке видна плесень, с белой нитью (красная стрелка) и черной спорой на кончике (зеленая стрелка), и она немного меньше, чем только что появившиеся личинки. Масштабная линейка = 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
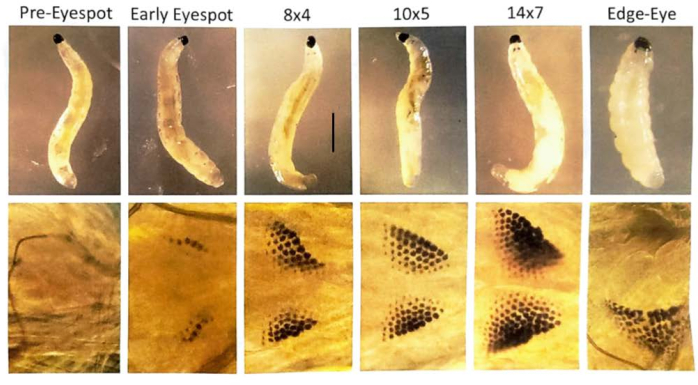
Рисунок 7: Стадии глазного пятна личинок B. coprophila . Глазные пятна образуются в передней части личинки, сразу за челюстью, и состоят из гранул пигмента, количество которых увеличивается. Глазные пятна являются анлажом для глаза взрослого человека. На верхней панели показаны личинки, которые были визуализированы с помощью препарирующего микроскопа; Нижняя панель представляет собой увеличенное изображение глазных пятен с помощью фазово-контрастного микроскопа для визуализации личинки на предметном стекле микроскопа с каплей дистиллированной воды и слегка плавающим сверху покровным стеклом. Номенклатура стадий глазного пятна соответствует шкале Габрусевича-Гарсиа30 , где количество гранул подсчитывается в самом длинном ряду (например, 12) и указывается количество дополнительных рядов, исключая самый длинный ряд (например, 6 для стадии глазного пятна 12x6). Инициация сайт-специфической амплификации ДНК в политенных хромосомах слюнных желез начинается на стадии глазного пятна 10x5 и завершается на стадии 14x7, когда происходит всплеск транскрипции в локусе и расширение ДНК-слоек31. На следующей стадии «край глаза/отвисшая челюсть» гранулы глазного пятна начинают сливаться, и они перемещаются в боковом направлении от средней линии; Длина тела личинки укорачивается. Далее на этом этапе слойки ДНК конденсируются. При температуре 21 °C для прохождения каждой стадии глазного пятна требуется около одного дня. Масштабная линейка = 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
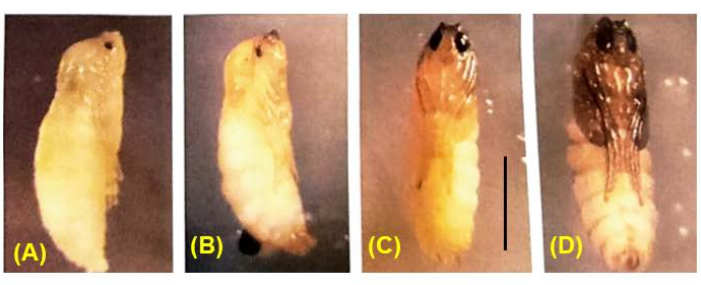
Рисунок 8: Развитие куколок B. coprophila . Во время окукливания все личиночные ткани гистолизируются за исключением нервной системы и замещаются взрослыми тканями, возникающими в результате клеточного деления имагинальных дисков. Цвет тела меняется от белого к коричневому, от коричневого до черного. Пигмент постепенно заполняется в куколке глаза; мейоз I и II встречается у куколок самцов с глазами, которые на 1/4-1/2 заполнены пигментом36. Масштабная линейка = 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Наименование акции | Маркеры | Коэффициент рождаемости | Комментарии |
| 7298 | Волнистое (W) крыло | ~75% | |
| Холо2 | Волнистое (W) крыло | ~90% | Производный от 7298 |
| П14 | Волнистое (W) крыло; Белые глаза | ~95% | производный от HoLo2 |
| 6980 | Волнистое (W) крыло; Опухшие (СВ) вены | ~65% | |
| 91С | слабое волнистое (W) крыло; Миниатюрные (P) крылья | ~50% | Волнистый маркер был введен в крест для спасения 91S |
Таблица 2: Запасы Bradysia (Sciara) coprophila. В таблице 1 Gerbi6 перечислены эти и другие маркеры, которые больше не существуют. Пять транслокаций (T1, T23, T29, T32, T70) на центральном конце X27 обобщены на рисунке 8 Gerbi6 , но больше не существуют.
Дополнительный файл 1: Кресты HoLo2 (а также 7298 и W14), крест и спасение 91S, крест 6980, скрещивание транслокаций. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Discussion
Представленные здесь протоколы по разведению B. coprophila будут полезны ученым, желающим выращивать этот организм в своих лабораториях для проведения экспериментов по изучению его уникальных биологических особенностей. Первоначальное описание метода кормления с использованием дрожжей и грибного порошка, посыпанных на агаровую основу для поддержания B. coprophila29 , было использовано в лаборатории Меца для выращивания 14 различных видов мух Sciarid5. Впоследствии было замечено, что добавление порошка крапивы и/или шпината еще больше увеличивает жизнеспособность B. coprophila (Gabrusewycz-Garcia, личное сообщение). Эти методы оказались успешными для поддержания родственных видов в семействе Sciaridae, включая Bradysia impatiens и Lycoriella ingenua , которые в настоящее время находятся в культуре (Роберт Бэрд, личное сообщение).
Другие методы (такие как альтернативные методы кормления, описанные ниже) были опробованы для выращивания B. coprophila, но описанные здесь протоколы были оптимизированы для получения наиболее благоприятного соотношения личинок на площадь поверхности агара для получения наиболее фертильного жира взрослых особей и минимизации роста плесени. Для увеличения масштаба массовое сопряжение может быть выполнено в стеклянных флаконах, как описано в протоколе 2 выше. В качестве альтернативы, несколько (2-4) взрослых самок могут быть помещены вместе с вдвое большим количеством взрослых самцов в колбу, подобную той, которая используется для выращивания дрозофилы (одноразовая полипропиленовая бутылка дрозофилы с квадратным дном объемом 6 унций = 177,4 мл квадратного дна). В обоих случаях исследователь должен быть полностью уверен в том, что в колбе находятся только все матери-самки или все матери-мужчины-производители.
Кормите только личинок, так как куколки и взрослые особи не едят. Не кормите флакон, если личинки превратились в куколок (признаком этого является появление первых рано появившихся взрослых мух). Как только взрослые особи закроются, поместите флаконы в более холодный инкубатор (например, 16 °C), если это возможно, так как это позволит взрослым особям жить дольше. Кормите три раза в неделю (например, в понедельник, среду, пятницу), увеличивая количество пищи, даваемой в одном флаконе, по мере взросления личинок. Кормите щедро, и вы будете вознаграждены жирными плодовитыми взрослыми особями. Однако, если вы кормите слишком много, появится белая плесень, а это признак того, что нужно уменьшить количество пищи, которую вы кладете во флакон. Кроме того, если вы будете кормить слишком много, на верхней части агара разовьется толстая подушечка с кормом, которая затруднит выход взрослых особей (вы можете удалить прокладку с помощью щипцов, но будьте осторожны, чтобы не вытащить личинки с помощью прокладки — лучше вообще не делать этого). Флаконы с небольшим количеством личинок (с пометкой «мало») нуждаются в меньшем количестве корма. Если кормить слишком мало, личинки будут карабкаться по стенкам флакона в поисках пищи. Недокормленные личинки приводят к появлению мелких взрослых особей, которые менее плодовиты.
Альтернативные способы кормления
Были опробованы различные методы, чтобы кормить личинок только один раз в течение личиночной стадии, а не 3 раза в неделю. B. coprophila не будет расти на пище в стиле дрозофилы . Джон Урбан (личное сообщение) попытался смешать пищу B. coprophila с агаром, но плесень выросла слишком сильно. Он обнаружил, что добавление двух ингибиторов плесени (тегосепта и пропионовой кислоты) в комбинации и по отдельности, пробуя несколько различных концентраций, было токсичным для B. coprophila в количествах, которые ингибируют плесень. Агар должен иметь pH 6-7 (нейтральный), так как B. coprophila заболевает при кислом pH (как при пропиановой кислоте). В качестве альтернативы, чтобы избежать трехкратного кормления в неделю, он пытался с помощью шпателя или шприца без иглы рассыпать густую дрожжевую пасту (активные сухие дрожжи Red Star, смешанные с небольшим количеством дистиллированной воды, чтобы увлажнить ее) в виде ложки поверх агара в каждом флаконе через неделю после спаривания (т.е. примерно в то время, когда личинки начнут появляться).
Еще один способ избежать трехкратного кормления в неделю — добавить в каждый флакон живую культуру грибов. Бат и Спонслер37 сообщили, что наклонная поверхность агара со средой Сабуро должна быть испещрена грибной культурой родов Chaetoconidia (лучшая) или же Baplosporangia или Xllescheria. Гриб выращивали от нескольких дней до одной недели до появления B. coprophila . После этого кормление не понадобилось в этом. Вариант этого метода также использовала Эллен Раш (личное общение). В наших руках флаконы оказались слишком влажными при таком способе и личинки утонули, но можно было попробовать еще раз для оптимизации количества личинок относительно флаконов с живыми грибами.
Артур Форер (личное сообщение) добился некоторого успеха в выращивании B. coprophila так же, как журавль летает38. При таком подходе куколки выращивались на влажном папье-маше. Впоследствии взрослые особи спаривались, а яйца откладывались на свежем влажном папье-маше. Образовавшихся личинок держали на папье-маше в чашках Петри и кормили порошкообразными листьями крапивы два раза в неделю. Куколок помещали в клетку для повторения цикла.
Юкико Ямасита (личное сообщение) безуспешно пыталась вырастить B. coprophila на почве, имитируя условия, где они встречаются в природе в горшечных растениях и теплицах с повышенной влажностью. Однако плесень может стать проблемой при повышении уровня влажности. Тем не менее, влажная почва с успехом использовалась для выращивания личинок Pseudolycoriella (ранее Bradysia) hygida в пластиковых ящиках с влажной почвой; их кормят разложившимися листьями Ilex paraguariensis, дополняя в позднюю личиночную жизнь 1,2% дрожжевым экстрактом, 1,4% кукурузным крахмалом, 0,8% овсяной мукой, 1,2% агаром12. Точно так же влажную почву можно заменить влажным торфяным мхом с измельченной фасолью для разведения мух Sciarid39,40.
Для поддержания лабораторных культур брадызии применялись и другие методы: (i) автоклавный картофель, в который добавляют дрожжи и удобрение для сухой крови41; (ii) навоз 42,43,44, к которому может быть добавлена засохшая кровь 45; (iii) пластиковые контейнеры с ватными дисками и смоченными бумажными полотенцами с молотыми соевыми бобами46.
Клещей
Клещи могут переноситься от дрозофилы к B. coprophila. Чтобы свести это к минимуму, лучше всего содержать B. coprophila в отдельном инкубаторе или комнате, не близко к запасам дрозофилы . Кроме того, проводите любые работы по поддержанию B. coprophila в начале дня перед обращением с дрозофилами. Клещи также могут переноситься на B. coprophila от комнатных растений, поэтому не держите растения в одной комнате с B. coprophila. Если клещи проникают во флаконы, их можно увидеть в виде маленьких белых сферических организмов, ползающих по телу B. coprophila. Химические обработки, которые уничтожают клещей у дрозофилы , не могут быть использованы для B. coprophila , поскольку химические вещества убивают B. coprophila (B. coprophila также чувствительна к органическим парам, таким как фенол). Единственным средством для избавления запасов B. coprophila от клещей является ручной сбор эмбрионов на агаровой пластине, осмотр каждого на отсутствие клещей, а затем перенос их в свежие агаровые флаконы с помощью тонкой кисти. Марлевые пробки с хлопчатобумажным наполнителем и пенопластовые пенопласты из ацетата целлюлозы (используемые для полипропиленовых флаконов дрозофилы ) помогают предотвратить попадание клещей внутрь флаконов.
Полезность протоколов содержания
Описанные здесь протоколы позволят растущему сообществу ученых выращивать B. coprophila в качестве нового/старого модельного организма для изучения его уникальных биологических особенностей. Новым лабораторным группам предлагается присоединиться к растущему сообществу для поддержания и исследования уникальных биологических особенностей Bradysia (Sciara).
Disclosures
У автора нет конфликта интересов, о котором он мог бы заявить.
Acknowledgements
Особая благодарность предыдущим владельцам скота B. coprophila (Джейкобу Э. Блиссу, Пауле Боназинга, Энн В. Керреброк, Ингрид М. Мерсер, Хайди С. Смит) и научному персоналу (особенно Роберту Бэрду, Майклу С. Фоулку, Донне Кубаи, Джону М. Урбану, Ютаке Ямамото) за тонкую настройку протоколов содержания. Первоначальные инструкции по уходу за B. coprophila были предоставлены Хелен В. Крауз, Натальей Габрусвич-Гарсия, Ребой М. Гудманом, Чарльзом В. Метцем и Эллен Раш. С благодарностью Юкико Ямасите и Энн В. Керреброк за то, что они взяли на себя управление стоковым центром Bradysia (Sciara). Выражаем глубокую признательность следующим людям за их полезную подготовку рисунков: Брайану Вигману (Рисунок 1), Джону М. Урбану (Рисунок 4 , верхняя панель), Лоре Росс (Рисунок 4 , нижняя панель), Ютаке Ямамото (Рисунок 5 , левая панель), Лео Кадоте (Рисунок 7 и Рисунок 8). Большое спасибо Аве Филисс и Многопрофильной лаборатории Университета Брауна за помощь в фото- и видеосъемке. Выражаю благодарность Роберту Бэрду за комментарии к этой рукописи. Наши исследования и поддержка B. coprophila были поддержаны NIH и NSF, включая самую последнюю поддержку от NIH GM121455 S.A.G. Более подробная информация о B. coprophila доступна на веб-сайтах Bradysia (Sciara) Stock Center (https://sites.brown.edu/sciara/ и https://sciara.wi.mit.edu), которые в настоящее время находятся в стадии строительства.
Materials
| Name | Company | Catalog Number | Comments |
| Agar (bacteriological) | U.S. Biological | A0930 | https://www.usbio.net; |
| CO2 FlyStuff Foot Pedal | Genesee Scientific | 59-121 | |
| CO2 FlyStuff Blowgun | Genesee Scientific | 54-104 | |
| CO2 FlyStuff UltimaterFlypad | Genesee Scientific | 59-172 | https://www.geneseesci.com |
| Ether fume hood | Labconco | 3955220 | Sits on top of lab bench |
| Filter replacement cat # 6961300 | |||
| Food: Brewer’s Yeast Powder | Solgar | Obtain from Amazon or health food store | |
| https://www.solgar.com; | |||
| Food: Nettle Powder (pesticide free) | Starwest Botanicals | 209460-51 | |
| Food: Shitake Mushrooms (pesticide free) | Starwest Botanicals | 202127-5 | https://www.starwest-botanicals.com; |
| Food: Spinach Powder ( pesticide free) | Starwest Botanicals | 209583-5 | |
| Food: Straw (pesticide free ) | Starwest Botanicals | 209465-3 | |
| Jar: clear glass, polypropylene lid | Fisher Scientific: | FB02911765 | 73 mm dia, 89 mm ht (240 ml) https://www.fishersci.com; |
| Needle Probe, wooden handle | US Geo Supply Inc | SKU: 4190 | 5.75” long probe, stainless steel needle https://usgeosupply.com; (970)-434-3708 |
| Vials: glass, preferred: | Wilmad LabGlass | ||
| Wilmad-glass custom vials | 28-33 mm inner dia, 33 mm outer dia, 9.5 cm ht Wilmad: https://www.SP-WilmadLabglass.com | ||
| Vials: glass (cheaper and ok) | Fisher Scientific | 03-339-26H | 29 mm outer dia, 9.5 cm h https://www.fishersci.com; |
| Vials: glass (a bit narrow) | Genesee Scientific | 32-201 | 24.5 mm outer dia,9.5 cm h thttps://www.geneseesci.com |
| Vials: polypropylene | Genesee Scientific | 32-114 | 28.5 mm outer dia,9.5 cm ht |
| Vial Plugs | |||
| roll of non-absorbent cotton | Fisher Scientific | 22-456881 | |
| cheesecloth | Fisher Scientific | 22-055053 | https://www.fishersci.com; |
References
- Lewin, H. A., et al. Earth BioGenome project: Sequencing life for the future of life. Proc Natl Acad Sci USA. 115 (17), 4325-4333 (2018).
- Wiegmann, B. M., et al. Episodic radiations in the fly tree of life. Proc Nat Acad Sci USA. 108 (14), 5690-5695 (2011).
- Yeates, D. K., Wiegmann, B. M. Phylogeny of Diptera. Manual of Afrotropical Diptera.Suricata. 3, 149-161 (2017).
- Vilkamaa, P., Burdíková, N., Ševčík, J. The genus Spinopygina gen. nov. (Diptera, Sciaridae) from Western North America: Preliminary molecular phylogeny and description of seven new species. Insects. 14 (2), 173 (2023).
- Metz, C. W. Chromosome behavior, inheritance and sex determination in Sciara. Amer Naturalist. 72 (743), 485-520 (1938).
- Gerbi, S. A., Hennig, N. Unusual chromosome movements in Sciarid flies. Results and Problems in Cell Differentiation. Vol 13 Germ Line - Soma Differentiation. 13, 71-104 (1986).
- Gerbi, S. A., Larracuente, A., Hanlon, S. Non-random chromosome segregation and chromosome eliminations in the fly Bradysia (Sciara). 34;Non-Mendelian Inheritance and Meiotic Drive.", Chromosome Research.(special issue). 30, 273-288 (2022).
- Steffan, W. A. A generic revision of the family Sciaridae (Diptera) of America North of Mexico. University of California Publications in Entomology. 44, 1-77 (1966).
- Shin, S., Jung, S., Menzel, F., Heller, K., Lee, H. Molecular phylogeny of black fungus gnats (Diptera: Sciaroidea: Sciaridae) and the evolution of larval habitats. Molec Phylogenetics Evolution. 66 (3), 833-846 (2013).
- Mohrig, W., Heller, K., Hippa, H., Vilkamaa, P., Menzel, F. Revision of the black fungus gnats (Diptera: Sciaridae) of North America. Studia Dipterologica. 19 (1-2), 141-286 (2013).
- Ševčík, J., et al. Molecular phylogeny of the megadiverse insect infraorder Bibionomorpha sensu lato (Diptera). PeerJ. 4, e2563 (2016).
- Menzel, F., et al. Pseudolycoriella hygida (Sauaia and Alves)-An overview of a model organism in genetics, with new aspects in morphology and systematics. Insects. 15 (2), 118 (2024).
- Meigen, J. W. . Klassifikazion und Beschreibung der europäischen zweiflügligen Insekten (Diptera Linn). 1 (1), (1804).
- Johannsen, O. A. The fungus gnats of North America part I. Maine Agricultural Experimental Station Bulletin. 172, 209-276 (1909).
- Johannsen, O. A. Mycetophilidae of North America. Maine Agricultural Experimental Station Bulletin. 200, 57-146 (1912).
- Urban, J. M., et al. Bradysia (Sciara) coprophila larvae up-regulate DNA repair pathways and down-regulate developmental regulators in response to ionizing radiation. Genetics. (3), (2024).
- Hodson, C. N., Jaron, K. S., Gerbi, S., Ross, L. Gene-rich germline-restricted chromosomes in black-winged fungus gnats evolved through hybridization. PLoS Biology. 20 (2), e3001559 (2021).
- Urban, J. M., et al. High contiguity de novo genome assembly and DNA modification analyses for the fungus fly, Sciara coprophila, using single-molecule sequencing. BMC Genomics. 22, 643 (2021).
- Baird, R. B., et al. Recent evolution of a maternally acting sex-determining supergene in a fly with single-sex broods. Mol Biol Evol. 40 (7), (2023).
- Yamamoto, Y., Gerbi, S. A. Making ends meet: targeted integration of DNA fragments by genome editing. Chromosoma. 127 (4), 405-420 (2018).
- Yamamoto, Y., Gerbi, S. A. Development of transformation for genome editing of an emerging model organism. Genes. 13 (7), 1108-1124 (2022).
- Metz, C. W., Smith, H. B. Further observation on the nature of the x-prime (X') chromosome in Sciara. Proc Nat Acad Sci USA. 17 (4), 195-198 (1931).
- Crouse, H. V. X-ray induced sex-linked recessive lethals and visibles in Sciara coprophila. Amer Naturalist. 95 (880), 21-26 (1961).
- Metz, C. W., Ullian, S. S. Genetic identification of the sex chromosomes in Sciara (Diptera). Proc Nat Acad Sci USA. 15 (2), 82-85 (1929).
- Crouse, H. V. X heterochromatin subdivision and cytogenetic analysis in Sciara coprophila (Diptera, Sciaridae). I. Centromere localization. Chromosoma. 63, 39-55 (1977).
- Crouse, H. V., Gerbi, S. A., Liang, C. M., Magnus, L., Mercer, I. M. Localization of ribosomal DNA within the proximal X heterochromatin of Sciara coprophila (Diptera, Sciaridae). Chromosoma. 64 (4), 305-318 (1977).
- Crouse, H. V. X heterochromatin subdivision and cytogenetic analysis in Sciara coprophila (Diptera, Sciaridae). II. The controlling element. Chromosoma. 74, 219-239 (1979).
- Mok, E. H., et al. Maintenance of the DNA puff expanded state is independent of active replication and transcription. Chromosoma. 110 (3), 186-196 (2001).
- Smith-Stocking, H. Genetic studies on selective segregation of chromosomes in Sciara coprophila Lintner. Genetics. 21 (4), 421-443 (1936).
- Gabrusewycz-Garcia, N. Cytological and autoradiographic studies in Sciara coprophila salivary gland chromosomes. Chromosoma. 15, 312-344 (1964).
- Wu, N., Liang, C., DiBartolomeis, S. M., Smith, H. S., Gerbi, S. A. Developmental progression of DNA puffs in Sciara coprophila: amplification and transcription. Dev Biol. 160 (1), 73-84 (1993).
- Yamamoto, Y., Gustafson, E. A., Foulk, M. S., Smith, H. S., Gerbi, S. A. Anatomy and evolution of a DNA replication origin. Chromosoma. 130 (2-3), 199-214 (2021).
- Misof, B., et al. Phylogenomics resolves the timing and pattern of insect evolution. Science. 346 (6210), 763-767 (2014).
- Bertone, M. A., Courtney, G. W., Wiegmann, B. M. Phylogenetics and temporal diversification of the earliest true flies (Insecta: Diptera) based on multiple nuclear genes. Syst Entomol. 33, 668-687 (2008).
- de Saint Phalle, B., Sullivan, W. Incomplete sister chromatid separation is the mechanism of programmed chromosome elimination during early Sciara coprophila embryogenesis. Development. 122 (12), 3775-3784 (1996).
- de Saint Phalle, B., Oldenbourg, R., Kubai, D., Salmon, E. D., Gerbi, S. A. Paternal chromosome elimination and X non-disjunction on asymmetric spindles in Sciara male meiosis. BioRxiv. , (2021).
- Bath, J. D., Sponsler, O. L. An alternative method for the culture of Sciara larvae. Science. 109 (2828), 255 (1949).
- Forer, A. Crane fly spermatocytes and spermatids: A system for studying cytoskeletal components. Methods Cell Biol. 25, 227-252 (1982).
- Gillespie, D. R. A simple rearing method for fungus gnats Corynoptera sp. (Diptera: Sciaridae) with notes on life history. J Entomol Soc Br Colum. 83, 45-48 (1986).
- Gardiner, R. B., Jarvis, W. R., Shipp, J. L. Ingestion of Pythium spp. by larvae of the fungus gnat Bradysia impatiens (Diptera: Sciaridae). Ann Appl Biol. 116, 205-212 (1990).
- Hungerford, H. B. Sciara maggots injurious to potted plants. J Econ Entomol. 9 (6), 538-549 (1916).
- Thomas, C. A. A method for rearing mushroom insects and mites. Entomol News. 40, 222-225 (1929).
- Austin, M. D., Pitcher, R. S. A laboratory method for rearing Sciara and phorid flies. Entomol Mon Mag. 72, 12-15 (1936).
- Butt, F. H., Galtsoff, P. S., Lutz, F. E., Welch, P. S., Needham, J. G. Culture of Sciara. Culture methods for invertebrate animals. , 400-401 (1937).
- Hudson, E. K. Regulation of greenhouse sciarid fly populations using Tetradonema plicans (Nematoda: Mermithoidea). J Invert Pathol. 23 (1), 85-91 (1974).
- Wilkinson, J. D., Daughterty, D. M. Comparative development of Bradysia impatiens (Diptera: Sciaridae) under constant and variable temperatures. Ann Entomol Soc Am. 63 (4), 1079-1083 (1970).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved