כימות מוות תאי הנגרם על ידי ציטוקינים באורגנואידים של המעי הגס האנושי באמצעות מיקרוסקופ פלואורסצנטי חי
In This Article
Summary
פרוטוקול זה מתאר שיטה פשוטה וחסכונית לחקור ולכמת מוות תאי באורגנואידים אנושיים של המעי הגס בתגובה להפרעות ציטוטוקסיות כגון ציטוקינים. הגישה משתמשת בצבע מוות פלואורסצנטי של תאים (SYTOX Green Nucleic Acid Stain), במיקרוסקופ פלואורסצנטי חי ובתוכנת ניתוח תמונות בקוד פתוח כדי לכמת תגובות אורגנואיד יחיד לגירויים ציטוטוקסיים.
Abstract
מוות מוגבר של תאי אפיתל במעי (IEC) מוגבר בחולים עם מחלות מעי דלקתיות (IBD) כגון קוליטיס כיבית (UC) ומחלת קרוהן (CD). זה יכול לתרום לפגמים בתפקוד מחסום המעי, החמרה של דלקת, ואימונופתוגנזה של המחלה. ציטוקינים וליגנדות קולטני מוות אחראים חלקית לעלייה זו בתמותה בחברת החשמל. ציטוקינים רלוונטיים ל-IBD, כגון TNF-α ו-IFN-γ, הם ציטוטוקסיים לחברת החשמל הן באופן עצמאי והן בשילוב. פרוטוקול זה מתאר בדיקה פשוטה ומעשית לכימות ציטוטוקסיות הנגרמת על ידי ציטוקינים באורגנואידים של המעי הגס שמקורם בחולי CD באמצעות צבע מוות של תאים פלואורסצנטיים (SYTOX Green Nucleic Acid Stain), מיקרוסקופ פלואורסצנטי חי ותוכנת ניתוח תמונה בקוד פתוח. אנו גם מדגימים כיצד להשתמש במודל המתמטי של עצמאות בליס כדי לחשב מקדם של אינטראקציית הפרעה (CPI) בהתבסס על ציטוטוקסיות אורגנואידית. מדד המחירים לצרכן יכול לשמש כדי לקבוע אם אינטראקציות בין שילובי ציטוקינים או סוגים אחרים של הפרעות הן אנטגוניסטיות, תוספתיות או סינרגטיות. פרוטוקול זה יכול להיות מיושם כדי לחקור את הפעילות ציטוטוקסית של ציטוקינים והפרעות אחרות באמצעות אורגנואידים המעי הגס שמקורם במטופל.
Introduction
אפיתל המעי יוצר מחסום פיזי חדיר למחצה בין התוכן של לומן המעי לבין הרקמות הבסיסיות. כדי לשמור על מחסום זה ביעילות, תאי אפיתל המעי (IECs) עוברים תחלופה תאית גבוהה במיוחד, עם מחזור מתמשך של מוות והתחדשות תאים. עם זאת, במהלך הפרעות דלקתיות, כגון מחלות מעי דלקתיות (IBD), רמות גבוהות יותר של מוות תאים חריגים להתרחש1. זה עשוי לקדם התמוטטות של תפקוד מחסום והפעלה של המערכת החיסונית, מה שמעורר דלקת נוספת. במחלת קרוהן (CD), סוג של IBD, הוכח כי איתות ציטוקינים תורם לרמות מוגברות של מוות IEC2. על ידי חקר האופן שבו איתות ציטוקינים גורם למוות תאי של IECs, אנו מקווים כי ניתן לפתח טיפולים משופרים עבור חולים עם IBD והפרעות דלקתיות אחרות במעיים1.
במחקר ביולוגיה וגילוי מטרות תרופות, סינרגיה מובנת בדרך כלל כמתרחשת כאשר מערכת ביולוגית המטופלת בשילובים של גירויים בודדים מראה תגובה לשילוב שהיא גדולה יותר מההשפעות המוספות המשולבות של הגירויים הבודדים בלבד. אינטראקציות סינרגטיות בין ציטוקינים תועדו היטב בהנעת תגובות אנטי-ויראליות מולדות3. ציטוקינים ידועים גם כגורמים למוות תאי באופן סינרגטי, כולל ב-IECs4. עם זאת, התפקיד שאיתות ציטוקיני ציטוטוקסי סינרגטי ממלא בהפרעות דלקתיות במעי כגון IBD אינו נחקר מספיק.
אורגנואידים אנושיים במעיים הם מיקרו-רקמות תלת-ממדיות המיוצרות במבחנה ונוצרות מתאי גזע אפיתליאליים במעי. ניתן לגדל אורגנואידים במעי מביופסיות רירית המעי המתקבלות מחולים עם IBD ולשמור על מאפיינים רבים של המחלה 5,6. אורגנואידים הוכיחו את עצמם כמערכת מודל אידיאלית לחקר ציטוטוקסיות ציטוקינים בהקשר של דלקת מעיים 7,8. בעבר, הקבוצה שלנו אפיינה את השפעות ההרג הסינרגטיות של הציטוקינים הרלוונטיים ל- IBD IFN-γ ו- TNF-α באורגנואידים של המעי הגס (קולונואידים) שמקורם בחולי CD 9,10. עם זאת, המנגנונים המדויקים המעורבים בתיווך צורה זו של מוות תאי סינרגטי נותרו חמקמקים. יש גם הרבה יותר אינטראקציות ציטוקסינים ציטוטוקסיות לא מאופיינות הרלוונטיות להפרעות דלקתיות במעי.
מספר פרוטוקולים זמינים לחקר מוות תאי באורגנואידים במעיים 10,11,12,13; עם זאת, לכל אחד מהם יש חסרונות. חלק מהטכניקות הללו מודדות רק את יכולת הקיום של התא ואינן מודדות מוות תאי ישירות, אינן מסוגלות להעריך תגובות של אורגנואיד יחיד, או דורשות ציוד יקר ופרוטוקולים מורכבים. יש צורך במתודולוגיות חזקות ופשוטות כדי לכמת את האינטראקציות בין מוות תאי אורגנואידים לבין אינטראקציות perturbagen באורגנואידים במעי. הפרוטוקול שאנו מציגים הוא גישה פשוטה וזולה למדידת תגובות אורגנואידים בודדים לציטוקינים ציטוטוקסיים, אך ניתן להשתמש בו לכל סוג של גירוי או הפרעה. אנו גם מדגימים כיצד להשתמש במודל הסינרגיה של עצמאות Bliss כדי לחשב מקדם של אינטראקציה perturbagen (CPI) המתאר אינטראקציות ציטוקסינים ציטוטוקסיים.
Protocol
ביופסיות רירית המעי הגס נאספו מחולים עם CD שעברו קולונוסקופיה שגרתית כחלק מהטיפול הסטנדרטי. אישור אתי לשימוש בדגימות רקמת מטופל ויצירת קווי אורגנואידים של המעי הגס מדגימות אלה התקבל מוועדת האתיקה למחקר קליני של בתי החולים להוראה בקורק (CREC). הסכמה מדעת בכתב התקבלה מכל החולים בהסכמה עם הצהרת הלסינקי. כל עבודת תרבית רקמות עם ביופסיות וקולונואידים של מטופלים חייבת להתבצע בתוך ארון בטיחות ביולוגית בהתאם לפרוטוקולי בטיחות BSL2. יש לוודא שכל בלאי הפלסטיק סטרילי לפני השימוש. עיין בטבלת החומרים לקבלת פרטים הקשורים לכל החומרים, הריאגנטים, המכשירים והתוכנות המשמשים בפרוטוקול זה.
הפרוטוקולים שהקבוצה שלנו משתמשת בהם לבידוד קריפטה ותרבית אורגנואידים הותאמו משיטות מבוססות 14,15,16 ופורסמו בעבר 9,10,17. עבור הפרוטוקול הבא, קולונואידים תורבתו באמצעות Organoid Proliferation Media (טבלה 1). קולונואידים הגדלים באמצעות Organoid Proliferation Media אינם ממוינים ומועשרים עבור תאי גזע של המעי הגס. המרכיב העיקרי של Organoid Proliferation Media הוא 50% מדיה מותנית L-WRN, המכילה את גורמי הגדילה של נישה של תאי גזע במעי Wnt-3A (W), R-spondin 3 (R) ו- Noggin (N)15. Organoid Proliferation Media מיוצר על ידי שילוב של מדיה מותנית L-WRN ומדיה נטולת סרום 1:1, ולאחר מכן תוספת עם ניקוטינאמיד ומעכבים כימיים (טבלה 1).
1. בידוד קריפטה המעי הגס ותרבות קולונואיד
- לדגור מראש צלחת microtiter 48 באר ב 37 ° C, 5% CO2 במשך מינימום של 72 שעות לפני זריעה עם crypts.
הערה: דגירה מוקדמת של הצלחת מאיצה את הפילמור של תמצית קרום המרתף (BME) במהלך הזריעה. - להפשיר את BME על קרח ב 4 °C בערב לפני בידוד של crypts.
- יש לאסוף את הביופסיות של המעי הגס בצינורית איסוף דגימות המכילה 15 מ"ל של מדיום איסוף ביופסיה (טבלה 1) ולאחסן בטמפרטורה של 4°C עד להכנה לעיבוד.
- יש להסיר בזהירות כמה שיותר מדיום איסוף ביופסיה באמצעות פיפטה. שטפו את הביופסיות על ידי הוספת 15 מ"ל של DPBS קר כקרח בתוספת 2.5 מיקרוגרם / מ"ל אמפוטריצין B ו 100 מיקרוגרם / מ"ל גנטמיצין לצינור הדגימה. נערו את צינורית הדגימה במרץ כדי לנתק רירית או פסולת מהביופסיות. תן ביופסיות להתיישב על ידי כוח הכבידה בזהירות להסיר DPBS ככל האפשר באמצעות פיפטה.
- חזור על הליך הכביסה משלב 1.4 פעמיים (2x).
- הוסף 10 מ"ל של מגיב דיסוציאציה תאי ללא אנזימים בתוספת 2.5 מיקרוגרם / מ"ל אמפוטריצין B ו 200 מיקרוגרם / מ"ל גנטמיצין לצינור הדגימה ודגור במשך 15 דקות בטמפרטורת החדר עם נדנוד ב -30 סל"ד.
- לאחר הדגירה, נערו את צינור הדגימה מצד לצד ביד במרץ כדי לשחרר את הקריפטים של המעי הגס. בדוק את הצינור באמצעות מיקרוסקופ אור בעוצמה נמוכה וחפש את הקריפטים ושברי הקריפטה ששוחררו בתרחיף. אם אינו גלוי, נער את הצינור ובדוק שוב; חזור על הפעולה עד שהקריפטים נראים בהשעיה.
- חבר מסננת תאים של 70 מיקרומטר לצינור של 50 מ"ל וסנן את מתלה הקריפטה דרך המסננת. הוסף 10 מ"ל של מדיית שטיפת אורגנואידים קרה כקרח (טבלה 1) לצינורית הדגימה הריקה, הסר את המדיה והעבר אותה דרך מסננת התא.
- העבר את הקריפטות המסוננות לשני צינורות 15 מ"ל (10 מ"ל לכל צינור) וצנטריפוגה ב -4 ° C למשך 5 דקות ב 150 × גרם.
- הסר את הסופרנאטנט בזהירות מכל צינור 15 מ"ל, השהה מחדש את כדורי הקריפטה ב- 500 מיקרוליטר של מדיית שטיפת אורגנואידים קרה כקרח, העבר את תמיסת הקריפטה משני צינורות 15 מ"ל לצינור מיקרוצנטריפוגה יחיד של 1.5 מ"ל, וצנטריפוגה ב -4 ° C למשך 3 דקות ב 400 × גרם.
- בזהירות להסיר את supernatant מן צינור microcentrifuge ו resuspend את גלולת הקריפטה ב 70 μL של BME (20 μL לכל באר ו 10 μL של נפח מת נוסף).
- באמצעות צלחת 48 בארות מודגרת מראש (שלב 1.1), זרע 20 μL של BME/קריפטה מתלה למרכז כל באר (1 BME כיפה לכל באר). הופכים את הצלחת בצורה חלקה ויציבה ודגרים בטמפרטורה של 37°C, 5% CO2 למשך 20 דקות.
הערה: היפוך הצלחת מונע מהתאים להיצמד למשטח הפלסטיק של הבאר ומבטיח את פיזורם בתוך ה-BME. - מוציאים את הצלחת מהאינקובטור. ודא שה-BME עבר פולימריזציה מלאה ולאחר מכן כסה את הכיפות ב-350 מיקרוליטר של חומר התפשטות אורגנואידים שחומם מראש בתוספת 100 מיקרוגרם/מ"ל של מגיב אנטי-מיקרוביאלי רחב טווח. לדגור את הצלחת ב 37 ° C, 5% CO2.
הערה: מגיב אנטי-מיקרוביאלי רחב טווח נועד למנוע זיהום מחיידקים ריריים הקשורים לביופסיות המעי הגס. זה נדרש רק בשבוע הראשון של התרבית לאחר בידוד קריפטה. - שנה את המדיה 2-3x בשבוע באמצעות Organoid Proliferation Media שחומם מראש, בתוספת מגיב אנטי-מיקרוביאלי רחב טווח בשבוע הראשון של התרבית; לאחר תקופה זו, הסר את המגיב.
- לאחר התבססות התרבית הקולונואידית במלואה (1-2 שבועות לאחר הבידוד), יש לנתק את הקולונואידים באמצעות מגיב הדיסוציאציה האנזימטי בתוספת 10 מיקרומטר של מעכב ROCK-I/II Y-27632 (ראה סעיף 2 לפרטים מלאים על דיסוציאציה קולונואידית).
הערה: עבור שני הקטעים הראשונים (P0-1, P1-2), יש להרחיב את הקולונואידים ביחס של 1:1/2; לאחר P2, קולונואידים יכולים לעבור באמצעות יחס של 1:3/4. - זרעו ותחזקו את הקולונואידים בהתאם לשלבים 1.11-1.13 (אין להשלים את Organoid Proliferation Media עם מגיב אנטי-מיקרוביאלי בטווח רחב).
2. הכנת קולונואידים לבדיקת מוות תאי
הערה: השלמת פרוטוקול בדיקת מוות תאי נמשכת 4 ימים (איור 1A).
- הרחיבו את הקולונואידים בפורמט צלחת של 48 בארות, זריעה של 20 מיקרוליטר של תרחיף BME/קריפטה לכל באר, דגירה בטמפרטורה של 37°C, 5% CO2, ושינוי המדיום 2-3x בשבוע (350 μL לכל באר).
- יש לעבור את הקולונואידים כשבוע לפני הקציר לבדיקת מוות תאי. לפני קצירת הקולונואידים, ודאו שהם מופצים לצפיפות גבוהה (איור 1Bi), שהם בקוטר של כ-25-50 מיקרומטר, ומתרבים באופן פעיל.
הערה: השתמשנו בקולונואידים לבדיקה זו מקטע 3 לקטע 14 עם תוצאות עקביות. עם זאת, הוכח כי תגובת השעתוק של קולונואידים לציטוקינים יכולה להשתנות בהתאם למשך התרבית18. על בסיס זה, אנו ממליצים לא להשתמש בקולונואידים לבדיקה זו לאחר מעבר 15. - יש לדגור מראש על לוחות מיקרוטיטר 96 בארות בטמפרטורה של 37°C, 5%CO2 למשך 72 שעות לפחות לפני הזריעה עם תאי קולונואידים.
- הפשיר את ה-BME על קרח ב-4 מעלות צלזיוס בערב שלפני תחילת הניסוי.
- הכינו נפח מספיק של מגיב הדיסוציאציה האנזימטית (500 מיקרוליטר לבאר קולונואידים) על ידי תוספת של 10 מיקרומטר של מעכב ROCK-I/II Y-27632. להסיר בעדינות את המדיום מן הבארות המכילות קולונואידים; פיפטה מקצה הבאר כדי למנוע פגיעה בכיפת הקולונואידים. הוסף 300 μL של מגיב דיסוציאציה אנזימטי לכל באר.
- עבור כל באר, לפרק את כיפת הקולונואיד על ידי גירוד פני השטח של הבאר עם קצה פיפטה P1000 ו pipeting את מתלה התא למעלה ולמטה; נסו להימנע מיצירת בועות אוויר. לאסוף את השעיית התא בצינור 15 מ"ל.
הערה: צינור זה של 15 מ"ל ישמש לאיסוף קולונואידים מ-10 בארות של צלחת 48 הקידוחים. - שטפו את אותה באר עם עוד 200 מיקרוליטר של מגיב הדיסוציאציה האנזימטית כדי להבטיח שכל החומר הקולונואידי נאסף ומועבר לאותו צינור של 15 מ"ל. חזור על תהליך זה עבור כל באר של קולונואידים מורחבים הנקצרים ואסוף אותם באותו צינור יחיד של 15 מ"ל.
הערה: לדיסוציאציה יעילה, יש לאסוף מקסימום 10 בארות קולונואידים לכל צינור. אם אתם אוספים >10 בארות, יש לפצל את הקולונואידים שנאספו באופן שווה על פני צינורות מרובים של 15 מ"ל.
- עבור כל באר, לפרק את כיפת הקולונואיד על ידי גירוד פני השטח של הבאר עם קצה פיפטה P1000 ו pipeting את מתלה התא למעלה ולמטה; נסו להימנע מיצירת בועות אוויר. לאסוף את השעיית התא בצינור 15 מ"ל.
- לדגור על צינור 15 מ"ל עם קולונואידים שנאספו משלב 2.5.2 באמבט מים ב 37 ° C במשך 5 דקות. לאחר הדגירה, צנטריפוגה את הצינור במשך 3 דקות ב 400 × גרם. הסר בעדינות את supernatant, משאיר כ 1.2 מ"ל מאחור בצינור.
הערה: השלב הבא דורש דיסוציאציה פיזית של קולונואידים באמצעות פיפטינג מהיר. כדי שזה יהיה יעיל, אתה חייב להיות נפח קטן של השעיית התא בצינור - 1.2 מ"ל שנותר בצינור 15 מ"ל מספיק למטרה זו. - להשעות מחדש את גלולת הקולונואיד ב -1.2 מ"ל הנותרים של מגיב הדיסוציאציה האנזימטי. בעזרת פיפטה P1000 המוגדרת ל-1,000 מיקרוליטר, הניחו את קצה הפיפטה לתוך המתלה, החזיקו אותה בדיוק מעל החלק התחתון של צינור ה-15 מ"ל, ולאחר מכן הכניסו במהירות את המתלה פנימה והחוצה מהקצה. כדי לבצע פיפטה במהירות, לחץ במהירות על כפתור הבוכנה לתחנה הראשונה, שחרר את הכפתור עד שהוא בערך באמצע הדרך למיקום העליון, וחזור על הפעולה. פיפטה במהירות במשך כ 10 s (30-40 שקעים), ולאחר מכן להשעות את המתלה במלואו לחזור על pipetting. בצע 2-3 סיבובים של פיפטינג מהיר.
- בדקו את הדגימה מתחת למיקרוסקופ כדי לוודא שלא נותרו קולונואידים שלמים ושרוב מקטעי הקולונואידים הם בגודל של כ-30-40 מיקרומטר (איור 1Bii).
- אם הדגימה דורשת דיסוציאציה נוספת, יש לדגור באמבט המים בטמפרטורה של 37 מעלות צלזיוס למשך 3 דקות נוספות, לחזור על טכניקת הצנרת בשלב 2.7 ולבדוק את הדגימה תחת המיקרוסקופ. חזור על תהליך זה עד שרוב מקטעי הקולונואיד הם בגודל האופטימלי.
הערה: היזהר לא לנתק את הקולונואידים יותר מדי מכיוון שהדבר יגרום למוות תאי מוגזם, יעילות ציפוי נמוכה וקולונואידים בגודל נמוך. - הוסף 10 מ"ל של אמצעי שטיפה אורגנואידים קרים כקרח (טבלה 1) לצינור של 15 מ"ל. צנטריפוגה את הצינור למשך 3 דקות ב 400 × גרם, להסיר את supernatant, resuspend ב 1 מ"ל של Organoid Wash Media קר כקרח, ולהעביר צינור microcentrifuge 1.5 מ"ל (המכונה צינור קטע קולונואידים).
- מערבבים את התוכן של צינור קטע קולונואיד על ידי pipetting ולקחת דגימה 50 μL; העבר דגימה זו של 50 μL לצינור מיקרוצנטריפוגה חדש של 1.5 מ"ל (המכונה צינור ספירת תאים). אחסנו את צינור שבר הקולונואיד על קרח מנקודה זו ועד להשלמת שלב 2.15.
- צנטריפוגה את צינור ספירת התאים למשך 3 דקות ב 400 × גרם, להסיר את supernatant, ולהשהות מחדש ב 500 μL של מגיב דיסוציאציה אנזימטי בתוספת 10 μM של מעכב ROCK-I/II Y-27632.
- לדגור על צינור ספירת התאים היחיד באמבט המים ב 37 ° C במשך 5 דקות. באמצעות פיפטה P1000 המוגדרת ל-400 μL, פיפטה את הדגימה כמתואר בשלב 2.7 ובדוק את הדגימה תחת המיקרוסקופ כדי לוודא שיש תרחיף חד-תאי. אם לא, חזור על תהליך זה עד שהקולונואידים מנותקים לחלוטין לתרחיף חד-תאי.
- הוסף 1 מ"ל של מדיית שטיפה אורגנואידית לצינור ספירת התאים היחיד, צנטריפוגה למשך 3 דקות ב 400 × גרם והסר בזהירות את supernatant. להשהות מחדש את התאים ב 50 μL של Organoid Wash Media ולאחר מכן להוסיף 50 μL של כחול טריפאן.
- לספור את התאים באמצעות hemocytometer. חשב את מספר התאים במדגם 50 μL והשתמש בו כדי לחשב את ריכוז התאים בצינור מקטע המעי הגס.
- חשב את נפח תרחיף התא הדרוש לניסוי שבו 0.5 × 104 תאי קולונואיד ייזרעו לכל באר של צלחת מיקרוטיטר 96 באר. הוסף כ- 15% נוספים לנפח מחושב זה כדי לקחת בחשבון נפח מת. העבר נפח כולל זה מצינור מקטע המעי הגס (שלב 2.11) לצינור מיקרוצנטריפוגה חדש של 1.5 מ"ל.
- צנטריפוגה את צינור המיקרוצנטריפוגה החדש בנפח 1.5 מ"ל המכיל שברי קולונואיד למשך 3 דקות ב-400 × גרם, מוציאים את הסופר-נטנט ומשהים מחדש ב-BME (יש להשתמש ב-10 מיקרוליטר BME לכל 0.5 × 104 תאים).
הערה: בשל המאפיינים הפיזיים של BME (צמיגות גבוהה, פילמור תלוי טמפרטורה), כמות משמעותית של חומר יכולה ללכת לאיבוד באמצעות פיפטינג (נפח מת).
- צנטריפוגה את צינור המיקרוצנטריפוגה החדש בנפח 1.5 מ"ל המכיל שברי קולונואיד למשך 3 דקות ב-400 × גרם, מוציאים את הסופר-נטנט ומשהים מחדש ב-BME (יש להשתמש ב-10 מיקרוליטר BME לכל 0.5 × 104 תאים).
- מקמו את הצינור או המאגר המכיל את מתלה הקולונואידים/BME על קרח במיכל סטרילי בתוך ארון הבטיחות הביולוגית.
הערה: שמירה על התאים על קרח בזמן הזריעה מונעת ממצע התא להתפלמר בטרם עת. - באמצעות לוחית מיקרוטיטר 96 בארות מודגרת מראש (משלב 2.3), פיפטה הפוכה 10 μL של תמיסת קולונואיד/BME לכל באר. הקפידו למקם את הקצה ממש מעל פני השטח של הבאר ואת פיפטה למרכז כדי למנוע פגיעה בקיר הבאר. ערבבו את מתלה הקולונואידים/BME באופן קבוע כדי למנוע זריעה לא אחידה.
הערה: אין לזרוע קולונואידים בבארות הקצה החיצוני של צלחת המיקרוטיטר.- כדי להפוך פיפטה:
- הגדר את פיפטה ולאחר מכן לחץ על כפתור הבוכנה מעבר לתחנה הראשונה לתחנה השנייה.
- בהחזקת תנוחה זו, טבלו את הקצה במתלה הקולונואידים/BME ושחררו לאט את הבוכנה למעלה.
- שחררו את המתלים על ידי לחיצה עדינה ויציבה על כפתור הבוכנה עד לתחנה הראשונה. אם זורעים בארות נוספות, החזק במצב זה וחזור על שלבים 2.18.1.2-2.18.1.3.
- לאחר שתסיים, סלק את הכמות הקטנה של המתלים שנותרו על ידי לחיצה על כפתור הבוכנה לתחנה השנייה.
הערה: אנו ממליצים להשתמש בטכניקת פיפטינג הפוך בשל צמיגות גבוהה של BME.
- כדי להפוך פיפטה:
- הופכים את הצלחת בצורה חלקה ויציבה ודגרים בטמפרטורה של 37°C, 5% CO2 למשך 20 דקות.
- מוציאים את הצלחת מהאינקובטור. ודא שה-BME עבר פולימריזציה מלאה ולאחר מכן, כסה את הכיפות ב-200 μL של מדיית התפשטות אורגנואידים שחוממה מראש. אם אתם משתמשים בפלטת מיקרוטיטר בעלת 96 בארות עם חפיר מסביב (המפחיתה אידוי), מלאו כל מאגר ב-2 מ"ל של מדיית שטיפה אורגנואידית.
- לדגור על הקולונואידים ב 37 ° C, 5% CO2 במשך 3 ימים ולבדוק מיקרוסקופית פעם ביום כדי להבטיח את הקולונואידים התאוששו והם מתרבים.
3. טיפולים בקולונואידים לבדיקת מוות תאי
- הכינו תמיסה של 2.5 מיקרומטר של צבע מוות תאי פלואורסצנטי (SYTOX Green Nucleic Acid Stain) ותמיסת DMSO על-ידי הוספת צבע פלואורסצנטי למוות תאים או DMSO למדיה להפצת אורגנואידים שחוממו מראש (טבלה 2).
הערה: הגן על מלאי הצבעים של מוות תאי הפלואורסצנטי ועל התמיסה המדוללת מפני אור. כתם חומצת גרעין ירוקה SYTOX מסיס ב-DMSO; פתרון DMSO משמש להכנת תנאי No Dye לבקרה על השפעות ממס. - השתמש בתמיסת 2.5 מיקרומטר של צבע מוות תאי פלואורסצנטי ותמיסת DMSO משלב 3.1 כדי להכין טיפולים כפי שמוצג בטבלה 2.
- להסיר בעדינות את המדיום מן צלחת microtiter 96 באר זרע קולונואידים על ידי הטיית הצלחת pipetting מקצה הבארות; לאחר מכן, להוסיף 200 μL של מדיום הטיפול לכל באר. ודא שיש לך בארות בקרה נוספות של PBS/BSA עבור תנאי הרעילות המרבית (ראה טבלה 2 למפת הלוחות).
- לדגור על הקולונואידים בטמפרטורה של 37°C, 5%CO2 עבור נקודות הזמן הדרושות לטיפול עד שהם מוכנים להדמיה.
- לפחות שעתיים לפני ההדמיה, הכינו תמיסה של 10% v/v של Triton-X 100 במים סטריליים בדרגת תרבית תאים והוסיפו 22 μL של 10% Triton-X 100 ישירות לתווך של בארות הבקרה עבור תנאי הרעילות המרבית לריכוז סופי של 1% v/v 1 שעה לפני ההדמיה.
הערה: שימוש בתמיסה של 10% מפחית שגיאות צנרת שעלולות להתרחש עקב צמיגות גבוהה של חומר פעילי שטח.
4. רכישת תמונות
- הסר את צלחת המיקרוטיטר בת 96 הבארות שנזרעה בקולונואידים מהאינקובטור והעבר לשלב של מיקרוסקופ אפיפלואורסצנטי הפוך דיגיטלי. תנו לצלחת להגיע לטמפרטורת החדר.
- אשרו שהקולונואידים במצב רעילות מרבית עוברים ליזה מלאה על-ידי בחינתם תחת המיקרוסקופ (איור 1, Biii).
- בחר מטרה מתאימה, כגון יעד פלואורסצנטי של 40x למרחק עבודה ארוך. מטב את הגדרות ההדמיה של המיקרוסקופ לפני שתתחיל.
- באמצעות ערוץ ההולכה, התמקדו בקולונואיד עם תאים חיוביים ל-SYTOX, עברו לחלבון הפלואורסצנטי הירוק (GFP)
ערוץ (488 ננומטר), וכוונן את עוצמת האור ואת זמן החשיפה כדי למקסם את האות הפלואורסצנטי תוך מזעור הרקע. ראשית, נסה עוצמת אור נמוכה, ולאחר מכן להגדיל בהדרגה את זמן החשיפה; אם משך החשיפה אינו מעשי, הגדל מעט את עוצמת האור.
הערה: הארכת זמן החשיפה במקום עוצמת האור תפחית את רעילות האור ואת ההלבנה של הדגימות19. חשוף את הדגימות לאור פלואורסצנטי רק בעת הצורך.
- באמצעות ערוץ ההולכה, התמקדו בקולונואיד עם תאים חיוביים ל-SYTOX, עברו לחלבון הפלואורסצנטי הירוק (GFP)
- באמצעות הגדרות ההדמיה הממוטבות עבור ערוץ GFP, שימו לב לתנאי הרעילות ללא צבע ומקס כדי להבטיח שהדגימות אינן חשופות יתר או תת-חשיפה. לאחר הסיום, שמור על עקביות בהגדרות ההדמיה בין התנאים.
- רכשו תמונות בגישת דגימה אקראית: עשו זאת על ידי בחירת שדות ראייה (FOV) העוקבים אחר תבנית רשת קבועה המכסה את כיפת הקולונואידים. רכוש תמונות של קולונואידים ממינימום של 10 FOVs. ודא שהמישור המרכזי של הקולונואיד נמצא בפוקוס וקבל תמונות הן בערוצי שידור והן בערוצי GFP.
- החל את קריטריוני ההחרגה הבאים.
- אין לרכוש תמונות אם אין קולונואידים נוכחים ב- FOV.
- אל תשיגו תמונות אם יש רק קולונואידים חופפים באותו מישור מוקד שנמצא ב-FOV (איור 1Biv).
- אל תשיגו תמונות אם יש רק פסולת קולונואידים ב-FOV (איור 1Bv). אין לכלול פסולת קולונואידים בניתוח.
- החל את קריטריוני ההחרגה הבאים.
- שמור תמונות בפורמט גרפי של רשת ניידת וייצוא.
- אם מדמים נקודות זמן נוספות, מחזירים את צלחת המיקרוטיטר 96 בארות עם קולונואידים לאינקובטור ב 37 ° C, 5% CO2.
5. ניתוח תמונות
- פתח את Fiji ImageJ וייבא את ערכת נתוני התמונה על-ידי גרירה ושחרור של הקבצים בסרגל הכלים ImageJ או ניווט אל File | פתח ובחר את הקבצים. לאחר הפתיחה, שלב את הקבצים לאוסף תמונות על-ידי לחיצה על תמונה| ערימות | תמונות לערימה. המר את אוסף התמונות לתבנית קובץ של 8 סיביות על-ידי לחיצה על תמונה| סוג| 8 סיביות.
- לכל ערכת תמונות, לחצו על הכלי בחירות חופשיות בסרגל הכלים ImageJ ובחרו ידנית באזור העניין (ROI) בתמונת השידור באמצעות עכבר המחשב; החזר ההשקעה הוא היקף הקולונואיד. לאחר מכן, עברו בין אוסף התמונות לתמונת ערוץ GFP המתאימה.
- לחץ על נתח | קביעת מדידות; בחלון הדו-שיח ' קביעת מדידות' , סמן את האפשרות 'ערך אפור ממוצע ' והשאר את כל שאר התיבות לא מסומנות. כשתמונת GFP נבחרה, לחץ על נתח | למדוד. חזור על ניתוח זה עבור כל קולונואיד בערימת התמונות. לאחר ניתוח ערכת הנתונים, העתק את כל הנתונים בחלון התוצאות והדבק אותם ביישום תוכנת גיליון אלקטרוני.
6. חישוב רעילות מקסימלית %
- חשב את הממוצע של הערכים האפורים הממוצעים (MGV) עבור כל תנאי באמצעות משוואה (1).
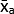 (ממוצע הטיפול א) =
(ממוצע הטיפול א) = 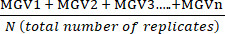 (1)
(1) - בטא את הממוצע של כל תנאי כאחוז ביחס לממוצע של תנאי רעילות מרבית (MT) באמצעות משוואה (2).
%MTa =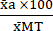 (2)
(2)
7. חישוב מדד המחירים לצרכן
- נרמול (NORM) של הנתונים באופן הבא, באמצעות הערכים הממוצעים המחושבים בשלב 6.1, החסרו את הממוצע של המצב הלא מטופל (UT) מכל תנאי טיפול ואת תנאי הרעילות המרבית (MT) (כדי להסיר את מוות תאי הרקע המתרחש ללא תלות בטיפול בציטוקינים). לאחר מכן, חלק כל תנאי טיפול בממוצע הרקע של תנאי רעילות מרבית (MT) כפי שמוצג במשוואה (3).
נורמהa =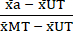 (3)
(3) - חסר את הערכים המנורמלים המחושבים בשלב 7.1 מ- 1; הערכים המתקבלים מייצגים את כדאיות התא (V) לאחר הטיפול (כמו במשוואה (4) להלן).
Va = 1 −NORMa (4) - חשב את מקדם האינטראקציה perturbagen (CPI) באמצעות משוואה (5):
מדד המחירים לצרכן =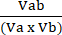 (5)
(5)
כאשר A מציין את הטיפול הראשון; B מציין את הטיפול השני; ו-AB הוא הטיפול המשולב. ערכי מדד המחירים לצרכן מציינים קשרים סינרגטיים (<1), תוספים (=1) או אנטגוניסטיים (>1).
Representative Results
באמצעות פרוטוקול זה, הדגמנו כיצד ניתן להשתמש בקולונידים של חולי CD כדי לחקור את ההשפעות ציטוטוקסיות של הציטוקינים הרלוונטיים ל- IBD IFN-γ ו- TNF-α על אפיתל ראשוני. השתמשנו בצבע מוות פלואורסצנטי זמין מסחרית (SYTOX Green Nucleic Acid Stain), שיכול להיכנס רק לתאים בעלי קרום תא פגוע, שם הוא מופעל על-ידי קשירה לחומצות גרעין. טיפלנו יחד בקולונואידים עם ציטוקינים וצבע המוות של תאים פלואורסצנטיים וביצענו הדמיה חיה של תאים ב-8 שעות וב-24 שעות במיקרוסקופ אפיפלואורסצנטי הפוך. תמונות כיסוי שידור/פלורסנט מייצגות בשעה 8 שעות מצביעות על כך שרק הקולונואידים המטופלים ב- IFN-γ + TNF-α חיוביים לאות פלואורסצנטי; אולם יש רק מספר קטן של תאים פלואורסצנטיים (איור 2A). Blebing תאים, אינדיקטור מורפולוגי של מוות תאי20, ניתן לראות גם במצב IFN-γ + TNF-α. לאחר 24 שעות, קולונואידים שטופלו ב-IFN-γ + TNF-α מציגים אזורים גדולים חיוביים לאות פלואורסצנטי (איור 2A). יש גם התמוטטות ברורה במורפולוגיה של הקולונואיד - הלומן המרכזי אינו נראה עוד, ומחסום האפיתל שובש לחלוטין.
כדי לכמת את אות צבע המוות של התא, השתמשנו בתוכנת ניתוח תמונות בקוד פתוח כדי לחשב את עוצמת הפלואורסצנט של כל קולונואיד. לאחר מכן נרמלנו את הנתונים על ידי ביטוי הממוצע של כל מצב כאחוז מהטיפול ברעילות מרבית. לאחר 8 שעות, מוות הומיאוסטטי או תאי רקע בקולונואידים של בקרת BSA היה נמוך יחסית (7.7% מהרעילות המרבית) (איור 2B). לא היו שינויים מובהקים סטטיסטית ברמות המוות של תאים בשלב זה; אולם מצבים שטופלו ב-TNF-α הראו עלייה קטנה בציטוטוקסיות (איור 2B). לאחר 24 שעות, רמות המוות של תאים עלו בכל המצבים שטופלו בציטוקינים. עם זאת, היה שינוי מזערי במוות תאי עבור מצב בקרת BSA בין נקודות זמן (7.5% מהרעילות המרבית לאחר 24 שעות). הקולונואידים שטופלו ב- IFN-γ + TNF-α היו בעלי העלייה הגדולה ביותר ברמות המוות של תאים בהשוואה לבקרת BSA (29.4% מהרעילות המרבית). ההבדל ברמות המוות התאית בין הטיפול המשולב לבין הטיפול בציטוקינים בודדים (IFN-γ, TNF-α) היה משמעותי ביותר. תוצאות אלה מצביעות על האפשרות של אינטראקציה סינרגטית ציטוטוקסית בין IFN-γ ו- TNF-α לאחר 24 שעות.
השתמשנו במדד המחירים לצרכן כדי לכמת את האינטראקציות ציטוטוקסיות בין טיפולי ציטוקינים ולקבוע אם הם סינרגטיים. אינטראקציות בין ציטוקינים נחשבות סינרגטיות כאשר ערך המדד הוא <1, תוסף כאשר =1, או אנטגוניסטי כאשר >1. חישבנו את ערכי מדד המחירים לצרכן לכל נקודת זמן (איור 2C). ב-8 שעות, ערך המדד הצביע על סינרגיזם קל (0.99), כאשר ערך המדד ירד משמעותית ב-24 שעות (0.83). ניתוח זה אישר כי האינטראקציה בין IFN-γ ו- TNF-α ב -24 שעות הייתה סינרגטית. יתר על כן, הוא ממחיש כיצד בהקשר זה סינרגיזם בין IFN-γ ו- TNF-α תלוי זמן.
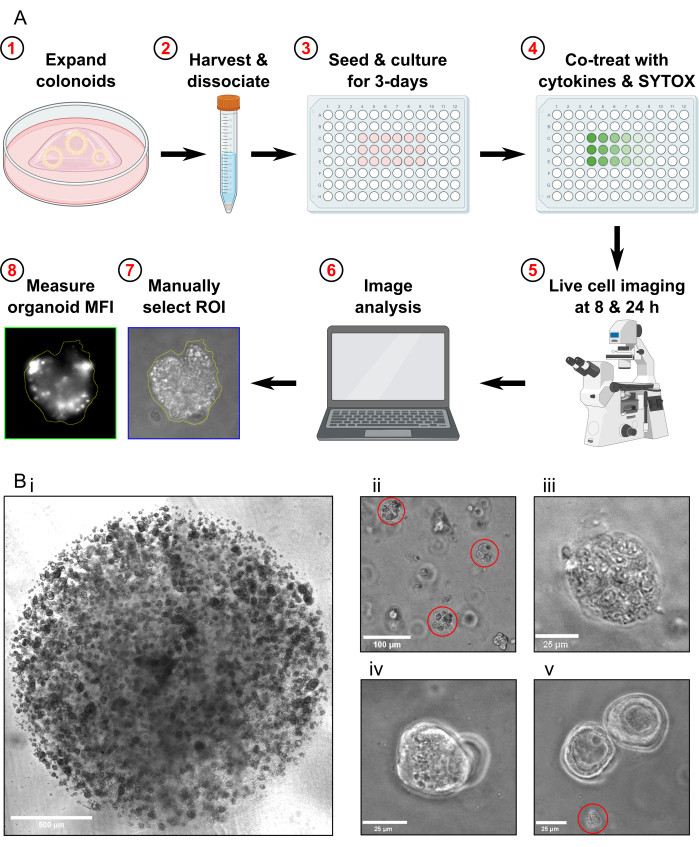
איור 1: סכמטיות של זרימת עבודה ניסיונית ופתרון בעיות. (A) סקירה סכמטית של פרוטוקול. (ב) תמונות מייצגות. (בי) תמונה במיקרוסקופ אור הממחישה את הצפיפות האופטימלית של התרבית ואת הגודל האופטימלי של קולונואידים לפני המעבר לבדיקה. סרגל קנה מידה = 500 מיקרומטר. (Bii) תמונת מיקרוסקופ אור הממחישה גודל אופטימלי של מקטעי קולונואידים לאחר דיסוציאציה; קטעים מודגשים באדום. סרגל קנה מידה = 100 מיקרומטר. (Biii) תמונה במיקרוסקופ אור של מורפולוגיית קולונואיד נמקית לאחר טיפול MT (עם Triton X-100). סרגל קנה מידה = 25 מיקרומטר. (Biv) תמונה במיקרוסקופ אור של שני קולונואידים החופפים באותו מישור מוקד. סרגל קנה מידה = 25 מיקרומטר. (Bv) תמונה במיקרוסקופ אור של פסולת תאי קולונואיד נוכחים לאחר מעבר; פסולת מודגשת באדום. סרגל קנה מידה = 25 מיקרומטר. קיצורים: החזר השקעה = אזור עניין; MFI = עוצמת פלואורסצנטיות ממוצעת; MT = רעילות מרבית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
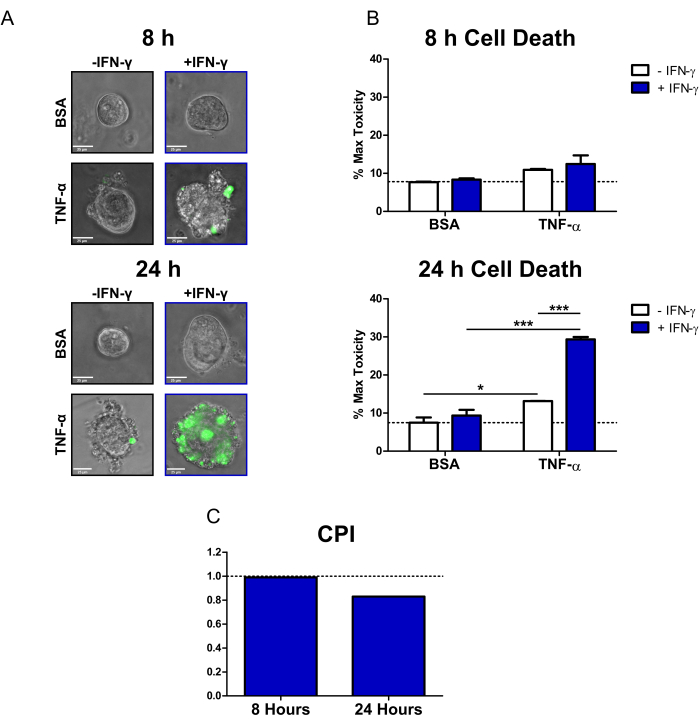
איור 2: ניתוח כמותי של מוות תאי המושרה על-ידי ציטוקינים בקולוניואידים של CD בבני אדם. (A) תמונות מיקרוסקופיות חיות מייצגות של קולונואידי CD שטופלו בכתם חומצת גרעין ירוקה SYTOX (צבע מוות של תאים פלואורסצנטיים) וציטוקינים בשעה 8 ו-24 שעות; ערוצי שידור ו- GFP (צבע ירוק) שכבת-על. קולונואידים טופלו באופן הבא: 1) PBS/BSA, 2) 10 ng/mL IFN-γ, 3) 10 ng/mL TNF-α, 4) 10 ng/mL IFN-γ + 10 ng/mL TNF-α. פסי קנה מידה = 25 מיקרומטר. (B) ניתוח כמותי של קולונואידים CD שטופלו בצבע מוות של תאים פלואורסצנטיים וציטוקינים בשעה 8 ו-24 שעות; הנתונים מבוטאים כאחוז ממצב MT. N = 2 קווי קולונואיד CD, 11-16 קולונואידים מצולמים לכל מצב. (C) מדד המחירים לצרכן מחושב לפי נקודת זמן באמצעות מערך הנתונים מקווי קולונואיד B, N = 2 CD. הנתונים באים לידי ביטוי כאמצעים ± SE. ב- B, ניתוח ANOVA דו-כיווני בוצע ואחריו בדיקות בונפרוני לאחר מכן, *P < 0.05, ***P < 0.001 כפי שצוין. קיצורים: CD = מחלת קרוהן; GFP = חלבון פלואורסצנטי ירוק; מדד המחירים לצרכן = מקדם האינטראקציה perturbagen; PBS = מלח חוצץ פוספט; BSA = אלבומין בסרום בקר; TNF-α = גורם נמק גידולי-אלפא; IFN-γ = אינטרפרון-גמא; MT = רעילות מרבית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: הרכב אמצעי תרבות לפרוטוקול. להכנת Organoid Proliferation Media, שלבו מדיה מותנית L-WRN עם מדיה ללא סרום 1:1, ולאחר מכן הוסיפו תוספים. יש להשתמש ב-Organoid Proliferation Media תוך שבועיים מרגע ההכנה. שים לב שכל המדיה המלאה צריכה להיות מאוחסנת ב- 4 ° C. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 2: פריסת צלחות ניסיונית של 96 בארות וטיפולי ציטוקינים. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
פותחו מספר שיטות לניתוח כמותי של מוות תאי באורגנואידים במעי. בחינת השיבוש במורפולוגיית אורגנואיד המעי על ידי מיקרוסקופ אור היא גישה פשוטה לכימות ההשפעות של חומרים ציטוטוקסיים11. עם זאת, שינויים מורפולוגיים אינם מדידה ישירה של מוות תאי, והשיטה היא כמותית למחצה בלבד. שיטה נוספת היא להעריך פעילות מטבולית אורגנואידית באמצעות בדיקת MTT או ATP10,11. חשוב לציין כי בדיקות אלה יכולות לקבוע רק שינויים בכדאיות התא ויש לאמת אותן באמצעות בדיקת מוות תאי. בדיקות מוות פלואורומטריות אחרות של תאים באמצעות צבעים קושרי DNA דווחו12,13. גישה ללא הדמיה באמצעות קורא מיקרו-לוחות פלואורסצנטי אפשרית ומאפשרת תפוקה גבוהה12. עם זאת, שיטה זו מודדת את האות הממוצע של באר שלמה, מה שהופך אותה ללא מתאימה לאוכלוסיות הטרוגניות. זה גם דורש שימוש בקורא microplate עם התאמת גובה Z. ניתן להשתמש בטכניקות מבוססות הדמיה פלואורסצנטית לניתוח אורגנואיד יחיד וללכידת נתונים תאיים/תת-תאיים ומורפולוגיים. מערכות הדמיה קונפוקליות אוטומטיות בעלות תוכן גבוה (HCI) יכולות להפיק כמויות גדולות של נתונים בתפוקה גבוהה13. למרבה הצער, HCI קונפוקלי זקוק לציוד מיוחד, משתמש בפרוטוקולים מורכבים, בדרך כלל דורש תוכנת ניתוח תמונה מסחרית, והוא יקר.
הפרוטוקול שלנו לניתוח כמותי של מוות תאי קולונואיד במספר נקודות זמן הוא פשוט, פשוט וזול. עם זאת, בהשוואה למערכות HCI אוטומטיות וקורא צלחות, היא גוזלת זמן ומפחיתה את התפוקה. מגבלה נוספת של השיטה שלנו היא השימוש בשדה רחב לעומת מיקרוסקופיה קונפוקלית. מיקרוסקופ קונפוקלי מתאים יותר להדמיית דגימות תלת-ממדיות עבות כגון אורגנואידים מכיוון שהוא מפחית אות מחוץ למיקוד ויכול לרכוש מקטעים אופטיים טוריים (ערימות Z). עם זאת, הדמיה קונפוקלית דורשת בדרך כלל זמני רכישה ארוכים יותר ולייזרים בעוצמה גבוהה המגבירים את הפוטוטוקסיות / הלבנה. חשוב לציין כי צבעי מוות פלואורסצנטיים של תאים כמו SYTOX Green מתאימים רק למדידת צורות של מוות תאי כאשר יש אובדן שלמות קרום התא כגון נמק, נמק משני מאוחר הקשור לאפופטוזיס, נקרופטוזיס ופירופטוזיס21. ישנן כמה צורות של מוות תאי מוסדר שבו קרום התא נשאר בלתי חדיר לפחות בשלבים המוקדמים של מוות תאי, כגון אפופטוזיס תלוי קספאז. עם זאת, פרוטוקול זה יכול להיות שונה בקלות כדי לשלב גם הדמיה של קספז 3/7 פעילות פלואורסצנטית כתב22. זה יספק נתונים נוספים שיעזרו לאפיין את שיטת המוות התאית הספציפית.
השתמשנו בפרוטוקול שלנו כדי להדגים את האינטראקציה הסינרגטית ציטוטוקסית בין הציטוקינים IFN-γ ו-TNF-α (איור 2C), עליה דיווחנו בעבר באורגנואידים 9,10 שמקורם בחולי CD. הרלוונטיות הפיזיולוגית של צורה זו של סינרגיזם הודגמה גם במודלים מורינים של לימפוהיסטיוציטוזה המופגוציטית ואלח דם23. מספר מודלים וגישות ייחוס מתמטיות יושמו לכימות סינרגיה בין שילובים של חומרים ביולוגיים 24,25. הם נבדלים זה מזה מבחינת מורכבותם, מספר הגורמים שהם לוקחים בחשבון, והסף להחשיב אינטראקציה כסינרגטית24,25. מודלים מסוימים דורשים ידע מוקדם על החומרים הביולוגיים שנבדקו, מניחים הנחות מסוימות לגבי פעילות הסוכנים, ויכולים לדרוש עקומות מנה-תגובה מקיפות לכל טיפול יחיד ומשולב25. השיטה שבחרנו למדידת סינרגיה היא שינוי של מודל מקדם האינטראקציה התרופתי (CDI), ששימש בעבר למדידת ההשפעות המעכבות של שילובי תרופות כימותרפיות על התפשטות קו תאים סרטניים26. ה-CDI הוא מודל עצמאות של בליס; כאשר מחשבים את ההשפעה המשולבת החזויה של שתי הפרעות, עצמאות בליס מניחה שהן מכוונות למסלולים נפרדים ויש להן מנגנוני פעולה עצמאיים27. כדי שאינטראקציה בין הפרעות תהיה סינרגטית, ההשפעה המשולבת בפועל חייבת להיות גדולה יותר מהאפקט החזוי. מודל זה מתאים למערך הניסויי שלנו מכיוון ש- IFN-γ ו- TNF-α ידועים כבעלי קולטנים שונים ורכיבי איתות במורד הזרם. יתר על כן, עצמאות בליס מאפשרת חישוב מקדם אינטראקציה לכימות סינרגיזם ואינה דורשת מערכי נתונים של תגובת מינון.
ישנם מספר גורמי מפתח שיש לקחת בחשבון כדי להבטיח תוצאות אופטימליות עבור פרוטוקול זה. חשוב שקולונואידים יופצו לצפיפות גבוהה (איור 1Bi), שהם בקוטר של כ-25-50 מיקרומטר, והם מתרבים באופן פעיל לפני שהם מנסים לזרוע תאים. השימוש בתרביות תת-אופטימליות של קולונואידים לבדיקות עלול לגרום למספר תאים לא מספיק, התאוששות קולונואידים נמוכה וניסויים לא עקביים. לקבלת תוצאות הניתנות לשחזור, חשוב גם לזרוע את צפיפות הקולונואידים באופן עקבי בין ניסויים. הוכח בעבר כי תגובת המבחנה לציטוקינים דלקתיים יכולה להיות מושפעת מצפיפות זריעת תאים28,29. בעיה נפוצה נוספת היא היווצרות בועות אוויר בכיפת BME, אשר יכולות להשפיע על ההדמיה. ניתן למנוע זאת על ידי שימוש בטכניקת הפיפטינג ההפוך. טכניקה זו גם מביאה לזריעה עקבית יותר.
יתר על כן, אם מדמים מספר נקודות זמן, הכינו תנאי רעילות מרבית לכל נקודת זמן. Triton-X 100, חומר פעילי שטח לא יוני, משמש בדרך כלל כבקרה חיובית (תנאי רעילות מרבית) עבור בדיקות ציטוטוקסיות. התוספת של Triton-X 100 שוכבת והורגת את הקולונואידים, ומאפשרת לצבע המוות הפלואורסצנטי להיכנס לתאים. שימוש בתנאי רעילות מרבית מנקודת זמן מוקדמת יותר יגרום לנורמליזציה לא מדויקת ולא עקבית של נתונים עקב דעיכת האות הפלואורסצנטי לאורך זמן.
נקודה אחרונה שיש לקחת בחשבון היא הבחירה של BME המשמש לתרבית קולונואידים. ישנם מספר יצרנים מסחריים של BME; עם זאת, עבור הפרוטוקול שלנו, בדקנו רק את המותג הכלול בטבלת החומרים. מחקר שנערך לאחרונה באמצעות אורגנואידים של סרטן הלבלב שמקורם בחולים מצא כי המקור המסחרי של BME שינה את שיעורי התרבות התא, אך לא הייתה לו השפעה משמעותית על התגובה לתרופות כימותרפיות או ביטוי גנים30. בהתחשב בכך, אנו מצפים שמגמת התוצאות תהיה דומה בין מותגי BME עבור הפרוטוקול שלנו, אך אנו ממליצים להשתמש באותו מותג באופן עקבי.
הדגמנו כיצד פרוטוקול זה יכול לשמש לניתוח של IFN-γ ו- TNF-α המושרה למוות תאי באמצעות קולונואידים שמקורם בחולה CD. אורגנואידי מעיים שמקורם במטופל הם כלי רב עוצמה לחקר CD מכיוון שהם שומרים על מאפיינים רבים של המחלה, כולל רגישות מוגברת להשפעות ציטוטוקסיות של TNF-α31. עם זאת, ניתן לשנות את הפרוטוקול בקלות כדי לחקור השפעות ציטוטוקסיות של הפרעות שאינן ציטוקינים או מצבי מחלה שאינם IBD כגון סרטן המעי הגס (בדקנו בהצלחה את הפרוטוקול באמצעות קולונואידים שאינם IBD). אנו מאמינים ששיטה זו שימושית לכל תחום מחקר העוסק במנגנוני מוות תאי, תפקוד מחסום אפיתל או אימונולוגיה של רירית המעי.
Disclosures
ק.נ. קיבלה מימון מחקר מחברת AbbVie Inc. בזמן השלמת העבודה. מימון זה היה במסגרת פרס של מרכז מחקר (SFI-14/SP/2710) ל-APC Microbiome Ireland.
Acknowledgements
המחברים מבקשים להודות למטופלים על הסכמתם מדעת והשתתפותם במחקר, ולצוות הקליני על עזרתם המצוינת. איור 1A נוצר באמצעות BioRender.com. עבודה זו נתמכה על ידי מענקים מקרן המדע אירלנד - כלומר פרס פיתוח קריירה (CDA) ל- K.N. (SFI-13 / CDA / 2171), מענק מרכז מחקר (SFI-12 / RC / 2273), ופרס דיבר מרכז מחקר (SFI-14 / SP / 2710) ל- APC Microbiome אירלנד. פ.פ. קיבל מימון גם מ-SFI/20/RP/9007.
Materials
| Name | Company | Catalog Number | Comments |
| Advanced DMEM/F12 | Gibco | 12634010 | |
| Amphotericin B Solution | Sigma-Merck | A2942 | |
| A-83-01 | Sigma-Merck | SML0788 | |
| BioRender | Science Suite Inc. | N/A | Scientific illustration software |
| Bovine Serum Albumin | Sigma-Merck | A2058 | Essentially IgG-free, low endotoxin |
| B27 Supplement | Invitrogen | 17504-044 | |
| CHIR-99021 | Sigma-Merck | SML1046 | |
| Costar 48-well Clear TC-treated Multiple Well Plates, Individually Wrapped, Sterile | Corning | 3548 | |
| Cultrex Basement Membrane Extract, Type 2, Pathclear | R&D Systems | 3532-010-02 | Basement membrane extract |
| Dimethyl sulfoxide | Sigma-Merck | D2650 | |
| Dulbecco′s Phosphate Buffered Saline | Sigma-Merck | D8537 | |
| EVOS FL Digital Inverted Fluorescence Microscope | Invitrogen | AMF4300 | Digital inverted epifluorescence microscope |
| EVOS 40x Objective, fluorite, LWD, phase-contrast | ThermoFisher Scientific | AMEP4683 | Long working distance 40x fluorescence objective |
| Fiji/ImageJ (Windows version) | Open-source software | N/A | Image analysis software |
| Foetal Bovine Serum | Sigma-Merck | F9665 | |
| Gentamicin Solution | Sigma-Merck | G1397 | |
| Gentle Cell Dissociation Reagent | STEMCELL Technologies | 100-0485 | Enzyme-free cell dissociation reagent |
| GlutaMAX-1 | Gibco | 35050061 | L-alanyl-L-glutamine dipeptide supplement |
| GraphPad Prism 5 (Windows version) | Dotmatics | N/A | Data graphics and statistics software |
| Greiner 15 mL Polypropylene Centrifuge Tube, Sterile with conical bottom & Screw Cap | Cruinn | 188261CI | |
| HEPES 1 M | Gibco | 15630080 | |
| Human recombinant EGF (animal free) | Peprotech | AF-100-15 | |
| N-Acetylcysteine | Sigma-Merck | A9165 | |
| Nicotinamide | Sigma-Merck | N0636 | |
| Normocin | InvivoGen | ant-nr-05 | Broad range antimicrobial reagent |
| Nunc Edge 96-Well, Nunclon Delta-Treated, Flat-Bottom Microplate | ThermoFisher Scientific | 15543115 | |
| N2 supplement | Invitrogen | 17502-048 | |
| Recombinant Human IFN-gamma Protein | R&D Systems | 285-IF | Resuspend in sterile filtered 0.1% PBS/BSA |
| Recombinant Human TNF-alpha Protein | R&D Systems | 210-TA | Resuspend in sterile filtered 0.1% PBS/BSA |
| SB202190 | Sigma-Merck | S7067 | |
| Snap Cap Low Retention Microcentrifuge Tubes | ThermoFisher Scientific | 3451 | |
| SYTOX Green Nucleic Acid Stain - 5 mM Solution in DMSO | Invitrogen | S7020 | Fluorescent cell death dye, protect from light |
| Triton X-100 | Sigma-Merck | 93420 | |
| Trypan Blue solution | Sigma-Merck | T8154 | |
| Tryple Express | Gibco | 12604013 | Enzymatic dissociation reagent |
| Y-27632 | MedChemExpress | HY-10071 | Inhibitor of ROCK-I and ROCK-II |
References
- Patankar, J. V., Becker, C. Cell death in the gut epithelium and implications for chronic inflammation. Nat Rev Gastroenterol Hepatol. 17 (9), 543-556 (2020).
- Zeissig, S., et al. Downregulation of epithelial apoptosis and barrier repair in active Crohn's disease by tumour necrosis factor alpha antibody treatment. Gut. 53 (9), 1295-1302 (2004).
- Bartee, E., Mcfadden, G. Cytokine synergy: An underappreciated contributor to innate anti-viral immunity. Cytokine. 63 (3), 237-240 (2013).
- Fish, S. M., Proujansky, R., Reenstra, W. W. Synergistic effects of interferon γ and tumour necrosis factor α on T84 cell function. Gut. 45 (2), 191-198 (1999).
- Wakisaka, Y., Sugimoto, S., Sato, T. Organoid medicine for Inflammatory Bowel Disease. Stem Cells. 40 (2), 123-132 (2022).
- Flood, P., Hanrahan, N., Nally, K., Melgar, S. Human intestinal organoids: Modeling gastrointestinal physiology and immunopathology - current applications and limitations. Eur J Immunol. 54 (2), e2250248 (2024).
- Matsuzawa-Ishimoto, Y., et al. An intestinal organoid-based platform that recreates susceptibility to t-cell-mediated tissue injury. Blood. 135 (26), 2388-2401 (2020).
- Lee, C., et al. Intestinal epithelial responses to IL-17 in adult stem cell-derived human intestinal organoids. J Crohns Colitis. 16 (12), 1911-1923 (2022).
- Woznicki, J. A., et al. TNF-α synergises with IFN-γ to induce caspase-8-JAK1/2-STAT1-dependent death of intestinal epithelial cells. Cell Death Dis. 12 (10), 864 (2021).
- Flood, P., et al. DNA sensor-associated type I interferon signaling is increased in ulcerative colitis and induces jak-dependent inflammatory cell death in colonic organoids. Am J Physiol Gastrointest Liver Physiol. 323 (5), G439-G460 (2022).
- Grabinger, T., et al. Ex vivo culture of intestinal crypt organoids as a model system for assessing cell death induction in intestinal epithelial cells and enteropathy. Cell Death Dis. 5 (5), e1228 (2014).
- Bode, K. J., Mueller, S., Schweinlin, M., Metzger, M., Brunner, T. A fast and simple fluorometric method to detect cell death in 3D intestinal organoids. Biotechniques. 67 (1), 23-28 (2019).
- Mertens, S., et al. Drug-repurposing screen on patient-derived organoids identifies therapy-induced vulnerability in KRAS-mutant colon cancer. Cell Rep. 42 (4), 112324 (2023).
- Vandussen, K. L., et al. Development of an enhanced human gastrointestinal epithelial culture system to facilitate patient-based assays. Gut. 64 (6), 911-920 (2015).
- Miyoshi, H., Stappenbeck, T. S. In vitro expansion and genetic modification of gastrointestinal stem cells in spheroid culture. Nat Protoc. 8 (12), 2471-2482 (2013).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Woznicki, J. A., et al. Human BCL-G regulates secretion of inflammatory chemokines but is dispensable for induction of apoptosis by IFN-γ and TNF-α in intestinal epithelial cells. Cell Death Dis. 11 (1), 68 (2020).
- Edgar, R. D., et al. Culture-associated DNA methylation changes impact on cellular function of human intestinal organoids. Cell Mol Gastroenterol Hepatol. 14 (6), 1295-1310 (2022).
- Mubaid, F., Brown, C. M. Less is more: Longer exposure times with low light intensity is less photo-toxic. Microscopy Today. 25 (6), 26-35 (2017).
- Ziegler, U., Groscurth, P. Morphological features of cell death. News Physiol Sci. 19 (3), 124-128 (2004).
- Zhang, Y., Chen, X., Gueydan, C., Han, J. Plasma membrane changes during programmed cell deaths. Cell Res. 28 (1), 9-21 (2018).
- Tamura, H., et al. Evaluation of anticancer agents using patient-derived tumor organoids characteristically similar to source tissues. Oncol Rep. 40 (2), 635-646 (2018).
- Karki, R., et al. Synergism of TNF-α IFN-γ triggers inflammatory cell death, tissue damage, and mortality in SARS-CoV-2 infection and cytokine shock syndromes. Cell. 184 (1), 149-168 (2021).
- Geary, N. Understanding synergy. Am J Physiol Endocrinol Metab. 304 (3), E237-E253 (2013).
- Duarte, D., Vale, N. Evaluation of synergism in drug combinations and reference models for future orientations in oncology. Curr Res Pharmacol Drug Discov. 3, 100110 (2022).
- Wong, F. C., Woo, C. C., Hsu, A., Tan, B. K. The anti-cancer activities of Vernonia amygdalina extract in human breast cancer cell lines are mediated through caspase-dependent and p53-independent pathways. PLoS One. 8 (10), e78021 (2013).
- Ryall, K. A., Tan, A. C. Systems biology approaches for advancing the discovery of effective drug combinations. J Cheminform. 7, 7 (2015).
- Sukho, P., et al. Effect of cell seeding density and inflammatory cytokines on adipose tissue-derived stem cells: An in vitro study. Stem Cell Rev Rep. 13 (2), 267-277 (2017).
- Vaughan-Jackson, A., et al. Density dependent regulation of inflammatory responses in macrophages. Front Immunol. 13, 895488 (2022).
- Lumibao, J. C., et al. The impact of extracellular matrix on the precision medicine utility of pancreatic cancer patient-derived organoids. bioRxiv. , (2023).
- Lee, C., et al. TNF-α induces LGR5+ stem cell dysfunction in patients with Crohn's disease. Cell Mol Gastroenterol Hepatol. 13 (3), 789-808 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved