Quantificazione della morte cellulare indotta da citochine in organoidi del colon umano mediante microscopia a fluorescenza dal vivo
In This Article
Summary
Questo protocollo descrive un metodo semplice ed economico per studiare e quantificare la morte cellulare negli organoidi del colon umano in risposta a perturbageni citotossici come le citochine. L'approccio impiega un colorante fluorescente per la morte cellulare (SYTOX Green Nucleic Acid Stain), la microscopia a fluorescenza dal vivo e un software di analisi delle immagini open source per quantificare le risposte di singoli organoidi a stimoli citotossici.
Abstract
La morte delle cellule epiteliali intestinali (IEC) è aumentata nei pazienti con malattie infiammatorie intestinali (IBD) come la colite ulcerosa (UC) e il morbo di Crohn (CD). Ciò può contribuire a difetti nella funzione della barriera intestinale, esacerbazione dell'infiammazione e immunopatogenesi della malattia. Le citochine e i ligandi del recettore della morte sono parzialmente responsabili di questo aumento della morte per IEC. Le citochine rilevanti per le IBD, come il TNF-α e l'IFN-γ, sono citotossiche per le IEC sia indipendentemente che in combinazione. Questo protocollo descrive un test semplice e pratico per quantificare la citotossicità indotta da citochine in organoidi del colon derivati da pazienti con CD utilizzando un colorante fluorescente per la morte cellulare (SYTOX Green Nucleic Acid Stain), microscopia a fluorescenza dal vivo e software di analisi delle immagini open source. Dimostriamo anche come utilizzare il modello matematico di indipendenza di Bliss per calcolare un coefficiente di interazione perturbagena (CPI) basato sulla citotossicità degli organoidi. Il CPI può essere utilizzato per determinare se le interazioni tra combinazioni di citochine o altri tipi di perturbageni sono antagoniste, additive o sinergiche. Questo protocollo può essere implementato per studiare l'attività citotossica di citochine e altri perturbageni utilizzando organoidi del colon derivati da pazienti.
Introduction
L'epitelio intestinale crea una barriera fisica semipermeabile tra il contenuto del lume intestinale e i tessuti sottostanti. Per mantenere efficacemente questa barriera, le cellule epiteliali intestinali (IEC) subiscono un turnover cellulare estremamente elevato, con un ciclo continuo di morte e rigenerazione cellulare. Tuttavia, durante i disturbi infiammatori, come la malattia infiammatoria intestinale (IBD), si verificano livelli più elevati di morte cellulare aberrante1. Ciò può favorire un'interruzione della funzione di barriera e dell'attivazione del sistema immunitario, innescando un'ulteriore infiammazione. Nella malattia di Crohn (CD), una forma di IBD, è stato dimostrato che la segnalazione delle citochine contribuisce all'aumento dei livelli di morte per IEC2. Studiando come la segnalazione delle citochine induce la morte cellulare delle IEC, si spera che possano essere sviluppati trattamenti migliori per i pazienti con IBD e altri disturbi infiammatori intestinali1.
In biologia e nella ricerca sulla scoperta di bersagli farmacologici, la sinergia è generalmente intesa quando un sistema biologico trattato con combinazioni di stimoli individuali mostra una risposta alla combinazione che è maggiore degli effetti additivi combinati dei singoli stimoli da soli. È stato ben documentato che le interazioni sinergiche tra citochine guidano le risposte antivirali innate3. È anche noto che le citochine inducono sinergicamente la morte cellulare, anche nelle IEC4. Tuttavia, il ruolo sinergico della segnalazione citotossica delle citochine nei disturbi infiammatori intestinali come l'IBD è poco studiato.
Gli organoidi intestinali umani sono microtessuti 3D prodotti in vitro che vengono generati da cellule staminali epiteliali intestinali. Gli organoidi intestinali possono essere coltivati da biopsie della mucosa intestinale ottenute da pazienti con IBD e conservano molte caratteristiche della malattia 5,6. Gli organoidi hanno dimostrato di essere un sistema modello ideale per lo studio della citotossicità delle citochine nel contesto dell'infiammazione intestinale 7,8. In precedenza, il nostro gruppo ha caratterizzato gli effetti di uccisione sinergica delle citochine rilevanti per le IBD IFN-γ e TNF-α in organoidi del colon derivati da pazienti con MC (colonoidi)9,10. Tuttavia, gli esatti meccanismi coinvolti nella mediazione di questa forma di morte cellulare sinergica rimangono sfuggenti. Ci sono anche potenzialmente molte altre interazioni citotossiche citotossiche non caratterizzate che sono rilevanti per i disturbi infiammatori intestinali.
Sono disponibili diversi protocolli per studiare la morte cellulare negli organoidi intestinali 10,11,12,13; Tuttavia, ognuno di essi presenta degli svantaggi. Alcune di queste tecniche misurano solo la vitalità cellulare e non misurano direttamente la morte cellulare, non sono in grado di valutare le risposte di singoli organoidi o richiedono attrezzature costose e protocolli complessi. Sono necessarie metodologie robuste e semplici per quantificare la morte cellulare degli organoidi e le interazioni perturbagene negli organoidi intestinali. Il protocollo che presentiamo è un approccio semplice ed economico per misurare le risposte di singoli organoidi alle citochine citotossiche, ma può essere utilizzato per qualsiasi tipo di stimolo o perturbageno. Dimostriamo anche come utilizzare il modello di sinergia dell'indipendenza di Bliss per calcolare un coefficiente di interazione perturbagena (CPI) che descrive le interazioni citotossiche delle citochine.
Protocol
Le biopsie della mucosa del colon sono state raccolte da pazienti con MC sottoposti a colonscopia di routine come parte dello standard di cura. L'approvazione etica per l'uso di campioni di tessuto dei pazienti e la generazione di linee di organoidi del colon da questi campioni è stata ottenuta dal Comitato Etico per la Ricerca Clinica degli Ospedali Universitari di Cork (CREC). Il consenso informato scritto è stato ottenuto da tutti i pazienti in accordo con la Dichiarazione di Helsinki. Tutto il lavoro di coltura tissutale con biopsie e colonoidi del paziente deve essere eseguito all'interno di una cabina di biosicurezza seguendo i protocolli di sicurezza BSL2. Assicurarsi che tutta l'usura della plastica sia sterile prima dell'uso. Vedere la Tabella dei materiali per i dettagli relativi a tutti i materiali, i reagenti, gli strumenti e il software utilizzati in questo protocollo.
I protocolli utilizzati dal nostro gruppo per l'isolamento delle cripte e la coltura di organoidi sono stati adattati dai metodi stabiliti 14,15,16 e sono stati pubblicati in precedenza 9,10,17. Per il seguente protocollo, i colonoidi sono stati coltivati utilizzando terreni di proliferazione degli organoidi (Tabella 1). I colonoidi coltivati utilizzando i terreni di proliferazione degli organoidi sono indifferenziati e arricchiti per le cellule staminali del colon. Il componente principale dei terreni di proliferazione degli organoidi è il 50% di terreno condizionato con L-WRN, che contiene i fattori di crescita della nicchia delle cellule staminali intestinali Wnt-3A (W), R-spondina 3 (R) e Noggin (N)15. I terreni di proliferazione degli organoidi vengono preparati combinando terreni condizionati con L-WRN e terreni privi di siero 1:1, seguiti da un'integrazione con nicotinamide e inibitori chimici (Tabella 1).
1. Isolamento delle cripte del colon e coltura colonoide
- Preincubare una piastra per microtitolazione a 48 pozzetti a 37 °C, 5% CO2 per un minimo di 72 ore prima di seminare con cripte.
NOTA: La preincubazione della piastra accelera la polimerizzazione dell'estratto della membrana basale (BME) durante la semina. - Scongelare il BME su ghiaccio a 4 °C la sera prima dell'isolamento delle cripte.
- Raccogliere le biopsie del colon in una provetta per la raccolta dei campioni contenente 15 mL di terreno per la raccolta delle biopsie (Tabella 1) e conservarle a 4 °C fino al momento dell'elaborazione.
- Rimuovere con cautela la maggior quantità possibile di terreno di raccolta per biopsia utilizzando una pipetta. Lavare le biopsie aggiungendo 15 mL di DPBS ghiacciato integrato con 2,5 μg/mL di amfotericina B e 100 μg/mL di gentamicina alla provetta del campione. Agitare energicamente la provetta del campione per dissociare il muco o i detriti dalle biopsie. Lasciare che le biopsie si depositino per gravità e rimuovere con cura quanto più DPBS possibile utilizzando una pipetta.
- Ripetere la procedura di lavaggio dal passaggio 1.4 due volte (2x).
- Aggiungere 10 mL di reagente di dissociazione cellulare privo di enzimi integrato con 2,5 μg/mL di amfotericina B e 200 μg/mL di gentamicina nella provetta del campione e incubare per 15 minuti a temperatura ambiente con oscillazione a 30 giri/min.
- Dopo l'incubazione, agitare energicamente la provetta del campione da un lato all'altro per liberare le cripte del colon. Ispeziona il tubo usando un microscopio ottico a bassa potenza e cerca le cripte rilasciate e i frammenti di cripta in sospensione. Se non è visibile, agitare il tubo e ricontrollare; Ripeti fino a quando le cripte non si vedono in sospensione.
- Collegare un filtro cellulare da 70 μm a una provetta da 50 ml e filtrare la sospensione della cripta attraverso il filtro. Aggiungere 10 mL di Organoid Wash Media ghiacciato (Tabella 1) alla provetta vuota, rimuovere il terreno e passarlo attraverso il filtro cellulare.
- Trasferire le cripte filtrate in due provette da 15 mL (10 mL per provetta) e centrifugare a 4 °C per 5 min a 150 × g.
- Rimuovere con cura il surnatante da ciascuna provetta da 15 mL, risospendere i pellet di cripta in 500 μL di Organoid Wash Media ghiacciato, trasferire la soluzione crypt da entrambe le provette da 15 mL a una singola provetta da microcentrifuga da 1,5 mL e centrifugare a 4 °C per 3 min a 400 × g.
- Rimuovere con cautela il surnatante dalla provetta per microcentrifuga e risospendere il pellet della cripta in 70 μL di BME (20 μL per pozzetto e 10 μL di volume morto extra).
- Utilizzando la piastra preincubata a 48 pozzetti (passaggio 1.1), seminare 20 μL di sospensione BME/cripta al centro di ciascun pozzetto (1 cupola BME per pozzetto). Capovolgere la piastra in modo uniforme e costante e incubare a 37 °C, 5% CO2 per 20 minuti.
NOTA: L'inversione della piastra impedisce alle cellule di aderire alla superficie plastica del pozzetto e ne garantisce la distribuzione all'interno del BME. - Rimuovere la piastra dall'incubatrice. Assicurarsi che il BME sia completamente polimerizzato e quindi sovrapporre le cupole con 350 μL di terreno di proliferazione degli organoidi preriscaldato integrato con 100 μg/mL di un reagente antimicrobico ad ampio spettro. Incubare la piastra a 37 °C, 5% CO2.
NOTA: Il reagente antimicrobico ad ampio raggio serve a prevenire la contaminazione da microbi della mucosa associati alle biopsie del colon. È richiesto solo per la prima settimana di coltura dopo l'isolamento della cripta. - Cambiare il terreno 2-3 volte in una settimana utilizzando terreni di proliferazione di organoidi preriscaldati, integrandoli con il reagente antimicrobico ad ampio spettro per la prima settimana di coltura; Trascorso questo periodo, rimuovere il reagente.
- Una volta che la coltura colonoide è completamente stabilita (1-2 settimane dopo l'isolamento), dissociare i colonoidi utilizzando il reagente di dissociazione enzimatica integrato con 10 μM dell'inibitore ROCK-I/II Y-27632 (vedere la sezione 2 per tutti i dettagli sulla dissociazione colonoide).
NOTA: Per i primi due passaggi (P0-1, P1-2), i colonoidi devono essere espansi utilizzando un rapporto 1:1/2; dopo P2, i colonoidi possono essere fatti passare utilizzando un rapporto 1:3/4. - Seminare e mantenere i colonoidi seguendo i passaggi 1.11-1.13 (non integrare i terreni di proliferazione degli organoidi con il reagente antimicrobico ad ampio raggio).
2. Preparazione di colonoidi per il saggio di morte cellulare
NOTA: Il protocollo del test di morte cellulare richiede 4 giorni per essere completato (Figura 1A).
- Espandere i colonoidi utilizzando un formato di piastra a 48 pozzetti, seminando 20 μL di sospensione BME/cripta per pozzetto, incubando a 37 °C, 5% CO2 e cambiando il terreno 2-3 volte a settimana (350 μL per pozzetto).
- Passaggio dei colonoidi circa 1 settimana prima del prelievo per il test di morte cellulare. Prima di raccogliere i colonoidi, assicurarsi che siano propagati ad alta densità (Figura 1Bi), che abbiano un diametro di circa 25-50 μm e che stiano proliferando attivamente.
NOTA: Abbiamo utilizzato i colonoidi per questo test dal passaggio 3 al passaggio 14 con risultati coerenti. Tuttavia, è stato dimostrato che la risposta trascrizionale dei colonoidi alle citochine può cambiare a seconda della durata della coltura18. Su questa base, si consiglia di non utilizzare colonoidi per questo test dopo il passaggio 15. - Preincubare piastre per microtitolazione a 96 pozzetti a 37 °C, 5% CO2 per un minimo di 72 ore prima della semina con cellule colonoidi.
- Scongelare il BME con ghiaccio a 4 °C la sera prima di iniziare l'esperimento.
- Preparare un volume sufficiente del reagente di dissociazione enzimatica (500 μL per pozzetto di colonoidi) integrando con 10 μM dell'inibitore ROCK-I/II Y-27632. Rimuovere delicatamente il terreno dai pozzetti contenenti colonoidi; pipetta dal bordo del pozzetto per evitare di danneggiare la cupola colonoide. Aggiungere 300 μl di reagente di dissociazione enzimatica a ciascun pozzetto.
- Per ogni pozzetto, rompere la cupola colonoide raschiando la superficie del pozzetto con la punta di una pipetta P1000 e pipettando la sospensione cellulare su e giù; Cerca di evitare di generare bolle d'aria. Raccogliere la sospensione cellulare in una provetta da 15 mL.
NOTA: Questa provetta da 15 mL verrà utilizzata per raccogliere i colonoidi da 10 pozzetti della piastra da 48 pozzetti. - Lavare lo stesso pozzetto con altri 200 μl del reagente di dissociazione enzimatica per assicurarsi che tutto il materiale colonoide venga raccolto e trasferito nella stessa provetta da 15 mL. Ripetere questo processo per ogni pozzetto di colonoidi espansi che vengono raccolti e raccoglierli nella stessa singola provetta da 15 mL.
NOTA: Per una dissociazione efficiente, è necessario raccogliere un massimo di 10 pozzetti di colonoidi per provetta. Se si raccolgono >10 pozzetti, dividere equamente i colonoidi raccolti su più provette da 15 ml.
- Per ogni pozzetto, rompere la cupola colonoide raschiando la superficie del pozzetto con la punta di una pipetta P1000 e pipettando la sospensione cellulare su e giù; Cerca di evitare di generare bolle d'aria. Raccogliere la sospensione cellulare in una provetta da 15 mL.
- Incubare la provetta da 15 mL con i colonoidi raccolti dal passaggio 2.5.2 in un bagno d'acqua a 37 °C per 5 minuti. Dopo l'incubazione, centrifugare la provetta per 3 minuti a 400 × g. Rimuovere delicatamente il surnatante, lasciando circa 1,2 ml nella provetta.
NOTA: La fase successiva richiede la dissociazione fisica dei colonoidi mediante pipettaggio rapido. Affinché ciò sia efficace, è necessario disporre di un piccolo volume di sospensione cellulare nella provetta: gli 1,2 mL rimasti nella provetta da 15 mL sono sufficienti a questo scopo. - Risospendere il pellet colonoide nei restanti 1,2 mL del reagente di dissociazione enzimatica. Utilizzando una pipetta P1000 impostata su 1.000 μl, posizionare il puntale della pipetta nella sospensione, tenendolo appena sopra il fondo della provetta da 15 mL, quindi pipettare rapidamente la sospensione dentro e fuori dal puntale. Per pipettare rapidamente, premere rapidamente il pulsante dello stantuffo fino al primo arresto, rilasciare il pulsante fino a quando non si trova a circa metà della posizione superiore e ripetere. Pipettare rapidamente per circa 10 s (30-40 depressioni), quindi risospendere completamente la sospensione e ripetere il pipettaggio. Eseguire 2-3 cicli di pipettaggio rapido.
- Controllare il campione al microscopio per confermare che non siano rimasti colonoidi interi e che la maggior parte dei frammenti di colonoidi abbia una dimensione di circa 30-40 μm (Figura 1Bii).
- Se il campione richiede un'ulteriore dissociazione, incubare in bagnomaria a 37 °C per altri 3 minuti, ripetere la tecnica di pipettaggio al punto 2.7 e controllare il campione al microscopio. Ripetere questo processo fino a quando la maggior parte dei frammenti di colonoide non raggiunge le dimensioni ottimali.
NOTA: Fare attenzione a non dissociare troppo i colonoidi in quanto ciò comporterà un'eccessiva morte cellulare, una bassa efficienza di placcatura e colonoidi sottodimensionati. - Aggiungere 10 mL di Organoid Wash Media ghiacciato (Tabella 1) alla provetta da 15 mL. Centrifugare la provetta per 3 minuti a 400 × g, rimuovere il surnatante, risospendere in 1 mL di Organoid Wash Media ghiacciato e trasferirla in una provetta da microcentrifuga da 1,5 mL (denominata provetta per frammenti di colonoide).
- Miscelare il contenuto della provetta del frammento di colonoide mediante pipettaggio e prelevare un campione da 50 μl; trasferire questo campione da 50 μl in una nuova provetta per microcentrifuga da 1,5 mL (denominata provetta per la conta cellulare). Conservare la provetta del frammento di colonoide sul ghiaccio da questo punto fino al completamento del passaggio 2.15.
- Centrifugare la provetta per la conta cellulare per 3 minuti a 400 × g, rimuovere il surnatante e risospendere in 500 μL di reagente di dissociazione enzimatica integrato con 10 μM dell'inibitore ROCK-I/II Y-27632.
- Incubare la provetta per la conta delle singole cellule nel bagno d'acqua a 37 °C per 5 minuti. Utilizzando una pipetta P1000 impostata su 400 μl, pipettare il campione come descritto al punto 2.7 e controllare il campione al microscopio per assicurarsi che vi sia una sospensione di una singola cellula. In caso contrario, ripetere questo processo fino a quando i colonoidi non sono completamente dissociati in una sospensione unicellulare.
- Aggiungere 1 mL di Organoid Wash Media alla provetta per la conta delle singole cellule, centrifugare per 3 minuti a 400 × g e rimuovere con cautela il surnatante. Risospendere le cellule in 50 μL di Organoid Wash Media e quindi aggiungere 50 μL di blu di tripano.
- Contare le cellule utilizzando un emocitometro. Calcolare il numero di cellule nel campione da 50 μl e utilizzarlo per calcolare la concentrazione di cellule nella provetta del frammento colonoide.
- Calcolare il volume di sospensione cellulare richiesto per l'esperimento in cui verranno seminate 0,5 × 104 cellule colonoidi per pozzetto di una piastra per microtitolazione a 96 pozzetti. Aggiungi circa il 15% in più a questo volume calcolato per tenere conto del volume morto. Trasferire questo volume totale dalla provetta per frammenti di colonoide (passaggio 2.11) a una nuova provetta per microcentrifuga da 1,5 mL.
- Centrifugare la nuova provetta per microcentrifuga da 1,5 ml contenente frammenti di colonoide per 3 minuti a 400 × g, rimuovere il surnatante e risospendere in BME (utilizzare 10 μl di BME per 0,5 × 104 cellule).
NOTA: A causa delle caratteristiche fisiche del BME (alta viscosità, polimerizzazione dipendente dalla temperatura), una quantità significativa di materiale può essere persa attraverso il pipettaggio (volume morto).
- Centrifugare la nuova provetta per microcentrifuga da 1,5 ml contenente frammenti di colonoide per 3 minuti a 400 × g, rimuovere il surnatante e risospendere in BME (utilizzare 10 μl di BME per 0,5 × 104 cellule).
- Posizionare la provetta o il serbatoio contenente la sospensione colonoide/BME sul ghiaccio in un contenitore sterile all'interno della cappa di biosicurezza.
NOTA: Mantenere le cellule sul ghiaccio durante la semina impedisce al substrato cellulare di polimerizzare prematuramente. - Utilizzando una piastra per microtitolazione preincubata a 96 pozzetti (dal passaggio 2.3), pipettare inversamente 10 μL della soluzione di colonoide/BME per pozzetto. Assicurarsi di posizionare la punta appena sopra la superficie del pozzetto e di pipettare al centro per evitare di colpire la parete del pozzetto. Mescolare regolarmente la sospensione colonoide/BME per evitare una semina irregolare.
NOTA: Non seminare colonoidi nei pozzetti del bordo esterno della piastra per microtitolazione.- Per invertire la pipetta:
- Posizionare la pipetta, quindi premere il pulsante dello stantuffo oltre il primo arresto fino al secondo.
- Mantenendo questa posizione, immergere la punta nella sospensione colonoide/BME e rilasciare lentamente lo stantuffo verso l'alto.
- Erogare la sospensione premendo delicatamente e costantemente il pulsante dello stantuffo fino al primo arresto. Se si seminano più pozzetti, mantenere questa posizione e ripetere i passaggi 2.18.1.2-2.18.1.3.
- Una volta terminato, espellere la piccola quantità di sospensione rimanente premendo il pulsante dello stantuffo fino al secondo arresto.
NOTA: Si consiglia di utilizzare la tecnica di pipettaggio inverso a causa dell'elevata viscosità del BME.
- Per invertire la pipetta:
- Capovolgere la piastra in modo uniforme e costante e incubare a 37 °C, 5% CO2 per 20 minuti.
- Rimuovere la piastra dall'incubatrice. Assicurarsi che il BME sia completamente polimerizzato e quindi sovrapporre le cupole con 200 μl di terreno di proliferazione degli organoidi preriscaldato. Se si utilizza una piastra per microtitolazione a 96 pozzetti con un fossato circostante (che riduce l'evaporazione), riempire ogni serbatoio con 2 mL di Organoid Wash Media.
- Incubare i colonoidi a 37 °C, 5% di CO2 per 3 giorni e ispezionare al microscopio una volta al giorno per assicurarsi che i colonoidi si siano ripresi e stiano proliferando.
3. Trattamenti colonoidi per il saggio della morte cellulare
- Preparare una soluzione da 2,5 μM di colorante fluorescente per la morte cellulare (SYTOX Green Nucleic Acid Stain) e una soluzione di DMSO aggiungendo un colorante fluorescente per la morte cellulare o DMSO ai terreni di proliferazione degli organoidi preriscaldati (Tabella 2).
NOTA: Proteggere il colorante fluorescente per la morte cellulare e la soluzione diluita dalla luce. SYTOX Green Nucleic Acid Stain è solubilizzato in DMSO; la soluzione di DMSO viene utilizzata per preparare la condizione No Dye per controllare gli effetti del solvente. - Utilizzare la soluzione da 2,5 μM di colorante fluorescente per la morte cellulare e la soluzione DMSO del passaggio 3.1 per preparare i trattamenti come mostrato nella Tabella 2.
- Rimuovere delicatamente il terreno dalla piastra per microtitolazione a 96 pozzetti seminata con colonoidi inclinando la piastra e pipettandola dal bordo dei pozzetti; quindi, aggiungere 200 μl di terreno di trattamento per pozzetto. Assicurarsi di disporre di pozzetti di controllo PBS/BSA aggiuntivi per le condizioni di tossicità massima (vedere la Tabella 2 per la mappa delle piastre).
- Incubare i colonoidi a 37 °C, 5% di CO2 per i punti temporali di trattamento richiesti fino al momento dell'imaging.
- Almeno 2 ore prima dell'imaging, preparare una soluzione al 10% v/v di Triton-X 100 in acqua sterile per colture cellulari e aggiungere 22 μl di Triton-X 100 al 10% direttamente al terreno dei pozzetti di controllo per la/e condizione/i di massima tossicità a una concentrazione finale dell'1% v/v 1 h prima dell'imaging.
NOTA: L'uso di una soluzione al 10% riduce gli errori di pipettaggio che possono verificarsi a causa dell'elevata viscosità del tensioattivo.
4. Acquisizione delle immagini
- Rimuovere la piastra per microtitolazione a 96 pozzetti seminata con colonoidi dall'incubatore e trasferirla al tavolino di un microscopio digitale a epifluorescenza invertita. Lasciare che la piastra raggiunga la temperatura ambiente.
- Confermare che i colonoidi della condizione di massima tossicità siano completamente lisati esaminandoli al microscopio (Figura 1Biii).
- Selezionare un obiettivo adatto, come un obiettivo a fluorescenza 40x a lunga distanza di lavoro. Ottimizza le impostazioni di imaging del microscopio prima di iniziare.
- Utilizzando il canale di trasmissione, concentrarsi su un colonoide con cellule SYTOX-positive, passare alla proteina fluorescente verde (GFP)
(488 nm) e regolare l'intensità della luce e il tempo di esposizione per massimizzare il segnale fluorescente riducendo al minimo lo sfondo. Innanzitutto, prova una bassa intensità luminosa, quindi aumenta gradualmente il tempo di esposizione; Se la durata dell'esposizione non è pratica, aumentare leggermente l'intensità della luce.
NOTA: Aumentando il tempo di esposizione invece dell'intensità della luce si riduce la fototossicità e il fotosbiancamento dei campioni19. Esporre i campioni alla luce fluorescente solo quando necessario.
- Utilizzando il canale di trasmissione, concentrarsi su un colonoide con cellule SYTOX-positive, passare alla proteina fluorescente verde (GFP)
- Utilizzando le impostazioni di imaging ottimizzate per il canale GFP, osservare le condizioni di assenza di colorante e massima tossicità per garantire che i campioni non siano sovra o sottoesposti. Una volta finalizzate, mantenere le impostazioni di imaging coerenti tra le condizioni.
- Acquisisci immagini utilizzando un approccio di campionamento casuale: fallo selezionando i campi visivi (FOV) che seguono uno schema a griglia fissa che copre la cupola colonoide. Acquisisci immagini di colonoidi da un minimo di 10 FOV. Assicurarsi che il piano centrale del colonoide sia a fuoco e acquisire immagini sia nei canali di trasmissione che in quelli GFP.
- Applicare i seguenti criteri di esclusione.
- Non acquisire immagini se non sono presenti colonoidi nel FOV.
- Non acquisire immagini se nel FOV sono presenti solo colonoidi che si sovrappongono sullo stesso piano focale (Figura 1Biv).
- Non acquisire immagini se nel FOV sono presenti solo detriti colonoidi (Figura 1Bv). Non includere detriti colonoidi nell'analisi.
- Applicare i seguenti criteri di esclusione.
- Salva le immagini in formato grafico di rete portatile ed esportale.
- Se si esegue l'imaging di punti temporali aggiuntivi, riportare la piastra per microtitolazione a 96 pozzetti con colonoidi nell'incubatore a 37 °C, 5% CO2.
5. Analisi delle immagini
- Apri Fiji ImageJ e importa il set di dati dell'immagine trascinando i file sulla barra degli strumenti di ImageJ o navigando su File | Apri e seleziona i file. Una volta aperti, combina i file in una pila di immagini facendo clic su Immagine| Pile| Immagini da impilare. Converti la pila di immagini in formato file a 8 bit facendo clic su Immagine| Tipo| 8 bit.
- Per ogni set di immagini, fare clic sullo strumento Selezioni a mano libera sulla barra degli strumenti di ImageJ e selezionare manualmente l'area di interesse (ROI) sull'immagine di trasmissione utilizzando il mouse del computer; il ROI è il perimetro del colonoide. Quindi, passa da una pila di immagini all'altra fino all'immagine del canale GFP corrispondente.
- Fai clic su Analizza| impostare le misure; nella finestra di dialogo Imposta misure , selezionare Valore medio di grigio e lasciare deselezionate tutte le altre caselle. Con l'immagine GFP selezionata, fare clic su Analizza | Misurare. Ripeti questa analisi per ogni colonoide nella pila di immagini. Una volta analizzato il set di dati, copiare tutti i dati nella finestra Risultati e incollarli in un'applicazione software per fogli di calcolo.
6. Calcolo della tossicità massima %
- Calcolare la media dei valori medi di grigio (MGV) della replica tecnica per ciascuna condizione utilizzando l'equazione (1).
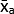 (media del trattamento a) =
(media del trattamento a) = 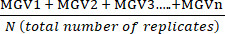 (1)
(1) - Esprimere la media di ciascuna condizione in percentuale rispetto alla media della condizione di massima tossicità (MT) utilizzando l'equazione (2).
%MTa =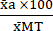 (2)
(2)
7. Calcolo dell'IPC
- Normalizzare (NORM) i dati come segue, utilizzando i valori medi calcolati nel passaggio 6.1, sottrarre la media della condizione non trattata (UT) da ciascuna condizione di trattamento e la condizione di massima tossicità (MT) (per rimuovere la morte cellulare di fondo che si verifica indipendentemente dal trattamento con citochine). Quindi, dividere ciascuna condizione di trattamento per la media sottratta dallo sfondo della condizione di tossicità massima (MT) come mostrato nell'equazione (3).
NORMAa =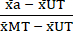 (3)
(3) - Sottrarre da 1 i valori normalizzati calcolati al punto 7.1; i valori risultanti rappresentano la vitalità cellulare (V) dopo il trattamento (come nell'equazione (4) di seguito).
Va = 1 −NORMa (4) - Calcola il coefficiente di interazione perturbagena (CPI) utilizzando l'equazione (5):
IPC =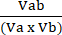 (5)
(5)
Dove a denota il primo trattamento; b indica il secondo trattamento; e l'AB è il trattamento combinato. I valori dell'IPC indicano relazioni sinergiche (<1), additive (=1) o antagonistiche (>1).
Representative Results
Utilizzando questo protocollo, abbiamo dimostrato come i colonoidi dei pazienti affetti da CD possano essere utilizzati per studiare gli effetti citotossici delle citochine rilevanti per le IBD IFN-γ e TNF-α sull'epitelio primario. Abbiamo utilizzato un colorante fluorescente per la morte cellulare disponibile in commercio (SYTOX Green Nucleic Acid Stain), che può entrare solo nelle cellule che hanno una membrana cellulare compromessa dove viene poi attivato legandosi agli acidi nucleici. Abbiamo co-trattato i colonoidi con citochine e il colorante fluorescente per la morte cellulare e abbiamo eseguito l'imaging di cellule vive a 8 ore e 24 ore con un microscopio a epifluorescenza invertita. Le immagini rappresentative di trasmissione/sovrapposizione fluorescente a 8 ore indicano che solo i colonoidi trattati con IFN-γ + TNF-α sono positivi per il segnale fluorescente; tuttavia, c'è solo un piccolo numero di celle fluorescenti (Figura 2A). Il blebbing cellulare, un indicatore morfologico della morte cellulare20, può essere osservato anche nella condizione IFN-γ + TNF-α. A 24 ore, i colonoidi trattati con IFN-γ + TNF-α mostrano ampie regioni positive per il segnale fluorescente (Figura 2A). C'è anche una chiara rottura nella morfologia del colonide: il lume centrale non è più visibile e la barriera epiteliale è stata completamente interrotta.
Per quantificare il segnale del colorante di morte cellulare, abbiamo utilizzato un software di analisi delle immagini open source per calcolare l'intensità fluorescente di ciascun colonoide. Abbiamo quindi normalizzato i dati esprimendo la media di ciascuna condizione come percentuale del trattamento di massima tossicità. A 8 ore, la morte cellulare omeostatica o di fondo nei colonoidi di controllo BSA era relativamente bassa (7,7% della tossicità massima) (Figura 2B). Non ci sono stati cambiamenti statisticamente significativi nei livelli di morte cellulare in questo momento; tuttavia, le condizioni trattate con TNF-α mostrato un piccolo aumento della citotossicità (Figura 2B). Dopo 24 ore, i livelli di morte cellulare erano aumentati per tutte le condizioni trattate con citochine. Tuttavia, c'è stato un cambiamento minimo nella morte cellulare per la condizione di controllo BSA tra i punti temporali (7,5% della tossicità massima a 24 ore). I colonoidi trattati con IFN-γ + TNF-α hanno avuto il maggiore aumento dei livelli di morte cellulare rispetto al controllo BSA (29,4% della tossicità massima). La differenza nei livelli di morte cellulare tra il trattamento combinato e i trattamenti con citochine singole (IFN-γ, TNF-α) è stata molto significativa. Questi risultati suggeriscono la possibilità di un'interazione sinergica citotossica tra IFN-γ e TNF-α a 24 ore.
Abbiamo utilizzato il CPI per quantificare le interazioni citotossiche tra i trattamenti con citochine e per determinare se fossero sinergiche. Le interazioni tra citochine sono considerate sinergiche quando il valore CPI è <1, additive quando =1 o antagoniste quando >1. Abbiamo calcolato i valori dell'IPC per punto temporale (Figura 2C). A 8 ore, il valore dell'IPC indicava un leggero sinergismo (0,99), con il valore dell'IPC che diminuiva sostanzialmente a 24 ore (0,83). Questa analisi ha confermato che l'interazione tra IFN-γ e TNF-α a 24 ore era sinergica. Inoltre, illustra come in questo contesto la sinergia tra IFN-γ e TNF-α sia dipendente dal tempo.
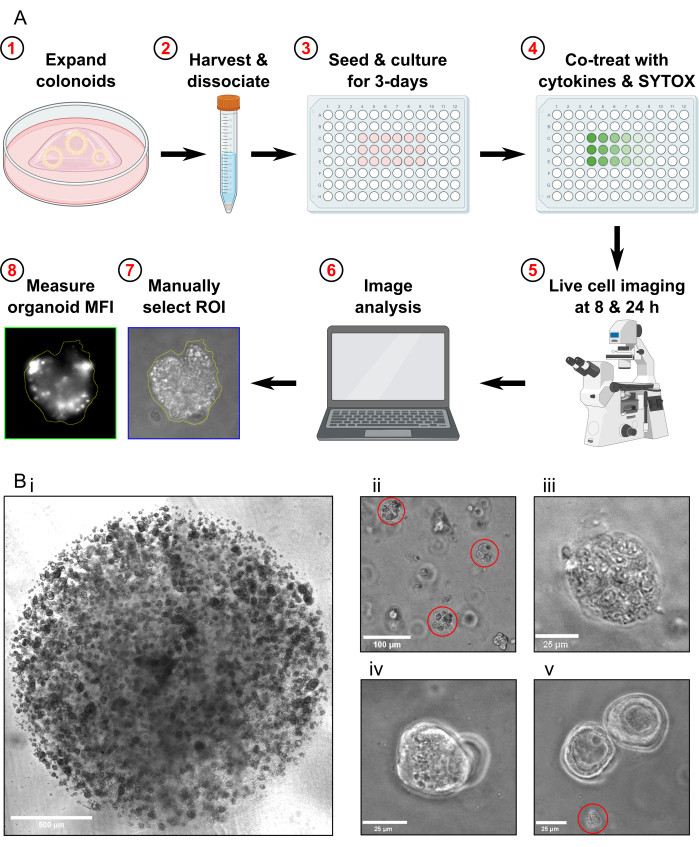
Figura 1: Schema del flusso di lavoro sperimentale e risoluzione dei problemi. (A) Panoramica schematica del protocollo. (B) Immagini rappresentative. (Bi) Immagine al microscopio ottico che illustra la densità ottimale della coltura e la dimensione ottimale dei colonoidi prima del passaggio per un test. Barra della scala = 500 μm. (Bii) Immagine al microscopio ottico che illustra la dimensione ottimale dei frammenti di colonoide dopo la dissociazione; Frammenti evidenziati in rosso. Barra della scala = 100 μm. (Biii) Immagine al microscopio ottico della morfologia del colonoide necrotico dopo trattamento MT (con Triton X-100). Barra della scala = 25 μm. (Biv) Immagine al microscopio ottico di due colonoidi sovrapposti sullo stesso piano focale. Barra della scala = 25 μm. (Bv) Immagine al microscopio ottico di detriti di cellule colonoidi presenti dopo il passaggio; detriti evidenziati in rosso. Barra della scala = 25 μm. Abbreviazioni: ROI = regione di interesse; MFI = intensità media della fluorescenza; MT = Tossicità massima. Clicca qui per visualizzare una versione più grande di questa figura.
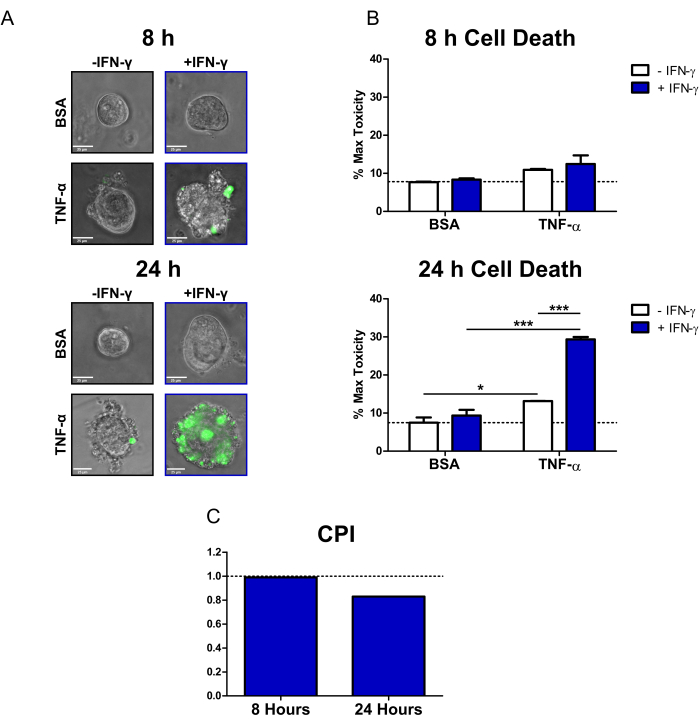
Figura 2: Analisi quantitativa della morte cellulare indotta da citochine nei colonoidi umani di CD. (A) Immagini rappresentative al microscopio dal vivo di colonoidi di CD trattati con SYTOX Green Nucleic Acid Stain (colorante fluorescente per la morte cellulare) e citochine a 8 ore e 24 ore; canali di trasmissione e GFP (colore verde) sovrapposti. I colonoidi sono stati trattati come segue: 1) PBS/BSA, 2) 10 ng/mL di IFN-γ, 3) 10 ng/mL di TNF-α, 4) 10 ng/mL di IFN-γ + 10 ng/mL di TNF-α. Barre della scala = 25 μm. (B) Analisi quantitativa di colonoidi CD trattati con il colorante fluorescente a morte cellulare e citochine a 8 e 24 ore; i dati sono espressi in % della condizione MT. N = 2 linee colonoidi CD, 11-16 colonoidi per condizione. (C) CPI calcolato per punto temporale utilizzando il set di dati da B, N = 2 linee colonoidi CD. I dati sono espressi come mezzi ± SE. In B, è stata eseguita l'analisi ANOVA a due vie seguita dai post-test di Bonferroni, *P < 0,05, ***P < 0,001 come indicato. Abbreviazioni: CD = Morbo di Crohn; GFP = proteina fluorescente verde; CPI = coefficiente di interazione perturbagena; PBS = soluzione salina tamponata con fosfato; BSA = albumina sierica bovina; TNF-α = fattore di necrosi tumorale-alfa; IFN-γ = interferone-gamma; MT = Tossicità massima. Clicca qui per visualizzare una versione più grande di questa figura.
Tabella 1: Composizione dei terreni di coltura per il protocollo. Per preparare i terreni di proliferazione degli organoidi, combinare i terreni condizionati con L-WRN e i terreni senza siero 1:1, quindi aggiungere gli integratori. I terreni di proliferazione degli organoidi devono essere utilizzati entro 2 settimane dalla preparazione. Si prega di notare che tutti i supporti completi devono essere conservati a 4 °C. Fare clic qui per scaricare questa tabella.
Tabella 2: Layout sperimentale della piastra a 96 pozzetti e trattamenti con citochine. Clicca qui per scaricare questa tabella.
Discussion
Sono stati sviluppati diversi metodi per l'analisi quantitativa della morte cellulare negli organoidi intestinali. L'esame dell'alterazione della morfologia degli organoidi intestinali mediante microscopia ottica è un approccio semplice per quantificare gli effetti delle sostanze citotossiche11. Tuttavia, i cambiamenti morfologici non sono una misura diretta della morte cellulare e il metodo è solo semiquantitativo. Un altro metodo consiste nel valutare l'attività metabolica degli organoidi utilizzando un test MTT o ATP10,11. È importante notare che questi test possono determinare solo i cambiamenti nella vitalità cellulare e devono essere convalidati con un test di morte cellulare. Sono stati riportati altri saggi fluorometrici di morte cellulare con coloranti leganti il DNA12,13. È possibile un approccio non di imaging che utilizza un lettore di micropiastre fluorescente e consente un'elevata produttività12. Tuttavia, questo metodo misura il segnale medio di un intero pozzo, rendendolo inadatto a popolazioni eterogenee. Richiede inoltre l'uso di un lettore di micropiastre con regolazione dell'altezza Z. Le tecniche basate sull'imaging fluorescente possono essere utilizzate per l'analisi di singoli organoidi e per l'acquisizione di dati cellulari/subcellulari e morfologici. I sistemi automatizzati di imaging confocale ad alto contenuto (HCI) possono generare grandi quantità di dati a un throughput elevato13. Sfortunatamente, l'HCI confocale necessita di apparecchiature specializzate, utilizza protocolli complessi, in genere richiede un software di analisi delle immagini commerciale ed è costosa.
Il nostro protocollo per l'analisi quantitativa della morte delle cellule colonoidi in più punti temporali è diretto, semplice ed economico. Tuttavia, rispetto ai sistemi automatizzati di lettura HCI e piastre, richiede molto tempo e ha una produttività ridotta. Un altro limite del nostro metodo è l'uso della microscopia a campo largo rispetto alla microscopia confocale. La microscopia confocale è più adatta per l'imaging di campioni 3D spessi come gli organoidi, in quanto riduce il segnale sfocato e può acquisire sezioni ottiche seriali (Z-stack). Tuttavia, l'imaging confocale richiede in genere tempi di acquisizione più lunghi e laser ad alta intensità che aumentano la fototossicità/fotosbiancamento. È fondamentale notare che i coloranti fluorescenti per la morte cellulare come SYTOX Green sono adatti solo per misurare forme di morte cellulare in cui vi è perdita di integrità della membrana cellulare come la necrosi, la necrosi secondaria associata all'apoptosi tardiva, la necroptosi e la piroptosi21. Esistono alcune forme di morte cellulare regolata in cui la membrana cellulare rimane impermeabile almeno durante le prime fasi della morte cellulare, come l'apoptosi caspasi-dipendente. Tuttavia, questo protocollo potrebbe essere facilmente modificato per incorporare anche l'imaging di un reporter fluorescente con attività caspasi 3/722. Ciò fornirebbe ulteriori dati per aiutare a caratterizzare la specifica modalità di morte cellulare.
Abbiamo utilizzato il nostro protocollo per dimostrare l'interazione sinergica citotossica tra le citochine IFN-γ e TNF-α (Figura 2C), che abbiamo precedentemente riportato in pazienti CD-derived organoids 9,10. La rilevanza fisiologica di questa forma di sinergismo è stata dimostrata anche in modelli murini di linfoistiocitosi emofagocitaria e sepsi23. Diversi modelli e approcci matematici di riferimento sono stati implementati per quantificare la sinergia tra combinazioni di agenti biologici 24,25. Differiscono in termini di complessità, numero di fattori che considerano e soglia per considerare sinergica un'interazione24,25. Alcuni modelli richiedono una conoscenza preliminare degli agenti biologici testati, fanno determinate ipotesi sull'attività degli agenti e possono richiedere curve dose-risposta complete per ogni trattamento singolo e combinato25. Il metodo che abbiamo scelto per misurare la sinergia è una modifica del modello del coefficiente di interazione farmacologica (CDI), che è stato precedentemente utilizzato per misurare gli effetti inibitori delle combinazioni di farmaci chemioterapici sulla proliferazione delle linee cellulari tumorali26. Il CDI è un modello di indipendenza Bliss; nel calcolare l'effetto combinato previsto di due perturbagenti, l'indipendenza di Bliss assume che essi mirino a percorsi separati e abbiano meccanismi d'azione indipendenti27. Affinché un'interazione tra perturbageni sia sinergica, l'effetto combinato effettivo deve essere maggiore dell'effetto previsto. Questo modello è appropriato per la nostra configurazione sperimentale poiché IFN-γ e TNF-α sono noti per avere recettori e componenti di segnalazione a valle diversi. Inoltre, l'indipendenza di Bliss consente il calcolo di un coefficiente di interazione per quantificare il sinergismo e non richiede set di dati dose-risposta.
Ci sono alcuni fattori chiave che devono essere considerati per garantire risultati ottimali per questo protocollo. È importante che i colonoidi siano propagati ad alta densità (Figura 1Bi), che abbiano un diametro di circa 25-50 μm e che stiano proliferando attivamente prima di tentare di seminare le cellule. L'uso di colture non ottimali di colonoidi per i saggi può comportare un numero insufficiente di cellule, un basso recupero di colonoidi ed esperimenti incoerenti. Per ottenere risultati riproducibili, è anche importante seminare la densità dei colonoidi in modo coerente tra gli esperimenti. È stato precedentemente dimostrato che la risposta in vitro alle citochine infiammatorie può essere influenzata dalla densità di semina cellulare28,29. Un altro problema comune è la formazione di bolle d'aria nella cupola BME, che possono influenzare l'imaging. Questo può essere evitato utilizzando la tecnica del pipettaggio inverso. Questa tecnica si traduce anche in una semina più coerente.
Inoltre, se si esegue l'imaging di più punti temporali, preparare una condizione di tossicità massima per ogni punto temporale. Triton-X 100, un tensioattivo non ionico, è comunemente usato come controllo positivo (condizione di massima tossicità) per i saggi di citotossicità. L'aggiunta di Triton-X 100 lisa e uccide i colonoidi, consentendo al colorante fluorescente di morte cellulare di entrare nelle cellule. L'utilizzo di una condizione di tossicità massima da un punto temporale precedente comporterà una normalizzazione imprecisa e incoerente dei dati a causa del decadimento del segnale fluorescente nel tempo.
Un ultimo punto da considerare è la scelta del BME utilizzato per la coltura colonoide. Esistono diversi produttori commerciali di BME; tuttavia, per il nostro protocollo, abbiamo testato solo il marchio incluso nella Tabella dei Materiali. Un recente studio che ha utilizzato organoidi di cancro al pancreas derivati da pazienti ha scoperto che la fonte commerciale di BME altera i tassi di proliferazione cellulare, ma non ha avuto alcun effetto significativo sulla risposta ai farmaci chemioterapici o sull'espressione genica30. Con questo in mente, ci aspettiamo che l'andamento dei risultati sia simile tra i marchi BME per il nostro protocollo, ma consigliamo di utilizzare lo stesso marchio in modo coerente.
Abbiamo dimostrato come questo protocollo possa essere utilizzato per l'analisi della morte cellulare indotta da IFN-γ e TNF-α utilizzando colonoidi derivati da pazienti con CD. Gli organoidi intestinali derivati da pazienti sono un potente strumento per studiare la MC in quanto conservano molte caratteristiche della malattia, tra cui una maggiore sensibilità agli effetti citotossici del TNF-α31. Tuttavia, il protocollo potrebbe essere facilmente modificato per studiare gli effetti citotossici di perturbageni diversi dalle citochine o stati patologici diversi dall'IBD come il cancro del colon-retto (abbiamo testato con successo il protocollo utilizzando colonoidi non-IBD). Riteniamo che questo metodo sia utile per qualsiasi area di ricerca riguardante i meccanismi di morte cellulare, la funzione della barriera epiteliale o l'immunologia della mucosa intestinale.
Disclosures
K.N. ha ricevuto finanziamenti per la ricerca da AbbVie Inc. durante il periodo in cui i lavori sono stati completati. Questo finanziamento è stato effettuato nel contesto di un premio spoke di un centro di ricerca (SFI-14/SP/2710) ad APC Microbiome Ireland.
Acknowledgements
Gli autori desiderano ringraziare i pazienti per il loro consenso informato e la partecipazione allo studio di ricerca, e il personale clinico per la loro eccellente assistenza. La Figura 1A è stata creata con BioRender.com. Questo lavoro è stato sostenuto da sovvenzioni della Science Foundation Ireland, in particolare un premio per lo sviluppo della carriera (CDA) a K.N. (SFI-13/CDA/2171), una sovvenzione per un centro di ricerca (SFI-12/RC/2273) e un premio per i raggi del centro di ricerca (SFI-14/SP/2710) ad APC Microbiome Ireland. P.F. ha anche ricevuto finanziamenti da SFI/20/RP/9007.
Materials
| Name | Company | Catalog Number | Comments |
| Advanced DMEM/F12 | Gibco | 12634010 | |
| Amphotericin B Solution | Sigma-Merck | A2942 | |
| A-83-01 | Sigma-Merck | SML0788 | |
| BioRender | Science Suite Inc. | N/A | Scientific illustration software |
| Bovine Serum Albumin | Sigma-Merck | A2058 | Essentially IgG-free, low endotoxin |
| B27 Supplement | Invitrogen | 17504-044 | |
| CHIR-99021 | Sigma-Merck | SML1046 | |
| Costar 48-well Clear TC-treated Multiple Well Plates, Individually Wrapped, Sterile | Corning | 3548 | |
| Cultrex Basement Membrane Extract, Type 2, Pathclear | R&D Systems | 3532-010-02 | Basement membrane extract |
| Dimethyl sulfoxide | Sigma-Merck | D2650 | |
| Dulbecco′s Phosphate Buffered Saline | Sigma-Merck | D8537 | |
| EVOS FL Digital Inverted Fluorescence Microscope | Invitrogen | AMF4300 | Digital inverted epifluorescence microscope |
| EVOS 40x Objective, fluorite, LWD, phase-contrast | ThermoFisher Scientific | AMEP4683 | Long working distance 40x fluorescence objective |
| Fiji/ImageJ (Windows version) | Open-source software | N/A | Image analysis software |
| Foetal Bovine Serum | Sigma-Merck | F9665 | |
| Gentamicin Solution | Sigma-Merck | G1397 | |
| Gentle Cell Dissociation Reagent | STEMCELL Technologies | 100-0485 | Enzyme-free cell dissociation reagent |
| GlutaMAX-1 | Gibco | 35050061 | L-alanyl-L-glutamine dipeptide supplement |
| GraphPad Prism 5 (Windows version) | Dotmatics | N/A | Data graphics and statistics software |
| Greiner 15 mL Polypropylene Centrifuge Tube, Sterile with conical bottom & Screw Cap | Cruinn | 188261CI | |
| HEPES 1 M | Gibco | 15630080 | |
| Human recombinant EGF (animal free) | Peprotech | AF-100-15 | |
| N-Acetylcysteine | Sigma-Merck | A9165 | |
| Nicotinamide | Sigma-Merck | N0636 | |
| Normocin | InvivoGen | ant-nr-05 | Broad range antimicrobial reagent |
| Nunc Edge 96-Well, Nunclon Delta-Treated, Flat-Bottom Microplate | ThermoFisher Scientific | 15543115 | |
| N2 supplement | Invitrogen | 17502-048 | |
| Recombinant Human IFN-gamma Protein | R&D Systems | 285-IF | Resuspend in sterile filtered 0.1% PBS/BSA |
| Recombinant Human TNF-alpha Protein | R&D Systems | 210-TA | Resuspend in sterile filtered 0.1% PBS/BSA |
| SB202190 | Sigma-Merck | S7067 | |
| Snap Cap Low Retention Microcentrifuge Tubes | ThermoFisher Scientific | 3451 | |
| SYTOX Green Nucleic Acid Stain - 5 mM Solution in DMSO | Invitrogen | S7020 | Fluorescent cell death dye, protect from light |
| Triton X-100 | Sigma-Merck | 93420 | |
| Trypan Blue solution | Sigma-Merck | T8154 | |
| Tryple Express | Gibco | 12604013 | Enzymatic dissociation reagent |
| Y-27632 | MedChemExpress | HY-10071 | Inhibitor of ROCK-I and ROCK-II |
References
- Patankar, J. V., Becker, C. Cell death in the gut epithelium and implications for chronic inflammation. Nat Rev Gastroenterol Hepatol. 17 (9), 543-556 (2020).
- Zeissig, S., et al. Downregulation of epithelial apoptosis and barrier repair in active Crohn's disease by tumour necrosis factor alpha antibody treatment. Gut. 53 (9), 1295-1302 (2004).
- Bartee, E., Mcfadden, G. Cytokine synergy: An underappreciated contributor to innate anti-viral immunity. Cytokine. 63 (3), 237-240 (2013).
- Fish, S. M., Proujansky, R., Reenstra, W. W. Synergistic effects of interferon γ and tumour necrosis factor α on T84 cell function. Gut. 45 (2), 191-198 (1999).
- Wakisaka, Y., Sugimoto, S., Sato, T. Organoid medicine for Inflammatory Bowel Disease. Stem Cells. 40 (2), 123-132 (2022).
- Flood, P., Hanrahan, N., Nally, K., Melgar, S. Human intestinal organoids: Modeling gastrointestinal physiology and immunopathology - current applications and limitations. Eur J Immunol. 54 (2), e2250248 (2024).
- Matsuzawa-Ishimoto, Y., et al. An intestinal organoid-based platform that recreates susceptibility to t-cell-mediated tissue injury. Blood. 135 (26), 2388-2401 (2020).
- Lee, C., et al. Intestinal epithelial responses to IL-17 in adult stem cell-derived human intestinal organoids. J Crohns Colitis. 16 (12), 1911-1923 (2022).
- Woznicki, J. A., et al. TNF-α synergises with IFN-γ to induce caspase-8-JAK1/2-STAT1-dependent death of intestinal epithelial cells. Cell Death Dis. 12 (10), 864 (2021).
- Flood, P., et al. DNA sensor-associated type I interferon signaling is increased in ulcerative colitis and induces jak-dependent inflammatory cell death in colonic organoids. Am J Physiol Gastrointest Liver Physiol. 323 (5), G439-G460 (2022).
- Grabinger, T., et al. Ex vivo culture of intestinal crypt organoids as a model system for assessing cell death induction in intestinal epithelial cells and enteropathy. Cell Death Dis. 5 (5), e1228 (2014).
- Bode, K. J., Mueller, S., Schweinlin, M., Metzger, M., Brunner, T. A fast and simple fluorometric method to detect cell death in 3D intestinal organoids. Biotechniques. 67 (1), 23-28 (2019).
- Mertens, S., et al. Drug-repurposing screen on patient-derived organoids identifies therapy-induced vulnerability in KRAS-mutant colon cancer. Cell Rep. 42 (4), 112324 (2023).
- Vandussen, K. L., et al. Development of an enhanced human gastrointestinal epithelial culture system to facilitate patient-based assays. Gut. 64 (6), 911-920 (2015).
- Miyoshi, H., Stappenbeck, T. S. In vitro expansion and genetic modification of gastrointestinal stem cells in spheroid culture. Nat Protoc. 8 (12), 2471-2482 (2013).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Woznicki, J. A., et al. Human BCL-G regulates secretion of inflammatory chemokines but is dispensable for induction of apoptosis by IFN-γ and TNF-α in intestinal epithelial cells. Cell Death Dis. 11 (1), 68 (2020).
- Edgar, R. D., et al. Culture-associated DNA methylation changes impact on cellular function of human intestinal organoids. Cell Mol Gastroenterol Hepatol. 14 (6), 1295-1310 (2022).
- Mubaid, F., Brown, C. M. Less is more: Longer exposure times with low light intensity is less photo-toxic. Microscopy Today. 25 (6), 26-35 (2017).
- Ziegler, U., Groscurth, P. Morphological features of cell death. News Physiol Sci. 19 (3), 124-128 (2004).
- Zhang, Y., Chen, X., Gueydan, C., Han, J. Plasma membrane changes during programmed cell deaths. Cell Res. 28 (1), 9-21 (2018).
- Tamura, H., et al. Evaluation of anticancer agents using patient-derived tumor organoids characteristically similar to source tissues. Oncol Rep. 40 (2), 635-646 (2018).
- Karki, R., et al. Synergism of TNF-α IFN-γ triggers inflammatory cell death, tissue damage, and mortality in SARS-CoV-2 infection and cytokine shock syndromes. Cell. 184 (1), 149-168 (2021).
- Geary, N. Understanding synergy. Am J Physiol Endocrinol Metab. 304 (3), E237-E253 (2013).
- Duarte, D., Vale, N. Evaluation of synergism in drug combinations and reference models for future orientations in oncology. Curr Res Pharmacol Drug Discov. 3, 100110 (2022).
- Wong, F. C., Woo, C. C., Hsu, A., Tan, B. K. The anti-cancer activities of Vernonia amygdalina extract in human breast cancer cell lines are mediated through caspase-dependent and p53-independent pathways. PLoS One. 8 (10), e78021 (2013).
- Ryall, K. A., Tan, A. C. Systems biology approaches for advancing the discovery of effective drug combinations. J Cheminform. 7, 7 (2015).
- Sukho, P., et al. Effect of cell seeding density and inflammatory cytokines on adipose tissue-derived stem cells: An in vitro study. Stem Cell Rev Rep. 13 (2), 267-277 (2017).
- Vaughan-Jackson, A., et al. Density dependent regulation of inflammatory responses in macrophages. Front Immunol. 13, 895488 (2022).
- Lumibao, J. C., et al. The impact of extracellular matrix on the precision medicine utility of pancreatic cancer patient-derived organoids. bioRxiv. , (2023).
- Lee, C., et al. TNF-α induces LGR5+ stem cell dysfunction in patients with Crohn's disease. Cell Mol Gastroenterol Hepatol. 13 (3), 789-808 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved