在基于高吸水性聚合物的自养系统上接种和观察丛枝菌根培养物
In This Article
Summary
在这里,我们描述了一种简单且廉价的技术,用于在基于高吸水性聚合物的自养系统中接种和观察丛枝菌根真菌。
Abstract
丛枝菌根 (AM) 真菌难以操作和观察,因为它们与植物根系永久关联并在根际繁殖。通常,AM 真菌在 体内 条件下与自养宿主一起在盆栽培养物中培养,或在 体外 条件下在培养皿中用 Ri Transfer-DNA 转化的根(异养宿主)培养。此外,盆栽培养中 AM 真菌的培养发生在不透明和非无菌的环境中。相比之下, 体外 培养涉及 AM 真菌在无菌、透明环境中的繁殖。最近开发了基于高吸水性聚合物的自养系统 (SAP-AS),并证明它结合了两种方法的优点,同时避免了它们各自的限制(不透明和异养宿主、无菌)。在这里,我们提出了一个详细的方案,用于易于制备、单孢子接种和观察 SAP-AS 中的 AM 真菌。通过修改培养皿,可以对活体标本进行高分辨率的照片和视频观察,这在目前的 体内 和 体外 技术中是困难或不可能的。
Introduction
丛枝菌根 (AM) 真菌 (Glomeromycotina) 是古老的植物根共生体 (~500 马 1,2),可能在气管植物在陆地土壤中的定植中发挥了重要作用。AM 真菌和气管植物之间的这种长期共同进化使丛枝菌根成为王国间共生的杰作。AM 真菌菌丝显着增加了宿主觅食土壤养分的能力3,包括通过菌根网络将养分带到新宿主4。菌丝网络改善了土壤结构,glomalin 的产生可以减少土壤侵蚀5。大气中部分碳转移到真菌根共生体会增加土壤碳封存6。总体而言,AM 真菌提高了植物对非生物和生物胁迫的恢复力,因此在农业生态学中受到了相当大的关注7。事实上,增材制造真菌友好型农业管理实践有可能减少作物生产中化学投入的使用并提高土壤有机碳含量,这是农民需要纳入其管理实践的重要目标,以遵守关于向可持续农业实践过渡和应对气候变化的国家和国际承诺。
然而,AM 真菌是土壤微观真菌,由于其专性生物养分和根际分布,其研究难度较大。土壤是最难研究的生境之一,因为它的不透明性、生态位的巨大多样性以及各种尺度的多营养相互作用。因此,AM 真菌的分离、繁殖和表征是困难的。直到 20世纪 中叶,只有形成孢子果皮的 AM 真菌物种被表征8。然而,大多数 AM 真菌物种产生直径为 ~20 μm 至 ~500 μm 的非孢子实体孢子。土壤湿筛技术9 (soil wet sieving technique) 的描述为描述这些 AM 真菌物种开辟了道路,从那时起物种描述的速度有所增加。然而,与 Dikarya 相比,AM 真菌代表了一小群物种。
诱捕培养物,即用孢子或含有 AM 真菌孢子的环境土壤样品接种装满高压灭菌材料(如土坯和蛭石)的花盆以及宿主的无菌种子(韭菜、车前草)的土壤样品,是在受控条件下繁殖 AM 真菌的一种方法10。然而,只能通过在染色后寻找根片段中是否存在丛枝,或者通过湿筛子样品或整个花盆来分离孢子来评估接种的成功。通常建议在分析盆栽培养物之前至少 6-12 周不要干扰系统。这种培养技术适用于繁殖大多数已知的 AM 真菌物种,但无法实时观察真菌共生体,并且接种成功是不确定的,尤其是在尝试单孢子培养时。
相反,由于培养基的透明度11,可以实时监测 AM 真菌的体外繁殖,但这种培养技术需要转化根的可用性和培养基中存在碳才能在无菌环境中工作。孢子必须进行消毒,再加上与异养宿主的结合,大多数已知的 AM 真菌物种都不能使用这种技术成功繁殖。
因此,使用当前技术传播 AM 真菌,虽然在大多数实验室中建立并广泛使用,但对 AM 真菌的研究存在一些局限性。Paré 等人 (2022)12 开发了一种体内 技术,使用透明高吸水性聚合物 (SAP) 与整株植物相结合来繁殖 AM 真菌。该技术设计为基于 SAP 的自养系统 (SAP-AS),简单且成本低廉,结合了盆栽培养(与自养宿主结合,非无菌条件)和 体外 培养(透明培养基,共生发育的实时监测)的优点。在这里,我们提出了一个方案,解释了如何用单孢子接种建立培养物,并使用 SAP-AS 对根外菌丝体进行高倍率观察。具体来说,我们描述了如何修饰两室培养皿、制备营养液、制备高吸水性聚合物 (SAP)、准备幼苗、组装 SAP-AS 并接种单个孢子、孢子发芽,并实时监测共生关系的发展。
Protocol
1. 双室培养皿的改良
注意: 此步骤所需的材料列在 材料表中。
- 修改培养皿盖。
- 使用旋转工具和适当的雕刻钻头,在盖子顶部钻两个孔(直径 ~7 毫米),并在侧面钻一个 1 厘米的开口。一个孔将用于灌溉根(蛭石)隔室,另一个孔用于菌丝 (SAP) 隔室。
- 修改培养皿底部。
- 使用电动旋转工具在培养皿底部的侧面为植物茎钻一个缺口。确保槽口不要太深,以防止液体流出。此缺口将与盖子上 1 厘米的开口对齐(步骤 1.1)。
- 要用尼龙网状滤膜替换双室培养皿的塑料屏障,请使用电动旋转工具在培养皿底部钻一个 30 mm 的矩形缺口。
- 为了进行高分辨率观察,请在培养皿底部钻直径为 ~25 毫米的圆孔。根据要求,在 SAP 侧打一个(或多个)孔,或在每个隔间中打一个。确保孔没有直接在盖子的灌溉孔下方钻孔。
- 安装尼龙网过滤膜。
- 使用金属导轨和回形针将尼龙网状滤膜楔入到位,然后将其牢牢地压在塑料屏障上。将膜的顶部与塑料屏障的顶部对齐。确保膜从导板底部伸出。
- 使用热成像套件,沿金属导轨的边缘切割以熔化并密封膜到培养皿底部和分隔两个隔室的塑料屏障。
- 在金属导轨和回形针仍在原位的情况下,用镊子小心地去除多余的尼龙网状滤膜。
- 在解剖显微镜下验证尼龙网状滤膜是否正确密封在塑料上,以防止根部渗透到菌丝 (SAP) 隔室中。
- 安装盖玻片。
注意:将盖玻片放在培养皿下方。这允许使用浸油并清洁盖玻片。- 将硅酮密封胶沿圆孔的边缘(培养皿底部外侧)放置。
- 将盖玻片放在培养皿底部的外侧,轻轻按压以确保完美粘附。
- 晾干,然后用剃须刀片去除多余的密封剂。
- 检查和清洁。
- 使用吹气去除可能粘附在培养皿上的任何灰尘或塑料碎片。
- 在解剖显微镜下检查以识别和纠正任何缺陷。
注意:戴上手套以避免在培养皿上留下指纹
2. 制备 1 L 营养液 mMS-1
- 准备储备溶液。
- 常量营养素:称取以下物质并将其溶解在 1 L 蒸馏水中:
7.31 g MgSO4·7 H2O、0.80 g KNO3、0.65 g KCl 和 0.048 g KH2PO4,. - 称取 2.88 g Ca(NO3)2·4H2O 并溶于 1 L 蒸馏水中。
- 称取 0.80 g NaFeEDTA 并溶于 0.5 L 蒸馏水中。
- 称取 0.375 g KI 并溶于 0.5 L 蒸馏水中。
- 微量营养素
- 溶解 3 g MnCl2·4H2O 加入 100 mL 蒸馏水中。
- 溶解 1.325 g ZnSO4·7H2O 溶于 100 mL 蒸馏水中。
- 将 0.75 g H3BO3 溶于 100 ml 蒸馏水中。
- 溶解后,混合在步骤 2.1.5.1-2.1.5.3 中制备的溶液。
- 称取 0.65 g CuSO4·5H2O 并溶于 50 mL 蒸馏水中。
- 溶解 0.12 g Na2MoO4·在 100 mL 蒸馏水中加入 2H2O。
- 将步骤 2.1.5.5 中的 5 mL 溶液和步骤 2.1.5.6 中的 1 mL 溶液添加到步骤 2.1.5.4 中的溶液中。
- 用蒸馏水将步骤 2.1.5.7 中获得的溶液体积调整至 500 mL。
- 常量营养素:称取以下物质并将其溶解在 1 L 蒸馏水中:
- 准备 1 L mMS-1 培养基。
- 将 700 mL 蒸馏水加入 2 L 玻璃瓶中。
- 在用磁棒不断搅拌的同时,加入 100 mL 常量营养素溶液(步骤 2.1.1)、100 mL 硝酸钙溶液(步骤 2.1.2)、5 mL EDTA 铁溶液(步骤 2.1.3)、1 mL KI 溶液(步骤 2.1.4)和 1 mL 微量营养素溶液(步骤 2.1.5)。
- 将溶液体积调节至 1000 mL。
注意:mMS-1 改编自 Bécard 和 Fortin (1988)14。由于 SAP-AS 不是无菌的,因此在 121 °C 下灭菌 15 分钟是可选的。由于 SAP 具有很强的缓冲作用,因此不调整 pH 值,Paré 等人(2022)12 表明 SAP 的条件相对中性(6.7 至 7.4)。
3. SAP 的准备
注意: 此步骤所需的材料列在 材料表中。
- 水合 SAP:将 5 g 干 SAP 与 500 mL mMS-1 营养液混合(步骤 2.2)。
- 在室温 (RT) 下水合 12 小时(过夜)。
- 沥干并收集水合的 SAP 颗粒。
- 当使用水合的 SAP 填充 12 孔板(第 7 节)时,不要排干水合的 SAP,并将水合的谷物和剩余的 mMS-1 营养液混合。
注意:干 SAP 有三种粒度可供选择:小、中和大。中等粒度 (1-2 mm) 是最合适的。大粒度计的 SAP 在水合时吞咽过多,培养皿盖无法关闭,而小粒度计 SAP 在它们之间留下的空间很小,这是观察颗粒之间真菌结构的限制。
- 当使用水合的 SAP 填充 12 孔板(第 7 节)时,不要排干水合的 SAP,并将水合的谷物和剩余的 mMS-1 营养液混合。
4. 幼苗的准备
注意: 此步骤所需的材料列在 材料表中。
- 在培养皿中用 mMS-1 营养液润湿的吸墨纸上发芽 P. lanceolata 的种子。
- 在 RT 的黑暗中孵育。
- 根据需要再水化,直到小根至少 2 厘米长。
5. SAP-AS 的组装和管理
注意: 此步骤所需的材料列在 材料表中。
- 组装 SAP-AS(步骤 1 + 步骤 2 + 步骤 3 + 步骤 4)
- 将幼苗茎放在培养皿侧面的凹槽中,根向内,子叶/叶子和茎向外。
- 用大约 1.5-2 克蛭石覆盖根部。
- 用 8 mL mMS-1 营养液水合根室。这将有助于稳定根和蛭石。
- 沿着根室一侧的尼龙网状滤膜加入 5 g 水合 SAP。
- 将 15 g 水合的 SAP 添加到菌丝隔室中。菌丝隔室是培养皿底部侧面没有缺口的隔室。
- 在用盖子合上培养皿之前,请确保盖子的侧槽口和培养皿底部对齐,以免损坏茎。
- 用一条连接底座和盖子的石蜡条密封培养皿,注意不要压碎年轻的茎。
- 称量并记录培养皿的平均重量,以确定何时需要再水化 SAP-AS。
- 堆叠培养皿以优化空间。使用不透明的盖子将培养皿放在黑暗中,侧面有一个开口用于幼苗。
- 管理 SAP-AS。
- 仅用 mMS-1 营养液水化培养皿。
- 使用平均重量作为参考。当培养皿减轻 5-6 g 时,加入 mMS-1 营养液以使其恢复到原始重量。确保蛭石和 SAP 保持水分但不被淹没。根部必须有氧气。
- 随着幼苗及其真菌伙伴的发育,更频繁地灌溉它们。没有必要同时给两个隔间浇水。灌溉要求根据幼苗的发育情况而变化,但也根据 SAP-AS 孵化的环境条件而变化。
- 如果植物有三片以上的健康叶子,通过去除老叶来减少灌溉需求。去除枯叶。
注:mMS-1 营养液中存在 K+、Mg2+ 和 Ca2+ 等阳离子往往会随着时间的推移降低 SAP 网络的扩张13 。
6. 用单个孢子接种 SAP-AS
注意: 此步骤所需的材料列在 材料表中。
- 接种单个孢子。
- 用火焰蜡烛或本生灯加热玻璃移液管。玻璃熔化时拉动以拉伸玻璃管,直到其分离。
- 在立体显微镜下,折断玻璃移液器的尖端以减小内径(通常为 100-300 μm)。这将极大地促进对单个孢子的操作。
- 打开培养皿,找到要放置孢子的位置,然后沿着尼龙网过滤膜在 5 g 水合 SAP 中清理出一个空间,以露出根的一部分。
- 在解剖显微镜下,用挤出的移液管吸取孢子。在移取孢子之前移取一些液体。收集孢子后避免移液。
- 在解剖显微镜下,小心地将孢子沉积在根部。移液孢子前移液的液体将有助于排出孢子。如果孢子没有沉积在最佳位置,请使用针灸针或刷毛使孢子重新与根部接触。如有必要,请拍摄沉积在根部的孢子的照片以供参考,并使用标记定位接种部位。
- 替换根片段上的 SAP,为根和孢子提供潮湿的微环境。在冲洗根室之前至少等待 24 小时,并注意不要将孢子从根上洗掉。
- 在用盖子关闭培养皿之前,请确保盖子的侧槽口和培养皿的底部对齐,以免损坏幼苗的茎。
注意:当根部到达尼龙网状滤膜时,SAP-AS 就可以接种了,最好在灌溉后几天,因此没有游离液体。
7. SAP 上的孢子萌发(可选)
注意: 此步骤所需的材料列在 材料表中。
- 孢子发芽。
- 混合水合的 SAP 以获得光滑的质地(参见步骤 3.3.1)。气泡通常在 24 小时内消失,或者通过高压灭菌(可选)混合 SAP 消失。
- 使用不带针头的 20 mL 注射器,将大约 2 g(相当于 2 mL)混合的 SAP 移液到 12 孔板的每个孔中。
- 在解剖显微镜下选择孢子,并按照第 6 节所述使用挤出移液器。
- 在解剖显微镜下,在每个孔的中心放置一个孢子。
- 在 RT 下避光孵育 12 孔板并定期监测发芽。
- 在解剖显微镜下,选择菌丝生长的孢子(至少几毫米长)。
- 向孔中加入 1 mL mMS-1 营养液,等待几分钟,让培养基变得更流畅。
- 如有必要,使用针灸针轻轻去除基质上的孢子和菌丝。
- 用移液管或将幼苗的根部带到培养基表面收集孢子,以便将孢子和菌丝粘附在根部。然后,按照步骤 5.1.3 中的说明将幼苗放入培养皿中。
注意:协调孢子萌发和幼苗生长。这种方法只用 R. irregularis 孢子进行了测试。
8. 共生发展实时监测
注意: 此步骤所需的材料列在 材料表中。
- 常规使用解剖显微镜、正置显微镜或倒置显微镜进行观察。
- 使用具有白色照明和暗视野的解剖显微镜以 20 倍 – 40 倍观察每个隔室的顶部。
- 如果没有倒置显微镜,则通过倒置培养皿,用解剖或正置显微镜观察每个隔室的底部。在倒置培养皿之前,让 SAP-AS 干燥 2 天,使 SAP 略微粘附在培养皿的底部。
- 通过培养皿底部以 40 倍进行详细观察,并通过盖玻片以高达 100 倍(油浸)进行详细观察。
- 观察孢子和菌丝网络。
注意:SAP 颗粒内部形成的真菌结构可以染色。- 根据 Vierheilig 等人 (1998)15 制备墨水和醋溶液。不要加热。
- 提取含有菌丝和孢子的 SAP 颗粒,并将其置于 RT 的墨水中。墨水会在几分钟内渗透到 SAP 颗粒并弄脏菌丝和孢子。
- 取出 SAP 颗粒并将其放入 mMS-1 营养液或自来水中。墨水将在 12 小时内从谷物中流出,但孢子和菌丝仍会染色。
- 将 SAP 颗粒压在两张显微镜载玻片之间,使其变平,以便进行摄影和孢子计数。
- 观察丛枝。
- 从根室中提取一些根,并根据 Vierheilig 等人 (1998) 15 使用墨水和醋方案染色。小心不要将根部浸入 KOH 溶液中超过 2-3 分钟;否则,根部将变得过于脆弱,无法进行以下步骤,并分解成无法使用的碎片。
- 在解剖显微镜下,选择一个约 5 毫米长且可能包含丛枝的根片段,并将其放在载玻片上的一滴水中。
- 使用针灸针或极细的镊子,将根部分成几层撕下。
- 吸收水分并在显微镜下检查带有丛枝的节段是否仍然存在且质量令人满意,并正确放置在载玻片上。此时,丛枝必须在根单元层中易于看到。
- 干燥 2-3 分钟,使根层粘附在载玻片上。加入一滴聚乙烯醇-乳酸甘油 (PVLG) 缓冲液,并加入盖玻片。通过标准显微镜方法观察。
Representative Results
SAP-AS 是一种简单且廉价的技术,用于培养 AM 真菌并观察根内和根外真菌结构的发展。在这里,我们提供了一个详细的协议来帮助用户设置 SAP-AS,并且与 SAP-AS 的原始描述相比,我们引入了两个修改。
首先,沿 Nitex 膜的根区室中存在 SAP 有助于用单个孢子接种系统(图 1)。
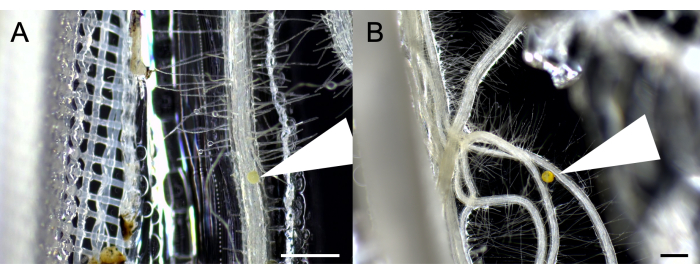
图 1:SAP-AS 的单个孢子接种。 (A) 用 不规则根瘤 菌的单个孢子接种。(B) 用 Funneliformis mosseae 的单个孢子接种。白色箭头表示接种点。比例尺:500 μm。 请单击此处查看此图的较大版本。
很容易识别出孢子可以沉积的几个根的区域。孢子的确切位置可以在培养皿盖的表面标记,并定期检查根的发芽和定植情况。SAP 水合颗粒的存在提供了有利于孢子发发的潮湿环境。接种在 Nitex 膜旁边的根上允许与根外菌丝体的快速共生关系发展,以快速进入菌丝室并寻找营养物质(图 2)。观察放置在接种点的单个孢子是否发芽的能力也使我们能够识别和去除不成功的培养物并更换它们。
其次,培养皿底部的盖玻片允许对 AM 真菌共生进行高分辨率实时成像(图 2B、C),特别是根外菌丝体内的细胞质流动(图 2D)。
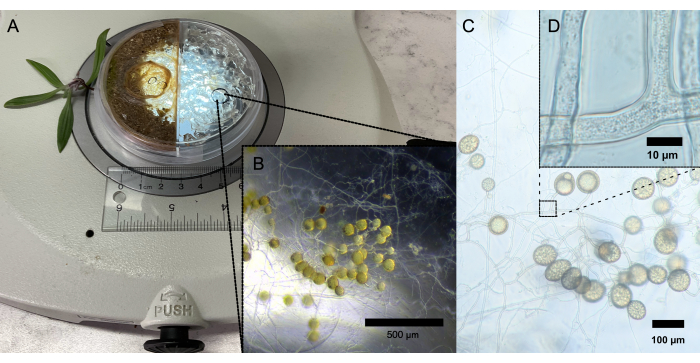
图 2:接种的 SAP-AS。 (A) 接种不 规则根瘤菌 (DAOM 197198) 的单个孢子的 SAP-AS。寄主植物是 车前草。(B) 在立体显微镜下通过菌丝室中的盖玻片观察到的孢子簇。比例尺:500 μm。(C) 在光学显微镜下以 10 倍放大倍率通过盖玻片观察到的孢子簇的高分辨率照片。比例尺:100 μm (D) 在光学显微镜下以 100 倍放大倍率通过盖玻片观察到的菌丝的高分辨率照片。比例尺:10 μm。 请点击此处查看此图的较大版本。
用户可以尝试在用 mMS-1 营养液水合的 SAP 上发芽 AM 真菌孢子,以保证 SAP-AS 仅接种活孢子(图 3)。然而,这仅用 R. irregularis 的商业孢子进行了测试,并且孢子在用 mMS-1 营养液水合的 SAP 上的成功率可能因其他 AM 真菌物种而有很大差异。

图 3: R. irregularis 孢子在 12 孔板中的发芽。 比例尺:500 μm。 请点击此处查看此图的较大版本。
最后,由于 SAP-AS 是一种用于繁殖 AMF 的 体内非无菌技术,因此可以在工作台上操作培养皿并打开以采样定植的根、游离孢子或 SAP 的定植颗粒(图 4)。根内和根外真菌结构可以以类似于在罐或根器官培养物中传播的 AMF 的方式进行染色(图 4C)。
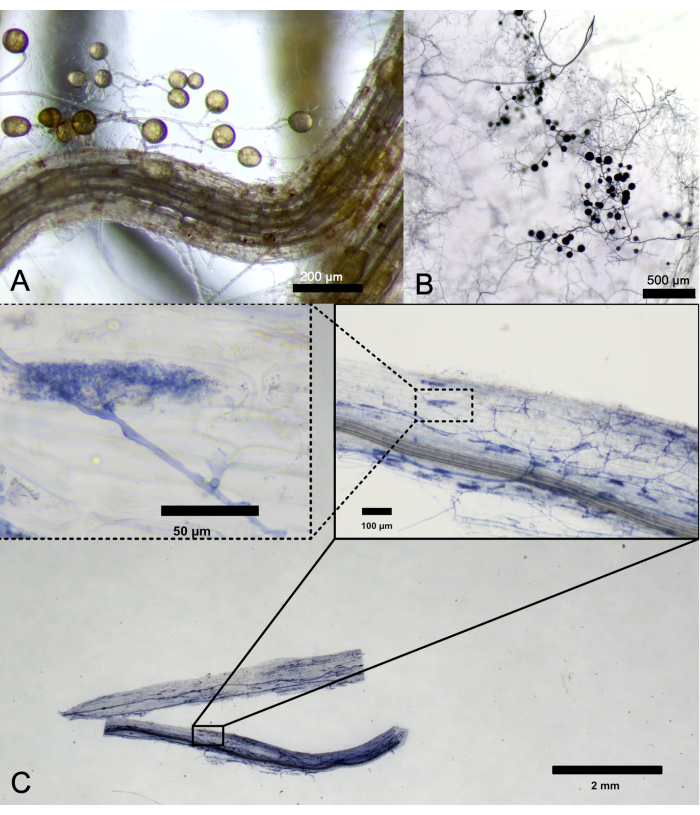
图 4:从 SAP-AS 中提取的根外和根内 AM 真菌结构。 (A) 在根室中观察到 不规则 R. irregularis 的游离孢子。比例尺:200 μm。(B) 在 SAP 中染色的 R. irregularis 孢子。比例尺:500 μm。(C) 染色的根片段显示根内菌丝和丛枝。比例尺:50 μm、100 μm。 请点击此处查看此图的较大版本。
补充图 1:可用于操纵 AM 真菌孢子的各种工具的厚度比较。请点击此处下载此文件。
补充图 2:堆叠式 SAP-AS。请点击此处下载此文件。
Discussion
接种是该方案中最关键的步骤,挤压玻璃巴斯德移液器被证明是准确操纵 AM 真菌单个孢子同时保持其完整性的绝佳工具。挤压玻璃巴斯德移液器很容易使用蜡烛或本生灯的火焰成型,并且可以在立体显微镜下调整开口以匹配被移液孢子的大小。重要的是用适合 AM 真菌孢子大小的工具操纵孢子(补充图 1),并在宿主植物根足够长以到达孢子沉积的 Nitex 膜时接种 SAP-AS。
SAP-AS 易于适应实验要求。可以使用具有多个隔室的较大培养皿来监测近亲菌株之间或不同种类的 AMF 之间的相互作用,或改变化学 (pH) 或生物环境(引入线虫、细菌、真菌)。各种真菌营养寄主植物也可用于为 AM 真菌提供光合产物。营养液 mMS-1 来源于 Bécard 和 Fortin (1988)15 描述的最小 (M) 培养基配方,减去蔗糖、维生素和细菌琼脂以限制碳源。然而,根据实验目标,SAP-AS 可以补充各种营养液。
AM 真菌在 SAP-AS 中的繁殖需要定期浇水。蛭石和 SAP 的有限体积使根和 AM 真菌暴露在湿度波动中,尤其是在标准的两室培养皿(直径 10 厘米)中。随着时间的推移,SAP 颗粒的膨胀能力以及透明度会降低。事实上,营养液中阳离子的存在逐渐限制了丙烯酸酯网络的扩展,需要在数月后更换 SAP。此外,如果培养皿没有得到适当的避光保护或过度浇水,绿藻和霉菌可能会随着时间的推移而生长。
迄今为止,已在 SAP-AS 中成功培养了 7 种 AM 真菌,这远低于可以在盆栽培养中繁殖的 AM 真菌物种的数量。然而,SAP-AS 中的生物和非生物条件与盆栽培养中的条件非常相似,其他 AM 真菌物种很可能能够在 SAP-AS 中繁殖。如果使用非无菌孢子/种子进行接种,由于 SAP 中根渗出物和/或细菌的存在,孢子在 SAP-AS 中的直接接种可能提供更接近自然土壤中根际的环境条件。这应该比接种发芽的孢子更可取。此外,在 AMF 中触发孢子萌发的条件仍然知之甚少,因此用 mMS-1 营养液水合的 SAP 可能无法适应其他 AM 真菌物种的孢子发芽。测试了用 mMS-1 营养液水合的 SAP 上的孢子萌发,以专门选择活孢子用于接种步骤,仅使用 R. irregularis 接种物。
在 SAP-AS 中很容易进行 AM 共生发展的接种和监测。改良的双室培养皿允许培养不同的 AM 真菌种类。Paré 等人12 已经繁殖了来自 6 个属和 3 个科的 7 种不同的 AMF 物种。使用廉价工具可以轻松完成双室培养皿的修改。制备和维护 SAP-AS 所需的材料(蛭石、SAP、巴斯德移液器等)和试剂 (mMS-1) 的成本和数量是有限的,因此可以以最低的成本管理大量的 SAP-AS。与盆栽培养物相比,堆叠 SAP-AS 的能力还显著减少了 AM 真菌培养物的足迹。例如,50 个 SAP-AS(5 堆 10 个)可以放在一个 1 m 长的架子上(补充图 2)。这些功能使 SAP-AS 成为一种简单且廉价的技术,与高中实验室课程或大学本科阶段的增材制造共生教学兼容。SAP 的定植颗粒可用于接种新的 SAP-AS 或盆栽培养物。
培养皿底部背面的盖玻片允许对根外真菌结构进行高分辨率照片和视频。在非常接近自然条件的生活条件下可以很容易地研究细胞质流动。这对于研究与其菌丝体相关的 AM 真菌功能(养分、水分运输、土壤结构等)和菌丝形态发生研究非常重要。
AMF 在植物根系和根际完成它们的生物循环。由于观察土壤环境的固有困难,土壤微生物的研究很复杂。SAP-AS 的主要目标是重建一个尽可能类似于根际的环境,以便 AM 真菌的繁殖,同时保持非常详细地观察 AM 真菌发育的能力。因为这意味着非无菌条件,所以应限制可用碳的量,以避免腐生微生物的增殖。关于 AM 真菌在根际行为的了解仍然极其有限,SAP-AS 提供了在物种之间就它们在自由基外环境中觅食的能力、孢子产生和根定植进行详细比较的可能性。通过增加与其他土壤物种(如细菌、线虫、原生生物和根系真菌病原体)的相互作用,这可能会使情况进一步复杂化,并且由于 SAP-AS 可以提高土壤微生物群相互作用的知识。
Disclosures
作者没有什么可披露的。
Acknowledgements
我们要感谢两位匿名审阅者的建议。这项研究的资金由加拿大农业和农业食品部 (AAFC) 在 J-002295(管理和增强 AAFC 的生物收藏)项目下提供。
Materials
| Name | Company | Catalog Number | Comments |
| 100 x 15 mm Stackable Bi-Plate | Kord Valmark | 1204U09 | https://www.thomassci.com/Laboratory-Supplies/Petri-Dishes/_/100-x-15-mm-Stackable-Bi-Plate |
| 12-well plate | Greiner Bio-one | 665180 | https://shop.gbo.com/en/row/products/bioscience/cell-culture-products/cellstar-cell-culture-multiwell-plates/665180.html |
| 18 mm round glass coverslips | Fisher Scientific | 12-545-100 | https://www.fishersci.com/shop/products/fisherbrand-cover-glasses-circles-11/12545100#?keyword=12-545-100 |
| 20 mL Syringe PP/PE without needle | Millipore Sigma | Z683620-100EA | https://www.sigmaaldrich.com/CA/en/product/aldrich/z683620?utm_source=google&utm_medium= cpc&utm_campaign=20674735406 &utm_content=157607444391&gc lid=Cj0KCQiA5rGuBhCnARIsAN11 vgQOT_WPRg9WFyBEyoO4b0x1 -F7Tks4houU7VTRS5EiYM9l0F-B oL7saAmFoEALw_wcB |
| Acupuncture needle | Lierre | A143-LP1-3075 | https://www.lierre.ca/products/lierre-plus-acupuncture-needles-100pcs?gad _source=1&gclid=Cj0KCQiA5rGuBh CnARIsAN11vgTwupmw51UTdR k9cKr4ewi12W3dyVikenzH3sjdUB4 g41G-_KnvppoaAkbTEALw_wcB& utm_campaign=PMax-needles&utm_content=shopify_CA_ 5213169090694_35001500991622 &utm_medium=cpc&utm_source= google&variant=35001500991622 |
| Blotting paper | FLINN | FB0678 | https://www.flinnsci.ca/blotting-paper-12-x-19-pkg.-of-10/fb0678/ |
| Commercial or scientific blender or kitchen hand blender | kitchenaid | KHBV53DG | https://www.kitchenaid.ca/en_ca/countertop-appliances/hand-blenders/hand-blender-products/p.variable-speed-corded-hand-blender.khbv53dg.html |
| Dremel 199 Carving Bit | Dremel | 2615000199 | https://www.dremel.com/ca/en/p/199-2615000199 |
| Dry SAP medium granulometry 1–2 mm | HORTA-SORB MD | 00810085242789 | https://www.horticulturalalliance.com/product/horta-sorb-md-granule/ |
| Feather Stainless-Steel Blades for Dissecting Knife Handles | Fisher Scientific | 08-916-5B | https://www.fishersci.ca/shop/products/graham-field-stainless-steel-blades-dissecting-knife-handles-8/089165b |
| Glass Pasteur pipettes 230 mm | Kimble | RK-25554-14 | https://www.coleparmer.ca/i/dwk-life-sciences-kimble-disposable-pasteur-pipettes-plugged-end-borosilicate-glass-230-mm-1000-cs/2555414 |
| Ink | Sheaffer | 94321 | https://www.amazon.com/Sheaffer-Skrip-Bottled-Black-94231/dp/B002IKKKUU |
| Melting guide: modified paint Scraper, 2-in | Mastercraft | #049-7335-8 | https://www.canadiantire.ca/en/pdp/mastercraft-carbon-steel-flexible-spackling-putty-knife-wall-paint-scraper-2-in-0497335p.0497335.html?loc=plp |
| Microscopy glass slide | Fisher Scientific | 12-552-5 | https://www.fishersci.com/shop/products/fisherbrand-frosted-microscope-slides-4/125525 |
| Nitex nylon mesh filter screen | Dynamic Aqua-Supply Ltd. | NTX30-108 | https://dynamicaquasupply.com/products/nitex-screen?_pos=1&_sid=ffc105328&_ss=r& variant=6945749106731 |
| Paper clip | Makanu | Clips-BK-41mm-24 | https://www.amazon.ca/classeur-standard-grandes-trombones-excellentes |
| Parafilm | Avantor/vwr | 470201-930 | https://www.avantorsciences.com/ca/en/product/8882964/parafilm |
| Plantago lanceolata seeds | ecoumene | NA | https://www.ecoumene.com/produit/semences/herbacees/plantain-lanceole-bio/ |
| Polyvinyl alcohol-lactic acid-glycerol (PVLG). | NA | NA | https://invam.ku.edu/recipes |
| Pyrography kit with fine tip | Walnut Hollow | 483103 | https://www.walnuthollow.com/collections/creative-wood-burning/products/walnut-hollow-creative-versa-tool |
| Silicone sealant | Aqueon | 100165003 | https://www.aqueon.com/products/aquariums/silicone-sealant |
| Surgeon scalpel handle | Fisher Scientific | 22-079657 | https://www.fishersci.ca/shop/products/surgical-design-scalpel-handles-blades/22079657#?keyword=scalpel |
| Two Speed Rotary Tool Kit | Dremel | 200-1/21 | https://www.dremel.com/ca/en/p/200-1-21-f0130200ah |
| Vermiculite | PRO-MIX | 4981110 | https://www.canadiantire.ca/fr/pdp/vermiculite-pro-mix-9-l-0597936p.0597936.html |
| X1000 Round Coverslip dia. 30 mm #1 (0.13–0.16 mm) | Fisher Scientific | 12164692 | https://www.fishersci.fi/shop/products/x1000-cover-slip-diam-30-mm-n-1-1/12164692 |
References
- Dotzler, N., Krings, M., Taylor, T. N., Agerer, R. Germination shields in Scutellospora (Glomeromycota: Diversisporales, Gigasporaceae) from the 400 million-year-old Rhynie chert. Mycol Prog. 5 (3), 178-184 (2006).
- Redecker, D. Glomalean fungi from the ordovician. Science. 289 (5486), 1920-1921 (2000).
- Olsson, P. A., Jakobsen, I., Wallander, H. . Foraging and Resource Allocation Strategies of Mycorrhizal Fungi in a Patchy Environment. Mycorrhizal Ecology. Ecological Studies. , (2003).
- Zheng, C., Chai, M., Jiang, S., Zhang, S., Christie, P., Zhang, J. Foraging capability of extraradical mycelium of arbuscular mycorrhizal fungi to soil phosphorus patches and evidence of carry-over effect on new host plant. Plant Soil. 387 (1-2), 201-217 (2015).
- Singh, A. K., et al. The role of glomalin in mitigation of multiple soil degradation problems. Crit Rev Environ Sci Technol. 52 (9), 1604-1638 (2022).
- Wilson, G. W. T., Rice, C. W., Rillig, M. C., Springer, A., Hartnett, D. C. Soil aggregation and carbon sequestration are tightly correlated with the abundance of arbuscular mycorrhizal fungi: results from long-term field experiments. Ecol Lett. 12 (5), 452-461 (2009).
- Gianinazzi, S., Gollotte, A., Binet, M. -. N., van Tuinen, D., Redecker, D., Wipf, D. Agroecology: the key role of arbuscular mycorrhizas in ecosystem services. Mycorrhiza. 20 (8), 519-530 (2010).
- Stürmer, S. L. A history of the taxonomy and systematics of arbuscular mycorrhizal fungi belonging to the phylum Glomeromycota. Mycorrhiza. 22 (4), 247-258 (2012).
- Gerdemann, J. W., Nicolson, T. H. Spores of mycorrhizal Endogone species extracted from soil by wet sieving and decanting. Trans Br Mycol Soc. 46 (2), 235-244 (1963).
- Walker, C., Vestberg, M. A simple and inexpensive method for producing and maintaining closed pot cultures of arbuscular mycorrhizal fungi. Agr Sci Finland. 3, 233-240 (1994).
- Fortin, J. A., et al. Arbuscular mycorrhiza on root-organ cultures. Can J Bot. 80 (1), 1-20 (2002).
- Paré, L., Banchini, C., Hamel, C., Bernier, L., Stefani, F. A simple and low-cost technique to initiate single-spore cultures of arbuscular mycorrhizal fungi using a superabsorbent polymer. Symbiosis. 88, 61-73 (2022).
- Saha, A., Sekharan, S., Manna, U. Superabsorbent hydrogel (SAH) as a soil amendment for drought management: A review. Soil Tillage Res. 204, 104736 (2020).
- Bécard, G., Fortin, J. A. Early events of vesicular-arbuscular mycorrhiza formation on Ri T-DNA transformed roots. New Phytol. 108 (2), 211-218 (1988).
- Vierheilig, H., Coughlan, A. P., Wyss, U., Piché, Y. Ink and vinegar, a simple staining technique for arbuscular-mycorrhizal fungi. Appl Environ Microbiol. 64 (12), 5004-5007 (1998).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved