הסרת בקטריופאג' מתרביות סלמונלה נגועות
In This Article
Summary
בקטריופאג'ים, הנמצאים בכל מקום ומגוונים על פני כדור הארץ, מדביקים ומשתכפלים בתוך פונדקאים חיידקיים, וממלאים תפקיד מכריע במערכות אקולוגיות מיקרוביות. למרות חשיבותם, נוכחותם עלולה לשבש תהליכים תעשייתיים. פיתחנו שיטה המשתמשת בליפופוליסכרידים חיידקיים לסילוק בקטריופאג'ים מתרביות סלמונלה .
Abstract
בקטריופאג'ים, או פשוט פאג'ים, ממלאים תפקיד חיוני בסביבות מיקרוביות, משפיעים על אוכלוסיות חיידקים ומעצבים את האבולוציה והאינטראקציות שלהם. אורגניזמים אלה הם וירוסים שמדביקים ומשתכפלים בתוך פונדקאים חיידקיים. פאגים נמצאים בכל מקום על כדור הארץ, מגוונים מאוד, ושופעים מאוד. בעוד שלבקטריופאג'ים יש תפקידים חשובים בסביבות שונות והם תחום מפתח של מחקר במיקרוביולוגיה ובאקולוגיה, נוכחותם יכולה להיות בלתי רצויה בתהליכים או מוצרים תעשייתיים מסוימים. בהתחשב בשפע ובשכיחות של בקטריופאג'ים על פני כדור הארץ, תכנון נהלים לסילוק בקטריופאג'ים מתרביות חיידקים הוא חיוני ביישומי מעבדה ותעשייה מגוונים כדי לשמור על שלמות התרביות ולהבטיח תוצאות ניסוי מדויקות או איכות המוצר. כאן, כיווננו פרוטוקול לסילוק הבקטריופאג'ים מתרביות סלמונלה אנטריקה נגועות, תוך שימוש באסטרטגיה המבוססת על שימוש בליפופוליסכרידים (LPS) הממוקמים בקרום החיצוני של חיידקים גראם-שליליים. LPS חיידקי ממלא תפקיד חשוב בזיהוי מארח על ידי פאגים, ואנו עושים שימוש בתכונה זו כדי לתכנן הליך יעיל להסרת פאגים, המשתמשים ב- LPS כקולטן, בתרביות חיידקי סלמונלה .
Introduction
אוכלוסיות מיקרוביאליות מתמודדות עם אתגרים מרובים בסביבות טבעיות, ואיום חמור במיוחד הוא פוטנציאל ההדבקה על ידי בקטריופאג'ים, הנגיפים שמדביקים חיידקים1. וירוסים אלה נפוצים על פני כדור הארץ, ומציגים מגוון ושפע רב 2,3,4,5. אף על פי שהבקטריופאג'ים מגוונים בגודלם, במורפולוגיה ובארגון הגנומי, לכולם אותו מבנה: גנום דנ"א או רנ"א העטוף בקפסיד שנוצר על ידי חלבונים המקודדים בפאגים6. חיידקים פיתחו מערך מגוון של מנגנוני הגנה נגדם7. היבט מרכזי של זיהום בקטריופאג'ים, הרלוונטי הן לאפיון והן לזיהוי, הוא תחומי קשירת הקולטנים הנמצאים על סיבי הזנב. לבקטריופאג'ים יש חלבונים על פני השטח שלהם הנקראים חלבונים קושרי קולטן או סיבי זנב לזיהוי וקשירה לאתרי קולטנים ספציפיים על פני התא החיידקי. במקרה של חיידקים גראם-שליליים, זיהוי מבני פני השטח, כגון ליפופוליסכרידים (LPS), חלבוני קרום חיצוני, פילי ו/או שוטונים, מעורבים באינטראקציה בין פאג'ים לחיידקים8. אינטראקציה זו בין בקטריופאג'ים לחיידקים היא ספציפית מאוד ותלויה בעיקר ביכולתם להיצמד למשטחים מארחים. אנטיגן O-של lipopolysaccharide הוא קולטן נפוץ9.
חקר יחסי הגומלין בין חיידקים לבקטריופאג'ים הוא לא רק מרתק מנקודת מבט ביולוגית, אלא יש לו גם יישומים מעשיים בתחומים כגון טיפול בפאגים וביוטכנולוגיה. בעוד שלבקטריופאג'ים יש תפקידים חשובים בהקשרים שונים, למשל, שינוי אוכלוסיות מיקרוביאליות10, נוכחותם יכולה להיות בלתי רצויה בתהליכים תעשייתיים מסוימים. בתרופות, ביוטכנולוגיה וייצור מזון, נוכחותם של בקטריופאג'ים יכולה להשפיע על האיכות והבטיחות של המוצרים הסופיים, מה שהופך את הסרתם לחיונית כדי לעמוד בתקני איכות. בעיבוד ביולוגי ובייצור ביולוגי, שבו תרביות חיידקים משמשות לייצור תרכובות שונות (למשל חלבונים, אנזימים או אנטיביוטיקה), נוכחותם של בקטריופאג'ים עלולה להוביל לשיבוש תהליכי הייצור בשל יכולתם לאזן את אוכלוסיית החיידקים בכל סביבה משותפת. פאגים יכולים לפעמים להפוך את חייו המקצועיים של המיקרוביולוג התעשייתי לסיוט11 . התכנון של נהלים יעילים לסילוק פאגים הוא קריטי כדי להבטיח ייצור עקבי ואמין, שיפור יעילות התהליכים. מלבד היבטים תעשייתיים אלה, בסביבה של מעבדת מחקר, שבה דיוק ויכולת שחזור הם קריטיים, חיסול הבקטריופאג'ים חיוני להשגת תוצאות מדויקות ואמינות. יתר על כן, הסרת פאגים יכולה לשמש גם להדמיית סביבות שונות כדי לבחון השערות שונות12. סילוק פאגים יכול גם להיות שימושי מאוד בסביבת המחקר מאחר שמחקרים רבים המבוססים על פאגים, כגון ספירת חיידקים לאחר יישום פאגים, יפיקו תועלת מצעד לסילוק פאגים כדי לייצר ספירות בנות קיימא אמינות הרבה יותר.
הסרת פאגים המבוססת על בידוד מושבות תארך מספר ימים כדי להבטיח שהמושבות יהיו נקיות מפאגים, בעוד שההליך המתואר כאן מאפשר יצירת תרביות נטולות פאגים תוך שעות. פרוטוקול זה מאפשר לנו לעקוב אחר האבולוציה של תרביות חיידקים מבלי למנוע מהן לבודד מושבות. במובן זה, ניתן לדמות סביבות משתנות (נוכחות ו / או היעדר פאגים) כדי לבחון השערות שונות. יתר על כן, פרוטוקול זה מאפשר ניתוח איכותי וכמותי של נוכחות פאגים בתרבית חיידקים.
לסיכום, תכנון נהלים חסכוניים לסילוק בקטריופאג'ים חיוני לשמירה על איכות המוצר, בטיחותו ויעילות התהליך בתעשיות שונות ולהתקדמות במחקר בסיסי ויישומי. במאמר זה אנו מתארים פרוטוקול יעיל ביותר המבוסס על שימוש ב-LPS לסילוק בקטריופאג'ים, המשתמשים ב-LPS כקולטן, מתרביות סלמונלה נגועות, שהוא גם חסכוני בזמן וגם דורש ציוד מינימלי.
Protocol
הערה: לפני ביצוע הליך חיסול הפאגים, אנו מתארים את הכנת תרבית סלמונלה נגועה בבקטריופאג'ים 9NA. באיור 1 מומחש ייצוג כללי של התהליך המלא לסילוק בקטריופאג'ים בתרביות חיידקים.
1. הכנת תרביות סלמונלה נגועות בבקטריופאג'ים
- הכנת תרבית חיידקים
הערה: במחקר זה, Salmonella enterica subsp. enterica serovar Typhimurium זן ATCC 14028 opvAB::lacZ (SV8011)13 שימש.- הפשירו באיטיות את הבקבוקון שנלקח מ -80 מעלות צלזיוס המכיל את זן S. enterica של עניין על ידי הנחתו על קרח.
- פזרו את זן S. enterica מציר הדימתיל סולפוקסיד המופשר על צלחת ציר לנוקס (LB) (10 גרם/ליטר טריפטון, 5 גרם/ליטר NaCl, 5 גרם/ליטר תמצית שמרים ו-15 גרם/ליטר אגר, ראו טבלת חומרים). לדגור את הצלחת ב 37 ° C במשך 24 שעות.
- בעזרת מחט חיסון, מעבירים מושבה מצלחת S. enterica ומחסנים אותה ל-5 מ"ל של LB נוזלי בצינור זכוכית. יש לדגור ב-37°C למשך 24 שעות עם אוורור על ידי טלטול ב-200 סל"ד.
- הכנת בקטריופאג'
הערה: Bacteriophage 9NA, השייך למשפחה Siphoviridae (סדר Caudovirales)14, שימש בפרוטוקול זה. יש לציין כי ניתן להשתמש בבקטריופאג'ים אחרים של סלמונלה אנטריקה המשתמשים באנטיגן O של הליפופוליסכריד כקולטן.- הכינו את ציר הבקטריופאג' על ידי הוספת 0.1 מ"ל של בקטריופאג' ליזט מרוכז לתערובת של 100 מ"ל ציר מזין (NB; 5 גרם / ליטר פפטון ו 3 גרם / ליטר תמצית שמרים), 2 מ"ל של 50x מלחי E (38.78 mM MgSO47 H2O, 520.5 mM חומצת לימוןH2O, 2.87 M K2HPO4 נטול מים ו 829 mM NaNH4HPO44 H2O) ו 0.4 מ"ל של 50% גלוקוז. מערבבים היטב על ידי היפוך.
- דוגמה מייצגת לריכוז בקטריופאג' יכולה להיות 109 PFU/mL (Plaque Forming Units/mL), אך ניתן להשתמש בריכוזים נמוכים יותר עם תוצאות דומות (ראו טבלת חומרים). להעריך את ריכוז הבקטריופאג'ים לאחר שלב 1.2.3.
- הכינו ליזט על ידי ביצוע השלבים המתוארים להלן.
- הכינו את S. enterica inoculum ב-5 מ"ל של LB (10 גרם/ליטר טריפטון, 5 גרם/ליטר NaCl ו-5 גרם/ליטר תמצית שמרים). יש לדגור ב-37°C וב-200 סל"ד למשך 24 שעות.
- מערבבים 4 מ"ל של מרק bacteriophage עם 1 מ"ל של תרבות לילה של S. enterica. לדגור את התערובת ב 37 ° C ו 200 סל"ד במשך 8 שעות.
- כדי להבחין בין חיידקים לבקטריופאג'ים, צנטריפוגו את התערובת במהירות של 2,377 x גרם למשך 20 דקות. לשחזר את supernatant בתוך צינור זכוכית, להוסיף 800 μL של כלורופורם (ראה טבלה של חומרים), ולסובב אותו. הקפידו להעביר את השלב העליון רק כאשר משתמשים בתערובת עם כלורופורם.
הערה: חשוב למנוע העברה של כלורופורם שיורי, אשר עלול להשפיע על יעילות ההליך. שלב הכלורופורם נפוץ הן בפרוטוקולי בידוד והן בפרוטוקולי התפשטות כדרך למקסם פאגים משוחררים. עם זאת, כלורופורם עלול להשבית חלק מהפאגים או להרוס את ההדבקה שלהם15. לכן, שלב זה חל רק על פאגים עמידים לכלורופורם. - שמור את lysates בטמפרטורת החדר במשך 2 שעות ולאחר מכן לאחסן אותם ב 4 ° C.
- טיטרט את הליזט כדי לכמת את מספר הבקטריופאג'ים/מספר PFU למ"ל הנמצאים בליזט המוכן. לשם כך, בצע את טכניקת הכיסוי המתוארת להלן.
- הכן 5 מ"ל של LB של inoculum עבור S. enterica. יש לדגור ב-37°C למשך 24 שעות עם אוורור על ידי טלטול ב-200 סל"ד.
- בצע דילול סדרתי של הליזט לתוך LB כדי להגיע למספר ניתן לספור של PFU/mL. כדי לקבוע את גורמי הדילול הדרושים, זהה את הבקטריופאג 'ליזט הראשוני מרוכז. לדוגמה מייצגת של ריכוז בקטריופאג'ים בסביבות 109 PFU/mL, גורמי הדילול שמביאים למספר רב של פלאקים הם בין 106-10 10.
- הוסף 100 μL של דילול lysate המתאים ו 60 μL של תרבית הלילה של S. enterica מוכן יום קודם 5 מ"ל של LB אגר רך, מוכן על ידי ערבוב LB נוזלי LB ו LB-אגר בפרופורציה 1: 1 ושמירה על 56 ° C כדי למנוע התמצקות. מערבבים בזהירות, ונמנעים מבועות.
- יוצקים כל תערובת לחלק העליון של צלחת LB ושומרים על הספסל עד שהמדיום מתמצק.
- צלחות לדגור במשך 24 שעות ב 37 ° C. ספור את מספר הפלאק על כל צלחת. כדי לקבוע את מספר PFU/mL, הכפל את מספר הפלאק של כל צלחת בגורם הדילול (FD). כדי להבטיח זיהום פאגים יעיל, 109-10 12 PFU/מ"ל נחוצים.
PFU/mL= לא. לוחות בצלחת x FD
- הכינו את ציר הבקטריופאג' על ידי הוספת 0.1 מ"ל של בקטריופאג' ליזט מרוכז לתערובת של 100 מ"ל ציר מזין (NB; 5 גרם / ליטר פפטון ו 3 גרם / ליטר תמצית שמרים), 2 מ"ל של 50x מלחי E (38.78 mM MgSO47 H2O, 520.5 mM חומצת לימוןH2O, 2.87 M K2HPO4 נטול מים ו 829 mM NaNH4HPO44 H2O) ו 0.4 מ"ל של 50% גלוקוז. מערבבים היטב על ידי היפוך.
- זיהום של תרביות סלמונלה עם בקטריופאג'ים
- לדלל תרבית לילה של S. enterica ל 1:100 בנפח סופי של 5 מ"ל של LB ולהוסיף 0.1 מ"ל של ליזט (מרוכז ב 109-10 12 PFU/mL). יש לדגור ב-37°C וב-200 סל"ד למשך 24 שעות.
- קביעת טיטר פאגים כ- PFU בבדיקת צלחת
- כדי לכמת את מספר הבקטריופאג'ים בתרבית הנגועה, בצע בדיקות צלחות כדי לקבוע את טיטר הפאגים כ-PFU/mL כמתואר להלן.
- מעבירים 1 מ"ל של התרבית לצינור. צנטריפוגה ב 17,115 x גרם במשך 2 דקות ויוצקים את supernatant לתוך בקבוקון מסומן חדש.
- הוסף 100 μL של כלורופורם לבקבוקון ולמערבולת כדי להסיר פסולת חיידקית מהתמיסה. בצע את שלב 1.2.3.
- כדי לכמת את מספר הבקטריופאג'ים בתרבית הנגועה, בצע בדיקות צלחות כדי לקבוע את טיטר הפאגים כ-PFU/mL כמתואר להלן.
2. הסרת בקטריופאג' מתרביות סלמונלה אנטריקה נגועות (ראו איור 2)
הערה: כדי לפקח על תהליך הסרת הבקטריופאג'ים, נלקחים אליציטוטים שונים לאורך פרוטוקול הניקוי לטיטרציה. בסך הכל, ישנם שמונה aliquots כדי לאשר כי מספר PFU/mL יורד לאורך כל תהליך הניקוי עד חיסול מוחלט.
- הסרת בקטריופאג' בהשעיה
- לדלל את תרבית החיידקים המכילה פאגים ל 1:100 ב 5 מ"ל של 0.22 מיקרומטר מסונן LB בצינור צנטריפוגה חרוטי 50 מ"ל. נקודת טיטרציה 1: זהו האליקוט הראשון לטיטרציה (תרבית הסלמונלה הנגועה ההתחלתית).
- צנטריפוגה את המתלים למשך 10 דקות במהירות של 2,377 x גרם. בזהירות להסיר את supernatant. אין להשתמש פיפטה; יוצקים את הצינור. נסה להשאיר קצת נפח בתחתית צינור הצנטריפוגה החרוטית כדי להבטיח נוכחות של תאים.
- לשטוף תאים חיידקיים עם 10 מ"ל של 0.22 מיקרומטר מסונן LB בינוני. חזור על שלבי הצנטריפוגה והשטיפה 3x. השהה מחדש את הגלולה ב 5 מ"ל של 0.22 מיקרומטר מסונן LB. נקודת טיטרציה 2: זהו aliquot השני עבור טיטרציה.
- העבר 50 μL של תרחיף החיידקים הנ"ל דרך מסנן סטרילי של 0.45 מיקרומטר (ראה טבלת חומרים) באמצעות מערכת סינון ואקום. שטפו את המסנן ב-100 מ"ל של ליברה מסוננת של 0.22 מיקרומטר.
הערה: גודל הראש של בקטריופאג' 9NA הוא 0.067 מיקרומטר. לעומת זאת, אורכה של הסלמונלה 2-5 מיקרומטר ורוחבה 0.5-1.5 מיקרומטר. לכן, אם משתמשים בקרומים של 0.45 מיקרומטר, רוב החיידקים לא יעברו כי הם גדולים מ-0.45 מיקרומטר, בעוד שרוב הפאגים יעברו דרך נקבוביות המסנן של 0.45 מיקרומטר.
- הסרת בקטריופאג' הכלול בתוך תאי סלמונלה
- כדי להקל על שחרור פאגים מתאי חיידקים, יש לדגור על מסנן 0.45 מיקרומטר המכיל תאים למשך שעתיים בטמפרטורה של 37°C בתוך האינקובטור מבלי לפרק את המערכת.
הערה: שלב זה של הדגירה נדרש כדי לקדם את הליזה של החיידקים הנגועים ואת שחרורם של פאגים תוך תאיים לתוך המסנן. - שטפו את מסנן ה-0.45 מיקרומטר באמצעות מערכת סינון ואקום, ושטפו את המסנן ב-100 מ"ל של ליברות מסוננות של 0.22 מיקרומטר.
- לשחזר תאי חיידקים מהמסנן ב 2 מ"ל של 2x LB (20 גרם / ליטר טריפטון, 10 גרם / ליטר NaCl, 10 גרם / ליטר תמצית שמרים; ראה טבלה של חומרים). לשם כך, העבר את מסנן 0.45 מיקרומטר לבקבוק באמצעות מלקחיים סטריליים. לאחר מכן, הוסף 2 מ"ל של 2x LB מעל המסנן פיפטה מספר פעמים כדי לשחרר תאים מהמסנן.
- צנטריפוגה 1 מ"ל של מתלה זה למשך 2 דקות ב 10,354 x גרם. השליכו את הסופרנאטנט ושטפו תאי חיידקים 3x עם 1 מ"ל של מדיום LB מסונן. להשהות תאים ב 1 מ"ל של 2x LB. נקודת טיטרציה 3: זהו aliquot השלישי עבור טיטרציה.
הערה: מומלץ מאוד להשתמש ב-LB מרוכז יותר (2x LB) מכיוון שכפי שיתואר להלן, יתווסף ליפופוליסכריד מסחרי (LPS), ו-LPS זה מתמוסס במים, ובכך מדלל את התווך.
- כדי להקל על שחרור פאגים מתאי חיידקים, יש לדגור על מסנן 0.45 מיקרומטר המכיל תאים למשך שעתיים בטמפרטורה של 37°C בתוך האינקובטור מבלי לפרק את המערכת.
- הימנע הדבקה חוזרת על ידי הטעיית הבקטריופאג'ים המשתחררים מתאי חיידקים עם ליפופוליסכריד מסחרי כמתואר להלן.
- יש לדגור על 20 μL של תרחיף החיידקים בנוכחות S . enterica lipopolysaccharide מסחרי (LPS; ראו טבלת חומרים) לריכוז סופי של 3.75 מ"ג/מ"ל ב-1 מ"ל של LB מסונן 0.22 מיקרומטר למשך שעתיים ב-37°C עם רעידות ב-200 סל"ד.
הערה: פאגים המשתחררים מתאים לתוך התווך עשויים להיקשר ל-S. enterica LPS המסחרי במקום LPS חיידקי. - לאחר שעתיים של דגירה, להעביר 1 מ"ל של תרבית לצינור מיקרוצנטריפוגה וצנטריפוגה את המתלה במשך 2 דקות ב 10,354 x גרם. נקודת טיטרציה 4: השתמש בסופרנאטנט כאליציטוט הרביעי לטיטרציה.
- לשטוף גלולה 3x עם 1 מ"ל של LB מסונן בינוני.
- לאחר השטיפה, יש להשהות מחדש את הגלולה ב-1 מ"ל של 2x ליברות. לדגור על 20 מיקרוליטר של תערובת זו ב-1 מ"ל של LB מסונן 0.22 מיקרומטר עם 0.8 מ"ג/מ"ל של LPS מסחרי למשך שעתיים ב-37°C עם טלטול ב-200 סל"ד. נקודת טיטרציה 5: השתמשו בשאר המתלה החיידקי לטיטרציה החמישית.
- לאחר שעתיים של דגירה, להעביר 1 מ"ל של תרבית צינור מיקרוצנטריפוגה גלולה על ידי צנטריפוגה במשך 2 דקות ב 10,354 x גרם. נקודת טיטרציה 6: השתמשו בסופרנאטנט כאליקוט השישי לטיטרציה על ידי מזיגת הסופרנאטנט לבקבוקון חדש.
- שטפו תאי חיידקים 3x עם LB מסונן. לאחר הכביסה, להשעות מחדש תאים שנאספו ב 1 מ"ל של 0.22 מיקרומטר מסונן LB.
- מעבירים 1 מ"ל של תרחיף חיידקי דרך מסנן סטרילי של 0.45 מיקרומטר באמצעות מערכת סינון ואקום. שטפו את המסנן באמצעות 100 מ"ל של ליברה מסוננת של 0.22 מיקרומטר.
- לשחזר תאים מהמסנן 0.45 מיקרומטר ב 2 מ"ל של 2x LB בינוני. לשם כך, מעבירים את מסנן 0.45 מיקרומטר לבקבוק באמצעות מלקחיים סטריליים. לאחר מכן, הוסף 2 מ"ל של 2x LB מעל המסנן פיפטה מספר פעמים כדי לנסות לשחרר תאים מהמסנן.
- גלולה 1 מ"ל של תאים על ידי צנטריפוגה במשך 2 דקות ב 10,354 x גרם. יש לשטוף 3 פעמים עם ליברה מסוננת של 0.22 מיקרומטר. לאחר שטיפה, להשעות מחדש תאים שנאספו ב 1 מ"ל של 2x LB. נקודת טיטרציה 7: זהו aliquot השביעי עבור טיטרציה. aliquot זה יודיע על היעילות של הסרת פאגים בתרביות חיידקים.
- יש לדגור על 20 μL של תרחיף החיידקים בנוכחות S . enterica lipopolysaccharide מסחרי (LPS; ראו טבלת חומרים) לריכוז סופי של 3.75 מ"ג/מ"ל ב-1 מ"ל של LB מסונן 0.22 מיקרומטר למשך שעתיים ב-37°C עם רעידות ב-200 סל"ד.
3. הכנת תרבית סלמונלה ללא בקטריופאג'ים לאחר הסרת בקטריופאג'ים
- הכינו את החיסון ללא פאגים. הוסף 100 μL של תאים מהתרחיף החיידקי ל 900 μL של LB המכיל 0.45 מ"ג / מ"ל LPS. יש לדגור ב-37°C למשך 24 שעות עם רעידות ב-200 סל"ד.
- נקודת טיטרציה 8: הכינו את האליקוט השמיני לטיטרציה (התרבית הפוטנציאלית הסופית שאינה נגועה). נקודה זו היא לאשר את היעדר זיהום חוזר פאגים.
Representative Results
לסלמונלה אנטריקה ולחיידקים גראם-שליליים אחרים יש קרום חיצוני המכיל LPS. O-antigen של LPS הוא קולטן נפוץ על ידי בקטריופאג'ים 9NA כדי להדביק תרביות סלמונלה 16,17.
בהתחשב בזיקה הספציפית של בקטריופאג'ים לאזורי O-antigen או פוליסכריד ליבה של LPS, רצינו לבחון אם LPS מסחרי של סלמונלה אנטריקה יכול לשמש כפיתוי כדי לא לכלול בקטריופאגים 9NA. כדי לעשות זאת, ערבבנו ריכוזים ידועים של LPS מסחרי וליזט 9NA, ולאחר מכן טיטרציה. LPS מסחרי ובקטריופאג'ים 9NA עורבבו בנפח כולל של 200 μL והודגרו במשך שעתיים ב-37°C ללא רעידות. לטיטרציה, 100 μL של תערובת LPS-9NA ו-60 μL של תרבית לילה נוספו ל-5 מ"ל של אגר רך LB ונשפכו על החלק העליון של צלחת LB. צלחות הודגרו במשך 24 שעות ב 37 מעלות צלזיוס. כפי שניתן לראות באיור 3, טיטר הליזט יורד באופן יחסי כאשר הריכוז של S. enterica Commercial LPS עולה. תוצאות אלה מצביעות על כך שה-LPS המסחרי מתפקד כראוי כפיתוי עבור בקטריופאג'ים 9NA.
באופן מעניין, הזמן הדרוש לפאג' 9NA כדי ללכוד תאי סלמונלה ולשחרר פאגים מתקל על-ידי מספר החיידקים והפאגים (איור 4). כדי לחקור כיצד היבט זה יכול להשפיע על פרוטוקול הסרת הפאגים, בחנו חיידקים שונים: יחסי פאגים (1:1, 1:10, 1:100 ו-1:1000). כפי שניתן לראות באיור 4, יש ירידה ב-OD600 ננומטר של התרבית ב-1.5-2.5 שעות לאחר הוספת פאג' 9NA. ערכי OD600 ננומטר הקרובים לאפס מעידים על כך שתרבית החיידקים עוברת ליזה18. מסיבה זו, זמני הדגירה בפרוטוקול זה הוגדרו כשעתיים על מנת להבטיח זמן מספיק לפאגים הכלולים בתוך תאי סלמונלה לליזה חיידקית ולהשתחרר. יש להעריך זמן זה עבור כל מערכת פאגים מארחת לפני ביצוע פרוטוקול זה.
ברגע שקבענו ש-LPS מסחרי עובד כפיתוי וזמן הליזה של חיידקים נגועים ב-9NA, ביצענו את הפרוטוקול המתואר לניקוי תרביות סלמונלה נגועות של הבקטריופאג'ים (איור 1 ואיור 2). כדי לנטר את נוכחותם של בקטריופאג'ים לאורך כל שלב של הפרוטוקול, ערכנו בדיקות פלאק כדי לחשב את ההדבקה של התרביות שנוצרו ב-100 מיקרוליטר של התערובת שהתקבלה בנקודות שונות (איור 5). אנו יכולים להבחין כי שטיפה וסינון חוזרים ונשנים אינם מספיקים לסילוק בקטריופאג'ים מתרביות (נקודות טיטרציה 1-3); עם זאת, מספר הפאגים פוחת ברגע שאנו משתמשים בשלב הדגירה עם LPS מסחרי (נקודת טיטרציה 4). השלב המכריע להסרה מלאה של בקטריופאג'ים בתרבית חיידקים הוא הדגירה השנייה עם LPS מסחרי (נקודת טיטרציה 6). שלב זה חיוני להסרה מוצלחת של בקטריופאג' 9NA בתרביות סלמונלה .
היבט מעניין של פרוטוקול זה יהיה לדעת את רמת העמידות בפני פאגים לאחר שלבי הסרת פאגים. להליך שמפריד פאגים מחיידקים עמידים לפאגים אין שום תועלת. מסיבה זו, חיוני לגלות שהחיידקים שנותרו בתרבית רגישים לפאגים. כדי להדגים שתאי פאגים רגישים נשארים בתרביות לאחר ההליך, השתמשנו בבדיקת צלחת אורנין כחול (EBU) של אוונס כדי לסנן זיהום פאגים19. לוחות EBU היו עשויים LB בינוני בתוספת 10 מ"ל / L K2HPO4 25%, 5 מ"ל / ליטר גלוקוז 50%, 2.5 מ"ל / ליטר פלואורסצאין 1%, 1.25 מ"ל / L כחול אוונס 1%, ו 15 גרם / ליטר אגר. פסים צולבים על לוחות EBU עם פאגים 9NA שימשו להבחנה בין מבודדים עמידים לפאגים ורגישים לפאגים (איור 6). תרביות החיידקים שהתקבלו בסוף פרוטוקול הניקוי שימשו לקבלת מושבות מבודדות, שנבדקו לאיתור זיהום פאגים (איור 6B). אנו יכולים לצפות בקיומם של תאים עמידים ורגישים כאחד. פרוטוקול זה אינו תומך בבחירת תאים עמידים לפאגים; זה רק מחסל בקטריופאג'ים.
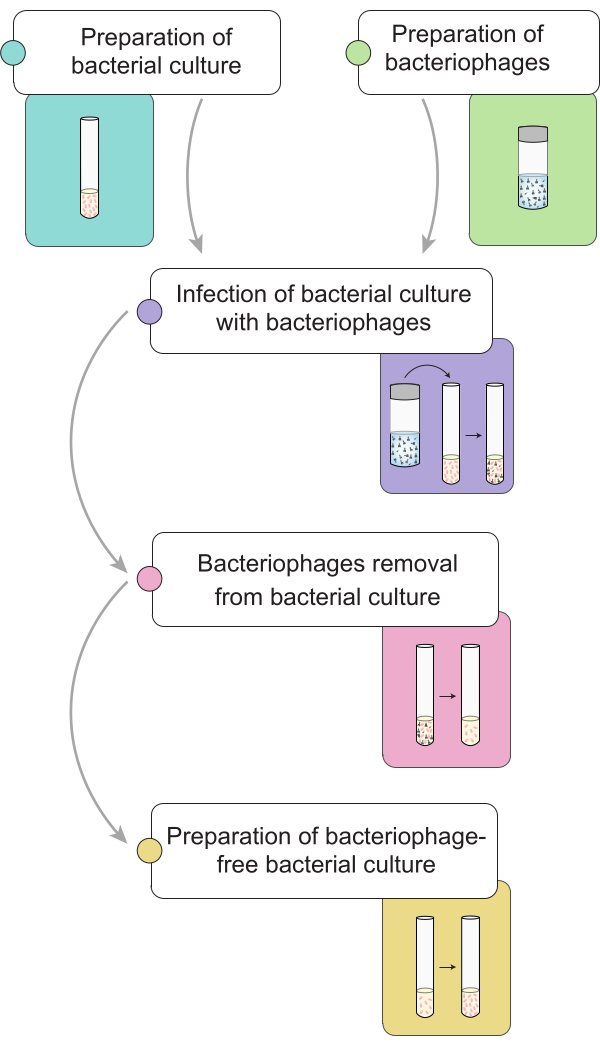
איור 1: תיאור קצר של הליך חיסול הבקטריופאג'ים בתרביות סלמונלה . תהליך העבודה מחולק לשלבים שונים: הכנת תרבית חיידקים וליזט, הדבקה של תרבית החיידקים בבקטריופאג'ים, סילוק בקטריופאג'ים מתרביות חיידקים נגועות והכנת חיסון חיידקי ללא פאגים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
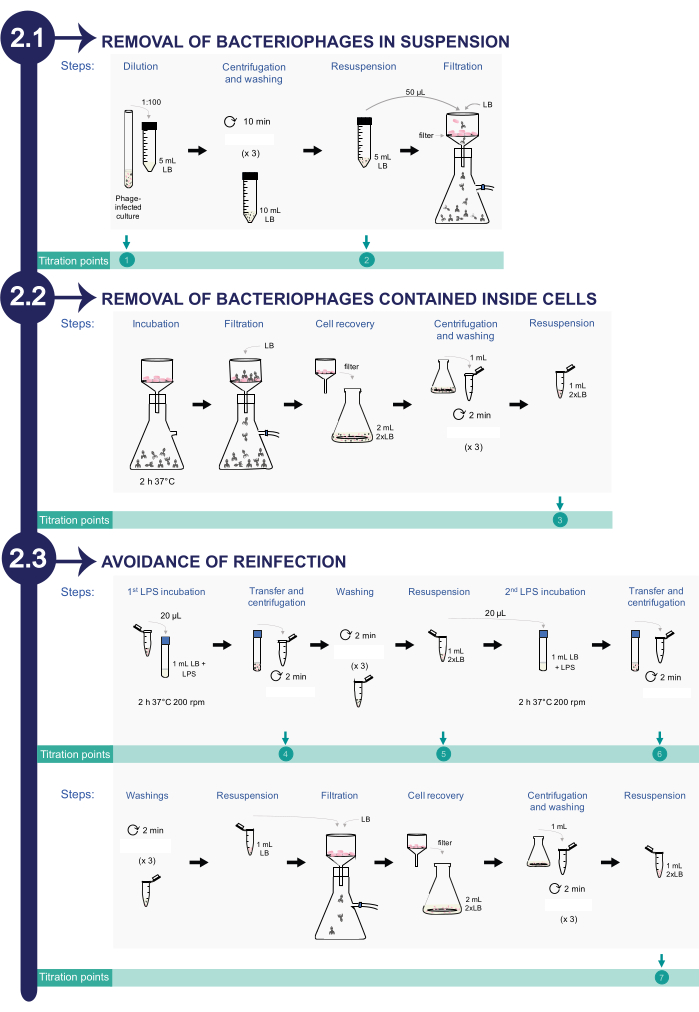
איור 2: הליך לסילוק בקטריופאג'ים מסלמונלהנגועה נכנסים לתרביות. התהליך מורכב משלושה שלבים: 1) הסרת בקטריופאג'ים בתרחיף, 2) הסרת פאגים הכלולים בתוך תאי חיידקים, 3) הימנעות מהדבקה חוזרת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
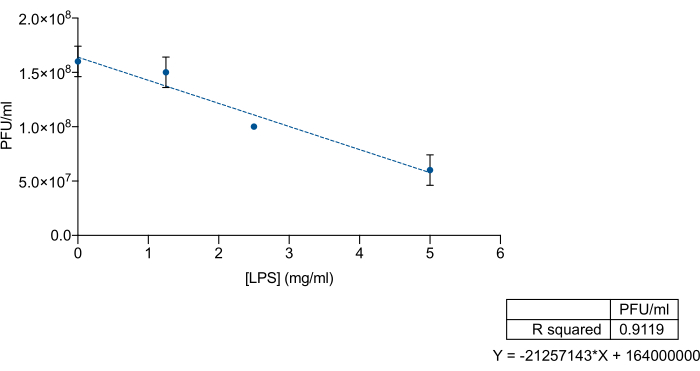
איור 3: בדיקת LPS-deoy למדידת היעילות של LPS מסחרי מסוג Salmonella enterica כדי לקשור בקטריופאג'ים. טיטרציה של ליזט 9NA (PFU/mL) בריכוזים הולכים וגדלים של LPS מסחרי מסוג Salmonella enterica . הניסוי בוצע בשלשה. ממוצע וסטיית תקן מוצגים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
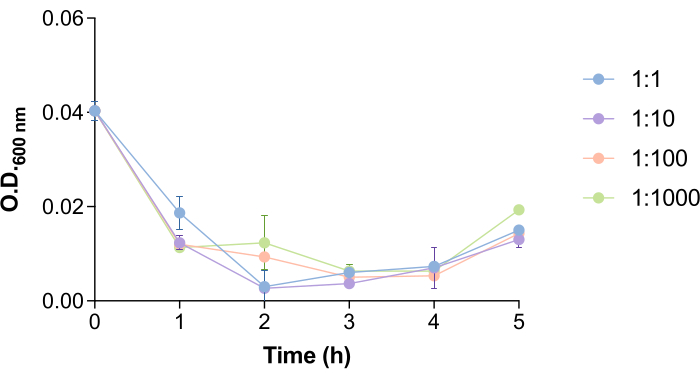
איור 4: זמן ליזה של בקטריופאג' 9NA בתרביות סלמונלה . עקומות גדילה של תרביות סלמונלה אנטריקה בנוכחות בקטריופאג' 9NA ביחס חיידקים:פאגים של 1:1, 1:10, 1:100 ו-1:1000. הניסוי בוצע בשלשה. ממוצע וסטיית תקן מוצגים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
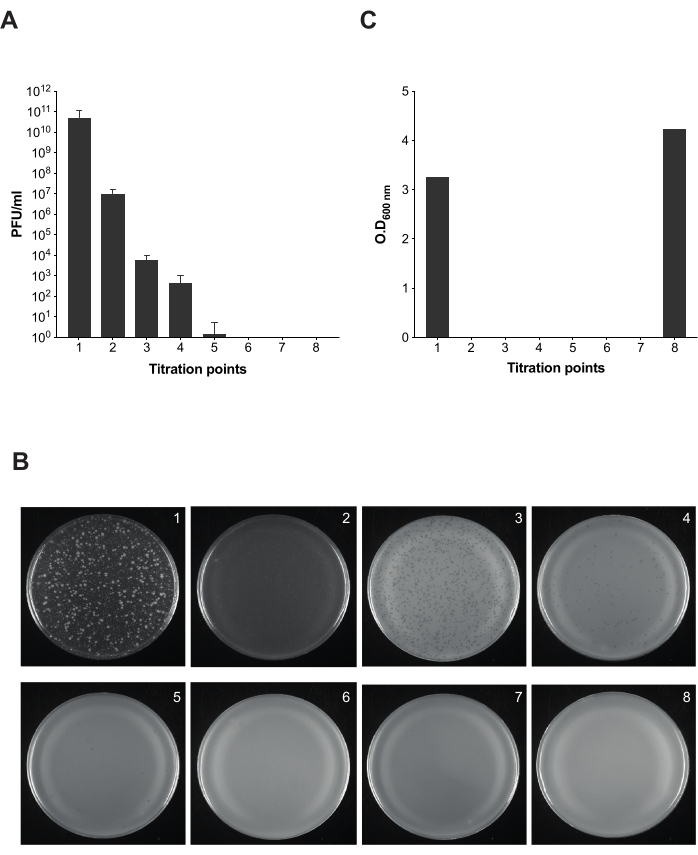
איור 5: בדיקת פלאק לבדיקת זיהומיות במהלך הסרת בקטריופאג'ים בתרביות סלמונלה . (A) טיטרציה של שמונה אליציטוטים נלקחה בנקודות שונות של הפרוטוקול (נקודות טיטרציה 1-7 מסומנות באיור 2). לצורך ניסוי זה נעשה שימוש בזן Salmonella enterica serovar Typhimurium ATCC 14028 opvAB::lacZ (SV8011) ובקטריופאג' 9NA. הניסויים בוצעו בשלשה, ומוצגים הממוצע וסטיות התקן. (B) צלחות אגר רכות עם סלמונלה אנטריקה התקבלו בטכניקת הכיסוי באמצעות אליציטוטים משמונה נקודות טיטרציה. הלוחות מתאימים משמאל לימין עם נקודות טיטרציה 1-8. (C) צפיפות אופטית של 600 ננומטר של תרבית חיידקים בזמנים שונים של פרוטוקול הסרת הפאגים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
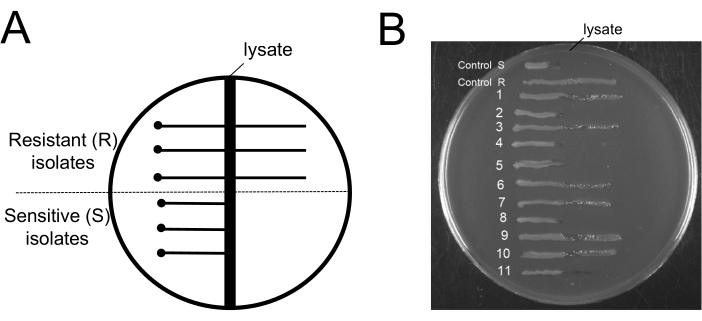
איור 6: בדיקה לחיידקים עמידים לפאגים לאחר הליך הסרת בקטריופאג'ים. (A) תרשים סכמטי של לוחית אגר EBU טיפוסית המשמשת לבדיקת אגר חוצה פסים: האזור הכהה האנכי במרכז מייצג את האזור של ליזט 9NA. הנקודה מייצגת את המיקום שבו התאים שנבדקו מחוסנים במרחק בטוח מאזור הליזט, והקווים המוצקים האופקיים מייצגים את התאים העמידים לפאגים שגדלים על פני אזור הליזט או את התאים הרגישים לפאגים שאינם גדלים מעבר לאזור הליזט. (B) בדיקות לוחיות EBU לבדיקת 11 מושבות התקבלו בסוף פרוטוקול ההסרה. Control R ו-S הן דוגמאות למבודדים עמידים בפני פאגים ורגישים לפאגים, בהתאמה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
אסטרטגיות מגוונות משמשות בקטריופאג'ים כדי לזהות ולהדביק פונדקאים חיידקיים. מבנים מולקולריים שונים על פני השטח של חיידקים יכולים לפעול כקולטני פאגים: חלבון, רב-סוכר, ליפופוליסכרידים (LPS) ומויטי פחמימות20. בחיידקים גראם-שליליים, LPS הוא קולטן נפוץ לפאגים. בנוסף, קולטנים אחרים הם חלבוני הממברנה החיצונית, פילי, ו flagella21.
האינטראקציה הספציפית בין בקטריופאג'ים וחיידקים המבוססת על זיהוי LPS8 נוצלה בעבודה זו לפיתוח פרוטוקול יעיל ביותר לסילוק בקטריופאג'ים בתרביות חיידקים נגועות (איור 1 ואיור 2). הפרוטוקול שלנו אינו תומך בבחירת תאים עמידים לפאגים; הוא מסלק רק בקטריופאג'ים (איור 6). גם תאים רגישים לפאגים וגם תאים עמידים לפאגים נשארים בתרבית חיידקים לאחר ביצוע פרוטוקול זה של הסרת פאגים.
הנוהג המקובל כאשר מתרחש זיהום פאגים הוא לנסות לסלק את כל החומר המזוהם, ולאחר מכן ניקוי ועיקור22. הליך הטיהור כרוך בחשיפת תרבית החיידקים לתנאי עקה, כגון טמפרטורות גבוהות, על מנת לחסל באופן חלקי או מלא את תאי החיידקים. כפי שמתואר בתוצאות מייצגות, השלב המכריע בפרוטוקול זה הוא דגירה של תרביות חיידקים נגועות בפאגים עם LPS מסחרי, חומר לא מזיק לתרביות חיידקים. זה עוזר לשמר את הכדאיות של תרביות חיידקים ומציע יתרונות משמעותיים ליישומים תעשייתיים בתסיסה ובביוריאקטורים.
זמן הדגירה בפרוטוקול זה הוא שעתיים כדי להבטיח מספיק זמן לליזה של פאגים של תאי חיידקים. אם יש להשתמש בזני חיידקים ובקטריופאג'ים שונים, פרמטר זה צריך להילקח בחשבון ולהיות מוגדר על ידי המשתמש. במקרה זה, יש לבצע בדיקה דומה לזו המתוארת באיור 4 לפני הניסוי.
באופן מעניין, ניתן לנתח את היעילות של פרוטוקול ניקוי זה גם על ידי שימוש בבדיקה המנטרת את תכולת הפאגים של דגימה נתונה. במובן זה, ביו-חיישנים אפיגנטיים הם כלי חדשני לזיהוי בקטריופאג'ים23. ביוסנסור פאגים ידוע המסוגל לזהות קוליפאגים, המשתמשים ב-LPS כקולטן, הוא מערכת opvAB::gfp 13,18,23,24. ביוסנסור פאגים זה מזהה עלייה בתת-אוכלוסיית OpvABON בנוכחות פאגים המשתמשים באנטיגן O כקולטן. במובן זה, אנו יכולים להשתמש בהיתוך opvAB::gfp כדי לנטר פאגים קושרי LPS בשלבים שונים של פרוטוקול זה ו / או מדיה ותנאים מגוונים. גישות אלה יכולות להיות בעלות ערך בקביעת העיתוי והמיקומים שבהם פרוטוקול יעיל עשוי להיות נחוץ.
בעוד זיהוי LPS הוא נפוץ, פאגים יכולים גם להשתמש במגוון של קולטני פני שטח אחרים על תאי חיידקים עבור התקשרות וזיהום. כאן, השתמשנו בסלמונלה גראם-שלילית כאנטרובקטריה מייצגת ובבקטריופאג' 9NA המשתמש ב-LPS כקולטן וכטריגר פליטת גנום. פאגים אנטרובקטריאליים אחרים (למשל, Escherichia coli T5) נקשרים באופן רופף ל-LPS ודורשים חלבון קרום חיצוני להזרקת גנום. הפרוטוקול המתואר ישים עבור בקטריופאג'ים המזהים וזקוקים לאנטיגן O-של LPS להדבקה מוצלחת, כגון 9NA, Det7 ו-P22 13,25,26,27. בהתאם לכך, היישום המוצלח של פרוטוקול זה לטיהור פאגים של תרביות חיידקים כרוך בקביעה אם מקור זיהום הפאגים דורש זיהוי LPS בפונדקאי.
לסיכום, ולמרות המגבלות האפשריות של הפרוטוקול, התוצאות המייצגות שלנו מראות בבירור כי שיטה זו היא כלי רב עוצמה לניקוי תרביות סלמונלה חיידקיות של בקטריופאג'ים המשתמשים ב- LPS כקולטן וכטריגר פליטת גנום.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים לד"ר כרמן ר. בוזון ולרוסיו קרוואחאל-הולגרה על הדיונים וההצעות המועילות. עבודה זו נתמכה על ידי המענק PID2020-116995RB-I00 שמומן על ידי MICIU/AEI/ 10.13039/5011100011033 ותוכנית VI Propio de Investigación y Transferencia מאוניברסיטת סביליה.
Materials
| Name | Company | Catalog Number | Comments |
| 20 mL syringe | BD Discardit II | 300296 | No special requirements |
| 50 mL conical tubes | Avantor | 525-0610 | No special requirements |
| 90 x 14 mm Petri dishes | Deltalab | 200209 | No special requirements |
| Agar | Sigma-Aldrich | A1296 | No special requirements |
| Bacteriophage lysate | Minimal concentration: 109 PFU/mL | ||
| Centrifuge | Eppendorf | No special requirements | |
| Chloroform | Panreac | 131252 | No special requirements |
| Citric acid · H2O | Merck | 1.00247 | |
| Colony counter | No special requirements | ||
| Evans Blue | Sigma-Aldrich | E-2129 | |
| Flasks | No special requirements | ||
| Fluorescein sodium salt | Sigma-Aldrich | F-6377 | |
| Forceps | No special requirements | ||
| Glass tubes | No special requirements | ||
| Glass tubes for lysate | No special requirements | ||
| Glucose | Sigma-Aldrich | G7021 | |
| K2HPO4 | Merck | 1.05104.1000 | |
| K2HPO4 anhydrous | Merck | 1.05104 | |
| Lipopolysaccharide from Salmonella enterica serotype Typhimurium | Sigma-Aldrich | L6511-25 mg | Dissolved in sterile water |
| Membrane 0.45 µm | MF-Millipore | HAWP02500 | No special requirements |
| MgSO4 · 7 H2O | Merck | 1.05886 | |
| NaCl | Sigma-Aldrich | S9888 | No special requirements |
| NaNH4HPO4 · 4 H2O | Sigma-Aldrich | S9506 | |
| Peptone | iNtRON | Ba2001 | No special requirements |
| Syringe Filter 0.22 µm | Millex | SLGSR33SB | No special requirements |
| Toothpicks | No special requirements | ||
| Tryptone | Panreac | 403682.1210 | No special requirements |
| Vacuum pump | Thermo Scientific | No special requirements | |
| Yeast extract | iNtRON | 48045 | No special requirements |
References
- Kasman, L. M., Porter, L. D. . Bacteriophages. , (2024).
- Lawrence, D., Baldridge, M. T., Handley, S. A. Phages and human health: More than idle hitchhikers. Viruses. 11 (7), 587 (2019).
- Beller, L., Matthijnssens, J. What is (not) known about the dynamics of the human gut virome in health and disease. Curr Opin Virol. 37, 52-57 (2019).
- Roux, S., Hallam, S. J., Woyke, T., Sullivan, M. B. Viral dark matter and virus-host interactions resolved from publicly available microbial genomes. eLife. 4, 08490 (2015).
- Wommack, K. E., Colwell, R. R. Virioplankton: Viruses in aquatic ecosystems. Microbiol Mol Biol Rev. 64 (1), 69-114 (2000).
- Louten, J. Virus structure and classification. Essentl Human Virol. , 19-29 (2016).
- Egido, J. E., Costa, A. R., Aparicio-Maldonado, C., Haas, P. J., Brouns, S. J. J. Mechanisms and clinical importance of bacteriophage resistance. FEMS Microbiol Rev. 46 (1), 048 (2022).
- Rakhuba, D. V., Kolomiets, E. I., Dey, E. S., Novik, G. I. Bacteriophage receptors, mechanisms of phage adsorption and penetration into host cell. Polish J Microbiol. 59 (3), 145-155 (2010).
- Lindberg, A. A. Bacteriophage receptors. Ann Rev Microbiol. 27 (1), 205-241 (1973).
- Koskella, B., Meaden, S. Understanding bacteriophage specificity in natural microbial communities. Viruses. 5 (3), 806-823 (2013).
- Marcó, M. B., Moineau, S., Quiberoni, A. Bacteriophages and dairy fermentations. Bacteriophage. 2 (3), 149-158 (2012).
- Fernández-Fernández, R., et al. Evolution of a bistable genetic system in fluctuating and non-fluctuating environments. bioRxiv. , (2024).
- Cota, I., Blanc-Potard, A. B., Casadesús, J. STM2209-STM2208 (opvAB): a phase variation locus of Salmonella enterica involved in control of O-antigen chain length. PloS one. 7 (5), 36863 (2012).
- Kropinski, A. M., Mazzocco, A., Waddell, T. E., Lingohr, E., Johnson, R. P. Enumeration of bacteriophages by double agar overlay plaque assay. Methods Mol Biol. 501, 69-76 (2009).
- Ackermann, H. W. Tailed bacteriophages: The order Caudovirales. Adv Virus Res. 51, 135-201 (1998).
- Wilkinson, R. G., Gemski, P., Stocker, B. A. D. Non-smooth mutants of Salmonella typhimurium: Differentiation by phage sensitivity and genetic mapping. J Gen Microbiol. 70 (3), 527-554 (1972).
- Casjens, S. R., Leavitt, J. C., Hatfull, G. F., Hendrix, R. W. Genome sequence of Salmonella Phage 9NA. Genome Announc. 2 (4), 00531-00614 (2014).
- Cota, I., et al. Epigenetic control of Salmonella enterica O-antigen chain length: A tradeoff between virulence and bacteriophage resistance. PLoS Genet. 11 (11), 1005667 (2015).
- Chan, K., Botstein, D., Watanabe, T., Ogata, Y. Specialized transduction of tetracycline resistance by phage P22 in Salmonella typhimurium. Virology. 50, 883-898 (1972).
- Bertozzi Silva, J., Storms, Z., Sauvageau, D. Host receptors for bacteriophage adsorption. FEMS Microbiol Lett. 363 (4), 002 (2016).
- Sørensen, M. C. H., et al. Bacteriophage F336 recognizes the capsular phosphoramidate modification of Campylobacter jejuni NCTC11168. J Bacteriol. 193 (23), 6742-6749 (2011).
- Ogata, S., Hongo, M. Bacteriophages of the Genus Clostridium. Adv Appl Microbiol. 25, 241-273 (1979).
- Olivenza, D. R., Casadesús, J., Ansaldi, M. Epigenetic biosensors for bacteriophage detection and phage receptor discrimination. Environ Microbiol. 22 (8), 3126-3142 (2020).
- Olivenza, D. R., et al. A portable epigenetic switch for bistable gene expression in bacteria. Sci Rep. 9 (1), 862 (2019).
- Walter, M., et al. Structure of the receptor-binding protein of bacteriophage Det7: a Podoviral tail spike in a Myovirus. J Virol. 82 (5), 2265-2273 (2008).
- Davies, M. R., Broadbent, S. E., Harris, S. R., Thomson, N. R., van der Woude, M. W. Horizontally acquired Glycosyltransferase operons drive Salmonellae lipopolysaccharide diversity. PLoS Genet. 9 (6), 1003568 (2013).
- Wahl, A., Battesti, A., Ansaldi, M. Prophages in Salmonella enterica: a driving force in reshaping the genome and physiology of their bacterial host. Mol Microbiol. 111 (2), 303-316 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved