Rimozione dei batteriofagi da colture di Salmonella infette
In This Article
Summary
I batteriofagi, onnipresenti e diversificati sulla Terra, infettano e si replicano all'interno degli ospiti batterici, svolgendo un ruolo cruciale negli ecosistemi microbici. Nonostante la loro importanza, la loro presenza può interrompere i processi industriali. Abbiamo sviluppato un metodo che utilizza lipopolisaccaridi batterici per eliminare i batteriofagi dalle colture di Salmonella .
Abstract
I batteriofagi, o semplicemente fagi, svolgono un ruolo vitale negli ambienti microbici, influenzando le popolazioni batteriche e modellando la loro evoluzione e interazioni. Questi organismi sono virus che infettano e si replicano all'interno degli ospiti batterici. I fagi sono onnipresenti sulla Terra, molto diversificati e molto abbondanti. Sebbene i batteriofagi svolgano ruoli preziosi in ambienti diversi e siano un'area chiave di ricerca in microbiologia ed ecologia, la loro presenza può essere indesiderabile in alcuni processi o prodotti industriali. Considerando l'abbondanza e l'ubiquità dei batteriofagi sulla Terra, la progettazione di procedure per la rimozione dei batteriofagi dalle colture batteriche è fondamentale in diverse applicazioni di laboratorio e industriali per preservare l'integrità delle colture e garantire risultati sperimentali accurati o la qualità del prodotto. Qui, abbiamo messo a punto un protocollo per eliminare i batteriofagi da colture infette di Salmonella enterica , utilizzando una strategia basata sull'uso di lipopolisaccaridi (LPS) situati nella membrana esterna dei batteri Gram-negativi. L'LPS batterico svolge un ruolo importante nel riconoscimento dell'ospite da parte dei fagi e utilizziamo questa proprietà per progettare una procedura efficace per la rimozione dei fagi, che utilizzano l'LPS come recettore, nelle colture batteriche di Salmonella .
Introduction
Le popolazioni microbiche si trovano ad affrontare molteplici sfide negli ambienti naturali e una minaccia particolarmente grave è il potenziale di infezione da batteriofagi, i virus che infettanoi batteri. Questi virus sono diffusi sul pianeta, esibendo una grande diversità e abbondanza 2,3,4,5. Sebbene i batteriofagi siano diversi per dimensioni, morfologia e organizzazione genomica, tutti condividono la stessa struttura: un genoma di DNA o RNA avvolto da un capside formato da proteine codificate dai fagi6. I batteri hanno sviluppato una vasta gamma di meccanismi di difesa contro di loro7. Un aspetto chiave dell'infezione da batteriofagi, che è rilevante per la caratterizzazione e per il rilevamento, sono i domini di legame del recettore presenti sulle fibre della coda. I batteriofagi hanno proteine sulla loro superficie chiamate proteine leganti il recettore o fibre della coda per riconoscere e legarsi a specifici siti recettoriali sulla superficie della cellula batterica. Nel caso dei batteri Gram-negativi, il riconoscimento delle strutture superficiali, come i lipopolisaccaridi (LPS), le proteine della membrana esterna, i pili e/o i flagelli, sono coinvolti nell'interazione fago-batterio8. Questa interazione tra batteriofagi e batteri è altamente specifica e dipende principalmente dalla loro capacità di attaccarsi alle superfici dell'ospite. L'antigene O del lipopolisaccaride è unrecettore 9 comunemente usato.
Lo studio delle interazioni batteriofago-batterio non è solo affascinante da un punto di vista biologico, ma ha anche applicazioni pratiche in settori come la terapia fagica e la biotecnologia. Sebbene i batteriofagi svolgano ruoli preziosi in vari contesti, ad esempio alterando le popolazioni microbiche10, la loro presenza può essere indesiderabile in alcuni processi industriali. Nel settore farmaceutico, biotecnologico e della produzione alimentare, la presenza di batteriofagi può influire sulla qualità e sulla sicurezza dei prodotti finali, rendendo la loro rimozione essenziale per soddisfare gli standard di qualità. Nel bioprocesso e nella bioproduzione, in cui le colture batteriche vengono utilizzate per produrre vari composti (ad esempio, proteine, enzimi o antibiotici), la presenza di batteriofagi può portare all'interruzione dei processi di produzione a causa della loro capacità di bilanciare la popolazione batterica in ogni ambiente condiviso. I fagi possono occasionalmente trasformare la vita professionale del microbiologo industriale in un incubo11. La progettazione di procedure efficaci per rimuovere i fagi è fondamentale per garantire una produzione coerente e affidabile, migliorando l'efficienza del processo. Al di là di questi aspetti industriali, in un laboratorio di ricerca, dove la precisione e la riproducibilità sono fondamentali, l'eliminazione dei batteriofagi è essenziale per ottenere risultati accurati e affidabili. Inoltre, la rimozione dei fagi può essere utilizzata anche per simulare ambienti variabili per testare diverse ipotesi12. La rimozione dei fagi può anche essere molto utile nell'ambiente di ricerca poiché molti studi basati sui fagi, come l'enumerazione dei batteri dopo l'applicazione dei fagi, trarrebbero beneficio da un passaggio per rimuovere i fagi al fine di produrre conteggi vitali molto più affidabili.
La rimozione dei fagi basata sull'isolamento delle colonie richiederebbe diversi giorni per garantire che le colonie siano prive di fagi, mentre la procedura qui descritta consente la generazione di colture prive di fagi in poche ore. Questo protocollo ci permette di seguire l'evoluzione delle colture batteriche senza impedire loro di isolare le colonie. In questo senso, è possibile simulare ambienti fluttuanti (presenza e/o assenza di fagi) per testare diverse ipotesi. Inoltre, questo protocollo consente l'analisi qualitativa e quantitativa della presenza di fagi in una coltura batterica.
In sintesi, la progettazione di procedure convenienti per la rimozione dei batteriofagi è fondamentale per mantenere la qualità, la sicurezza e l'efficienza dei processi dei prodotti in vari settori e per i progressi nella ricerca di base e applicata. Qui, descriviamo un protocollo altamente efficace basato sull'uso di LPS per la rimozione di batteriofagi, che utilizzano LPS come recettore, da colture di Salmonella infette, che è efficiente in termini di tempo e richiede un'attrezzatura minima.
Protocol
NOTA: Prima di eseguire la procedura di eliminazione dei fagi, descriviamo la preparazione di una coltura di Salmonella infettata con batteriofagi 9NA. Nella Figura 1 è illustrata una rappresentazione generale della procedura completa per la rimozione dei batteriofagi nelle colture batteriche.
1. Preparazione di colture di Salmonella infettate da batteriofagi
- Preparazione di colture batteriche
NOTA: In questo studio è stato utilizzato Salmonella enterica subsp. enterica sierotipo Typhimurium ceppo ATCC 14028 opvAB::lacZ (SV8011)13 .- Scongelare lentamente la fiala recuperata da -80 °C che contiene il ceppo di S. enterica di interesse ponendola su ghiaccio.
- Strisciare il ceppo di S. enterica dal brodo di dimetilsolfossido scongelato su una piastra di brodo Lennox (LB) (10 g/L di triptone, 5 g/L di NaCl, 5 g/L di estratto di lievito e 15 g/L di agar, vedere la Tabella dei materiali). Incubare la piastra a 37 °C per 24 ore.
- Utilizzando un ago da inoculazione, trasferire una colonia dalla piastra di S. enterica e inocularela in 5 ml di LB liquido in una provetta di vetro. Incubare a 37 °C per 24 ore con aerazione agitando a 200 giri/min.
- Preparazione dei batteriofagi
NOTA: In questo protocollo è stato utilizzato il batteriofago 9NA, che appartiene alla famiglia Siphoviridae (ordine Caudovirales)14. In particolare, possono essere utilizzati altri batteriofagi di Salmonella enterica che utilizzano l'antigene O del lipopolisaccaride come recettore.- Preparare il brodo di batteriofago aggiungendo 0,1 mL di lisato batteriofago concentrato a una miscela di 100 mL di brodo nutriente (NB; 5 g/L di peptone e 3 g/L di estratto di lievito), 2 mL di sali 50x E (38,78 mM MgSO47 H2O, 520,5 mM Acido citricoH2O, 2,87 M K2HPO4 anidro e 829 mM NaNH4HPO44 H2O) e 0,4 mL di 50% glucosio. Mescolare accuratamente per inversione.
- Un esempio rappresentativo di concentrazione di batteriofagi potrebbe essere10-9 PFU/mL (unità formanti placca/mL), ma concentrazioni più basse possono essere utilizzate con risultati simili (vedere Tabella dei materiali). Stimare la concentrazione di batteriofago seguendo il passaggio 1.2.3.
- Preparare il lisato seguendo i passaggi descritti di seguito.
- Preparare l'inoculo di S. enterica in 5 ml di LB (10 g/L di triptone, 5 g/L di NaCl e 5 g/L di estratto di lievito). Incubare a 37 °C e 200 giri/min per 24 ore.
- Mescolare 4 ml di brodo batteriofago con 1 ml di coltura notturna di S. enterica. Incubare la miscela a 37 °C e 200 giri/min per 8 ore.
- Per discriminare tra batteri e batteriofagi, centrifugare la miscela a 2,377 x g per 20 minuti. Recuperare il surnatante in una provetta di vetro, aggiungere 800 μL di cloroformio (vedi Tabella dei materiali) e agitarlo. Assicurarsi di trasferire la fase superiore solo quando si utilizza una miscela con cloroformio.
NOTA: È importante prevenire il trasferimento di cloroformio residuo, che potrebbe influire sull'efficienza della procedura. La fase del cloroformio è comune sia nei protocolli di isolamento che in quelli di propagazione come un modo per massimizzare i fagi rilasciati. Tuttavia, il cloroformio può inattivare alcuni fagi o distruggerne l'infettività15. Pertanto, questo passaggio è applicabile solo ai fagi resistenti al cloroformio. - Mantenere i lisati a temperatura ambiente per 2 h e poi conservarli a 4 °C.
- Titolare il lisato per quantificare il numero di batteriofagi/numero di PFU per mL presenti nel lisato preparato. A tale scopo, eseguire la tecnica di sovrapposizione descritta di seguito.
- Preparare 5 ml di LB di inoculo per S. enterica. Incubare a 37 °C per 24 ore con aerazione agitando a 200 giri/min.
- Eseguire diluizioni seriali del lisato in LB per raggiungere un numero numerabile di PFU/mL. Per determinare i fattori di diluizione necessari, identificare il lisato batteriofago iniziale concentrato. Per un esempio rappresentativo di concentrazione di batteriofagi a circa10-9 PFU/mL, i fattori di diluizione che determinano un numero numerabile di placche sono compresi tra 106-10 10.
- Aggiungere 100 μl dell'appropriata diluizione del lisato e 60 μl della coltura notturna di S. enterica preparata il giorno prima a 5 mL di agar molle LB, preparato mescolando LB e LB-agar liquidi in proporzione 1:1 e mantenendo a 56 °C per evitare la solidificazione. Mescolate con cura, evitando la formazione di bolle.
- Versare ogni miscela nella parte superiore di un piatto LB e tenerlo sul banco fino a quando il mezzo non si solidifica.
- Incubare le piastre per 24 ore a 37 °C. Conta il numero di placche su ogni piatto. Per determinare il numero di PFU/mL, moltiplicare il numero di placche di ciascuna piastra per il fattore di diluizione (FD). Per garantire un'efficace infezione dei fagi, sono necessari 10 9-1012 PFU/mL.
PFU/mL= n. targhe nella piastra x FD
- Preparare il brodo di batteriofago aggiungendo 0,1 mL di lisato batteriofago concentrato a una miscela di 100 mL di brodo nutriente (NB; 5 g/L di peptone e 3 g/L di estratto di lievito), 2 mL di sali 50x E (38,78 mM MgSO47 H2O, 520,5 mM Acido citricoH2O, 2,87 M K2HPO4 anidro e 829 mM NaNH4HPO44 H2O) e 0,4 mL di 50% glucosio. Mescolare accuratamente per inversione.
- Infezione delle colture di Salmonella con batteriofagi
- Diluire una coltura notturna di S. enterica a 1:100 in un volume finale di 5 mL di LB e aggiungere 0,1 mL di lisato (concentrato a 10,9-10,12 PFU/mL). Incubare a 37 °C e 200 giri/min per 24 ore.
- Determinazione del titolo fagico come PFU nel saggio su piastra
- Per quantificare il numero di batteriofagi nella coltura infetta, eseguire saggi su piastra per determinare il titolo del fago come PFU/mL come descritto di seguito.
- Trasferire 1 mL di coltura in una provetta. Centrifugare a 17.115 x g per 2 minuti e versare il surnatante in un nuovo flaconcino etichettato.
- Aggiungere 100 μl di cloroformio al flaconcino e al vortice per rimuovere i detriti batterici dalla soluzione. Segui il passaggio 1.2.3.
- Per quantificare il numero di batteriofagi nella coltura infetta, eseguire saggi su piastra per determinare il titolo del fago come PFU/mL come descritto di seguito.
2. Rimozione dei batteriofagi da colture infette di Salmonella enterica (cfr. figura 2)
NOTA: Per monitorare il processo di rimozione dei batteriofagi, vengono prelevate aliquote diverse durante il protocollo di pulizia per la titolazione. In totale, ci sono otto aliquote per confermare che il numero di PFU/mL sta diminuendo durante il processo di pulizia fino alla completa eliminazione.
- Rimozione del batteriofago in sospensione
- Diluire la coltura batterica contenente fagi a 1:100 in 5 mL di LB filtrato da 0,22 μm in una provetta da centrifuga conica da 50 mL. Punto di titolazione 1: questa è la prima aliquota per la titolazione (la coltura di Salmonella infetta di partenza).
- Centrifugare la sospensione per 10 minuti a 2,377 x g. Rimuovere con cautela il surnatante. Non utilizzare una pipetta; Versare il tubo. Cerca di lasciare un po' di volume sul fondo della provetta da centrifuga conica per garantire la presenza di cellule.
- Lavare le cellule batteriche con 10 mL di terreno LB filtrato da 0,22 μm. Ripetere i passaggi di centrifugazione e lavaggio 3 volte. Risospendere il pellet in 5 mL di LB filtrato da 0,22 μm. Punto di titolazione 2: Questa è la seconda aliquota per la titolazione.
- Trasferire 50 μl della suddetta sospensione batterica attraverso un filtro sterile da 0,45 μm (vedere la tabella dei materiali) utilizzando un sistema di filtrazione sottovuoto. Sciacquare il filtro con 100 ml di LB filtrato da 0,22 μm.
NOTA: La dimensione della testa del batteriofago 9NA è di 0,067 μm. Al contrario, la Salmonella è lunga 2-5 μm e larga 0,5-1,5 μm. Pertanto, se vengono utilizzate membrane da 0,45 μm, la maggior parte dei batteri non passerà perché sono più grandi di 0,45 μm, mentre la maggior parte dei fagi passerà attraverso i pori del filtro da 0,45 μm.
- Rimozione dei batteriofagi contenuti all'interno delle cellule di Salmonella
- Per facilitare il rilascio dei fagi dalle cellule batteriche, incubare il filtro da 0,45 μm contenente le cellule per 2 ore a 37 °C all'interno dell'incubatore senza smontare il sistema.
NOTA: Questa fase di incubazione è necessaria per promuovere la lisi dei batteri infetti e il rilascio di fagi intracellulari nel filtro. - Lavare il filtro da 0,45 μm utilizzando un sistema di filtrazione sottovuoto, risciacquando il filtro con 100 ml di LB filtrato da 0,22 μm.
- Recuperare le cellule batteriche dal filtro in 2 mL di 2x LB (20 g/L di triptone, 10 g/L di NaCl, 10 g/L di estratto di lievito; vedere la Tabella dei materiali). A tale scopo, trasferire il filtro da 0,45 μm in un pallone utilizzando una pinza sterile. Quindi, aggiungere 2 mL di 2x LB sul filtro e pipettare più volte per rilasciare le cellule dal filtro.
- Centrifugare 1 mL di questa sospensione per 2 minuti a 10,354 x g. Scartare il surnatante e lavare le cellule batteriche 3 volte con 1 mL di terreno LB filtrato. Risospendere le cellule in 1 mL da 2x LB. Punto di titolazione 3: Questa è la terza aliquota per la titolazione.
NOTA: L'uso di un LB più concentrato (2x LB) è altamente raccomandato perché, come descritto di seguito, verrà aggiunto lipopolisaccaride commerciale (LPS) e questo LPS si dissolve in acqua, diluendo così il mezzo.
- Per facilitare il rilascio dei fagi dalle cellule batteriche, incubare il filtro da 0,45 μm contenente le cellule per 2 ore a 37 °C all'interno dell'incubatore senza smontare il sistema.
- Evitare la reinfezione ingannando i batteriofagi rilasciati dalle cellule batteriche con lipopolisaccaride commerciale come descritto di seguito.
- Incubare 20 μL di sospensione batterica in presenza di un lipopolisaccaride commerciale di S. enterica (LPS; vedere la Tabella dei materiali) a una concentrazione finale di 3,75 mg/mL in 1 mL di LB filtrato da 0,22 μm per 2 ore a 37 °C con agitazione a 200 giri/min.
NOTA: I fagi rilasciati dalle cellule nel mezzo possono legarsi all'LPS commerciale di S. enterica invece che all'LPS batterico. - Dopo 2 ore di incubazione, trasferire 1 mL di coltura in una provetta da microcentrifuga e centrifugare la sospensione per 2 minuti a 10,354 x g. Punto di titolazione 4: Utilizzare il surnatante come quarta aliquota per la titolazione.
- Lavare il pellet 3 volte con 1 mL di terreno LB filtrato.
- Dopo il lavaggio, risospendere il pellet in 1 mL da 2x LB. Incubare 20 μL di questa miscela in 1 mL di LB filtrato da 0,22 μm con 0,8 mg/mL di LPS in commercio per 2 ore a 37 °C con agitazione a 200 giri/min. Punto di titolazione 5: Utilizzare il resto della sospensione batterica per la quinta titolazione.
- Dopo 2 ore di incubazione, trasferire 1 mL di coltura in una provetta da microcentrifuga e pellettare mediante centrifugazione per 2 minuti a 10,354 x g. Punto di titolazione 6: Utilizzare il surnatante come sesta aliquota per la titolazione versando il surnatante in una nuova fiala.
- Lavare le cellule batteriche 3 volte con LB filtrato. Dopo il lavaggio, risospendere le cellule raccolte in 1 mL di LB filtrato da 0,22 μm.
- Far passare 1 mL di sospensione batterica attraverso un filtro sterile da 0,45 μm utilizzando un sistema di filtrazione sottovuoto. Sciacquare il filtro con 100 ml di LB filtrato da 0,22 μm.
- Recuperare le cellule dal filtro da 0,45 μm in 2 mL di terreno 2x LB. A tal fine, trasferire il filtro da 0,45 μm in un pallone utilizzando una pinza sterile. Quindi, aggiungere 2 mL di 2x LB sul filtro e pipettare più volte per cercare di rilasciare le cellule dal filtro.
- Pellet 1 mL di cellule mediante centrifugazione per 2 minuti a 10,354 x g. Lavare 3 volte con LB filtrato da 0,22 μm. Dopo il lavaggio, risospendere le cellule raccolte in 1 mL da 2x LB. Punto di titolazione 7: Questa è la settima aliquota per la titolazione. Questa aliquota informerà sull'efficienza della rimozione dei fagi nelle colture batteriche.
- Incubare 20 μL di sospensione batterica in presenza di un lipopolisaccaride commerciale di S. enterica (LPS; vedere la Tabella dei materiali) a una concentrazione finale di 3,75 mg/mL in 1 mL di LB filtrato da 0,22 μm per 2 ore a 37 °C con agitazione a 200 giri/min.
3. Preparazione di colture di Salmonella prive di batteriofagi dopo la rimozione dei batteriofagi
- Preparare l'inoculo senza fagi. Aggiungere 100 μL di cellule dalla sospensione batterica a 900 μL di LB contenenti 0,45 mg/mL di LPS. Incubare a 37 °C per 24 ore agitando a 200 giri/min.
- Punto di titolazione 8: Preparare l'ottava aliquota per la titolazione (l'ultima coltura potenzialmente non infetta). Questo punto serve a confermare l'assenza di reinfezione dei fagi.
Representative Results
La Salmonella enterica e altri batteri Gram-negativi hanno una membrana esterna contenente LPS. L'antigene O dell'LPS è un recettore comunemente usato dai batteriofagi 9NA per infettare le colture di Salmonella 16,17.
Data l'affinità specifica dei batteriofagi per l'antigene O o le regioni polisaccaridiche centrali dell'LPS, abbiamo voluto esaminare se l'LPS commerciale di Salmonella enterica potesse essere utilizzato come esca per escludere i batteriofagi 9NA. Per farlo, abbiamo mescolato concentrazioni note di LPS commerciale e lisato di 9NA, seguite da una titolazione. I batteriofagi LPS e 9NA commerciali sono stati miscelati in un volume totale di 200 μl e incubati per 2 ore a 37 °C senza agitare. Per la titolazione, 100 μl della miscela LPS-9NA e 60 μl di una coltura notturna sono stati aggiunti a 5 mL di agar morbido LB e versati sulla parte superiore di una piastra LB. Le piastre sono state incubate per 24 ore a 37 °C. Come mostrato nella Figura 3, il titolo del lisato diminuisce proporzionalmente all'aumentare della concentrazione di LPS commerciale di S. enterica . Questi risultati indicano che l'LPS commerciale funziona correttamente come esca per i batteriofagi 9NA.
È interessante notare che il tempo necessario al fago 9NA per lisare le cellule di Salmonella e rilasciare i fagi è facilitato dal numero di batteri e fagi (Figura 4). Al fine di studiare come questo aspetto potrebbe influenzare il protocollo di rimozione dei fagi, abbiamo testato diversi rapporti batteri/fagi (1:1, 1:10, 1:100 e 1:1000). Come si vede nella Figura 4, c'è un calo di OD600 nm della coltura a 1,5-2,5 ore dopo l'aggiunta del fago 9NA. I valori di OD600 nm vicini allo zero sono indicativi che la coltura batterica viene lisata18. Per questo motivo, i tempi di incubazione in questo protocollo sono stati definiti in 2 ore al fine di garantire un tempo sufficiente per il fago contenuto all'interno delle cellule di Salmonella per lisare i batteri e essere rilasciato. Questo tempo deve essere stimato per ogni sistema ospite-fago prima di eseguire questo protocollo.
Una volta determinato che l'LPS commerciale funziona come esca e il tempo di lisi per i batteri infetti da 9NA, abbiamo eseguito il protocollo descritto per la pulizia delle colture di Salmonella infette dai batteriofagi (Figura 1 e Figura 2). Al fine di monitorare la presenza di batteriofagi lungo ogni fase del protocollo, abbiamo eseguito saggi di placca per calcolare l'infettività delle colture risultanti in 100 μL della miscela risultante in diversi punti (Figura 5). Possiamo osservare che il lavaggio e il filtraggio ripetuti non sono sufficienti per l'eliminazione dei batteriofagi dalle colture (punti di titolazione 1-3); tuttavia, il numero di fagi diminuisce non appena impieghiamo una fase di incubazione con LPS commerciale (punto di titolazione 4). Il passaggio cruciale per la completa rimozione dei batteriofagi in una coltura batterica è la seconda incubazione con LPS commerciale (punto di titolazione 6). Questo passaggio è essenziale per la corretta rimozione del batteriofago 9NA nelle colture di Salmonella .
Un aspetto interessante di questo protocollo sarebbe conoscere il livello di resistenza dei fagi dopo le fasi di rimozione dei fagi. Una procedura che separa i fagi dai batteri resistenti ai fagi non ha alcuna utilità. Per questo motivo, è fondamentale rivelare che i batteri che rimangono nella coltura sono suscettibili ai fagi. Per dimostrare che le cellule dei fagi sensibili rimangono nelle colture dopo la procedura, abbiamo utilizzato il test su piastra Evans Blue Uranine (EBU) per lo screening della contaminazione da fagi19. Le piastre EBU sono state realizzate con terreno LB integrato con 10 mL/L K2HPO4 25%, 5 mL/L di glucosio 50%, 2,5 mL/L di fluoresceina 1%, 1,25 mL/L di Evans Blue 1% e 15 g/L di agar. Il cross-streaking su piastre EBU con fago 9NA è stato utilizzato per discriminare gli isolati resistenti ai fagi e sensibili ai fagi (Figura 6). Le colture batteriche ottenute al termine del protocollo di pulizia sono state utilizzate per ottenere colonie isolate, che sono state controllate per la contaminazione dei fagi (Figura 6B). Possiamo osservare l'esistenza di cellule sia resistenti che sensibili. Questo protocollo non favorisce la selezione di cellule fagi-resistenti; Elimina solo i batteriofagi.
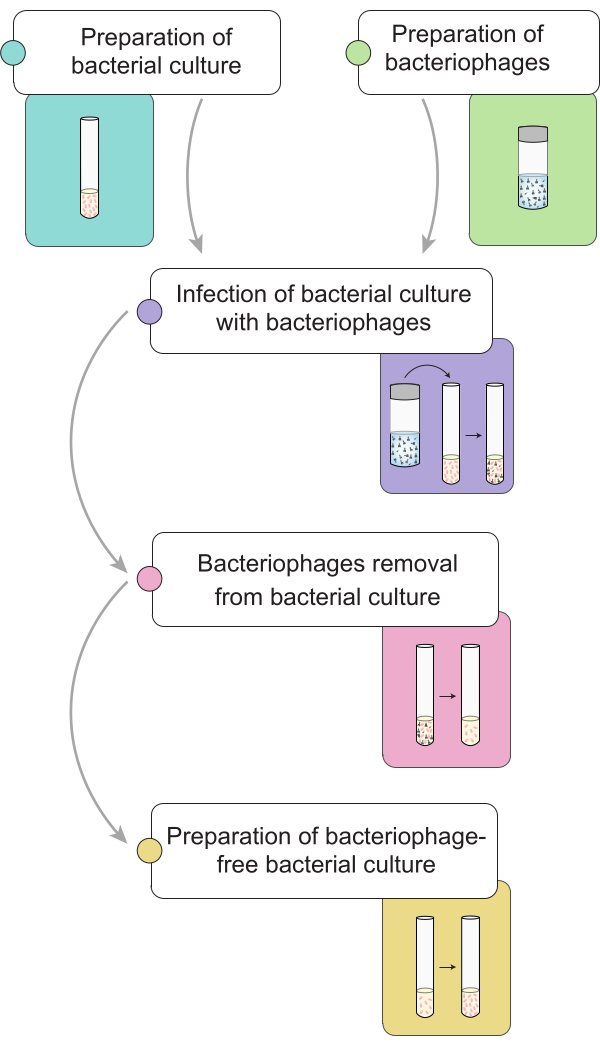
Figura 1: Breve descrizione della procedura per l'eliminazione dei batteriofagi nelle colture di Salmonella . Il flusso di lavoro è suddiviso in diverse fasi: preparazione della coltura batterica e del lisato, infezione della coltura batterica con batteriofagi, rimozione dei batteriofagi da colture batteriche infette e preparazione di un inoculo batterico privo di fagi. Clicca qui per visualizzare una versione più grande di questa figura.
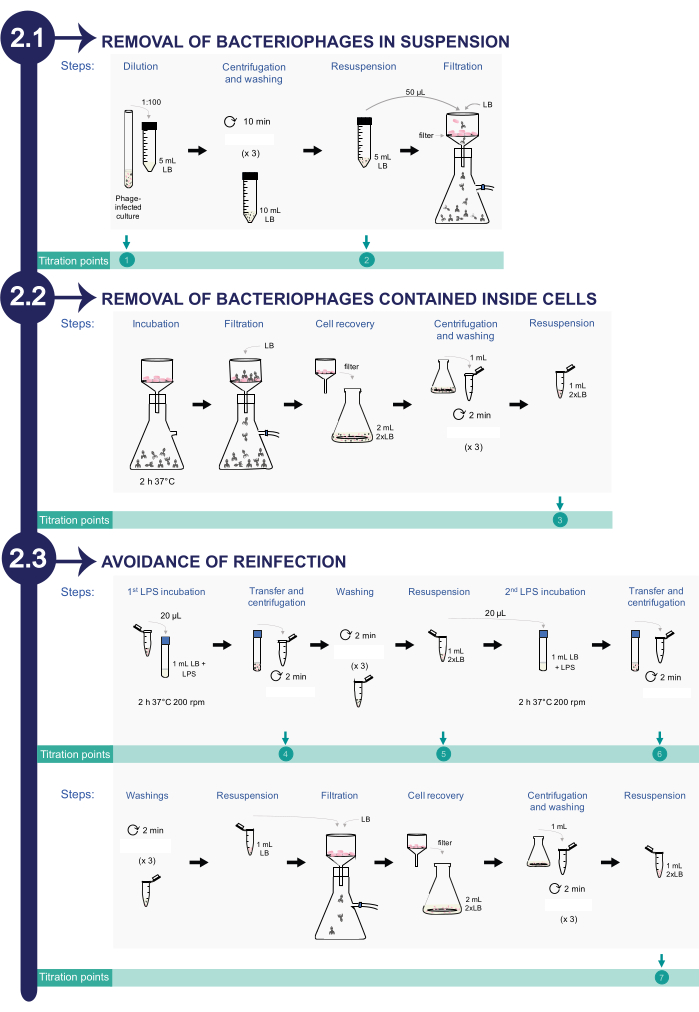
Figura 2: Procedura per la rimozione dei batteriofagi dalle colture di Salmonella infetta. Il processo si compone di tre fasi: 1) Rimozione dei batteriofagi in sospensione, 2) Rimozione dei fagi contenuti all'interno delle cellule batteriche e 3) Prevenzione della reinfezione. Clicca qui per visualizzare una versione più grande di questa figura.
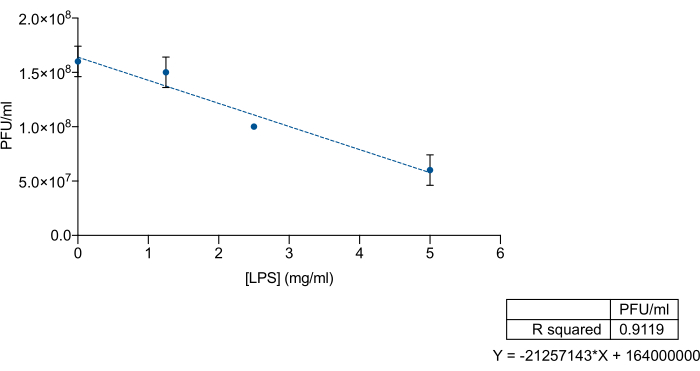
Figura 3: Saggio esca LPS per misurare l'efficienza dell'LPS commerciale di Salmonella enterica nel legare i batteriofagi. Titolazione di un lisato 9NA (PFU/ML) a concentrazioni crescenti di Salmonella enterica LPS commerciale. L'esperimento è stato condotto in triplice copia. Vengono presentate la media e la deviazione standard. Clicca qui per visualizzare una versione più grande di questa figura.
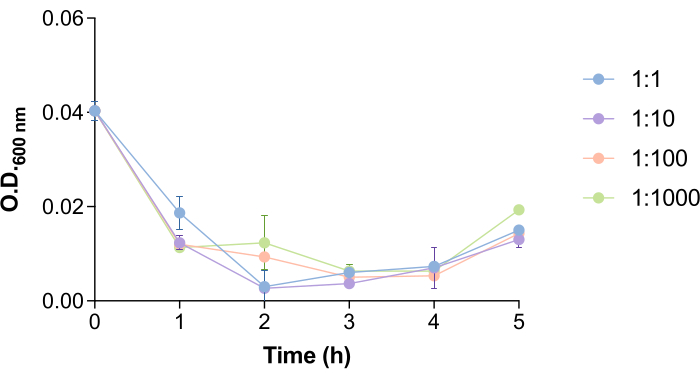
Figura 4: Tempo di lisi del batteriofago 9NA nelle colture di Salmonella . Curve di crescita delle colture di Salmonella enterica in presenza di batteriofago 9NA con rapporti batteri:fagi di 1:1, 1:10, 1:100 e 1:1000. L'esperimento è stato condotto in triplice copia. Vengono presentate la media e la deviazione standard. Clicca qui per visualizzare una versione più grande di questa figura.
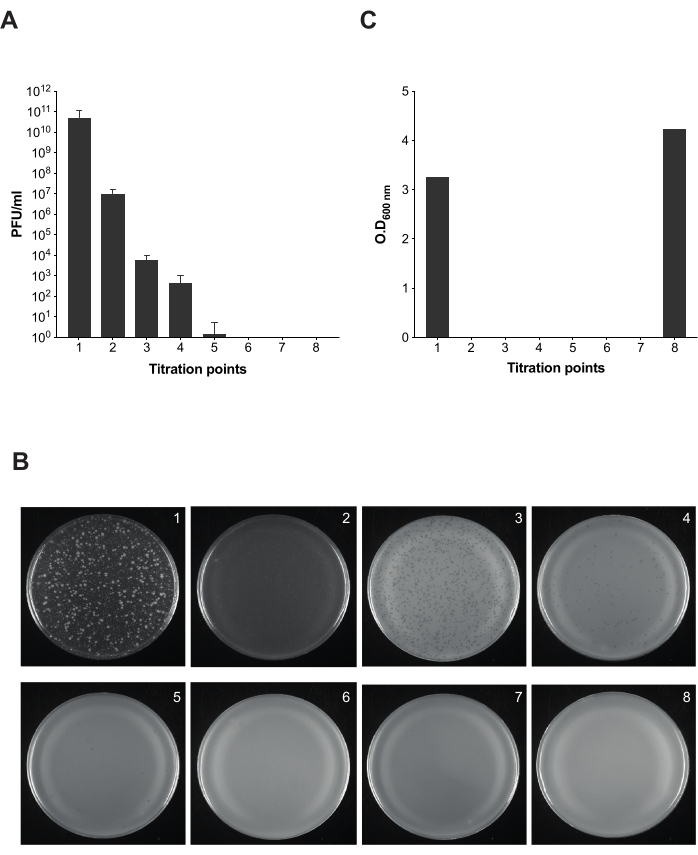
Figura 5: Saggio della placca per il test di infettività durante la rimozione dei batteriofagi in colture di Salmonella . (A) La titolazione di otto aliquote è stata effettuata in diversi punti del protocollo (i punti di titolazione 1-7 sono contrassegnati nella Figura 2). Per questo esperimento, sono stati utilizzati il sierotipo Salmonella enterica Typhimurium ceppo ATCC 14028 opvAB::lacZ (SV8011) e il batteriofago 9NA. Gli esperimenti sono stati eseguiti in triplice copia e sono mostrate la media e le deviazioni standard. (B) Le piastre di agar morbido con Salmonella enterica sono state ottenute seguendo la tecnica del overlay utilizzando aliquote da otto punti di titolazione. Le piastre corrispondono da sinistra a destra con i punti di titolazione 1-8. (C) Densità ottica a 600 nm di coltura batterica in diversi momenti del protocollo di rimozione dei fagi. Clicca qui per visualizzare una versione più grande di questa figura.
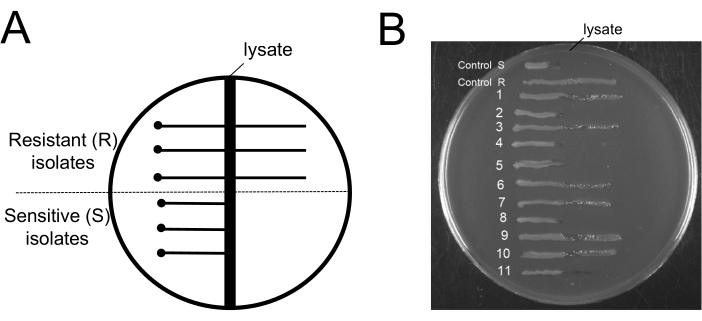
Figura 6: Test per batteri fagi-resistenti dopo la procedura di rimozione dei batteriofagi. (A) Diagramma schematico di una tipica piastra di agar EBU utilizzata per il saggio di agar a strisce incrociate: la regione scura verticale al centro rappresenta la zona del lisato 9NA. Il punto rappresenta la posizione in cui le cellule testate vengono inoculate a una distanza di sicurezza dalla zona del lisato e le linee continue orizzontali rappresentano le cellule resistenti ai fagi che crescono attraverso la zona del lisato o le cellule sensibili ai fagi che non crescono oltre la zona del lisato. (B) Alla fine del protocollo di rimozione sono stati ottenuti saggi su piastra EBU per testare 11 colonie. Control R e S sono esempi di isolati fagi-resistenti e fagi-sensibili, rispettivamente. Clicca qui per visualizzare una versione più grande di questa figura.
Discussion
Diverse strategie sono impiegate dai batteriofagi per riconoscere e infettare gli ospiti batterici. Diverse strutture molecolari sulla superficie dei batteri possono agire come recettori fagici: proteine, polisaccaridi, lipopolisaccaridi (LPS) e frazioni di carboidrati20. Nei batteri Gram-negativi, l'LPS è un recettore comune per i fagi. Inoltre, altri recettori sono le proteine della membrana esterna, i pili e i flagelli21.
L'interazione specifica tra batteriofagi e batteri basata sul riconoscimento di LPS8 è stata sfruttata in questo lavoro per lo sviluppo di un protocollo altamente efficiente per l'eliminazione di batteriofagi in colture batteriche infette (Figura 1 e Figura 2). Il nostro protocollo non favorisce la selezione di cellule fagi-resistenti; elimina solo i batteriofagi (Figura 6). Sia le cellule fagiche sensibili che quelle fagiche rimangono in coltura batterica dopo aver eseguito questo protocollo di rimozione dei fagi.
La pratica standard tradizionale quando si verifica un'infezione da fagi è quella di tentare di eliminare tutto il materiale contaminato, seguito dalla pulizia e dalla sterilizzazione22. La procedura di decontaminazione prevede l'esposizione della coltura batterica a condizioni di stress, come alte temperature, al fine di eliminare parzialmente o completamente le cellule batteriche. Come descritto nei risultati rappresentativi, la fase cruciale di questo protocollo è l'incubazione di colture batteriche infettate da fagi con LPS commerciale, una sostanza non dannosa per le colture batteriche. Ciò contribuisce a preservare la vitalità delle colture batteriche e offre vantaggi significativi per le applicazioni industriali in fermentatori e bioreattori.
Il tempo di incubazione in questo protocollo è di 2 ore per garantire un tempo sufficiente per la lisi fagica delle cellule batteriche. Se devono essere utilizzati diversi ceppi batterici e batteriofagi, questo parametro deve essere considerato e definito dall'utente. In questo caso, prima dell'esperimento deve essere eseguito un test simile a quello descritto nella Figura 4 .
È interessante notare che l'efficacia di questo protocollo di pulizia potrebbe essere analizzata anche utilizzando un test che monitora il contenuto di fagi di un determinato campione. In questo senso, i biosensori epigenetici sono un nuovo strumento per il rilevamento dei batteriofagi23. Un noto biosensore fagico in grado di rilevare i colifagi, che utilizzano LPS come recettore, è il sistema opvAB::gfp 13,18,23,24. Questo biosensore fagico rileva un aumento della sottopopolazioneOpvAB ON in presenza di fagi che utilizzano l'antigene O come recettore. In questo senso, potremmo utilizzare una fusione opvAB::gfp per monitorare i fagi leganti LPS in vari passaggi di questo protocollo e/o in diversi mezzi e condizioni. Questi approcci potrebbero essere preziosi per determinare i tempi e i luoghi in cui potrebbe essere necessario un protocollo efficace.
Sebbene il riconoscimento dell'LPS sia comune, i fagi possono anche utilizzare una varietà di altri recettori di superficie sulle cellule batteriche per l'attaccamento e l'infezione. Qui, abbiamo utilizzato la Salmonella Gram-negativa come enterobatteri rappresentativi e il batteriofago 9NA che utilizza LPS come recettore e innesco dell'espulsione del genoma. Altri fagi enterobatteri (ad esempio, Escherichia coli T5) si legano liberamente all'LPS e richiedono una proteina della membrana esterna per l'iniezione del genoma. Il protocollo descritto è applicabile ai batteriofagi che riconoscono e necessitano dell'antigene O di LPS per un'infezione riuscita, come 9NA, Det7 e P22 13,25,26,27. Di conseguenza, l'implementazione di successo di questo protocollo per la decontaminazione fagica delle colture batteriche comporta la determinazione se la fonte dell'infezione fagica richiede il riconoscimento dell'LPS nell'ospite.
In conclusione, e nonostante le potenziali limitazioni del protocollo, i nostri risultati rappresentativi dimostrano chiaramente che questo metodo è un potente strumento per ripulire le colture batteriche di Salmonella dai batteriofagi che utilizzano LPS come recettore e innesco dell'espulsione del genoma.
Disclosures
Gli autori non hanno nulla da rivelare.
Acknowledgements
Ringraziamo la Dott.ssa Carmen R. Beuzón e Rocío Carvajal-Holguera per le utili discussioni e suggerimenti. Questo lavoro è stato sostenuto dalla sovvenzione PID2020-116995RB-I00 finanziata da MICIU/AEI/ 10.13039/5011100011033 e dal VI Plan Propio de Investigación y Transferencia dell'Universidad de Sevilla.
Materials
| Name | Company | Catalog Number | Comments |
| 20 mL syringe | BD Discardit II | 300296 | No special requirements |
| 50 mL conical tubes | Avantor | 525-0610 | No special requirements |
| 90 x 14 mm Petri dishes | Deltalab | 200209 | No special requirements |
| Agar | Sigma-Aldrich | A1296 | No special requirements |
| Bacteriophage lysate | Minimal concentration: 109 PFU/mL | ||
| Centrifuge | Eppendorf | No special requirements | |
| Chloroform | Panreac | 131252 | No special requirements |
| Citric acid · H2O | Merck | 1.00247 | |
| Colony counter | No special requirements | ||
| Evans Blue | Sigma-Aldrich | E-2129 | |
| Flasks | No special requirements | ||
| Fluorescein sodium salt | Sigma-Aldrich | F-6377 | |
| Forceps | No special requirements | ||
| Glass tubes | No special requirements | ||
| Glass tubes for lysate | No special requirements | ||
| Glucose | Sigma-Aldrich | G7021 | |
| K2HPO4 | Merck | 1.05104.1000 | |
| K2HPO4 anhydrous | Merck | 1.05104 | |
| Lipopolysaccharide from Salmonella enterica serotype Typhimurium | Sigma-Aldrich | L6511-25 mg | Dissolved in sterile water |
| Membrane 0.45 µm | MF-Millipore | HAWP02500 | No special requirements |
| MgSO4 · 7 H2O | Merck | 1.05886 | |
| NaCl | Sigma-Aldrich | S9888 | No special requirements |
| NaNH4HPO4 · 4 H2O | Sigma-Aldrich | S9506 | |
| Peptone | iNtRON | Ba2001 | No special requirements |
| Syringe Filter 0.22 µm | Millex | SLGSR33SB | No special requirements |
| Toothpicks | No special requirements | ||
| Tryptone | Panreac | 403682.1210 | No special requirements |
| Vacuum pump | Thermo Scientific | No special requirements | |
| Yeast extract | iNtRON | 48045 | No special requirements |
References
- Kasman, L. M., Porter, L. D. . Bacteriophages. , (2024).
- Lawrence, D., Baldridge, M. T., Handley, S. A. Phages and human health: More than idle hitchhikers. Viruses. 11 (7), 587 (2019).
- Beller, L., Matthijnssens, J. What is (not) known about the dynamics of the human gut virome in health and disease. Curr Opin Virol. 37, 52-57 (2019).
- Roux, S., Hallam, S. J., Woyke, T., Sullivan, M. B. Viral dark matter and virus-host interactions resolved from publicly available microbial genomes. eLife. 4, 08490 (2015).
- Wommack, K. E., Colwell, R. R. Virioplankton: Viruses in aquatic ecosystems. Microbiol Mol Biol Rev. 64 (1), 69-114 (2000).
- Louten, J. Virus structure and classification. Essentl Human Virol. , 19-29 (2016).
- Egido, J. E., Costa, A. R., Aparicio-Maldonado, C., Haas, P. J., Brouns, S. J. J. Mechanisms and clinical importance of bacteriophage resistance. FEMS Microbiol Rev. 46 (1), 048 (2022).
- Rakhuba, D. V., Kolomiets, E. I., Dey, E. S., Novik, G. I. Bacteriophage receptors, mechanisms of phage adsorption and penetration into host cell. Polish J Microbiol. 59 (3), 145-155 (2010).
- Lindberg, A. A. Bacteriophage receptors. Ann Rev Microbiol. 27 (1), 205-241 (1973).
- Koskella, B., Meaden, S. Understanding bacteriophage specificity in natural microbial communities. Viruses. 5 (3), 806-823 (2013).
- Marcó, M. B., Moineau, S., Quiberoni, A. Bacteriophages and dairy fermentations. Bacteriophage. 2 (3), 149-158 (2012).
- Fernández-Fernández, R., et al. Evolution of a bistable genetic system in fluctuating and non-fluctuating environments. bioRxiv. , (2024).
- Cota, I., Blanc-Potard, A. B., Casadesús, J. STM2209-STM2208 (opvAB): a phase variation locus of Salmonella enterica involved in control of O-antigen chain length. PloS one. 7 (5), 36863 (2012).
- Kropinski, A. M., Mazzocco, A., Waddell, T. E., Lingohr, E., Johnson, R. P. Enumeration of bacteriophages by double agar overlay plaque assay. Methods Mol Biol. 501, 69-76 (2009).
- Ackermann, H. W. Tailed bacteriophages: The order Caudovirales. Adv Virus Res. 51, 135-201 (1998).
- Wilkinson, R. G., Gemski, P., Stocker, B. A. D. Non-smooth mutants of Salmonella typhimurium: Differentiation by phage sensitivity and genetic mapping. J Gen Microbiol. 70 (3), 527-554 (1972).
- Casjens, S. R., Leavitt, J. C., Hatfull, G. F., Hendrix, R. W. Genome sequence of Salmonella Phage 9NA. Genome Announc. 2 (4), 00531-00614 (2014).
- Cota, I., et al. Epigenetic control of Salmonella enterica O-antigen chain length: A tradeoff between virulence and bacteriophage resistance. PLoS Genet. 11 (11), 1005667 (2015).
- Chan, K., Botstein, D., Watanabe, T., Ogata, Y. Specialized transduction of tetracycline resistance by phage P22 in Salmonella typhimurium. Virology. 50, 883-898 (1972).
- Bertozzi Silva, J., Storms, Z., Sauvageau, D. Host receptors for bacteriophage adsorption. FEMS Microbiol Lett. 363 (4), 002 (2016).
- Sørensen, M. C. H., et al. Bacteriophage F336 recognizes the capsular phosphoramidate modification of Campylobacter jejuni NCTC11168. J Bacteriol. 193 (23), 6742-6749 (2011).
- Ogata, S., Hongo, M. Bacteriophages of the Genus Clostridium. Adv Appl Microbiol. 25, 241-273 (1979).
- Olivenza, D. R., Casadesús, J., Ansaldi, M. Epigenetic biosensors for bacteriophage detection and phage receptor discrimination. Environ Microbiol. 22 (8), 3126-3142 (2020).
- Olivenza, D. R., et al. A portable epigenetic switch for bistable gene expression in bacteria. Sci Rep. 9 (1), 862 (2019).
- Walter, M., et al. Structure of the receptor-binding protein of bacteriophage Det7: a Podoviral tail spike in a Myovirus. J Virol. 82 (5), 2265-2273 (2008).
- Davies, M. R., Broadbent, S. E., Harris, S. R., Thomson, N. R., van der Woude, M. W. Horizontally acquired Glycosyltransferase operons drive Salmonellae lipopolysaccharide diversity. PLoS Genet. 9 (6), 1003568 (2013).
- Wahl, A., Battesti, A., Ansaldi, M. Prophages in Salmonella enterica: a driving force in reshaping the genome and physiology of their bacterial host. Mol Microbiol. 111 (2), 303-316 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved