高分辨率荧光肺活测定法评估人免疫细胞中线粒体膜电位的动态变化
In This Article
Summary
在免疫细胞中生理相关底物浓度下研究线粒体生物能量学的方法有限。我们提供了一个详细的方案,该方案使用高分辨率荧光肺活量法来评估线粒体膜电位对人 T 细胞、单核细胞和外周单核细胞中能量需求的响应变化。
Abstract
外周单核细胞 (PBMC) 表现出线粒体呼吸能力的强烈变化,以应对健康和疾病。虽然这些变化并不总是反映其他组织(如骨骼肌)中发生的情况,但这些细胞是人类受试者活线粒体的可获取且有价值的来源。PBMC暴露于影响其生物能量状态的系统信号。因此,扩展我们的工具来研究该人群的线粒体代谢将阐明与疾病进展相关的机制。线粒体的功能测定通常仅限于使用遵循最大底物、抑制剂和解偶联子浓度的呼吸输出量来确定呼吸能力的全部范围,这在 体内可能无法实现。ATP-合酶将二磷酸腺苷 (ADP) 转化为三磷酸腺苷 (ATP) 导致线粒体膜电位 (mMP) 降低和耗氧量增加。为了提供对线粒体动力学的更综合分析,本文介绍了使用高分辨率荧光肺活量法来测量耗氧量和线粒体膜电位 (mMP) 对生理相关 ADP 浓度的同时响应。该技术使用四甲基罗丹明甲酯 (TMRM) 来测量 mMP 极化,以响应于复合物 I 和 II 底物的最大超极化后的 ADP 滴定。该技术可用于量化健康状况的变化(例如衰老和代谢疾病)如何影响线粒体反应对人类受试者 PBMC、T 细胞和单核细胞能量需求的敏感性。
Introduction
细胞在生理应激时期的功能和生存能力在很大程度上取决于其满足恢复体内平衡的能量需求的能力 1,2。能源需求因各种刺激而上升。例如,运动期间肌肉收缩增加会增加骨骼肌对 ATP 和葡萄糖的利用,感染后蛋白质合成的增加会增加免疫细胞对 ATP 的利用,用于细胞因子的产生和增殖 3,4,5,6。能源需求的激增触发了一系列生物能源过程,以恢复ATP/ADP比率。随着 ATP 的消耗,ADP 水平上升并刺激 F1F0 ATP 合酶(复合物 V),它需要质子动力来驱动其机械旋转并催化 ADP 在线粒体内转化为 ATP7。质子动力是一种电化学梯度,由电子通过线粒体内膜内的电子传输系统 (ETS) 从底物转移到氧时泵送质子而产生。由此产生的质子浓度(delta pH)和电势(膜电位)的差异产生了质子动力,该质子动力驱动ATP合成和氧气消耗,以响应能量需求,从而降低ATP / ADP比率或提高ADP水平。线粒体对 ADP 的亲和力可以通过计算 ADP 刺激的分离线粒体或透化细胞的呼吸的 Km 或 EC50 来确定 8,9。这种方法表明,与年轻受试者相比,来自老年人的透化肌肉纤维需要更高浓度的 ADP 才能刺激其最大氧化磷酸化能力的 50%9。同样,老化的小鼠骨骼肌需要更多的 ADP 来降低线粒体活性氧 (ROS) 的产生10,11。此外,与对照组相比,饮食诱导的肥胖小鼠的通透肌纤维中的ADP敏感性降低,并且在胰岛素存在和硝酸盐消耗后增强12,13。因此,线粒体对能量需求的反应能力在不同的生理条件下会有所不同,但以前尚未在免疫细胞的背景下探索过这一点。
外周血单核细胞 (PBMC) 通常用于研究人类受试者的细胞生物能量学 14,15,16,17,18,19,20。这主要是由于在临床研究中可以很容易地从未凝固的血液样本中获得细胞,细胞对代谢扰动的反应性,以及各种小组开发的通过使用抑制剂和解偶联剂来询问线粒体代谢的方法,以确定线粒体呼吸的最大和最小容量21,22.这些方法使人们认识到生物能量学在衰老、代谢疾病和免疫功能中的作用14,20,23,24。在心力衰竭的情况下,骨骼肌和 PBMC 的线粒体呼吸能力通常会降低18,25。PBMC 生物能量学还与健康成年人的心脏代谢危险因素相关17,并且对烟酰胺核苷18 等治疗有反应。PBMC 包括中性粒细胞、淋巴细胞(B 细胞和 T 细胞)、单核细胞、自然杀伤细胞和树突状细胞,它们都有助于 PBMC 线粒体容量 26,27,28。此外,细胞生物能量学在免疫细胞活化、增殖和更新中起着至关重要的作用23.然而,这些方法的局限性是细胞在底物的生理范围内不起作用。因此,需要其他方法来研究底物浓度中的线粒体功能,这些底物浓度与细胞在体内的经历更相关。
线粒体膜电位 (mMP) 是质子动力的主要组成部分,对于 ATP 产生以外的各种线粒体过程至关重要,例如呼吸通量调节、活性氧产生、蛋白质和离子输入、自噬和凋亡。mMP 可以使用对膜极化变化敏感的电化学探针或荧光染料(如 JC-1、Rhod123、DiOC6、四甲基罗丹明 (TMRE) 或甲酯 (TMRM) 和番红素)进行评估。后两种是亲脂性阳离子染料,已成功用于组织匀浆、分离线粒体和透化组织的高分辨率荧光肺活量测定 11,29,30,31,32,33。在这种技术中,TMRM 以淬灭模式使用,其中细胞暴露于高浓度的 TMRM 中,当极化(高 mMP 和质子动力)时,这些 TMRM 会积聚在线粒体基质中,从而导致胞质 TMRM 荧光的淬灭。当线粒体响应 ADP 或解偶联剂去极化时,染料从基质中释放出来,增加 TMRM 荧光信号34,35。该方法的目的是同时测量人源性 PBMC、循环单核细胞和 T 细胞中响应 ADP 滴定的线粒体呼吸和 mMP 的变化,也可以应用于小鼠脾 T 细胞。
Protocol
本文介绍的用于数据和方法开发的血液样本收集已获得华盛顿大学内部审查委员会的批准。代表性结果还包括从Jackson Laboratories购买的雄性C57BL / 6J小鼠(5-7个月大)的数据。所有动物程序均得到华盛顿大学动物福利办公室的批准。协议概述如图 1 所示。该协议的试剂制备可在 补充文件1中找到。
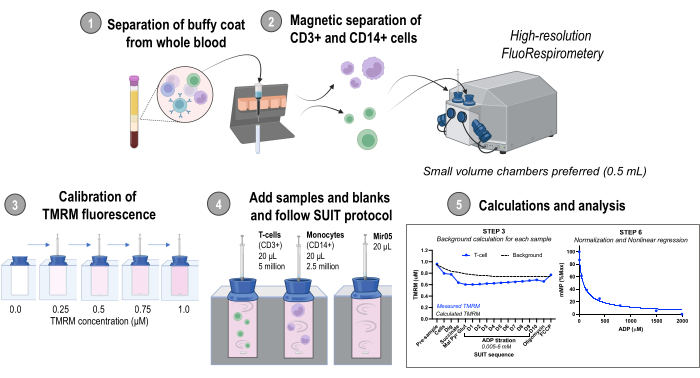
图 1:协议概述。 使用高分辨率荧光肺活量法评估新鲜人血液样本中分离的单核细胞 (CD14+) 和 T 细胞 (CD3+) 中线粒体膜电位的变化的工作流程。简称:TMRM,四甲基罗丹明甲酯;SUIT, 底物-解偶联剂-抑制剂滴定;ADP, 二磷酸腺苷;挖,洋地黄皂苷;Mal, 苹果酸;Pyr, 丙酮酸;过剩,谷氨酸;D1-10,连续10次ADP滴定。 请点击这里查看此图的较大版本.
1. 从全血中分离出血沉棕黄层
注:细胞分离修改自 Kramer 等人 27。
- 让 RPMI、密度梯度和离心机达到室温。在开始之前对生物安全柜和材料进行消毒。
- 将静脉血收集到三个 10 mL K2EDTA 管中。将管子倒置至少 3 次。
- 以500× g 离心管10分钟(22°C,9加速度[acc],2减速[dec])。
- 从每个试管中取出1mL血浆,并储存在-80°C以备将来分析。
- 将血浆和每根管的一半红细胞层转移到单个 50 mL 锥形管中。将 RPMI 加入至 40 mL 标记。倒置至少 3 次。
- 缓慢地将 10 mL 血浆溶液分层到四个 15 mL 锥形管中,其中包含 3 mL 的密度梯度。
- 以700× g 离心30分钟(22°C,5acc,2dec)。
- 收集所有血浆和含有外周单核细胞 (PBMC) 的血沉棕黄层,而不破坏红细胞。
- 以500× g 离心10分钟(22°C,5acc,5dec)并吸出上清液。
- 通过将PBMC沉淀重悬于10mL RPMI中并以500× g 离心10分钟(22°C,5acc,5dec)洗涤PBMC沉淀1x-2x。
2. CD14+和CD3+细胞的磁性分离
- 将一根柱子放在磁性细胞分离器的磁场中(参见 材料表)。用 3 mL RP-5 洗涤色谱柱。
- 将 PBMC 沉淀重悬于 80 μL RP-5 和 20 μL 抗 CD14 微珠中(参见 材料表)。在4°C孵育15分钟。
- 用 1 mL RP-5 重悬细胞,并将悬浮液加载到色谱柱上。收集流经标有“流通 1”的 15 mL 锥形管的未标记细胞。等到所有细胞悬液都通过色谱柱,然后继续用 3 mL RP-5 3x 洗涤,收集所有流出物。
- 小心地将色谱柱从磁场中取出,并将其放在新的 15 mL 锥形管上。加入 5 mL RP-5,并立即使用柱塞将色谱柱内容物吹入标有“CD14+”的收集管中。
- 将“流通1”以500× g 离心10分钟(22°C,5acc,5dec)并吸出上清液。
- 使用 流通 1 中的细胞,使用抗 CD3 微珠(参见 材料表)重复步骤 2.2-2.5 以分离 T 细胞。
- 将含有T细胞(CD3 +)和单核细胞(CD14 +)的管以300× g 离心5分钟。吸出上清液并将沉淀重悬于 1 mL RP-5 中。
- 使用血细胞计数器或自动细胞计数仪确定细胞浓度。
注:可以通过向血细胞计数器中加入 10 μL 1:10 或 1:20 的细胞稀释液来计数细胞。可以参考以前发表的使用血细胞计数器36对细胞进行计数的方案。 - 将 250 万个单核细胞或 500 万个 T 细胞移液到新的离心管中。以 2000 x g 离心 30 秒,吸出上清液并将细胞重悬于 MiR05 中,总体积为 20 μL,终浓度为 1.25 亿个单核细胞或 2.5 亿个 T 细胞/mL。
注:选择最终浓度注射 250 万个单核细胞或 500 万个 T 细胞,体积为 20 μL。 从脾脏分离的小鼠 T 细胞也已使用该方法进行了测试。该过程可在 补充文件 1 中找到。
3. 高分辨率荧光肺活计 - 氧气和 TMRM 荧光校准
注:该方法改编自 Pharaoh 等人 11 之前对透化纤维所做的工作。TMRM 的高非抑制浓度用于淬灭模式,其中基体中 mMP 和 TMRM 浓度的关系是倒置的。因此,mMP 的降低导致 TMRM 染料从基质中释放并增加荧光32。
- 根据制造商的说明在 O.5K 呼吸计中安装 2 mL 腔室(参见 材料表)。打开仪器,将其连接到制造商提供的软件进行数据采集。
- 将温度调节至 37 °C,搅拌速度至 750 rpm。
- 用蒸馏水清洗腔室 3 次。用 0.54 mL Mir05 置水,完全关闭塞子,并使用集成抽吸系统 (ISS) 去除多余的缓冲液。抬起塞子,使室内氧气与使用塞子垫片平衡腔室氧气。
- 一旦氧通量稳定,就按照制造商的说明执行空气氧校准 (R1)。
注意:氧通量可能需要 >30 分钟才能稳定下来。氧传感器需要使用连二亚硫酸盐滴定法测定 50-200 μM 的零点氧 (R0) 和背景氧通量。具体方法可以在制造商的手册中找到。 - 通过关闭塞子来密封腔室。
注:与使用透化纤维的实验不同,这些腔室不需要对 PBMC 进行过度氧化。 R1 校准后密封腔室可为实验提供足够的氧气。氧水平应保持在50-250μM之间。如果氧气浓度低于阈值,则腔室可以部分打开,以便腔室氧气可以与室内空气中的氧气平衡。 - TMRM 校准
- 使用绿色 LED 荧光传感器(例如 525 nm)和 AmR 滤光片组(参见 材料表)。将荧光计 增益 设置为 1000 ,将 强度 设置为 1000。打开荧光传感器并开始记录基线。
- 注入 2.5 μL 0.05 mM TMRM,并在下一次 2.5 μL 进样之前让信号稳定(~2 分钟),直到总共进行 4 次进样,总 TMRM 浓度为 1 μM TMRM 在腔室中。使用汉密尔顿注射器进行所有注射。
- 通过为每次进样选择代表 0、0.25、0.5、0.75 和 1.0 μM TMRM 的荧光信号(电压)来校准荧光传感器,以进行五点校准。
4. 底物-解偶联剂-抑制剂滴定 (SUIT) 方案
注:运行空白实验,将 20 μL Mir05 注射到腔室中,而不是 20 μL 细胞悬液,因为 TMRM 信号将响应单独注射而变化(在代表性结果中讨论)。在下次进样之前,让氧通量信号稳定(约2-3分钟),用于空白和样品实验。以下滴定方案和预期观察结果见 表1。
- 一旦氧通量稳定,选择并标记氧通量和TMRM信号“前池”。
- 在 ~20 μL 中注射含有 500 万个 T 细胞或 250 万个单核细胞的细胞悬液并测量约 10 分钟。选择氧通量和 TMRM 信号并将其标记为“单元”。
- 通过注射 2 μL 1 mg/mL 洋地黄皂苷(终浓度:4 μg/mL)透化细胞。等待 20 分钟。选择氧通量和 TMRM 信号并将其标记为“Dig”。
注意:建议在单独的实验中优化洋地黄皂苷浓度。 - 加入 2.5 μL 1 M 琥珀酸酯(终浓度:5 mM)。选择氧通量和 TMRM 信号并将其标记为“SUCC”。
- 一旦氧通量稳定,加入 5 μL 100 mM 苹果酸(终浓度:1.0 mM)、5 μL 1 M 谷氨酸(终浓度:10 mM)和 5 μL 500 mM 丙酮酸(终浓度:5 mM)。选择氧通量和 TMRM 信号并将其标记为“MPG”。
- 一旦氧通量稳定,滴定 ADP。选择每次滴定的速率,并根据滴定次数按顺序将其标记为“D”1 到 10。使用 表2中的滴定方案。
- 一旦氧通量稳定,执行一系列 1 μL 滴定 0.25 mM 羰基氰对(三氟甲氧基)苯腙 (FCCP),直至荧光信号达到最大值。选择并标记代表最小膜电位的氧通量和 TMRM 信号,并将其标记为“FCCP”。
注意:通常需要 0.5-1.0 μM 的 FCCP 浓度来耗尽线粒体膜电位。
注意:FCCP是有毒的。请参阅安全数据表 (SDS) 以进行正确处理。 - 可选:一旦氧通量稳定,注射 1 μL 0.25 mM 鱼藤酮以抑制复合物 I 并通过复合物 II 确定呼吸能力。
注意:使用解偶联仪滴定后,膜电位的变化不再相关。
注意:鱼藤酮是有毒的。请参阅 SDS 以正确处理。 - 一旦氧通量稳定,注射 1 μL 1.25 mM(终浓度:2.5 μM)抗霉素 A 以抑制线粒体呼吸。
注意:抗霉素 A 有毒。请参阅 SDS 以正确处理。
5. 线粒体膜电位的计算和分析
- 使用空白实验,在注入空白样品(“预样品”)之前和每次进样之前记录校准的 TMRM 值(微摩尔 TMRM)。请参阅 图 2。
- 对于每个空白实验,通过将“预采样”TMRM浓度设置为1.0来计算背景比。计算 TMRM 的后续比例减少。计算所有空白实验的平均背景比。
注意:要包含的空白实验数量可能取决于仪器的精度。参见 表 3 中来自五个不同空白实验的计算示例,其中每次滴定的平均背景比标准偏差介于 0 和 0.016 之间。 - 背景计算: 通过将样品实验的“样本前”TMRM 乘以每次进样的平均背景比来计算每个样品实验的背景。请参阅 表 3 中的计算示例。
- 背景校正:将实验的背景减去样品的测得的 TMRM 值。请参阅 表 4 中的计算示例。
- FCCP 校正:从每次进样中减去 FCCP 背景校正的 mMP。请参阅 表 4 中的计算示例。
- ADP 灵敏度曲线:通过使用在整个 ADP 滴定过程中收集的 mMP 值,将最高和最低膜电位分别设置为 100% 和 0%,归一化 ADP 驱动的 mMP 降低。使用首选的统计软件将数据拟合到非线性拟合回归模型中,以计算 ADP 在 mMP 上的半最大抑制浓度 (IC50)。
注意:该曲线拟合 Prism 中的 [抑制器] 与归一化响应 - 可变斜率。
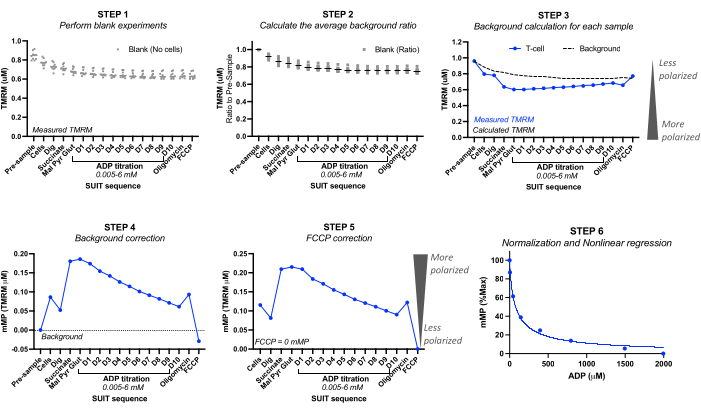
图 2:通过 TMRM 荧光计算线粒体膜电位 (mMP) 和 ADP 灵敏度。 通过高分辨率荧光肺活测定法对一个 T 细胞样本 (n = 1) 测量 TMRM 荧光来计算线粒体膜电位 (mMP) 和 ADP 敏感性的步骤。第 1 步:在空白样品中测量 TMRM 荧光,就像在生物样品中所做的那样。第 2 步:确定每次滴定时 TMRM 信号相对于每个空白实验样品之前的信号的比率。计算所有空白实验的每次滴定的平均值。第 3 步:通过将“样品前”荧光乘以每次滴定的平均背景比来计算每个样品实验的背景。第 4 步:计算每次滴定的背景和样品 TMRM 荧光之间的差异,以将数据表示为 mMP 或线粒体 TMRM 摄取。第 5 步:校正 mMP,以便与 FCCP 的完全解耦反映零 mMP。第 6 步:执行非线性回归,绘制 mMP 随 ADP 浓度增加而变化的图表。在 0.5 mL 腔室中进行测量,其中一个腔室含有来自健康志愿者的 500 万个 T 细胞。平均数据表示为SEM±平均值。单次重复的单个数据点表示时不带误差线。 请点击这里查看此图的较大版本.
Representative Results
为了说明测定的最佳细胞浓度的差异,将 500 万个 T 细胞加载到一个 0.5 mL 腔室(1000 万个细胞/mL)中,将 125 万个细胞加载到含有 1 μM TMRM 的另一个腔室(250 万个细胞/mL)中(图 3A-G)。还包括三个空白实验来计算TMRM背景。我们发现,较高浓度的 T 细胞导致 TMRM 荧光相对于背景发生更明显的变化(图 3B,D)。此外,较高的细胞浓度使我们能够检测到预期的耗氧量增加和响应FCCP的同时mMP消耗消耗(图3E,F)。使用低浓度的细胞会产生与背景平行的微弱荧光变化。由于 mMP 的计算会从信号中减去背景,因此低细胞浓度无法确定 mMP 响应底物和解耦器的变化。除了在该测定中使用较高浓度的细胞外,我们还建议在实验之间保持每种细胞类型的细胞浓度恒定。
为了验证 ATP 合酶在 ADP 滴定法中 mMP 耗散的影响,我们在 PBMC 和 T 细胞上进行了平行实验,其中一个室在 ADP 滴定之前接受寡霉素(图 4)。我们发现在用寡霉素处理的细胞中,mMP 对 ADP 没有消散,这表明 ADP 的 mMP 逐渐减少是质子通量通过 ATP-合酶的结果(图 4A-F)。我们还比较了同一参与者的 T 细胞和 PBMC 之间的 ADP 敏感性,发现 T 细胞组分中的 ADP 敏感性较低(较高 EC50)(图 4G,H)。
我们进行了一系列空白实验,以确定时间或SUIT协议对TMRM荧光的影响。我们发现,空白实验中的TMRM信号主要受SUIT滴定(图5A)的影响,而不是滴定的时间(图5B)。
我们比较了 11 名健康社区居民志愿者的 T 细胞和单核细胞中 ADP 驱动的耗氧率 (OCR) 和 mMP 变化(图 6A-H)。与先前发表的使用细胞外通量和酶促测定的实验结果类似,单核细胞表现出比淋巴细胞更大的线粒体呼吸能力26,27(图6A,H)。然而,我们在两种细胞类型中都没有检测到ADP的OCR的典型剂量反应增加(图6C,D),这与该方法在使用高度代谢组织(如小鼠肝脏)时显示的情况相反(图7A-H)。另一方面,TMRM的使用使我们能够在人类免疫细胞(图6E-G)和小鼠的脾脏T细胞(图7E-H)中检测到带有ADP的mMP逐渐下降。虽然我们没有使用相同的滴定方案直接比较人类和小鼠 T 细胞,但我们确实发现,与人类受试者的循环 T 细胞相比,小鼠 T 细胞的 IC50 低 10 倍。
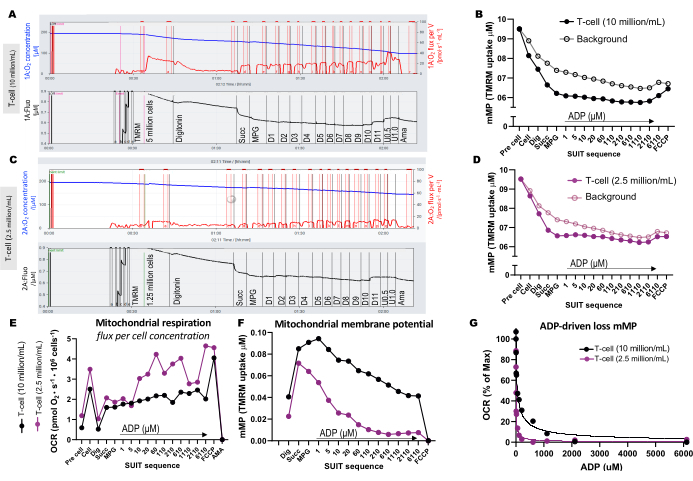
图 3:高分辨率荧光肺活量测定实验。 (A-D) 在 0.5 mL 腔室中使用 T 细胞浓度为 1000 万个细胞/mL 和 250 万个细胞/mL 的高分辨率荧光肺活量测定实验的轨迹。(A) 1000 万个细胞/mL,0.5 mL 腔室。(C) 250 万个细胞/mL,0.5 mL 腔室。氧通量 (pmol/s/mL) 显示在顶部面板(红色)中,校准的 TMRM 信号显示在底部面板(黑色)中。绘制了含有 (B) 1000 万个细胞/mL 和 (D) 250 万个细胞/mL 的腔室中样品的整个 SUIT 中 TMRM 的变化及其计算背景。(E) 对于每种细胞浓度,计算氧通量 (pmol/s/百万个细胞) 和 (F) 线粒体膜电位。(G) 绘制 ADP 敏感性曲线并拟合到非线性回归模型(实线)。缩写:mMP,线粒体膜电位;TMRM, 四甲基罗丹明甲酯;SUIT, 底物-解偶联剂-抑制剂滴定;ADP, 二磷酸腺苷;挖,洋地黄皂苷;Mal, 苹果酸;Pyr, 丙酮酸;过剩,谷氨酸;D1-11,连续11次ADP滴定;U, 解偶联FCCP为0.5和1.0μM;AMA, 抗霉素 A. 请点击这里查看此图的较大版本.
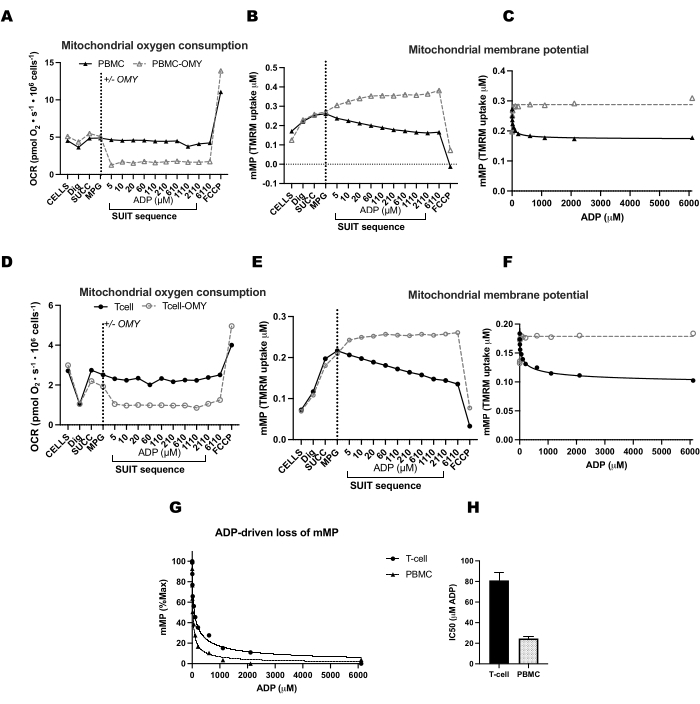
图 4:ATP 合酶驱动 ADP 驱动的 T 细胞和 PBMC 中膜电位降低。 (AH) 此处描述的方案已在 PBMC 和 T 细胞中进行了测试。两个 O2K 腔室注射了 PBMC,两个额外的 O2K 腔室注射了来自同一参与者的 T 细胞。在所有腔室中注射底物苹果酸盐、丙酮酸和谷氨酸后,一个腔室的 PBMC 和 T 细胞接受寡霉素。寡霉素可防止 (A) PBMC 和 (D) T 细胞中任何 ADP 驱动的呼吸升高或 (B,C) PBMC 和 (E,F) T 细胞中线粒体膜电位的下降。(克,高)与 T 细胞相比,PBMC 中的 ADP 敏感性更高。请点击这里查看此图的较大版本.
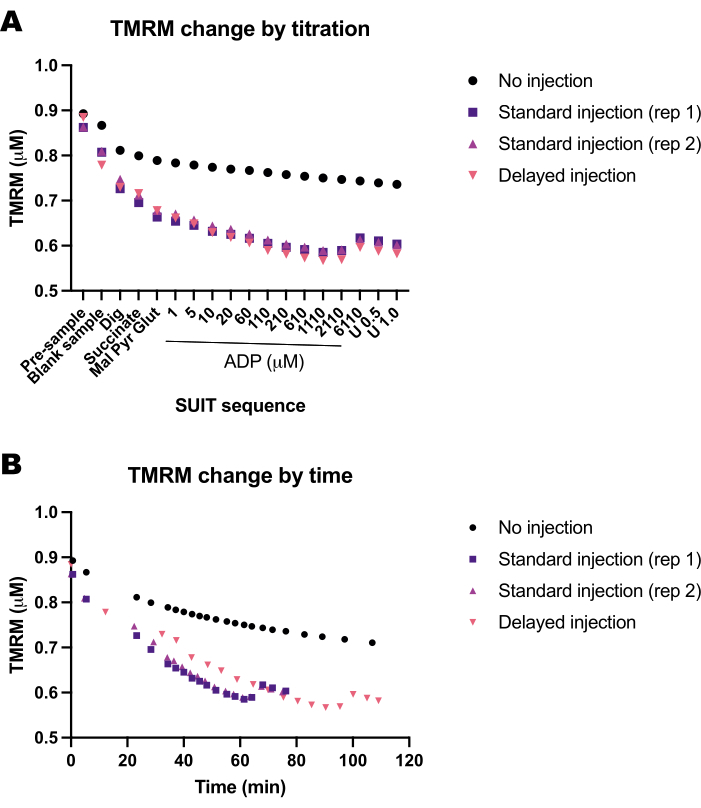
图 5:空白实验显示了 TMRM 荧光随时间和底物、解偶联剂和抑制剂 (SUIT) 滴定的变化。 (A) TMRM 荧光响应滴定的变化。(B) TMRM荧光随时间的变化。实验在装有含有 1 μM TMRM 的 Mir05 的 0.5 mL 腔室中进行。一个腔室未接受任何 SUIT 滴定(未进样);两种不同仪器中的两个腔室接受标准套装方案(标准进样);一个腔室接受相同的 SUIT 滴定,但每次进样之间有延迟(延迟进样)。 请点击这里查看此图的较大版本.
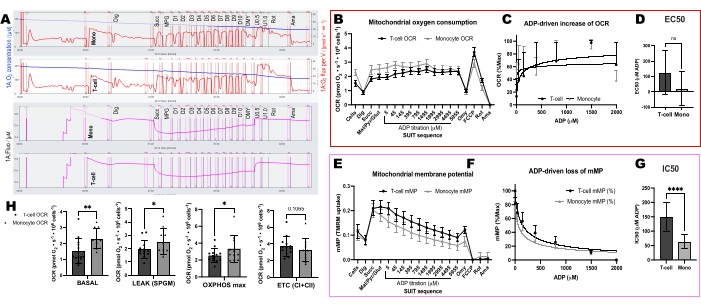
图 6:使用 OCR 和 mMP 的 T 细胞和单核细胞之间 ADP 灵敏度的差异。 (A) 来自受试者单核细胞和 T 细胞样本的高分辨率荧光肺活测定实验的痕迹。(B) 健康志愿者血液中单核细胞 (n= 11) 和 T 细胞 (n= 13) 的耗氧量。(C,D)使用 ADP 滴定法对绘制的呼吸上升进行非线性回归拟合,以计算 EC50。(E) 线粒体膜电位的同时测量。(F,G)使用 ADP 滴定法对线粒体膜电位的绘制下降进行非线性回归拟合,以计算 IC50。(H) 单核细胞和T细胞的呼吸能力参数。折线图的数据表示为 SEM 的平均值±条形图的平均值± SD。t 检验后具有统计学意义的差异表示为 *p < 0.05。**P < 0.01,****P < 0.0001。请点击这里查看此图的较大版本.
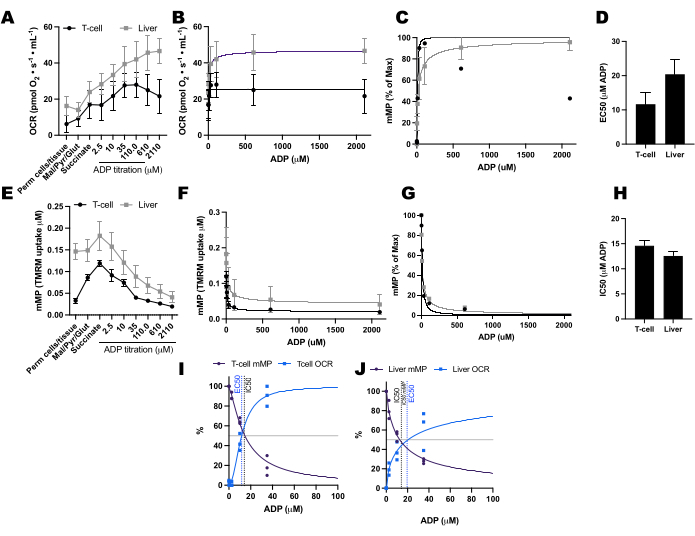
图 7:比较通透小鼠脾 T 细胞和肝脏中呼吸和线粒体膜电位 (mMP) 的 ADP 反应。 (A-D) 通透小鼠脾 T 细胞和肝脏的呼吸反应。(E-H)在通透的小鼠脾 T 细胞和肝脏中 mMP 的反应。从颈椎脱位后的三只小鼠身上解剖新鲜肝脏和脾脏。使用抗体偶联的磁珠分离分离脾 Pan T 细胞。两种样品在1μM TMRM存在下都进行了相同的SUIT方案。(一,日)从耗氧量 (OCR) 的增加计算的 EC50 和响应 ADP 的 mMP 减少计算的 IC50 的比较。N = 每组 3 个。数据以SEM±平均值表示。 请点击这里查看此图的较大版本.
表 1:使用 0.5 mL 腔室评估新鲜分离的 T 细胞和单核细胞中线粒体膜电位的 SUIT 方案示例。请按此下载此表格。
表 2:0.5 mL 腔室的推荐 ADP 滴定。请按此下载此表格。
表3:使用五个独立的空白实验计算平均背景比。请按此下载此表格。
表 4:计算样品实验的线粒体膜电位 (mMP)。请按此下载此表格。
补充图1:Mir05和DMSO对线粒体呼吸和膜电位的影响。请点击这里下载此文件。
补充文件1:从小鼠脾脏中分离T细胞的试剂制备和方案。请点击这里下载此文件。
Discussion
该协议使用高分辨率荧光肺活计通过测量 mMP 响应于 PBMC、单核细胞和 T 细胞中 ADP 水平升高的耗散来测量线粒体反应对能量需求的敏感性。这是通过添加复合物 I 和 II 底物以最大限度地提高线粒体膜电位和滴定 ADP 以逐渐刺激 ATP 合酶以使用质子梯度生成 ATP 来实现的。
方案中的关键步骤包括将荧光团的增益和强度设置为1000,并确保在TMRM滴定期间获得TMRM荧光信号。由于每次滴定后TMRM荧光都会下降(该方法的局限性),因此必须使用空白样品进行背景实验。我们还发现DMSO对线粒体呼吸和膜电位具有抑制作用,因此,建议稀释Mir05中TMRM的工作溶液(补充图1)。
尝试此方案时可以使用的一些修改是调整细胞浓度并使用标准的 2 mL 腔室。然而,0.5 mL 腔室是 T 细胞和单核细胞的首选,因为膜电位和氧通量的最佳响应需要高浓度的细胞。在测试具有较强呼吸能力的细胞(如巨噬细胞)时,较低浓度的细胞可能是最佳的。
本文介绍的方法的其他局限性包括至少需要 500 万个 T 细胞和 250 万个单核细胞。我们通常可以从健康参与者的 ~20 mL 血液中获得足够的细胞,但这些数字可能因健康状况、年龄和性别而异26。此外,与大多数评估线粒体容量的方法一样,细胞需要新鲜分离。然而,这种方法将来可以在冷冻保存的细胞中尝试。与人血液的产量相比,健康小鼠脾脏的T细胞产量足够高,可以进行这种测定。
循环 T 细胞,尤其是长寿命记忆 (TM) 和调节 (Treg) 细胞,依靠氧化磷酸化获取能量37。虽然他们的能量需求和氧气消耗量较低(例如,与静息肌肉相比),但他们的生存对于对再感染和癌症的有效免疫反应至关重要 38,39,40。T 细胞氧化磷酸化减少导致增殖能力受损,并促进 T 细胞衰竭和衰老 5,41。此外,线粒体超极化在激活过程中促进效应 CD4 T 细胞持续产生细胞因子(IL-4 和 IL-21)42。感染后,免疫细胞激活和增殖所需的能量可高达基础代谢率的25%-30%43。因此,免疫细胞在广泛而极端的能量需求范围内发挥作用,该协议可以在该范围内测试线粒体反应。
慢性炎症是肥胖、糖尿病和衰老的常见特征。循环激素、脂质和葡萄糖水平失调会产生全身性影响,从而影响线粒体对能量挑战的反应。在这里,我们提出了一种评估循环 PBMC 中线粒体 ADP 敏感性的方法。需要进一步的研究来确定ADP敏感性如何在代谢疾病中被调节,以及它如何影响健康状况。
Disclosures
作者声明没有利益冲突。
Acknowledgements
我们要感谢为这个项目献血的善良志愿者。我们还对Ellen Schur博士和她的团队向我们提供了他们研究的额外样本表示衷心的感谢。我们还要感谢 Andrew Kirsh 审阅了手稿并对其进行了编辑以提高可读性。这项工作得到了以下资金来源的支持:P01AG001751、R01AG078279、P30AR074990、P30DK035816、P30DK017047、R01DK089036、K01HL154761、T32AG066574。
Materials
| Name | Company | Catalog Number | Comments |
| Adenosine Diphosphate | Sigma-Aldrich | A5285 | Fluorespirometry |
| Antimycin A | Sigma-Aldrich | A8674 | Fluorespirometry |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A6003 | Mir05 buffer |
| Bovine Serum Albumin | Sigma-Aldrich | A6003 | Cell isolation |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma-Aldrich | C2920 | Fluorespirometry |
| Cell strainers | Fisher Scientific | 22-363-548 | Isolation of T-cells from mouse spleen protocol |
| CD14 Microbeads, human | Miltenyi Biotec | 130-050-201 | Cell isolation |
| CD3 Microbeads, human | Miltenyi Biotec | 130-050-101 | Cell isolation |
| DatLab | Oroboros | Version 8 | |
| Digitonin | Sigma-Aldrich | D141 | Fluorespirometry |
| D-Sucrose | Sigma-Aldrich | 84097 | Mir05 buffer |
| Ethylene glycol-bis(β-aminoethyl ether)-N,N,N′,N′-tetraacetic acid (EGTA) | Sigma-Aldrich | E4378 | Mir05 buffer |
| Filter Set AmR | Oroboros | 44321-01 | |
| HBSS (10x) | Gibco | 12060-040 | |
| HEPES sodium salt | Sigma-Aldrich | H7523 | Mir05 buffer |
| Histopaque 1077 | Sigma-Aldrich | 10771 | Cell isolation |
| K2EDTA blood collection tubes | BD Vacutainer | 366643 | Cell isolation |
| Lactobionic acid | Sigma-Aldrich | 153516 | Mir05 buffer |
| L-Glutamic acid | Sigma-Aldrich | G1626 | Fluorespirometry |
| L-Malic Acid | Sigma-Aldrich | M1000 | Fluorespirometry |
| LS Columns | Miltenyi Biotec | 130-042-401 | Cell isolation |
| Magnesium Chloride (MgCl2) | Sigma-Aldrich | M9272 | Mir05 buffer |
| Multi-MACS stand and MidiMACS Separator | Miltenyi Biotec | 130-042-301 | Cell isolation |
| O2k-Fluo Smart-Module | Oroboros | 12100-03 | |
| O2k-FluoRespirometer series J | Oroboros | 10201-03 | |
| O2k-sV-Module (0.5 chamber) | Oroboros | 11200-01 | |
| Oligomycin | Sigma-Aldrich | 04876 | Fluorespirometry |
| Pan T Cell Isolation Kit II, mouse | Miltenyi | 130095130 | Isolation of T-cells from mouse spleen protocol |
| Potassium dihydrogen phosphate (KH2PO4) | Sigma-Aldrich | P0662 | Mir05 buffer |
| Potassium Hydroxide (KOH) | Sigma-Aldrich | 221473 | Mir05 buffer |
| Prism | GraphPad | Version 10 | |
| Rotenone | Sigma-Aldrich | R8875 | Fluorespirometry |
| RPMI Buffer | Corning | 17-105-CV | Cell isolation |
| Sodium Pyruvate | Sigma-Aldrich | P2256 | Fluorespirometry |
| Succinate disodium salt | Sigma-Aldrich | S2378 | Fluorespirometry |
| Taurine | Sigma-Aldrich | T0625 | Mir05 buffer |
| Tetramethyrhodamine methyl ester perchlorite | Sigma-Aldrich | T5428 | Fluorespirometry |
References
- Eisner, V., Picard, M., Hajnóczky, G. Mitochondrial dynamics in adaptive and maladaptive cellular stress responses. Nat Cell Biol. 20 (7), 755-765 (2018).
- Sokolova, I. Bioenergetics in environmental adaptation and stress tolerance of aquatic ectotherms: linking physiology and ecology in a multi-stressor landscape. J Exp Biol. 224, 236802 (2021).
- Buttgereit, F., Brand, M. D. A hierarchy of ATP-consuming processes in mammalian cells). Biochem J. 312, 163-167 (1995).
- Schmid, D., Burmester, G. R., Tripmacher, R., Kuhnke, A., Buttgereit, F. Bioenergetics of human peripheral blood mononuclear cell metabolism in quiescent, activated, and glucocorticoid-treated states. Biosci Rep. 20 (4), 289-302 (2000).
- Vardhana, S. A., et al. Impaired mitochondrial oxidative phosphorylation limits the self-renewal of T cells exposed to persistent antigen. Nat Immunol. 21 (9), 1022-1033 (2020).
- Nelson, S. R., Li, A., Beck-Previs, S., Kennedy, G. G., Warshaw, D. M. Imaging ATP consumption in resting skeletal muscle: One molecule at a time. Biophys J. 119 (6), 1050-1055 (2020).
- Meyrat, A., von Ballmoos, C. ATP synthesis at physiological nucleotide concentrations. Sci Rep. 9 (1), 3070 (2019).
- Gouspillou, G., et al. Accurate determination of the oxidative phosphorylation affinity for ADP in isolated mitochondria. PLoS One. 6 (6), e20709 (2011).
- Holloway, G. P., et al. Age-associated impairments in mitochondrial ADP sensitivity contribute to redox stress in senescent human skeletal muscle. Cell Rep. 22 (11), 2837-2848 (2018).
- Pharaoh, G., Brown, J., Ranjit, R., Ungvari, Z., Van Remmen, H. Reduced adenosine diphosphate sensitivity in skeletal muscle mitochondria increases reactive oxygen species production in mouse models of aging and oxidative stress but not denervation. JCSM Rapid Commun. 4 (1), 75-89 (2021).
- Pharaoh, G., et al. The mitochondrially targeted peptide elamipretide (SS-31) improves ADP sensitivity in aged mitochondria by increasing uptake through the adenine nucleotide translocator (ANT). Geroscience. 45 (6), 3529-3548 (2023).
- Brunetta, H. S., Petrick, H. L., Vachon, B., Nunes, E. A., Holloway, G. P. Insulin rapidly increases skeletal muscle mitochondrial ADP sensitivity in the absence of a high lipid environment. Biochem J. 478 (13), 2539-2553 (2021).
- Brunetta, H. S., et al. Nitrate consumption preserves HFD-induced skeletal muscle mitochondrial ADP sensitivity and lysine acetylation: A potential role for SIRT1. Redox Biol. 52, 102307 (2022).
- Tyrrell, D. J., et al. Blood-cell bioenergetics are associated with physical function and inflammation in overweight/obese older adults. Exp Gerontol. 70, 84-91 (2015).
- Liepinsh, E., et al. Low-intensity exercise stimulates bioenergetics and increases fat oxidation in mitochondria of blood mononuclear cells from sedentary adults. Physiol Rep. 8 (12), e14489 (2020).
- Hedges, C. P., et al. Peripheral blood mononuclear cells do not reflect skeletal muscle mitochondrial function or adaptation to high-intensity interval training in healthy young men. J Appl Physiol. 126 (2), 454-461 (2019).
- DeConne, T. M., Muñoz, E. R., Sanjana, F., Hobson, J. C., Martens, C. R. Cardiometabolic risk factors are associated with immune cell mitochondrial respiration in humans. Am J Physiol Heart Circ Physiol. 319 (2), H481-H487 (2020).
- Zhou, B., et al. Boosting NAD level suppresses inflammatory activation of PBMCs in heart failure. J Clin Invest. 130 (11), 6054-6063 (2020).
- Altintas, M. M., DiBartolo, S., Tadros, L., Samelko, B., Wasse, H. Metabolic changes in peripheral blood mononuclear cells isolated from patients with end stage renal disease. Front Endocrinol (Lausanne). 12, 629239 (2021).
- Pence, B. D., Yarbro, J. R. Aging impairs mitochondrial respiratory capacity in classical monocytes). Exp Gerontol. 108, 112-117 (2018).
- vander Windt, G. J. W., Chang, C. H., Pearce, E. L. Measuring bioenergetics in T Cells using a Seahorse extracellular flux analyzer. Curr Protoc Immunol. 113, 11-14 (2016).
- Chacko, B. K., et al. Methods for defining distinct bioenergetic profiles in platelets, lymphocytes, monocytes, and neutrophils, and the oxidative burst from human blood. Lab Invest. 93 (6), 690-700 (2013).
- Buck, M. D., et al. Mitochondrial dynamics controls T Cell fate through metabolic programming. Cell. 166 (1), 63-76 (2016).
- Quinn, K. M., et al. Metabolic characteristics of CD8. Nat Commun. 11 (1), 2857 (2020).
- Scandalis, L., et al. Skeletal muscle mitochondrial respiration and exercise intolerance in patients with heart failure with preserved ejection fraction. JAMA Cardiol. 8 (6), 575-584 (2023).
- Rausser, S., et al. Mitochondrial phenotypes in purified human immune cell subtypes and cell mixtures. Elife. 10, e70899 (2021).
- Kramer, P. A., et al. Bioenergetics and the oxidative burst: protocols for the isolation and evaluation of human leukocytes and platelets. J Vis Exp. (85), e51301 (2014).
- Kramer, P. A., Ravi, S., Chacko, B., Johnson, M. S., Darley-Usmar, V. M. A review of the mitochondrial and glycolytic metabolism in human platelets and leukocytes: implications for their use as bioenergetic biomarkers. Redox Biol. 2, 206-210 (2014).
- Teodoro, J. S., Machado, I. F., Castela, A. C., Rolo, A. P., Palmeira, C. M. The evaluation of mitochondrial membrane potential using fluorescent dyes or a membrane-permeable cation (TPP+) electrode in isolated mitochondria and intact cells. Methods Mol Biol. 2184, 197-213 (2020).
- Hassan, H., Zakaria, F., Makpol, S., Karim, N. A. A link between mitochondrial dysregulation and idiopathic autism spectrum disorder (ASD): Alterations in mitochondrial respiratory capacity and membrane potential. Curr Issues Mol Biol. 43 (3), 2238-2252 (2021).
- Williams, A. S., et al. Disruption of Acetyl-Lysine turnover in muscle mitochondria promotes insulin resistance and redox stress without overt respiratory dysfunction. Cell Metab. 31 (1), 131-147 (2020).
- Krumschnabel, G., Eigentler, A., Fasching, M., Gnaiger, E. Use of safranin for the assessment of mitochondrial membrane potential by high-resolution respirometry and fluorometry. Methods Enzymol. 542, 163-181 (2014).
- Chowdhury, S. R., Djordjevic, J., Albensi, B. C., Fernyhough, P. Simultaneous evaluation of substrate-dependent oxygen consumption rates and mitochondrial membrane potential by TMRM and safranin in cortical mitochondria. Biosci Rep. 36 (1), 00286 (2015).
- Vianello, C., et al. High-throughput microscopy analysis of mitochondrial membrane potential in 2D and 3D models. Cells. 12 (7), (2023).
- Perry, S. W., Norman, J. P., Barbieri, J., Brown, E. B., Gelbard, H. A. Mitochondrial membrane potential probes and the proton gradient: a practical usage guide. Biotechniques. 50 (2), 98-115 (2011).
- JoVE, Science Education Database. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. JoVE. , (2023).
- Geltink, R. I. K., Kyle, R. L., Pearce, E. L. Unraveling the complex interplay between T cell metabolism and function. Annu Rev Immunol. 36, 461-488 (2018).
- Sukumar, M., et al. Inhibiting glycolytic metabolism enhances CD8+ T cell memory and antitumor function. J Clin Invest. 123 (10), 4479-4488 (2013).
- Gerriets, V. A., et al. Foxp3 and Toll-like receptor signaling balance T. Nat Immunol. 17 (12), 1459-1466 (2016).
- MacIver, N. J., Michalek, R. D., Rathmell, J. C. Metabolic regulation of T lymphocytes. Annu Rev Immunol. 31, 259-283 (2013).
- Desdín-Micó, G., et al. T cells with dysfunctional mitochondria induce multimorbidity and premature senescence. Science. 368 (6497), 1371-1376 (2020).
- Yang, R., et al. Mitochondrial Ca2+ and membrane potential, an alternative pathway for Interleukin 6 to regulate CD4 cell effector function. Elife. 4, 06376 (2015).
- Straub, R. H., Cutolo, M., Buttgereit, F., Pongratz, G. Energy regulation and neuroendocrine-immune control in chronic inflammatory diseases. J Intern Med. 267 (6), 543-560 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved