פלואורספירומטריה ברזולוציה גבוהה להערכת שינויים דינמיים בפוטנציאל הממברנה המיטוכונדריאלית בתאי מערכת החיסון האנושית
In This Article
Summary
השיטות לחקר ביו-אנרגטיקה מיטוכונדריאלית תחת ריכוזי מצע רלוונטיים פיזיולוגית בתאי מערכת החיסון מוגבלות. אנו מספקים פרוטוקול מפורט המשתמש בפלואורספירומטריה ברזולוציה גבוהה כדי להעריך שינויים בתגובה של פוטנציאל הממברנה המיטוכונדריאלית לדרישת אנרגיה בתאי T אנושיים, מונוציטים ותאים חד-גרעיניים היקפיים.
Abstract
תאים חד-גרעיניים היקפיים (PBMCs) מציגים שינויים חזקים ביכולת הנשימה המיטוכונדריאלית בתגובה לבריאות ולמחלות. בעוד שינויים אלה לא תמיד משקפים את מה שקורה ברקמות אחרות, כגון שרירי השלד, תאים אלה הם מקור נגיש ובעל ערך של מיטוכונדריה קיימא מנבדקים אנושיים. PBMCs חשופים לאותות מערכתיים המשפיעים על מצבם הביו-אנרגטי. לכן, הרחבת הכלים שלנו לחקר חילוף החומרים במיטוכונדריה באוכלוסייה זו תבהיר מנגנונים הקשורים להתקדמות המחלה. בדיקות תפקודיות של מיטוכונדריה מוגבלות לעתים קרובות לשימוש בתפוקות נשימה בעקבות ריכוזי מצע, מעכב ובלתי מצמד מרביים כדי לקבוע את הטווח המלא של קיבולת הנשימה, שייתכן שלא ניתן להשיג in vivo. ההמרה של אדנוזין דיפוספט (ADP) לאדנוזין טריפוספט (ATP) על ידי ATP-סינתאז גורמת לירידה בפוטנציאל הממברנה המיטוכונדריאלית (mMP) ולעלייה בצריכת החמצן. כדי לספק ניתוח משולב יותר של דינמיקה מיטוכונדריאלית, מאמר זה מתאר את השימוש בפלואורספירומטריה ברזולוציה גבוהה כדי למדוד את התגובה הבו-זמנית של צריכת חמצן ופוטנציאל קרום מיטוכונדריאלי (mMP) לריכוזים רלוונטיים מבחינה פיזיולוגית של ADP. טכניקה זו משתמשת במתילאסטר טטרמתילרודאמין (TMRM) כדי למדוד קיטוב mMP בתגובה לטיטרציות ADP לאחר היפרפולריזציה מקסימלית עם מצעים מורכבים I ו- II. ניתן להשתמש בטכניקה זו כדי לכמת כיצד שינויים במצב הבריאותי, כגון הזדקנות ומחלות מטבוליות, משפיעים על הרגישות של התגובה המיטוכונדריאלית לדרישת האנרגיה ב- PBMCs, תאי T ומונוציטים מנבדקים אנושיים.
Introduction
יכולתו של התא לתפקד ולשרוד בתקופה של לחץ פיזיולוגי תלויה במידה רבה ביכולתו לעמוד בדרישה האנרגטית לשחזור הומאוסטזיס 1,2. הביקוש לאנרגיה עולה בתגובה למגוון גירויים. לדוגמה, כיווץ מוגבר של שרירים במהלך פעילות גופנית מגביר את ניצול ATP וגלוקוז על ידי שרירי השלד, ועלייה בסינתזת חלבונים בעקבות זיהום מגבירה את ניצול ATP על ידי תאי מערכת החיסון לייצור ציטוקינים והתפשטות 3,4,5,6. זינוק בביקוש לאנרגיה מעורר סדרה של תהליכים ביו-אנרגטיים כדי לשחזר את יחס ה-ATP/ADP. כאשר ATP נצרך, רמות ADP עולות ומעוררות F1F0 ATP-סינתאז (קומפלקס V), אשר דורש כוח פרוטומניע כדי להניע את הסיבוב המכני שלו ואת ההמרה הקטליטית של ADP ל- ATP בתוך המיטוכונדריה7. הכוח הפרוטומניע הוא שיפוע אלקטרוכימי שנוצר על ידי שאיבת פרוטונים במהלך העברת אלקטרונים ממצעים לחמצן דרך מערכת הובלת האלקטרונים (ETS) בתוך הממברנה המיטוכונדריאלית הפנימית. ההבדל שנוצר כתוצאה מכך בריכוז הפרוטונים (דלתא pH) ובפוטנציאל החשמלי (פוטנציאל הממברנה) יוצר את הכוח הפרוטומניע המניע סינתזת ATP וצריכת חמצן בתגובה לביקוש לאנרגיה, הפחתת יחס ATP/ADP או העלאת רמות ADP. הזיקה של מיטוכונדריה ל- ADP יכולה להיקבע על ידי חישוב של Km או EC50 של נשימה מעוררת ADP של מיטוכונדריה מבודדים או תאים חדירתיים 8,9. שיטה זו הראתה כי סיבי שריר חדירתיים מבני אדם מבוגרים דורשים ריכוז גבוה יותר של ADP כדי לעורר 50% מיכולת הזרחן החמצוני המקסימלית שלהם מאשר אלה של נבדקים צעירים9. באופן דומה, הזדקנות שרירי השלד של עכבר דורשת יותר ADP כדי להפחית את הייצור של מיני חמצן תגובתי מיטוכונדריאלי (ROS)10,11. בנוסף, רגישות ADP מופחתת בסיבי שריר חדירתיים של עכברים עם השמנת יתר הנגרמת על ידי דיאטה ביחס לבקרות והיא מוגברת בנוכחות אינסולין ולאחר צריכת חנקות12,13. לפיכך, היכולת של מיטוכונדריה להגיב לדרישת אנרגיה משתנה בתנאים פיזיולוגיים שונים, אך זה לא נחקר בעבר בהקשר של תאי מערכת החיסון.
תאי דם חד-גרעיניים היקפיים (PBMCs) משמשים בדרך כלל לחקר ביו-אנרגטיקה תאית בבני אדם 14,15,16,17,18,19,20. זה נובע בעיקר מכך שניתן להשיג תאים בקלות מדגימות דם לא מוסדרות במחקרים קליניים, תגובת התאים להפרעות מטבוליות, והשיטות שפותחו על ידי קבוצות שונות לחקור את חילוף החומרים במיטוכונדריה באמצעות מעכבים ומפרקים כדי לקבוע את היכולת המקסימלית והמינימלית של נשימה מיטוכונדריאלית21,22. שיטות אלה הובילו להערכה של תפקידי הביו-אנרגטיקה בהזדקנות, מחלות מטבוליות ותפקוד מערכת החיסון 14,20,23,24. קיבולת הנשימה המיטוכונדריאלית מופחתת לעתים קרובות בשרירי השלד וב- PBMCs בתנאים של אי ספיקת לב18,25. PBMC bioenergetics מתואמים גם עם גורמי סיכון cardiometabolic במבוגרים בריאים17 והם מגיבים לטיפולים כגון nicotinamide riboside18. PBMCs כוללים נויטרופילים, לימפוציטים (תאי B ותאי T), מונוציטים, תאי הרג טבעיים ותאים דנדריטיים, שכולם תורמים לקיבולת המיטוכונדריה של PBMC 26,27,28. נוסף על כך, ביו-אנרגטיקה תאית ממלאת תפקיד מכריע בהפעלה, שגשוג והתחדשות של תאי מערכת החיסון23. עם זאת, מגבלה של שיטות אלה היא כי התאים אינם מתפקדים תחת טווח פיזיולוגי של מצעים. לכן נדרשות שיטות נוספות כדי לחקור את תפקוד המיטוכונדריה בריכוזי המצע הרלוונטיים יותר למה שתאים חווים in vivo.
פוטנציאל הממברנה המיטוכונדריאלית (mMP) הוא המרכיב העיקרי של כוח פרוטומניע והוא חיוני למגוון תהליכים מיטוכונדריאליים מעבר לייצור ATP, כגון ויסות שטף הנשימה, ייצור מיני חמצן תגובתי, ייבוא חלבונים ויונים, אוטופגיה ואפופטוזיס. ניתן להעריך mMP באמצעות בדיקות אלקטרוכימיות או צבעים פלואורסצנטיים הרגישים לשינויים בקיטוב הממברנות כמו JC-1, Rhod123, DiOC6, טטרמתיל רודאמין (TMRE) או מתיל אסטר (TMRM), וספרנין. שני האחרונים הם צבעים קטיוניים ליפופיליים ששימשו בהצלחה בפלואורספירומטריה ברזולוציה גבוהה של הומוגנאטים ברקמות, מיטוכונדריה מבודדת ורקמות חדירות 11,29,30,31,32,33. בטכניקה זו, TMRM משמש במצב מרווה, שבו תאים נחשפים לריכוז גבוה של TMRM המצטבר במטריצה המיטוכונדריאלית כאשר הוא מקוטב (mMP גבוה וכוח פרוטומניע), וכתוצאה מכך מרווה את הפלואורסצנטיות של TMRM ציטוסולי. כאשר מיטוכונדריה מבצעים דה-פולריזציה בתגובה ל-ADP או ל-uncouplers, הצבע משתחרר מהמטריצה, מה שמגדיל את האות הפלואורסצנטי TMRM34,35. מטרת שיטה זו היא למדוד בו זמנית שינויים בנשימה המיטוכונדריאלית וב-mMP בתגובה לטיטרציות ADP ב-PBMCs שמקורם בבני אדם, מונוציטים במחזור הדם ותאי T, וניתן ליישם אותה גם על תאי T ספלניים של עכברים.
Protocol
איסוף דגימות הדם לפיתוח נתונים ושיטות המוצג כאן אושר על ידי ועדת הביקורת הפנימית של אוניברסיטת וושינגטון. התוצאות המייצגות כוללות גם נתונים מעכברי C57BL/6J זכרים (בני 5-7 חודשים) שנרכשו ממעבדות ג'קסון. כל הליכי בעלי החיים אושרו על ידי המשרד לרווחת בעלי חיים באוניברסיטת וושינגטון. סקירת הפרוטוקול מוצגת באיור 1. הכנת מגיבים לפרוטוקול זה ניתן למצוא בקובץ משלים 1.
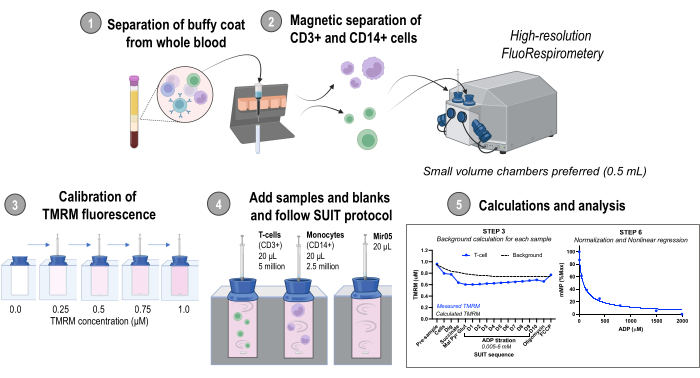
איור 1: סקירה כללית של הפרוטוקול. זרימת עבודה באמצעות פלואורספירומטריה ברזולוציה גבוהה להערכת שינויים בפוטנציאל הממברנה המיטוכונדריאלית במונוציטים מבודדים (CD14+) ובתאי T (CD3+) מדגימות דם אנושיות טריות. קיצורים: TMRM, tetramethylrhodamine methyl ester; חליפה, טיטרציות מעכבות מצע-uncoupler; ADP, אדנוזין דיפוספט; לחפור, digitonin; מל, מלאטה; פיר, פירובט; גלוט, גלוטמט; D1-10, 10 טיטרציות ADP רצופות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
1. הפרדת מעיל באפי מדם שלם
הערה: בידוד התאים שונה מ- Kramer et al.27.
- אפשר לסל"ד, שיפוע צפיפות וצנטריפוגה להגיע לטמפרטורת החדר. יש לעקר את ארון הבטיחות הביולוגית ואת החומרים לפני שמתחילים.
- לאסוף דם ורידי לתוך שלושה 10 מ"ל K2צינורות EDTA. הפוך את הצינורות לפחות 3 פעמים.
- צנטריפוגה את הצינורות ב 500 x גרם 10 דקות (22 ° C, 9 תאוצה [acc], 2 האטה [דצמבר]).
- הסר 1 מ"ל פלזמה מכל צינור ואחסן ב -80 ° C לניתוחים עתידיים.
- מעבירים את הפלזמה וחצי משכבת תאי הדם האדומים מכל צינור לצינור חרוטי יחיד של 50 מ"ל. הוסף סל"ד עד לסימן 40 מ"ל. הפוך לפחות 3 פעמים.
- שכבה איטית של 10 מ"ל של תמיסת הפלזמה לארבעה צינורות חרוטיים של 15 מ"ל המכילים 3 מ"ל של שיפוע הצפיפות.
- צנטריפוגה ב 700 x גרם במשך 30 דקות (22 ° C , 5 acc , 2 dec).
- אספו את כל הפלזמה ואת המעיל האפי המכיל את התאים החד-גרעיניים ההיקפיים (PBMCs) מבלי להפריע לכדוריות הדם האדומות.
- צנטריפוגה ב 500 x גרם במשך 10 דקות (22 ° C, 5 acc, 5 דצמבר) ולשאוף את supernatant.
- שטפו את גלולת PBMC 1x-2x על ידי השעייתה מחדש ב-10 מ"ל סל"ד וצנטריפוגה ב-500 x גרם למשך 10 דקות (22°C, 5 acc, 5 dec).
2. הפרדה מגנטית של תאי CD14+ ו- CD3+
- מקם עמודה בשדה המגנטי של מפריד תאים מגנטי (ראה טבלת חומרים). לשטוף את העמוד עם 3 מ"ל של RP-5.
- השהה מחדש את גלולת PBMC ב- 80 μL של RP-5 ו- 20 μL של מיקרו-כדוריות נגד CD14 (ראה טבלת חומרים). יש לדגור במשך 15 דקות ב-4°C.
- השהה מחדש את התאים עם 1 מ"ל של RP-5 וטען את המתלה על העמודה. אסוף תאים ללא תווית הזורמים לתוך צינור חרוטי של 15 מ"ל המסומן "זרימה דרך 1". המתן עד שכל מתלה התא עבר את העמודה, ולאחר מכן המשך לשטוף עם 3 מ"ל של RP-5 3x, איסוף כל הזרימה דרך.
- בזהירות להסיר את העמוד מן השדה המגנטי ומניחים אותו על צינור חרוטי חדש 15 מ"ל. הוסף 5 מ"ל של RP-5 והשתמש מיד בבוכנה כדי לטהר את תוכן העמודה לתוך צינור איסוף שכותרתו "CD14+".
- צנטריפוגה "זרימה דרך 1" ב 500 x גרם במשך 10 דקות (22 ° C, 5 acc, 5 דצמבר) ולשאוף את supernatant.
- באמצעות תאים מ - Flow-through 1, חזור על שלבים 2.2-2.5 באמצעות מיקרו-כדוריות נגד CD3 (ראה טבלת חומרים) כדי לבודד תאי T.
- צינורות צנטריפוגות המכילות תאי T (CD3+) ומונוציטים (CD14+) ב 300 x גרם למשך 5 דקות. שאפו את הסופרנאטנט והשעו מחדש את הגלולה ב-1 מ"ל של RP-5.
- קבע את ריכוז התא באמצעות המוציטומטר או מונה תאים אוטומטי.
הערה: ניתן לספור תאים על-ידי הוספת 10 μL של דילול תאים של 1:10 או 1:20 להמוציטומטר. ניתן להתייחס לפרוטוקולים שפורסמו בעבר כדי לספור תאים באמצעות המוציטומטר36. - פיפטה 2.5 מיליון מונוציטים או 5 מיליון תאי T לתוך צינור צנטריפוגה חדש. צנטריפוגה במשך 30 שניות ב 2000 x g, לשאוף את supernatant ולהשהות מחדש את התאים ב MiR05 עבור נפח כולל של 20 μL וריכוז סופי של 125 מיליון מונוציטים או 250 מיליון תאי T לכל מ"ל.
הערה: הריכוז הסופי נבחר להזריק 2.5 מיליון מונוציטים או 5 מיליון תאי T בנפח של 20 μL. תאי T של עכבר שבודדו מהטחול נבדקו גם הם בשיטה זו. הנוהל נמצא בקובץ משלים 1.
3. פלואורספירומטריה ברזולוציה גבוהה - כיול פלואורסצנטי חמצן ו-TMRM
הערה: שיטה זו הותאמה מעבודה קודמת שנעשתה על סיבים חדירים על ידי פרעה ואחרים 11. ריכוז גבוה ובלתי מעכב של TMRM משמש למצב מרווה, שבו הקשר בין ריכוז mMP ו-TMRM במטריצה הפוך. לפיכך, ירידה ב- mMP מובילה לשחרור צבע TMRM מהמטריצה ולעלייה בפלואורסצנטיות32.
- התקן תאי 0.5 מ"ל ברספירומטר O2K בהתאם להוראות היצרן (ראה טבלת חומרים). הפעל את המכשיר וחבר אותו לתוכנה שסופקה על ידי היצרן לרכישת נתונים.
- יש לכוונן את הטמפרטורה ל-37°C ולערבב את המהירות ל-750 סל"ד.
- שטפו את התאים במים מזוקקים פי 3. החלף מים ב- 0.54 מ"ל של Mir05, סגור את הפקקים במלואם והסר חיץ עודף באמצעות מערכת היניקה המשולבת (ISS). הרם פקקים כדי לאפשר לחמצן בחדר להתאזן עם חמצן התא באמצעות פקק-ספייסר.
- לאחר ששטף החמצן יציב, בצע את כיול החמצן באוויר (R1) בהתאם להוראות היצרן.
הערה: ייתכן שיחלפו >30 דקות עד ששטף החמצן יתייצב. חיישני חמצן דורשים קביעה של חמצן נקודת אפס (R0) ושטף חמצן רקע בין 50-200 מיקרומטר מניסויים נפרדים המשתמשים בטיטרציות דיתיוניט. שיטות ספציפיות ניתן למצוא במדריך היצרן. - אטמו את החדר על ידי סגירת הפקקים.
הערה: שלא כמו ניסויים המשתמשים בסיבים חדירים, התאים אינם דורשים חמצון יתר עבור PBMCs. איטום התא לאחר כיול R1 מספק מספיק חמצן לניסוי. רמות החמצן צריכות להישמר בין 50-250 מיקרומטר. אם ריכוז החמצן יורד מתחת לסף, ניתן לפתוח את התא באופן חלקי כך שהחמצן בתא יוכל להתאזן עם חמצן באוויר החדר. - כיול TMRM
- השתמש בחיישני הפלאו LED הירוקים (לדוגמה 525 ננומטר) עם ערכת מסנני AmR (ראה טבלת חומרים). הגדר רווח פלואורומטר ל- 1000 ועוצמה ל- 1000. הפעל את חיישני הפלאו והתחל להקליט את קו הבסיס.
- הזריקו 2.5 μL של 0.05 mM TMRM ואפשרו לאות להתייצב (~2 דקות) לפני הזרקת 2.5 μL הבאה עד לביצוע סך של 4 זריקות לריכוז TMRM כולל של 1 μM TMRM בתא. השתמש מזרק המילטון עבור כל הזרקות.
- כייל את חיישן הפלואו-חיישן על-ידי בחירת האות הפלואורסצנטי (מתח) עבור כל הזרקה המייצגת 0, 0.25, 0.5, 0.75 ו-1.0 מיקרומטר של TMRM לכיול של חמש נקודות.
4. פרוטוקול טיטרציה של סובסטרט-uncoupler-inhibitor (SUIT)
הערה: הפעל ניסויים ריקים שבהם 20 μL של Mir05 מוזרק לתוך התא במקום 20 μL של תרחיף התא, מכיוון שאות TMRM ישתנה בתגובה לזריקות בלבד (נדון בתוצאות מייצגות). אפשרו לאות שטף החמצן להתייצב (כ-2-3 דקות) לפני הזריקה הבאה הן לניסויים ריקים והן לניסויים לדוגמה. פרוטוקול הטיטרציה הבא והתצפיות הצפויות מופיעים בטבלה 1.
- לאחר ששטף החמצן יציב, בחר ותייג הן את שטף החמצן והן את אות TMRM כ"קדם-תא".
- הזריקו את תרחיף התא המכיל 5 מיליון תאי T או 2.5 מיליון מונוציטים ב~20 μL ומדדו במשך כ-10 דקות. בחר ותייג הן את שטף החמצן והן את אות TMRM כ"תא".
- לחדור תאים על ידי הזרקת 2 μL של 1 מ"ג / מ"ל digitonin (ריכוז סופי: 4 מיקרוגרם / מ"ל). המתן 20 דקות. בחר ותייג הן את שטף החמצן והן את אות TMRM כ- "Dig".
הערה: מומלץ למטב את ריכוז הדיגיטונין בניסויים נפרדים. - הוסף 2.5 μL של 1 M succinate (ריכוז סופי: 5 mM). בחר ותייג הן את שטף החמצן והן את אות TMRM כ- "SUCC".
- לאחר ששטף החמצן יציב, יש להוסיף 5 μL של 100 mM malate (ריכוז סופי: 1.0 mM), 5 μL של 1 M גלוטמט (ריכוז סופי: 10 mM), ו 5 μL של 500 mM pyruvate (ריכוז סופי: 5 mMM). בחר ותייג הן את שטף החמצן והן את אות TMRM כ- "MPG".
- ברגע שטף החמצן יציב, טיטראט ADP. בחר תעריפים עבור כל טיטרציה ותייג אותם "D" ברצף 1 עד 10, בהתאם למספר הטיטרציות. השתמש בערכת הטיטרציה בטבלה 2.
- ברגע שטף החמצן יציב, בצע סדרה של 1 μL טיטרציות של 0.25 mM קרבוניל ציאניד p-(tri-fluromethoxy) פניל-הידרזון (FCCP) עד שהאות הפלואורסצנטי מגיע למקסימום. בחר ותייג הן את שטף החמצן והן את אות TMRM המייצגים פוטנציאל מינימלי של הממברנה ותייג אותו כ- "FCCP".
הערה: ריכוז FCCP של 0.5-1.0 מיקרומטר נדרש בדרך כלל כדי לרוקן את פוטנציאל הממברנה המיטוכונדריאלית.
זהירות: FCCP רעיל. עיין בגיליון נתוני הבטיחות (SDS) לטיפול נכון. - אופציונלי: ברגע ששטף החמצן יציב, יש להזריק 1 μL של 0.25 mM rotenone כדי לעכב קומפלקס I ולקבוע את יכולת הנשימה באמצעות קומפלקס II.
הערה: שינויים בפוטנציאל הממברנה אינם רלוונטיים עוד לאחר טיטרציה עם uncoupler.
זהירות: רוטנון רעיל. עיין ב-SDS לטיפול נכון. - ברגע ששטף החמצן יציב, יש להזריק 1 μL של 1.25 mM (ריכוז סופי: 2.5 μM) של Antimycin A כדי לעכב נשימה מיטוכונדריאלית.
זהירות: אנטימיצין A הוא רעיל. עיין ב-SDS לטיפול נכון.
5. חישוב פוטנציאל הממברנה המיטוכונדריאלית ואנליזה
- באמצעות ניסויים ריקים, רשום את ערכי TMRM המכוילים (TMRM מיקרומולארי) לפני הזרקת הדגימה הריקה ("קדם-דגימה") ועבור כל אחת מהזריקות. ראו איור 2.
- עבור כל ניסוי ריק, חשב את יחס הרקע על ידי הגדרת ריכוז TMRM "לפני הדגימה" ל- 1.0. חשב את הירידה היחסית הבאה ב- TMRM. חשב את יחס הרקע הממוצע מכל הניסויים הריקים.
הערה: מספר הניסויים הריקים שיש לכלול עשוי להיות תלוי בדיוק המכשיר. ראו את דוגמת החישוב בטבלה 3 מחמישה ניסויים ריקים שונים, שבהם סטיית התקן של יחס הרקע הממוצע הייתה בין 0 ל-0.016 עבור כל טיטרציה. - חישוב רקע: חישוב הרקע עבור כל ניסוי מדגם על ידי הכפלת TMRM "טרום דגימה" של ניסוי הדגימה כפול יחס הרקע הממוצע עבור כל זריקה. ראו את דוגמת החישוב בטבלה 3.
- תיקון רקע: הפחת את רקע הניסוי לערכי TMRM הנמדדים של הדגימה. ראו את דוגמת החישוב בטבלה 4.
- תיקון FCCP: החסר את ה-mMP המתוקן ברקע של FCCP מכל הזרקה. ראו את דוגמת החישוב בטבלה 4.
- עקומת רגישות ADP: נרמל את הירידה המונעת על-ידי ADP ב- mMP על-ידי הגדרת פוטנציאל הממברנה הגבוה ביותר והנמוך ביותר כ- 100% ו- 0%, בהתאמה, באמצעות ערכי mMP שנאספו לאורך הטיטרציה של ADP. התאם את הנתונים למודל רגרסיה לא ליניארית באמצעות התוכנה הסטטיסטית המועדפת כדי לחשב את הריכוז המעכב החצי מקסימלי (IC50) של ADP ב- mMP.
הערה: העקומה מתאימה לתגובה [מעכב] לעומת תגובה מנורמלת - שיפוע משתנה בפריזמה.
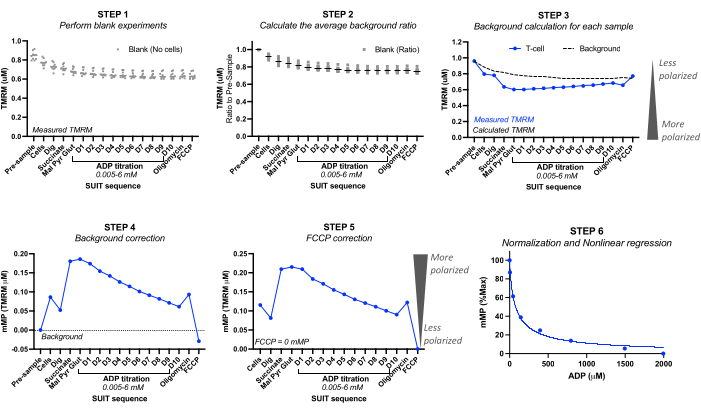
איור 2: חישוב פוטנציאל הממברנה המיטוכונדריאלית (mMP) ורגישות ADP מפלואורסצנטיות TMRM. שלבים לחישוב פוטנציאל הממברנה המיטוכונדריאלית (mMP) ורגישות ADP ממדידות של פלואורסצנטיות TMRM על ידי פלואורספירומטריה ברזולוציה גבוהה של דגימה אחת של תאי T (n = 1). שלב 1: פלואורסצנטיות TMRM נמדדת בדגימות ריקות כפי שנעשה בדגימה הביולוגית. שלב 2: קבע את היחס באות TMRM עם כל טיטרציה ביחס לאות שלפני הדגימה עבור כל ניסוי ריק. חשב את הממוצע עבור כל טיטרציה של כל הניסויים הריקים. שלב 3: חשב את הרקע עבור כל ניסוי מדגם על ידי הכפלת הפלואורסצנטיות "לפני הדגימה" ביחס הרקע הממוצע עבור כל טיטרציה. שלב 4: חשב את ההבדל בין פלואורסצנטיות TMRM ברקע לבין הדגימה עבור כל טיטרציה כדי לבטא נתונים כקליטת mMP או TMRM מיטוכונדריאלי. שלב 5: תקן mMP כך שביטול צימוד מלא עם FCCP ישקף אפס mMP. שלב 6: בצע רגרסיה לא ליניארית לשינויי גרף ב- mMP עם עלייה בריכוזי ADP. המדידות בוצעו בתאים של 0.5 מ"ל, אחד מהם הכיל 5 מיליון תאי T ממתנדב בריא. נתונים ממוצעים מבוטאים כממוצע ± SEM. נקודות נתונים בודדות של משכפל יחיד מבוטאות ללא קווי שגיאה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Representative Results
כדי להמחיש את ההבדלים בריכוז התאים האופטימלי עבור הניסוי, 5 מיליון תאי T הועמסו לתוך תא אחד של 0.5 מ"ל (10 מיליון תאים/מ"ל), ו-1.25 מיליון תאים הועמסו לתוך תא אחר (2.5 מיליון תאים/מ"ל) שהכיל 1 מיקרומטר TMRM (איור 3A-G). שלושה ניסויים ריקים נכללו גם כדי לחשב את רקע TMRM. מצאנו שריכוז גבוה יותר של תאי T הביא לשינוי בולט יותר בפלואורסצנטיות TMRM ביחס לרקע (איור 3B,D). נוסף על כך, ריכוז תאים גבוה יותר אפשר לנו לזהות את העלייה הצפויה בצריכת החמצן ואת הדלדול הסימולטני של mMP בתגובה לתוספת של FCCP (איור 3E,F). שימוש בריכוז נמוך של תאים הניב שינוי חלש בפלואורסצנטיות שמקביל לרקע. מכיוון שחישוב mMP מפחית את הרקע מהאות, ריכוז תאים נמוך אינו מאפשר קביעת שינויים ב- mMP בתגובה למצעים ולמפרקים. בנוסף לשימוש בריכוזים הגבוהים יותר של תאים בניסוי זה, אנו ממליצים לשמור על ריכוז תאים קבוע עבור כל סוג תא בין ניסויים.
כדי לאמת את ההשפעה של ATP-סינתאז בפיזור של mMP עם טיטרציות ADP, ערכנו ניסויים מקבילים על PBMCs ותאי T שבהם תא אחד קיבל אוליגומיצין לפני טיטרציית ADP (איור 4). לא מצאנו פיזור של mMP בתגובה ל-ADP בתאים שטופלו באוליגומיצין, מה שמרמז על כך שהירידה ההדרגתית ב-mMP עם ADP היא תוצאה של שטף פרוטונים דרך ATP-סינתאז (איור 4A-F). השווינו גם את רגישות ADP בין תאי T ו-PBMCs של אותו משתתף, ומצאנו שרגישות ADP נמוכה יותר (EC50 גבוה יותר) במקטע תאי T (איור 4G,H).
ערכנו סדרה של ניסויים ריקים כדי לקבוע את השפעת הזמן או פרוטוקול SUIT על פלואורסצנטיות TMRM. מצאנו שאות TMRM בניסויים ריקים מושפע בעיקר מטיטרציות SUIT (איור 5A), בניגוד לתזמון הטיטרציות (איור 5B).
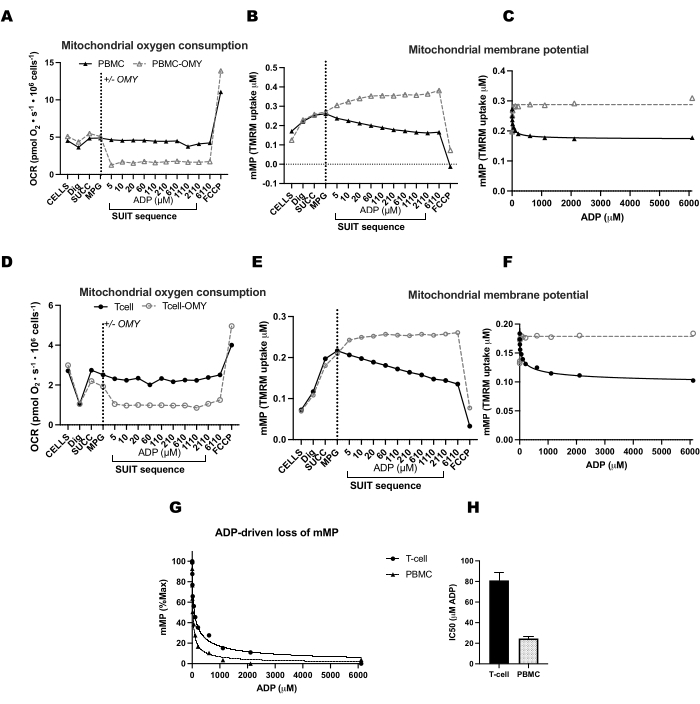
השווינו שינויים המונעים על-ידי ADP בשיעורי צריכת חמצן (OCR) וב-mMP בתאי T ובמונוציטים מ-11 מתנדבים בריאים המתגוררים בקהילה (איור 6A-H). בדומה לתוצאות של ניסויים שפורסמו בעבר באמצעות שטף חוץ-תאי ובדיקות אנזימטיות, מונוציטים הציגו יכולת נשימה מיטוכונדריאלית גדולה יותר מאשר לימפוציטים26,27 (איור 6A,H). אולם לא זיהינו עלייה אופיינית בתגובת מינון ב-OCR עם ADP באף אחד מסוגי התאים (איור 6C,D), בניגוד למה שהשיטה הזו מראה בעת שימוש ברקמות מטבוליות מאוד כמו כבד עכבר (איור 7A-H). מצד שני, השימוש ב-TMRM אפשר לנו לזהות ירידה הדרגתית ב-mMP עם ADP בתאי מערכת החיסון האנושית (איור 6E-G) ובתאי T ספלניים מעכברים (איור 7E-H). בעוד שלא השווינו ישירות בין תאי T אנושיים לתאי T של עכברים באמצעות אותו פרוטוקול טיטרציה, מצאנו כי IC50 של תאי T בעכבר היה נמוך פי 10 בהשוואה לזה של תאי T במחזור מנבדקים אנושיים.
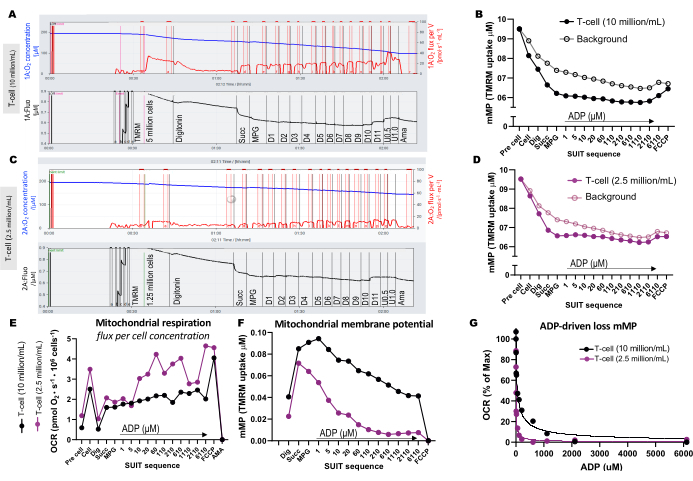
איור 3: ניסויים פלואורספירומטריה ברזולוציה גבוהה. (A-D) עקבות של ניסויים פלואורספירומטריים ברזולוציה גבוהה באמצעות ריכוזי תאי T של 10 מיליון תאים/מ"ל ו-2.5 מיליון תאים/מ"ל בתאים של 0.5 מ"ל. (A) 10 מיליון תאים/מ"ל בתאים של 0.5 מ"ל. (C) 2.5 מיליון תאים/מ"ל בתאים של 0.5 מ"ל. שטף חמצן (pmol/s/mL) מוצג בלוח העליון (אדום), ואות TMRM המכויל מוצג בלוח התחתון (שחור). שינויים ב-TMRM לאורך כל ה-SUIT עבור הדגימה והרקע המחושב שלה שורטטו עבור התאים המכילים (B) 10 מיליון תאים/מ"ל ו-(D) 2.5 מיליון תאים/מ"ל. (E) עבור כל ריכוז תא חושבו שטף חמצן (pmol/s/מיליון תאים) ו-(F) פוטנציאל קרום מיטוכונדריאלי. (G) עקומת רגישות ADP שורטטה והותאמה למודל רגרסיה לא ליניארית (קווים מוצקים). קיצורים: mMP, פוטנציאל קרום מיטוכונדריאלי; TMRM, tetramethylrhodamine מתיל אסטר; חליפה, טיטרציות מעכבות מצע-uncoupler; ADP, אדנוזין דיפוספט; לחפור, digitonin; מל, מלאטה; פיר, פירובט; גלוט, גלוטמט; D1-11, 11 טיטרציות ADP רצופות; U, FCCP uncoupler של 0.5 ו 1.0 מיקרומטר; AMA, antimycin A. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
איור 4: ATP-סינתאז מניע ירידה מונעת ADP בפוטנציאל הממברנה בתאי T ובתאי PBMC. (A-H) הפרוטוקול המתואר כאן נבדק בתאי PBMC ובתאי T. לשני תאי O2K הוזרקו תאי PBMC, ולשני תאים של O2K נוסף הוזרקו תאי T מאותו משתתף. לאחר הזרקת מצעים מלאט, פירובט וגלוטמט בכל החדרים, חדר אחד של PBMCs ותאי T קיבל אוליגומיצין. אוליגומיצין מנע כל עלייה מונעת ADP בנשימה בתאי T (A) PBMCs ו-(D) או ירידה בפוטנציאל הממברנה המיטוכונדריאלית בתאי (B,C) PBMCs ו-(E,F) T. (ז,ח) רגישות ADP הייתה גבוהה יותר בתאי PBMC בהשוואה לתאי T. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
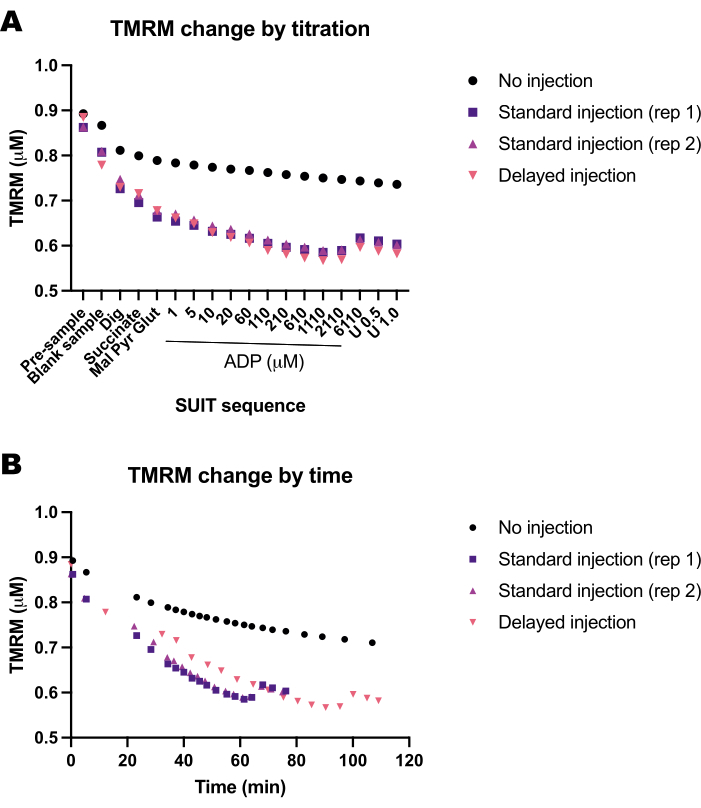
איור 5: ניסויים ריקים מראים את השינוי בפלואורסצנטיות TMRM בתגובה לזמן ולטיטרציות של מצעים, מפרקים ומעכבים (SUIT). (A) שינוי בפלואורסצנטיות TMRM בתגובה לטיטרציה. (B) שינוי בפלואורסצנטיות TMRM בתגובה לזמן. הניסויים נערכו בתאים של 0.5 מ"ל מלאים ב-Mir05 המכילים 1 מיקרומטר TMRM. תא אחד לא קיבל טיטרציות חליפה (ללא הזרקה); שני תאים בשני מכשירים שונים קיבלו פרוטוקול חליפה סטנדרטי (הזרקה סטנדרטית); תא אחד קיבל את אותם טיטרציות SUIT אך עם עיכוב בין כל זריקה (זריקה מאוחרת). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
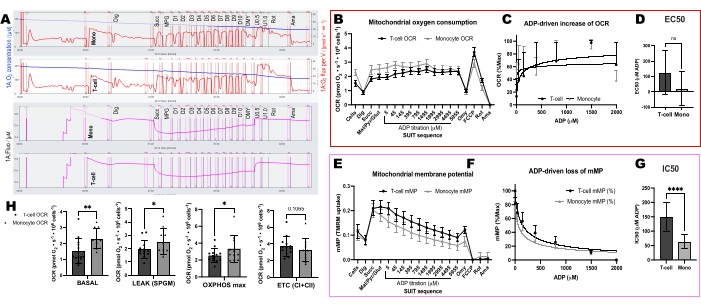
איור 6: הבדלים ברגישות ADP בין תאי T ומונוציטים באמצעות OCR ו-mMP. (A) עקבות של ניסוי פלואורספירומטריה ברזולוציה גבוהה מדגימת מונוציטים ותאי T של נבדק. (B) צריכת חמצן במונוציטים (n=11) ובתאי T (n=13) מדמם של מתנדבים בריאים. (ג,ד) רגרסיה לא ליניארית המתאימה לעלייה המתוכננת בנשימה עם טיטרציות ADP לחישוב EC50. (E) מדידה סימולטנית של פוטנציאל הממברנה המיטוכונדריאלית. (ו,ז) רגרסיה לא ליניארית המתאימה לירידה המתוכננת בפוטנציאל הממברנה המיטוכונדריאלית עם טיטרציות ADP לחישוב IC50. (H) פרמטרים של יכולת נשימה של מונוציטים ותאי T. הנתונים מבוטאים כממוצע ± SEM עבור תרשימים קוויים וממוצע ± SD עבור תרשימי עמודות. הבדלים מובהקים סטטיסטית לאחר מבחני t מבוטאים כ- *p < 0.05. **p < 0.01, ו- ****p < עבור 0.0001. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
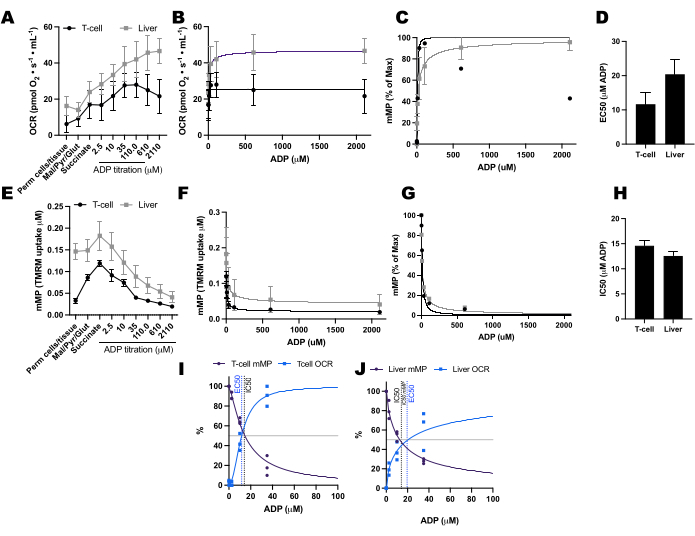
איור 7: השוואת תגובת ADP בנשימה ופוטנציאל הממברנה המיטוכונדריאלית (mMP) בתאי T ובכבד של עכבר חדיר. (A-D) תגובה בנשימה בתאי T ובכבד של עכבר חדיר. (ה-ה) תגובה ב- mMP בתאי T וכבד של עכבר חדירים. כבד וטחול טריים נותחו משלושה עכברים בעקבות פריקת צוואר הרחם. תאי T מסוג Splenic Pan בודדו באמצעות הפרדת חרוזים מגנטית מצומדת נוגדנים. שתי הדגימות עברו את אותו פרוטוקול SUIT בנוכחות 1 μM TMRM. (ט,י) השוואה בין EC50 המחושבת מהעלייה בצריכת החמצן (OCR) לבין IC50 מהירידה ב-mMP בתגובה ל-ADP. N = 3 לכל קבוצה. הנתונים מבוטאים כממוצע ± SEM. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: פרוטוקול SUIT לדוגמה להערכת פוטנציאל הממברנה המיטוכונדריאלית בתאי T ומונוציטים שבודדו זה עתה באמצעות תאי 0.5 מ"ל. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 2: טיטרציה מומלצת של ADP עבור תא של 0.5 מ"ל. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 3: חישוב יחס הרקע הממוצע באמצעות חמישה ניסויים ריקים בלתי תלויים. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 4: חישוב פוטנציאל הממברנה המיטוכונדריאלית (mMP) מניסוי דגימה. אנא לחץ כאן כדי להוריד טבלה זו.
איור משלים 1: השפעת Mir05 ו-DMSO על הנשימה המיטוכונדריאלית ופוטנציאל הממברנה. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 1: הכנת מגיבים ופרוטוקול לבידוד תאי T מטחול עכבר. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
פרוטוקול זה משתמש בפלואורספירומטריה ברזולוציה גבוהה כדי למדוד את רגישות התגובה המיטוכונדריאלית לדרישת אנרגיה על-ידי מדידת הפיזור של mMP בתגובה לרמות הולכות וגדלות של ADP ב-PBMCs, מונוציטים ותאי T. זה נעשה על ידי הוספת מצעים מורכבים I ו- II כדי למקסם את פוטנציאל הממברנה המיטוכונדריאלית וטיטרציה ADP כדי לעורר בהדרגה ATP-סינתאז להשתמש בשיפוע הפרוטון ליצירת ATP.
שלבים קריטיים בפרוטוקול כוללים הגדרת הרווח והעוצמה של הפלואורופור ל-1000 ווידוא רכישת אות פלואורסצנטי TMRM במהלך הטיטרציה של TMRM. מכיוון שהפלואורסצנטיות של TMRM יורדת לאחר כל טיטרציה (מגבלה של שיטה זו), הכרחי להריץ ניסויי רקע באמצעות דגימות ריקות. מצאנו גם של-DMSO יש השפעה מעכבת על הנשימה המיטוכונדריאלית ועל פוטנציאל הממברנה, ולכן אנו ממליצים לדלל את תמיסת העבודה של TMRM ב-Mir05 (איור משלים 1).
כמה שינויים שניתן להשתמש בהם בעת ניסיון פרוטוקול זה הם התאמת ריכוזי התאים ושימוש בתא סטנדרטי של 2 מ"ל. עם זאת, תא 0.5 מ"ל מועדף עבור תאי T ומונוציטים בגלל ריכוז גבוה של תאים הדרושים לתגובה אופטימלית בפוטנציאל הממברנה ובשטף החמצן. ריכוז נמוך יותר של תאים עשוי להיות אופטימלי כאשר בוחנים תאים עם קיבולת נשימה גדולה יותר, כמו מקרופאגים.
מגבלות נוספות של השיטה המוצגות כאן כוללות את הדרישה ללפחות 5 מיליון תאי T ו-2.5 מיליון מונוציטים. לעתים קרובות אנו יכולים להשיג מספיק תאים מ ~ 20 מ"ל של דם ממשתתפים בריאים, אבל מספרים אלה יכולים להשתנות לפי מצב בריאותי, גיל, ומין26. בנוסף, כמו ברוב השיטות להערכת קיבולת המיטוכונדריה, התאים צריכים להיות מבודדים טריים. עם זאת, שיטה זו יכולה להיות נסה בתאים cryopreserved בעתיד. בהשוואה לתשואה מדם אנושי, תפוקת תאי T מטחול של עכברים בריאים גבוהה מספיק כדי לבצע בדיקה זו.
תאי T במחזור, במיוחד תאי זיכרון בעלי תוחלת חיים ארוכה (TM) ותאי בקרה (Treg), מסתמכים על זרחן חמצוני לאנרגיה37. בעוד שצריכת האנרגיה והחמצן שלהם נמוכה (למשל, בהשוואה לזו של שריר במנוחה), הישרדותם חיונית לתגובה חיסונית יעילה להדבקה חוזרת ולסרטן 38,39,40. הפחתה בזרחן החמצוני של תאי T גורמת לפגיעה ביכולת ההתרבות ומקדמת תשישות תאי T והזדקנות 5,41. בנוסף, היפרפולריזציה מיטוכונדריאלית מקדמת ייצור מתמשך של ציטוקינים (IL-4 ו- IL-21) על ידי תאי T CD4 במהלך הפעלה42. בעת זיהום, דרישת האנרגיה להפעלה ושגשוג של תאי מערכת החיסון יכולה להיות גבוהה עד 25%-30% מקצב חילוף החומרים הבסיסי43. לכן, תאי מערכת החיסון מתפקדים בטווח רחב וקיצוני של דרישות אנרגיה, ופרוטוקול זה יכול לבדוק תגובות מיטוכונדריאליות בטווח זה.
דלקת כרונית היא מאפיין נפוץ של השמנת יתר, סוכרת והזדקנות. לרמות לא מווסתות של הורמונים, שומנים וגלוקוז במחזור הדם יש השפעות מערכתיות, ולכן הן יכולות להשפיע על האופן שבו המיטוכונדריה מגיבים לאתגר אנרגטי. במאמר זה הצגנו שיטה להערכת רגישות ל-ADP מיטוכונדריאלי ב-PBMCs במחזור. מחקרים נוספים נדרשים כדי לקבוע כיצד רגישות ADP עשויה להיות מווסתת במחלות מטבוליות וכיצד היא משפיעה על מצב הבריאות.
Disclosures
המחברים מצהירים כי אין ניגודי עניינים.
Acknowledgements
ברצוננו להודות למתנדבים האדיבים שתרמו דם לפרויקט זה. אנו גם מביעים את הערכתנו הכנה לד"ר אלן שור ולצוותה על שסיפקו לנו דגימות נוספות ממחקרם. ברצוננו גם להודות לאנדרו קירש על סקירת כתב היד ועריכתו לקריאות. עבודה זו נתמכה על ידי מקורות המימון הבאים: P01AG001751, R01AG078279, P30AR074990, P30DK035816, P30DK017047, R01DK089036, K01HL154761, T32AG066574.
Materials
| Name | Company | Catalog Number | Comments |
| Adenosine Diphosphate | Sigma-Aldrich | A5285 | Fluorespirometry |
| Antimycin A | Sigma-Aldrich | A8674 | Fluorespirometry |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A6003 | Mir05 buffer |
| Bovine Serum Albumin | Sigma-Aldrich | A6003 | Cell isolation |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma-Aldrich | C2920 | Fluorespirometry |
| Cell strainers | Fisher Scientific | 22-363-548 | Isolation of T-cells from mouse spleen protocol |
| CD14 Microbeads, human | Miltenyi Biotec | 130-050-201 | Cell isolation |
| CD3 Microbeads, human | Miltenyi Biotec | 130-050-101 | Cell isolation |
| DatLab | Oroboros | Version 8 | |
| Digitonin | Sigma-Aldrich | D141 | Fluorespirometry |
| D-Sucrose | Sigma-Aldrich | 84097 | Mir05 buffer |
| Ethylene glycol-bis(β-aminoethyl ether)-N,N,N′,N′-tetraacetic acid (EGTA) | Sigma-Aldrich | E4378 | Mir05 buffer |
| Filter Set AmR | Oroboros | 44321-01 | |
| HBSS (10x) | Gibco | 12060-040 | |
| HEPES sodium salt | Sigma-Aldrich | H7523 | Mir05 buffer |
| Histopaque 1077 | Sigma-Aldrich | 10771 | Cell isolation |
| K2EDTA blood collection tubes | BD Vacutainer | 366643 | Cell isolation |
| Lactobionic acid | Sigma-Aldrich | 153516 | Mir05 buffer |
| L-Glutamic acid | Sigma-Aldrich | G1626 | Fluorespirometry |
| L-Malic Acid | Sigma-Aldrich | M1000 | Fluorespirometry |
| LS Columns | Miltenyi Biotec | 130-042-401 | Cell isolation |
| Magnesium Chloride (MgCl2) | Sigma-Aldrich | M9272 | Mir05 buffer |
| Multi-MACS stand and MidiMACS Separator | Miltenyi Biotec | 130-042-301 | Cell isolation |
| O2k-Fluo Smart-Module | Oroboros | 12100-03 | |
| O2k-FluoRespirometer series J | Oroboros | 10201-03 | |
| O2k-sV-Module (0.5 chamber) | Oroboros | 11200-01 | |
| Oligomycin | Sigma-Aldrich | 04876 | Fluorespirometry |
| Pan T Cell Isolation Kit II, mouse | Miltenyi | 130095130 | Isolation of T-cells from mouse spleen protocol |
| Potassium dihydrogen phosphate (KH2PO4) | Sigma-Aldrich | P0662 | Mir05 buffer |
| Potassium Hydroxide (KOH) | Sigma-Aldrich | 221473 | Mir05 buffer |
| Prism | GraphPad | Version 10 | |
| Rotenone | Sigma-Aldrich | R8875 | Fluorespirometry |
| RPMI Buffer | Corning | 17-105-CV | Cell isolation |
| Sodium Pyruvate | Sigma-Aldrich | P2256 | Fluorespirometry |
| Succinate disodium salt | Sigma-Aldrich | S2378 | Fluorespirometry |
| Taurine | Sigma-Aldrich | T0625 | Mir05 buffer |
| Tetramethyrhodamine methyl ester perchlorite | Sigma-Aldrich | T5428 | Fluorespirometry |
References
- Eisner, V., Picard, M., Hajnóczky, G. Mitochondrial dynamics in adaptive and maladaptive cellular stress responses. Nat Cell Biol. 20 (7), 755-765 (2018).
- Sokolova, I. Bioenergetics in environmental adaptation and stress tolerance of aquatic ectotherms: linking physiology and ecology in a multi-stressor landscape. J Exp Biol. 224, 236802 (2021).
- Buttgereit, F., Brand, M. D. A hierarchy of ATP-consuming processes in mammalian cells). Biochem J. 312, 163-167 (1995).
- Schmid, D., Burmester, G. R., Tripmacher, R., Kuhnke, A., Buttgereit, F. Bioenergetics of human peripheral blood mononuclear cell metabolism in quiescent, activated, and glucocorticoid-treated states. Biosci Rep. 20 (4), 289-302 (2000).
- Vardhana, S. A., et al. Impaired mitochondrial oxidative phosphorylation limits the self-renewal of T cells exposed to persistent antigen. Nat Immunol. 21 (9), 1022-1033 (2020).
- Nelson, S. R., Li, A., Beck-Previs, S., Kennedy, G. G., Warshaw, D. M. Imaging ATP consumption in resting skeletal muscle: One molecule at a time. Biophys J. 119 (6), 1050-1055 (2020).
- Meyrat, A., von Ballmoos, C. ATP synthesis at physiological nucleotide concentrations. Sci Rep. 9 (1), 3070 (2019).
- Gouspillou, G., et al. Accurate determination of the oxidative phosphorylation affinity for ADP in isolated mitochondria. PLoS One. 6 (6), e20709 (2011).
- Holloway, G. P., et al. Age-associated impairments in mitochondrial ADP sensitivity contribute to redox stress in senescent human skeletal muscle. Cell Rep. 22 (11), 2837-2848 (2018).
- Pharaoh, G., Brown, J., Ranjit, R., Ungvari, Z., Van Remmen, H. Reduced adenosine diphosphate sensitivity in skeletal muscle mitochondria increases reactive oxygen species production in mouse models of aging and oxidative stress but not denervation. JCSM Rapid Commun. 4 (1), 75-89 (2021).
- Pharaoh, G., et al. The mitochondrially targeted peptide elamipretide (SS-31) improves ADP sensitivity in aged mitochondria by increasing uptake through the adenine nucleotide translocator (ANT). Geroscience. 45 (6), 3529-3548 (2023).
- Brunetta, H. S., Petrick, H. L., Vachon, B., Nunes, E. A., Holloway, G. P. Insulin rapidly increases skeletal muscle mitochondrial ADP sensitivity in the absence of a high lipid environment. Biochem J. 478 (13), 2539-2553 (2021).
- Brunetta, H. S., et al. Nitrate consumption preserves HFD-induced skeletal muscle mitochondrial ADP sensitivity and lysine acetylation: A potential role for SIRT1. Redox Biol. 52, 102307 (2022).
- Tyrrell, D. J., et al. Blood-cell bioenergetics are associated with physical function and inflammation in overweight/obese older adults. Exp Gerontol. 70, 84-91 (2015).
- Liepinsh, E., et al. Low-intensity exercise stimulates bioenergetics and increases fat oxidation in mitochondria of blood mononuclear cells from sedentary adults. Physiol Rep. 8 (12), e14489 (2020).
- Hedges, C. P., et al. Peripheral blood mononuclear cells do not reflect skeletal muscle mitochondrial function or adaptation to high-intensity interval training in healthy young men. J Appl Physiol. 126 (2), 454-461 (2019).
- DeConne, T. M., Muñoz, E. R., Sanjana, F., Hobson, J. C., Martens, C. R. Cardiometabolic risk factors are associated with immune cell mitochondrial respiration in humans. Am J Physiol Heart Circ Physiol. 319 (2), H481-H487 (2020).
- Zhou, B., et al. Boosting NAD level suppresses inflammatory activation of PBMCs in heart failure. J Clin Invest. 130 (11), 6054-6063 (2020).
- Altintas, M. M., DiBartolo, S., Tadros, L., Samelko, B., Wasse, H. Metabolic changes in peripheral blood mononuclear cells isolated from patients with end stage renal disease. Front Endocrinol (Lausanne). 12, 629239 (2021).
- Pence, B. D., Yarbro, J. R. Aging impairs mitochondrial respiratory capacity in classical monocytes). Exp Gerontol. 108, 112-117 (2018).
- vander Windt, G. J. W., Chang, C. H., Pearce, E. L. Measuring bioenergetics in T Cells using a Seahorse extracellular flux analyzer. Curr Protoc Immunol. 113, 11-14 (2016).
- Chacko, B. K., et al. Methods for defining distinct bioenergetic profiles in platelets, lymphocytes, monocytes, and neutrophils, and the oxidative burst from human blood. Lab Invest. 93 (6), 690-700 (2013).
- Buck, M. D., et al. Mitochondrial dynamics controls T Cell fate through metabolic programming. Cell. 166 (1), 63-76 (2016).
- Quinn, K. M., et al. Metabolic characteristics of CD8. Nat Commun. 11 (1), 2857 (2020).
- Scandalis, L., et al. Skeletal muscle mitochondrial respiration and exercise intolerance in patients with heart failure with preserved ejection fraction. JAMA Cardiol. 8 (6), 575-584 (2023).
- Rausser, S., et al. Mitochondrial phenotypes in purified human immune cell subtypes and cell mixtures. Elife. 10, e70899 (2021).
- Kramer, P. A., et al. Bioenergetics and the oxidative burst: protocols for the isolation and evaluation of human leukocytes and platelets. J Vis Exp. (85), e51301 (2014).
- Kramer, P. A., Ravi, S., Chacko, B., Johnson, M. S., Darley-Usmar, V. M. A review of the mitochondrial and glycolytic metabolism in human platelets and leukocytes: implications for their use as bioenergetic biomarkers. Redox Biol. 2, 206-210 (2014).
- Teodoro, J. S., Machado, I. F., Castela, A. C., Rolo, A. P., Palmeira, C. M. The evaluation of mitochondrial membrane potential using fluorescent dyes or a membrane-permeable cation (TPP+) electrode in isolated mitochondria and intact cells. Methods Mol Biol. 2184, 197-213 (2020).
- Hassan, H., Zakaria, F., Makpol, S., Karim, N. A. A link between mitochondrial dysregulation and idiopathic autism spectrum disorder (ASD): Alterations in mitochondrial respiratory capacity and membrane potential. Curr Issues Mol Biol. 43 (3), 2238-2252 (2021).
- Williams, A. S., et al. Disruption of Acetyl-Lysine turnover in muscle mitochondria promotes insulin resistance and redox stress without overt respiratory dysfunction. Cell Metab. 31 (1), 131-147 (2020).
- Krumschnabel, G., Eigentler, A., Fasching, M., Gnaiger, E. Use of safranin for the assessment of mitochondrial membrane potential by high-resolution respirometry and fluorometry. Methods Enzymol. 542, 163-181 (2014).
- Chowdhury, S. R., Djordjevic, J., Albensi, B. C., Fernyhough, P. Simultaneous evaluation of substrate-dependent oxygen consumption rates and mitochondrial membrane potential by TMRM and safranin in cortical mitochondria. Biosci Rep. 36 (1), 00286 (2015).
- Vianello, C., et al. High-throughput microscopy analysis of mitochondrial membrane potential in 2D and 3D models. Cells. 12 (7), (2023).
- Perry, S. W., Norman, J. P., Barbieri, J., Brown, E. B., Gelbard, H. A. Mitochondrial membrane potential probes and the proton gradient: a practical usage guide. Biotechniques. 50 (2), 98-115 (2011).
- JoVE, Science Education Database. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. JoVE. , (2023).
- Geltink, R. I. K., Kyle, R. L., Pearce, E. L. Unraveling the complex interplay between T cell metabolism and function. Annu Rev Immunol. 36, 461-488 (2018).
- Sukumar, M., et al. Inhibiting glycolytic metabolism enhances CD8+ T cell memory and antitumor function. J Clin Invest. 123 (10), 4479-4488 (2013).
- Gerriets, V. A., et al. Foxp3 and Toll-like receptor signaling balance T. Nat Immunol. 17 (12), 1459-1466 (2016).
- MacIver, N. J., Michalek, R. D., Rathmell, J. C. Metabolic regulation of T lymphocytes. Annu Rev Immunol. 31, 259-283 (2013).
- Desdín-Micó, G., et al. T cells with dysfunctional mitochondria induce multimorbidity and premature senescence. Science. 368 (6497), 1371-1376 (2020).
- Yang, R., et al. Mitochondrial Ca2+ and membrane potential, an alternative pathway for Interleukin 6 to regulate CD4 cell effector function. Elife. 4, 06376 (2015).
- Straub, R. H., Cutolo, M., Buttgereit, F., Pongratz, G. Energy regulation and neuroendocrine-immune control in chronic inflammatory diseases. J Intern Med. 267 (6), 543-560 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved