Робастное обнаружение амплификации генов в образцах, инспирированных формалином, с помощью флуоресцентной гибридизации in situ
In This Article
Summary
Этот протокол представляет собой воспроизводимый метод визуализации амплификации генов в образцах тканей, встроенных в парафин с фиксированным формалином (FFPE).
Abstract
Фокальная амплификация генов, таких как экстрахромосомная ДНК (экДНК), играет важную роль в развитии рака и резистентности к терапии. В то время как методологии, основанные на секвенировании, позволяют объективно идентифицировать экДНК, цитогенетические методы, такие как флуоресцентная гибридизация in situ (FISH), остаются эффективными с точки зрения времени и затрат для идентификации экДНК в клинических образцах. Применение FISH в образцах тканей, залитых формалином и парафином (FFPE), открывает уникальные возможности для обнаружения амплифицированных генов, особенно в тех случаях, когда жизнеспособные образцы недоступны для исследования кариотипа. Тем не менее, существует отсутствие согласованных процедур для этой техники. Этот протокол содержит исчерпывающие, полностью оптимизированные, пошаговые инструкции по проведению FISH для обнаружения амплификации генов, включая экДНК, в образцах тканей FFPE, которые представляют собой уникальные проблемы, которые данный протокол призван преодолеть и стандартизировать. Следуя этому протоколу, исследователи могут воспроизводимо получать высококачественные данные визуализации для оценки амплификации генов.
Introduction
Изучение амплификации фокальных онкогенов имеет решающее значение, поскольку она стимулирует образование, прогрессирование рака и резистентность к терапии1. Важно отметить, что онкогены и иммунорегуляторные гены могут амплифицироваться в виде внехромосомных ДНК (экДНК), асимметричное наследование которых способствует генетической гетерогенности при раке 2,3. экДНК была связана с резистентностью к терапии и неблагоприятными клиническими исходами 4,5,6.
Образцы тканей, интегрированные формалином в парафин (FFPE), представляют собой обширный архивный ресурс в лабораториях патологии, предлагая обильную информацию для ретроспективных исследований. Тем не менее, извлечение молекулярных данных из образцов FFPE с помощью ПЦР или секвенирования является сложной задачей из-за фрагментации, деградации и сшивания нуклеиновых кислот во время фиксации7. Среди множества методов, доступных для молекулярного анализа тканей FFPE, флуоресцентная гибридизация in situ (FISH) доказала свою эффективность для визуализации конкретных последовательностей ДНК8.
Несмотря на развитие современных методов молекулярной диагностики, способность FISH визуализировать и количественно оценивать амплификацию генов на уровне отдельных клеток дает ценную информацию о молекулярных механизмах, лежащих в основе онкогенеза и клинических исходов. Используя флуоресцентно меченые зонды, комплементарные интересующему гену-мишени, FISH может удобно разрешить локализацию онкогена и может сделать вывод о форме амплификации онкогена (например, экДНК) в отдельных клетках, что в противном случае невозможно или дорого при использовании других технологий. Таким образом, FISH предлагает экономичный способ оценки гетерогенности опухоли и клональной эволюции9. Кроме того, достижения в области автоматизации, визуализации и вычислительного анализа облегчили высокопроизводительный анализ данных FISH, что позволило провести надежную количественную оценку амплификации генов в больших тканевых когортах.
Тем не менее, применение FISH к тканям FFPE сопряжено с неотъемлемыми трудностями, включая артефакты поперечного сшивания и фоновую автофлуоресценцию. Преодоление этих препятствий требует тщательной оптимизации каждой процедуры для обеспечения точных и воспроизводимых результатов. В этой статье представлен пошаговый, полностью оптимизированный протокол применения FISH для исследования амплификации генов в образцах тканей FFPE. Используя зонд, нацеленный на локус гена ERBB2 (HER2), мы демонстрируем, что FISH может надежно обнаруживать статус амплификации ERBB2 в образцах FFPE у пациентов с раком молочной железы. Можно даже оценить, амплифицируется ли ERBB2 в виде экДНК. Синтезируя существующую литературу и наши экспериментальные результаты, мы проливаем свет на методологические соображения, технические проблемы и потенциальные подводные камни анализа на основе FISH. Мы также обсуждаем клиническую значимость профилирования амплификации генов при различных типах рака, подчеркивая его прогностическую значимость и потенциал для персонализированных терапевтических стратегий.
Подводя итог, можно сказать, что в этой статье подчеркивается важность FISH как ценного инструмента для изучения амплификации генов в образцах тканей FFPE, предлагающего беспрецедентное понимание биологии опухоли и направляющего для принятия клинических решений в онкологии. Благодаря постоянному совершенствованию и интеграции с комплементарными молекулярными анализами, анализ на основе FISH готов еще больше углубить наше понимание патогенеза рака и улучшить результаты лечения пациентов в эпоху точной медицины.
Protocol
Этот протокол исследования был одобрен Институциональным наблюдательным советом (IRB) Юго-западного медицинского центра Техасского университета. Перед операцией было получено информированное согласие от всех пациентов.
1. Подготовка реагентов и материалов
- Приготовьте 0,2 Н раствор натрия хлорида (HCl) в вытяжном шкафу, медленно добавив 8,212 мл HCl (37% w/w или 12,1 N) к 491,788 мл ddH2O. Хранить при комнатной температуре (RT).
ВНИМАНИЕ: Медленно добавляйте кислоту в воду. Не добавляйте воду в кислоту. - Приготовьте 10 мМ раствор лимонной кислоты (pH 6,0), растворив 1,47 г цитрата тринатрия (дигидрата) в 400 мл ddH2O. Используйте HCl для доведения pH до pH 6,0, а затем доведите окончательный объем до 500 мл с ddH2O. Храните буфер при RT.
- Приготовьте 10% раствор Tween-20, добавив 100 мкл Tween-20 к 900 мкл ddH2O. Храните его при RT.
- Приготовьте 10% раствор IGEPAL, добавив 5 мл IGEPAL CA-630 к 45 мл ddH2O. Храните его при RT.
- Приготовьте 20-кратный раствор SSC (pH 7,0, 3 M NaCl, 0,3 M цитрат натрия), растворив 44,1 г три-натрия цитрата (дигидрата) и 87,65 г хлорида натрия (NaCl) в 900 мл ddH2O. Используйте HCl для регулировки pH до 7,0, а затем доведите окончательный объем до 1000 мл с ddH2O. Храните буфер при RT.
- Приготовьте 2x раствор SSC, добавив 100 мл 20x SSC к 900 мл ddH2O. При необходимости добавьте 0,5 мл консерванта (Таблица материалов). Храните его в RT.
- Приготовьте зондовый буфер для гибридизации, смешав 910 мкл ddH2O, 500 мкл 20x SSC, 50 мкл 10% Tween-20, 40 мкл РНКазы А, 1 мл 50% сульфата декстрана и 2,5 мл формамида. Добавьте аликвоты в 1 мл и храните их при температуре -20 °C.
- Приготовьте 0,4x SSC с 0,3% раствором IGEPAL, смешав 100 мл 2x SSC, 15 мл 10% IGEPAL и 385 мл ddH2O. Храните при RT.
- Приготовьте 2x SSC с 0,1% раствором IGEPAL, добавив 5 мл 10% IGEPAL к 495 мл 2x раствора SSC. Храните его в RT.
- Перед использованием приготовьте буфер для расщепления протеиназы К, добавив 1 мкл протеиназы К к 99 мкл буфера Tris-EDTA.
- Приготовьте запас DAPI объемом 1 мг/мл, растворив 1 мг DAPI в 1 мл ddH2O. Храните при температуре -20 °C в защищенном от света месте. Приготовьте рабочий раствор DAPI, добавив 1 мкл запаса DAPI к 999 мкл 2x раствора SSC. Хранить в незащищенном от света месте до использования.
2. Предварительная обработка образца
ПРИМЕЧАНИЕ: Используемый здесь предметный скольжение содержит образец.
- Состарите предметное стекло при температуре 60-90°C в течение 20 минут или в течение ночи (Рисунок 1).
ПРИМЕЧАНИЕ: Этот этап способствует плавлению парафина. Обычно достаточно 20 минут нагрева. Он может быть продлен до ночи, чтобы уложиться в расписание. - Депарафинизируйте предметное стекло, погрузив его в ксилол или его заменители в банку Coplin на 10 минут. Повторите этот шаг со свежим ксилолом или его заменителями. Выполните все следующие этапы предварительной обработки и промывки в банке Coplin.
ПРИМЕЧАНИЕ: Заменители ксилола являются безопасной и экологически чистой альтернативой ксилолу. Один из заменителей (см. Таблицу материалов) работает так же хорошо, как ксилол, если не лучше. Хотя заменители ксилола издают меньше запаха, чем ксилол, рекомендуется использовать его в вытяжном шкафу. Если заменители ксилола недоступны, все процедуры совместимы с депарафинизацией на основе ксилола без каких-либо изменений. - Смойте заменитель ксилола со 100% этанолом в течение 5 минут.
- Увлажните предметное стекло погружением на 70% этанол на 5 минут.
- Погрузите предметное стекло в 0,2 Н соляной кислоты (HCl) при температуре RT на 20 минут.
HCl эффективно экстрагирует кислоторастворимые белки, такие как основные ядерные белки, для улучшения доступности ДНК к зондам FISH11. - Погрузите предметное стекло в 10 мМ горячего раствора лимонной кислоты и инкубируйте при температуре 90-95 °C в течение 20 минут.
ПРИМЕЧАНИЕ: Обработка лимонной кислотой при высоких температурах аналогичным образом экстрагирует кислоторастворимые белки. Считается, что оба кислотных метода экстрагируют белки внеклеточного матрикса для снижения автофлуоресценции12. Перед нанесением на предметное стекло лимонный раствор рекомендуется предварительно нагреть до нужного температурного диапазона. Микроволновая печь может быть удобным способом сделать это. Водяная баня, например, с варкой су-вид, является наиболее эффективным и экономичным решением для высокотемпературной инкубации. - Кратковременно промойте предметное стекло в 2x SSC, чтобы нейтрализовать pH.
- Переварите ткань, добавив 100-200 мкл (достаточно, чтобы полностью покрыть ткань, в зависимости от размера участка) буфера для переваривания протеиназы К и инкубируйте при RT в течение 1 минуты.
ПРИМЕЧАНИЕ: Расщепление протеиназы К еще больше повышает доступность зондов FISH и снижает аутофлуоресценцию. Время пищеварения должно быть оптимизировано в зависимости от типа тканей. В большинстве случаев достаточно 1 минуты пищеварения. Чрезмерное переваривание приводит к галообразной морфологии ядер, и время переваривания должно быть сокращено. - Немедленно остановите переваривание протеиназы К и обезвожьте предметное стекло, погрузив его в 70% этанол на 2 минуты, а затем обработайте 85% и 100% этанолом в течение 2 минут каждое.
3. FISH и визуализация
- Приготовьте смесь для гибридизации FISH, разбавив 2 мкл зонда FISH с 8 мкл буфера для гибридизации, затем нанесите ее на предметное стекло. Накройте образец покровным стеклоподъемником.
ПРИМЕЧАНИЕ: Общий запас используемого зонда FISH колеблется от 0,5 до 4 мкл, в зависимости от качества изображения. Если сигнал слишком низкий, увеличьте вход щупа. Уменьшите вход FISH-зонда, если фон слишком высок, особенно когда наблюдаются флуоресцентные обломки за пределами ядер. Буфер для гибридизации может быть либо буфером, поставляемым с коммерчески приобретенными зондами, либо изготовленным, как описано в разделе 1. - Поместите предметные стекла на горячую плиту, например, на систему гибридизации со рвом для денатурации ДНК при температуре 75 °C в течение 2-5 минут. Затем перенесите предметное стекло на другую конфорку, установленную при температуре 37 °C, для гибридизации на ночь.
ПРИМЕЧАНИЕ: Если на конфорке есть поддон или резервуар для воды для поддержания влажности во время гибридизации, нет необходимости герметизировать покровное стекло резиновым цементом. - После гибридизации опустите предметное стекло в температуру 40-60 °C с подогревом 0,4x SSC с 0,3% промывочным буфером IGEPAL CA-630, затем осторожно снимите покровное стекло. Продолжить стирку дважды по 5 мин каждый в темноте, с перемешиванием в течение первых 10-15 с.
ПРИМЕЧАНИЕ: Погружение предметного стекла в буфер для стирки помогает аккуратно освободить покровное стекло. - Затвор промыть в SSC с 0,1% IGEPAL CA-630 в течение 5 мин при RT в темноте, с перемешиванием в течение первых 10-15 с.
- Чтобы погасить автофлуоресценцию, обработайте предметное стекло с помощью набора для гашения автофлуоресценции (см. Таблицу материалов), нанеся 150 μL реагента (50 μL + 50 μL + 50 μL реагентов A, B, C) в течение 2-5 минут, затем промойте его 2x SSC в течение 5 минут.
ПРИМЕЧАНИЕ: Это необязательный шаг. Тканевая аутофлуоресценция в первую очередь происходит из компонентов внеклеточного матрикса, таких как коллаген и эластин. На него также значительное влияние оказывают лизосомы и митохондрии из-за содержания в них липофусцина, NADPH и флавина. Фиксация альдегида и присутствие клеток крови также могут хорошо увеличивать аутофлуоресценцию13,14. - Закрасьте предметное стекло DAPI на 10 минут. Промойте предметное стекло 2x буфером SSC в течение 5 минут.
ПРИМЕЧАНИЕ: Если предметное стекло не обработано набором для гашения автофлуоресценции, окрашивание DAPI можно уменьшить до 2 минут. - Быстро опустите горку в деионизированную воду не более чем на 1 с, затем быстро высушите ее, впитав лишнюю влагу бумажным полотенцем.
ПРИМЕЧАНИЕ: Это необязательный шаг. Очистка деионизированной воды эффективно предотвращает отложение кристаллов соли буфера SSC на предметном стекле и улучшает качество изображения. Однако в условиях такого низкого содержания ионов водородные связи между зондом FISH и целевой ДНК ослабевают, что приводит к диссоциации зонда и потере сигнала. Поэтому поддержание этапа очистки воды в течение очень короткого времени имеет решающее значение. - Высушите затвор, затем закрепите его с помощью монтажного материала, препятствующего выцветанию. Перед съемкой заклейте покровное стекло лаком для ногтей.
ПРИМЕЧАНИЕ: Если предметное стекло обработано реагентом для гашения автофлуоресценции, установите предметное стекло с помощью монтажного материала, препятствующего выцветанию, в соответствии с инструкцией производителя. Кроме того, в зависимости от типа монтажной среды, закалочной или неупрочняющей, образец должен быть отвержден в течение 1-24 часов перед герметизацией и нанесением изображений. Рекомендуется отверждать образец по крайней мере в течение ночи для достижения наилучшего показателя преломления для визуализации. - Используйте масляную линзу 60× для захвата флуоресцентного сигнала. Используйте канал DAPI для регулировки фокусировки. Убедитесь, что получено несколько Z-стеков. Как правило, достаточно 5-10 z-стеков с интервалом в 1 мкм. Выполняйте максимальную 3D-проекцию для достижения наилучшего разрешения. Применяйте деконволюцию или другие алгоритмы очистки фона для дальнейшего улучшения качества изображения.
Representative Results
Мы использовали образцы FFPE как от HER2-положительного, так и от отрицательного рака молочной железы, чтобы продемонстрировать результат визуализации FISH. Амплификация HER2 (кодируется геном ERBB2 ) является благоприятным маркером из-за доступности и эффективности молекулярной таргетной терапии HER2. Напротив, пациенты с трижды негативным раком молочной железы, у которых отсутствует экспрессия HER2, рецептора эстрогена (ER) и рецептора прогестерона (PR), сталкиваются с плохими исходами из-за ограниченных терапевтических возможностей. Таким образом, определение статуса HER2 имеет решающее значение в исследованиях и лечении рака молочной железы15.
В образце трижды негативного рака молочной железы большинство ядер отображают две отдельные точки, представляющие сигналы HER2/ERBB2 FISH. Некоторые ядра могут иметь только одну точку из-за смещения секционирования (рис. 2, слева). Напротив, HER2-положительные образцы представляют обильные сигналы FISH с двумя различными паттернами. На одном рисунке видны разбросанные точки по всему ядру (рис. 2, посередине). Этот паттерн является характерной чертой морфологии экДНК, поскольку экДНК не могут занимать уникальную и организованную ядерную территорию16. Кроме того, асимметричная сегрегация экДНК во время митоза приводит к изменению числа копий, что приводит к гетерогенности сигналов среди ядер17. Некоторые ядра могут иметь случайные кластеры, указывающие на концентраторы экДНК18 (рисунок 2, справа). Другой тип амплификации HER2 в основном представляет собой стержневые, конденсированные агрегаты. Эта морфология, вероятно, указывает на амплификацию на основе хромосом, такую как гомогенное окрашивание областей (HSR)19 или через цикл breakage-fusion-bridge (BFB)20. Примечательно, что экДНК, HSR и амплификация BFB могут сосуществовать в одном ядре. Поэтому рекомендуется исследовать множественные ядра, чтобы сделать вывод о форме фокальной амплификации.
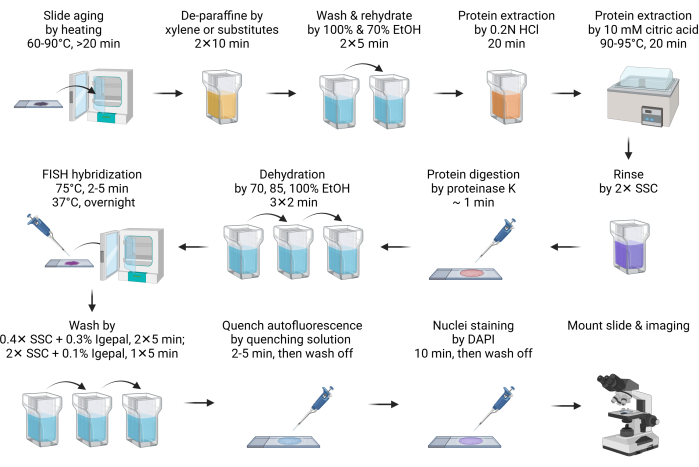
Рисунок 1: Схема FISH в образцах FFPE. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
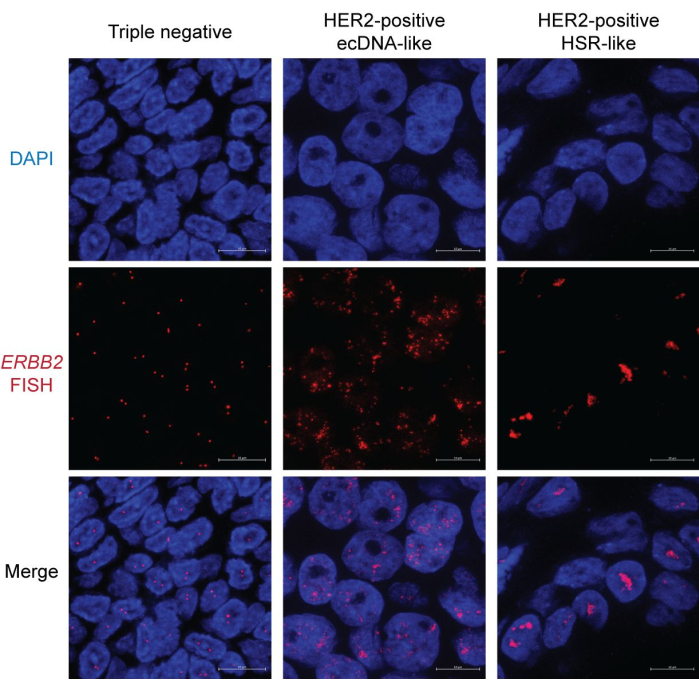
Рисунок 2: Репрезентативное изображение FISH в образцах FFPE рака молочной железы. Увеличение: 600x; Масштабная линейка: 10 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Discussion
FISH – это быстрый и доступный вариант цитогенетической диагностики. Особенно при определении того, присутствует ли экДНК при раке, доказательства FISH остаются золотымстандартом. FISH в тканях FFPE позволяет быстро определить статус гена в образцах биопсии пациента, что позволяет быстрее диагностировать и отслеживать изменения на протяжении всего течения заболевания. Эта методика особенно ценна для тестирования клинических образцов, которые уже были собраны на патологию.
Этот протокол включает в себя несколько важных этапов. Первым этапом является тщательная депарафинизация. Остаточный парафин может нарушить гибридизацию FISH. Если после этапа 2 образец по-прежнему выглядит восковым, его следует снова обработать свежим ксилолом или его заменителями.
Во-вторых, извлечение и переваривание белка имеют решающее значение. Эти процессы не только повышают доступность ДНК к FISH-зонду, но и значительно снижают автофлуоресценцию. Этот протокол включает в себя три этапа депротеинизации. В то время как лечение 0,2 N HCl и 10 мМ лимонной кислотой является простым, расщепление протеиназы К может потребовать оптимизации. Переваривание является наиболее распространенной ошибкой при использовании протеинады К, приводящей к образованию галообразных ядер. Сокращение времени переваривания улучшит морфологию ядер. Кроме того, рекомендуется не переваривать более четырех образцов одновременно, чтобы свести к минимуму разницу во времени между первым и последним образцом. Важно отметить, что даже неповрежденное ядро может выглядеть как ореол при большом увеличении и микроскопии с высоким разрешением. Это связано с тем, что ядро не находится в одной фокальной плоскости. Поэтому предлагается взять несколько Z-стеков и выполнить максимальную проекцию для изучения морфологии ядра.
Наконец, рекомендуется гашение автофлуоресценции. Несмотря на то, что экстракция кислотой и расщепление протеиназы К могут значительно снизить фон белка, флуоресцентные метаболиты все же могут влиять на качество визуализации.
Несмотря на то, что FISH предлагает беспрецедентное пространственное разрешение для идентификации фокальной амплификации генов, у него есть ограничения. Во-первых, содержание и производительность являются низкими по сравнению с подходами, основанными на ПЦР или секвенировании нового поколения (NGS). Как правило, от одного до трех FISH-зондов разных цветов могут быть нанесены на одно предметное стекло без специального оборудования. Тем не менее, достижения в области технологий автоматизации сделали возможным использование FISH с высоким содержанием и высокой пропускной способностью, например, секвенирование in situ 21. Во-вторых, конструкция FISH-зонда требует предварительной информации. Продолжающиеся усилия по выявлению повторяющихся событий фокальной амплификации при раке позволили создать предварительно разработанные панели FISH для лабораторного и клинического применения. Например, онкогены семейства MYC часто амплифицируются в виде экДНК при мелкоклеточном раке легкого для опосредования резистентности к химиотерапии. Таким образом, панель FISH, нацеленная на гены MYC, MYCL и MYCN, может ускорить определение ответов на лечение в биопсии. Для сравнения, NGS позволяет проводить более объективный скрининг генов, представляющих интерес. Однако среди технологий, основанных на NGS, только полногеномное секвенирование с ресурсоемким анализом22 может охарактеризовать экДНК.
Таким образом, мы представляем надежные и исчерпывающие инструкции по исследованию фокальной амплификации генов в образцах FFPE. Изучая паттерн сигнала FISH, становится однозначно ясно, усиливается ли локус гена и каким образом. Мы ожидаем интеграции машинного обучения в анализ изображений23 интерфазных ядер для извлечения цитогенетической информации о количестве копий и форме амплификации (хромосоме или экДНК), тем самым оптимизируя процесс молекулярной диагностики и улучшая наше понимание патогенетических механизмов при раке.
Disclosures
С.В. является членом научно-консультативного совета компании Dimension Genomics Inc.
Acknowledgements
С.В. является научным сотрудником и получает поддержку Техасского института профилактики и исследований рака (RR210034)
Materials
| Name | Company | Catalog Number | Comments |
| DAPI | Tocris Bioscience | 5748 | Nucleus staining |
| Dextran sulfate 50% solution | EMD Millipore Sigma | S4030 | Probe hybridization buffer |
| ERBB2 (HER2) FISH Probe | Empire Genomics | ERBB2-20-RE | FISH probe |
| Ethanol | Decon Labs | 2716 | Dehydrating and hydrating tissue |
| Formamide | Thermo Scientific Chemicals | 205821000 | Probe hybridization buffer |
| Formula 83 (Xylene substitute) | CBG Biotech | CH0104A | Removing paraffin |
| Hydrochloric acid | Fisher Chemical | A144-500 | Sample pretreatment |
| IGEPAL CA-630 | Thermo Scientific Chemicals | J19628K2 | Slide washing |
| Proclin 300 | Sigma-Aldrich | 48914-U | Preservative for SSC buffer (optional) |
| Proteinase K (800 units/mL) | New England Biolabs | P8107S | Protein digestion |
| RNase A (20 mg/mL) | New England Biolabs | T3018L | Probe hybridization buffer |
| Slide Moat Hybridization System | Boekel Scientific | 280001 | Sample denature and hybridization. Alternative hot plates are acceptable. |
| Sodium chloride | Fisher Chemical | S2713 | SSC buffer |
| Sodium citrate dihydrate | Fisher BioReagents | FLBP3271 | SSC buffer and sample pretreatment |
| Tris-EDTA (TE) buffer | Fisher BioReagents | BP2473500 | Proteinase K digestion buffer |
| Tween-20 | Fisher BioReagents | BP337-500 | Probe hybridization buffer |
| Vectashield antifade mounting media | Vector Laboratories | H190010 | Slide mounting |
| Vector TrueVIEW | Vector Laboratories | SP8400 | Autofluorescence quenching kit |
References
- ICGC/TCGA Pan-Cancer Analysis of Whole Genomes Consortium. Pan-cancer analysis of whole genomes. Nature. 578 (7793), 82-93 (2020).
- Wu, S., Bafna, V., Chang, H. Y., Mischel, P. S. Extrachromosomal DNA: An emerging hallmark in human cancer. Annu Rev Pathol. 17, 367-386 (2022).
- Luebeck, J., et al. Extrachromosomal DNA in the cancerous transformation of Barrett's oesophagus. Nature. 616 (7958), 798-805 (2023).
- Nathanson, D. A., et al. Targeted therapy resistance mediated by dynamic regulation of extrachromosomal mutant EGFR DNA. Science. 343 (6166), 72-76 (2014).
- Kim, H., et al. Extrachromosomal DNA is associated with oncogene amplification and poor outcome across multiple cancers. Nat Genet. 52 (9), 891-897 (2020).
- Pal Choudhuri, S., et al. Acquired cross-resistance in small cell lung cancer due to extrachromosomal DNA amplification of MYC paralogs. Cancer Discov. 14 (5), 804-827 (2024).
- Greytak, S. R., Engel, K. B., Bass, B. P., Moore, H. M. Accuracy of molecular data generated with FFPE biospecimens: Lessons from the literature. Cancer Res. 75 (8), 1541-1547 (2015).
- Chrzanowska, N. M., Kowalewski, J., Lewandowska, M. A. Use of fluorescence in situ hybridization (FISH) in diagnosis and tailored therapies in solid tumors. Molecules. 25 (8), 1864 (2020).
- Cui, C., Shu, W., Li, P. Fluorescence in situ hybridization: Cell-based genetic diagnostic and research applications. Front Cell Dev Biol. 4, 89 (2016).
- Finn, E. H., Misteli, T. A high-throughput DNA FISH protocol to visualize genome regions in human cells. STAR Protoc. 2 (3), 100741 (2021).
- Watters, A. D., Bartlett, J. M. S. Fluorescence in situ hybridization in paraffin tissue sections. Mol Biotechnol. 21 (3), 217-220 (2002).
- Richardson, S. O., et al. One-fits-all pretreatment protocol facilitating fluorescence in situ hybridization on formalin-fixed paraffin-embedded, fresh frozen and cytological slides. Mol Cytogenet. 12, 27 (2019).
- Monici, M. Cell and tissue autofluorescence research and diagnostic applications. Biotechnol Annu Rev. 11, 227-256 (2005).
- Davis, A. S., et al. Characterizing and diminishing autofluorescence in formalin-fixed paraffin-embedded human respiratory tissue. J Histochem Cytochem. 62 (6), 405-423 (2014).
- Cancer Genome Atlas Network. Comprehensive molecular portraits of human breast tumours. Nature. 490 (7418), 61-70 (2012).
- Liang, Z., et al. Chromatin-associated RNA dictates the ecDNA interactome in the nucleus. bioRxiv. , (2023).
- Lange, J. T., et al. The evolutionary dynamics of extrachromosomal DNA in human cancers. Nat Genet. 54 (10), 1527-1533 (2022).
- Hung, K. L., et al. ecDNA hubs drive cooperative intermolecular oncogene expression. Nature. 600 (7890), 731-736 (2021).
- Storlazzi, C. T., et al. Gene amplification as double minutes or homogeneously staining regions in solid tumors: origin and structure. Genome Res. 20 (9), 1198-1206 (2010).
- Guerin, T. M., Marcand, S. Breakage in breakage-fusion-bridge cycle: an 80-year-old mystery. Trends Genet. 38 (7), 641-645 (2022).
- Nguyen, H. Q., et al. 3D mapping and accelerated super-resolution imaging of the human genome using in situ sequencing. Nat Methods. 17 (8), 822-832 (2020).
- Deshpande, V., et al. Exploring the landscape of focal amplifications in cancer using AmpliconArchitect. Nat Commun. 10 (1), 392 (2019).
- Rajkumar, U., et al. EcSeg: Semantic segmentation of metaphase images containing extrachromosomal DNA. iScience. 21, 428-435 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved