Progressi nella tecnologia degli organoidi bovini utilizzando interfacce monostrato per l'intestino tenue e crasso
In This Article
Summary
Questo studio presenta un protocollo per la generazione di monostrati 2D intestinali bovini da organoidi, offrendo un migliore accesso per lo studio delle interazioni ospite-patogeno. Include metodi per valutare l'integrità e la funzionalità della membrana, avanzando modelli in vitro che imitano la fisiologia gastrointestinale del bestiame. Questo approccio promette significativi benefici biomedici e agricoli, tra cui strategie di trattamento avanzate.
Abstract
L'avanzamento delle conoscenze sulla fisiologia gastrointestinale e sulle sue malattie dipende in modo critico dallo sviluppo di modelli in vitro precisi e specie-specifici che imitino fedelmente i tessuti intestinali in vivo . Ciò è particolarmente importante per lo studio delle interazioni ospite-patogeno nei bovini, che sono serbatoi significativi di agenti patogeni che comportano gravi rischi per la salute pubblica. Gli organoidi 3D tradizionali offrono un accesso limitato alla superficie apicale dell'epitelio intestinale, un ostacolo superato dall'avvento delle colture monostrato 2D. Queste colture, derivate da cellule organoidi, forniscono una superficie luminale esposta per uno studio più accessibile. In questa ricerca, viene introdotto un protocollo dettagliato per la creazione e il mantenimento di colture monostrato 2D da cellule di organoidi bovini dell'intestino tenue e crasso. Questo metodo include protocolli per valutare l'integrità della membrana attraverso la resistenza elettrica transepiteliale e la permeabilità paracellulare insieme a tecniche di colorazione immunocitochimica. Questi protocolli gettano le basi per la creazione e la caratterizzazione di un sistema di coltura monostrato bovina 2D, spingendo i confini di queste applicazioni metodologiche nella ricerca biomedica e traslazionale di importanza per la salute pubblica. L'impiego di questo approccio innovativo consente lo sviluppo di modelli in vitro fisiologicamente pertinenti per esplorare sia gli stati normali che quelli malati della fisiologia intestinale dei bovini. Le implicazioni per i progressi biomedici e agricoli sono profonde e aprono la strada a trattamenti più efficaci per i disturbi intestinali dei bovini, migliorando così sia il benessere degli animali che la sicurezza alimentare.
Introduction
La coltura di cellule staminali epiteliali intestinali in colture tridimensionali (3D), note come organoidi intestinali, segna un progresso significativo nella tecnologia in vitro per lo studio delle funzioni intestinali, della nutrizione e delle interazioni con i patogeni 1,2. Questi organoidi imitano la complessa struttura dell'epitelio intestinale in vivo autoreplicandosi e organizzandosi in formazioni 3D che comprendono varie linee cellulari intestinali3. Questa caratteristica evidenzia il loro notevole potenziale per far progredire la comprensione della biologia intestinale.
Il crescente interesse per l'applicazione della tecnologia degli organoidi intestinali agli animali da allevamento richiede il perfezionamento delle tecniche di coltura e mantenimento 4,5. L'importanza di questa tecnologia è sottolineata dal suo potenziale impatto sullo studio della salute intestinale degli animali da allevamento, che svolge un ruolo critico nella loro produttività e, di conseguenza, nell'economia dell'industria alimentare-animale, influenzando il benessere degli animali e i costi operativi 6,7. In particolare, l'impiego di colture di organoidi intestinali per esplorare la funzione intestinale dei bovini è di fondamentale importanza, dato il loro ruolo come serbatoi per patogeni enterici zoonotici, come Salmonella spp. ed Escherichia coli (E. coli) O157:H78. Questi patogeni sono localizzati in particolari segmenti dell'intestino, il che rende essenziale differenziare i metodi di coltura degli organoidi intestinali per segmento intestinale per migliorare la precisione negli studi9.
Un ostacolo significativo nello studio degli organoidi intestinali è l'accesso limitato alla superficie apicale della cellula epiteliale10. Quando vengono coltivate all'interno di una matrice extracellulare (ECM), le cellule si orientano naturalmente in modo che la superficie basale sia rivolta verso l'esterno e la superficie apicale sia diretta verso l'interno10. Per affrontare questa sfida, vengono presentati metodi che prevedono la dissociazione di organoidi 3D in singole cellule e la loro semina in inserti di coltura cellulare semipermeabili. Questa configurazione stabilisce un'interfaccia tra la superficie apicale e un compartimento basolaterale. Questo protocollo dimostra che le cellule derivate da organoidi intestinali bovini possono formare un monostrato 2D coerente, come evidenziato dalle misurazioni della resistenza elettrica transepiteliale (TEER) e dai saggi di permeabilità paracellulare. Inoltre, lo sviluppo della polarità cellulare con bordi a spazzola e giunzioni strette nelle cellule monostrato 2D derivate da organoidi è confermato attraverso l'immunofluorescenza e la microscopia elettronica, riflettendo le proprietà dell'epitelio intestinale in vivo .
In questo studio, l'ileo rappresenta il tratto intestinale tenue e il retto indica il tratto intestinale crasso. Queste selezioni si basano su patogeni enterici rilevanti come Salmonella spp., che può traslocare l'ileo11, ed E. coli O157:H7 noto per colonizzare principalmente il retto9 nei bovini. La selezione di questi specifici segmenti intestinali evidenzia la necessità di adattare i metodi di coltura degli organoidi intestinali alla regione intestinale per garantire la precisione nella ricerca. Questi metodi descrivono in dettaglio la procedura per coltivare efficacemente un'interfaccia monostrato 2D derivata da organoidi da questi segmenti intestinali, fornendo un modello robusto per esplorare la salute dell'intestino del bestiame, le infezioni da agenti patogeni e le interazioni tra il microbioma intestinale e l'ospite.
Protocol
Le cripte intestinali sono state ottenute da campioni intestinali in eccesso provenienti da un macello locale e la segnalazione dei donatori è fornita nella Tabella supplementare 1. Gli organoidi sono stati generati utilizzando tessuti derivati da animali che sono stati sottoposti a eutanasia umana in un macello e gli animali non sono stati acquistati esclusivamente per questa ricerca; pertanto, questo studio è esente dalla revisione IACUC e una dichiarazione etica non è applicabile.
1. Rivestimento ECM su inserti per colture cellulari per colture monostrato 2D derivate da organoidi
NOTA: Tutte le procedure vengono eseguite utilizzando materiali sterilizzati e tecniche asettiche in una cappa di biosicurezza. Tutti i reagenti vengono mantenuti in ghiaccio durante la procedura, salvo diversa indicazione.
- Preparare 100 μl di ECM per il rivestimento di ogni inserto di coltura cellulare da 0,33 cm2 mescolando accuratamente il terreno basale con idrogel a base di ECM al 2% (v/v) in una microprovetta.
- Rimuovere l'inserto per colture cellulari individuali dalla confezione con una pinza sterilizzata e posizionarlo singolarmente nei pozzetti di una piastra per colture cellulari a fondo piatto trasparente a 24 pozzetti.
- Applicare 100 μl di rivestimento ECM preparato nella fase 1.1 nella camera apicale di ciascun inserto di coltura cellulare preparato nella fase 1.2.
- Riposizionare il coperchio e incubare la piastra per colture cellulari contenente gli inserti per colture cellulari rivestiti in un incubatore umidificato a 37 °C e 5% di CO2 per 1 ora.
- Per le cellule organoidi ileali, l'inserto è pronto per l'uso dopo 1 ora di incubazione. Per le cellule organoidi rettali, dopo 1 ora di incubazione, sostituire il rivestimento ECM con un terreno di coltura rettale monostrato e incubare per una notte (Tabella 1). Preparare inserti di coltura cellulare aggiuntivi per i controlli in bianco, se si intende eseguire misure TEER.
| Ileo | Retto | |
| Tempo di incubazione del rivestimento ECM | 1 ora | 1 ora seguita da Pernottamento in terreni di coltura monostrato |
| Integrazioni a terreno di coltura per organoidi | ||
| CHIR99021 | ||
| LY2157299 | LY2157299 | |
| Y-27632 | Y-27632 | |
| Siero fetale bovino | Siero fetale bovino | |
| Densità di semina cellulare (cellule/pozzetto) | 5 x 105 | 3 x 105 |
Tabella 1: Sintesi del protocollo ottimizzato per la creazione di monostrati 2D derivati da organoidi ileali e rettali bovini adulti.
2. Semina di cellule organoidi bovine ileali e/o rettali e coltura 2D monostrato
NOTA: Il protocollo descritto in questa sezione utilizza organoidi ileali e rettali bovini, che sono stati coltivati e mantenuti su piastre a 48 pozzetti utilizzando le tecniche descritte5. Per ottenere risultati ottimali, si consiglia di utilizzare organoidi mantenuti in modo stabile che siano stati fatti passare più di 3 volte dopo l'insediamento iniziale e che siano stati coltivati per più di 3 giorni dopo il passaggio più recente.
- Senza disturbare la cupola di idrogel basata su ECM contenente organoidi maturi, rimuovere i terreni di coltura degli organoidi utilizzando una pipetta Pasteur in vetro monouso collegata a un sistema a vuoto e aggiungere 300 μl di soluzione di depolimerizzazione ECM ghiacciata per pozzetto. Incubare per almeno 1 ora a 4 °C.
NOTA: In alternativa, interrompere meccanicamente l'organoide contenente la cupola di idrogel a base di ECM dopo l'aggiunta della soluzione di depolimerizzazione ECM e raccogliere la sospensione in una provetta conica da 15 ml prima dell'incubazione a 4 °C. Questo metodo è consigliato quando organoidi che non sono destinati ad essere utilizzati per la coltura monostrato 2D vengono coltivati contemporaneamente sulla stessa piastra. La densità delle colture di organoidi influenza in modo significativo il numero di pozzetti di coltura di organoidi necessari per una semina ottimale negli inserti di coltura cellulare.- Per le colture di organoidi ad alta densità (Figura 1A supplementare), gli inserti per colture di cellule rettali utilizzano un rapporto di semina compreso tra 1:1 e 1:2, il che significa che un pozzetto di coltura può seminare da uno a due pozzetti. Per l'ileo, mantenere il rapporto a 1:1. Al contrario, le colture a bassa densità (Figura supplementare 1B) richiedono più pozzetti di coltura; Utilizzare 3-4 pozzetti di coltura di organoidi rettali per un inserto di coltura di cellule rettali (rapporto 3-4:1) e 4-5 pozzetti di coltura di organoidi ileali per un inserto di coltura di cellule ileali (rapporto 4-5:1).
- Ispezionare visivamente la dissoluzione completa dell'idrogel basato sulla ECM e raccogliere la sospensione di organoidi in una provetta conica da 15 mL.
- Pellet di organoidi per centrifugazione a 200 x g e 4 °C per 5 min. Scartare il surnatante. Pellet di risospensione in 1 mL di soluzione dell'enzima di dissociazione cellulare ricombinante integrata con 10 μM di Y-27632.
- Incubare la sospensione di organoidi in un bagno d'acqua a 37 °C per 10 minuti con agitazione intermittente di 3-5 s con un vortice ogni 2-3 minuti per facilitare un'efficace dissociazione degli organoidi.
- Dopo la digestione enzimatica, aggiungere 5 mL di terreno basale e pipettare in modo aggressivo con una micropipetta P1000 per disgregare ulteriormente gli organoidi nelle singole cellule. Ispezionare la sospensione per verificare la presenza di grumi di organoidi e, se ancora visivamente apprezzabili, ripetere il pipettaggio per migliorare la dissociazione di singole cellule.
- Preparare una provetta conica da 50 mL con un filtro cellulare da 70 μm. Prebagnare il colino applicando 1-2 ml di terreno basale.
- Filtrare la sospensione delle celle attraverso il filtro per rimuovere i detriti residui di idrogel a base di ECM e i grandi grumi di cellule. Sciacquare la provetta originale da 15 ml e il filtro cellulare da 70 μm con altri 10 ml di terreno basale.
NOTA: Se la sospensione cellulare non passa facilmente attraverso un colino, può essere un'indicazione di dissociazione incompleta dell'organoide. Si può tentare di ripassare la sospensione cellulare raccolta attraverso lo stesso filtro cellulare da 70 μm. Potrebbe essere necessario un ulteriore disturbo enzimatico o meccanico. - Sospensione monocellulare di pellet mediante centrifugazione a 200 x g e 4 °C per 5 min. Rimuovere il surnatante e risospendere le cellule con un volume appropriato di terreno basale per eseguire la conta cellulare.
- Contare le cellule vitali con un emocitometro dopo la colorazione con blu di tripano per calcolare il numero totale di cellule raccolte.
- Sospensione monocellulare di pellet mediante centrifugazione a 200 x g e 4 °C per 5 min. Rimuovere il surnatante e risospendere le cellule alla densità di semina appropriata nel rispettivo terreno di coltura monostrato (Tabella 1).
- Per le cellule organoidi ileali, risospendere le cellule alla concentrazione di 2,5 x 106 cellule/mL per ottenere una densità di semina di 5 x 105 cellule per inserto di coltura cellulare in 200 μL di terreno di coltura monostrato ileale, che è il terreno di coltura per organoidi integrato con 500 nM di LY2157299, 10 μM di Y-27632 e 20% di siero fetale bovino (FBS).
- Per le cellule organoidi rettali, risospendere le cellule alla concentrazione di 1,5 x 106 cellule/mL per ottenere una densità di semina di 3 x 105 cellule per inserto di coltura cellulare in 200 μL di terreno di coltura rettale monostrato, che è il terreno di coltura organoide integrato con 100 nM CHIR99021, 500 nM LY2157299, 10 μM Y-27632, e 20% FBS.
- Recuperare la piastra per colture cellulari a 24 pozzetti con inserti per colture cellulari rivestiti in ECM e svuotare la camera apicale dell'inserto per colture cellulari con un'attenta aspirazione a vuoto per non interrompere il rivestimento.
- Applicare delicatamente 200 μl di sospensione unicellulare preparata al punto 2.10 sulla camera apicale dell'inserto di coltura cellulare. Per il controllo del bianco, aggiungere 200 μl di terreno di coltura senza cellule nella camera apicale. Per il controllo del bianco, aggiungere 200 μl di terreno di coltura senza cellule nella camera apicale.
- Applicare 500 μl di terreno di coltura monostrato opportunamente integrato (a seconda delle cellule ileali rispetto a quelle rettali) nella camera basolaterale di ciascun pozzetto.
- Incubare in un incubatore umidificato a 37 °C e 5% di CO2 per facilitare l'adesione e la crescita delle cellule e formare un monostrato 2D confluente sull'inserto della coltura cellulare.
- Cambiare i terreni di coltura nelle camere apicali e basolaterali a giorni alterni a partire da 48 ore dopo la semina cellulare. Garantire lo stesso tempo di incubazione per il controllo in bianco e per l'inserto contenente le cellule.
3. Misurazione TEER
NOTA: Il metodo qui descritto utilizza un sistema di misurazione TEER manuale disponibile in commercio noto come voltohmmetro epiteliale con una coppia di elettrodi Ag/AgCl (Figura 1A). La determinazione del TEER su un monostrato 2D richiede la misurazione di pozzetti bianchi. Assicurarsi che la lettura in bianco venga effettuata allo stesso modo del campione.
- Recuperare dall'incubatore la piastra contenente inserti per colture cellulari con monostrato 2D derivato da organoidi e il bianco. Lasciare che la piastra raggiunga la temperatura ambiente per circa 10 minuti.
- Disinfettare gli elettrodi con etanolo al 70% e lasciarli asciugare completamente.
- Introdurre con cautela gli elettrodi con l'estremità corta nella camera apicale e l'estremità lunga nella camera basolaterale (Figura 1A).
NOTA: È necessaria la massima cautela per non interrompere il monostrato della cella. - Lasciare che la lettura si equilibri e registrare il valore in ohm quando si stabilizza.
NOTA: La sensibilità del voltohmmetro è tale che si verificheranno fluttuazioni del valore ohm durante la misurazione della resistenza elettrica. Una lettura affidabile si ottiene quando le misurazioni si stabilizzano e si aggirano costantemente intorno a un valore di plateau. - Determinare il TEER del monostrato 2D con la seguente formula:
TEER (Ω x cm2) = superficie degli inserti per colture cellulari (cm2) x Resistenza elettrica netta
Dove la resistenza elettrica netta è uguale alla resistenza misurata dell'inserto monostrato della cella meno la resistenza misurata dell'inserto grezzo. Gli inserti per colture cellulari per piastre a 24 pozzetti hanno una superficie di 0,33 cm2.
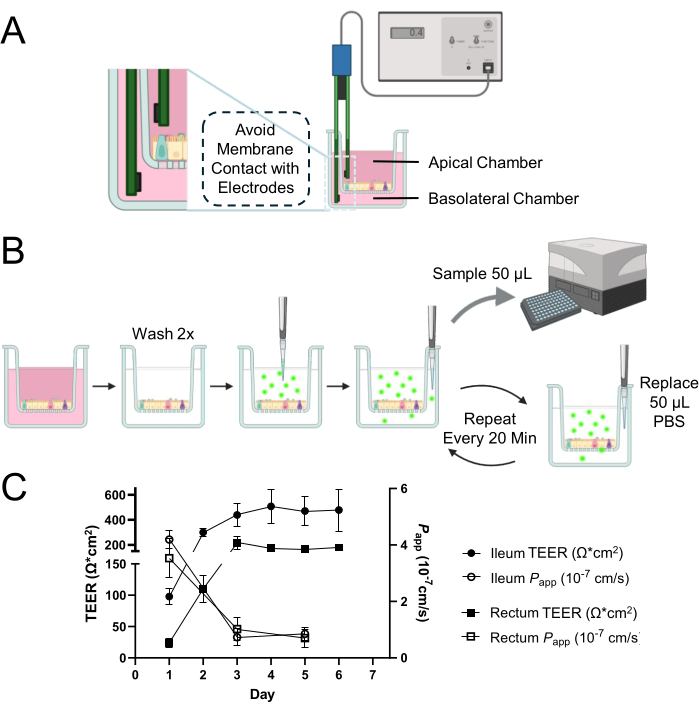
Figura 1: Valutazione dell'integrità della barriera epiteliale di un monostrato 2D derivato da organoidi intestinali bovini. (A) Schema del posizionamento appropriato degli elettrodi all'interno delle camere apicali e basolaterali di un inserto per colture cellulari per misure TEER. L'elettrodo corto viene inserito nella camera apicale e l'elettrodo lungo viene posizionato nella camera basolaterale con cura per evitare il contatto con la membrana. (B) Schema del processo di saggio di permeabilità. Le camere di coltura cellulare vengono lavate 2 volte con PBS riscaldato e 0,5 mg/mL di tracciante FITC-destrano da 4 kDa disciolto in PBS viene applicato alla camera apicale. Aliquote ripetute di 50 μl dalla camera basolaterale vengono campionate con la sostituzione di un volume uguale di PBS per mantenere il volume totale nella camera basolaterale per tutta la durata del periodo di incubazione. L'intensità di fluorescenza dell'aliquota viene misurata utilizzando un lettore di micropiastre per quantificare la diffusione del tracciante FITC-destrano da 4 kDa attraverso il monostrato cellulare. (C) Lo sviluppo dinamico dell'integrità della barriera all'interno dei monostrati ileale e rettale nel tempo è stato valutato utilizzando misurazioni TEER (rappresentate da cerchi chiusi per l'ileo e quadrati chiusi per il retto) e saggi di permeabilità (indicati da cerchi aperti per l'ileo e quadrati aperti per il retto) con un tracciante FITC-destrano da 4 kDa. Entro il terzo giorno di coltura, entrambi i tipi di monostrati hanno mostrato la creazione di barriere epiteliali stabili e funzionali, come evidenziato dai rispettivi profili di TEER e permeabilità. I risultati sono la media di almeno due esperimenti indipendenti con due repliche tecniche. Le barre di errore rappresentano il SEM delle misurazioni. Clicca qui per visualizzare una versione più grande di questa figura.
4. Saggio di permeabilità paracellulare
NOTA: Questo test prevede la determinazione dell'intensità di fluorescenza risultante dalla diffusione dell'isotiocianato di fluoresceina (FITC)-destrano dalla camera apicale alla camera basolaterale attraverso monostrati 2D per 120 minuti (Figura 1B). Per ottenere risultati ottimali, si consiglia di ridurre al minimo l'esposizione alla luce durante il saggio e di effettuare le misurazioni in un lettore di micropiastre immediatamente dopo ogni campionamento per evitare qualsiasi diminuzione o estinzione della fluorescenza. Ogni pozzetto può essere utilizzato una sola volta e non può essere riutilizzato in saggi successivi. Preparare almeno 2 pozzetti che fungano da repliche tecniche per ogni saggio. Ad esempio, sono necessari un totale di 6 pozzetti per ottenere i risultati presentati nella Figura 1C, dove i saggi sono stati eseguiti in duplice copia in 3 diversi punti temporali (giorni 1, 3 e 5 di coltura).
- Preparare serie di diluizioni a curva standard con 4 kDa di FITC-destrano in soluzione salina tamponata con fosfato (PBS). Per ogni diluizione, pipettare 50 μl in una piastra a 96 pozzetti in triplicato.
NOTA: Si consiglia di creare una serie di 5-7 diluizioni che vanno da 0 a 0,5 mg/mL. - Determinare l'intensità di fluorescenza degli standard in un lettore di micropiastre pre-calibrato a una lunghezza d'onda di eccitazione di 495 nm e una lunghezza d'onda di emissione di 535 nm.
- Calcola la regressione lineare con i risultati dell'intensità della fluorescenza per creare una curva standard.
- Recuperare dall'incubatore la piastra contenente inserti per colture cellulari con monostrato 2D derivato da organoidi. Rimuovere i terreni di coltura monostrato dalla camera apicale e basolaterale dell'inserto di coltura cellulare contenente il monostrato 2D derivato da organoidi da valutare.
- Lavare delicatamente ciascuna camera 2 volte con 200 μl (camera apicale) e 500 μl (camera basolaterale) di PBS preriscaldato, rispettivamente.
- Rimuovere la soluzione di lavaggio dalla camera apicale e applicare 200 μL di tracciante FITC-destrano da 0,5 mg/mL da 4 kDa in PBS nella camera apicale dell'inserto di coltura cellulare.
- Incubare in un incubatore umidificato a 37 °C e 5% di CO2 per 20 min.
- Campionare 50 μl dalla camera basolaterale della piastra a 24 pozzetti incubata e trasferirlo in una piastra a 96 pozzetti compatibile con il lettore di micropiastre.
- Sostituire 50 μl di PBS fresco nella camera basolaterale del pozzetto campionato.
- Effettuare immediatamente la misurazione dell'intensità della fluorescenza in un lettore di micropiastre pre-calibrato a una lunghezza d'onda di eccitazione di 495 nm e una lunghezza d'onda di emissione di 535 nm.
- Ripetere i passaggi 4.6-4.10 ogni 20 minuti fino a 120 minuti. Al termine del saggio, se si desidera conservare il monostrato 2D, sciacquare sia la camera apicale che quella basolaterale con PBS 2x fresco, sostituire con terreno di coltura monostrato fresco e incubare.
NOTA: È possibile eseguire ulteriori valutazioni dei monostrati 2D, ad esempio misurazioni TEER, colorazione in immunofluorescenza, ecc.; Tuttavia, non è raccomandato in quanto è probabile che il tracciante fluorescente residuo possa influire sull'analisi. - Determinare il coefficiente di permeabilità apparente (Papp) con la seguente formula:
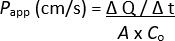
ΔQ / Δt = concentrazione di tracciante fluorescente che ha passato il monostrato alla camera basolaterale dell'inserto di coltura cellulare per un determinato periodo di tempo, misurata dall'intensità di fluorescenza ed estrapolata in μg/mL tramite la curva standard
A = superficie degli inserti per colture cellulari
Co = concentrazione di tracciante fluorescente aggiunto alla camera apicale dell'inserto di coltura cellulare in μg/mL
5. Colorazione in immunofluorescenza di monostrato 2D derivato da organoidi
- Rimuovere i terreni di coltura monostrato dall'inserto per colture cellulari con aspirazione a vuoto e aggiungere 200 μl di paraformaldeide (PFA) al 4%. Incubare a temperatura ambiente per 15-30 minuti per il fissaggio cellulare.
- Rimuovere il PFA con l'aspirazione a vuoto e lavare con 100 μL di PBS 2x.
- Permeabilizzare le cellule con 100 μL di Triton X-100 allo 0,3% in albumina sierica bovina al 2% (BSA) in PBS incubando a temperatura ambiente per 10 minuti.
- Rimuovere il surnatante con aspirazione a vuoto e lavare con 100 μL di PBS 2x.
- Rimuovere il surnatante e sostituirlo con il 2% di BSA in PBS e incubare a temperatura ambiente per 1 ora per il blocco.
- Rimuovere il surnatante, applicare 100 μL di anticorpo primario diluito in BSA al 2% in PBS e incubare a temperatura ambiente per 1 ora o per una notte a 4 °C.
NOTA: Le concentrazioni degli anticorpi primari utilizzati sono riportate nella Tabella dei materiali. Se non diversamente specificato, vengono seguite le raccomandazioni del produttore. - Rimuovere il surnatante e lavare con 100 μL di PBS 3x.
- Applicare 100 μl di anticorpo secondario diluito in BSA al 2% in PBS e incubare a temperatura ambiente per 1 ora o per una notte a 4 °C.
NOTA: Questo passaggio può essere saltato se l'anticorpo primario utilizzato è coniugato con una sonda a fluorescenza. Le concentrazioni degli anticorpi secondari utilizzati sono riportate nella Tabella dei materiali. Se non diversamente specificato, vengono seguite le raccomandazioni del produttore. - Rimuovere il surnatante e lavare con 100 μL di PBS 3x.
- Opzionale: per la controcolorazione di F-actina e nuclei (DAPI), preparare mescolando entrambe le sonde a una diluizione appropriata (secondo le raccomandazioni del produttore) in PBS, applicare 100 μl e incubare a temperatura ambiente per 30 minuti. Rimuovere il surnatante e lavare con 100 μL di PBS 3x.
- Ritagliare con cura la membrana dell'inserto per colture cellulari con una lama di bisturi e montarla su un vetrino con una soluzione di montaggio. Metti un vetrino coprioggetto e osserva.
Representative Results
Questo protocollo genera in modo affidabile robusti monostrati 2D derivati da organoidi intestinali bovini dal tratto intestinale tenue e crasso, emulando la complessità dell'epitelio intestinale in vivo . Questo metodo utilizza organoidi maturi sviluppati da campioni di cripte intestinali di bovini sani allevati con condizioni ottimizzate. È interessante notare che le condizioni di successo e ripetibilità per i monostrati 2D derivati da organoidi sono uniche per il segmento dell'intestino (Tabella 1). Ciò rafforza l'importanza di avere tecniche di coltura ottimizzate per il segmento intestinale di interesse.
A 1 giorno dalla semina di organoidi maturi dissociati su un inserto di coltura cellulare, è apparso formarsi un monostrato 2D (Figura 2A). Tuttavia, nonostante questa comparsa iniziale, le misurazioni TEER per i monostrati ileali e rettali sono rimaste basse in questa fase (Figura 1C). Inoltre, un saggio di permeabilità paracellulare ha rivelato che il monostrato, dopo appena 1 giorno di coltura, ha permesso il passaggio di un tracciante FITC-destrano da 4 kDa attraverso lo strato cellulare (Figura 1C). Entro il 3° giorno di coltura, entrambi i tipi di monostrati 2D derivati da organoidi hanno mostrato una maturazione significativa, evidenziata da un aumento dei valori di TEER e dalla resistenza al tracciante FITC-destrano da 4 kDa, una tendenza che è continuata fino al 5° giorno di coltura.
Particolarmente notevole è la variabilità interspecie, dove, nonostante i valori di TEER più bassi delle colture monostrato 2D derivate da organoidi bovini rispetto alle controparti umane e canine in condizioni simili 12,13,14,15, l'integrità della membrana rimane intatta. Questa conclusione è tratta dalla risposta appropriata dei monostrati nei saggi di permeabilità, suggerendo che bassi valori di TEER nei campioni bovini non riflettono necessariamente una mancanza di funzione barriera. Questa integrità è fondamentale per una barriera epiteliale funzionale ed è efficacemente dimostrata attraverso l'attenta interpretazione dei risultati dei saggi di permeabilità insieme alle misure TEER.
Visualizzazione della demarcazione cellulare e dei microvilli ben sviluppati sulla superficie apicale dei monostrati 2D con microscopia elettronica a scansione, visualizzazione di strutture microanatomiche specializzate, ulteriore maturazione rinforzata di monostrati 2D derivati da organoidi ileali e rettali (Figura 2B). Inoltre, la colorazione in immunofluorescenza dei monostrati 2D ha confermato la presenza di bordo apicale a spazzola, giunzioni di aderenza basolaterali e cellule caliciformi produttrici di muco in monostrati 2D derivati da organoidi ileali (Figura 3A) e rettali (Figura 3B). Questi risultati rafforzano il fatto che il monostrato 2D sviluppato è complesso nella composizione e nella formazione, non solo esprime le caratteristiche chiave di un epitelio intestinale intatto, ma è composto da una popolazione cellulare multilineare.
Il successo dello sviluppo di un monostrato 2D si basa sull'aderenza delle cellule alla ECM e sulla crescita alla confluenza per creare uno strato epiteliale intatto. In particolare, una distribuzione non uniforme della MEC o condizioni non ottimali durante l'incubazione sull'inserto di coltura cellulare possono provocare il distacco parziale dello strato cellulare, particolarmente evidente lungo i suoi bordi (Figura 4Ai). Questo problema è ulteriormente aggravato se le cellule vengono seminate a una densità superiore a quella ottimale o se le cellule di semina non sono distribuite uniformemente sulla superficie di coltura, uno scenario che spesso deriva dalla dissociazione incompleta degli organoidi in una singola sospensione cellulare. Tale distribuzione irregolare può portare alla formazione di lacune all'interno del monostrato e/o alla morfogenesi 3D su un inserto di coltura cellulare (Figura 4Aii). Al contrario, la sottosemina delle cellule può anche comportare uno sviluppo del monostrato infruttuoso o ritardato durante il periodo di coltura previsto, il che influisce inavvertitamente sull'efficienza degli studi successivi che utilizzano il sistema monostrato 2D (Figura 4Aiii). Inoltre, la contaminazione del sistema di coltura può anche portare alla formazione di spazi vuoti all'interno del monostrato, interrompendo il monostrato confluente una volta formato in una fase successiva della coltura (Figura 4Aiv). I valori sostenuti di TEER e la risposta di permeabilità paracellulare possono essere influenzati da disturbi nello strato cellulare dovuti a tecniche di lavaggio o manipolazione aggressive, anche quando le potenziali cause di guasto di cui sopra non erano state riscontrate prima di questi saggi (Figura 4B). Pertanto, un'attenta manipolazione delle cellule e la valutazione della formazione o delle interruzioni del monostrato sono fondamentali per il successo dello sviluppo di monostrati 2D derivati da organoidi attraverso l'applicazione efficace di strategie di risoluzione dei problemi.
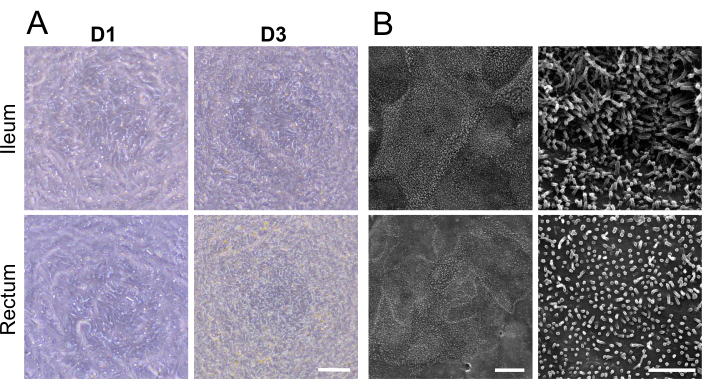
Figura 2: Caratterizzazione microscopica dei monostrati 2D derivati da organoidi ileali e rettali bovini. (A) Immagini rappresentative al microscopio a contrasto di fase di monostrati 2D al giorno 1 e al giorno 3 (D1 e D3) di coltura su un inserto di coltura cellulare. Barra della scala = 100 μm. (B) Immagini rappresentative al microscopio elettronico a scansione di monostrati 2D con ingrandimenti inferiori (a sinistra) e superiori (a destra). La struttura dettagliata della superficie cellulare, compresi i microvilli, può essere apprezzata sia nei monostrati ileali (in alto) che in quelli rettali (in basso). Barra della scala sinistra = 10 μm, barra della scala destra = 2 μm. Clicca qui per visualizzare una versione più grande di questa figura.
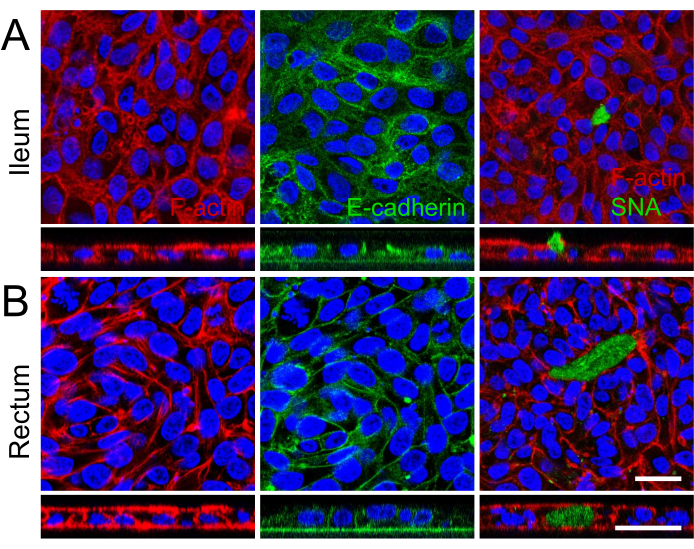
Figura 3: Caratterizzazione in immunofluorescenza di monostrati 2D derivati da organoidi ileali e rettali. (A, B) Il pannello (A) mostra l'ileale e il pannello (B) mostra gli organoidi rettali. A sinistra, le fibre di F-actina sono evidenziate con falloidina (rosso), illustrando l'architettura citoscheletrica e la formazione del bordo del pennello apicale. L'immagine centrale cattura la localizzazione basolaterale delle giunzioni aderenti, contrassegnata da E-caderina (verde), indicativa dell'adesione cellula-cellula e dell'integrità del monostrato. A destra, la presenza di cellule caliciformi produttrici di mucina è identificata da SNA (verde), con un'immagine z-stack che raffigura la secrezione apicale di mucina nel monostrato ileale. I nuclei di tutte le immagini sono stati controcolorati con DAPI (blu). Inoltre, l'imaging z-stack su tutte le immagini dimostra ulteriormente la formazione di un singolo strato cellulare all'interno dell'inserto di coltura. Barra della scala = 25 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
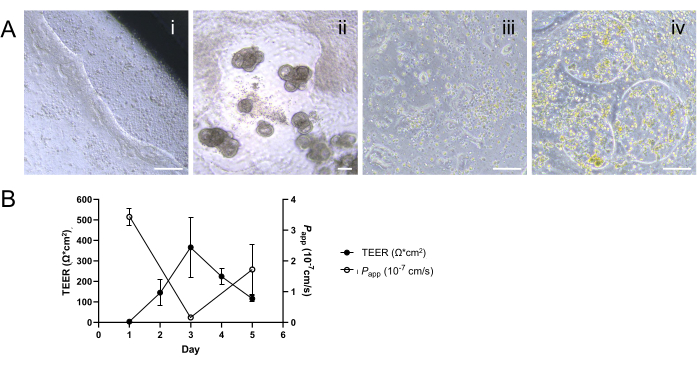
Figura 4: Caratterizzazione della formazione di monostrati 2D subottimali. (A) Immagini rappresentative a contrasto di fase che dimostrino (i) il distacco parziale del monostrato lungo il bordo dell'inserto di coltura cellulare; (ii) lo sviluppo di escrescenze 3D e la formazione di lacune all'interno del monostrato; iii) formazione di un monostrato incompleta o ritardata a causa di una densità di semina inferiore a quella ottimale, nota come adesione irregolare delle cellule; e (iv) formazione di spazi vuoti all'interno del monostrato 2D una volta formato in una fase successiva, probabilmente derivanti da sospetta contaminazione. Barre della scala = 100 μm. (B) Il calo delle misurazioni TEER accoppiato con l'aumento dei profili di permeabilità dopo il giorno 3 indicano un fallimento nello stabilire barriere epiteliali stabili e funzionali. I risultati sono presentati come media ± errore standard della media (SEM) da un singolo esperimento con due repliche tecniche. Clicca qui per visualizzare una versione più grande di questa figura.
Figura 1 supplementare: Variazioni di densità in colture di organoidi intestinali bovini in idrogel a base di ECM. organoidi intestinali bovini coltivati in un idrogel a base di ECM; (A) alta densità e (B) bassa densità. Barra della scala = 100 μm. Clicca qui per scaricare questo file.
Tabella supplementare 1: Segnali riassunti del donatore di tessuti. Clicca qui per scaricare questo file.
Discussion
La salute del tratto intestinale è fondamentale sia per la produttività che per il benessere generale dei bovini16. Sfruttando la tecnologia 2D monostrato derivata da organoidi, gli scienziati possono ora imitare in modo più accurato la complessa struttura dell'epitelio intestinale bovino in un contesto in vitro 5. Questo approccio innovativo non solo riproduce la diversa composizione cellulare del rivestimento intestinale, comprese le sue linee multicellulari, ma cattura anche caratteristiche funzionali chiave, come la secrezione di muco e la presenza di microvilli, essenziali per comprendere la fisiologia e la patologia intestinale3. Lo sviluppo di protocolli di coltura su misura per segmenti dell'ileo e del retto ha dato origine a una piattaforma avanzata che migliora significativamente la capacità di studiare la salute dell'intestino bovino. Questo approccio sofisticato consente di studiare in dettaglio le interazioni tra i patogeni zoonotici e l'ambiente intestinale bovino. La capacità di replicare e studiare da vicino gli aspetti unici dell'ecosistema intestinale bovino in vitro è un passo significativo verso lo sviluppo di strategie mirate per migliorare la salute del bestiame e mitigare la diffusione delle malattie zoonotiche.
Tuttavia, per garantire il successo dello sviluppo di monostrati 2D utilizzando organoidi intestinali bovini, è fondamentale mantenere la salute e la vitalità sia degli organoidi che delle loro singole cellule dissociate. Un'attenta manipolazione e la riduzione al minimo dello stress sono fondamentali per preservare l'integrità e la funzionalità delle cellule, essenziali per l'efficace crescita degli organoidi e la successiva creazione di un monostrato funzionante. Inoltre, il raggiungimento di un monostrato uniforme si basa sulla dissociazione riuscita degli organoidi in singole cellule senza formare grandi grumi. Tali grumi possono interrompere la distribuzione cellulare e compromettere la struttura del monostrato. Pertanto, l'impiego di tecniche precise per una dissociazione regolare è fondamentale, in quanto si ottiene una sospensione uniforme di una singola cellula. Inoltre, diventa utile ridurre al minimo i disturbi durante l'adesione cellulare e quando si lavano via le cellule non aderenti in eccesso. Questo approccio è particolarmente importante per affrontare potenziali problemi con la morfogenesi 3D, migliorando così la qualità complessiva del monostrato.
Una sfida nota con gli idrogel a base di ECM di origine biologica è la variazione da lotto a lotto nella composizione17. Sebbene ciò non sia stato osservato utilizzando i protocolli e i materiali descritti, le variazioni da lotto a lotto nella composizione dell'ECM potrebbero rappresentare una sfida per il successo dello sviluppo del monostrato. Se la formazione del monostrato è compromessa quando i prodotti, le marche o i numeri di lotto ECM cambiano, potrebbero essere necessarie fasi di ottimizzazione per determinare la concentrazione ECM appropriata richiesta per il rivestimento degli inserti per colture cellulari.
Inoltre, regolare il terreno di coltura a temperatura ambiente prima di apportare qualsiasi modifica è un passaggio fondamentale che aiuta a mitigare lo shock termico, proteggere la salute delle cellule e mantenere la qualità sia delle colture di organoidi che di monostrato. Anche le pratiche di lavaggio delicate sono fondamentali per mantenere l'integrità del monostrato durante la sua formazione e i successivi saggi, ed evitare interruzioni può prevenire imprecisioni nei risultati. La sostituzione del PBS con la soluzione salina bilanciata di Hank (HBSS) è sembrata utile per ridurre al minimo il distacco del monostrato quando diventava un problema durante il lavaggio ripetuto o l'esposizione prolungata al PBS, come nei saggi di permeabilità paracellulare. Infine, adattare il terreno di coltura per soddisfare le esigenze specifiche delle cellule provenienti da diversi segmenti del tratto intestinale, come l'ileo e il retto, è essenziale per replicare accuratamente le condizioni in vivo . Questa specificità garantisce una salute e una funzionalità cellulari ottimali, facilitando la modellazione precisa della fisiologia intestinale del bestiame e delle interazioni con i patogeni, evidenziando così queste fasi critiche nella ricerca sugli organoidi.
Oltre a impiegare una pratica delicata di manipolazione delle celle, lo sviluppo di una buona competenza tecnica associata al conteggio delle cellule e alle misure TEER è fondamentale per il successo dello sviluppo di un monostrato 2D funzionante. Poiché sia le densità di semina troppo basse che quelle troppo alte, risultanti rispettivamente da un conteggio eccessivo o insufficiente delle cellule, possono portare a una crescita compromessa del monostrato. Si consiglia di esaminare attentamente la conta cellulare e di garantire un'adeguata densità di semina nelle occasioni in cui si sospetta una densità di semina imprecisa. Inoltre, tecniche di misurazione TEER inadeguate possono causare l'interruzione del monostrato a causa di graffi involontari con gli elettrodi. Introdurre con cura gli elettrodi nella camera apicale e prestare particolare attenzione a mantenere il loro orientamento verticale rispetto alla superficie della membrana potrebbe aiutare a mitigare il rischio di danni accidentali ai monostrati.
I metodi di saggio della permeabilità paracellulare qui descritti sono stati adattati da un precedente protocollo18. Le modifiche al protocollo riportato, che includono campionamenti multipli superiori a 120 minuti e la sostituzione dell'aliquota campionata con quantità uguali di PBS, vengono apportate per migliorare l'accuratezza e l'affidabilità dei risultati. Mantenere il volume totale all'interno della camera è fondamentale per diversi motivi: preserva l'equilibrio osmotico, garantisce l'integrità delle cellule, mantiene il gradiente di concentrazione essenziale per un'accurata valutazione della permeabilità e previene le alterazioni della pressione idrostatica che potrebbero influire sulle velocità di trasporto. Questa pratica di riempire la camera basolaterale con PBS fresco equivalente al volume del PBS contenente tracciante fluorescente campionato è fondamentale per preservare queste condizioni, consentendo valutazioni accurate e significative della permeabilità del monostrato. Il test di permeabilità paracellulare funge da complemento alla misurazione TEER, valutando direttamente il movimento delle molecole traccianti attraverso il monostrato. Inoltre, il confronto dei valori TEER tra vari laboratori potrebbe non fornire informazioni rilevanti, poiché questi valori possono essere influenzati da numerose variabili, come la temperatura e le condizioni specifiche in cui le cellule vengono coltivate, inclusi i tipi di cellule, il numero di passaggi e la composizione del terreno di coltura19. Il test di permeabilità paracellulare fornisce una valutazione funzionale in vitro dell'efficace espressione di aderenze e giunzioni strette all'interno di una barriera epiteliale20.
Sebbene lo sviluppo di monostrati 2D da organoidi 3D rappresenti un progresso significativo nella tecnologia delle colture, è importante riconoscere i limiti associati ai monostrati 2D. Uno dei principali svantaggi è che questo rimane un sistema di coltura statico, privo della stimolazione dinamica che si trova nell'ambiente in vivo . Inoltre, la modifica del contenuto di ossigeno all'interno del sistema di coltura presenta sfide a causa della sua configurazione aperta che prevede piastre di coltura con coperchi, rendendolo meno adatto per la co-coltura a lungo termine con batteri anaerobici. Queste limitazioni potrebbero potenzialmente essere affrontate adottando piattaforme di coltura più dinamiche, come i sistemi microfluidici21, che offrono un ambiente più controllato e fisiologicamente rilevante. Inoltre, è fondamentale riconoscere che, sebbene le attuali condizioni di coltura siano ricche di nutrienti benefici per il mantenimento della crescita delle cellule staminali, potrebbero non essere ottimali per indurre la differenziazione fisiologica delle cellule epiteliali. Questa discrepanza evidenzia la necessità di un'ottimizzazione nella ricerca futura per imitare da vicino le condizioni in vivo e supportare il processo di differenziazione. Affrontando queste limitazioni e perfezionando questi approcci, l'utilità e l'applicabilità delle tecnologie di coltura degli organoidi vengono migliorate, avvicinandosi alla replica delle complesse dinamiche e interazioni del tratto gastrointestinale in vitro.
Il protocollo per la generazione di monostrati 2D da tessuti ileali e rettali bovini offre ai ricercatori un prezioso modello in vitro dell'interfaccia luminale dell'epitelio dell'intestino tenue e crasso. Questo modello apre vaste possibilità di applicazione negli studi fondamentali sulla nutrizione animale, in particolare nell'esame di come i nutrienti vengono assorbiti in varie condizioni. Un'area di notevole interesse è lo studio della sindrome dell'intestino permeabile, caratterizzata da un aumento anomalo della permeabilità gastrointestinale, spesso innescato da cambiamenti nella dieta e temperature ambientali estreme 22,23. Inoltre, questo modello funge da strumento essenziale per esplorare le complesse interazioni tra il microbioma intestinale e il suo ospite. Consente lo studio di come i microrganismi commensali possono influenzare la salute dell'organismo ospite, affrontando un aspetto cruciale della scienza veterinaria e medica 1,24. Inoltre, i patogeni di origine alimentare umana si trovano spesso come commensali in diversi segmenti dell'intestino del bestiame 8,9,25, questo protocollo consente studi dettagliati delle condizioni specifiche che consentono a questi agenti zoonotici di prosperare nelle rispettive nicchie.
Nel corso di questo studio, è stato osservato che i monostrati derivati da organoidi rettali e ileali richiedono condizioni diverse per uno sviluppo di successo. In particolare, quando i monostrati derivati da organoidi rettali sono stati inizialmente seminati su inserti di coltura cellulare preparati con idrogel a base di ECM al 2% in terreno basale per 1 ora, sono stati notati fori di grandi dimensioni e desquamazione cellulare. Questo problema è stato risolto passando a un terreno di coltura monostrato rettale specializzato ed estendendo il periodo di incubazione alla notte prima della semina, mentre i monostrati derivati da organoidi ileali sono stati sviluppati con successo utilizzando un protocollo di preparazione più breve. Inoltre, l'aggiunta di CHIR99021 al terreno di coltura ha costantemente migliorato la formazione di monostrati rettali26 , ma non è stata necessaria per i monostrati ileali27. Inoltre, i monostrati ileali richiedevano una densità cellulare più elevata per uno sviluppo di successo rispetto agli organoidi rettali27. Queste condizioni ottimizzate (Tabella 1) hanno ripetutamente sviluppato monostrati che mantengono l'integrità della barriera resistente, sottolineando l'importanza di adattare le condizioni di coltura allo specifico segmento intestinale.
L'accesso a un modello che rifletta accuratamente la complessità del lignaggio multicellulare dell'intestino in vivo è fondamentale per queste indagini. Consente ai ricercatori di imitare da vicino le condizioni naturali dell'ambiente intestinale, fornendo una base più affidabile per gli esperimenti. Con questo protocollo, i ricercatori sono dotati di un modello robusto che migliora le loro capacità di ricerca, portando potenzialmente a scoperte rivoluzionarie nei loro campi di studio. Questo approccio non solo contribuisce a comprendere la salute e le malattie intestinali, ma aiuta anche nello sviluppo di strategie per migliorare la gestione del bestiame e la sicurezza alimentare.
Disclosures
Gli autori non hanno conflitti di interesse da dichiarare.
Acknowledgements
Questo studio è stato supportato in parte dall'Ufficio del Direttore del National Institutes of Health (K01OD030515 e R21OD031903 a YMA) e dalla WSU VCS Resident and Graduate Student Research Grant (a GDD). Gli autori ringraziano il macello partecipante per aver fornito il bestiame donatore.
Materials
| Name | Company | Catalog Number | Comments |
| Basal Medium | |||
| Advanced DMEM/F12 (1X) | Gibco | 12634-010 | n/a |
| GlutaMAX-I (100X) | Gibco | 35050-061 | 2 mM |
| HEPES (1M) | Gibco | 15630-080 | 10 mM |
| Pen Strep Glutamine (100X) | Gibco | 10378-016 | 1X |
| Organoid Culture Medium (Supplements to Basal Medium) | |||
| A-83-01 | Sigma-Aldrich | SML0788-5MG | 500 nM |
| B27 Supplement (50X) | Gibco | 17504-001 | 1X |
| [Leu15]-Gastrin I human | Sigma-Aldrich | G9145-.5MG | 10 nM |
| Murine EGF | PeproTech | 315-09-500UG | 50 ng/mL |
| Murine Wnt-3a | PeproTech | 315-20-10UG | 100 ng/mL |
| N-Acetyl-L-cysteine | MP Biomedicals | 194603 | 1 mM |
| N-2 MAX Media Supplement (100X) | R&D Systems | AR009 | 1X |
| Nicotinamide | Sigma-Aldrich | N0636-100G | 10 mM |
| Noggin Conditioned Medium | n/a | n/a | 10 vol/vol % |
| Primocin | InvivoGen | ant-pm-2 | 100 µg/mL |
| R-Spondin-1 Conditioned Medium | n/a | n/a | 20 vol/vol % |
| SB202190 | Sigma-Aldrich | S7067-25MG | 10 µM |
| Monolayer Culture Medium (Supplements to Organoid Culture Medium) | |||
| CHIR99021 | Sigma-Aldrich | SML1046-5MG | 2.5 µM |
| HI FBS | Gibco | 10438-034 | 20 vol/vol % |
| LY2157299 | Sigma-Aldrich | SML2851-5MG | 500 nM |
| Y-27632 | StemCellTechnologies | 72308 | 10 µM |
| Reagents | |||
| Alexa Fluor 488 Mouse anti-E-cadherin | BD Biosciences | 560061 | 1:200 dilution |
| Alexa Fluor 647 Phalloidin | Invitrogen | A22287 | 1:400 dilution |
| BSA | Cytiva | SH30574.02 | 2 w/vol % |
| Cell Recovery Solution | Corning | 354253 | n/a |
| DAPI Solution (1 mg/mL) | Thermo Scientific | 62248 | 1:1000 dilution |
| DPBS (1X) | Gibco | 14190-144 | n/a |
| Fluorescein Isothiocyanate–Dextran | Sigma-Aldrich | FD4-100MG | 0.5 mg/mL |
| Matrigel Matrix | Corning | 354234 | n/a |
| Paraformaldehyde Solution (4%) | Thermo Scientific | J19943K2 | n/a |
| ProLong Gold antifade reagent | Invitrogen | P36930 | n/a |
| SNA, EBL, Fluorescein | Vector Laboratories | FL-1301 | 1:100 dilution |
| Triton X-100 | Thermo Scientific | A16046.AE | 0.3 vol/vol % |
| TrypLE Express | Gibco | 12605-028 | n/a |
| Trypan Blue Solution, 0.4% | VWR Life Science | K940-100ML | n/a |
| Materials and Equipment | |||
| 0.4 µm Cell Culture Insert | Falcon | 353095 | |
| 24-well Cell Culture Plate | Corning | 3524 | |
| 48-well Cell Culture Plate | Thermo Scientific | 150687 | |
| 70 µm Sterile Cell Strainer | Fisher Scientific | 22-363-548 | |
| 96-well Cell Culture Plate | Greiner Bio-One | 655086 | |
| Centrifuge | Eppendorf | 5910Ri | |
| CO2 Incubator | Thermo Scientific | 370 | |
| Epithelial Volt-Ohm Meter | Millipore | Millicell ERS-2 | |
| Hemocytometer | LW Scientific | CTL-HEMM-GLDR | |
| Inverted Confocal Microscope | Leica Microsystems | SP8-X | |
| Inverted Phase-Contrast Microscope | Leica Microsystems | DMi1 | |
| Microscope Cover Glass | Fisher Scientific | 12-540-B | |
| Microplate Reader | Molecular Devices | SpecrtraMax i3x | |
| Microscope Slides | Fisher Scientific | 22-034-486 | |
| Pasteur Pipets | Fisher Scientific | 13-678-20C | |
| Scalpel Blade | iMed Scientific | - | #11 carbon steel |
| Vortex Mixer | Scientific Industries | SI-0236 | |
| Software | |||
| LAS X imaging software | Leica Microsystems | LAS X 3.7.6.25997 | |
| Microplate Reader software | Molecular Devces | SoftMax Pro 7.1.2 |
References
- Min, S., Kim, S., Cho, S. W. Gastrointestinal tract modeling using organoids engineered with cellular and microbiota niches. Exp Mol Med. 52 (2), 227-237 (2020).
- Fitzgerald, S. F., et al. Shiga toxin sub-type 2a increases the efficiency of Escherichia coli O157 transmission between animals and restricts epithelial regeneration in bovine enteroids. PLoS Pathogens. 15 (10), e1008003 (2019).
- Dutta, D., Heo, I., Clevers, H. Disease modeling in stem cell-derived 3D organoid systems. Trend Mol Med. 23 (5), 393-410 (2017).
- Beaumont, M., et al. Intestinal organoids in farm animals. Vet Res. 52 (1), 33 (2021).
- Kawasaki, M., Dykstra, G. D., McConnel, C. S., Burbick, C. R., Ambrosini, Y. M. Adult bovine-derived small and large intestinal organoids: In vitro development and maintenance. J Tissue Eng Regene Med. 2023, e3095002 (2023).
- Kvidera, S. K., et al. Intentionally induced intestinal barrier dysfunction causes inflammation, affects metabolism, and reduces productivity in lactating Holstein cows. J Dairy Sci. 100 (5), 4113-4127 (2017).
- Crawford, C. K., et al. Inflammatory cytokines directly disrupt the bovine intestinal epithelial barrier. Sci Rep. 12 (1), 14578 (2022).
- Heredia, N., García, S. Animals as sources of food-borne pathogens: A review. Animal Nutri. 4 (3), 250-255 (2018).
- Naylor, S. W., et al. Lymphoid follicle-dense mucosa at the terminal rectum is the principal site of colonization of enterohemorrhagic Escherichia coli O157:H7 in the bovine host. Infect Immun. 71 (3), 1505-1512 (2003).
- Co, J. Y., et al. Controlling epithelial polarity: A human enteroid model for host-pathogen interactions. Cell Rep. 26 (9), 2509-2520.e4 (2019).
- Pullinger, G. D., et al. Systemic translocation of Salmonella enterica Serovar Dublin in cattle occurs predominantly via efferent lymphatics in a cell-free niche and requires type III secretion system 1 (T3SS-1) but not T3SS-2. Infect Immun. 75 (11), 5191-5199 (2007).
- Nickerson, K. P., et al. A versatile human intestinal organoid-derived epithelial monolayer model for the study of enteric pathogens. Microbiol Spectr. 9 (1), e0000321 (2021).
- Varani, J., McClintock, S. D., Aslam, M. N. Cell-matrix interactions contribute to barrier function in human colon organoids. Front Med. 9, 838975 (2022).
- Freire, R., et al. Human gut derived-organoids provide model to study gluten response and effects of microbiota-derived molecules in celiac disease. Sci Rep. 9, 7029 (2019).
- Ambrosini, Y. M., et al. Recapitulation of the accessible interface of biopsy-derived canine intestinal organoids to study epithelial-luminal interactions. PLoS ONE. 15 (4), e0231423 (2020).
- Kogut, M. H., Arsenault, R. J. Editorial: Gut health: The new paradigm in food animal production. Front Vet Sci. 3, 71 (2016).
- Lingard, E., et al. Optimising a self-assembling peptide hydrogel as a Matrigel alternative for 3-dimensional mammary epithelial cell culture. Biomater Adv. 160, 213847 (2024).
- Turksen, K. . Permeability Barrier: Methods and Protocols. , (2011).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. J Lab Autom. 20 (2), 107-126 (2015).
- Frost, T. S., Jiang, L., Lynch, R. M., Zohar, Y. Permeability of epithelial/endothelial barriers in Transwells and microfluidic bilayer devices. Micromachines. 10 (8), 533 (2019).
- Bein, A., et al. Microfluidic organ-on-a-chip models of human intestine. Cell Mol Gastroenterol Hepatol. 5 (4), 659 (2018).
- Sanz-Fernandez, M. V., et al. Targeting the hindgut to improve health and performance in cattle. Animals. 10 (10), 1817 (2020).
- Gressley, T. F., Hall, M. B., Armentano, L. E. Ruminant nutrition symposium: Productivity, digestion, and health responses to hindgut acidosis in ruminants. J Anim Sci. 89 (4), 1120-1130 (2011).
- O'Hara, E., Neves, A. L. A., Song, Y., Guan, L. L. The role of the gut microbiome in cattle production and health: Driver or passenger. Ann Rev Animal Biosci. 8 (2020), 199-220 (2020).
- Beach, J. C., Murano, E. A., Acuff, G. R. Prevalence of Salmonella and Campylobacter in beef cattle from transport to slaughter. J Food Protect. 65 (11), 1687-1693 (2002).
- Kawasaki, M., Ambrosini, Y. M. Accessible luminal interface of bovine rectal organoids generated from cryopreserved biopsy tissues. PLoS One. 19 (3), e0301079 (2024).
- Kawasaki, M., McConnel, C. S., Burbick, C. R., Ambrosini, Y. M. Pathogen-epithelium interactions and inflammatory responses in Salmonella Dublin infections using ileal monolayer models derived from adult bovine organoids. Scientific Reports. 14 (1), 11479 (2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved