用于对增量岩芯进行采样和数字化的新工作流程
In This Article
Summary
我们提出了一种协议,使用 3D 打印支架在现场固定增量芯,而无需拆包并将它们粘合在木制支架上。新的 GSC 支架允许将核心放置在核心切片机中,以切割其表面并直接将其转移到数字图像捕获中。
Abstract
在这里,我们提出了一种新的工作流程,从在野外采集增量岩芯,将它们储存并运输到实验室,再到数字化它们的树木年轮以进行进一步的分析,以便进行后续的树木生态学分析。该过程涉及对增量核心使用新的样品载体。这些新的 Gärtner Schneider Core (GSC) 支架是使用 3D 建模软件设计的,最后使用 3D 打印机打印。在现场从一开始就使用这些支架,可以直接用核心切片机切割核心,然后可以使用新的高分辨率图像捕获系统对其表面进行数字化,而无需进一步重新排列。因此,它们可用于直接分析。该系统允许对岩心和磁盘的树木年轮进行数字化,还可以使用透射光从长微观切片(长达 40 厘米)中拍摄图像。此功能对于树状生态学和地貌应用特别感兴趣,以识别使用切片机核心切片机切割的微切片中任何干扰的开始。
Introduction
1881 年,奥地利森林科学家 Arthur Freiherr von Seckendorff-Gudent 首次提出了通过应用交叉测年技术对树木年轮进行测年的原则1。在 20世纪 上半叶,“树木年代学之父”安德鲁·埃利科特·道格拉斯 (Andrew Ellicott Douglass) 重新发明了这项技术,并将其深入应用于考古遗址和活树的年代测定2。
如今,树木生态学作为树木年代学的一种环境框架的研究课题,被定义为研究由生态和环境随时间变化引起的树木年轮及其固有的生长变化3。在树木生态学研究中,除年轮宽度变化外的许多其他特征,例如稳定同位素、晚期木材密度或单个年轮内的细胞特征,用于将这些数据与环境参数相关联,以更好地了解环境条件对树木生长随时间推移的影响4。通过不断将木材解剖学研究与树木生态学研究相结合,树木生态学研究在过去十年中不断发展,并且比以往任何时候都更能成为重建过去气候条件的支柱 5,6,7,8。
尽管在过去十年中,样品制备和分析的技术发展,尤其是木材解剖学方面的技术发展强劲 9,10,11,12,13,14,但在简化采样技术方面几乎没有真正的进展15。尽管有声波技术16,但直到今天还没有可靠的“无损”方法可以提取树木年轮的特征。
因此,所有与树木年轮相关的研究仍然依赖于从感兴趣地点采集的树木或灌木的木制样本。当关注树时,标准过程是从Stems 15 中获取增量核心。
使用增量取芯通常表示为一种“非破坏性”技术17。与从茎中取出磁盘相比,这是正确的;然而,这种采样技术会在茎上形成一个直径约 1 厘米的孔,大部分延伸到茎的髓3 之外。树木能够自行闭合这个伤口,但这个过程会引起生长反应,改变伤口附近的常见结构,并且由于真菌病害,孔周围现有木材或多或少地严重变色18,19。因此,最好将其称为“微创”而不是“非破坏性”。
最近通过使用机械钻头的能力,采用增量岩芯的技术不断发展,从而产生更高质量的样本,尤其是用于木材解剖学分析15。与人工取芯相比,该程序还节省了大量现场时间。保持不变的是处理岩芯的程序,从从树中提取到标记、储存运输,并在实验室中为各种可能的分析技术做准备。
芯材仍需包装在稳定的容器中,例如塑料或纸制的吸管,以防止它们在运输过程中破损。使用软铅笔直接在芯上标记芯,或者(更频繁地)在每根吸管的外侧进行标记。使用塑料容器时,必须在短时间内取出芯,以避免真菌传播。因此,需要再次将 Core 从容器中取出。为了稳定型芯并防止它们在开始干燥时弯曲,需要将型芯固定在支架上。这也有助于后续的表面处理,以便进一步分析。执行此操作时,还需要将标签转移到相应的安装座上。标准程序是将芯子粘在木制支架上或用胶带将它们固定在瓦楞纸板的凹槽中。将它们粘合在木制支架上是最常用的技术。虽然这个程序非常适合稳定和打磨或切割芯,但它在潜在的化学、同位素甚至木材解剖分析方面有几个缺点。尽管需要时间,但另一个缺点是每个内核的标签容易错误地转移到新的安装座上。
在树木年代学中,作为准确测年的基础的年轮宽度测量是所有树木生态学研究的支柱20。尽管许多实验室仍然依赖于使用测量表进行手动测量,例如带有双筒望远镜的 Lintab21,但有一种趋势是使用平板扫描仪对核心表面进行数字化,并使用 CooRecorder22 或 WinDENDRO23 等软件测量环宽。不幸的是,这些扫描仪,例如广泛使用的 Epson Expression 10000XL 没有足够的分辨率来清楚地将结构描绘为早木或晚木管胞(图 1)。因此,生成的图像不适合识别困难的结构,例如非常窄的环或密度波动,这对于准确的交叉测年程序至关重要,而无需使用双筒望远镜返回原始岩芯24,25。
由于高图像分辨率是树木年轮科学10 中充分图像分析不可或缺的先决条件,因此 WSL (Skippy;https://www.wsl.ch/en/services-produkte/skippy/) 开发了一种新的图像捕获系统,使用数码相机对岩心表面的树木年轮进行数字化处理,从而获得比所有现有平板扫描仪更高的分辨率的图像。该系统基于2007 年开发的 ATRICS 系统 26 的理念。最近,一种与 Skippy 相当的简单但高效的图像捕获系统作为自组装套件27 推出。
数字化树木年轮,即反射光图像捕获,是创建增量核心或磁盘的高分辨率图像的重要步骤,以支持省时、基于数字的年轮宽度测量。WSL 开发的系统还允许使用透射光从长微切片(长达 40 厘米)拍摄图像。例如,这种附加功能对于树状地貌应用来说很有意义,以识别微切片中反应木材的开始。
在这项研究中,我们提出了一种协议,以简化在现场和实验室处理岩芯的过程。提出的新技术的基础是可重复使用的支架;新型 GSC 支架 GärtnerSchneiderC矿石 (GSC) 支架使用 3D 建模软件设计并使用 3D 打印机打印。GSC 支架允许直接处理在现场采集的岩芯,而无需重新包装或重新贴标签。我们还提出了一种高效的新系统,用于对型芯的准备好的表面进行数字化。该协议涵盖了从现场取芯到样品制备、数字化芯表面以进行后续分析并最终将其存储在档案中的整个过程。
Protocol
1. 创建 GSC 支架
- 在与 3D 打印机兼容的切片器程序中打开支架的 3D 模型。创建可由 3D 打印机读取的打印文件(在本例中为“*.gcode”文件)。
注意:可以使用任何 3D 建模软件设计 3D 模型。 - 使用存储卡或 U 盘将打印文件传输到 3D 打印机,然后在 3D 打印机上激活打印文件。
- 打印支架后,请等待支架冷却至室温 (RT)。然后,从打印机上取下支架粘住的印版,并将印版稍微弯曲,直到模板与表面分离。
- 从支架上取下所有多余的螺纹或附件。
注意:一次打印的支架数量取决于打印机的尺寸。在印版尺寸为 36 厘米 x 36 厘米的 3D 打印机上,一次可以打印大约 30 个长度为 35 厘米的支架。打印 30 个支架所需的时间取决于设备。平均而言,这应该在大约 8 小时内完成(隔夜打印)。
2. 在现场提取、稳定和运输增量岩芯
- 取一个装有扭矩助推器和增量取芯器的无绳电钻,选择取芯的位置,并将取芯器垂直于茎的生长轴。
注意: 同样的操作可以使用增量取芯器手动完成,无需充电式电钻。 - 开始去核,直到去核器至少达到茎直径的一半。如上所述,通过将提取器(与取芯器的长度相同)与取芯器一起检查深度。
- 如果使用充电式钻头,取下钻头,将手柄放在取芯器上(手动使用增量取芯器时已经出现这种情况),取出提取器,开口面朝上,然后将其完全插入取芯器。
- 向后转动增量去芯器(一整圈)以将核心从阀杆上折断。取出提取器,包括型芯。
- 从提取器中取出型芯。检查纤芯的光纤方向,以确保在将纤芯放入支架时光纤的方向是直立的。
注意:可以在纤芯的两端以及纤芯的侧面检查光纤方向。为此,请将磁芯对着光线并转动它,直到看到侧面发光。发生这种情况是因为,在这一侧,径向单元壁是纵向切割的,并且反射光线的方式与核心的其余部分不同。 - 将纤芯放在支架顶部,纤维方向朝直。用所有手指按压岩芯顶部,直到岩芯滑入支架。
- 使用软铅笔在支架侧面标记芯,即使在玻璃上也能书写。
注意:稍后可以用普通橡胶去除书写物。 - 将带有芯的支架放入运输箱中,然后合上盖子。
3. 在实验室中准备已安装的磁芯
- 可选:将封固的芯包埋在石蜡中,以进行可能的微切片。
- 将一个带盖的钢盒放在热板上,用石蜡填充至约 2 厘米,然后等待其完全熔化。
- 从运输箱中取出已安装的芯。将支架与核心放在液体石蜡中一样,然后盖上盖子。
- 启动真空泵,对容器施加恒定的轻度真空,然后等待约 2 小时。由于支架的开放式结构,石蜡可以穿透型芯,而不会产生额外的屏障。
- 停止真空泵并打开盖子。取出带有芯的支架,将它们放在网格上,让它们冷却。
- 如果需要,从支架侧面去除多余的石蜡。
- 准备型芯表面
- 将已安装的岩芯从运输箱或石蜡浴中取出。将支架与核心放在核心切片机的样品架中一样。确保将芯的方向调整为环的晚材朝向刀片。
- 拧紧样品架的螺钉,直到岩芯架完全固定。
- 提起样品架,直到样品芯稍微接触刀片。将刀片拉过核心的整个范围以切断顶部的第一部分。
- 将刀推回核心后面,将样品架抬起几微米,然后重复该过程,直到获得至少 2-3 毫米宽的平面。
- 按预期切割表面后,立即从切片机的样品架上取下核心支架。
注意:建议使用核心切片机切割核心,不要打磨它们,因为表面更干净、更直,并且细胞不会充满灰尘。
4. 数字化核心表面
- 将具有普通核心表面的岩芯支架放在图像捕获系统的桌子上,因为这里介绍了 WSL-Skippy 系统。
- 确保磁芯支架与工作台或相机的移动方向对齐。
- 将带有核心支架的工作台放置在相机下方,以将最外层的环置于相机物镜下方的视图中心。
- 在核心起点旁边放置一个刻度,并拍摄图像以进行校准。
注意:在连续执行多个内核的映像时,只需执行一次此操作。 - 在软件中定义内核的长度并开始图像捕获过程。拍摄最后一张图像时,表格将移回起始位置。
- 从桌子上取出样品,将下一个支架放在相机下方,然后通过定义核心的长度来重复前面描述的过程,直到拍摄到所有核心。
- 使用(无失真的)拼接软件(例如 PTGui)将单个图像组合成核心表面的一个最终图像。
5. 存储核心
- 将分析好的岩芯放入支架中,将它们放在用 3D 打印机打印的便携式存储架中。
- 为机架贴上标签,以便从外部识别核心。
- 将机架存放在架子或任何其他可用的存档上。
Representative Results
GSC 支架
核心支架(默认)打印为 35 厘米的长度,这几乎对应于所用 3D 打印机的最大打印尺寸(原始 Prusa XL,构建体积 36 厘米× 36 厘米× 36 厘米)。如果采用较长的纤芯,则可以通过所有支架两端的凹痕将支架与小连接件连接,从而为支架扩展额外的支架(图 2A)。
在进行野外工作时,将岩芯直接存放在支架中所需的时间与简单地将它们放入吸管或其他包装材料中所需的时间相当。虽然在将纤芯压入支架之前需要尊重每个纤芯的光纤方向(图 2),但这个额外的时间只有几秒钟,并且可以通过使用镜头来支撑。根据我们的经验,10 个内核所需的额外时间(如果有)总和约为 1 分钟。这个最小的额外时间也指破损的内核。这些碎片不是一块一块地放入吸管中,而是简单地将这些碎片一个接一个地放入支架中并压入。
为了保证岩芯在现场和实验室的安全运输,我们为支架(包括岩芯)设计并打印了一个特殊的运输箱(图 3)。支架可以简单地放在盒子中,在那里它们被正好适合支架两端凹槽的小凸起固定。然后可以通过从箱子的侧面凹槽中推入的盖子来关闭箱子。
新支架的真正优势在实验室中显而易见。无需从吸管(或其他容器)中取出芯,用线索准备木制镶样,将芯固定在镶样上,将标签转移到新的镶样上,并等待至少几个小时直到胶水干燥稳定以进行进一步处理,支架中的芯可以直接 (i) 固定在切片机中以切割普通表面,或者 (ii) 可以直接用砂光打磨机器,无需任何进一步的准备过程。无需将标签转移到任何新的支架上,特别避免了可能的传输错误。
由于支架可以设计用于任何纤芯直径,因此对于“标准”5 mm 纤芯还是 10 mm 或 12 mm 纤芯,例如用于同位素或其他化学分析,它们都无关紧要。
与同位素或化学分析相关,支架的优点是无需胶水或固定介质即可固定岩芯。因此,岩芯不会受到污染,并且可以轻松地从支架中取出,以进行更具体的分析。此外,在木材解剖分析方面,能够轻松地从支架中取出芯材,从而可以直接处理用于制备显微切片的芯材。
可以选择将核心固定在支架中,从而可以稳定敏感结构,因为细胞壁较薄的细胞在切割时往往会破裂。在许多情况下,通过将核心包埋在石蜡中来稳定核心比简单地添加玉米淀粉溶液更有效。
当需要存储型芯以备以后检查或重新分析时,另一个优势也会出现。支架可以放置在专门设计的架子上(图 4),也可以使用 3D 打印机打印,可与运输箱中的存储相媲美。带有芯的 GSC 支架按原样放置在机架中,然后可以存放在任何地方。机架的宽度,即单个机架中可以固定多少个芯,取决于货架或储藏室的可用空间。机架模型可以适应任何特定需求并相应地打印。
数字化核心或磁盘表面
WSL 开发的图像捕获系统(图 5)允许对树木年轮进行数字化(自动图像捕获),以创建增量核心或磁盘的高分辨率图像,以支持基于数字的省时、高效的年轮宽度测量。该系统由一个固定在螺纹杆上的板组成,该板以 0.1 至 1 cm 之间的预定义步长将样品移动到 61 MP 相机(Sony Alpha 7R IV)的物镜(Sony FE 90 mm f/2.8 Macro)下方。图像是使用相机的自动对焦系统拍摄的,以确保聚焦单张图像。相机的分辨率允许使用 SilverFast 分辨率目标 (USAF 1951) 测试每张图像的 6500 dpi 的实际分辨率。与指定分辨率为 4800 dpi 的平板扫描仪的官方分辨率相比,这听起来可能有点低。但是,当使用 4800 dpi 分辨率测试使用 Epson XL 扫描仪拍摄的同一目标的图像时,生成的图像显示的实际分辨率仅为 1825 dpi(图 6)。图像的高分辨率允许清晰地看到单个细胞,为此,可以清楚地定义图像中捕获的环边界(图 7)。如果所使用的型芯或圆盘的表面准备充分,则无需返回原始样品再次检查结构。拼接单个图像后,可以使用首选的分析软件分析所得的核心图像。
图像采集系统还允许使用透射光从长达 40 cm 的微切片中采集图像。例如,对于树状地貌应用,以识别反应木材的开始或整个树芯微切片中的其他特定特征,这一特征很有意义(图 8)。

图 1: Larix decidua Mill 的扫描图像。 使用平板扫描仪以不同的分辨率扫描树木年轮。 请单击此处查看此图的较大版本。
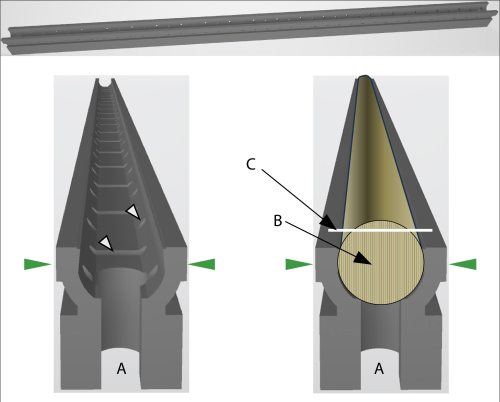
图 2:GSC 支架的示意图。 (A) 支架两端的开口允许用小杆连接两个支架,以固定较长的芯。绿色箭头表示将支架固定在核心切片机中的压力方向。左:白色箭头表示允许空气或液体(用于嵌入)循环的开口。右:压入芯的 GSC 支架。(B) 纤芯的纤维方向需要竖直。(C) 白线表示芯的切割表面。 请单击此处查看此图的较大版本。

图 3:用于在现场储存和运输 GSC 支架的运输箱。请单击此处查看此图的较大版本。

图 4:用于放置 GSC 支架以最终存储在存档中的存储框架。 框架可以堆叠以节省空间。 请单击此处查看此图的较大版本。

图 5:WSL 开发的图像捕获系统。请单击此处查看此图的较大版本。
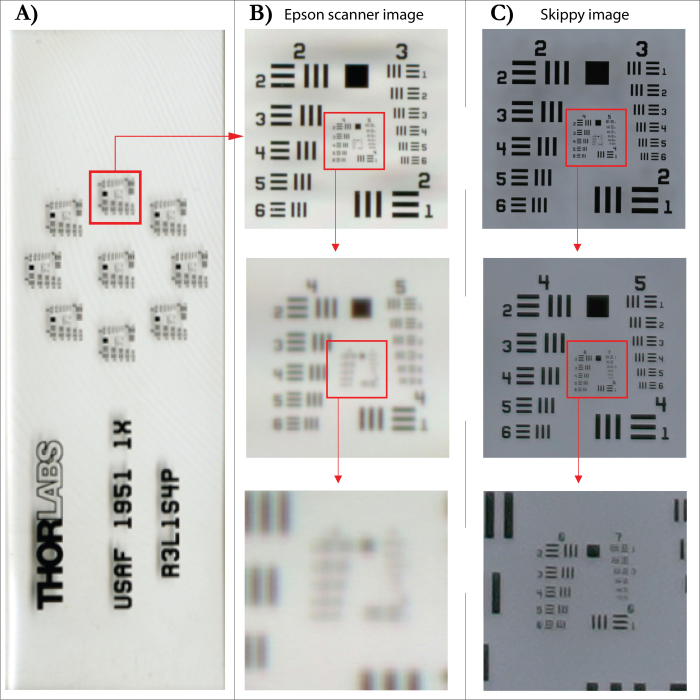
图 6:平板扫描仪和图像捕获系统之间的图像分辨率比较。 (A) SilverFast 分辨率目标 (USAF 1951)。(B) 使用指定分辨率为 4800 dpi(插值)的平板扫描仪扫描的图像,以及下面的相应部分放大图。(C) 使用图像采集系统拍摄的图像以及下面的相应放大部分。 请单击此处查看此图的较大版本。

图 7: 落叶松 磨坊的合成图像。增量核心(上图)和下面的相应截面放大。 使用图像捕获系统拍摄合成的单个图像。 请单击此处查看此图的较大版本。
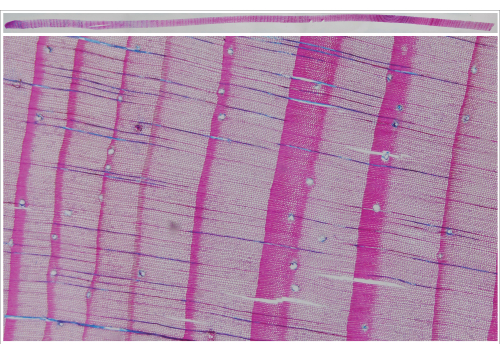
图 8:整个增量核心 (Larix decidua Mill.) 的微观截面的合成图像和相应的截面放大。 使用图像捕获系统(透射光)拍摄合成的单个图像。 请单击此处查看此图的较大版本。
Discussion
将木材解剖学纳入树木生态学研究广泛开放了这些研究,以便对过去的环境条件进行新的和深入的分析28,29,30。这些新技术还加强了分析工作,即生成感兴趣数据所需的实验室时间。已经有许多尝试来优化实验室工作并减少有关木材解剖技术9、12、13、15、30 的实验室所需时间。但几乎没有采取任何措施来简化处理、准备和储存这些研究所需的岩芯的常见程序。
3D 打印在这方面提供了新的可能性9.新的 3D 打印岩芯支架是简化整个过程的首次尝试,使其更省时,因此效率更高。
虽然需要取出储存在塑料吸管 31,32 或类似容器中的岩芯,以防止真菌在岩芯的外部(很快也会是内部)生长,但固定在 GSC 支架中的岩芯可以保持原样。在这一点上,它相当于将它们存放在纸吸管中 33。
一旦 (i) 从稻草(或其他容器)中取出芯线,(ii) 将它们粘在木制支架上或将它们固定在其他物体上作为电缆支架,以及 (iii) 传输每个芯线使用的相应代码的过程可能容易出错,因为几十年来它几乎是一个标准34, 变得不必要。
GSC 支架的开放式结构允许储存岩芯,而不会像储存在塑料容器中那样有真菌侵扰的风险。如上所述,支架还允许包埋在石蜡中以稳定结构。然而,这种“简单”的包埋不能与使用包埋盒将样品包埋在石蜡块中的常见包埋程序相提并论,就像对微核心35 所做的那样。这种简单的技术与在切割微切片36 时施用玉米淀粉相当。它会更好地稳定细胞并防止它们在切割过程中破裂,但比简单地添加玉米淀粉更耗时。这种形式的 embedding 不会像嵌入到 block 中那样稳定整个 core。如果核心断裂,各部分也会断裂。由于 GSC 支架安装在核心切片机37 中,因此只需几分钟即可为后续的数字化过程准备表面。
对于树木年轮的数字化过程,经常用于蓝色强度测量38,39 的平板扫描仪的应用对于年轮结构的更详细视图并不令人满意,因为生成的图像质量相当低。尽管在这些图像中可以看到针叶树的常见(宽)环的边界,但几乎不可能识别窄环,甚至密度波动。
尽管有一些令人着迷的新尝试可以以高分辨率数字化树木年轮,例如 X 射线 CT40,但使用高分辨率的数码相机仍然是生成高质量图像以供进一步测量的最有效和最具成本效益的方法。
Disclosures
作者声明他们没有相互竞争的经济利益。
Acknowledgements
作者要感谢 Jussi Grießinger 教授支持创建新支架的想法。
Materials
| Name | Company | Catalog Number | Comments |
| Core-microtome | WSL | https://www.wsl.ch/en/services-produkte/microtomes/ | Microtome to cut micro sections from increment cores |
| Epson Expression 10000XL | EPSON | https://epson.com/Support/Scanners/Expression-Series/Epson-Expression-10000XL---Graphic-Arts/s/SPT_E10000XL-GA | flatbed scanner |
| GSC holder | WSL | in-house | 3D printed mount to fix cores for transport, preparation, analyses, and storage |
| Skippy image capturing system | WSL | https://www.wsl.ch/en/services-produkte/skippy/) | Image capturing system developed at WSL equiped with a 61 MP camera (Sony Alpha 7R IV and Sony FE 90mm f/2.8 Macro lens) |
References
- Wimmer, R. Arthur Freiherr von Seckendorff-Gudent and the early history of tree-ring crossdating. Dendrochronologia. 19 (1), 153-158 (2001).
- McGraw, D. J. Andrew Ellicott Douglass and the giant sequoias in the founding of dendrochronology. Tree-Ring Res. 59 (1), 21-27 (2003).
- Schweingruber, F. H. . Tree Rings and Environment: Dendroecology. , (1996).
- Amoroso, M. M., Daniels, L. D., Baker, P. J., Camarero, J. J. . Dendroecology: Tree-Ring Analyses Applied to Ecological Studies (Vol.231). 231, (2017).
- Lopez-Saez, J., Corona, C., Von Arx, G., Fonti, P., Slamova, L., Stoffel, M. Tree-ring anatomy of Pinus cembra trees opens new avenues for climate reconstructions in the European Alps. Sci Total Environ. 855, 158605 (2023).
- Björklund, J., et al. Fennoscandian tree-ring anatomy shows a warmer modern than medieval climate. Nature. 620 (7972), 97-103 (2023).
- Camarero, J. J., Colangelo, M., Rodriguez-Gonzalez, P. M. Tree growth, wood anatomy and carbon and oxygen isotopes responses to drought in Mediterranean riparian forests. Forest Ecol Manag. 529, 120710 (2023).
- Huang, R., Xu, C., Grießinger, J., Feng, X., Zhu, H., Bräuning, A. Rising utilization of stable isotopes in tree rings for climate change and forest ecology. JForestry Res. 35, 13 (2024).
- Schneider, L., Gärtner, H. Additive manufacturing for lab applications in environmental sciences: pushing the boundaries of rapid prototyping. Dendrochronologia. 76, 126015 (2022).
- Björklund, J., et al. Scientific merits and analytical challenges of tree-ring densitometry. Rev Geophys. 57, 1224-1264 (2019).
- Katzenmaier, M., Garnot, V. S. F., Björklund, J., Schneider, L., Wegner, J. D., von Arx, G. Towards ROXAS AI: Deep learning for faster and more accurate conifer cell analysis. Dendrochronologia. 81, 126126 (2023).
- Gärtner, H., Lucchinetti, S., Schweingruber, F. H. A new sledge microtome to combine wood anatomy and tree-ring ecology. IAWA J. 36 (4), 452-459 (2015).
- Gärtner, H., et al. A technical perspective in modern tree-ring research - how to overcome dendroecological and wood anatomical challenges. J Vis Exp. 97 (e52337), (2015).
- Gärtner, H., Banzer, L., Schneider, L., Schweingruber, F. H., Bast, A. Preparing micro sections of entire (dry) conifer increment cores for wood anatomical time-series analyses. Dendrochronologia. 34, 19-23 (2015).
- Gärtner, H., Schneider, L., Lucchinetti, S., Cherubini, P. Advanced workflow for taking high-quality increment cores - new techniques and devices. J Vis Exp. (193), e64747 (2023).
- Wang, X. Acoustic measurements on trees and logs: a review and analysis. Wood Sci Technol. 47, 965-975 (2013).
- Steenkamp, C. J., Van Rooyen, M. W., Van Rooyen, N. A non-destructive sampling method for dendrochronology in hardwood species. South Afr For J. 186, 5-7 (1999).
- Toole, E. R., Gammage, J. L. Damage from increment borings in bottomland hardwoods. J For. 57, 909-911 (1959).
- Grissino-Mayer, H. D. A manual and tutorial for the proper use of an increment borer. Tree-Ring Res. 59 (2), 63-79 (2003).
- Griffin, D., et al. Gigapixel macro photography of tree rings. Tree-Ring Res. 77, 86-94 (2021).
- . LINTAB-Precision ring by ring Available from: https://rinntech.info/products/lintab/ (2003)
- . Regent Instruments Available from: https://regentinstruments.com (2024)
- De Micco, V., et al. Intra-annual density fluctuations in tree rings: How, when, where, and why. IAWA J. 37, 232-259 (2016).
- Edwards, J., et al. Intra-annual climate anomalies in northwestern North America following the 1783-1784 CE Laki eruption. J Geophys Res Atmos. 126, e2020JD033544 (2020).
- Levanič, T. ATRICS-A new system for image acquisition in dendrochronology. Tree-Ring Res. 63 (2), 117-122 (2007).
- García-Hidalgo, M., et al. CaptuRING: A do-it-yourself tool for wood sample digitization. Methods Ecol Evol. 13 (6), 1185-1191 (2022).
- Rodriguez, D. R. O., et al. Exploring wood anatomy, density and chemistry profiles to understand the tree-ring formation in Amazonian tree species. Dendrochronologia. 71, 125915 (2022).
- Gärtner, H., Farahat, E. Cambial activity of Moringa peregrina (Forssk.) Fiori in arid environments. Front Plant Sci. 12, 760002 (2021).
- Gärtner, H., Lucchinetti, S., Schweingruber, F. H. New perspectives for wood anatomical analysis in dendrosciences: the GSL1-microtome. Dendrochronologia. 32, 47-51 (2014).
- Maeglin, R. R. . Increment Cores: How to Collect, Handle, and Use Them (Vol. 25). , (1979).
- Agee, J. K., Huff, M. H. . The Care and Feeding of Increment Borers. , (1986).
- Phipps, R. L., , . . Collecting, Preparing, Crossdating, and Measuring Tree Increment Cores (No. 85-4148). , (1985).
- Cole, D. M. . Protection and Storing Increment Cores in Plastic Straws. 216, (1977).
- Rossi, S., Anfodillo, T., Menardi, R. Trephor: a new tool for sampling microcores from tree stems. IAWA J. 27 (1), 89-97 (2006).
- Schneider, L., Gärtner, H. The advantage of using a starch based non-Newtonian fluid to prepare micro sections. Dendrochronologia. 31, 175-178 (2013).
- Gärtner, H., Nievergelt, D. The core-microtome: A new tool for surface preparation on corse and time series analysis of varying cell parameters. Dendrochronologia. 28 (2), 85-92 (2010).
- McCarroll, D., Pettigrew, E., Luckman, A., Guibal, F., Edouard, J. L. Blue reflectance provides a surrogate for latewood density of high-latitude pine tree rings. Arct Antarct Alp Res. 34 (4), 450-453 (2002).
- Björklund, J., Seftigen, K., Kaczka, R. J., Rydval, M., Wilson, R. A standard definition and terminology for Blue Intensity from conifers. Dendrochronologia. 85, 126200 (2024).
- Van den Bulcke, J., et al. Advanced X-ray CT scanning can boost tree ring research for earth system sciences. Ann Bot. 124 (5), 837-847 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved