Ecosistema modello basato sull'agarosio per la coltivazione di metanotrofi in un gradiente contatore metano-ossigeno
In This Article
Summary
Viene descritto un protocollo per la preparazione di un semplice ecosistema modello che ricrea il gradiente di contrasto metano-ossigeno presente nell'habitat naturale dei batteri aerobi ossidanti il metano, consentendo lo studio della loro fisiologia in un contesto spazialmente risolto. Vengono inoltre descritte le modifiche ai comuni saggi biochimici per l'uso con l'ecosistema modello basato sull'agarosio.
Abstract
I batteri aerobici che ossidano il metano, noti come metanotrofi, svolgono un ruolo importante nel ciclo biogeochimico. I metanotrofi occupano una specifica nicchia ambientale all'interno dei gradienti contatore metano-ossigeno presenti nei suoli e nei sedimenti, che influenza il loro comportamento a livello individuale e comunitario. Tuttavia, i metodi convenzionali per studiare la fisiologia di questi microrganismi che mitigano i gas serra spesso utilizzano colture planctoniche omogenee, che non rappresentano accuratamente i gradienti spaziali e chimici presenti nell'ambiente. Ciò ostacola la comprensione da parte degli scienziati di come questi batteri si comportano in situ. Qui viene descritto un ecosistema modello semplice ed economico chiamato siringa a gradiente, che utilizza l'agarosio semisolido per ricreare i ripidi gradienti di contatore metano-ossigeno caratteristici degli habitat naturali dei metanotrofi. La siringa a gradiente consente la coltivazione di ceppi metanotrofici e l'arricchimento di consorzi misti metano-ossidanti da campioni ambientali, rivelando fenotipi visibili solo in questo contesto spazialmente risolto. Questo protocollo riporta anche vari saggi biochimici che sono stati modificati per essere compatibili con la matrice semisolida di agarosio, che possono essere preziosi per i ricercatori che coltivano microrganismi all'interno di altri sistemi a base di agarosio.
Introduction
I microrganismi che vivono in un'interfaccia anossico-ossica spesso svolgono importanti ruoli ecologici1. Un esempio sono i batteri aerobici che ossidano il metano (metanotrofi), che esistono in gradienti contrari di metano e ossigeno nei suoli e nei sedimenti2. Questi microrganismi possiedono caratteristiche metaboliche e fisiologiche uniche che consentono loro di sfruttare i gradienti di gas presenti nei loro ambienti e sono stati oggetto di ricerche in corso per decenni 3,4,5. Attualmente, la maggior parte delle ricerche pubblicate sui metanotrofi e sulle comunità metano-ossidanti si basa sul lavoro con colture planctoniche omogenee che spesso non riescono a catturare i gradienti spaziali e chimici che sono inerenti ai loro habitat microbici naturali. Questa limitazione ostacola la nostra comprensione della fisiologia microbica e la nostra capacità di collegare le informazioni genomiche ai tratti fenotipici.
Questo protocollo riporta un semplice ecosistema modello basato su laboratorio che crea condizioni riproducibili per lo studio sia di metanotrofi specifici, come il ceppo LW13 di Methylomonas sp., sia delle comunità ossidanti del metano direttamente da campioni ambientali del suolo. È importante sottolineare che la coltivazione nella siringa a gradiente produce fenotipi specifici del controgradiente che non sono presenti nelle colture planctoniche omogenee6, evidenziando la capacità del sistema di svelare nuovi aspetti della fisiologia del metanotrofio. Ispirata agli ecosistemi modello 7,8,9 precedentemente pubblicati, la siringa a gradiente è un metodo semplificato che può essere utilizzato per raccogliere informazioni chimiche e molecolari da microrganismi coltivati utilizzando questo approccio.
Le procedure riportate per le analisi genetiche, chimiche e molecolari sono state modificate per funzionare in modo affidabile su colture microbiche coltivate all'interno di una matrice di agarosio semisolida. Queste procedure possono essere utili anche per analizzare i batteri cresciuti in altri sistemi semisolidi a base di agarosio, come quelli utilizzati per i saggi di nuoto batterico con agar morbido. L'adattamento di queste analisi a contesti spazialmente risolti può aprire nuove strade per lo studio della vita microbica in ambienti più rilevanti dal punto di vista ecologico.
Protocol
I dettagli dei reagenti e delle attrezzature utilizzate nello studio sono elencati nella tabella dei materiali.
1. Preparazione ed estrusione di siringhe a gradiente
NOTA: La preparazione della siringa a gradiente deve essere eseguita utilizzando una tecnica sterile.
- Utilizzare diverse colonie di Methylomonas sp. LW13 appena coltivato su una piastra per inoculare 6 mL di terreno di sali minerali nitrati (NMS) in una provetta di vetro da 18 mm x 150 mm. Sigillare la provetta con un tappo di siero e un sigillo a crimpare in alluminio e aggiungere metano utilizzando una siringa fino a un'atmosfera finale di metano al 50% (v/v) nell'aria. Agitare questa coltura liquida planctonica a 200 giri/min a temperatura ambiente fino a quando non si torbida (circa un giorno).
- Passaggio di colture liquide 1:10 in terreni freschi. Continuare a coltivare colture liquide di metanotrofi fino alla crescita in fase logaritmica (OD600 di ~0,5) e regolare a un OD600 = 1,0.
- Preparare le siringhe rimuovendo lo stantuffo in dotazione e conservandole in un contenitore sterile. Collegare un puntale con filtro sterile in PTFE alla siringa e posizionarlo in un rack per provette standard con la punta rivolta verso il basso.
- Per ogni siringa da 10 mL, miscelare accuratamente 1 mL di cellule del passaggio 1.2 con 5 mL di NMS e 4 mL di agarosio fuso (0,5% m/v, raffreddato a 55 °C) in una provetta conica sterile. Questi volumi possono essere aumentati per riempire più siringhe in parallelo.
- Versare lentamente o utilizzare una pipetta sierologica per aggiungere la miscela a ciascuna siringa, fino alla marcatura di 8 ml. Lasciare solidificare l'agarosio all'interno delle siringhe (~15 min), quindi tappare con un tappo di gomma butilico sterile da 20 mm. Fissare il tappo alla siringa con del nastro adesivo da laboratorio ed etichettarla con il contenuto della siringa.
- Per aggiungere metano allo spazio di testa della siringa, riempire una siringa grande (60 ml) con 100% CH4 e collegare un puntale del filtro in PTFE (0,2 μm, 25 mm) collegato a un ago sterile (23 G). Forare il tappo di gomma con la siringa grande e forare un secondo ago sterile attraverso il tappo per creare un'uscita del gas.
- Premere lo stantuffo della siringa grande per consentire a 20 mL di 100% CH4 di fluire attraverso lo spazio di testa, avendo cura di rimuovere l'ago di uscita quando sono rimasti 1-2 mL di CH4 nella siringa grande per evitare il riflusso di ossigeno attraverso l'ago di uscita.
- Incubare le siringhe a 18 °C, ripetendo i passaggi 1.6 e 1.7 ogni giorno per reintegrare il metano.
- Per estrudere l'agarosio, sostituire la punta del filtro in PTFE con un ago sterile da 23 G e sostituire il tappo di gomma con lo stantuffo della siringa in dotazione. Premere lentamente lo stantuffo per erogare incrementi di 1 mL in provette sterili per microcentrifuga separate da 1,5 mL.
2. Determinazione delle concentrazioni di gas in controgradiente
- Misurazione del gradiente di ossigeno disciolto
- Utilizzare una lama di rasoio per tagliare la larghezza di una siringa riempita di agarosio (preparata seguendo i passaggi 1.1-1.8) vicino al filtro in PTFE. Fissare la siringa aperta a una pompa a siringa orientata verso un microelettrodo di tipo Clark, con l'estremità aperta rivolta verso la punta dell'elettrodo.
- Regolare le impostazioni della pompa a siringa per spostare la siringa verso il microelettrodo a una velocità di 1 mL/min (0,6 cm/min); iniziare a registrare le misurazioni dell'ossigeno disciolto sul software Unisense Logger non appena la pompa a siringa inizia a muoversi.
- Misurazione del gradiente di metano
- Immediatamente prima dell'estrusione, sostituire la punta del filtro della siringa con un rubinetto unidirezionale collegato a un ago da 23 G e sostituire rapidamente il tappo di gomma con uno stantuffo della siringa. Aggiungere otto aliquote di agarosio da 1 mL per separare le fiale a tenuta di gas da 12 mL evacuate e lasciare che i campioni si equilibrino a temperatura ambiente per 1 ora.
- Equilibrare le fiale dei campioni alla pressione atmosferica aprendo e richiudendo immediatamente le fiale o forando e rimuovendo rapidamente un ago. Iniettare 500 μl di spazio di testa della fiala in un gascromatografo con rilevamento a ionizzazione di fiamma (GC-FID) utilizzando una siringa a tenuta di gas. Creare una curva di calibrazione derivata dagli standard CH4 per convertire l'area del picco (pA*min) in μmol/L.
3. Conteggio delle cellule nella siringa a gradiente
- Citometria a flusso
- Estrudere 1 mL di segmenti di agarosio da siringhe a gradiente inoculate con LW13 wild-type o mutante, come descritto al punto 1.9. Inoltre, preparare ed estrudere l'agarosio da una siringa sterile priva di cellule come controllo negativo.
- Aggiungere 0,75 mL di NaCl allo 0,85% (m/v) in acqua a tutti i campioni di agarosio estrusi e omogeneizzare mediante vortex. Inoltre, diluire i campioni 1:10 trasferendo 100 μl in una nuova provetta da microcentrifuga e aggiungendo 900 μl della soluzione salina.
- Aggiungere 3 μl di una miscela 1:1 di SYTO9 e coloranti di ioduro di propidio, quindi incubare al buio a temperatura ambiente per 15 minuti. Per determinare le cellule per mL di agarosio, sonicare la sospensione di microsfere in un bagno d'acqua per 5 minuti. Quindi, aggiungere 10 μl di sospensione a ciascun campione prima dell'analisi di citometria a flusso.
- Analizzare i campioni con un citometro a flusso10,11 con i seguenti parametri: attivazione su fluorescenza verde, velocità di flusso di 10 μL/s e velocità di analisi delle particelle inferiore a 1.000 particelle/s.
- Confronta SSC con SSC Grafici a punti FITC tra campioni di controllo privi di cellule e campioni di agarosio inoculati per disegnare gate di tensione di "evento batterico" che escludono le particelle di agarosio di fondo. Inoltre, disegnare le porte di tensione per le microsfere di conteggio delle microsfere, che dovrebbero essere coerenti tra i campioni.
- Per determinare la concentrazione di cellule in ciascun segmento di agarosio all'interno della siringa a gradiente, utilizzare la seguente equazione, notando che il fattore di diluizione per il protocollo di cui sopra è 17,7275 e che 10-6 mL è il volume di una microsfera.
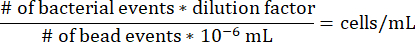
- Conteggio delle unità formanti colonie all'interno della siringa a gradiente
- Estrudere 1 mL di segmenti di agarosio in provette per microcentrifuga separate e sterili da 2 mL, aggiungere 800 μL di NMS e agitare per 10 s per facilitare il pipettaggio.
- Preparare una piastra sterile a 96 pozzetti aggiungendo 180 μl di NMS a ciascun pozzetto. Aggiungere 20 μl di campioni di agarosio diluiti a ciascun pozzetto della prima colonna e pipettare per miscelare.
- Utilizzando una pipetta multicanale, diluire in serie i campioni di dieci volte trasferendo 20 μl dalla prima fila di pozzetti alla seconda fila di pozzetti e pipettando 10 volte per miscelare. Continuate questo processo fino all'ultima fila del piatto.
- Etichettare le piastre a griglia quadrata contenenti agar NMS o terreni a scelta. Utilizzando una pipetta multicanale, individuare 5 μl da una colonna della piastra a 96 pozzetti sulla piastra di agar. A seconda delle dimensioni della piastra di agar, è possibile individuare più colonne sulla stessa piastra.
- Incubare le piastre sotto il 40% di metano nell'aria e farle crescere a 18 °C. Contare le colonie batteriche dopo 2-3 giorni e determinare le unità formanti colonie per millilitro (CFU/mL).
4. Saggi di rilevamento di biomolecole
- Saggio dei polisaccaridi
- Estrudere 1 mL di segmenti di agarosio in provette per microcentrifuga separate da 2 mL e miscelare con 1 mL di una soluzione di Na2CO3 all'1% (m/v) in acqua. Riscaldare i campioni a 80 °C per 30 minuti con vortice ogni 5-10 minuti, seguito da centrifugazione a 4.000 x g a 4 °C per 20 minuti.
- Raccogliere il surnatante combinato con tre volumi di etanolo al 100% e incubare a 20 °C per almeno 2 ore (o durante la notte).
- Raccogliere i polisaccaridi precipitati con etanolo mediante centrifugazione a 16.100 x g a 4 °C per 30 minuti. Rimuovere il surnatante e asciugare il pellet all'aria. Risospendere il pellet in 100 μL di acqua deionizzata.
- Misurare il contenuto relativo di polisaccaridi di ciascun segmento di agarosio utilizzando un test colorimetrico dell'acido fenolo-solforico12,13. Combinare 50 μl di estratto risospeso con 150 μl di acido solforico concentrato e 30 μl di fenolo al 5% (v/v) in acqua in una piastra trasparente a 96 pozzetti.
- Misurare l'assorbanza a 490 nm utilizzando un lettore di micropiastre e calcolare il contenuto relativo di polisaccaridi di ciascun segmento di agarosio come percentuale dell'assorbanza del segmento di agarosio più vicino al filtro in PTFE.
- Dosaggio delle proteine
- Estrudere l'agarosio in provette per microcentrifuga separate da 1,5 mL e trasferire 100 μL di ciascuna aliquota in provette di vetro.
- Determinare la concentrazione totale di proteine utilizzando il protocollo in provetta di un kit per il dosaggio delle proteine BCA. Preparare l'albumina BSA standard con agarosio estruso da una siringa sterile come diluente.
- Saggio del DNA extracellulare
- Estrudere l'agarosio in provette per microcentrifuga separate da 1,5 mL e trasferire 20 μl di ciascuna in provette per microcentrifuga da 0,2 mL.
- Misura le concentrazioni di DNA utilizzando il kit di test ad alta sensibilità 1x dsDNA disponibile in commercio seguendo il protocollo del produttore.
5. Estrazione dell'RNA
- Preparare il tampone di estrazione combinando quanto segue in 800 mL di acqua priva di RNasi: 2,0 g di CTAB, 2,0 g di polivinilpirrolidone (PVP 40), 81,8 g di NaCl, 100 mM di Tris-HCl (pH 8,0) e 20 mM di EDTA. Portare il volume a 1 L e sterilizzare in autoclave; conservare a 4 °C.
- Aliquotare il tampone di estrazione preparato e aggiungere l'1% (v/v) di concentrazione finale di beta-mercaptoetanolo appena prima dell'uso. Riscaldare il tampone a 65 °C con un bagnomaria o un blocco termico.
- Dividere ogni siringa a gradiente in sezioni da 1 mL estrudendo l'agarosio in provette per microcentrifuga da 2 mL separate prive di RNasi seguendo la procedura descritta al punto 1.9.
- Centrifugare i campioni a 21.000 x g, 4 °C, per 15 minuti e scartare il surnatante, mantenendo i campioni in ghiaccio.
- Aggiungere 600 μl di tampone di estrazione preriscaldato a ciascun 1 mL pellettato di agarosio estruso. Aggiungere circa 200 μl di perle di zirconia/silice e omogeneizzare i campioni per 3 minuti a 30 Hz/s utilizzando un frusta per microlinee, fermandosi a metà per posizionare i campioni sul ghiaccio per 2 minuti.
- Centrifugare i campioni a 15.000 x g, 4 °C, per 2 minuti per ridurre la formazione di schiuma. Estrarre i campioni aggiungendo 600 μL di cloroformio: alcol isoamilico (24:1) alle provette e agitare per 10 s.
- Centrifugare i campioni a 15.000 x g, 4 °C, per 8 minuti. Trasferire con cautela la fase acquosa superiore in una nuova provetta da microcentrifuga priva di RNasi e aggiungere 600 μL di cloroformio: alcol isoamilico (24:1) alla fase superiore trasferita e vortice per 10 s.
- Centrifugare i campioni a 15.000 x g, 4 °C, per 8 minuti e trasferire la nuova fase acquosa superiore in una nuova provetta per microcentrifuga priva di RNasi. Aggiungere un volume uguale di isopropanolo alla fase superiore trasferita e incubare i campioni per diverse ore a -20 °C. Opzionale: i campioni possono essere lasciati a -20 °C per una notte.
- Raccogliere precipitati contenenti RNA centrifugando i campioni a 16.100 x g, 4 °C per 30 minuti.
- Scartare il surnatante e lavare il pellet con 300 μL di etanolo freddo al 75% (v/v) prodotto con acqua priva di RNasi e centrifugare a 16.100 x g, 4 °C, per 5 minuti.
- Lavare nuovamente il pellet seguendo il passaggio 5.10.
- Dopo aver rimosso il surnatante di etanolo, lasciare asciugare i pellet all'aria per 15 minuti. Sciogliere i pellet in 100 μL di acqua priva di RNasi.
- Trattare i campioni con DNasi I a 37 °C per 30 minuti seguendo il protocollo del produttore.
- Inattivare la DNasi I aggiungendo 300 μL di fenolo acido: cloroformio: IAA (125:24:1, pH 4,5). Vorticare per 10 s e incubare a temperatura ambiente per 5 min.
- Centrifugare a 16.100 x g, 4 °C, per 5 minuti e mantenere la fase acquosa superiore trasferendola in una nuova provetta per microcentrifuga priva di RNasi.
- Opzionale: raggruppare l'RNA dello stesso segmento in tutte le siringhe replicate combinando le fasi superiori in un tubo conico.
- Aggiungere 1 volume di isopropanolo pari al volume della fase superiore contenente RNA e aggiungere 7,5 M di LiCl ad una concentrazione finale di 0,8 M, invertendo più volte per mescolare.
- Incubare i campioni per diverse ore a -20 °C. Opzionale: i campioni possono essere lasciati a -20 °C per una notte.
- Centrifugare i campioni a 16.100 x g, 4 °C, per 15 minuti ed eliminare con cura il surnatante. Lavare due volte il pellet contenente RNA aggiungendo etanolo freddo al 70% (v/v) in acqua priva di RNasi, centrifugando a 16.100 x g, 4 °C, per 5 minuti e rimuovendo il surnatante.
- Lasciare asciugare i pellet all'aria a temperatura ambiente per 10 minuti e riproporli in 50 μL di acqua priva di RNasi. Conservare i campioni di RNA a -80 °C.
- Opzionale, a seconda della qualità dell'RNA: i campioni possono essere ripurificati utilizzando un kit di purificazione dell'RNA per rimuovere gli RNA piccoli (<200 nt).
- Per confermare che i campioni di RNA non contengono DNA residuo, utilizzare 1 μL di RNA purificato come modello per l'amplificazione della PCR utilizzando i primer genici universali dell'rRNA batterico 16S 27F/1492R. Includere due ulteriori reazioni PCR contenenti 1 μL di DNA genomico (diluito 1:100) o acqua priva di nucleasi per fungere rispettivamente da controlli positivi e negativi.
- Esegui i prodotti su un gel TBE di agarosio all'1% utilizzando l'elettroforesi su gel14.
NOTA: I campioni di RNA senza contaminazione del DNA dovrebbero comportare l'assenza di una banda nella corsia del campione. Se i campioni di RNA mostrano una contaminazione del DNA, riprocessare i campioni a partire dal passaggio 5.13. L'RNA è pronto per l'analisi a valle e può essere analizzato per quantificarne l'integrità misurando il numero di integrità dell'RNA (RIN).
Representative Results
In questo caso, l'ecosistema del modello a siringa a gradiente è stato utilizzato per coltivare un singolo ceppo (il metanotropo Methylomonas sp. ceppo LW13) (Figura 1A)6, ma può anche essere utilizzato per arricchire una comunità microbica ossidante il metano mediante inoculazione diretta del suolo (Figura 1B). La presenza di un gradiente contatore metano-ossigeno è stata convalidata misurando la concentrazione di metano e ossigeno in siringhe libere da cellule e inoculate (Figura 1C). Per le siringhe a gradiente inoculate con LW13, si è formato un controgradiente entro un giorno dal lavaggio della siringa, che si è irripidato in tre giorni di incubazione. Nello stesso periodo di tempo, si è formata una banda orizzontale alla stessa profondità alla quale entrambi i substrati gassosi hanno raggiunto le loro concentrazioni più basse (Figura 1A). Il ripido gradiente di gas e l'esaurimento del metano e dell'ossigeno oltre la profondità della banda orizzontale hanno mostrato che LW13 metabolizza aerobicamente il metano e produce un fenotipo non osservato in colture planctoniche omogenee. Questo fenotipo è prodotto anche da altri batteri metanotrofi isolati dallo stesso campione ambientale di LW136. La variazione dipendente dalla deformazione nei tempi e nella profondità dello sviluppo della banda orizzontale tra diversi ceppi metanotrofici ha suggerito che la banda orizzontale era influenzata dal comportamento specifico di ciascun microbo quando coltivato in un contesto spazialmente risolto6.
Il numero di cellule nell'intero tappo di agarosio è stato misurato utilizzando la citometria a flusso e la conta delle colonie (UFC/mL) (Figura 2A). Questo metodo è stato utilizzato per confrontare la distribuzione cellulare e la sopravvivenza di LW13 wild-type con un ceppo mutante di LW13 contenente una delezione nel gene fucoso 4-O-acetiltransferasi (OAT), che in precedenza aveva dimostrato di influenzare lo sviluppo della banda orizzontale6. Il mutante ΔOAT di LW13 ha avuto una crescita complessiva inferiore nella siringa a gradiente nell'arco di 6 giorni rispetto al wild-type, un effetto che non è stato osservato in colture planctoniche omogenee degli stessi ceppi6. Il ceppo mutante non formava la stessa banda orizzontale distinta del tipo selvatico LW13 quando coltivato nella siringa a gradiente (Figura 2B). Il numero di cellule e l'aspetto della banda orizzontale sono stati ripristinati a livelli simili al tipo selvatico dopo la complementazione genica nel ceppo mutante. Questi risultati dimostrano che la siringa a gradiente può essere utilizzata per collegare i geni a fenotipi specifici presenti solo nel gradiente contatore metano-ossigeno.
Una varietà di tecniche genetiche, chimiche e molecolari sono state adattate per l'uso con batteri cresciuti all'interno di una matrice di agarosio semisolida. L'ecosistema del modello di siringa a gradiente può essere facilmente utilizzato per saggi di quantificazione biomolecolare standard con l'inclusione dell'agarosio non inoculato come controllo negativo. È stata misurata la concentrazione di tre diverse biomolecole che si trovano comunemente nelle sostanze polimeriche extracellulari e nei biofilm: polisaccaridi, proteine e DNA extracellulare15 (Figura 3). Nei segmenti della siringa inoculati con LW13, la banda orizzontale aveva significativamente più polisaccaridi rispetto ad altri segmenti, senza alcun aumento significativo delle proteine o del DNA extracellulare.
L'RNA-seq è stato utilizzato per misurare le differenze trascrizionali in LW13 che cresce a diverse profondità della siringa. L'estrazione robusta dell'RNA è stata ottenuta utilizzando un tampone di estrazione basato su CTAB seguito da fenolo convenzionale: estrazione del cloroformio e fasi di precipitazione. I risultati dell'analisi RNA-seq sono stati successivamente utilizzati per identificare i geni implicati nella produzione della banda orizzontale dei polisaccaridi. Questi risultati indicano che l'agarosio semisolido, essenziale per la creazione di un ecosistema modello spazialmente risolto, non impedisce ulteriori analisi biochimiche che sono generalmente riservate alle colture planctoniche e basate su piastre.
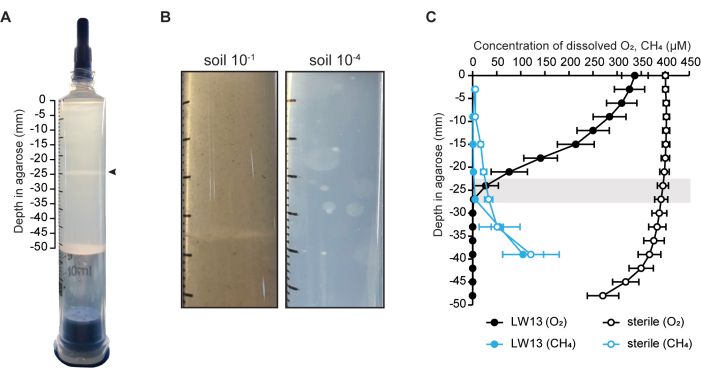
Figura 1: L'ecosistema del modello di siringa a gradiente. (A) La siringa a gradiente inoculata con il metanotropo Methylomonas sp. Una banda orizzontale distinta (punta di freccia) si sviluppa entro due giorni dal lavaggio della siringa con metano al 100%. (B) Foto ravvicinate di siringhe a gradiente inoculate con terriccio diluito 10-1 e 10-4 e incubate per due settimane. Le siringhe a gradiente contenenti più terreno diluito hanno prodotto colonie sferiche in tutto l'agarosio, mentre gli inoculi del suolo più concentrati hanno portato a una banda distinta. (C) Caratterizzazione del gradiente contatore metano-ossigeno in siringhe a gradiente sterile e inoculate con LW13 dopo tre giorni di incubazione. La barra grigia indica l'intervallo di profondità a cui si trovava la banda polisaccaridica; i dati mostrano la media ± SD di tre esperimenti indipendenti con tre repliche tecniche ciascuno. I pannelli (A) e (C) sono stati modificati da Beals et al.6. Clicca qui per visualizzare una versione più grande di questa figura.
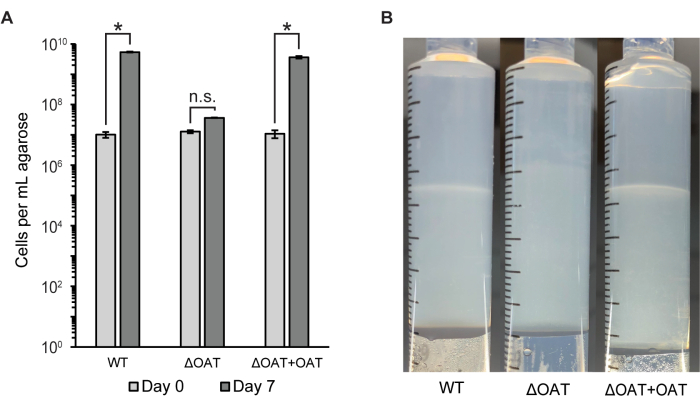
Figura 2: Quantificazione di LW13 wild type e mutante dopo l'incubazione nella siringa a gradiente. (A) Il numero totale di cellule LW13 per mL di agarosio estruso recuperato da siringhe a gradiente il giorno 0 e il giorno 7 misurato mediante citometria a flusso. ΔOAT contiene una delezione del gene fucoso 4-O-acetiltransferasi, che è risultato essere altamente espresso nelle cellule situate alla profondità della banda polisaccaridica. ΔOAT+OAT contiene il gene OAT inserito in una posizione distale del genoma ΔOAT. *, significativamente diverso ( t-test eteroschedastico a due code, α = 0,05); n.s., non significativamente diverso. I dati mostrano la media ± SD di tre esperimenti indipendenti con due repliche tecniche ciascuno. (B) Sviluppo di bande orizzontali in siringhe a gradiente inoculate con LW13 wild type, ΔOAT o ΔOAT+OAT dopo sette giorni di incubazione. Questa cifra è stata modificata da Beals et al.6. Clicca qui per visualizzare una versione più grande di questa figura.
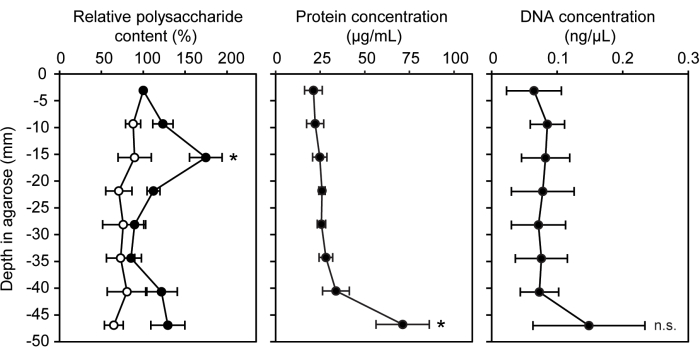
Figura 3: Quantificazione di biomolecole a profondità crescenti della siringa a gradiente. Contenuto relativo di polisaccaridi (%), concentrazione proteica (μg/mL) e concentrazione di DNA (ng/μL) in otto sezioni di siringhe a gradiente inoculate con LW13 incubate per sette giorni (cerchi pieni; i cerchi aperti mostrano i valori delle siringhe sterili a gradiente). I dati mostrano la media ± SD di tre esperimenti indipendenti con tre repliche tecniche ciascuno. Per il contenuto relativo di polisaccaridi, * indica una differenza significativa rispetto al controllo sterile a profondità equivalente ( test t eteroschedastico a due code, α = 0,05). Per le concentrazioni di proteine e DNA, * indica una differenza significativa rispetto alla sezione contenente la banda orizzontale (ANOVA unidirezionale con analisi post hoc di Tukey-Kramer); n.s., non significativo. La cifra è stata modificata da Beals et al.6. Clicca qui per visualizzare una versione più grande di questa figura.
Discussion
Metodi per la coltivazione del metanotropo
I metanotrofi sono stati studiati per decenni per comprendere la loro fisiologia, il loro comportamento individuale e comunitario nell'ambiente naturale e il loro potenziale per la mitigazione del metano nelle applicazioni industriali. Nel corso di questi studi, gran parte della ricerca condotta è stata eseguita utilizzando colture planctoniche omogenee in cui il contesto spaziale è perso. L'ecosistema modello di siringa a gradiente è stato sviluppato per replicare il gradiente contatore metano-ossigeno caratteristico degli habitat metanotrofi naturali in laboratorio, consentendo ai ricercatori di studiare i metanotrofi che crescono in un ambiente che assomiglia più da vicino a dove si sono evoluti questi organismi.
Negli ultimi 30 anni, i ricercatori hanno ricreato il gradiente contatore metano-ossigeno in laboratorio utilizzando una varietà di metodi, spesso con l'obiettivo primario di isolare e classificare metanotrofi da consorzi misti metano-ossidanti. Questi metodi possono essere suddivisi in due approcci, entrambi che prevedono l'uso di camere opposte di metano e ossigeno: sospendere il terreno relativamente indisturbato su una membrana 16,17,18, o inoculare piccole quantità di terreno o coltura batterica pura in un mezzo minimo in agarosio 7,8,19. Il metodo della siringa a gradiente qui descritto combina l'approccio basato su siringa di Dedysh e collaboratori9 con la coltivazione di metanotrofi da lavori precedenti di Amaral e Knowles8 e Schink e collaboratori7. L'ultimo di questi metodi ha gettato le basi per la coltivazione di metanotrofi in un gradiente contatore metano-ossigeno e ha utilizzato un flusso continuo di metano e ossigeno su entrambi i lati del tappo di agarosio. Sebbene ciò fornisca un ambiente più costante, questo approccio aggiunge complessità alla configurazione sperimentale e richiede fonti di gas dedicate.
Al contrario, la siringa a gradiente qui descritta si basa sul lavaggio quotidiano della siringa per fornire metano fresco, un processo che richiede meno di un minuto per siringa, fornendo al contempo un accesso continuo all'ossigeno atmosferico attraverso una punta filtrante sterile in PTFE. Questo metodo più semplice può consentire una più ampia adozione di questo ecosistema modello per lo studio dei metanotrofi in un contesto spazialmente risolto. Il protocollo descritto descrive anche le analisi chimiche e a livello molecolare che possono essere eseguite direttamente sui batteri incubati nell'agarosio semisolido. Di conseguenza, i batteri non devono essere asportati e coltivati al di fuori della matrice di agarosio prima dell'analisi, preservando le condizioni di gradiente di gas al momento del campionamento.
Osservazioni sul protocollo
Poiché i batteri vengono coltivati all'interno di una siringa volumetrica in polipropilene, i ricercatori possono utilizzare lo stantuffo della siringa in dotazione per segmentare in modo accurato e riproducibile il tappo di agarosio, mantenendo l'integrità spaziale della matrice di agarosio che rimane ancora nel cilindro della siringa. Senza il design a tenuta d'aria inerente alla siringa, i tappi di agarosio dovrebbero essere rimossi dal cilindro della siringa e affettati, introducendo incertezza nel volume dei segmenti di agarosio e rilasciando quantità non quantificabili di metano e ossigeno disciolto nell'atmosfera. L'estrusione dell'agarosio attraverso un ago sterile semplifica la preparazione del campione e aiuta a omogeneizzare i segmenti estrusi senza recidere le cellule batteriche. Questo metodo consente ai ricercatori di dividere ogni siringa a gradiente inoculata in almeno otto segmenti di agarosio ed eseguire esperimenti paralleli su metanotrofi che crescono in una gamma di concentrazioni di ossigeno e metano.
Nell'ottimizzare l'estrazione dell'RNA dall'agarosio ad alto contenuto di polisaccaridi, è stato riscontrato che reagenti comuni come il tiocianato di guanidio e il TRIzol portavano alla gelificazione dell'agarosio, che ostruiva le colonne di purificazione e resisteva alla pellettatura mediante centrifugazione. Anche le basse rese e la qualità dell'RNA erano un problema, poiché le grandi molecole di polisaccaridi possono intrappolare gli acidi nucleici, mentre i piccoli polisaccaridi possono co-precipitare con l'RNA20. Invece, è stato utilizzato un tampone di estrazione contenente il tensioattivo cationico CTAB, che solubilizza le membrane lipidiche20; e NaCl, che impedisce la formazione di complessi CTAB-acidi nucleici e consente agli acidi nucleici di precipitare, ma mantiene i polisaccaridi in soluzione21. Le RNasi sono state denaturate mediante l'inclusione di β-mercaptoetanolo nel tampone CTAB. Per l'esperimento RNA-seq, è stata inclusa una fase di purificazione opzionale basata su colonna per escludere piccoli RNA (<200 nucleotidi) prima della preparazione della libreria.
Limitazioni e considerazioni
Mentre l'NMS e l'agarosio forniscono una matrice media minima per la coltivazione di batteri metanotrofi, la siringa a gradiente come descritto qui ricrea solo i gradienti di gas degli habitat metanotrofici, ma non altri gradienti presenti in quegli ambienti come i metalli in tracce22, la salinità23 o altri nutrienti24. È possibile che questi gradienti possano essere aggiunti a un sistema simile in futuro. Inoltre, il volume della siringa (8 mL di agarosio) limita la biomassa totale per siringa, rendendo necessario il raggruppamento di più siringhe per alcune analisi (come descritto al punto 5.16). Sebbene la siringa portatile segmenti convenientemente l'agarosio in aliquote da 1 mL, le sue dimensioni limitano anche lo spazio di testa a circa 4 mL, limitando la quantità di metano che può essere immagazzinato per i microbi coltivati. Poiché i tassi di ossidazione del metano sono proporzionali al tasso di crescita dei metanotrofi aerobici25, si raccomanda il rifornimento giornaliero di metano nello spazio di testa. Sebbene ciò possa ancora comportare periodi di limitazione del metano, questi periodi sono riproducibili in laboratorio e probabilmente imitano situazioni che si trovano negli ambienti naturali.
Durante l'utilizzo della siringa a gradiente, la presenza dei polisaccaridi di agarosio richiede alcuni aggiustamenti ai saggi utilizzati per analizzare i metanotrofi coltivati in questo sistema. Ad esempio, i protocolli che richiedono il trasferimento di piccoli volumi di agarosio estruso necessitano di più fasi di diluizione con un'omogeneizzazione completa tra ogni diluizione per un pipettaggio accurato. Inoltre, in casi come il saggio dei polisaccaridi in cui i polisaccaridi inerenti alla matrice di agarosio reagiscono con il reagente acido solforico-fenolo, è essenziale l'inclusione di un controllo negativo dell'agarosio sterile e privo di cellule. I primi tentativi di mitigare questi problemi includendo l'enzima idrolizzante dell'agarosio β-agarasi non hanno avuto successo e hanno introdotto una variabile sconosciuta negli esperimenti biologici. L'uso di più repliche tecniche, la diluizione accurata, l'omogeneizzazione e l'inclusione di controlli possono essere utilizzati per mitigare la maggior parte delle sfide inerenti alla matrice di agarosio.
Applicazioni
Oltre agli studi su un singolo ceppo, la siringa a gradiente può supportare la co-coltura di più ceppi e il terreno può essere utilizzato come inoculo al posto della coltura batterica pura. Il design semplice dell'ecosistema del modello di siringa a gradiente è suscettibile di coltura di altri tipi di microrganismi che esistono all'interfaccia tra ambienti anossici e ossici utilizzando un substrato di gas diverso, come H2 o CO, al posto del metano. In sintesi, l'uso di un ecosistema modello semplice e spazialmente risolto consente ai ricercatori di studiare la fisiologia unica e gli adattamenti metabolici dei microrganismi anossico-ossici e può essere utilizzato per collegare i geni con i fenotipi degli organismi.
Disclosures
Gli autori dichiarano di non avere conflitti di interesse.
Acknowledgements
Questo lavoro è stato supportato da finanziamenti per l'avvio del Dipartimento di Chimica dell'Università dello Utah e dal NSF CAREER Award #2339190. Ringraziamo i membri del Puri Lab per le utili discussioni. Ringraziamo Rachel Hurrell (Università dello Utah) per la guida iniziale con l'esperimento di citometria a flusso.
Materials
| Name | Company | Catalog Number | Comments |
| 1% Gas mix analytical standard | Supelco | 22561 | 1% each component in nitrogen: carbon monoxide, carbon dioxide, hydrogen, methane and oxygen |
| 100% Methane | Airgas | ME CP300 | chemically pure grade |
| 15 ppm Gas mix analytical standard | Supelco | 23470-U | 15 ppm each component in nitrogen: methane, ethane, ethylene, acetylene, propane, propylene, propyne, and n-butane |
| 1x Nitrate mineral salts | see CAS numbers below | Dissolve the following in Mili-Q water and autoclave: 0.2 g/L MgSO4·7H2O, 0.2 g/L CaCl2·6H2O, 1 g/L KNO3, and 30 μM LaCl3. Before use, add trace elements to a 1X final concentration and phosphate buffer (pH 6.8) to a final concentration of 5.8 mM. | |
| 23 G needle | BD Biosciences | 305194 | sterile, Luer-Lok |
| 500x Trace elements | see CAS numbers below | Dissolve the following in Milli-Q water: 1.0 g/L Na2-EDTA, 2.0 g/L FeSO4·7H2O, 0.8 g/L ZnSO4·7H2O, 0.03 g/L MnCl2·4H2O, 0.03 g/L H3BO3, 0.2 g/L CoCl2·6H2O, 0.6 g/L CuCl2·2H2O, 0.02 g/L NiCl2·6H2O, and 0.05 g/L Na2MoO·2H2O. | |
| 96 Well plate | CELLTREAT | 229596 | sterile |
| Acid phenol:chloroform:IAA (125:24:1) | Invitrogen | AM9720 | pH 4.5 |
| Agarose | Fisher Scientific | BP160 | molecular biology grade, CAS 9012-36-6 |
| Aluminum crimp seals | VWR | 30618-460 | 20 mm |
| Bead beater | Qiagen | 9003240 | TissueLyser III |
| Butyl rubber stopper | Chemglass Life Science | 50-143-854 | 20 mm, blue |
| Chloroform:isoamyl alcohol (24:1) | Millipore Sigma | 25666 | BioUltra, for molecular biology |
| Clark-type O2 microelectrode | Unisense | OX-500 | |
| DEPC-treated water | Thermo Scientific | R0601 | |
| DNase I (Ambion) | Invitrogen | AM2222 | |
| Flow cytometer | Beckman Coulter | CytoFLEX | |
| Gas chromatograph (flame ionization detection) | Agilent | 6890N | |
| Gastight analytical syringe | Hamilton | 81220 | 1750 TLL |
| Gastight analytical syringe needle | Hamilton | 7729-07 | 22 G, metal hub needle, 2 in, point style 5 |
| Gas-tight vials | Labco | 938W | Exetainer vial: 12 mL, round bottom |
| Glass culture tubes | Bellco Glass | 2048-00150 | 18 x 150 mm |
| LiCl precipitation solution (7.5 M) | Invitrogen | AM9480 | |
| One-way stopcock | VWR | MFLX30600-00 | inlet port: female luer, outlet port: male luer lock |
| Petri dish, square | Fisher Scientific | FB0875711A | 100 x 100 mm |
| Phosphate buffer, 0.2 M (pH 6.8) | see CAS numbers below | Dissolve the following in Milli-Q water and autoclave: 12.24 g/L KH2PO4, 26.29 g/L Na2HPO4 · 7H2O | |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23225 | |
| PTFE syringe filter tip | Thermo Scientific | 03-050-469 | hydrophobic, pore size: 0.2 µm, diameter: 4 mm |
| Qubit 1x dsDNA High Sensitivity Assay Kit | Invitrogen | Q33230 | |
| Qubit 4 Fluorometer | Invitrogen | Q33238 | |
| RNA Clean & Concentrator-5 | Zymo Research | R1013 | |
| Serum stopper | Fisher Scientific | 03-340-302 | 20 mm |
| Syringe | BD Biosciences | 302995 | Luer-Lock, 10 mL, single use, sterile |
| Syringe pump | New Era Pump Systems Inc. | 1000-US | NE-1000 one channel programmable |
| SYTO9, propidium iodide, microspheres | Invitrogen | L34856 | LIVE/DEAD BacLight Bacterial Viability Kit |
| Zirconia/silica beads | BioSpec Products | 11079101z | 0.1 mm diameter |
| Chemical reagents | CAS number | ||
| CaCl2·6H2O | 7774-34-7 | ||
| CoCl2·6H2O | 7791-13-1 | ||
| Concentrated sulfuric acid | 7664-93-9 | ||
| CTAB, cetrimonium bromide | 57-09-0 | ||
| CuCl2·2H2O | 10125-13-0 | ||
| Ethanol | 64-17-5 | ||
| FeSO4·7H2O | 7782-63-0 | ||
| H3BO3 | 10043-35-3 | ||
| Isopropanol | 69-63-0 | ||
| KH2PO4 | 7778-77-0 | ||
| KNO3 | 7757-79-1 | ||
| LaCl3 | 10099-58-8 | ||
| MgSO4·7H2O | 10034-99-8 | ||
| MnCl2·4H2O | 13446-34-9 | ||
| Na2CO3, sodium carbonate | 497-19-8 | ||
| Na2-EDTA | 139-33-3 | ||
| Na2HPO4 · 7H2O | 7782-85-6 | ||
| Na2MoO·2H2O | 10102-40-6 | ||
| NaCl, sodium chloride | 7647-14-5 | ||
| NiCl2·6H2O | 7791-20-0 | ||
| Phenol (90% solution in water) | 108-95-2 | ||
| PVP40, polyvinylpyrrolidone | 9003-39-8 | ||
| Tris-HCl | 1185-53-1 | ||
| ZnSO4·7H2O | 7446-20-0 | ||
| β-Mercaptoethanol | 60-24-2 |
References
- Brune, A., Frenzel, P., Cypionka, H. Life at the oxic-anoxic interface: microbial activities and adaptations. FEMS Microbiol Rev. 24 (5), 691-710 (2000).
- Auman, A. J., Stolyar, S., Costello, A. M., Lidstrom, M. E. Molecular characterization of methanotrophic isolates from freshwater lake sediment. Appl Environ Microbiol. 66 (12), 5259-5266 (2000).
- Whittenbury, R., Phillips, K. C., Wilkinson, J. F. Enrichment, isolation and some properties of methane-utilizing bacteria. J Gen Microbiol. 61 (2), 205-218 (1970).
- Koo, C., Rosenzweig, A. Biochemistry of aerobic biological methane oxidation. Chem Soc Rev. 50 (5), 3424-3436 (2021).
- Strong, P. J., Xie, S., Clarke, W. P. Methane as a resource: Can the methanotrophs add value. Environ Sci Technol. 49 (7), 4001-4018 (2015).
- Beals, D. G., Puri, A. W. Linking methanotroph phenotypes to genotypes using a simple spatially resolved model ecosystem. ISME J. 18 (1), wrae060 (2024).
- Bussmann, I., Rahalkar, M., Schink, B. Cultivation of methanotrophic bacteria in opposing gradients of methane and oxygen. FEMS Microbiol. Ecol. 56 (3), 331-344 (2006).
- Amaral, J. A., Knowles, R. Growth of methanotrophs in methane and oxygen counter gradients. FEMS Microbiol Lett. 126 (3), 215-220 (1995).
- Danilova, O. V., et al. A new cell morphotype among methane oxidizers: a spiral-shaped obligately microaerophilic methanotroph from northern low-oxygen environments. ISME J. 10 (11), 2734-2743 (2016).
- Ou, F., McGoverin, C., Swift, S., Vanholsbeeck, F. Absolute bacterial cell enumeration using flow cytometry. J Appl Microbiol. 123 (2), 464-477 (2017).
- Krause, S. M. B., et al. Lanthanide-dependent cross-feeding of methane-derived carbon is linked by microbial community interactions. Proc Natl Acad Sci USA. 114 (2), 358-363 (2017).
- Masuko, T., et al. Carbohydrate analysis by a phenol-sulfuric acid method in microplate format. Anal Biochem. 339 (1), 69-72 (2005).
- Felz, S., Al-Zuhairy, S., Aarstad, O. A., van Loosdrecht, M. C. M., Lin, Y. M. Extraction of structural extracellular polymeric substances from aerobic granular sludge. J Vis Exp. (115), e54534 (2016).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. J Vis Exp. (62), e3923 (2012).
- Costa, O. Y. A., Raaijmakers, J. M., Kuramae, E. E. Microbial extracellular polymeric substances: Ecological function and impact on soil aggregation. Front Microbiol. 9, 1636 (2018).
- Sinke, A. J. C., Cottaar, F. H. M., Buis, K., Keizer, P. Methane oxidation by methanotrophs and its effects on the phosphate flux over the sediment-water interface in a eutrophic lake. Microb Ecol. 24 (3), 259-269 (1992).
- Murase, J., Frenzel, P. A methane-driven microbial food web in a wetland rice soil. Environ Microbiol. 9 (12), 3025-3034 (2007).
- Reim, A., Lüke, C., Krause, S., Pratscher, J., Frenzel, P. One millimetre makes the difference: High-resolution analysis of methane-oxidizing bacteria and their specific activity at the oxic-anoxic interface in a flooded paddy soil. ISME J. 6 (11), 2128-2139 (2012).
- Rahalkar, M., Bussmann, I., Schink, B. Methylosoma difficile gen. nov., sp. nov., a novel methanotroph enriched by gradient cultivation from littoral sediment of Lake Constance. Int J Syst Evol Microbiol. 57 (5), 1073-1080 (2007).
- Wang, L., Stegemann, J. P. Extraction of high-quality RNA from polysaccharide matrices using cetlytrimethylammonium bromide. Biomaterials. 31 (7), 1612 (2010).
- Liyanage, N. M. N., Chandrasekara, B. C. H. W. M., Bandaranayake, P. C. G. A CTAB protocol for obtaining high-quality total RNA from cinnamon (Cinnamomum zeylanicum Blume). 3 Biotech. 11 (4), 201 (2021).
- Semrau, J. D., DiSpirito, A. A., Gu, W., Yoon, S. Metals and methanotrophy. Appl Environ Microbiol. 84 (6), e02289-e02317 (2018).
- Zhang, S., et al. Salinity significantly affects methane oxidation and methanotrophic community in Inner Mongolia lake sediments. Front Microbiol. 13, 1067017 (2023).
- Fox, A. L., Trefry, J. H. Nutrient fluxes from recent deposits of fine-grained, organic-rich sediments in a Florida estuary. Front Mar Sci. , (2023).
- He, L., et al. A methanotrophic bacterium to enable methane removal for climate mitigation. Proc Natl Acad Sci. 120 (35), e2310046120 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved