Ecossistema modelo baseado em agarose para cultivo de metanotróficos em um gradiente de contador de metano-oxigênio
In This Article
Summary
Um protocolo é descrito para a preparação de um ecossistema modelo simples que recria o contragradiente metano-oxigênio encontrado no habitat natural de bactérias oxidantes aeróbicas de metano, permitindo o estudo de sua fisiologia em um contexto espacialmente resolvido. Modificações em ensaios bioquímicos comuns para uso com o ecossistema modelo baseado em agarose também são descritas.
Abstract
Bactérias aeróbicas oxidantes de metano, conhecidas como metanotróficas, desempenham papéis importantes no ciclo biogeoquímico. Os metanotróficos ocupam um nicho ambiental específico dentro dos contra-gradientes de metano-oxigênio encontrados em solos e sedimentos, o que influencia seu comportamento em nível individual e comunitário. No entanto, os métodos convencionais para estudar a fisiologia desses microrganismos mitigadores de gases de efeito estufa geralmente usam culturas planctônicas homogêneas, que não representam com precisão os gradientes espaciais e químicos encontrados no ambiente. Isso dificulta a compreensão dos cientistas sobre como essas bactérias se comportam in situ. Aqui, um ecossistema modelo simples e barato chamado seringa de gradiente é descrito, que usa agarose semi-sólida para recriar os gradientes íngremes de metano-oxigênio característicos dos habitats naturais dos metanotróficos. A seringa gradiente permite o cultivo de cepas metanotróficas e o enriquecimento de consórcios mistos oxidantes de metano a partir de amostras ambientais, revelando fenótipos visíveis apenas neste contexto espacialmente resolvido. Este protocolo também relata vários ensaios bioquímicos que foram modificados para serem compatíveis com a matriz de agarose semissólida, o que pode ser valioso para pesquisadores que cultivam microrganismos em outros sistemas baseados em agarose.
Introduction
Os microrganismos que vivem em uma interface anóxico-óxica geralmente desempenham papéis ecológicos importantes1. Um exemplo são as bactérias aeróbicas oxidantes de metano (metanotróficas), que existem em contragradientes de metano e oxigênio em solos e sedimentos2. Esses microrganismos possuem características metabólicas e fisiológicas únicas que lhes permitem explorar os gradientes gasosos presentes em seus ambientes e têm sido objeto de pesquisas contínuas há décadas 3,4,5. Atualmente, a maioria das pesquisas publicadas sobre metanotróficos e comunidades oxidantes de metano é baseada em trabalhos com culturas planctônicas homogêneas que muitas vezes não conseguem capturar os gradientes espaciais e químicos inerentes aos seus habitats microbianos naturais. Essa limitação dificulta nossa compreensão da fisiologia microbiana e nossa capacidade de vincular informações genômicas a características fenotípicas.
Este protocolo relata um ecossistema modelo simples baseado em laboratório que cria condições reprodutíveis para estudar metanotróficos específicos, como Methylomonas sp. cepa LW13, e comunidades oxidantes de metano diretamente de amostras ambientais de solo. É importante ressaltar que o cultivo na seringa de gradiente resulta em fenótipos específicos de gradiente que não estão presentes em culturas planctônicas homogêneas6, destacando a capacidade do sistema de desvendar novos aspectos da fisiologia metanotrófica. Inspirada em ecossistemas modelo publicados anteriormente 7,8,9, a seringa gradiente é um método simplificado que pode ser usado para coletar informações químicas e moleculares de microrganismos cultivados usando essa abordagem.
Os procedimentos relatados para análises genéticas, químicas e moleculares foram modificados para funcionar de forma confiável em culturas microbianas cultivadas dentro de uma matriz de agarose semi-sólida. Esses procedimentos também podem ser úteis para analisar bactérias cultivadas em outros sistemas semissólidos à base de agarose, como aqueles usados para ensaios de natação em ágar mole bacteriano. Adaptar essas análises a contextos espacialmente resolvidos pode abrir novos caminhos para estudar a vida microbiana em ambientes ecologicamente mais relevantes.
Protocol
Os detalhes dos reagentes e do equipamento utilizado no estudo estão listados na Tabela de Materiais.
1. Preparação e extrusão de seringas de gradiente
NOTA: A preparação da seringa gradiente deve ser realizada usando técnica estéril.
- Usar várias colônias de Methylomonas sp. LW13 recém-cultivadas em uma placa para inocular 6 mL de meio de sais minerais de nitrato (NMS) em um tubo de vidro de 18 mm x 150 mm. Sele o tubo com uma rolha de soro e um selo de crimpagem de alumínio e adicione metano usando uma seringa a uma atmosfera final de 50% (v / v) de metano no ar. Agite esta cultura líquida planctônica a 200 rpm em temperatura ambiente até ficar turva (cerca de um dia).
- Culturas líquidas de passagem 1:10 em meios frescos. Continue cultivando culturas líquidas de metanotróficos até o crescimento da fase logarítmica (OD600 de ~ 0,5) e ajuste para um OD600 = 1,0.
- Prepare as seringas removendo o êmbolo que as acompanha e mantendo-as em um recipiente estéril. Conecte uma ponta de filtro de PTFE estéril à seringa e coloque-a em um suporte de tubo de ensaio padrão com a ponta voltada para baixo.
- Para cada seringa de 10 mL, misture bem 1 mL de células da etapa 1.2 com 5 mL de NMS e 4 mL de agarose derretida (0,5% m / v, resfriado a 55 ° C) em um tubo cônico estéril. Esses volumes podem ser ampliados para encher várias seringas em paralelo.
- Despeje lentamente ou use uma pipeta sorológica para adicionar a mistura a cada seringa, até a marcação de 8 mL. Deixe a agarose dentro das seringas solidificar (~ 15 min) e, em seguida, tampe com uma rolha de butilo de borracha estéril de 20 mm. Prenda a rolha à seringa usando fita adesiva e rotule-a com o conteúdo da seringa.
- Para adicionar metano ao headspace da seringa, encha uma seringa grande (60 mL) com 100% CH4 e conecte uma ponta de filtro de PTFE (0,2 μm, 25 mm) conectada a uma agulha estéril (23 G). Fure a rolha de borracha com a seringa grande e passe uma segunda agulha estéril através da rolha para criar uma saída de gás.
- Pressione o êmbolo na seringa grande para permitir que 20 mL de CH4 100% passem pelo headspace, tomando cuidado para remover a agulha de saída quando houver 1-2 mL de CH4 restantes na seringa grande para evitar o refluxo de oxigênio através da agulha de saída.
- Incubar as seringas a 18 °C, repetindo diariamente os passos 1.6 e 1.7 para repor o metano.
- Para extrudar agarose, substitua a ponta do filtro de PTFE por uma agulha estéril de 23 G e substitua a rolha de borracha pelo êmbolo da seringa fornecido. Pressione lentamente o êmbolo para dispensar incrementos de 1 mL em tubos de microcentrífuga estéreis separados de 1,5 mL.
2. Determinação das concentrações de gás de contra-gradiente
- Medição do gradiente de oxigénio dissolvido
- Use uma lâmina de barbear para cortar a largura de uma seringa cheia de agarose (preparada seguindo as etapas 1.1-1.8) perto do filtro de PTFE. Prenda a seringa aberta a uma bomba de seringa orientada para um microeletrodo do tipo Clark, com a extremidade aberta voltada para a ponta do eletrodo.
- Ajuste as configurações da bomba de seringa para mover a seringa em direção ao microeletrodo a uma taxa de 1 mL/min (0.6 cm/min); comece a registrar as medições de oxigênio dissolvido no software Unisense Logger assim que a bomba da seringa começar a se mover.
- Medindo o gradiente de metano
- Imediatamente antes da extrusão, substitua a ponta do filtro da seringa por uma torneira unidirecional conectada a uma agulha de 23 G e troque rapidamente a rolha de borracha por um êmbolo de seringa. Adicione oito alíquotas de agarose de 1 mL para separar os frascos evacuados de 12 mL à prova de gás e deixe as amostras se equilibrarem à temperatura ambiente por 1 h.
- Equilibre os frascos de amostra à pressão atmosférica abrindo e selando imediatamente os frascos ou perfurando e removendo rapidamente uma agulha. Injete 500 μL de headspace em um cromatógrafo de gás com detecção de ionização de chama (GC-FID) usando uma seringa estanque a gás. Crie uma curva de calibração derivada dos padrões CH4 para converter a área de pico (pA*min) em μmol/L.
3. Contagem de células na seringa de gradiente
- Citometria de fluxo
- Faça a extrusão de 1 mL de segmentos de agarose de seringas de gradiente inoculadas com LW13 de tipo selvagem ou mutante, conforme descrito na etapa 1.9. Além disso, prepare e expulse a agarose de uma seringa estéril sem células como controle negativo.
- Adicione 0,75 mL de NaCl a 0,85% (m/v) em água a todas as amostras extrudadas de agarose e homogeneizar por vórtice. Além disso, dilua as amostras 1:10 transferindo 100 μL para um novo tubo de microcentrífuga e adicionando 900 μL da solução salina.
- Adicione 3 μL de uma mistura 1:1 de corantes de SYTO9 e iodeto de propídio e, em seguida, incube no escuro em temperatura ambiente por 15 min. Para determinar as células por mL de agarose, sonicar a suspensão de esferas de contagem de microesferas em banho-maria por 5 min. Em seguida, adicionar 10 μl da suspensão a cada amostra antes da análise por citometria de fluxo.
- Analisar amostras com citômetrode fluxo 10,11 com os seguintes parâmetros: disparo em fluorescência verde, vazão de 10 μL/s e taxa de análise de partículas abaixo de 1.000 partículas/s.
- Compare SSC vs. Os gráficos de pontos FITC entre amostras de controle sem células e amostras de agarose inoculadas para desenhar portas de tensão de "evento bacteriano" que excluem partículas de agarose de fundo. Além disso, desenhe portas de tensão para as esferas de contagem de microesferas, que devem ser consistentes entre as amostras.
- Para determinar a concentração de células em cada segmento de agarose dentro da seringa de gradiente, use a seguinte equação, observando que o fator de diluição para o protocolo acima é 17,7275 e que 10-6 mL é o volume de um grânulo de microesfera.
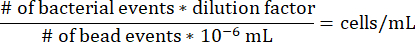
- Contagem de unidades formadoras de colônias dentro da seringa de gradiente
- Faça a extrusão de 1 mL de segmentos de agarose em tubos de microcentrífuga separados e estéreis de 2 mL, adicione 800 μL de NMS e vortex por 10 s para ajudar na pipetagem.
- Prepare uma placa estéril de 96 poços adicionando 180 μL de NMS a cada poço. Adicione 20 μL de amostras diluídas de agarose a cada poço na primeira coluna e pipete para misturar.
- Usando uma pipeta multicanal, dilua as amostras em série dez vezes, transferindo 20 μL da primeira fileira de poços para a segunda fileira de poços e pipetando 10 vezes para misturar. Continue este processo até a última linha da placa.
- Rotule as placas de grade quadrada contendo ágar NMS ou mídia de sua escolha. Usando uma pipeta multicanal, coloque 5 μL de uma coluna da placa de 96 poços na placa de ágar. Dependendo do tamanho da placa de ágar, várias colunas podem ser vistas na mesma placa.
- Incubar placas com menos de 40% de metano no ar e crescer a 18 °C. Conte as colônias bacterianas após 2-3 dias e determine as unidades formadoras de colônias por mililitro (UFC/mL).
4. Ensaios de detecção de biomoléculas
- Ensaio de polissacarídeo
- Faça a extrusão de 1 mL de segmentos de agarose em tubos de microcentrífuga separados de 2 mL e misture com 1 mL de uma solução de Na2CO3 a 1% (m/v) em água. Aqueça as amostras a 80 °C por 30 min com vórtice a cada 5-10 min, seguido de centrifugação a 4.000 x g a 4 °C por 20 min.
- Recolher o sobrenadante combinado com três volumes de etanol a 100% e incubar a 20 °C durante, pelo menos, 2 h (ou durante a noite).
- Coletar os polissacarídeos precipitados com etanol por centrifugação a 16.100 x g a 4 °C por 30 min. Remova o sobrenadante e seque o pellet ao ar. Ressuspenda o pellet em 100 μL de água deionizada.
- Meça o conteúdo relativo de polissacarídeos de cada segmento de agarose usando um ensaio colorimétrico de fenol-ácido sulfúrico12,13. Combine 50 μL do extrato ressuspenso com 150 μL de ácido sulfúrico concentrado e 30 μL de fenol a 5% (v / v) em água em uma placa transparente de 96 poços.
- Medir a absorvância a 490 nm utilizando um leitor de microplacas e calcular o teor relativo de polissacáridos de cada segmento de agarose em percentagem da absorvância do segmento de agarose mais próximo do filtro de PTFE.
- Ensaio de proteína
- Extrusão de agarose em tubos de microcentrífuga separados de 1,5 mL e transferência de 100 μL de cada alíquota para tubos de ensaio de vidro.
- Determine a concentração total de proteínas usando o protocolo de tubo de ensaio de um kit de ensaio de proteína BCA. Prepare os padrões de albumina BSA com agarose extrudada de uma seringa estéril como diluente.
- Ensaio de DNA extracelular
- Faça a extrusão de agarose em tubos de microcentrífuga separados de 1,5 mL e transfira 20 μL de cada um para tubos de microcentrífuga de 0,2 mL.
- Meça as concentrações de DNA usando o kit de ensaio de alta sensibilidade 1x dsDNA disponível comercialmente seguindo o protocolo do fabricante.
5. Extração de RNA
- Prepare o tampão de extração combinando o seguinte em 800 mL de água livre de RNase: 2,0 g de CTAB, 2,0 g de polivinilpirrolidona (PVP 40), 81,8 g de NaCl, 100 mM de Tris-HCl (pH 8,0) e 20 mM de EDTA. Aumente o volume para 1 L e autoclave; Conservar a 4 °C.
- Aliquotar o tampão de extracção preparado e adicionar 1% (v/v) de concentração final de beta-mercaptoetanol imediatamente antes da utilização. Aquecer o tampão a 65 °C utilizando um banho-maria ou um bloco de calor.
- Divida cada seringa de gradiente em seções de 1 mL por extrusão de agarose em tubos de microcentrífuga separados de 2 mL sem RNase, seguindo o procedimento na etapa 1.9.
- Centrifugue as amostras a 21.000 x g, 4 °C, durante 15 min e elimine o sobrenadante, mantendo as amostras no gelo.
- Adicione 600 μL de tampão de extração pré-aquecido a cada 1 mL de agarose extrudida peletizada. Adicione aproximadamente 200 μL de esferas de zircônia/sílica e homogeneize as amostras por 3 min a 30 Hz/s usando um batedor de contas, parando até a metade para colocar as amostras no gelo por 2 min.
- Centrifugue as amostras a 15.000 x g, 4 °C, por 2 min para reduzir a formação de espuma. Extrair amostras adicionando 600 μL de clorofórmio: álcool isoamílico (24:1) aos tubos e vórtice por 10 s.
- Centrifugar as amostras a 15.000 x g, 4 °C, durante 8 min. Transferir cuidadosamente a fase aquosa superior para um novo tubo de microcentrífuga sem RNase e adicionar 600 μL de clorofórmio: álcool isoamílico (24:1) à fase superior transferida e ao vórtice durante 10 s.
- Centrifugue as amostras a 15.000 x g, 4 °C, por 8 min e transfira a nova fase aquosa superior para um novo tubo de microcentrífuga livre de RNase. Adicionar um volume igual de isopropanol à fase superior transferida e incubar as amostras durante várias horas a -20 °C. Opcional: as amostras podem ser deixadas a -20 °C durante a noite.
- Coletar precipitados contendo RNA centrifugando amostras a 16.100 x g, 4 °C por 30 min.
- Rejeitar o sobrenadante e lavar o pellet com 300 μL de etanol frio a 75% (v/v) feito com água isenta de RNase e centrifugar a 16.100 x g, 4 °C, durante 5 min.
- Lave os pellets novamente seguindo o passo 5.10.
- Após remover o sobrenadante de etanol, deixe os pellets secarem ao ar por 15 min. Dissolva os grânulos em 100 μL de água livre de RNase.
- Trate as amostras com DNase I a 37 °C por 30 min seguindo o protocolo do fabricante.
- Inative a DNase I adicionando 300 μL de fenol ácido: clorofórmio: IAA (125:24:1, pH 4,5). Vórtice por 10 s e incubar em temperatura ambiente por 5 min.
- Centrifugue a 16.100 x g, 4 °C, por 5 min e mantenha a fase aquosa superior, transferindo-a para um novo tubo de microcentrífuga sem RNase.
- Opcional: Agrupe o RNA do mesmo segmento em todas as seringas replicadas, combinando as fases superiores em um tubo cônico.
- Adicione 1 volume de isopropanol igual ao volume da fase superior contendo RNA e adicione 7,5 M de LiCl a uma concentração final de 0,8 M, invertendo várias vezes para misturar.
- Incubar as amostras durante várias horas a -20 °C. Opcional: as amostras podem ser deixadas a -20 °C durante a noite.
- Centrifugar as amostras a 16,100 x g, 4 °C, durante 15 min e rejeitar cuidadosamente o sobrenadante. Lave o pellet contendo RNA duas vezes adicionando etanol frio a 70% (v / v) em água livre de RNase, centrifugando a 16.100 x g, 4 ° C, por 5 min e removendo o sobrenadante.
- Deixe os pellets secarem ao ar livre em temperatura ambiente por 10 min e ressuspenda em 50 μL de água livre de RNase. Armazenar as amostras de RNA a -80 °C.
- Opcional, dependendo da qualidade do RNA: As amostras podem ser repurificadas usando um kit de purificação de RNA para remover RNAs pequenos (<200 nt).
- Para confirmar que as amostras de RNA não contêm DNA residual, use 1 μL de RNA purificado como modelo para amplificação por PCR usando primers universais do gene bacteriano 16S rRNA 27F / 1492R. Inclua duas reações de PCR adicionais contendo 1 μL de DNA genômico (diluído 1:100) ou água livre de nuclease para servir como controles positivo e negativo, respectivamente.
- Execute os produtos em um gel TBE de agarose a 1% usando eletroforeseem gel 14.
NOTA: Amostras de RNA sem contaminação de DNA devem resultar na ausência de uma banda na pista de amostra. Se as amostras de RNA mostrarem contaminação por DNA, reprocesse as amostras a partir da etapa 5.13. O RNA está pronto para análise a jusante e pode, opcionalmente, ser analisado para quantificar sua integridade medindo o Número de Integridade do RNA (RIN).
Representative Results
Aqui, o ecossistema do modelo de seringa gradiente foi usado para cultivar uma única cepa (o metanotrófico Methylomonas sp. cepa LW13) (Figura 1A)6, mas também pode ser usado para enriquecer uma comunidade microbiana oxidante de metano por inoculação direta no solo (Figura 1B). A presença de um contragradiente metano-oxigênio foi validada pela medição da concentração de metano e oxigênio em seringas livres de células e inoculadas (Figura 1C). Para seringas de gradiente inoculadas com LW13, um contra-gradiente se formou dentro de um dia após a lavagem da seringa, que se inclinou ao longo de três dias de incubação. No mesmo período, uma faixa horizontal se formou na mesma profundidade em que ambos os substratos gasosos atingiram suas concentrações mais baixas (Figura 1A). O gradiente acentuado de gás e a depleção de metano e oxigênio além da profundidade da banda horizontal mostraram que o LW13 metabolizou aerobicamente o metano e produziu um fenótipo não observado em cultura planctônica homogênea. Esse fenótipo também é produzido por outras bactérias metanotróficas isoladas da mesma amostra ambiental que LW136. A variação dependente da cepa no tempo e na profundidade do desenvolvimento da banda horizontal entre diferentes cepas metanotróficas sugeriu que a banda horizontal foi afetada pelo comportamento específico de cada micróbio quando cultivado em um contexto espacialmente resolvido6.
O número de células em todo o tampão de agarose foi medido por citometria de fluxo e contagem de colônias (UFC/mL) (Figura 2A). Este método foi usado para comparar a distribuição celular e a sobrevivência do LW13 do tipo selvagem com uma cepa mutante de LW13 contendo uma deleção no gene da fucose 4-O-acetiltransferase (OAT), que foi previamente demonstrado influenciar o desenvolvimento da banda horizontal6. O mutante ΔOAT de LW13 teve menor crescimento geral na seringa gradiente ao longo de 6 dias em comparação com o tipo selvagem, um efeito que não foi observado em culturas planctônicas homogêneas das mesmas cepas6. A cepa mutante não formou a mesma faixa horizontal distinta que o tipo selvagem LW13 quando cultivada na seringa gradiente (Figura 2B). O número de células e a aparência da banda horizontal foram restaurados a níveis semelhantes ao tipo selvagem após a complementação do gene na cepa mutante. Esses resultados demonstram que a seringa de gradiente pode ser usada para ligar genes a fenótipos específicos presentes apenas no contragradiente metano-oxigênio.
Uma variedade de técnicas genéticas, químicas e moleculares foram adaptadas para uso com bactérias cultivadas dentro de uma matriz de agarose semi-sólida. O ecossistema do modelo de seringa gradiente pode ser prontamente usado para ensaios de quantificação biomolecular padrão com a inclusão de agarose não inoculada como controle negativo. A concentração de três biomoléculas diferentes comumente encontradas em substâncias poliméricas extracelulares e biofilmes foi medida: polissacarídeos, proteínas e DNA extracelular15 (Figura 3). Nos segmentos de seringa inoculados com LW13, a banda horizontal apresentou significativamente mais polissacarídeos do que outros segmentos, sem aumento significativo de proteína ou DNA extracelular.
O RNA-seq foi usado para medir as diferenças transcricionais no crescimento de LW13 em diferentes profundidades da seringa. A extração robusta de RNA foi obtida usando um tampão de extração baseado em CTAB seguido por fenol convencional: extração de clorofórmio e etapas de precipitação. Os resultados da análise de RNA-seq foram posteriormente usados para identificar genes implicados na produção da banda de polissacarídeo horizontal. Esses resultados indicam que a agarose semissólida essencial para a criação de um ecossistema modelo espacialmente resolvido não impede novas análises bioquímicas que geralmente são reservadas para culturas planctônicas e baseadas em placas.
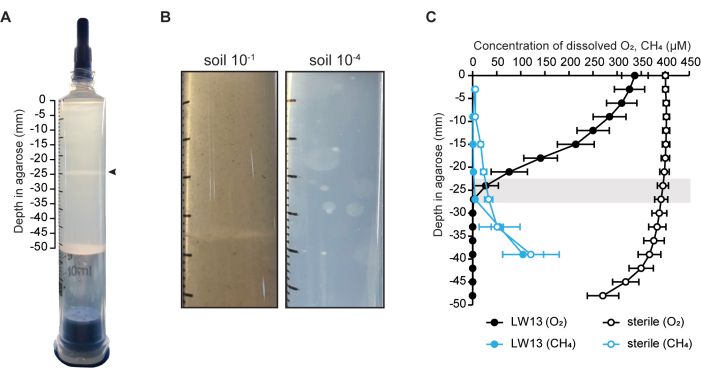
Figura 1: O ecossistema do modelo de seringa gradiente. (A) A seringa gradiente inoculada com o metanotrófico Methylomonas sp. LW13. Uma faixa horizontal distinta (ponta de seta) se desenvolve dentro de dois dias após a lavagem da seringa com 100% de metano. (B) Fotos em close-up de seringas de gradiente inoculadas com solo diluído 10-1 e 10-4 e incubadas por duas semanas. Seringas de gradiente contendo solo mais diluído resultaram em colônias esféricas em toda a agarose, enquanto inóculos de solo mais concentrados resultaram em uma banda distinta. (C) Caracterização do contragradiente metano-oxigênio em seringas inoculadas com LW13 e gradiente estéril após três dias de incubação. A barra cinza indica a faixa de profundidades em que a banda de polissacarídeo estava localizada; os dados mostram o DP ± médio de três experimentos independentes com três repetições técnicas cada. Os painéis (A) e (C) foram modificados a partir de Beals et al.6. Clique aqui para ver uma versão maior desta figura.
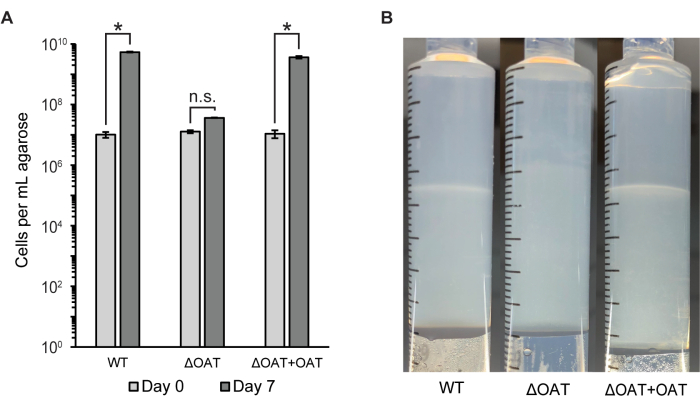
Figura 2: Quantificação do tipo selvagem LW13 e mutante após incubação na seringa gradiente. (A) O número total de células LW13 por mL de agarose extrusada recuperadas de seringas gradientes no Dia 0 e Dia 7 medido por citometria de fluxo. ΔOAT contém uma deleção do gene da fucose 4-O-acetiltransferase, que foi altamente expresso em células localizadas na profundidade da banda de polissacarídeos. ΔOAT+OAT contém o gene OAT inserido em um local distal do genoma ΔOAT. *, significativamente diferente ( teste t heterocedástico bicaudal, α = 0,05); n.s., não significativamente diferente. Os dados mostram a média ± DP de três experimentos independentes com duas repetições técnicas cada. (B) Desenvolvimento de banda horizontal em seringas de gradiente inoculadas com LW13 tipo selvagem, ΔOAT ou ΔOAT+OAT após sete dias de incubação. Essa figura foi modificada de Beals et al.6. Clique aqui para ver uma versão maior desta figura.
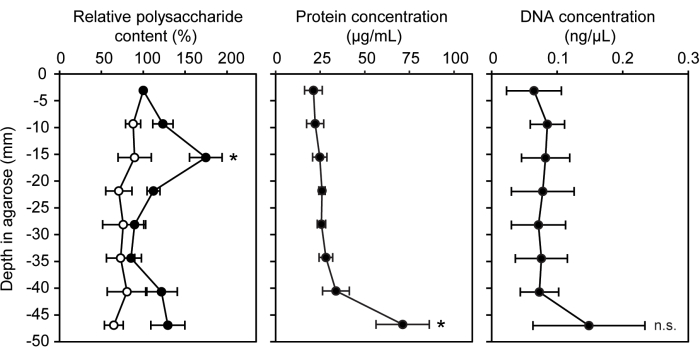
Figura 3: Quantificação de biomoléculas em profundidades crescentes da seringa gradiente. Teor relativo de polissacarídeos (%), concentração de proteína (μg/mL) e concentração de DNA (ng/μL) em oito seções de seringas de gradiente inoculadas com LW13 incubadas por sete dias (círculos preenchidos; círculos abertos mostram valores de seringas de gradiente estéreis). Os dados mostram o DP médio ± de três experimentos independentes com três repetições técnicas cada. Para o teor relativo de polissacarídeos, * indica uma diferença significativa em relação ao controle estéril em profundidade equivalente ( teste t heterocedástico bicaudal, α = 0,05). Para as concentrações de proteínas e DNA, * indica uma diferença significativa em relação à seção que contém a banda horizontal (ANOVA unidirecional com análise post hoc de Tukey-Kramer); n.s., não significativo. A figura foi modificada a partir de Beals et al.6. Clique aqui para ver uma versão maior desta figura.
Discussion
Métodos para cultivo metanotrófico
Os metanotróficos têm sido estudados há décadas para entender sua fisiologia, seu comportamento individual e comunitário no ambiente natural e seu potencial para mitigação de metano em aplicações industriais. Ao longo desses estudos, grande parte da pesquisa realizada foi realizada usando culturas planctônicas homogêneas onde o contexto espacial é perdido. O ecossistema do modelo de seringa de gradiente foi desenvolvido para replicar o contra-gradiente metano-oxigênio característico dos habitats metanotróficos naturais no laboratório, permitindo que os pesquisadores estudem metanotróficos que crescem em um ambiente que se assemelha mais ao local onde esses organismos evoluíram.
Nos últimos 30 anos, os pesquisadores recriaram o contra-gradiente metano-oxigênio no laboratório usando uma variedade de métodos, muitas vezes com o objetivo principal de isolar e classificar metanotróficos de consórcios mistos de oxidação de metano. Esses métodos podem ser divididos em duas abordagens, ambas envolvendo o uso de câmaras opostas de metano e oxigênio: suspender o solo relativamente intacto em uma membrana 16,17,18 ou inocular pequenas quantidades de solo ou cultura bacteriana pura em um meio mínimo em agarose 7,8,19. O método de seringa gradiente descrito aqui combina a abordagem baseada em seringa de Dedysh e colaboradores9 com o cultivo de metanotróficos de trabalhos anteriores de Amaral e Knowles8 e Schink e colaboradores7. O último desses métodos lançou as bases para o cultivo de metanotróficos em um contra-gradiente de metano-oxigênio e usou um fluxo contínuo de metano e oxigênio em ambos os lados do tampão de agarose. Embora isso forneça um ambiente mais constante, essa abordagem adiciona complexidade à configuração experimental e requer fontes de gás dedicadas.
Em contraste, a seringa gradiente descrita aqui depende da lavagem diária da seringa para fornecer metano fresco, um processo que leva menos de um minuto por seringa, ao mesmo tempo em que fornece acesso contínuo ao oxigênio atmosférico por meio de uma ponta de filtro de PTFE estéril. Este método mais simples pode permitir uma adoção mais ampla desse ecossistema de modelo para estudar metanotróficos em um contexto espacialmente resolvido. O protocolo descrito também detalha análises químicas e moleculares que podem ser realizadas diretamente em bactérias incubadas na agarose semissólida. Como resultado, as bactérias não precisam ser excisadas e cultivadas fora da matriz de agarose antes da análise, preservando as condições do gradiente de gás no momento da amostragem.
Observações sobre o protocolo
Como as bactérias são cultivadas dentro de uma seringa volumétrica de polipropileno, os pesquisadores podem usar o êmbolo da seringa que o acompanha para segmentar com precisão e reprodutibilidade o tampão de agarose, mantendo a integridade espacial da matriz de agarose que ainda permanece no corpo da seringa. Sem o design hermético inerente à seringa, os tampões de agarose precisariam ser removidos do corpo da seringa e fatiados, introduzindo incerteza no volume dos segmentos de agarose e liberando quantidades não quantificáveis de metano e oxigênio dissolvido na atmosfera. A extrusão de agarose através de uma agulha estéril simplifica a preparação da amostra e ajuda a homogeneizar os segmentos extrudados sem cisalhar as células bacterianas. Este método permite que os pesquisadores dividam cada seringa de gradiente inoculada em pelo menos oito segmentos de agarose e realizem experimentos paralelos em metanotróficos que crescem em uma variedade de concentrações de oxigênio e metano.
Ao otimizar a extração de RNA de agarose com alto teor de polissacarídeos, verificou-se que reagentes comuns como tiocianato de guanídio e TRIzol levaram à gelificação de agarose, que obstruiu as colunas de purificação e resistiu à peletização por centrifugação. Baixos rendimentos e qualidade de RNA também foram uma preocupação, pois grandes moléculas de polissacarídeos podem reter ácidos nucléicos, enquanto pequenos polissacarídeos podem co-precipitar com RNA20. Em vez disso, foi utilizado um tampão de extração contendo o surfactante catiônico CTAB, que solubiliza as membranas lipídicas20; e NaCl, que impede a formação de complexos CTAB-ácidos nucleicos e permite que os ácidos nucléicos precipitem, mas mantém os polissacarídeos em solução21. As RNases foram desnaturadas pela inclusão de β-mercaptoetanol no tampão CTAB. Para o experimento de RNA-seq, uma etapa de purificação opcional baseada em coluna foi incluída para excluir RNAs pequenos (<200 nucleotídeos) antes da preparação da biblioteca.
Limitações e considerações
Enquanto o NMS e a agarose fornecem uma matriz média mínima para o cultivo de bactérias metanotróficas, a seringa de gradiente, conforme descrito aqui, apenas recria os gradientes de gás de habitats metanotróficos, mas não outros gradientes presentes nesses ambientes, como traços de metais22, salinidade23 ou outros nutrientes24. É possível que esses gradientes possam ser adicionados a um sistema semelhante no futuro. Além disso, o volume da seringa (8 mL de agarose) limita a biomassa total por seringa, necessitando de agrupar várias seringas para algumas análises (conforme descrito na etapa 5.16). Embora a seringa portátil segmente convenientemente a agarose em alíquotas de 1 mL, seu tamanho também limita o headspace a aproximadamente 4 mL, limitando a quantidade de metano a granel que pode ser armazenada para os micróbios cultivados. Como as taxas de oxidação do metano são proporcionais à taxa de crescimento dos metanotróficos aeróbios25, recomenda-se a reposição diária de metano do headspace. Embora isso ainda possa resultar em períodos de limitação de metano, esses períodos são reproduzíveis em laboratório e provavelmente imitam situações encontradas em ambientes naturais.
Ao usar a seringa gradiente, a presença dos polissacarídeos de agarose requer alguns ajustes nos ensaios usados para analisar metanotróficos cultivados neste sistema. Por exemplo, protocolos que exigem a transferência de pequenos volumes de agarose extrudada precisam de várias etapas de diluição com homogeneização completa entre cada diluição para pipetagem precisa. Além disso, em casos como o ensaio de polissacarídeos, onde os polissacarídeos inerentes à matriz de agarose reagirão com o reagente ácido sulfúrico-fenol, a inclusão de um controle negativo de agarose estéril e livre de células é essencial. As primeiras tentativas de mitigar esses problemas incluindo a enzima hidrolisadora de agarose β-agarase não tiveram sucesso e introduziram uma variável desconhecida nos experimentos biológicos. O uso de múltiplas réplicas técnicas, diluição completa, homogeneização e inclusão de controles podem ser usados para mitigar a maioria dos desafios inerentes à matriz de agarose.
Aplicativos
Além dos estudos de cepa única, a seringa gradiente pode suportar a co-cultura de várias cepas, e o solo pode ser usado como inóculo no lugar da cultura bacteriana pura. O design simples do ecossistema do modelo de seringa gradiente é passível de cultivo de outros tipos de microrganismos que existem na interface entre ambientes anóxicos e óxicos, usando um substrato gasoso diferente, como H2 ou CO, no lugar do metano. Em resumo, o uso de um ecossistema modelo simples e espacialmente resolvido permite que os pesquisadores estudem a fisiologia única e as adaptações metabólicas de microrganismos anóxico-óxicos e podem ser usados para vincular genes a fenótipos de organismos.
Disclosures
Os autores declaram não haver conflitos de interesse.
Acknowledgements
Este trabalho foi apoiado por financiamento inicial do Departamento de Química da Universidade de Utah e NSF CAREER Award #2339190. Agradecemos aos membros do Puri Lab pelas discussões úteis. Agradecemos a Rachel Hurrell (Universidade de Utah) pela orientação inicial com o experimento de citometria de fluxo.
Materials
| Name | Company | Catalog Number | Comments |
| 1% Gas mix analytical standard | Supelco | 22561 | 1% each component in nitrogen: carbon monoxide, carbon dioxide, hydrogen, methane and oxygen |
| 100% Methane | Airgas | ME CP300 | chemically pure grade |
| 15 ppm Gas mix analytical standard | Supelco | 23470-U | 15 ppm each component in nitrogen: methane, ethane, ethylene, acetylene, propane, propylene, propyne, and n-butane |
| 1x Nitrate mineral salts | see CAS numbers below | Dissolve the following in Mili-Q water and autoclave: 0.2 g/L MgSO4·7H2O, 0.2 g/L CaCl2·6H2O, 1 g/L KNO3, and 30 μM LaCl3. Before use, add trace elements to a 1X final concentration and phosphate buffer (pH 6.8) to a final concentration of 5.8 mM. | |
| 23 G needle | BD Biosciences | 305194 | sterile, Luer-Lok |
| 500x Trace elements | see CAS numbers below | Dissolve the following in Milli-Q water: 1.0 g/L Na2-EDTA, 2.0 g/L FeSO4·7H2O, 0.8 g/L ZnSO4·7H2O, 0.03 g/L MnCl2·4H2O, 0.03 g/L H3BO3, 0.2 g/L CoCl2·6H2O, 0.6 g/L CuCl2·2H2O, 0.02 g/L NiCl2·6H2O, and 0.05 g/L Na2MoO·2H2O. | |
| 96 Well plate | CELLTREAT | 229596 | sterile |
| Acid phenol:chloroform:IAA (125:24:1) | Invitrogen | AM9720 | pH 4.5 |
| Agarose | Fisher Scientific | BP160 | molecular biology grade, CAS 9012-36-6 |
| Aluminum crimp seals | VWR | 30618-460 | 20 mm |
| Bead beater | Qiagen | 9003240 | TissueLyser III |
| Butyl rubber stopper | Chemglass Life Science | 50-143-854 | 20 mm, blue |
| Chloroform:isoamyl alcohol (24:1) | Millipore Sigma | 25666 | BioUltra, for molecular biology |
| Clark-type O2 microelectrode | Unisense | OX-500 | |
| DEPC-treated water | Thermo Scientific | R0601 | |
| DNase I (Ambion) | Invitrogen | AM2222 | |
| Flow cytometer | Beckman Coulter | CytoFLEX | |
| Gas chromatograph (flame ionization detection) | Agilent | 6890N | |
| Gastight analytical syringe | Hamilton | 81220 | 1750 TLL |
| Gastight analytical syringe needle | Hamilton | 7729-07 | 22 G, metal hub needle, 2 in, point style 5 |
| Gas-tight vials | Labco | 938W | Exetainer vial: 12 mL, round bottom |
| Glass culture tubes | Bellco Glass | 2048-00150 | 18 x 150 mm |
| LiCl precipitation solution (7.5 M) | Invitrogen | AM9480 | |
| One-way stopcock | VWR | MFLX30600-00 | inlet port: female luer, outlet port: male luer lock |
| Petri dish, square | Fisher Scientific | FB0875711A | 100 x 100 mm |
| Phosphate buffer, 0.2 M (pH 6.8) | see CAS numbers below | Dissolve the following in Milli-Q water and autoclave: 12.24 g/L KH2PO4, 26.29 g/L Na2HPO4 · 7H2O | |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23225 | |
| PTFE syringe filter tip | Thermo Scientific | 03-050-469 | hydrophobic, pore size: 0.2 µm, diameter: 4 mm |
| Qubit 1x dsDNA High Sensitivity Assay Kit | Invitrogen | Q33230 | |
| Qubit 4 Fluorometer | Invitrogen | Q33238 | |
| RNA Clean & Concentrator-5 | Zymo Research | R1013 | |
| Serum stopper | Fisher Scientific | 03-340-302 | 20 mm |
| Syringe | BD Biosciences | 302995 | Luer-Lock, 10 mL, single use, sterile |
| Syringe pump | New Era Pump Systems Inc. | 1000-US | NE-1000 one channel programmable |
| SYTO9, propidium iodide, microspheres | Invitrogen | L34856 | LIVE/DEAD BacLight Bacterial Viability Kit |
| Zirconia/silica beads | BioSpec Products | 11079101z | 0.1 mm diameter |
| Chemical reagents | CAS number | ||
| CaCl2·6H2O | 7774-34-7 | ||
| CoCl2·6H2O | 7791-13-1 | ||
| Concentrated sulfuric acid | 7664-93-9 | ||
| CTAB, cetrimonium bromide | 57-09-0 | ||
| CuCl2·2H2O | 10125-13-0 | ||
| Ethanol | 64-17-5 | ||
| FeSO4·7H2O | 7782-63-0 | ||
| H3BO3 | 10043-35-3 | ||
| Isopropanol | 69-63-0 | ||
| KH2PO4 | 7778-77-0 | ||
| KNO3 | 7757-79-1 | ||
| LaCl3 | 10099-58-8 | ||
| MgSO4·7H2O | 10034-99-8 | ||
| MnCl2·4H2O | 13446-34-9 | ||
| Na2CO3, sodium carbonate | 497-19-8 | ||
| Na2-EDTA | 139-33-3 | ||
| Na2HPO4 · 7H2O | 7782-85-6 | ||
| Na2MoO·2H2O | 10102-40-6 | ||
| NaCl, sodium chloride | 7647-14-5 | ||
| NiCl2·6H2O | 7791-20-0 | ||
| Phenol (90% solution in water) | 108-95-2 | ||
| PVP40, polyvinylpyrrolidone | 9003-39-8 | ||
| Tris-HCl | 1185-53-1 | ||
| ZnSO4·7H2O | 7446-20-0 | ||
| β-Mercaptoethanol | 60-24-2 |
References
- Brune, A., Frenzel, P., Cypionka, H. Life at the oxic-anoxic interface: microbial activities and adaptations. FEMS Microbiol Rev. 24 (5), 691-710 (2000).
- Auman, A. J., Stolyar, S., Costello, A. M., Lidstrom, M. E. Molecular characterization of methanotrophic isolates from freshwater lake sediment. Appl Environ Microbiol. 66 (12), 5259-5266 (2000).
- Whittenbury, R., Phillips, K. C., Wilkinson, J. F. Enrichment, isolation and some properties of methane-utilizing bacteria. J Gen Microbiol. 61 (2), 205-218 (1970).
- Koo, C., Rosenzweig, A. Biochemistry of aerobic biological methane oxidation. Chem Soc Rev. 50 (5), 3424-3436 (2021).
- Strong, P. J., Xie, S., Clarke, W. P. Methane as a resource: Can the methanotrophs add value. Environ Sci Technol. 49 (7), 4001-4018 (2015).
- Beals, D. G., Puri, A. W. Linking methanotroph phenotypes to genotypes using a simple spatially resolved model ecosystem. ISME J. 18 (1), wrae060 (2024).
- Bussmann, I., Rahalkar, M., Schink, B. Cultivation of methanotrophic bacteria in opposing gradients of methane and oxygen. FEMS Microbiol. Ecol. 56 (3), 331-344 (2006).
- Amaral, J. A., Knowles, R. Growth of methanotrophs in methane and oxygen counter gradients. FEMS Microbiol Lett. 126 (3), 215-220 (1995).
- Danilova, O. V., et al. A new cell morphotype among methane oxidizers: a spiral-shaped obligately microaerophilic methanotroph from northern low-oxygen environments. ISME J. 10 (11), 2734-2743 (2016).
- Ou, F., McGoverin, C., Swift, S., Vanholsbeeck, F. Absolute bacterial cell enumeration using flow cytometry. J Appl Microbiol. 123 (2), 464-477 (2017).
- Krause, S. M. B., et al. Lanthanide-dependent cross-feeding of methane-derived carbon is linked by microbial community interactions. Proc Natl Acad Sci USA. 114 (2), 358-363 (2017).
- Masuko, T., et al. Carbohydrate analysis by a phenol-sulfuric acid method in microplate format. Anal Biochem. 339 (1), 69-72 (2005).
- Felz, S., Al-Zuhairy, S., Aarstad, O. A., van Loosdrecht, M. C. M., Lin, Y. M. Extraction of structural extracellular polymeric substances from aerobic granular sludge. J Vis Exp. (115), e54534 (2016).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. J Vis Exp. (62), e3923 (2012).
- Costa, O. Y. A., Raaijmakers, J. M., Kuramae, E. E. Microbial extracellular polymeric substances: Ecological function and impact on soil aggregation. Front Microbiol. 9, 1636 (2018).
- Sinke, A. J. C., Cottaar, F. H. M., Buis, K., Keizer, P. Methane oxidation by methanotrophs and its effects on the phosphate flux over the sediment-water interface in a eutrophic lake. Microb Ecol. 24 (3), 259-269 (1992).
- Murase, J., Frenzel, P. A methane-driven microbial food web in a wetland rice soil. Environ Microbiol. 9 (12), 3025-3034 (2007).
- Reim, A., Lüke, C., Krause, S., Pratscher, J., Frenzel, P. One millimetre makes the difference: High-resolution analysis of methane-oxidizing bacteria and their specific activity at the oxic-anoxic interface in a flooded paddy soil. ISME J. 6 (11), 2128-2139 (2012).
- Rahalkar, M., Bussmann, I., Schink, B. Methylosoma difficile gen. nov., sp. nov., a novel methanotroph enriched by gradient cultivation from littoral sediment of Lake Constance. Int J Syst Evol Microbiol. 57 (5), 1073-1080 (2007).
- Wang, L., Stegemann, J. P. Extraction of high-quality RNA from polysaccharide matrices using cetlytrimethylammonium bromide. Biomaterials. 31 (7), 1612 (2010).
- Liyanage, N. M. N., Chandrasekara, B. C. H. W. M., Bandaranayake, P. C. G. A CTAB protocol for obtaining high-quality total RNA from cinnamon (Cinnamomum zeylanicum Blume). 3 Biotech. 11 (4), 201 (2021).
- Semrau, J. D., DiSpirito, A. A., Gu, W., Yoon, S. Metals and methanotrophy. Appl Environ Microbiol. 84 (6), e02289-e02317 (2018).
- Zhang, S., et al. Salinity significantly affects methane oxidation and methanotrophic community in Inner Mongolia lake sediments. Front Microbiol. 13, 1067017 (2023).
- Fox, A. L., Trefry, J. H. Nutrient fluxes from recent deposits of fine-grained, organic-rich sediments in a Florida estuary. Front Mar Sci. , (2023).
- He, L., et al. A methanotrophic bacterium to enable methane removal for climate mitigation. Proc Natl Acad Sci. 120 (35), e2310046120 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved