Galleria mellonella 作为抗菌筛选模型
In This Article
Summary
本研究提出了一个标准化框架,用于优化 梅洛氏杆菌 感染模型,用于临床前抗菌评估。将 梅克隆球菌 模型作为临床前抗菌药物开发管道的一部分,可以减少进入临床试验的无效化合物的数量。
Abstract
为了应对日益严重的全球抗生素耐药性问题,加速开发新型抗生素至关重要。目前的临床前抗菌药物开发产生了大量先导化合物,这些先导化合物在临床试验之前或期间被证明是不合适的。为了提高临床前开发的效率,必须开发相关、标准化、可访问且具有成本效益的模型。 Galleria mellonella (大蜡蛾)幼虫被广泛用作感染模型来评估微生物毒力,进行药物毒性测试,并作为评估新型抗菌化合物 体内疗效的 初步手段。这些感染模型比许多具有相当通量的体外筛选具有更大的生物学相关性,并且在用作抗菌检测的预筛选时减少了对哺乳动物模型的依赖。该协议描述了一种优化 梅克隆球菌 感染模型的标准化方法,该方法可应用于细菌种类和选择的抗菌疗法。以 WHO 重点病原体铜 绿假单胞 菌为示例,我们概述了可以采取的步骤,以开发可重复的感染和治疗检测模型。这包括有关实验设置、样品制备以及感染和治疗方案的建议。将该模型整合到临床前抗菌药物开发管道中将减少对哺乳动物模型的依赖,减少进入临床试验的无效化合物的数量,并最终提高临床前抗菌药物开发的效率。
Introduction
Galleria mellonella(大蜡蛾)幼虫在生物科学中被广泛用作微生物物种的感染模型,以及用于新型药物化合物的毒性测试1,2。它们有可能在临床前抗菌检测管道中具有相当大的实用性,因为它们具有高通量,复制人类感染的整体体内特征,并减少对哺乳动物模型的依赖,符合在研究中管理哺乳动物物种的道德使用的原则。
在临床验证之前,开发新的抗生素需要在 体外 和 体内 模型中进行广泛的临床前测试3。只有少数具有前景广阔的临床前数据包的新型药物能够转化为临床,而导致这种高流失率的一个原因是临床前筛选未能捕捉感染环境的复杂性4。这些问题不仅导致抗菌药物到临床的转化率低,而且在临床前筛选后期导致实验脊椎动物的使用增加。为了改进新型抗菌药物的临床前评估并减少昂贵、耗时、复杂且在伦理上存在问题的小鼠 体内 模型的使用,需要更好的早期药物筛选工具,以减少在脊椎动物系统中进行测试的无前途化合物的数量。
G. mellonella 的生命周期很短,只有 8 周,由四个生命阶段组成:卵、幼虫、蛹和成虫,其中幼虫形式用于本协议1。G. mellonella 梅洛氏菌在整个实验过程中易于维护,无需专业设备或专门的动物研究设施。使用它们不需要寻求伦理批准,研究人员可以在内部培育该生物体以提高实验质量 2,5,6,7。G. mellonella 免疫系统与哺乳动物先天免疫系统非常相似,能够对“自我”和“非自我”刺激做出反应8。血细胞负责病原体相关分子模式的识别和随后的吞噬作用,其作用在功能上类似于人类中性粒细胞的作用9。G. mellonella 编码三种类型的 toll 样受体,这些受体已通过与人类的序列同源性鉴定,并产生补体样蛋白,这些蛋白识别非自身物质并在酚氧化酶激活和聚合成黑色素后形成局部黑色素化复合物10。这可以作为感染实验期间幼虫健康状况的视觉读数,因为角质层因黑色素化而变暗。然而,应该注意的是,昆虫中涉及酚氧化酶的黑色素化轴与哺乳动物的酪氨酸酶-黑色素轴有很大不同11,12。此外,G. mellonella 产生 18 种可诱导型抗菌肽,包括溶菌酶和防御素同源物13。这种相似性,以及简单的幼虫维持程序和模型的高通量性质,使 G. mellonella 成为新药评估中广泛使用的生物体。在临床前抗生素开发中,与体外模型相比,梅洛氏菌的实用性更高,因为它们可以在具有主动免疫力的复杂环境中更准确地模拟宿主-病原体-药物相互作用。
目前,欧洲没有标准化的研究级 G. mellonella 供应商。研究人员必须从诱饵店购买 G. mellonella 幼虫或维持自己的蚁群。虽然已经描述了维持内部 G. mellonella 菌落的方法,并且可以增加实验一致性 5,6,7,但这种选择可能只对那些经常使用幼虫的人有吸引力。因此,该协议侧重于从活饵供应商处购买幼虫后的实验设置。虽然更容易获得,但这种方法增加了实验复杂性,并且由于从供应商处接收幼虫时幼虫的健康状况不一致,可能会给检测带来额外的可变性。为了让学术界、行业和监管机构接受并采用梅克隆球菌检测作为临床前抗菌药物开发管道的一部分,需要一个标准化的系统来优化和评估抗菌药物疗效。
本研究优化了用于抗生素开发的梅克隆氏杆菌感染模型的实验设计。虽然已经描述了梅洛氏杆菌感染模型14,15,但目前的方法记录了减轻供应不一致带来的额外复杂性的额外步骤,并为评估新型抗菌剂提供了一个框架。作为一个测试案例,G. mellonella 感染了 WHO 第一重点病原体铜绿假单胞菌,并优化了氨基糖苷类药物 (妥布霉素) 的治疗。该框架如图 1 所示,为未来使用新型药物的临床前抗菌药物筛选研究奠定了基础。
Protocol
在本研究中,选择 Galleria mellonella (大蜡蛾) 幼虫作为抗生素敏感性测试和急性毒性试验的模型。 Galleria mellonella 的实验使用不需要伦理批准。所用试剂和设备的详细信息列在 材料表中。
1. 实验设计
- 根据研究旨在捕获的幼虫存活率变化确定适当的 Galleria mellonella 幼虫组大小。 表 1 详细说明了使用 铜绿假单胞 菌菌株 PAO1 感染模型检测生存率特定百分比变化所需的组规模。
注:当使用新型病原体时,首先确定感染但未经处理的幼虫比例存活的分析间变异性,因为这会影响样本量的确定。- 包括两组 PBS 对照:一组在其余感染之前注射,以确保注射器锋利且适合使用,另一组在细菌感染期间或之后注射,以确保感染组之间进行适当灭菌。如果使用新的病原体进行优化,请包括热处理对照,以确保死亡不是对外来颗粒的免疫反应的结果。
注意:胰岛素注射器可用于注射,从而降低钝化和污染的风险。然而,实验可能经常使用数百个 梅洛氏杆菌,这使得胰岛素注射器的使用成本高昂且浪费。 - 对于优化抗菌治疗的研究,包括两个额外的对照:一组感染细菌,然后注射载体 “假 ”治疗,一组用载体注射两次,一次在感染其他情况时注射,一次在治疗时注射。
注意:前者是未经治疗的对照,而后者控制注射引起的任何创伤。当使用钝针时,这种创伤更容易发生。
- 包括两组 PBS 对照:一组在其余感染之前注射,以确保注射器锋利且适合使用,另一组在细菌感染期间或之后注射,以确保感染组之间进行适当灭菌。如果使用新的病原体进行优化,请包括热处理对照,以确保死亡不是对外来颗粒的免疫反应的结果。
- 从活饵供应商处订购 G. mellonella,或如前所述维持 G. mellonella 菌落 5,6,7。对于材料表中列出的供应商,订购计划幼虫数量的 1.8 倍,因为根据大小,大约 33% 的幼虫将被排除在外,另外 10% 的幼虫可能会在角质层灭菌后死亡。
- 在实验使用前确定 G. mellonella 的体重变异性,并确保体重范围不超过平均值的一个标准差。
注意: 对于材料 表中未列出的供应商,请安排供应商提供新库存。
- 在实验使用前确定 G. mellonella 的体重变异性,并确保体重范围不超过平均值的一个标准差。
- 收到后,将 G. mellonella 储存在室温下,以限制在 37 °C 下孵育后发生的茧状机会。
注意:并非所有来自商业供应商的幼虫都会形成茧,茧以前曾被用作幼虫健康的指标16。 - 在收到幼虫后 1 周内使用,在这种情况下,它们不需要喂食。
注意:尽管幼虫生命阶段因批次而异,但大多数幼虫是在化蛹前的最后一个龄期分娩的。与早期阶段相比,在这个阶段,喂养自然减少17。
2. 梅洛氏杆菌 幼虫的杀菌和选择
- 称量 Galleria mellonella 幼虫并丢弃任何超出 224 毫克± 49.2 毫克范围的幼虫,这是幼虫的平均重量正负一个标准差。这将导致大约 33% 的幼虫被排除。
注意: 不同供应商的重量差异可能有所不同。对于本协议中未列出的供应商,请计算适当的重量范围。 - 在无菌条件下执行以下步骤。
- 将 70% 乙醇喷洒到培养皿中,确保足以覆盖培养皿底部。
- 分批对 G. mellonella 的表面进行消毒,每批 10-20 只幼虫。
- 将每批单独放入培养皿中,并用 70% 乙醇喷洒幼虫两次。
- 用镊子滚动幼虫,确保完全覆盖。
- 从乙醇中取出幼虫,并将它们放入无菌培养皿中。不要盖上盖子,让幼虫干燥。
注意:将 G. mellonella 留在乙醇中超过 15 秒会导致高死亡率。
- 一旦大约 90% 的幼虫在 2 小时后恢复活动,根据 表 1 中详述的功率计算,将恢复的幼虫分成一定大小的组,以便充分检测存活变化。
- 在灭菌后 6 小时内使用 G. mellonella 。
3. 优化细菌接种物密度
- 在感染前准备已知 CFU/mL 的细菌感染原液。生成储液的方法因生物体而异。在这里, 铜绿假单胞 菌在营养液中生长至对数中期,分装,并以 6 x 107 CFU/mL 的密度冷冻。
- 通过在室温下以 10,000 x g 离心 5 分钟来沉淀感染原液,并在 PBS 中重悬。考虑到每个幼虫注射 10 μL 接种物,将细菌原液连续稀释 10 倍,以产生每只幼虫 101-10 7 CFU 的接种剂量范围。
注:特定接种剂量范围会因细菌毒力而异,但此处建议的范围应适用于大多数致病物种。 体外 生长速率测定有助于选择合适的剂量范围,因为液体培养物中的菌株特异性生长速率与幼虫死亡率相关。 - 在开始感染之前,用 Miles 和 Misra 系列稀释液计数接种物,以准确确定接种物密度18。
- 准备三个 1 mL 微量离心管,其中包含无菌 dH2O、70% 乙醇或无菌 PBS。这些将持续用于对用于注射幼虫的注射器进行消毒。
- 检查无菌的 100 μL Hamilton 注射器,确保针尖锋利且没有形成钩子,否则会对感染部位造成严重创伤。
注意: Hamilton 注射器针尖将在大约 300 次感染后开始翘曲。如果针尖翘曲,则必须更换针尖。 - 感染前用 dH2O、乙醇和 PBS 依次清洗注射器,吸取并丢弃注射器的最大容量。
- 涡旋重悬的感染接种物,并将最多 100 μL 吸入 Hamilton 注射器中,足以为每个幼虫注射 10 μL。
- 在每只幼虫的右后前腿注射 10 μL 接种物。确保针头刺入体内约 2 毫米。
注意:可以使用各种感染方法。这些方法包括将幼虫放在移液器吸头上以露出前肢,静态固定注射器并用手定位 梅洛氏杆菌 ,或徒手注射。 - 在每组感染之间,按照步骤 2.5 中的详细说明对注射器进行消毒,以防止残留皮肤共生物污染。
- 将受感染的幼虫在足以促进微生物生长的温度下孵育,在 20 °C 和 42 °C 之间,这是梅 洛氏杆菌 存活的适当范围5。
- 从通常首次观察到死亡率的时间开始,定期监测 梅克隆梭 菌的存活率,以准确测量死亡时间。这必须在初始筛选中进行评估。取出所有死亡的幼虫并记录它们的死亡时间。
- 根据 18 小时死亡率为 50% 和 72 小时死亡率超过 80% 的剂量为治疗测试研究选择最佳感染剂量。这允许开发快速的单日筛选,同时确保足够的毒力和适当的治疗窗口。
4. 新型抗菌剂在未感染幼虫中的毒性试验
- 在与实验感染的幼虫一起使用之前,评估 Galleria mellonella 中新型抗菌剂和选定载体的毒性。在 体外 (例如细胞系)毒性数据(如果有)的指导下,准备超出抗菌药物预期治疗范围的广泛剂量。
- 考虑将向幼虫注射 10 μL 的治疗剂。制备浓度与输送治疗剂的浓度相匹配的仅载体对照。
- 按照步骤 3.2-3.10 中的详细说明,以适当的组大小注射具有不同抗菌剂和 PBS 载体浓度的健康、无菌梅 洛氏菌 。在本研究中,使用的抗菌剂是妥布霉素。
注意:对于需要 DMSO 作为溶剂的试剂,请使用 26 号针头注射,而不是标准的 22 号针头,因为使用 DMSO 时,较大针头的创伤会增加死亡率。 - 将安全剂量定义为与仅注射 PBS 的幼虫相比,死亡率没有显着差异的剂量。
5. 使用抗菌剂优化治疗梅克隆酵母菌感染
- 考虑到感染的幼虫用 10 μL 剂量处理,准备一系列剂量的抗菌剂。使用一系列毒性最小的剂量,如步骤 4 中评估的那样。
- 按照该方案的步骤 1 和 2 以先前优化的感染剂量在适当的组中制备和感染 Galleria mellonella 。
- 感染后 2 小时,用准备好的抗菌剂或载体对照溶液处理幼虫。按照步骤 3.2-3.8,注射到与感染期间注射的相反的前肢。在组之间对针头进行消毒。
注意:选择在 2 小时进行治疗以进行此优化,以获得强剂量反应数据,从中确定治疗时间的后续优化19。 - 每隔 30 分钟监测一次梅 洛氏杆菌 的存活率,或者从通常首次观察到死亡率开始更频繁地监测。取出所有死亡的幼虫并记录它们的死亡时间。
- 计算治疗组之间生存比例的变化。使用 Kaplan-Meier 生存分析来确定治疗是否会导致幼虫死亡率显著改变。在多组分析中包括对成对多重性的适当事后校正。
6. 优化感染的梅克隆芽孢杆菌的治疗时机
- 按照步骤 1 和 2 以先前优化的感染剂量在适当的组中制备 Galleria mellonella 。
- 以先前在步骤 4 中优化的剂量制备抗菌剂。
- 在感染后 2 小时、4 小时、6 小时、9 小时或 12 小时,按照步骤 3.2-3.8 处理受感染的幼虫,以比较治疗时间如何影响死亡率。
- 每隔 30 分钟监测一次梅 洛氏杆菌 的存活率,或者从通常首次观察到死亡率开始更频繁地监测。取出所有死亡的幼虫并记录它们的死亡时间。最佳时机是在初始优化治疗剂量后维持观察到的生存率的时间。
注意:在测试 G. mellonella 的抗菌效果时,分别优化治疗剂量和时间,使用前者来告知后者的治疗剂量。
Representative Results
评估 梅克隆氏菌 重量的批次变异
感染实验中不需要的变化的一个潜在来源是单个实验单元(即幼虫)之间和批次之间的大小差异。这种变化的影响可以通过根据体重调整治疗剂量或感染剂量,或者只选择定义体重范围内的幼虫用于实验来减轻。后一种调整更实用,不受剂量制备过程中可能出现的人为错误的影响。称量幼虫的另一个优点是,它能够将治疗剂量从给予幼虫的剂量转换为其 mg/kg 人类当量。为了量化批次内和批次间的差异,对在不同时间订购的三批 50 只幼虫进行了称重。每组平均体重为 225.5 mg、230.54 mg 和 215.86 mg,标准差分别为 49.1 mg、53.7 mg 和 44.3 mg(图 2A)。批次之间,重量没有显著差异。各批次的体重范围为 107.5 毫克至 341.0 毫克,平均值为 224.0 毫克± 49.2 毫克。
为了获得可重复的结果,在实验前称量幼虫,并选择其体重为 224 mg ± 49.2 mg,将重量范围从 233.5 mg 减少到 98.4 mg,并去除 33% 的幼虫。这与之前的工作一致,该工作确定了体重带大于 100 毫克的 MRSA 感染幼虫的存活率存在显着差异14,20。我们还比较了梅洛氏杆菌分娩时的体重与分娩后一周的体重,因为当幼虫到达时没有立即使用,任何显着的体重变化都会影响实验结果。梅洛氏菌平均重量为 230.54 mg ± 53.7 mg。分娩后一周,平均体重为 221.8 mg ± 45.7 mg 标准差(图 2B)。到达时的体重和一周后的体重之间没有显著差异,由此我们得出结论,幼虫可以在分娩后第一周内的任何时候用于实验目的。需要注意的是,这些结果仅代表从一个供应商处购买的 G. mellonella,并且不同供应商之间或在不同时间订购幼虫时的重量可能有很大差异。
优化 铜绿假单 胞菌 PAO1 的接种密度
评估了 5 株铜 绿假单 胞菌分离株在 4 种接种密度下的毒力,包括 3 种常用的实验室菌株 PAO1 、 PA14 和 PAK,以及 2 种来自慢性呼吸道感染的临床分离株 LESB58 和 IST27-M。这些被用作 Mahenthiralingam 等人开发的 CF 相关菌株面板的一部分。21 并且代表了该物种的全球系统发育。营养肉汤中的初步生长数据显示,慢性感染分离株的生长速率较低(图 3)。考虑到这一点,梅 洛氏杆菌 以 10 只幼虫为一组感染,剂量为 101、102、103 或 104 CFU/幼虫在 10μl PBS 中用于 PAO1、PA14 和 PAK,剂量为 102、103、104 或 105 CFU/幼虫用于 LESB58 和 IST27-M。两组 10 只幼虫也仅注射 PBS,一组在感染前注射,一组在感染后注射。感染前注射 PBS 可控制受污染的 PBS 或针头被 Galleria 角质层中的微生物污染,而感染后注射 PBS 可控制感染过程中使用的细菌对针头的任何污染。PAO1 、 PA14 和 PAK 的最佳剂量为 10 CFU/幼虫,因为更大的密度导致 18 小时> 50% 的死亡(图 4)。10 CFU 是可以可靠且可重复地为感染准备的最低剂量。需要更高剂量的 LESB58 和 IST27-M 才能达到所需的存活动力学,这反映了这些分离株在 体外 条件下的生长较慢和载能力较低(图 4)。两者的最佳剂量为 104 CFU/幼虫。LESB58 和 IST27-M 是来自慢性感染个体的临床分离株,LESB58 以前在啮齿动物模型中的毒力低于 PAO122。
妥布霉素和粘菌素在 Galleria mellonella 中的毒性试验
在评估新型抗菌化合物的疗效之前,必须通过注射广泛的临床相关剂量来评估其毒性。这使得高毒性化合物可以在临床前管道的早期从测试中去除。对未感染的梅克隆球菌幼虫评估了妥布霉素和粘菌素,因为它们通常用于治疗囊性纤维化 (pwCF) 患者的铜绿假单胞菌感染23。妥布霉素的临床使用范围从无囊性纤维化的重症个体每天 3 mg/kg 到囊性纤维化患者每 24 小时 11 mg/kg24,25。这些值用作 Galleria mellonella 剂量的指南,选择 1 mg/kg、2.5 mg/kg、5 mg/kg、10 mg/kg、25 mg/kg、50 mg/kg、100 mg/kg、250 mg/kg 妥布霉素进行毒性测试。在任何浓度下均未观察到死亡。考虑到妥布霉素在高浓度下没有毒性,对粘菌素毒性进行了评估,因为它以前与 29.8% 的 pwCF 的肾或神经毒性有关,负荷剂量为 2.9 (±1.5) mg/kg,总日剂量为 4.1 (±1.1) mg/kg26。这使其成为毒性测试的有价值的候选者,尽管对人类的器官特异性影响表明毒性可能不会转化为梅洛氏杆菌。事实上,当给予 1 mg/kg、2.5 mg/kg、5 mg/kg、10 mg/kg、25 mg/kg、50 mg/kg、100 mg/kg 和 250 mg/kg 的粘菌素剂量时,在 72 小时内未观察到幼虫死亡。因此,粘菌素最终在 H2O 中以最高溶解度 2000 mg/kg 给药。在 12 小时内观察到所有幼虫的死亡,证实可以在 G. mellonella 中评估药物毒性,但在尝试预测人类毒性时应谨慎。
优化妥布霉素治疗铜 绿假单 胞菌 PAO1 感染的剂量
对铜绿假单胞菌感染的幼虫施用一系列临床相关的妥布霉素剂量,以优化治疗剂量。对于新型抗菌剂,可以根据类似现有抗生素的临床使用情况或新型药物的临床前数据(例如肉汤最低抑菌浓度)初步选择剂量。为了评估妥布霉素对铜绿假单胞菌 PAO1 的疗效,梅洛氏杆菌幼虫感染 10 CFU 铜绿假单胞菌 PAO1,如前所述,并在感染后 2 小时注射 1 mg/kg、2.5 mg/kg 或 5 mg/kg 妥布霉素。这些剂量是根据之前 G. mellonella 与妥布霉素的研究选择的,并且与目前无囊性纤维化个体的妥布霉素临床剂量一致 24,27,28。
初步成功的阈值是与未治疗的对照组相比, 梅洛氏杆菌 存活率增加 50%。用 1 mg/kg 妥布霉素处理 PAO1 对 梅洛氏菌 死亡率影响不大,感染后 28 小时死亡率为 90%(图 5)。用 2.5 mg/kg 妥布霉素治疗可延迟死亡率,但用 5 mg/kg 妥布霉素治疗可使总体死亡率降低 80%,从而获得最佳的 90% 生存率。PA14 的有效剂量为 5 mg/kg,而 PAK 的有效剂量为 2.5 mg/kg。IST27-M 的有效剂量较高,为 10 mg/kg,而没有测试的妥布霉素浓度足以将幼虫从 LESB58 感染中拯救出来。这一趋势与阳离子调整的 Mueller Hinton 肉汤中妥布霉素的最低抑菌浓度 (MIC) 值相关,其中 1 μg/mL 足以抑制除 LESB58 外所有菌株 90% 的生长,LESB58 的 MIC 为 8 μg/mL。因此,初始 MIC 测试可用于指示菌株之间的相对耐药性,但不应用于确定 梅洛氏菌的剂量范围,应单独优化。
针对 铜绿假单 胞菌 PAO1 感染的妥布霉素治疗时机的优化
抗生素的临床应用通常不会在感染后数小时内发生,而是在感染后数天或数周内发生。以这种方式测试新型抗菌剂在 G. mellonella 中是无法实现的,因为在感染 铜绿假单 胞菌 PAO1 后 24 小时内观察到高死亡率。为了增加感染模型的相关性,应在感染期间尽可能晚地使用新型抗菌药物。为了优化治疗时间,在感染后 2 小时、 4 小时、 6 小时、 9 小时和 12 小时对 PAO1 感染的 梅洛氏杆菌 幼虫给予 5 mg/kg 妥布霉素。实验成功定义为与 PAO1 感染相比,抗生素治疗使生存率增加 >50%。9 小时和 12 小时的治疗延迟了死亡率,尽管它无法解决感染(图 6)。2 小时、4 小时和 6 小时的处理存活率超过 50%。
优化 梅克隆猪 (G. mellonella ) 群体大小
实验组规模是根据感染 10 CFU / 铜绿假单胞菌 PAO1 幼虫后在梅洛氏菌存活率中观察到的变化计算的。在任何研究中,组大小都可能根据未处理对照组和治疗组之间的预期百分比变化而有所不同(表 1)。按照 Charan 等人 29 描述的计算进行。使用的方程如下所述。
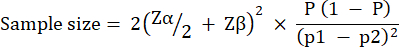
哪里:
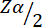 = 1.96,类型 1 误差为 5%。
= 1.96,类型 1 误差为 5%。
Zβ = 0.842 是提供 80% 统计功效的值。
p1 = 测试组中事件的比例,计算公式为 p2 + 预期百分比变化
p2 = 对照(未经治疗的感染)组中的事件比例,根据铜绿假单胞菌 PAO1 生存变异性计算。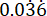
P = 汇总患病率,定义为 (p1 + p2)/2。
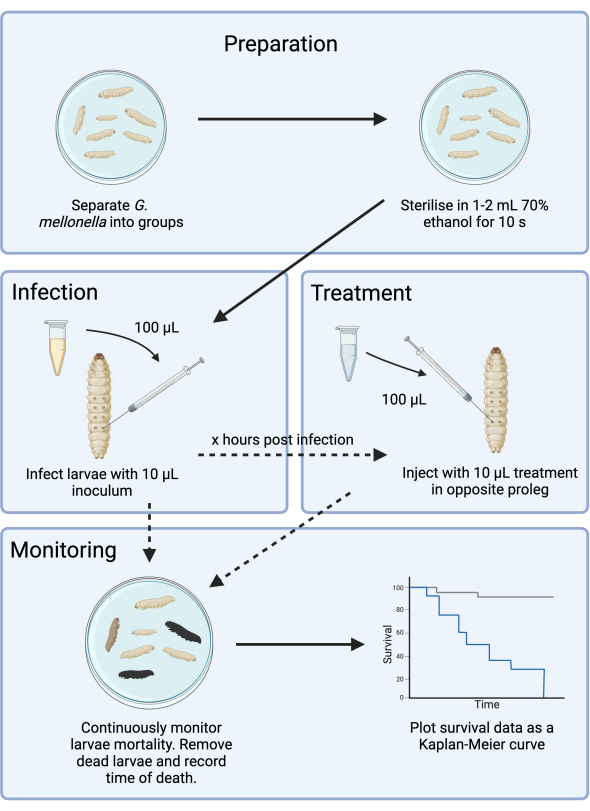
图 1: 梅洛氏杆菌 感染研究示意图。 一般方案包括在感染前准备 梅洛氏杆菌 幼虫,用 10 μL 接种物感染,感染后数小时进行可选处理,以及持续监测。 请单击此处查看此图的较大版本。
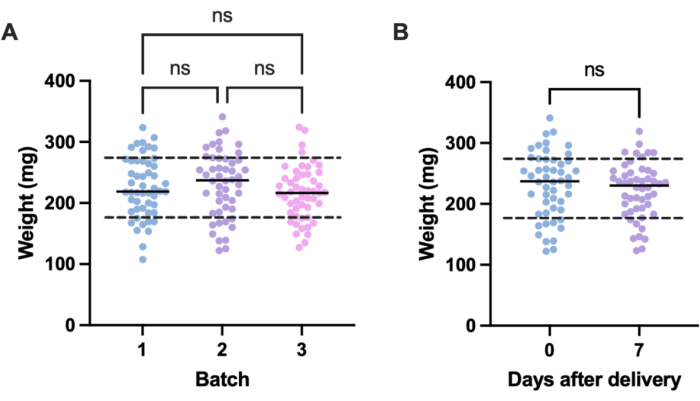
图 2: Galleria mellonella 幼虫体重的批次和时间依赖性变化。 (A) 三批 50 只 Galleria mellonella 幼虫的重量,交货后立即称重。每批都是在不同的时间订购的。通过单因素方差分析计算的批次间重量无显著差异 (P > 0.05)。(B) 收到时称量 50 只幼虫的重量与一周后称量的同一批次的重量进行比较。通过学生 t 检验 计算的体重没有显着差异 (P > 0.05)。ns:不显著。 请单击此处查看此图的较大版本。
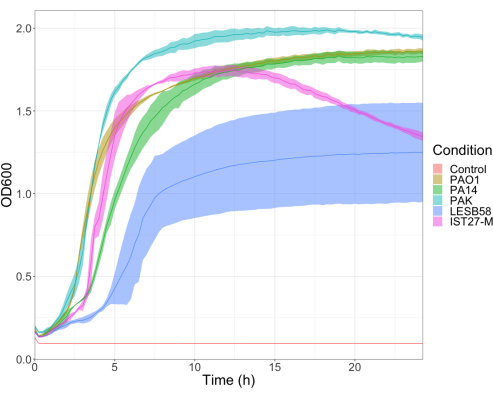
图 3:铜绿假单胞菌菌株 PAO1、PA14、PAK、LESB58 和 IST27-M 的生长曲线。每个菌株在 LB 中从 0.08-0.13 的初始 OD600 开始生长,随后在 37 °C 的 24 小时静态生长期间每 15 分钟测量一次 OD600。请单击此处查看此图的较大版本。
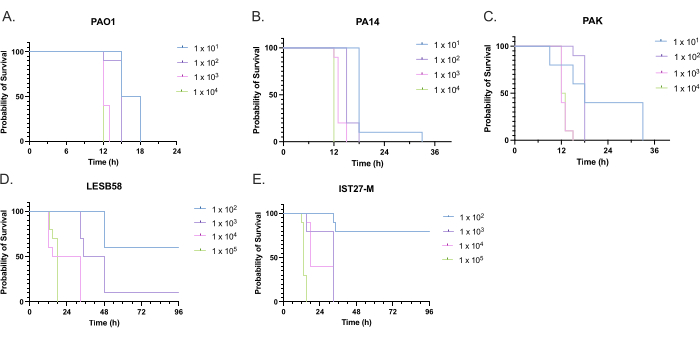
图 4:铜绿假单胞菌菌株感染 Galleria mellonella 幼虫的接种密度优化。 注射不同密度的每只幼虫的菌落形成单位 (CFU) 后 Galleria mellonella 幼虫的存活率。(A) PAO1、(B) PA14 或 (C) PAK 测试的接种密度为每只幼虫 10、10²、10³ 或 104 CFU,(D) LESB58 和 (E) IST27-M 每只幼虫 10²、10³、104 或 105 CFU。每组使用 10 只幼虫,每只幼虫在右后腿注射 10 μL 接种物。从感染后 16 小时开始,每 30 分钟监测一次生存率,并记录死亡时间。所有菌株均表现出剂量依赖性毒力,由 Log-rank (Mantel-Cox) 显着性检验确定。除 PAK 101与外,所有菌株内剂量比较的 P < 0.05。PAK 102, PAK 103vs.PAK 104, LESB58 104对LESB58 105 和 IST27-M 103对。IST27-M 104,这并不显著。该图代表了 3 个生物学重复。请单击此处查看此图的较大版本。
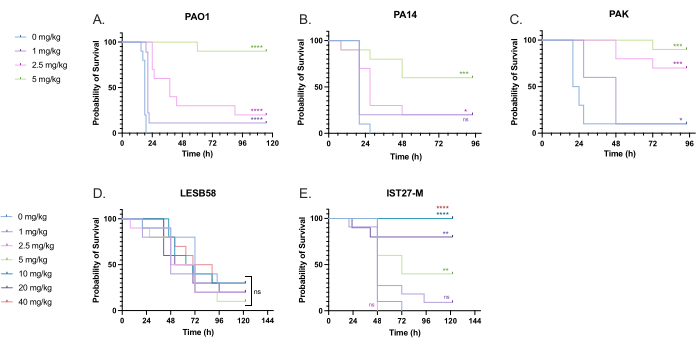
图 5:感染后 2 小时注射铜绿假单胞菌面板菌株并用硫酸妥布霉素处理后 Galleria mellonella 幼虫的存活率。 每个实验组 10 只梅洛氏菌幼虫感染 10 CFU 的 (A) PAO1、 (B) PA14 或 (C) PAK 或 103 CFU 的 (D) LESB58 或 (E) IST27-M,溶于 10 μL PBS 中。感染发生在左后腿。感染后 2 小时,注射 10 μL PBS 作为无处理对照,注射 PAO1、PA14 和 PAK,1 mg/kg、2.5 mg/kg 或 5 mg/kg 妥布霉素,LESB58 和 IST27-M 用 10 μL PBS、1 mg/kg、2.5 mg/kg、5 mg/kg、10 mg/kg、20 mg/kg 或 40 mg/kg 妥布霉素处理, 如图所示。妥布霉素用蒸馏水稀释,并在右后前肢给药。持续监测生存情况,并记录死亡时间。显著性 vs. 的对数秩 (Mantel-Cox) 检验。每种菌株的 PBS 对照。ns: 不显著, *P < 0.05, **P < 0.005, ***P < 0.0005 ****P < 0.0001.该图代表了 3 个生物学重复。请单击此处查看此图的较大版本。
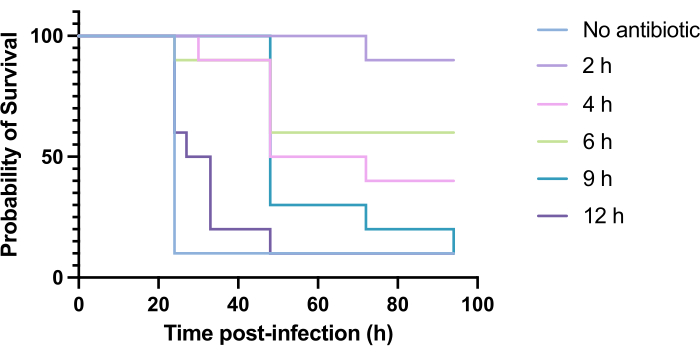
图 6:感染铜绿假单胞菌 PAO1 并随后用妥布霉素治疗后梅洛氏菌幼虫在感染后不同时间点的存活率。 每个实验组 10 只梅洛氏菌幼虫用 10 CFU 的 PAO1 溶于 10 μL PBS 中,注射到右后前腿中。随后在感染后 2 小时、 4 小时、 6 小时、 9 小时或 12 小时在左后腿的 10 μL 蒸馏水中注射 5 mg/kg 硫酸妥布霉素。持续监测生存情况,并记录死亡时间。显著性 vs. 的对数秩 (Mantel-Cox) 检验。未处理的对照。P < 0.0005,******P < 0.0001。该图代表了 3 个生物学重复。请单击此处查看此图的较大版本。
| 预期生存率变化 (%) | 小组规模 |
| 30 | 26 |
| 40 | 18 |
| 50 | 13 |
| 60 | 10 |
| 70 | 8 |
| 80 | 6 |
| 90 | 5 |
| 100 | 4 |
表 1: 梅克隆球菌 存活实验的组数,其中 梅球球菌 幼虫感染 10 CFU/铜 绿假单 胞菌 PAO1 幼虫,随后施用药物。
Discussion
抗微生物药物耐药性 (AMR) 的负担不断增加。2019 年,全球估计有 495 万人死亡与 AMR 相关30。到 2050 年,抗微生物药物耐药性造成的死亡估计将达到 1000 万31。为了应对这一风险,必须高效且经济地开发和测试新型抗菌药物,因此需要使用准确预测抗菌疗效的临床前模型。在转化为临床试验期间观察到的高流失率是一个主要的限制因素。一项研究描述了 13 种在临床试验中失败的候选抗生素,其中 11 种未能进入 II 期32。
本研究为梅洛氏杆菌临床前抗菌筛选研究的优化提供了框架,并提供了抗菌疗效评估方法。G. mellonella 幼虫在评估药物毒性、MIC 测定和毒力测试方面具有相当大的效用,同时有助于减少临床前开发中使用的哺乳动物。Galleria mellonella 幼虫具有相对较高的通量,具有生物学相关性,并且可以很好地转化为更复杂的哺乳动物模型。同时,野生型实验室小鼠每只成本在 8 到 30 英镑之间,每只小鼠每周维护 ~7 英镑,而 G. mellonella 每 50 只幼虫的成本为 ~2 英镑。因此,在 G. mellonella 模型中测试 10 种化合物将花费 ~60 英镑,而在小鼠中进行相同的研究则需要 4000 英镑以上。此外,以前的研究比较了新化合物的毒性和疗效,并确定了 G. mellonella 和小鼠急性毒性之间的相关性 8,19,33。因此,建议实施梅洛氏菌筛选,以优先考虑在小鼠模型中进一步测试的化合物。
尽管该模型具有明显的实用性,但要确保成功应用,还需要考虑几个因素。缺乏研究级的不育幼虫使它们的实验用制剂复杂化,因为需要乙醇灭菌,或者研究人员需要维持自己的梅洛氏杆菌菌落,这将降低污染风险并提高整体实验质量 5,6。灭菌不当会导致相当高的死亡率,并且对生物体进行完全灭菌具有挑战性,因为较长的乙醇暴露时间会导致死亡。替代的绝育方法包括在感染前用 70% 乙醇擦拭每只幼虫的前腿,这将降低绝育过程中的死亡率,但是一种更费力的方法。也可以使用其他防腐剂,但本研究中没有评估替代品,因为乙醇灭菌一旦优化,死亡率为 <10%。此外,通常不清楚供应商是否用抗生素治疗他们的梅洛氏杆菌,因为供应商可能从其他供应商那里采购幼虫,而不是自己维护菌落。
G. mellonella 生物学与哺乳动物有很大不同,这对其效用施加了限制。他们的免疫系统缺乏任何适应性免疫,尽管存在先天免疫的关键可溶性和细胞方面。血细胞是 梅洛氏杆菌 的主要先天免疫防御,并表现出吞噬细胞样特性。 已经描述了这些细胞的各种亚群,包括粒细胞和浆细胞等34。 G. mellonella 也不能概括相关的感染部位,例如呼吸道或膀胱感染的部位。然而,在临床前管道中, G. mellonella 将作为小鼠模型的预筛选,确保只有最有前途的化合物才能进入更接近人类感染环境的复杂哺乳动物系统。最后,该模型将受益于 G. mellonella 的进一步基因组表征,以确定其是否适合评估临床相关生物标志物的变化。特别是,这需要提高我们对梅 洛氏杆菌 免疫力的理解。
总体而言, Galleria mellonella 感染模型是在哺乳动物模型中评估新型抗菌化合物之前对其进行临床前评估的宝贵工具。虽然由于缺乏供应标准化,它们的使用很复杂,但它们的应用通量高、简单,并且可以广泛应用于抗菌药物开发领域。未来,将该模型整合到标准化的临床前管道中可以加速新抗菌化合物的开发,以增加从临床前评估进入临床试验的候选药物的比例。
Disclosures
作者没有什么可披露的。
Acknowledgements
TB、AK、JF 和 DN 获得了战略研究中心 (SRC) 的赠款支持“囊性纤维化抗菌疗法开发的循证临床前框架”(PIPE-CF;项目编号SRC 022) 的 S Varit Varis Trust(SRC 022)。LD 和 JF 感谢 Kidney Research North West(项目编号 49/19)的资助。
Materials
| Name | Company | Catalog Number | Comments |
| 22s gauge, Small Hub RN Needle, 2 in, point style 2 | Hamilton | 7758-03 | Replacement for the Hamilton syringe. |
| Bacterial infection stocks | Bacterial stocks of a known density (CFU/mL) frozen during mid-exponential phase of growth. | ||
| Ethanol | Fisher Scientific | 10610813 | Other manufacturers may be used. |
| G. mellonella larvae | Livefoods | 5.06045E+12 | For this supplier, orders are marked as “New stock for lab use”. As of April 2024, new stock is delivered to the supplier on Mondays. Orders should be placed then, for delivery on Wednesdays. |
| Microliter syringe | Hamilton | 80630 | The 80630 syringe has a 100 µL capacity. Other volumes exist, such as the 80430, 80530 or 80730. |
| Petri dish | Fisher Scientific | 12674785 | Other manufacturers may be used. |
References
- Menard, G., Rouillon, A., Cattoir, V., Donnio, P. Y. Galleria mellonella as a suitable model of bacterial infection: Past, present and future. Front Cell Infect Microbiol. 11, 782733 (2021).
- Piatek, M., Sheehan, G., Kavanagh, K. Galleria mellonella: The versatile host for drug discovery, in vivo toxicity testing and characterizing host-pathogen interactions. Antibiotics. 10 (12), 1545 (2021).
- Miethke, M., et al. Towards the sustainable discovery and development of new antibiotics. Nat Rev Chem. 5 (10), 726-749 (2021).
- Seyhan, A. A. Lost in translation: The valley of death across preclinical and clinical divide - identification of problems and overcoming obstacles. Transl Med Commun. 4 (1), (2019).
- Firacative, C., et al. Rearing and maintenance of Galleria mellonella and its application to study fungal virulence. J Fungus. 6 (3), 130 (2020).
- Pereira, M. F., Rossi, C. C. Overview of rearing and testing conditions and a guide for optimizing Galleria mellonella breeding and use in the laboratory for scientific purposes. APMIS. 128 (12), 607-620 (2020).
- Jorjão, A. L., et al. From moths to caterpillars: Ideal conditions for Galleria mellonella rearing for in vivo microbiological studies. Virulence. 9 (1), 383-389 (2018).
- Tsai, C. J. -. Y., Loh, J. M. S., Proft, T. Galleria mellonella infection models for the study of bacterial diseases and for antimicrobial drug testing. Virulence. 7 (3), 214-229 (2016).
- Gallorini, M., et al. Immunophenotyping of hemocytes from infected Galleria mellonella larvae as an innovative tool for immune profiling, infection studies and drug screening. Sci Rep. 14, 759 (2024).
- Smith, F. Q., Casadevall, A. Fungal immunity and pathogenesis in mammals versus the invertebrate model organism Galleria mellonella. Pathog Dis. 79 (3), ftab013 (2021).
- Sugumaran, M. Comparative biochemistry of eumelanogenesis and the protective roles of phenoloxidase and melanin in insects. Pigment Cell Res. 15 (1), 2-9 (2002).
- Sheehan, G., Garvey, A., Croke, M., Kavanagh, K. Innate humoral immune defences in mammals and insects: The same, with differences. Virulence. 9, 1625-1639 (2018).
- Wright, C. L., Kavanagh, O. Galleria mellonella as a novel in vivo model to screen natural product-derived modulators of innate immunity. Appl Sci. 12 (13), 6587 (2022).
- Newton, S. M., et al. Use of the invertebrate Galleria mellonella as an infection model to study the Mycobacterium tuberculosis complex. J Vis Exp. (148), e59703 (2019).
- Frankel, G., Collins, J. W., Schroeder, G. N., Harding, C. R. Use of Galleria mellonella as a model organism to study Legionella pneumophila infection. J Vis Exp. (81), e50964 (2013).
- Romera, D., et al. The Galleria mellonella infection model as a system to investigate the virulence of Candida auris strains. Pathog Dis. 78 (9), ftaa067 (2020).
- Kwadha, C. A., Ong'amo, G. O., Ndegwa, P. N., Raina, S. K., Fombong, A. T. The biology and control of the greater wax moth, Galleria mellonella. Insects. 8 (2), 61 (2017).
- Miles, A. A., Misra, S. S., Irwin, J. O. The estimation of the bactericidal power of the blood. J Hyg. 38, 732-749 (1938).
- Ignasiak, K., Maxwell, A. Galleria mellonella (greater wax moth) larvae as a model for antibiotic susceptibility testing and acute toxicity trials. BMC Res Notes. 10 (1), 428 (2017).
- Hesketh-Best, P. J., Mouritzen, M. V., Shandley-Edwards, K., Billington, R. A., Upton, M. Galleria mellonella larvae exhibit a weight-dependent lethal median dose when infected with methicillin-resistant Staphylococcus aureus. Pathog Dis. 79 (2), ftab003 (2021).
- Mahenthiralingam, E., Weiser, R., Floto, R. A., Davies, J. C., Fothergill, J. L. Selection of relevant bacterial strains for novel therapeutic testing: a Guidance document for priority cystic fibrosis lung pathogens. Curr Clin MicrobiolRep. 9 (4), 33-45 (2022).
- Carter, M. E. K., et al. A subtype of a Pseudomonas aeruginosa cystic fibrosis epidemic strain exhibits enhanced virulence in a murine model of acute respiratory infection. J Infect Dis. 202 (6), 935-942 (2010).
- Herrmann, G., et al. Colistin-tobramycin combinations are superior to monotherapy concerning the killing of biofilm Pseudomonas aeruginosa. J Infect Dis. 202 (10), 1585-1592 (2010).
- Hennig, S., Standing, J. F., Staatz, C. E., Thomson, A. H. Population pharmacokinetics of tobramycin in patients with and without cystic fibrosis. Clin Pharmacokinet. 52 (4), 289-301 (2013).
- Reyhanoglu, G., Reddivari, A. K. R. . Tobramycin. , (2023).
- Crass, R. L., Rutter, W. C., Burgess, D. R., Martin, C. A., Burgess, D. S. Nephrotoxicity in patients with or without cystic fibrosis treated with polymyxin b compared to colistin. Antimicrob Agents Chemother. 61 (4), e02329-e02416 (2017).
- Deacon, J., et al. Antimicrobial efficacy of tobramycin polymeric nanoparticles for Pseudomonas aeruginosa infections in cystic fibrosis: Formulation, characterization and functionalization with dornase alfa (DNase). J Control Release. 198, 55-61 (2015).
- Tamma, P. D., et al. Infectious Diseases Society of America 2022 guidance on the treatment of extended-spectrum β-lactamase producing enterobacterales (ESBL-E), carbapenem-resistant enterobacterales (CRE), and Pseudomonas aeruginosa with difficult-to-treat resistance (DTR-P. aeruginosa). Clin Infect Dis. 75 (2), 187-212 (2022).
- Charan, J., Kantharia, N. D. How to calculate sample size in animal studies. J PharmacolPharmacother. 4 (4), 303-306 (2022).
- Murray, C. J. L., et al. Global burden of bacterial antimicrobial resistance in 2019: A systematic analysis. Lancet. 399 (10325), 629-655 (2022).
- de Kraker, M. E. A., Stewardson, A. J., Harbarth, S. Will 10 million people die a year due to antimicrobial resistance by 2050. PLoS Med. 13 (11), e1002184 (2016).
- Prasad, N. K., Seiple, I. B., Cirz, R. T., Rosenberg, O. S. Leaks in the pipeline: A failure analysis of gram-negative antibiotic development from 2010 to 2020. Antimicrob Agents Chemother. 66 (5), e0005422 (2022).
- Wang, S., et al. A novel Galleria mellonella experimental model for zoonotic pathogen Brucella. Virulence. 14 (1), 2268496 (2023).
- Senior, N. J., Titball, R. W. Isolation and primary culture of Galleria mellonella hemocytes for infection studies. F1000Res. 9, 1932 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved