Galleria mellonella в качестве модели антимикробного скрининга
In This Article
Summary
В этом исследовании представлена стандартизированная структура для оптимизации моделей инфекции G. mellonella для использования в доклинической оценке антимикробных препаратов. Применение модели G. mellonella в рамках доклинической разработки антимикробных препаратов может уменьшить количество неэффективных соединений, проходящих клинические испытания.
Abstract
Для борьбы с растущей глобальной проблемой устойчивости к антибиотикам необходима ускоренная разработка новых антибиотиков. В настоящее время доклинические разработки противомикробных препаратов дают значительное количество выводов, которые оказываются непригодными ни до, ни во время клинических испытаний. Для повышения эффективности доклинических разработок необходимо разработать актуальные, стандартизированные, доступные и экономически эффективные модели. Личинки Galleria mellonella (большая восковая моль) широко используются в качестве модели инфекции для оценки вирулентности микроорганизмов, проведения испытаний на токсичность лекарственных препаратов и служат в качестве предварительного средства оценки эффективности новых антимикробных соединений in vivo . Эти модели инфекций имеют большую биологическую значимость, чем многие скрининги in vitro с сопоставимой пропускной способностью, и снижают зависимость от моделей млекопитающих при использовании в качестве предварительного скрининга для тестирования противомикробных препаратов. В этом протоколе описывается стандартизированная методология оптимизации моделей инфекции G. mellonella , которая может быть применена к видам бактерий и противомикробным препаратам выбора. На примере приоритетного патогена ВОЗ Pseudomonas aeruginosa мы намечаем шаги, которые могут быть предприняты для разработки воспроизводимой модели инфекционного и терапевтического тестирования. Это включает в себя рекомендации по экспериментальной установке, подготовке образцов, протоколам инфицирования и лечения. Интеграция этой модели в процессы доклинической разработки антимикробных препаратов снизит зависимость от моделей млекопитающих, уменьшит количество неэффективных соединений, проходящих клинические испытания, и, в конечном итоге, повысит эффективность доклинических разработок антимикробных препаратов.
Introduction
Личинки Galleria mellonella (большая восковая моль) широко используются в биологических науках в качестве моделей инфекций микробных видов, а также для тестирования токсичности новых лекарственных соединений 1,2. Они обладают значительным потенциалом полезности в процессе доклинических испытаний противомикробных препаратов, поскольку обладают высокой пропускной способностью, воспроизводят интегральные характеристики инфекции человека in vivo и снижают зависимость от моделей млекопитающих, в соответствии с принципами сокращения, уточнения и замены, которые регулируют этичное использование видов млекопитающих в исследованиях.
Разработка новых антибиотиков требует обширных доклинических испытаний на моделях in vitro и in vivo до клинической валидации3. Лишь немногие новые препараты с многообещающими пакетами доклинических данных когда-либо доходят до клиники, и одним из факторов, обусловливающих такой высокий уровень отсева, является неспособность доклинических скринингов охватить сложности инфекционной среды4. Эти проблемы способствуют не только низкой скорости трансляции антимикробных препаратов в клинику, но и более широкому использованию экспериментальных позвоночных животных во время доклинического скрининга на поздних стадиях. Для улучшения доклинической оценки новых противомикробных препаратов и сокращения использования дорогостоящих, трудоемких, сложных и этически проблемных мышиных моделей in vivo необходимы более совершенные инструменты скрининга лекарственных препаратов на ранних стадиях, которые уменьшают количество бесперспективных соединений, проходящих тестирование в системах позвоночных.
G. mellonella имеет короткий жизненный цикл продолжительностью 8 недель, состоящий из четырех жизненных стадий: яйцо, личинки, куколки и взрослые особи, из которых личиночная форма используется вэтом протоколе. G. mellonella легко содержать на протяжении всего эксперимента и не требует специального оборудования или специализированного исследовательского центра на животных. Нет необходимости получать этическое одобрение для их использования, и исследователи могут разводить организм внутри компании для улучшения качества эксперимента 2,5,6,7. Иммунная система G. mellonella очень похожа на иммунную систему врожденного иммунитета млекопитающих, обладающую способностью реагировать на «свои» и «чужие»стимулы. Гемоциты отвечают за ассоциированное с патогенами распознавание молекулярных образов и последующий фагоцитоз, играя роль, которая функционально аналогична роли нейтрофилов у человека9. G. mellonella кодирует три типа толл-подобных рецепторов, которые были идентифицированы с помощью гомологии последовательностей для человека, и продуцируют комплемент-подобные белки, которые распознают несобственный материал и образуют локализованные комплексы меланизации после активации и полимеризации фенолоксидазы в меланин10. Это может служить визуальным считыванием здоровья личинки во время экспериментов с инфекцией, поскольку кутикула темнеет из-за меланизации. Следует, однако, отметить, что ось меланизации у насекомых, в которой участвует фенолоксидаза, существенно отличается от оси тирозиназа-меланин у млекопитающих11,12. Кроме того, G. mellonella продуцирует 18 индуцируемых антимикробных пептидов, включая гомологи лизоцима и дефензина13. Это сходство, а также простые процедуры содержания личинок и высокая пропускная способность модели сделали G. mellonella широко используемым организмом при оценке новых лекарств. В доклинической разработке антибиотиков G. mellonella имеет повышенную полезность по сравнению с моделями in vitro, поскольку они могут более точно моделировать взаимодействия хозяина, патогена и лекарства в сложной среде с активным иммунитетом.
В настоящее время в Европе нет стандартизированного поставщика G. mellonella исследовательского класса. Вместо этого исследователи должны покупать личинки G. mellonella в магазинах приманок или содержать собственную колонию. Несмотря на то, что методы поддержания собственной колонии G. mellonella были описаны и могут повысить экспериментальную согласованность 5,6,7, этот вариант, вероятно, будет привлекательным только для тех, кто часто использует личинок. Таким образом, этот протокол сосредоточен на экспериментальной установке после покупки личинок у поставщика живой наживки. Несмотря на то, что этот метод более доступен, он увеличивает сложность эксперимента и может внести дополнительную вариативность в анализы из-за несоответствий в состоянии здоровья личинок в момент их получения от поставщиков. Для того, чтобы ученые, промышленность и регулирующие органы могли принять и внедрить тестирование G. mellonella в рамках процесса доклинической разработки противомикробных препаратов, необходима стандартизированная система оптимизации и оценки эффективности противомикробных препаратов.
Это исследование оптимизирует экспериментальный дизайн модели инфекции G. mellonella для разработки антибиотиков. Несмотря на то, что модели инфекции G. mellonella были описаны14,15, настоящая методология документирует дополнительные шаги по смягчению дополнительной сложности, вызванной непостоянством поставок, и обеспечивает основу для оценки новых противомикробных препаратов. В качестве тестового случая G. mellonella была инфицирована приоритетным по ВОЗ патогеном Pseudomonas aeruginosa, и лечение аминогликозидным агентом (тобрамицином) было оптимизировано. Эта структура, показанная на рисунке 1, обеспечивает основу для будущих доклинических исследований антимикробного скрининга с использованием новых агентов.
Protocol
В этом исследовании личинки Galleria mellonella (большая восковая моль) были выбраны в качестве модели для тестирования чувствительности к антибиотикам и испытаний острой токсичности. Для экспериментального использования Galleria mellonella не требуется никакого этического одобрения. Подробная информация об используемых реагентах и оборудовании приведена в Таблице материалов.
1. Экспериментальный дизайн
- Определите подходящие размеры групп личинок Galleria mellonella на основе пропорционального изменения выживаемости личинок, на которые направлено исследование. В таблице 1 подробно описаны размеры групп, необходимые для выявления конкретных процентных изменений выживаемости с использованием модели инфекции PAO1 штамма Pseudomonas aeruginosa .
ПРИМЕЧАНИЕ: При использовании нового патогена сначала определите межтестовую вариабельность пропорциональной выживаемости инфицированных, но необработанных личинок, так как это повлияет на определение размера выборки.- Включите две группы контроля PBS: одну вводят перед остальными инфекциями, чтобы убедиться, что шприц острый и пригодный для использования, а другую вводят во время или после бактериальных инфекций для обеспечения надлежащей стерилизации между группами инфекции. При оптимизации с помощью нового патогена включите термообработанный контроль, чтобы гарантировать, что смерть не является результатом иммунного ответа на чужеродные частицы.
ПРИМЕЧАНИЕ: Инсулиновые шприцы можно использовать для инъекций, снижая риск затупления и загрязнения. Тем не менее, эксперименты могут рутинно использовать сотни G. mellonella, что делает использование инсулиновых шприцев дорогостоящим и расточительным. - Для исследований, оптимизирующих антибактериальное лечение, включите два дополнительных контрольных метода: группу, инфицированную бактериями, а затем введенную «фиктивную» терапию носителем, и группу, которой дважды вводили носитель, один раз во время инфекции по поводу других состояний и один раз во время лечения.
ПРИМЕЧАНИЕ: Первый является нелеченым контролем, в то время как второй контролирует любые травмы, вызванные инъекциями. Такая травма более вероятна при использовании тупых игл.
- Включите две группы контроля PBS: одну вводят перед остальными инфекциями, чтобы убедиться, что шприц острый и пригодный для использования, а другую вводят во время или после бактериальных инфекций для обеспечения надлежащей стерилизации между группами инфекции. При оптимизации с помощью нового патогена включите термообработанный контроль, чтобы гарантировать, что смерть не является результатом иммунного ответа на чужеродные частицы.
- Закажите G. mellonella у поставщика живой наживки или содержите колонию G. mellonella, как описано ранее 5,6,7. Для поставщика, указанного в Таблице материалов, закажите в 1,8 раза больше запланированного количества личинок, так как примерно 33% будут исключены в зависимости от размера, а еще 10% могут погибнуть после стерилизации кутикулы.
- Определите весовую вариабельность G. mellonella до начала экспериментального использования и убедитесь, что диапазон массы не превышает одного стандартного отклонения от среднего.
ПРИМЕЧАНИЕ: Для поставщиков, не указанных в Таблице материалов, договоритесь с поставщиком о предоставлении новых запасов.
- Определите весовую вариабельность G. mellonella до начала экспериментального использования и убедитесь, что диапазон массы не превышает одного стандартного отклонения от среднего.
- После получения храните G. mellonella при комнатной температуре, чтобы ограничить вероятность образования кокона, которое происходит после инкубации при 37 °C.
ПРИМЕЧАНИЕ: Не все личинки от коммерческих поставщиков образуют коконы, которые ранее использовались в качестве индикатора здоровья личинок16. - Используют личинок в течение 1 недели с момента получения, в таком случае они не требуют кормления.
ПРИМЕЧАНИЕ: Хотя стадия жизни личинки будет варьироваться от партии к партии, большинство личинок доставляются в течение последнего возраста перед окукливанием. На этой стадии кормление естественным образом уменьшается по сравнению с более ранними стадиями17.
2. Стерилизация и отбор личинок G. mellonella
- Взвесьте личинок Galleria mellonella и отбросьте те, которые выходят за пределы диапазона 224 мг ± 49,2 мг, что является средним весом личинок плюс-минус одно стандартное отклонение. Это приведет к исключению примерно 33% личинок.
ПРИМЕЧАНИЕ: Различия в весе могут отличаться у разных поставщиков. Для поставщиков, не указанных в данном протоколе, рассчитайте подходящий диапазон веса. - Выполните следующие действия в асептических условиях.
- Распылите 70% этанол в чашку Петри, убедившись, что дно посуды покрыто достаточно.
- Стерилизуйте поверхность G. mellonella партиями по 10-20 личинок.
- Поместите каждую партию по отдельности в посуду и дважды опрыскайте личинки 70% этанолом.
- С помощью пинцета скатайте личинок, обеспечивая полное покрытие.
- Извлеките личинки из этанола и поместите их в стерильную чашку Петри. Оставьте посуду открытой крышкой, чтобы личинки высохли.
ВНИМАНИЕ: Оставление G. mellonella в этаноле дольше 15 секунд приведет к высокой смертности.
- Как только примерно 90% личинок вновь обретут активность через 2 часа, разделите восстановленных личинок на группы такого размера, который позволит обнаруживать достаточные изменения выживаемости в соответствии с расчетами мощности, подробно приведенными в таблице 1.
- Используйте G. mellonella в течение 6 часов после стерилизации.
3. Оптимизация плотности бактериального посевного материала
- Перед инфекцией подготовьте запас бактериальной инфекции с известным содержанием КОЕ/мл. Методы формирования запасов могут различаться в зависимости от организма. Здесь Pseudomonas aeruginosa выращивали до среднелогической фазы в бульоне питательных веществ, аликвотировали и замораживали при плотности 6 x 107 КОЕ/мл.
- Гранулируйте инфекционное сырье центрифугированием при 10 000 x g при комнатной температуре в течение 5 минут и повторно суспендируйте в PBS. Последовательно разбавляйте бактериальный запас в десять раз, чтобы получить диапазон доз инокулюма 101-10 7 КОЕ на личинку, учитывая, что каждой личинке вводится 10 мкл инокулюма.
ПРИМЕЧАНИЕ: Конкретный диапазон доз инокулюма будет отличаться в зависимости от вирулентности бактерий, но предлагаемый диапазон здесь должен быть подходящим для большинства патогенных видов. Определение темпов роста in vitro может помочь в выборе подходящего диапазона доз, поскольку специфическая для штамма скорость роста в жидкой культуре коррелирует со смертностью личинок. - Перед началом инфекций перечислите инокулюм с помощью серийного разведения Майлза и Мисры, чтобы точно определить плотность инокулюма18.
- Приготовьте три пробирки для микрофуги объемом 1 мл, содержащие стерильный dH2O, 70% этанол или стерильный PBS. Они будут постоянно использоваться для стерилизации шприца, используемого для введения личинок.
- Осмотрите стерильный шприц Hamilton объемом 100 мкл, убедившись, что кончик иглы острый и на нем нет крючка, который может нанести значительную травму месту инфекции.
ВНИМАНИЕ: Кончик иглы шприца Hamilton начнет деформироваться примерно после 300 инфекций. Если кончик иглы деформирован, его необходимо заменить. - Перед инфекцией последовательно промойте шприц dH2O, этанолом и PBS, набирая и выбрасывая шприц максимальной емкости.
- Вортексируйте ресуспендированную инфекцию инокулятом и наберите максимум 100 мкл в шприц Гамильтона, что достаточно для введения 10 мкл на личинку.
- Введите каждой личинке 10 μл инокулюма в заднюю правую ногу. Следите за тем, чтобы игла проникла примерно на 2 мм внутрь тела.
ПРИМЕЧАНИЕ: Могут использоваться различные методы заражения. К ним относятся удержание личинки над кончиком пипетки, чтобы обнажить передние ноги, статическое закрепление шприца и позиционирование G. mellonella вручную или инъекция от руки. - Между каждым набором инфекций стерилизуйте шприц, как описано в шаге 2.5, чтобы предотвратить загрязнение остаточных кожных коммензалов.
- Инкубируйте инфицированных личинок при температуре, достаточной для роста микроорганизмов, от 20 °C до 42 °C, что является подходящим диапазоном для выживания G. mellonella 5.
- Отслеживайте выживаемость G. mellonella через равные промежутки времени с момента, когда смертность обычно впервые наблюдается, чтобы точно измерить время смерти. Это должно быть оценено на первоначальном экране. Удалите все мертвые личинки и запишите время их смерти.
- Выберите оптимальную дозу инфекции для терапевтического исследования на основе дозы, которая дает 50% смертности к 18 ч и более 80% к 72 ч. Это позволяет быстро разработать однодневный скрининг, обеспечивая при этом достаточную вирулентность и соответствующее терапевтическое окно.
4. Испытание токсичности новых противомикробных препаратов на неинфицированных личинках
- Оцените токсичность новых противомикробных препаратов и выбранных носителей у Galleria mellonella перед их применением с экспериментально инфицированными личинками. Готовьте широкий диапазон доз, превышающий ожидаемый терапевтический диапазон противомикробного препарата, руководствуясь данными о токсичности in vitro (например, клеточной линии), если таковые имеются.
- Учтите, что личинкам будет вводиться 10 μл терапевтического средства. Подготовьте контрольные меры только для транспортных средств в концентрациях, совпадающих с концентрациями, в которых вводится терапевтическое средство.
- Вводите здоровую, стерильную G. mellonella в соответствующие размеры групп с различными концентрациями противомикробных препаратов и носителей PBS, как описано в шагах 3.2-3.10. В настоящем исследовании в качестве противомикробного препарата использовался тобрамицин.
ПРИМЕЧАНИЕ: Для агента, требующего ДМСО в качестве растворителя, вводите иглой калибра 26, а не стандартной иглой 22 калибра, так как травма от игл большего размера увеличивает смертность при использовании ДМСО. - Определите безопасную дозу как такую, которая не дает существенной разницы в смертности по сравнению с личинками, которым вводили только PBS.
5. Оптимизация лечения бактериальной инфекции G. mellonella противомикробным средством
- Приготовьте ряд доз противомикробного средства, учитывая, что инфицированные личинки обрабатываются дозой 10 μл. Используйте диапазон доз с минимальной токсичностью, как показано на шаге 4.
- Следуйте шагам 1 и 2 настоящего протокола для подготовки и заражения Galleria mellonella в соответствующих группах в предварительно оптимизированной дозе инфекции.
- Через 2 ч после заражения обработайте личинки приготовленным противомикробным средством или раствором для борьбы с носителем. Выполните шаги 3.2-3.8, вводя инъекцию в противоположную пролегацию от той, которая вводилась во время инфекции. Простерилизуйте иглу между группами.
Примечание: Для этой оптимизации была выбрана обработка через 2 ч для получения сильных данных о зависимости «доза-реакция», на основании которых была определена последующая оптимизация временилечения19. - Контролируйте выживаемость G. mellonella с интервалом в 30 минут или чаще с момента первого наблюдения смертности. Удалите все мертвые личинки и запишите время их смерти.
- Рассчитайте изменение пропорций выживаемости между группами лечения. Используйте анализ выживаемости по методу Каплана-Мейера, чтобы определить, приводит ли лечение к значительному изменению смертности личинок. Включите соответствующую апостериорную поправку на парную множественность в многогрупповой анализ.
6. Оптимизация сроков лечения инфицированной G. mellonella
- Следуйте шагам 1 и 2 для подготовки Galleria mellonella в соответствующих группах в предварительно оптимизированной дозе инфекции.
- Приготовьте противомикробное средство в дозе, предварительно оптимизированной на шаге 4.
- Через 2, 4, 6, 9 или 12 часов после заражения обработайте инфицированных личинок, следуя шагам 3.2-3.8, чтобы сравнить, как время лечения влияет на смертность.
- Контролируйте выживаемость G. mellonella с интервалом в 30 минут или чаще с момента первого наблюдения смертности. Удалите все мертвые личинки и запишите время их смерти. Оптимальным является время, обеспечивающее выживаемость, наблюдаемую после первоначальной оптимизации лечебной дозы.
Примечание: При тестировании антимикробной эффективности G. mellonella оптимизируйте как дозу лечения, так и время лечения по отдельности, используя первую для информирования о дозе лечения во второй.
Representative Results
Оценка вариации массы G. mellonella в партии
Потенциальным источником нежелательных вариаций в экспериментах с инфекциями являются различия в размерах между отдельными экспериментальными единицами (т.е. личинками) и между партиями. Последствия этой вариации могут быть смягчены либо путем корректировки лечебных или инфекционных доз в зависимости от веса, либо путем отбора только тех личинок в пределах определенного диапазона веса для использования в экспериментах. Последняя корректировка является более прагматичной и не подвержена человеческим ошибкам, которые могут возникнуть при приготовлении дозы. Дополнительным преимуществом взвешивания личинок является то, что оно позволяет преобразовывать лечебные дозы из доз, вводимых личинкам, в их эквиваленты в мг/кг для человека. Чтобы количественно оценить вариации внутри и между партиями, были взвешены три партии по 50 личинок, заказанные в разное время. Средний вес в каждой группе составил 225,5 мг, 230,54 мг и 215,86 мг со стандартными отклонениями 49,1 мг, 53,7 мг и 44,3 мг соответственно (рисунок 2A). Между партиями существенной разницы в весе не наблюдалось. В разных партиях вес варьировался от 107,5 мг до 341,0 мг, в среднем от 224,0 мг ± 49,2 мг.
Для получения воспроизводимых результатов личинки взвешивали перед экспериментом и выбирали, если их вес составлял 224 мг ± 49,2 мг, уменьшая диапазон массы с 233,5 мг до 98,4 мг и удаляя 33% личинок. Это согласуется с предыдущими работами, в которых были выявлены значительные различия в выживаемости личинок, инфицированных MRSA, с весовыми диапазонами более 100 мг14,20. Мы также сравнили вес G. mellonella в момент доставки с весом в течение одной недели после доставки, поскольку любое значительное изменение веса может повлиять на результаты эксперимента, если личинки не используются сразу после прибытия. Средняя масса G. mellonella составила 230,54 мг ± 53,7 мг. Через неделю после родов средний вес составил 221,8 мг ± стандартным отклонением 45,7 мг (рисунок 2B). Существенной разницы между весом по прибытии и весом через неделю не наблюдалось, из чего мы делаем вывод, что личинки могут быть использованы в экспериментальных целях в любой момент в течение первой недели после доставки. Важно отметить, что эти результаты являются репрезентативными только для G. mellonella, приобретенной у одного поставщика, и вес может значительно отличаться у разных поставщиков или при заказе личинок в разное время.
Оптимизация плотности посевного материала P. aeruginosa PAO1
Была оценена вирулентность пяти изолятов P. aeruginosa при четырех плотностях инокулята, включая три широко используемых лабораторных штамма, PAO1, PA14 и PAK, и два клинических изолята хронической респираторной инфекции, LESB58 и IST27-M. Они были использованы как часть тензивной панели, относящейся к муковисцидозу, разработанной Mahenthiralingam et al.21 и являются репрезентативными для глобальной филогении вида. Предварительные данные о росте в бульоне питательных веществ показали более низкую скорость роста изолятов от хронической инфекции (рис. 3). Учитывая это, G. mellonella заражали группами по 10 личинок с дозами 101, 102, 103 или 104 КОЕ/личинка в 10 мкл PBS для PAO1, PA14 и PAK и дозами 102, 103, 104 или 105 КОЕ/личинка для LESB58 и IST27-M. Двум группам по 10 личинок также вводили только PBS, одной группе до и одной группе после заражения. Инъекции PBS до инфекционного контроля на предмет заражения PBS или загрязнения игл микробными видами из кутикулы Galleria, в то время как инъекции PBS после инфекционного контроля на предмет любого загрязнения игл бактериями, используемыми в инфекционном процессе. Оптимальные дозы для PAO1, PA14 и PAK составляли 10 КОЕ/личинку, так как более высокая плотность приводила к гибели > 50% к 18 ч (рис. 4). 10 КОЕ была самой низкой дозой, которую можно было надежно и воспроизводимо подготовить к инфекции. Для достижения желаемой кинетики выживаемости требовались более высокие дозы LESB58 и IST27-M, что отражает более медленный рост и меньшую несущую способность этих изолятов в условиях in vitro (рис. 4). Оптимальная доза для обоих составляла 104 КОЕ/личинки. LESB58 и IST27-M являются клиническими изолятами от людей с хроническими инфекциями, и LESB58 ранее демонстрировал более низкую вирулентность на моделях грызунов, чем PAO122.
Определение токсичности тобрамицина и колистина в Galleria mellonella
Прежде чем оценивать эффективность новых антимикробных соединений, необходимо оценить их токсичность путем введения широкого диапазона клинически значимых доз. Это позволяет выводить соединения с высокой токсичностью из испытаний на ранних этапах доклинической разработки. Тобрамицин и колистин оценивали в отношении неинфицированных личинок G. mellonella, поскольку они обычно назначаются для лечения инфекции P. aeruginosa у людей с муковисцидозом (pwCF)23. Клиническое применение тобрамицина колеблется от 3 мг/кг в сутки для тяжелобольных лиц без муковисцидоза до 11 мг/кг каждые 24 ч для пациентов с муковисцидозом24,25. Эти значения были использованы в качестве ориентира для дозирования в Galleria mellonella с 1 мг/кг, 2,5 мг/кг, 5 мг/кг, 10 мг/кг, 25 мг/кг, 50 мг/кг, 100 мг/кг, тобрамицином, отобранным для тестирования на токсичность. Смертельных исходов при любой концентрации не наблюдалось. Учитывая недостаточную токсичность тобрамицина в высоких концентрациях, токсичность колистина была оценена, поскольку ранее она была связана с нефро- или нейротоксичностью у 29,8% pwCF при нагрузочной дозе 2,9 (±1,5) мг/кг и общей суточной дозе 4,1 (±1,1) мг/кг26. Это сделало его ценным кандидатом для тестирования на токсичность, хотя специфические для органов эффекты у людей позволяют предположить, что токсичность может не передаваться G. mellonella. Действительно, при введении колистина в дозах 1 мг/кг, 2,5 мг/кг, 5 мг/кг, 10 мг/кг, 25 мг/кг, 50 мг/кг, 100 мг/кг и 250 мг/кг колистина гибель личинок не наблюдалась. Таким образом, колистин в конечном итоге вводили в его максимальной растворимости вН2О, в дозе 2000 мг/кг. Гибель всех личинок наблюдалась в течение 12 ч, что подтверждает, что токсичность препарата для G. mellonella может быть оценена, но что следует соблюдать осторожность при попытке прогнозирования дальнейшей токсичности для человека.
Оптимизация лечебной дозы тобрамицина против инфекции P. aeruginosa PAO1
Личинкам, инфицированным P. aeruginosa, вводили ряд клинически значимых доз тобрамицина для оптимизации дозировки лечения. Для новых противомикробных препаратов дозировка может быть первоначально выбрана на основе клинического применения аналогичных существующих антибиотиков или на основе доклинических данных для нового агента, таких как минимальные ингибирующие концентрации в бульоне. Для оценки эффективности тобрамицина в отношении P. aeruginosa PAO1 личинок G. mellonella инфицировали 10 КОЕ P. aeruginosa PAO1, как было оптимизировано ранее, и вводили 1 мг/кг, 2,5 мг/кг или 5 мг/кг тобрамицина через 2 ч после заражения. Эти дозы были выбраны на основе предыдущей работы G. mellonella с тобрамицином и соответствуют текущим клиническим дозам тобрамицина у лиц без муковисцидоза 24,27,28.
Порогом первоначального успеха было 50% увеличение выживаемости G. mellonella по сравнению с контрольной группой, не получавшей лечения. Лечение PAO1 1 мг/кг тобрамицина оказало незначительное влияние на смертность от G. mellonella , при этом 90% смертей были достигнуты через 28 ч после заражения (Рисунок 5). Лечение 2,5 мг/кг тобрамицина отсрочило смертность, но дало 80% общей смертности при приеме 5 мг/кг тобрамицина, что привело к оптимальной 90% выживаемости. Эффективная доза для ПА14 составила 5 мг/кг, для ПАК – 2,5 мг/кг. Эффективная доза для IST27-M была выше и составляла 10 мг/кг, при этом ни одна из протестированных концентраций тобрамицина не была достаточной для спасения личинок от инфекции LESB58. Эта тенденция коррелировала с минимальными значениями ингибирующей концентрации (MIC) для тобрамицина в катионно-скорректированном бульоне Мюллера-Хинтона, в котором 1 мкг/мл было достаточно для ингибирования 90% роста у всех штаммов, кроме LESB58, у которого MIC составлял 8 мкг/мл. Таким образом, первоначальное тестирование MIC может быть использовано для определения относительной резистентности между штаммами, хотя его не следует использовать для определения диапазонов доз G. mellonella, которые должны быть оптимизированы отдельно.
Оптимизация сроков лечения тобрамицином против инфекции P. aeruginosa PAO1
Клиническое применение антибиотиков обычно происходит не в течение нескольких часов после заражения, а через несколько дней или недель после заражения. Тестирование новых противомикробных препаратов таким образом не представляется возможным для G. mellonella, так как высокая смертность наблюдается в течение 24 ч после инфицирования P. aeruginosa PAO1. Чтобы повысить актуальность модели инфекции, новые противомикробные препараты следует вводить как можно позже во время инфекции. Для оптимизации времени лечения 5 мг/кг тобрамицина вводили инфицированным PAO1 личинкам G. mellonella через 2 ч, 4 ч, 6 ч, 9 ч и 12 ч после заражения. Экспериментальный успех был определен как лечение антибиотиками, приведшее к увеличению выживаемости на >50% по сравнению с инфекцией PAO1. Лечение через 9 ч и 12 ч отсрочило смертность, хотя оно не смогло устранить инфекцию (Рисунок 6). Лечение в 2 ч, 4 ч и 6 ч давало выживаемость более 50%.
Оптимизация размера группы G. mellonella
Размер экспериментальной группы рассчитывали на основе вариаций, наблюдаемых в выживаемости G. mellonella после заражения 10 КОЕ / личинками P. aeruginosa PAO1. Размер группы может варьироваться в зависимости от ожидаемого процентного изменения между контрольной и лечебной группами в любом исследовании (Таблица 1). Расчеты проводились в соответствии с тем, что описано в работе Charan et al.29. Используемое уравнение описано ниже.
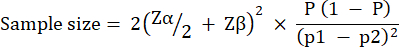
Где:
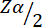 = 1,96 при ошибке 1-го типа 5%.
= 1,96 при ошибке 1-го типа 5%.
Zβ = 0,842 — это значение, обеспечивающее 80% статистической мощности.
p1 = Доля событий в тестовой группе, рассчитанная как p2 + ожидаемое процентное изменение
p2 = Доля событий в контрольной группе (нелеченная инфекция), рассчитанная на основе вариабельности выживаемости P. aeruginosa PAO1 при 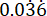 .
.
P = Объединенная распространенность, определяемая как (p1 + p2)/2.
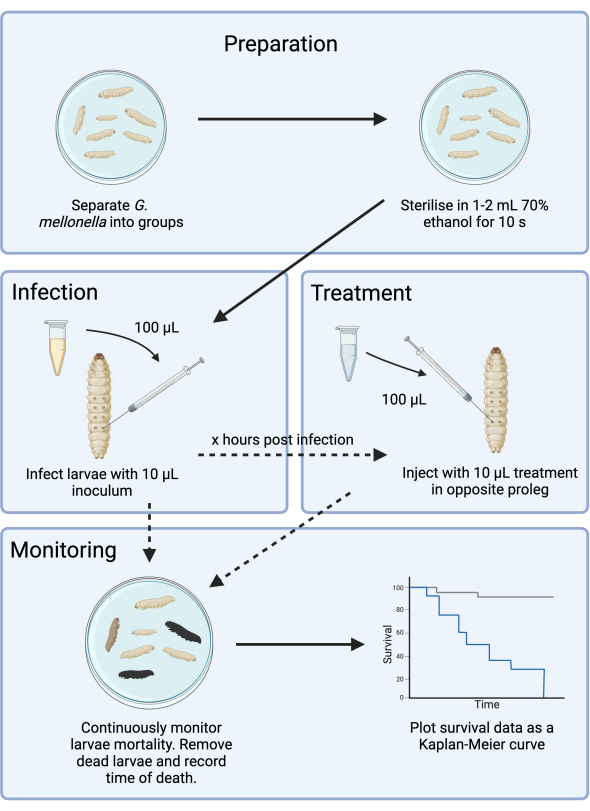
Рисунок 1: Схема исследования инфекции G. mellonella . Общий протокол включает подготовку личинок G. mellonella до заражения, заражение 10 мкл инокулюма, необязательное лечение через несколько часов после заражения и непрерывное наблюдение. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
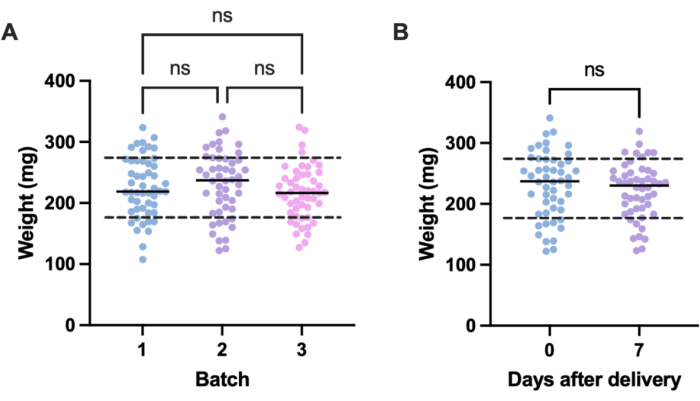
Рисунок 2: Периодическое и временное изменение массы личинок Galleria mellonella . (А) Вес трех партий из 50 личинок Galleria mellonella , взвешиваемых сразу после доставки. Каждая партия была заказана в разное время. Не было существенной разницы в весе между партиями, рассчитанной с помощью одностороннего ANOVA (P > 0,05). (В) Вес 50 личинок, взвешенных при получении, по сравнению с той же партией, взвешенной неделей позже. Не было существенной разницы в весе, рассчитанном по t-критерию Стьюдента (P > 0,05). Н.С.: Не существенно. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
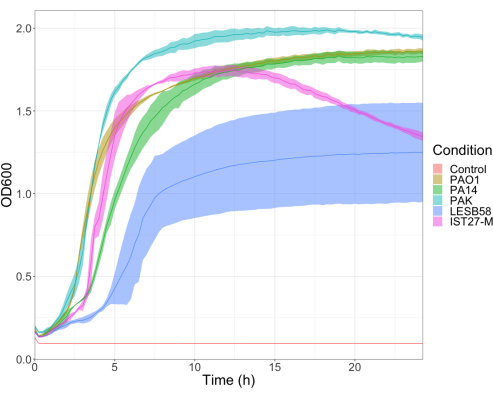
Рисунок 3: Кривые роста штаммов P. aeruginosa PAO1, PA14, PAK, LESB58 и IST27-M. Каждый штамм выращивали в LB с начальным наружным диаметром600 0,08-0,13, а затем OD600 измеряли каждые 15 минут в течение 24 часов статического роста при 37 °C. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
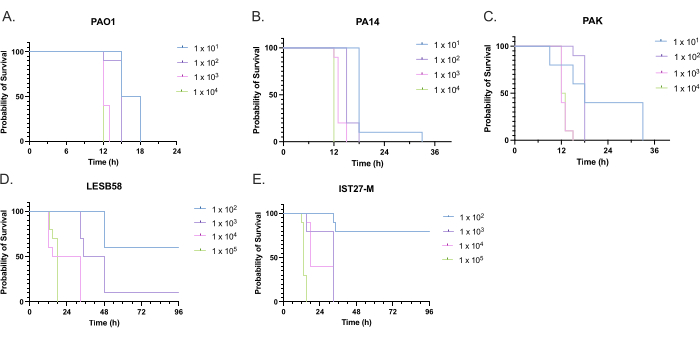
Рисунок 4: Оптимизация плотности посевного материала штаммов Pseudomonas aeruginosa для инфицирования личинок Galleria mellonella. Выживаемость личинок Galleria mellonella после инъекции с различной плотностью колониеобразующих единиц (КОЕ) на личинку. Испытанная плотность инокулята составляла 10, 10², 10³ или 10,4 КОЕ на личинку для (A) PAO1, (B) PA14 или (C) PAK и 10², 10³, 104 или 105 КОЕ на личинку для (D) LESB58 и (E) IST27-M. Использовали десять личинок на группу, каждой из которых вводили 10 мкл инокулюма в правую заднюю ногу. Выживаемость контролировалась каждые 30 мин, начиная с 16 ч после заражения, и регистрировалось время смерти. Все штаммы показали дозозависимую вирулентность, что было определено по критерию значимости Логарифмического ранга (Мантел-Кокса). P < 0,05 для всех сравнений доз внутри штамма, за исключением PAK 101против . ПАК 102, ПАК 103против. ПАК 104, ЛЕСБ58 104против. LESB58 105, и IST27-M 103против. ИСТ27-М 104, которые не были значительными. Эта цифра является репрезентативной для трех биологических реплик. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
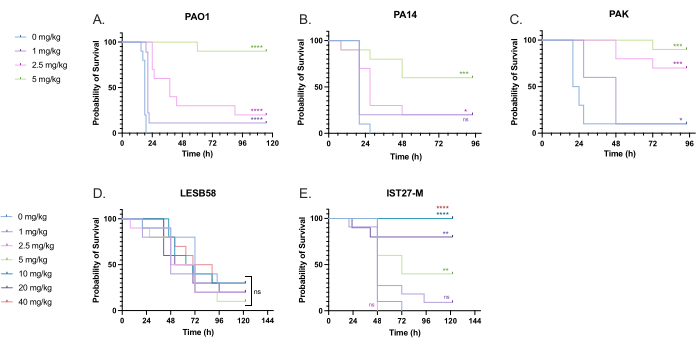
Рисунок 5: Выживаемость личинок Galleria mellonella после инъекции панельных штаммов P. aeruginosa и обработки тобрамицина сульфатом через 2 ч после заражения. 10 личинок G. mellonella в каждой опытной группе были инфицированы либо 10 КОЕ (A) PAO1, (B) PA14 или (C) PAK, либо 103 КОЕ (D) LESB58 или (E) IST27-M на личинку в 10 мкл PBS. Инфекции вводились в заднюю левую ногу. Через 2 ч после инфицирования PAO1, PA14 и PAK вводили 10 мкл PBS в качестве контроля без лечения, 1 мг/кг, 2,5 мг/кг или 5 мг/кг тобрамицина, при этом LESB58 и IST27-M получали 10 мкл PBS, 1 мг/кг, 2,5 мг/кг, 5 мг/кг, 10 мг/кг, 20 мг/кг или 40 мг/кг тобрамицина, как указано на рисунке. Тобрамицин разводили в дистиллированной воде и вводили в заднюю правую ногу. Выживаемость постоянно контролировалась, и время смерти регистрировалось. Логарифмический критерий ранга (Мантела-Кокса) на значимость в соотношении. контроль PBS для каждого штамма. ns: Не существенно, *P < 0,05, **P < 0,005, ***P < 0,0005 ****P < 0,0001. Эта цифра является репрезентативной для трех биологических реплик. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
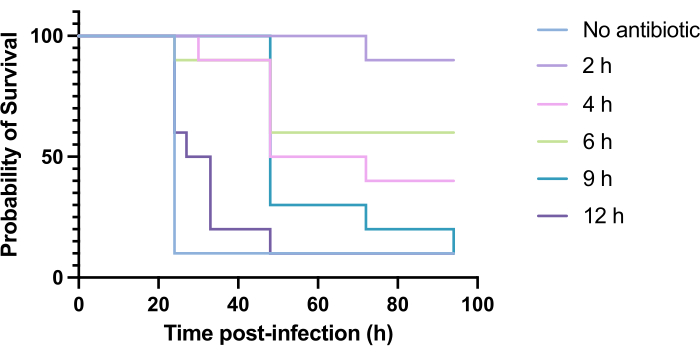
Рисунок 6: Выживаемость личинок Galleria mellonella после инфицирования Pseudomonas aeruginosa PAO1 и последующего лечения тобрамицином в различные моменты времени после заражения. 10 личинок G. mellonella в опытной группе заражали 10 КОЕ PAO1 в 10 мкл PBS, вводимых в заднюю правую ногу. Личинкам впоследствии вводили через 2 ч, 4 ч, 6 ч, 9 ч или 12 ч после заражения 5 мг/кг тобрамицина сульфата в 10 мкл дистиллированной воды в заднюю левую ногу. Выживаемость постоянно контролировалась, и время смерти регистрировалось. Логарифмический критерий ранга (Мантела-Кокса) на значимость в соотношении. необработанный контроль. P < 0,0005, ****P < 0,0001. Эта цифра является репрезентативной для трех биологических реплик. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Ожидаемое изменение выживаемости (%) | Размер группы |
| 30 | 26 |
| 40 | 18 |
| 50 | 13 |
| 60 | 10 |
| 70 | 8 |
| 80 | 6 |
| 90 | 5 |
| 100 | 4 |
Таблица 1: Размер группы для экспериментов по выживанию G. mellonella , в которых личинки G. mellonella заражаются 10 КОЕ/личинками P. aeruginosa PAO1 и впоследствии вводят агент.
Discussion
Бремя устойчивости к противомикробным препаратам (УПП) постоянно растет. По оценкам, в 2019 году во всем мире с УПП было связано 4,95 миллиона смертей30. По оценкам, к 2050 году смертность от УПП достигнет 10 миллионов31 человека. Для устранения этого риска необходимо разрабатывать и тестировать новые противомикробные препараты эффективно и экономично, что требует использования доклинических моделей, которые точно прогнозируют эффективность противомикробных препаратов. Высокий коэффициент отсева, наблюдаемый при переводе в клинические испытания, является основным ограничивающим фактором. В одном исследовании описано 13 кандидатов на антибиотики, которые потерпели неудачу в клинических испытаниях, причем 11 из них не смогли перейти в фазу II32.
Настоящее исследование обеспечивает основу для оптимизации доклинических антимикробных скрининговых исследований G. mellonella и метод оценки антимикробной эффективности. Личинки G. mellonella имеют значительную полезность при оценке токсичности лекарственных препаратов, определении МПК и тестировании вирулентности, в то же время способствуя сокращению численности млекопитающих, используемых в доклинических разработках. Личинки Galleria mellonella обладают относительно высокой пропускной способностью, биологически значимы и хорошо переносятся в более сложные модели млекопитающих. Между тем, в то время как лабораторные мыши дикого типа стоят от 8 до 30 фунтов стерлингов каждая с ~£7 еженедельного обслуживания на мышь, G. mellonella стоит ~£2 за 50 личинок. Таким образом, тестирование 10 соединений на модели G. mellonella будет стоить ~ 60 фунтов стерлингов, по сравнению с более чем 4000 фунтов стерлингов для того же исследования на мышах. Кроме того, в предыдущих исследованиях сравнивали токсичность и эффективность новых соединений и выявляли корреляцию между острой токсичностью у G. mellonella и мышей 8,19,33. В связи с этим рекомендуется использовать скрининг G. mellonella для определения приоритетности соединений, подлежащих дальнейшему тестированию на мышиных моделях.
Несмотря на очевидную полезность модели, есть несколько соображений для обеспечения успешного применения. Отсутствие стерильных личинок исследовательского класса затрудняет их подготовку к экспериментальному использованию, поскольку требуется стерилизация этанолом или исследователям необходимо поддерживать собственную колонию G. mellonella, что снизило бы риск заражения и улучшило бы общее качество экспериментов 5,6. Неправильная стерилизация может привести к значительной смертности, и полностью стерилизовать организм сложно, так как более длительное воздействие этанола приводит к смерти. Альтернативные методы стерилизации включают в себя взятие мазка с передней ноги каждой личинки 70% этанолом до заражения, что снизило бы смертность во время стерилизации, но является более трудоемким методом. Можно было использовать и другие антисептики, хотя в этом исследовании не оценивались альтернативы, так как стерилизация этанолом давала <10% смертности после оптимизации. Кроме того, часто неясно, лечат ли поставщики G. mellonella антибиотиками, поскольку поставщики могут получать свои личинки от других поставщиков, а не содержать колонии самостоятельно.
Биология G. mellonella значительно отличается от биология млекопитающих, что накладывает ограничения на их полезность. Их иммунная система лишена какого-либо адаптивного иммунитета, хотя ключевые растворимые и клеточные аспекты врожденного иммунитета присутствуют. Гемоциты являются основной врожденной иммунной защитой G. mellonella и проявляют фагоцитоподобные свойства. Были описаны различные подмножества этих клеток, в том числе гранулоциты и плазматоциты. G. mellonella также не может повторять соответствующие места инфекции, такие как инфекции дыхательных путей или мочевого пузыря. Тем не менее, в доклиническом процессе G. mellonella будет служить в качестве предварительного скрининга для мышиных моделей, гарантируя, что только наиболее перспективные соединения будут продвигаться в сложную систему млекопитающих, которая больше напоминает среду заражения человека. Наконец, модель выиграет от дальнейшей геномной характеристики G. mellonella для определения ее пригодности для оценки изменений в клинически значимых биомаркерах. В частности, это требует улучшения нашего понимания иммунитета к G. mellonella.
В целом, модель инфекции Galleria mellonella является ценным инструментом для доклинической оценки новых антимикробных соединений до их оценки на моделях млекопитающих. Несмотря на то, что их использование осложняется отсутствием стандартизации поставок, их применение отличается высокой пропускной способностью, простотой и может широко применяться в области разработки противомикробных препаратов. В будущем интеграция этой модели в стандартизированный доклинический конвейер может ускорить разработку новых антимикробных соединений для увеличения доли кандидатов, проходящих путь от доклинической оценки к клиническим испытаниям.
Disclosures
Авторам нечего раскрывать.
Acknowledgements
TB, AK, JF и DN получили грантовую поддержку для Центра стратегических исследований (ЦНИИ) «Научно обоснованная доклиническая основа для разработки антимикробной терапии при муковисцидозе» (PIPE-CF; Проект No. SRC 022) от Британского фонда муковисцидоза и Фонда муковисцидоза США. LD и JF выражают признательность за финансирование от Kidney Research North West (проект No 49/19).
Materials
| Name | Company | Catalog Number | Comments |
| 22s gauge, Small Hub RN Needle, 2 in, point style 2 | Hamilton | 7758-03 | Replacement for the Hamilton syringe. |
| Bacterial infection stocks | Bacterial stocks of a known density (CFU/mL) frozen during mid-exponential phase of growth. | ||
| Ethanol | Fisher Scientific | 10610813 | Other manufacturers may be used. |
| G. mellonella larvae | Livefoods | 5.06045E+12 | For this supplier, orders are marked as “New stock for lab use”. As of April 2024, new stock is delivered to the supplier on Mondays. Orders should be placed then, for delivery on Wednesdays. |
| Microliter syringe | Hamilton | 80630 | The 80630 syringe has a 100 µL capacity. Other volumes exist, such as the 80430, 80530 or 80730. |
| Petri dish | Fisher Scientific | 12674785 | Other manufacturers may be used. |
References
- Menard, G., Rouillon, A., Cattoir, V., Donnio, P. Y. Galleria mellonella as a suitable model of bacterial infection: Past, present and future. Front Cell Infect Microbiol. 11, 782733 (2021).
- Piatek, M., Sheehan, G., Kavanagh, K. Galleria mellonella: The versatile host for drug discovery, in vivo toxicity testing and characterizing host-pathogen interactions. Antibiotics. 10 (12), 1545 (2021).
- Miethke, M., et al. Towards the sustainable discovery and development of new antibiotics. Nat Rev Chem. 5 (10), 726-749 (2021).
- Seyhan, A. A. Lost in translation: The valley of death across preclinical and clinical divide - identification of problems and overcoming obstacles. Transl Med Commun. 4 (1), (2019).
- Firacative, C., et al. Rearing and maintenance of Galleria mellonella and its application to study fungal virulence. J Fungus. 6 (3), 130 (2020).
- Pereira, M. F., Rossi, C. C. Overview of rearing and testing conditions and a guide for optimizing Galleria mellonella breeding and use in the laboratory for scientific purposes. APMIS. 128 (12), 607-620 (2020).
- Jorjão, A. L., et al. From moths to caterpillars: Ideal conditions for Galleria mellonella rearing for in vivo microbiological studies. Virulence. 9 (1), 383-389 (2018).
- Tsai, C. J. -. Y., Loh, J. M. S., Proft, T. Galleria mellonella infection models for the study of bacterial diseases and for antimicrobial drug testing. Virulence. 7 (3), 214-229 (2016).
- Gallorini, M., et al. Immunophenotyping of hemocytes from infected Galleria mellonella larvae as an innovative tool for immune profiling, infection studies and drug screening. Sci Rep. 14, 759 (2024).
- Smith, F. Q., Casadevall, A. Fungal immunity and pathogenesis in mammals versus the invertebrate model organism Galleria mellonella. Pathog Dis. 79 (3), ftab013 (2021).
- Sugumaran, M. Comparative biochemistry of eumelanogenesis and the protective roles of phenoloxidase and melanin in insects. Pigment Cell Res. 15 (1), 2-9 (2002).
- Sheehan, G., Garvey, A., Croke, M., Kavanagh, K. Innate humoral immune defences in mammals and insects: The same, with differences. Virulence. 9, 1625-1639 (2018).
- Wright, C. L., Kavanagh, O. Galleria mellonella as a novel in vivo model to screen natural product-derived modulators of innate immunity. Appl Sci. 12 (13), 6587 (2022).
- Newton, S. M., et al. Use of the invertebrate Galleria mellonella as an infection model to study the Mycobacterium tuberculosis complex. J Vis Exp. (148), e59703 (2019).
- Frankel, G., Collins, J. W., Schroeder, G. N., Harding, C. R. Use of Galleria mellonella as a model organism to study Legionella pneumophila infection. J Vis Exp. (81), e50964 (2013).
- Romera, D., et al. The Galleria mellonella infection model as a system to investigate the virulence of Candida auris strains. Pathog Dis. 78 (9), ftaa067 (2020).
- Kwadha, C. A., Ong'amo, G. O., Ndegwa, P. N., Raina, S. K., Fombong, A. T. The biology and control of the greater wax moth, Galleria mellonella. Insects. 8 (2), 61 (2017).
- Miles, A. A., Misra, S. S., Irwin, J. O. The estimation of the bactericidal power of the blood. J Hyg. 38, 732-749 (1938).
- Ignasiak, K., Maxwell, A. Galleria mellonella (greater wax moth) larvae as a model for antibiotic susceptibility testing and acute toxicity trials. BMC Res Notes. 10 (1), 428 (2017).
- Hesketh-Best, P. J., Mouritzen, M. V., Shandley-Edwards, K., Billington, R. A., Upton, M. Galleria mellonella larvae exhibit a weight-dependent lethal median dose when infected with methicillin-resistant Staphylococcus aureus. Pathog Dis. 79 (2), ftab003 (2021).
- Mahenthiralingam, E., Weiser, R., Floto, R. A., Davies, J. C., Fothergill, J. L. Selection of relevant bacterial strains for novel therapeutic testing: a Guidance document for priority cystic fibrosis lung pathogens. Curr Clin MicrobiolRep. 9 (4), 33-45 (2022).
- Carter, M. E. K., et al. A subtype of a Pseudomonas aeruginosa cystic fibrosis epidemic strain exhibits enhanced virulence in a murine model of acute respiratory infection. J Infect Dis. 202 (6), 935-942 (2010).
- Herrmann, G., et al. Colistin-tobramycin combinations are superior to monotherapy concerning the killing of biofilm Pseudomonas aeruginosa. J Infect Dis. 202 (10), 1585-1592 (2010).
- Hennig, S., Standing, J. F., Staatz, C. E., Thomson, A. H. Population pharmacokinetics of tobramycin in patients with and without cystic fibrosis. Clin Pharmacokinet. 52 (4), 289-301 (2013).
- Reyhanoglu, G., Reddivari, A. K. R. . Tobramycin. , (2023).
- Crass, R. L., Rutter, W. C., Burgess, D. R., Martin, C. A., Burgess, D. S. Nephrotoxicity in patients with or without cystic fibrosis treated with polymyxin b compared to colistin. Antimicrob Agents Chemother. 61 (4), e02329-e02416 (2017).
- Deacon, J., et al. Antimicrobial efficacy of tobramycin polymeric nanoparticles for Pseudomonas aeruginosa infections in cystic fibrosis: Formulation, characterization and functionalization with dornase alfa (DNase). J Control Release. 198, 55-61 (2015).
- Tamma, P. D., et al. Infectious Diseases Society of America 2022 guidance on the treatment of extended-spectrum β-lactamase producing enterobacterales (ESBL-E), carbapenem-resistant enterobacterales (CRE), and Pseudomonas aeruginosa with difficult-to-treat resistance (DTR-P. aeruginosa). Clin Infect Dis. 75 (2), 187-212 (2022).
- Charan, J., Kantharia, N. D. How to calculate sample size in animal studies. J PharmacolPharmacother. 4 (4), 303-306 (2022).
- Murray, C. J. L., et al. Global burden of bacterial antimicrobial resistance in 2019: A systematic analysis. Lancet. 399 (10325), 629-655 (2022).
- de Kraker, M. E. A., Stewardson, A. J., Harbarth, S. Will 10 million people die a year due to antimicrobial resistance by 2050. PLoS Med. 13 (11), e1002184 (2016).
- Prasad, N. K., Seiple, I. B., Cirz, R. T., Rosenberg, O. S. Leaks in the pipeline: A failure analysis of gram-negative antibiotic development from 2010 to 2020. Antimicrob Agents Chemother. 66 (5), e0005422 (2022).
- Wang, S., et al. A novel Galleria mellonella experimental model for zoonotic pathogen Brucella. Virulence. 14 (1), 2268496 (2023).
- Senior, N. J., Titball, R. W. Isolation and primary culture of Galleria mellonella hemocytes for infection studies. F1000Res. 9, 1932 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved