Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Obliteratif Havayolu Hastalığı Geliştirme Eğitim Modeli olarak kullanılan Farelerde Heterotopik ve Ortotopik Trakeal Nakli
Özet
Bu video gösterileri ve farelerde obliteratif hava yolu hastalığı (OAD) geliştirilmesi, heterotopik ve ortotopik trakeal nakli modeli incelemek için iki deneysel modeller karşılaştırır.
Özet
Obliteratif solunum yolu hastalığı (OAD), uzun süreli sağkalım (1-7) sınırlar akciğer transplantasyon sonrası önemli bir komplikasyonudur.
Patofizyolojisi çalışma için, tedavisi ve önlenmesi kemirgenler trakeal nakli OAD, farklı hayvan modelleri geliştirilmiştir (1-7). Burada, iki trakea transplantasyonu, heterotopik ve ortotopik model kurulu modelleri kullanmak ve bunların avantaj ve dezavantajlarının göstermek.
Heterotopik modeli için donör trakea ortotopik model, uçtan-uca anastomoz ile anastomoz ise donör trakea, alıcının büyük omentum içine sarılır.
Her iki modelde de, klinik OAD benzer histolojik obliteratif lezyonların gelişme (1-7) kanıtlanmıştır.
Bu video gerçekleştirmek için nasıl gösterir, heterotopik yanı sıra ortotopik trakeal nakli tekniği, farelerde ve histoloji kullanan her iki model OAD gelişimi zaman ders karşılaştırır.
Protokol
- Erkek Balb / C fareler (8-12 hafta), Charles River Laboratuvarları (Sulzfeld Almanya) satın alınır. Fareler geleneksel koşulları, beslenen standart farelerin yiyecek ve su ad libitum altında muhafaza edilir.
- % 2 Isofluran anestezi için kullanılır.
DONÖR HAZIRLIĞI
- Karın saç Tıraş ve betaisodona kullanarak dezenfekte edin.
- Mikroskopik görünümü altında, gırtlak sternum orta hat servikal insizyon gerçekleştirin.
- Trakea net bir görünüm elde etmek için subkutan yağ ve kayış kasları çıkarın.
- Yemek borusu, sinirler, arterler, bağ doku ve kemik gibi, herhangi bir çevre dokulara trakea parçalara ayır.
- Tüm trakea (larinks çatallanma) çıkarın.
- Soğuk tuzlu su ile yıkayın ve nakli greft saklamak, 4 ° C
- Donör trakea hasat sonrasında servikal dislokasyon ötenazi.
ALICI: heterotopik NAKLİ
- Kesi yeri etrafında geniş bir marj karın saç Tıraş ve bölgede alkol ile takip betaisodona (betadin) kullanarak üç kez dezenfekte edin. Gözler kornealar kurumasını önlemek için bir oftalmik merhem ürün ile yağlanır olmalıdır.
- Medyan laparotomi gerçekleştirin bağırsak ve nemli steril eldiven içine yerleştirin.
- Büyük omentum dikkatlice sürün. Merkezi haline greft yerleştirin ve 8-0 (Prolen, Ethicon, Almanya) kullanarak tek bir sütür ile sabitleşmek.
- Tamamen büyük omentum nakli örtüsü ve tek sütür 8-0 (Prolen, Ethicon, Almanya) ile greft düzeltmek.
- Bağırsaklar karın içine taşınmaya ve kapatılması önce sıcak, steril tuzlu su ile yıkayın.
- 2 kat Yakın Çekim ile karın duvarı ve cilt tabakası, kas ve cilt için 7-0 vicryl için 7-0 Prolen kullanarak sürekli desen.
ALICI: ortotopik NAKLİ
- Kesi yeri etrafında geniş bir marj karın saç Tıraş ve bölgede alkol ile takip betaisodona (betadin) kullanarak üç kez dezenfekte edin. Gözler kornealar kurumasını önlemek için bir oftalmik merhem ürün ile yağlanır olmalıdır.
- Tüm laringotrakeal kompleks görselleştirmek için kayış kasları bölün.
- Dikkatle trakea, çevresindeki dokulardan disseke rekürren laringeal sinirleri korumak için dikkat.
- Krikoid kaudal trakea üç yüzük bölün. Hayvan trakeostomi yoluyla fizyolojik solunum tutar.
- Greft alıcı yanı sıra trakeal kenarları temiz olun.
- Greft alıcı trakeal kusurları ve anatomik polarite korumak yönelik arasında yer.
- Anastomoze distal (mediasten) trakea ile donör greft (Prolen, Ethicon, Almanya) 8-0. Anastomoz arka yönü sürekli çalışan moda yapılır. Ön yüzüne sonra kesintiye dikiş ile tamamlandı.
- Salgıları, solunum yolu herhangi bir çıkarın.
- Proksimal anastomoz sonra distal biri olarak aynı şekilde tamamlandı.
- Havayolu ve yeterli spontan solunum bütünlüğünü sağlamak.
- Kayış kasları taşınmaya ve deri altı doku ve cilt katmanı sürekli deseni ile 6-0 sütürler (Vicryl, Ethicon, Almanya) kullanılarak yakın.
- Bu nedenle hayvan trakea yoluyla fizyolojik solunum koruyacaktır, alıcı için enjeksiyon anestezi kullanın. Bir arada 75/1/0.2 mg / kg propofol, medetomidine ve sırasıyla fentanil, farelerde ip anestezi için kullanılır.
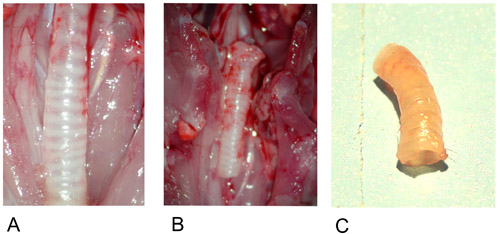
Şekil 1: Donör trakea.
1A: hazırlandıktan sonra in situ Donör trakea.
1B: eksize donör trakea.
1C: Donör eksplantasyonu sonra trakea.
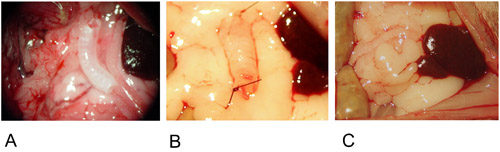
Şekil 2: Heterotopik Model.
2A: greft büyük omentum merkezi bir konuma sahiptir.
2B: greft tek bir sütür ile her iki ucunda da sabittir.
2C: greft büyük omentum içine sarılmış ve tek bir sütür ile sabittir.
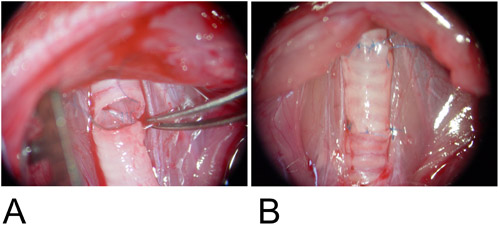
Şekil 3: Ortotopik Modeli.
3A: greft alıcı trakeal kusurları ve arka duvar arasında interpoze sürekli çalışan moda anastomoz.
3B: ön duvarı, tek bir sütür kullanılarak tamamlandı.
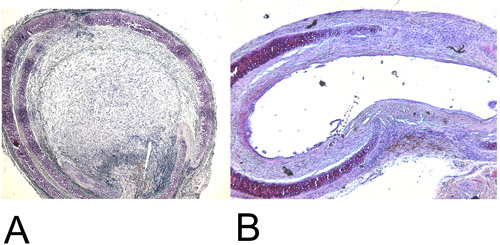
Şekil 4: Histoloji.
4A: H + E sta 28 gün sonra Kurtarılan heterotopik nakledilen trakeaining (15x). % 100 luminal obliterasyonu unutmayın.
4B: H 60 gün sonra ortotopik nakledilen trakea Kurtarılan + E boyama (15x). Maksimal elde luminal obliterasyonu yaklaşık% 45.
| Heterotopik Trakeal Nakli Modeli | Ortotopik Trakeal Nakli Modeli | |
| Avantajları | + Kolay gerçekleştirmek için 28 gün sonra tam bir solunum yolu tıkanıklığı + Luminal obliterasyonu OAD + hayvanların fiziksel sevgi | + Greft Fiziksel havalandırma + İnhale ilaç uygulama Alloreactive IgM antikor üretimi + Güçlü immunolojik reaksiyonlar + Fizyolojik torasik ortam + Trakea-trakeal anastomoz klinik ortamda taklit |
| Dezavantajları | - Nakledilen trakea hiçbir havalandırma - Inhale patojenlerin yok değerlendirme mümkün - Mukosiliyer klirensi ve muhafaza salgıları inhibisyonu - Periton mikroçevresinin torasik ortam yerine | - Gerekli Cerrahi eğitimi - Luminal oklüzyon uygulaması ile Luminal obliterasyonu. 60 gün sonra% 45 - Hayvanlar OAD, belirtiler ortaya çıkabilir |
Tablo 1: Heterotopik ve Ortotopik Trakeal Nakli Avantajları ve Dezavantajları.
Tartışmalar
Fareler farklı transgeneic ve boşaltma modeli mevcuttur ve bu nedenle uygun OAD (4) ile ilgili mekanistik sorular çalışma.
Bu videoda gösterilen trakeal nakli Her iki model de, OAD geliştirme eğitimi için güvenilir bir model olarak kullanılabilir.
Ancak, her model avantaj ve sınırlamaları göstermektedir.
Heterotopik trakeal nakli gerçekleştirmek için kolay ve özel cerrahi eğitimi (3, 5) gerektirmez. Luminal obliterasyonu heterotopik transpla...
Açıklamalar
Sonja Schrepfer Deutsche Forschungsgemeinschaft (DFG) (SCHR992/3-1) bir araştırma bursu aldı.]
Bütün hayvanlar Laboratuar Hayvan Bakımı İlkeleri ile uyumlu insan bakım, hayvanlar üzerinde yapılan deneyler tarafından yayınlanan Laboratuvar Hayvanları Bakım ve Kullanım için Tıbbi araştırma ve Kılavuzu Ulusal Derneği tarafından belirlenen kurallara ve yönetmeliklere uygun olarak yapıldı Ulusal Sağlık Enstitüleri (Ulusal Sağlık yayın 85-23 Enstitüleri, 1985 revize).
Bütün hayvanlar, Charles River Laboratuvarları (Sulzfeld Almanya) elde edilen ve hayvan bakım tesisleri Üniversitesi Hastanesi Hamburg Eppendorf tutuldu. Hayvanlar standart yem ve su ad libitum aldı.
Teşekkürler
Yazarlar Christiane Pahrmann (Lab Yöneticisi) teşekkür ederim.
Referanslar
- Adams, B., Berry, G., Huang, X., Shorthouse, R., Brazelton, T., Morris, R. Immunosuppressive therapies for the prevention and treatment of obliterative airway disease in heterotopic rat trachea allografts. Transplantation. 69, 2260-2266 .
- Adams, B., Brazelton, T., Berry, G., Morris, R. The role of respiratory epithelium in a rat model of obliterative airway disease. Transplantation. 69, 661-665 .
- Deuse, T., Schrepfer, S., Reichenspurner, H., Hoyt, G., Fischbein, M., Robbins, R., Pelletier, M. Techniques for experimental heterotopic and orthotopic tracheal transplantations – when to use which model; Transplant Immunology 17. , 255-261 (2007).
- Hele, D., Yacoub, M., Belvisi, M. The heterotopic tracheal allograft as an animal model of obliterative bronchiolitis. Respiratory Research. 2, 169-183 .
- Hertz, M., Jessurun, J., King, M., Savic, S., Murray, J. Reproduction of the obliterative bronchiolitis lesion after heterotopic transplantation of mouse airways. American Journal of Pathology. 142, (1993).
- McDyer, J. Human and murine obliterative bronchiolitis in transplant. Proceedings of the American Thoracic Society. 4, 37-43 .
- Schrepfer, S., Deuse, T., Hoyt, G., Sheikh, A., Hoffmann, J., Reichenspurner, H., Robbins, R., Pelletier, M. Experimental orthotopic tracheal transplantation: the stanford technique. Microsurgery. 27, 187-189 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır