Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Organotipik murin Retina Wholemount Kültür in vivo
Özet
Bu video makale Organotipik retina wholemount kültürler ve eksojen kaynaklı etkileri analizi için bir sitospin prosedürü kurulması göstermektedir. Organotipik retina wholemount kültürleri taklit In vivo Durum ve klasik fare hayvan modellerinde dezavantajları engellemeyi deneysel manipülasyonlar için fare retina erişilebilirliğini önemli ölçüde kolaylaştıracaktır.
Özet
Genler ve hayvan modellerinde analiz Hedeflenen ablasyonların kayıt yaptıran özel retina gen fonksiyonu için klasik bir strateji. Ancak, transgenik, retina özel veya koşullu nakavt fare modelleri genellikle erken öldürücülüğü görüntülemek veya embriyonik ya da erken doğum sonrası aşamalarında ötesinde bir analiz önlemede ciddi malformasyonlar muzdarip.
Primer hücre kültürü Eksojen olarak uygulanan rekombinant faktörler, gen ya da kontrollü bir ortamda siRNA-aracılı gen demonte aşırı ekspresyonu etkilerini araştırmak için bir alternatiftir. Disosiye hücre kültürü, böylece, farmakolojik manipülasyon sonra eksojen tetiklenen etkileri kimlik kolaylaştırmak, hedef hücreleri ulaşan endojen sinyalleri azalır avantajı vardır. Ancak, önemli hücre-hücre etkileşimleri başlangıçta yeniden toplanan retinospheroid kültürler 1 kullanılsa bile, enzimatik sindirim veya mekanik ayrılma tarafından yok edilir.
Buna karşılık, Organotipik retina wholemount kültürler nöronal etkileşimleri ve bağlantıları hala korunmuş 2-5 in vivo durum fizyolojik yakın bir sistem sağlar .
Bu video makalede, postnatal embriyonik ve yetişkin fare gözleri diseksiyonu özellikleri ve nöronal analizi (2) bölünmeler ve sitospin prosedürü de dahil olmak üzere Organotipik retina wholemount kültür gibi in vivo (1) kurulmasına adım gösteri bir adım Eksojen olarak uygulanan rekombinant faktörleri varlığında kültür sonra apoptoz ve Organotipik wholemounts retinal hücre çoğalması, örn.
Protokol
Tüm ekipman ve reaktifler steril satın alınacak ya da ısı veya buharla sterilize veya% 70 ETOH ile sterilize edilmiş olması gerekir.
Hayvanlar üzerinde yapılan deneylerde, hayvanların bakımı ve kullanımı ile ilgili deneysel prosedürleri ve Kurumsal Hayvan tarafından belirlenen düzenlemelere NIH Rehberi ardından, Avrupa Toplulukları Konsey Direktifi (86/609/EEC) uygun olarak yapıldığını ve bu yazarlar Bakım ve Duisburg-Essen Üniversitesi (Almanya) Komitesi (IACUC) kullanın.
Bölüm 1: farklı gelişim evreleri fare gözleri Enükleasyon
Embriyonik gözleri, enükleasyon
- Zaman hamile çiftleşmelerin kadar vajinal fiş kadın çiftleşme tespit edildiği günün sabah ve gebeliğin gün 0 belirlenmiş.
- Ve sabit bir balmumu tahta 6: embriyo gelişimi istenilen aşamada (embriyonik gün (E) 15) ulaşmıştır zaman hamile kadın servikal dislokasyon ile sakrifiye.
- Karın duvarı orta hat boyunca kesilir ve cilt flep Pin 6 yanal sabit% 70 ETOH ile ıslatılır.
- Uterusses karın, soğuk PBS 6 ile müstakil ve bir behere aktarılır kaldırılır.
- Embriyolar, ayrılmış bir Petri kabı ve rahim duvarına aktarılır ve embriyonik membranlar, forseps 6 kullanımı ile dikkatlice çıkarılır .
- Embriyolar dekapitasyon tarafından öldürüldü.
- Göz, göz soketten gözleri "soyma", ince, kavisli bir forseps kullanımı enükleasyon.
Postnatal ve yetişkin gözler, Enükleasyon
- Genç yavrular servikal dislokasyon dekapitasyon, büyük yavrular ve yetişkinler tarafından öldürüldü.
- Doğum sonrası sahne P15, fareler gözleri açık bir zaman noktasında, göz yarıklar mekanik forseps kullanımı tarafından açılan ve iki yaylı makas ile göz kapaklarını enine kesimler tarafından büyütülmüş olması var.
- Gözler yörüngesine basınç uygulayarak, kavisli bir forseps yardımı ile enükleasyon.
Not: orbital kemikler hala kıkırdak postnatal günde 2 itibariyle, gözleri kaldırmak için çalışırken çok fazla baskı uygulamak için önemlidir.
Buna karşılık, yetişkin farelerde, orbital kemikler firma vardır. Böylece, gözleri aydınlatmak amacıyla, önceden göz yarıklar büyütme olmadan yörüngesine baskı uygulamak için yeterli olacaktır.
Bölüm 2: embriyonik, doğum sonrası ve yetişkin fare retina Diseksiyon
Retina, diseksiyonu
- Gözler steril PBS ve çevresindeki göz katmanları bir diseksiyon mikroskobu altında kaldırılır küçük bir Petri kabındaki yerleştirilir.
- Doğum sonrası aşamaları ve optik sinir temelinde mümkün olduğunca yakın olarak forseps, yaylı makas veya sıkışmak kapalı yardımı ile kesilmek üzere yetişkin gözleri, dış göz tabakaları kaldırmak için.
- Göz, optik sinir başlangıçta ikamet delik arka tarafı size bakacak şekilde çevirin. Retina ve pigment epiteli arasında çok ince optik sinir göz katmanlarına nüfuz sitesinden iki forseps ipuçları ile subretinal boşluk girin.
Not: Genellikle koyu renk pigment epitel kolayca tespit edilebilir. Özellikle albino hayvanlar - bazı fare mutant Ancak bu pigment tabakasının renkli olmayabilir ve bu nedenle tespit etmek kolay olmayabilir. - Bağlı koroid membran ve sklera ile pigment epitel hem forseps ile her iki tarafında dikkatle yırtarak çıkartın.
- Diğer forseps kalan retina kupasını tutarken, korneanın seviyesine katmanları soyun, sonra göz fincan lens tarafına çevirin ve pigment epitel, koroid membran ve sklera ile birlikte kornea kaldırmak.
- Küçük bir objektif ile birlikte vitreus kavrayın ve forseps ile yırtılma ederken, ikinci forseps ile retina wholemount tutmak.
Not: embriyonik gözleri diseksiyon, tamamen vitreus ile birlikte vitreus altındaki üçgen, çadır gibi kapiller pleksus kaldırmak için emin olun.
Yetişkin gözü, vitreus kenarlarında kavradı gereken ve bakım içeriği kaldırılmasını engelleyen, forseps viskoz ve sopalarla olarak forseps ipuçları ile delmek vitreus alınmalıdır. - Organotipik wholemount kültürü için retina bardak 200 ul Dulbecco'nun modifiye kartal orta (aşağıya bakın) içeren bir 96-plaka toplanır.
Not: bireysel retina diseksiyonu arasında, kültür ortamı pH inkübatörde 96-iyi bir kültür ortamı içeren koleksiyon plaka karbonat sistemi yoluyla CO 2 tarafından tetiklenir .
Bölüm 3: murin Organotipik retina wholemountkültür
- Ağırlık 7.8g Dulbecco'nun modifiye kartal orta / besin karışımı F-12 HAM (DMEM) ve 0.6 NaHCO 3 ve MiIliQ suda hem erime 500 ml kültür hazırlayın. 7.15 pH ayarlayın. Kaputun altında, 2.5 ml gentamicine (200 mM), 50μl sodyum selenit (stok:: 52μg/ml), progesteron (60μg/ml stok): 50mg apo-transferin 50μl pütresin (60mg/ml hisse senedi) ekleyin. Mix ve bir şişe üst filtre süzülmeye. Kullanımı ml kültür ortamı başına 10μl glutamin (200 mM) hemen önce.
Not: Bu serum ve insülin-orta, insülin dengeleyerek 2 haftaya kadar 4 ° C'de saklanır ve apoptozis indüksiyonu deneyleri için kullanılan olabilir. 24 saat daha uzun süre boyunca wholemounts inkübasyon istenilen hücre ölüm oranları değerlendirmeye alınmayacaktır, insülin serum (örneğin fetal buzağı serumu; FCS) veya takviye sağkalım oranlarını artırmak için ilave edilmelidir. - Kültür başlamadan önce, retina wholemounts 37 az 15 dakika önceden inkübe edilir ° C, M Müller glia iç ve dış sınırlayıcı membran içeren hiyalüronidaz ön sindirimi 0.5mg/ml hiyalüronidaz içeren 200 ul sıcak, pH dengeli DMEM hücreleri, Eksojen olarak uygulanan maddelerin penetrasyonu kolaylaştırıcı.
- Retinanın 2ml kimyasal olarak tanımlanmış Dulbecco'nun modifiye kartal orta Organotipik wholemounts olarak kültür ve mümkün olduğunca az hiyalüronidaz 24 plaka aktarılır.
Not: retina aktarmak için, 1 ml pipet kullanın ve açılış genişletmek için pipet ucu birkaç milimetre kesmek. Embriyonik gözler için, 200 ul pipet ucu yeterlidir. Kesicilere ikinci bir pipet ucu ekleme ve büküm tarafından düzeltilir olmalıdır.
24-48 saat kısa vadeli kültürleri için tüm adımları tezgah yapılabilir, ancak kültürlerin kirlenmesini bir sorun ortaya çıkarsa, bir başlık altında çalışması gerekir. - , 37 ° C'de% 5 CO 2 atmosfer 48 saat ve rekombinant faktörler ile farmakolojik tedavi tabi örneğin - Kültürler 24 saat süreyle korunur .
Bölüm 4: kültürlü retina wholemounts Ayrılma
- Istenilen kültür bir süre sonra, retina 850 ul PBS ve 50 ul sığır serum albümin (30 mg / ml BSA) içeren yuvarlak alt 2ml Eppendorf tüpleri toplanır.
- Eppendorf tüpleri, retina ile 37 kadar ısıtılmış bir ısıtma bloğu ° C. içine yerleştirin
- Her Eppendorf tüpüne 25 ul kollajenaz (200 U / ml) ve 25 ul hiyalüronidaz (20mg/ml) ekleyin ve bir silikonlu Pasteur pipeti ile 3 geçer tek hücre süspansiyonu retina dissociating başlatmak.
- 10 ul tripsin (1mg/ml) ekleyin, 3-5 dakika bekleyin ve sonra yavaş yavaş mekanik doku ayırmak silikonlu Pasteur pipeti ile 3-5 kez pipet ve.
- 10 ul DNaz I (5mg/ml) ekleyin, yine 3-5 dakika sonra yavaş yavaş aşağı silikonlu Pasteur pipeti ile 3-5 kez pipet ve bekleyin.
Not: enzimatik ayrılma inkübasyon süresi, gözleri ve gelişimsel aşamada büyüklüğü sırasıyla değişir ve bağlıdır. Hafifçe aşağı yukarı pipetleme ve doku enzimatik sindirim aşamasında kontrol edin. - Hücre süspansiyonu artık homojen değil ama hala büyük hücre agrega içeren, ek 10 ul tripsin ve 10 ul DNaz I. eklemek
- Hücre süspansiyonu homojen olduğunda, doku sindirim ek 10 ul EDTA (0.5 M) tarafından durdurulur, Eppendorf tüpleri, ısıtıcı ve hücre süspansiyonları kaldırılır 1ml taze, buz gibi% 8 paraformaldehid ek 1s için sabit (PFA) bir dönme çalkalayıcı oda sıcaklığında.
Bölüm 5: ayrışmış hücre süspansiyonları Yıkama
- Hücre süspansiyonu ° C ile 0.2 RCF soğutma santrifüj 4 5 dakika santrifüj edilir.
- Süpernatant atılır ve pelet 1ml PBS içeren 3mg/ml BSA yeniden askıya alınır.
- Bu yıkama adımları iki kez tekrarladıktan sonra, pelet sonunda 500 ul PBS içeren 3mg/ml BSA, 5mM EDTA ve% 0.1 sodyum azid yeniden askıya alınır.
Not: Ayrıca sodyum asit, birkaç gün, 4 ° C hücre süspansiyonu saklanmasına izin Ancak, bir immünositokimyasal boyama takip edersen, boyama kalitesi kaybı bu sonucu olarak, tabanda tampon sodyum asit eklemek yok.
Bölüm 6: kantitatif apoptozis ve proliferasyon analizi için hücre süspansiyonları sitospin
- Bir veya iki delik ve sitospin huni ile bir buzlu uç mikroskop lamı, sitospin filtre bir sitospin slayt klip içine eklenir. Slayt klip kapalı ve sitospin rotor konumlandırılmış.
- Ayrışmış hücre süspansiyonu hafifçe aşağı yukarı pipetleme ve homojenize edilir.
Not: retinanın gelişim aşamasına bağlı olarak, ayrışma prosedürü hücre süspansiyonu gerekebilirsayılabilen bir hücre numarası almak için PBS ile sulandırılmış. - Hücre süspansiyonu (100 ul) bir kısım, bir sitospin huni uygulanır.
Not: huni hücre süspansiyonu pipetleme, pipet ucu huni alt tüm şekilde aşağı ulaştırılması gerekmektedir. Sitospin sonra hücre noktada görünür olacak hava kabarcıkları oluşturur ve hücre sayımı engellemektedir pipet ikinci basınç noktası üzerinden itmek için önemlidir. - 700 rpm'de 7 dakika süreyle bir slayt hücre süspansiyonu damlatılır.
- Apoptozis seviyelerde Eksojen olarak uygulanan faktörlerin etkisinin belirlenmesi için hücreler 4 ile boyanarak olabilir ',6-Diamidino-2-phenylindole (DAPI; 2μg/ml), floresan montaj orta monte edilmiş. Sitospin hücre noktalar (en az 10 pycnotic çekirdekleri oluşan) en az 1000 hücre sayımı ve hücre ölümü oranı toplam hücre yüzdesi olarak hesaplanan 3,4 sayar hücre apoptozis değişiklikler tespit edilebilir.
Not: Alternatif olarak, kültür retina wholemounts flatmounts 3 veya Kriyostat sections4 apoptotik çekirdeğinin dağıtım TdT aracılı dUTP nick sonuna etiketleme (TUNEL) tarafından değerlendirilmelidir. - Hücre proliferasyonunu tespiti için, BrdU (5 mcM) kültür ve BrdU dahil sonundan önce 6h immünositokimyasal boyama ile bir anti-BrdU antikoru (örneğin Gelişim Çalışmaları Hibridoma Bankası, Iowa, ABD) kullanılarak hücre homojenatlarında cytospins görselleştirilemediği eklenebilir.
- Farklı retinal hücre tipleri tedavi etkisi Brn3a (ganglion hücre belirteci) veya opsin (fotoreseptör işaretleyici) ve DAPI ile counterstaining gibi nöron spesifik antikorların cytospins görüntülenebilmekte.
Bölüm 7: Temsilci Sonuçlar
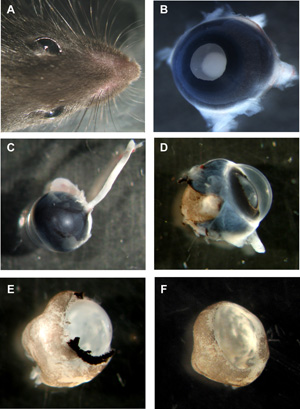
Şekil 1: fare Organotipik retina wholemounts hazırlanması Adımlar
Her iki gözü ile fare Başkanı lens yüzü B murin göz, tüm katmanları hala yerinde. C optik sinir arka murin gözü hâlâ bağlı D murin göz sklera ve pigment epitel kısmen kaldırıldı. E murin retinanın kornea, sklera ve pigment epitel tamamen kaldırıldı, ancak hala yerinde lens ve vitreus F lens ve vitreus ile retina murin wholemount fincan kaldırıldı. Lütfen Şekil 1'de bir büyük halini görmek için buraya tıklayınız .
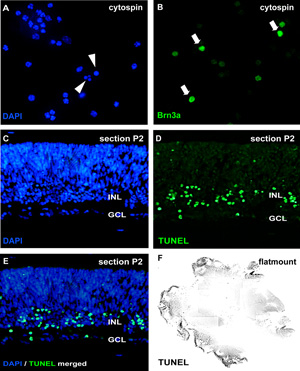
Şekil 2: sitospin ve bölümleri Organotipik retina wholemount kültür analizi
Apopitoz analizi için, ayrışmış hücre süspansiyonları cytospins DAPI ile boyanmış ve pycnotic çekirdekleri (A ok başları), nükleer parçalanma veya kromatin yoğunlaşması ile ayırt edilebilir . Alternatif olarak, wholemount bölümler (CE, fare retina postnatal gün (P) 2) veya (F) retina flatmount TUNEL assay ve DAPI (E) ile zıt olabilir. Farklı retinal hücre tipleri tedavi etkisi cytospins ganglion hücre belirteci Brn3a (B oklar) gibi nöron spesifik antikorlar tarafından görüntülenebilmekte GCL, ganglion hücre tabakası;. INL, ileriye dönük iç nükleer tabaka. Lütfen Şekil 2'de büyük halini görmek için buraya tıklayın .
Tartışmalar
Disosiasyon, tek tabaka üzerinde fare Organotipik retina wholemount kültürleri 2-5, retinospheroid veya yeniden toplanan 3D sfero kültürlerin korunması nöronal etkileşimleri ve bağlantıları 1 yalan, avantaj in vivo durumu taklit. Eski raporlar 2 karşılaştırıldığında, video makalede, lens ve vitreus retina zarar vermeden kaldırılması da dahil olmak üzere farklı gelişim evreleri retina fare gözleri ve diseksiyon enükleasyon özellikleri ayrıntılı bir ...
Teşekkürler
Yazarları, teknik yardım için Organotipik kültürleri ve U. Laub ve U. Gerster kuruluşu ile E. de la Rosa ve AI Valenciano ilk yardım için teşekkür etmek istiyorum.
Malzemeler
| Name | Company | Catalog Number | Comments | |
| Mice | Animal | Charles River Laboratories | ||
| Dissection microscope | Tool | Carl Zeiss, Inc. | ||
| PBS | Reagent | Sigma-Aldrich | PBS should be cold (> 4°C) and sterile | |
| Dulbecco`s modified eagle`s medium / nutrient mixture F-12 Ham | Reagent | Sigma-Aldrich | D 8900 | DMEM / F-12 |
| Apo-transferin | Reagent | Sigma-Aldrich | T 1147 | |
| Putrescin | Reagent | Sigma-Aldrich | P 5780 | |
| Sodium selenite | Reagent | Sigma-Aldrich | S 9133 | |
| Progesterone | Reagent | Sigma-Aldrich | P 6149 | |
| Gentamicine | Reagent | Invitrogen | ||
| L-Glutamine | Reagent | Invitrogen | 25030-024 | 200 mM (100X), liquid |
| Bovine serum albumine (BSA) | Reagent | Carl Roth Gmbh | 8076.3 | 30 mg/ml |
| Collagenase | Reagent | Sigma-Aldrich | C 0773 | 200 U/ml |
| Trypsin | Reagent | Sigma-Aldrich | T4799 | From porcine pancreas; 1 mg/ml |
| Hyaluronidase | Reagent | Sigma-Aldrich | H 3884 | 200 mg/ml |
| DNase I | Reagent | Roche Group | 1 284 932 | 10 mg/ml |
| EDTA | Reagent | Sigma-Aldrich | E 6511 | |
| Silicone solution | Reagent | SERVA Electrophoresis | 35130 | |
| Paraformaldehyde (PFA) | Reagent | Sigma-Aldrich | P6148 | 8% PFA in 0.1M phosphate buffer (pH 7.4). |
| 4’,6-diamidino-2-phenylindole dihydrochloride | Reagent | Sigma-Aldrich | D 0542 | DAPI |
| Fluorescent Mounting Medium | Reagent | Dako | S3023 | |
| BrDU | Reagent | Sigma-Aldrich | B 9285 | |
| 96-well plates | Tool | Falcon BD | 3072 | |
| 24-well plates | Tool | Falcon BD | 3047 | |
| Pasteur pipettes | Tool | Brand GmbH | 747720 | |
| Forceps DUMONT #5 | Tool | Fine Science Tools | 11252-30 | bevelled very fine shanks (0.05 mm x 0.02 mm tip) |
| Forceps DUMONT #7 | Tool | Fine Science Tools | 11271-30 | curved shanks (0.07 mm x 0.10 mm tip) |
| Spring scissors,straight, 8cm | Tool | Fine Science Tools | 15000-00 | fine, small straight blades |
| Standard scissors, straight, sharp/blunt | Tool | Fine Science Tools | 14007-14 | Use for decapitation or cervical dislocation |
| Eppendorf tubes | Tool | Eppendorf | 2ml; round bottom for better precipitation of pellet during centrifugation /cytospin | |
| Cooling centrifuge | Tool | Eppendorf | ||
| Rotation shaker | Tool | CAT | ||
| Cytospin | Tool | Thermo Fisher Scientific, Inc. |
Referanslar
- Rieke, M., Gottwald, E., Weibezahn, K. -. F., Layer, P. G. Tissue reconstruction in 3D-spheroids from rodent retina in a motion-free, bioreactor-based microstructure. Lab. Chip. 8, 2006-2213 (2008).
- Donovan, S. L., Dyer, M. A. Preparation and square wave electroporation of retinal explant cultures. Nature Protocols. 1, 2710-2718 (2006).
- Duenker, N., Valenciano, A. I., Franke, A., Hernandez-Sanchez, C., Dressel, R., Behrendt, M., de Pablo, F., Krieglstein, K., de la Rosa, E. J. Balance of pro-apoptotic transforming growth factor-beta and anti-apoptotic insulin effects in the control of cell death in the postnatal mouse retina. Eur. J. Neurosci. 22, 28-38 (2005).
- Franke, A. G., Gubbe, C., Beier, M., Duenker, N. Transforming growth factors beta and Bone morphogenetic proteins: Cooperative players in chick and murine programmed retinal cell death. J. Comp. Neurol. 495, 263-278 (2005).
- de la Rosa, E. J., Díaz, B., De Pablo, F. Organoculture of the chick embryonic neuroretina. Curr. Top. Dev. Biol. 36, 133-144 (1998).
- Dohle, D. S., Pasa, S. D., Gustmann, S., Laub, M., Wissler, J. H., Jennissen, H. P., Duenker, N. Chick ex ovo culture and ex ovo CAM assay: How it really works. J Vis Exp. 32, (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır