Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Uygulamalarda Canlı Görüntüleme Drosophila melanogaster Embriyonik Hemocyte Göçler
Özet
Drosophila hemocytes gelişmekte olan embriyonun bütünlüğü içinde dağılırlar . Bu protokol, floresan etiketli hemocytes embriyoları kullanılarak bu göçler montaj ve görüntü nasıl gösteriyor.
Özet
Birçok çalışma, adres hücre göçü
Protokol
Hazırlık
- Hemocyte özel bir Gal4 sürücüsü (örneğin srp-Gal4 2) ve genetik olarak kodlanmış UAS kontrol (örneğin UAS-GFP) altında bir floresan muhabiri içeren uygun Drosophila hatları alın. Srp-Gal4 UAS-GMA 3 veya CRQ-Gal4 UAS-GFP 4, 5, homozigot Sinekler görüntüleme amaçlı (nb GMA moesin aktin bağlayıcı etki alanı için erimiş GFP) yararlıdır; bir tartışma için aşağıya bakınız Gal4 sürücüleri ve UAS aralığı (Bloomington Menkul Kıymetler Merkezi, geniş bir çeşitlilik içerir) oluşturur.
- Genelde genetik haçlar, mutant allel Gal4 sürücüleri ve alternatif kromozomlar üzerinde taşınan UAS yapıları ile, floresan dengeleyici CTG veya TTG 6 kullanarak dengeli yürütülmektedir. Bu CTG / TTG ilişkili GFP floresan (bu aşamada 2.11 yapılır) yokluğu temelinde homozigot mutantlar seçmek mümkün kılar.
- Bir elma suyu agar plaka 7 ile döşeme kafes, hisse senetleri ve yer sinekler artırın . Sinekler yeterli embriyolar döşenecek başlamadan önce döşeme kafes iklime alıştırmak için en az iki gün gerekir. Genel olarak her seks yirmi sinekler görüntüleme için yeterli embriyolar üretmek için yeterli olmalıdır, ancak farklı çizgiler, bereket derece farklı olduğunu belirtmek gerekir. Biz hava akımına izin tabanı delinmiş, plastik bir kabın alt içine sığacak 55mm Petri kapları kullanın. Tam embriyo toplama aracı önemsiz, ancak zamanlamaları embriyolar sahnelenen doğru toplamak için kritik öneme sahiptir.
- 25 ° C'de veya zamanlanmış bir plaka tutulan bir gecede elma suyu agar plaka embriyolar toplayın. Ikincisi için biz genellikle sinekler plaka kaldırma ve embriyo montaj önce 15-16 saat 18 ° C'de yerleştirmeden önce, 4 saat önceden ısıtılmış bir plaka üzerinde bırakmaya izin verir ve bu geç dönem 12 ile embriyolar sağlar gelişme 15 sahne. Bir gecede plaka aşamaları büyük bir çeşitlilik içerir, ancak 25 kez daha uzun bir süre nedeniyle hemocytes floresan muhabir ifade daha yüksek düzeyde avantaj sunuyor ° C Gal4 UAS sistemi olarak ısıya duyarlı.
Prosedür
- Küçük bir miktar su ve yumuşak uçlu bir fırça kullanarak elma suyu agar plaka embriyolar yerinden oynatın. Yerinden çıkar embriyolar çıplak gözle kolayca görülebilir.
- Bir hücre süzgeç (Balıkçı) ya da ev yapımı elma suyu agar plaka, atık su toplamak için bir beher üzerinde yapılan sepetin içine su dökerek sepeti 7 embriyo transfer
- Eğer elma suyu agar plaka transfer yeterli embriyolar memnun olana kadar 2.2 adımı tekrarlayın.
- Su kullanarak hücre süzgecinden / sepeti embriyolar yıkayın.
- Yer hücre süzgecinden / sepet elma suyu agar plaka Petri kabı kapağı ve hücre süzgecinden / sepete embriyolar askıya almaya yetecek kadar düzgün çamaşır suyu ekleyin.
- Aydınlık altında diseksiyon mikroskobu embriyoların dechorionation izleyin: dechorionation iki dakika içinde gerçekleşmesi gereken, tamamlandığında dorsal uzantıları çözünmüş.
- Çamaşır suyu hücre süzgecinden / sepet içeren embriyolar çıkarın ve kalan çamaşır suyu su kullanarak yıkayın. Çamaşır suyu tüm izlerini 2.8 adıma geçmeden önce çıkarılmalıdır. Artık çamaşır suyu mavi renk pembe / beyaz ağartılmış varsa çamaşır suyu kaldırıldı olup olmadığını değerlendirmek için bir hile, mavi renkli laboratuvar dokular üzerinde kalan su örtecek.
- Kalan su hücre süzgecinden / sepeti alt uygulanan laboratuar doku / mediwipes kullanarak kurutun.
- Petri kabı kapağı bir damlacık su koyun. Ince bir fırça ile tüm dechorionated embriyolar, embriyo sepeti toplamak ve damlacık onları tekrar süspansiyon haline getirin. Sonraki mikropipet kullanarak su aspire veya dikkatli bir laboratuvar doku / mediwipes emici embriyolar kurulayın.
- Embriyoların kurutulduktan sonra, tüm embriyoların voltalef petrol bir damla ekleyin. Embriyoları içeren damlacık bitişik ikinci bir küçük bir damla yağ koyun. NB biz İngiltere'de bir voltalef petrol tabanlı ticaret bulamadı; Halokarbon petrol 700 (Sigma) yerine kullanılıyor olabilir.
- Uygun bir floresan diseksiyon mikroskobu altında yağ damlacığı saatçiler forseps bir çift (sayı 5) kullanarak istenilen genotip embriyolar sahnelenen seçin. Bu forseps kendi vitellin membran delinmesiyle embriyolar kepçe için içe doğru kıvrıktır (Şekil 1) olmalıdır. Ikinci petrol damlacığı seçilen embriyolar transfer. Konfokal mikroskop (Şekil 2) iyi görüntüler toplamak mümkün olması için diseksiyon mikroskobu floresan hemocytes görmek mümkün olduğu önemlidir. Biz genellikle ventral orta hat veya sahne 15 embriyolar hemocytes görüntü yanal göç monte sahne 13/14 embriyolarmotilite hemocytes embriyo üzerinde dağılımı aşağıdaki görüntü.
- (Şekil 3) arasında yaklaşık 1 cm bırakarak voltalef yağı 2 küçük damla kullanarak bir Petriperm / Lumox çanak (Sarstedt) alt iki lamelleri (18x18mm, kalınlık 1), Çubuk, bu lamel üzerine yerleştirilen bir destek için kullanılacak embriyoların onları ezmek için değil. Petriperm yemekleri (50mm çap), hidrofobik, gaz geçirgen bir zar içerir. Biz yemekleri (yemekler% 70 etanol ile silinir ve yeniden olabilir) birkaç kez kullanıldıktan sonra kullanımı daha kolay hale gelir.
- Diseksiyon mikroskobu aydınlık altında, bükülmüş forseps ve hat ventral tarafta seçilen embriyolar tek tek pick up ve paralel lamelleri kenarına (Şekil 3). Beceri ve sabrınız bağlı olarak, bu şekilde 15 kadar embriyolar hizalamak mümkündür. Embriyo ve Petriperm çanak membran hem kırılgan olduğu ve kolayca rüptüre olabilir hafifçe embriyolar işlemek için önemlidir.
- Bir kere küçük bir damla yağ ekleyin ve iki lamelleri arasında homojen bir tabaka oluşturacak şekilde yayılır izin embriyoların hizalanır. Petrol yayıldı sonra (bu birkaç dakika sürebilir) embriyoların hala ventral tarafta olup olmadığını kontrol edin. Embriyoların biraz haddelenmiş varsa, forseps ile onları tekrar yeniden konumlandırmak.
- Son olarak, cımbız (3 numara) iki önceden yapıştırılmış lamelleri üzerine oturtulmuş embriyolar üzerinde lamel (18x18mm, kalınlık 1) kullanarak. Tutkal lamel Bu lamel oje (Şekil 3) kullanılarak destekler.
- Konfokal veya geniş alan mikroskobu monte embriyolar Petriperm çanak alın ve uygun bir adaptörü kullanarak sahnede Petriperm çanak montaj. Dik veya ters çevrilmiş bir mikroskop lamel (zarından aksine) odaklı objektif lens ile kullanılıyor olabilir Ya.
Temsilcisi Sonuç:
Bu protokol, embriyonun ventral tarafında hemocytes canlı görüntüleme için Drosophila embriyolar monte anlatılmaktadır. Eğer doğru yapılırsa hemocytes, fotoğraf ya da film ya da oluşturmak için kolay olacaktır. Hemocytes (özellikle objektif lens) görüntü için kullanılan en önemli belirleyicisi mikroskop, ancak elde edilen görüntülerin niteliği de geliştirme aşamasında bağlıdır, sıcaklık embriyoların kaldırdı ve Gal4 ve UAS hatları kullanılır.
Floresan protein ekspresyonu yüksek seviyelerde hemocytes daha kolay bir şekilde görüntülü olmasını sağlayacak, bu nedenle, embriyoların (Şekil 2 ile alınan embriyoların içinde açık hemocytes örnekleri içeren protokol aşamasında 2.11 hemocytes görmek mümkün önemlidir. kamera) bir diseksiyon mikroskobu takılmıştır. Gal4 ve UAS yapıları nedenle artan sayıda, daha büyük bir sinyal-gürültü oranı sağlar. Ayrıca, bu da hemocyte davranış sağlayan görüntüleme, daha uzun süre takip edilmesi gereken yüksek lazer şiddetleri artan pozlama süreleri ihtiyacını azaltır.
GFP ifade çok yüksek seviyede, surround yuvarlak hücre gövdesi (Şekil 4A-B), özellikle ince bir tabaka gibi lamel hemocyte morfolojisi ince ayrıntılarına kadar gösterecektir. GFP hariç Dairesel bölgelerde phagosomes (Şekil 4A-C) temsil eder. Lamel (Şekil 4B) çıkan filopodia-gibi Parmak de görülebilir. İki Gal4 sürücüleri (tartışma) bir veya daha fazla srp-Gal4 özellikle bu işlemler (Şekil 4C) görmek için yeterli kalır, ancak konfokal mikroskop yavaş tarama hızları veya daha fazla lazer güç gerekli olabilir. Ekspresyon düzeylerinde azalma gibi görüntü hemocytes, çıkıntılar daha zor olur; yine de bu çıkıntılar daha az belirgindir (Şekil 4D) bile hücre gövdesi ve açık kaldığı sürece, bu koşullar altında hemocytes göç izlemek için hala mümkündür.
Önceki gelişim aşamaları (en fazla 13 sahne) hemocytes birbirleriyle yakın temas halinde göç eden ve tek tek hücrelerin ayırt etmek genellikle zordur. Aşamasının sonuna gelindiğinde 13 hemocytes ventral orta hat (Şekil 5A) aşağı tek bir satır oluşturdular, sonra, daha fazla hareketli olma, ventral sinir kablosu (Şekil 5B) kenarlarına yanal göç. Hemocytes dinamik çıkıntılar içinde aktin hücre iskeletinin GMA (Şekil 5C) veya kiraz moesin ifade aracılığıyla doğrudan görülebilir.
Bu şekilde embriyoların Montaj gaz değişimi sağlar ve dehidratasyonu engeller ve embriyolar yaşayabilir aşağıdaki görüntü kalır. Embriyo, embriyo içerik, vitellin zarından sızıntı olarak genellikle açıktır montaj sırasında hasar görmüşse. Bir embriyo sonra kurutmak Eğer bu genellikle vitellin membran deformasyonlar görülmüştür. Bazen bir embriyo timelapse film seyri sırasında rulo, ancak bu sadece uzun zaman ölçeğinde filmler için sorunlu olma eğilimindedir. Lastly, aynı anda birden fazla embriyoların montaj experimentalist kendi deney için mükemmel bir yönde bir embriyo elde etmek için en iyi şansı verir.

Şekil 1. Dechorionated embriyo manipülasyonu için Forseps.
Saatçiler forseps (boyut numarası 5) ipuçları moda için bir araç, burada gösterildiği gibi embriyolar kadar kepçe bükük içe olmalıdır. Ponksiyon embriyo hiçbir keskin kenarlara sahip olarak bükülmüş bölgenin dış yüzeyi de Petriperm membran konumlandırma sırasında embriyoların işlemek için yararlıdır.
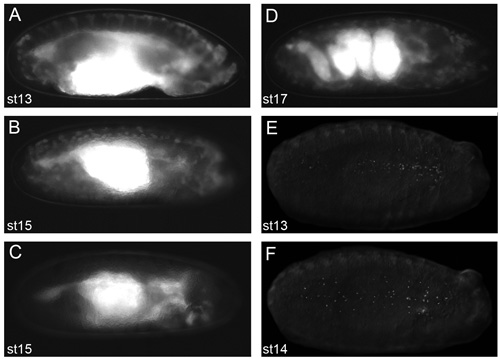
Şekil 2. Iyi canlı görüntüleme sonuçlar verecektir embriyolar Temsilcisi görüntüler.
Voltalef yağ dechorionated embriyolar (protokol 2.11 sahne) Görüntüler floresan diseksiyon mikroskobu alınan. CRQ Gal4, UAS-GFP embriyolar; aşamada 13 (A) ve sahne 15 (B) srp-Gal4, UAS-GFP Yanal manzaralı. Hangi bir sahne 15 srp-Gal4, UAS-GFP / + Yanal; CRQ-Gal4 uas-GFP/uas-N17Rac embriyo (C) hemocytes zaman hemocytes gibi neye embriyolar gösteren, kafasının dışına göç başarısız oldu onların göç yolları üzerinde belirgin değildir. Geliştirme (D) Bu aşamada gut dolambaçlı bir yapı gösteren CRQ Gal4, UAS-GFP embriyo; bir sahne 17 srp-Gal4, UAS-GFP Yanal görünümü kas kasılması başlangıcı bunun ötesinde embriyoların canlı görüntüleme önler gelişme aşamasında. Ventral aşamada 13 (E) ve sahne 14 kez (F) srp-Gal4, floresan etiketli çekirdekleri ile hemocytes yayılma gösteren UAS-kırmızı stinger embriyolar. Protokol aşamasında 2.11 floresan hemocytes Gözlem mükemmel görüntüler elde etmek için bir ön koşuldur; anterior tüm görüntüleri için doğru.

Şekil 3. Embriyoların Petriperm / Lumox çanak montajı.
İki 18x18mm lamelleri (kalınlığı 1) gösterildiği gibi yaklaşık 1cm ayrılmış küçük bir damla petrol kullanarak Petriperm çanak alt yüzüne yapışmış. Embriyolar sonra lamelleri kenarları uzun (ön-arka) eksenine paralel ventral tarafta kadar astarlı ve küçük bir damla yağ ile kaplıdır. Bir kez üçüncü bir lamel (18x18mm kalınlığı 1) hafifçe ezilmiş olan embriyolar önlemek için bir köprü olarak iki önceden yapıştırılmış lamelleri kullanarak yağ kaplı embriyoların üstüne yerleştirilen iki lamelleri arasındaki boşluğu doldurmak için petrol yayıldı. Bu lamel sonra oje iki küçük damla kullanarak iki lamel köprüler yapıştırılır. Bir kez ayarlandığında, embriyoların lamel (Petriperm zarından aksine) aşağı doğru odaklama objektif lens ile Dik veya ters çevrilmiş bir mikroskop görüntülenebilir.
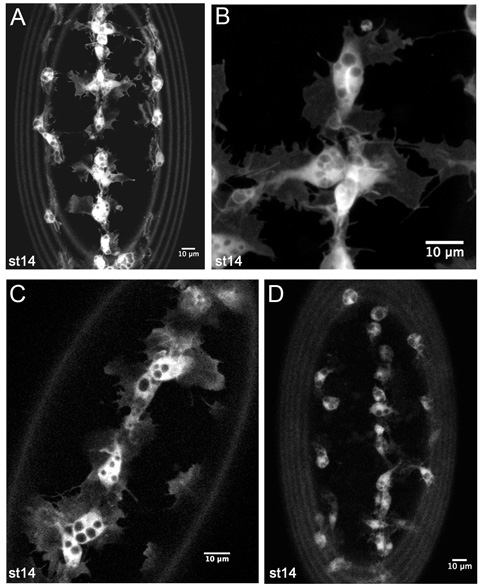
Şekil 4. GFP etiketli hemocytes canlı görüntüleme Temsilcisi sonuçlar.
CRQ Gal4, UAS-GFP embriyo (AB); bir sahne 14 srp-Gal4, UAS-GFP ventral tarafta hemocytes Z-projeksiyonları. (A) timelapse filmlerde hemocyte gelişimsel göçleri izlemek için kullanıldığı gibi daha düşük bir büyütme görüntü. (B) kendi morfolojisi ince ayrıntılarını gösteren, ventral orta hat hemocytes hala daha yüksek bir büyütme. (C), ventral orta hat üzerinde bir sahne 14 srp-Gal4, UAS-GFP / + hemocytes 1 m tek bir dilim CRQ-Gal4 UAS-GFP / + embriyo, ifşa Gal4 sürücüleri ve UAS düşük kopya sayısı yapıları da iyi bir görüntü oluşturmak için yeterlidir. (D) bir sahne 14 CRQ-Gal4, UAS-GFP embriyo hemocytes z-projeksiyon görüntüler. Burada hemocyte çıkıntılar nedeniyle, GFP, düşük ifadesi daha az belirgin ama film yapmak ve bu kombinasyon inşa Gal4 sürücü ve kullanıcı arayüzleri ile hemocyte göç izlemek için hala mümkün. Görüntüler Leica LSM510 konfokal mikroskop alındı anterior tüm görüntüler; görüntülerin çevre halkalar vitellin membran otofloresans kaynaklanır.

Şekil 5. GMA ifade hemocytes canlı görüntüleme Temsilcisi sonuçlar.
Evre (13), ventral orta hat (A) ve sahne 14 hemocytes Z-projeksiyonları (B) srp-Gal4 UAS-GMA embriyolar hemocytes gelişimsel göçler göstermek için timelapse filmleri alınmıştır. GMA ifade hemocytes (C) daha yüksek büyütme görüntüleme aktin dinamikleri hakkında detaylı bilgi elde edilebilir. GMA moesin ve etiketler aktin filamentler aktin bağlayıcı etki alanı erimiş GFP oluşur. Anterior tüm görüntüler; konfokal mikroskop görüntüleri alındı.
Tartışmalar
Bu prosedürün en önemli unsurlardan açıkça etiketli hemocytes sağlıklı embriyoların seçimi ve onlara zarar vermeden bunları dikkatli bir şekilde monte etmek için. Birkaç saat süreyle imaged embriyoların Halokarbon yağı sonra dehidratasyon dayanıklı ve bir kez monte edilebilir. Bizim ellerde 40X amacı ile her üç dakikada bir Zeiss LSM510 konfokal mikroskop görüntüleri z yığını alarak, embriyo ya da açık foto-hasar ihmal dehidratasyon üç saat görüntü hemocytes,. Hemocytes son derece d...
Teşekkürler
Bu protokol, Paul Martin ve Antonio Jacinto laboratuvarları ile işbirliği içinde ve çalışma ile geliştirilmiştir. Biz Bloomington Menkul Kıymetler Merkezi sinek satırları paylaşmak için devam etmek için mükemmel servis ve Drosophila topluluk için teşekkür ederiz . BS BBSRC bir proje hibe ile finanse edilmektedir. WW, Wellcome Trust Kariyer Geliştirme Bursu tarafından finanse edilmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Cell strainer | BD Biosciences | 352350 | 70μm pores |
| Halcarbon oil 700 | Sigma-Aldrich | H8898 | |
| Lumox/Petriperm dish | Sarstedt Ltd | 96077305 |
Referanslar
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Bruckner, K. The PDGF/VEGF receptor controls blood cell survival in Drosophila. Dev Cell. 7, 73-84 (2004).
- Dutta, D., Bloor, J. W., Ruiz-Gomez, M., VijayRaghavan, K., Kiehart, D. P. Real-time imaging of morphogenetic movements in Drosophila using Gal4-UAS-driven expression of GFP fused to the actin-binding domain of moesin. Genesis. 34, 146-151 (2002).
- Stramer, B. Live imaging of wound inflammation in Drosophila embryos reveals key roles for small GTPases during in vivo cell migration. J Cell Biol. 168, 567-573 (2005).
- Wood, W., Jacinto, A. Drosophila melanogaster embryonic haemocytes: masters of multitasking. Nat Rev Mol Cell Biol. 8, 542-551 (2007).
- Halfon, M. S. New fluorescent protein reporters for use with the Drosophila Gal4 expression system and for vital detection of balancer chromosomes. Genesis. 34, 135-138 (2002).
- Sullivan, W., Ashburner, M., Hawley, R. S. . Drosophila protocols. , (2000).
- Tepass, U., Fessler, L. I., Aziz, A., Hartenstein, V. Embryonic origin of hemocytes and their relationship to cell death in Drosophila. Development. 120, 1829-1837 (1994).
- Millard, T. H., Martin, P. Dynamic analysis of filopodial interactions during the zippering phase of Drosophila dorsal closure. Development. 135, 621-626 (2008).
- Doerflinger, H., Benton, R., Shulman, J. M., St Johnston, D. The role of PAR-1 in regulating the polarised microtubule cytoskeleton in the Drosophila follicular epithelium. Development. 130, 3965-3975 (2003).
- Olofsson, B., Page, D. T. Condensation of the central nervous system in embryonic Drosophila is inhibited by blocking hemocyte migration or neural activity. Dev Biol. 279, 233-243 (2005).
- Paladi, M., Tepass, U. Function of Rho GTPases in embryonic blood cell migration in Drosophila. J Cell Sci. 117, 6313-6326 (2004).
- Vlisidou, I. Drosophila embryos as model systems for monitoring bacterial infection in real time. PLoS Pathog. 5, e1000518-e1000518 (2009).
- Jacinto, A. Dynamic actin-based epithelial adhesion and cell matching during Drosophila dorsal closure. Curr Biol. 10, 1420-1426 (2000).
- Wood, W., Jacinto, A. Imaging cell movement during dorsal closure in Drosophila embryos. Methods Mol Biol. 294, 203-210 (2005).
- Kunwar, P. S. Tre1 GPCR initiates germ cell transepithelial migration by regulating Drosophila melanogaster E-cadherin. J Cell Biol. 183, 157-168 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır