Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Havayolu Direnci Ölçümleri ve Fare Bronkoalveolar Lavaj Sıvısı Örnekleme için, geri dönüşümlü, Non-invaziv Yöntemi
Özet
Kemirgen solunum fizyolojisi ve solunum yolu inflamatuar hücrelerin örnekleme tekrarlanan ölçümler arzu edilir, ancak genellikle mümkün değildir. Burada sözlü havayolu inflamatuar hücrelerin havayolu hiperreaktivite ve örnekleme tekrarlanan ölçümler izin verir fareler Entübasyon için tekrarlanabilir bir yöntem açıklanmaktadır.
Özet
Havayolu hiperreaktivite (AHR) ölçümleri ve bronkoalveoler lavaj (BAL) sıvısı örneklemesi, deneysel astım modelleri için gerekli olan, ama aynı hayvan gibi ölçümler elde etmek için tekrarlanır prosedürleri genellikle mümkün değildir. Burada, farelerde AHR ve bronkoalveoler lavaj sıvısı örnekleri tekrarlanan ölçümler elde etmek için protokoller göstermektedir. Fareler tedavi güçlü bir allerjen veya plasebo ile 14 gün boyunca intranazal yedi kez meydan vardı. Ilk meydan okuma öncesinde ve her intranazal meydan takip eden 24 saat içinde, aynı hayvanlar sözlü entübe ve mekanik ventilasyon, anesteziye edildi. Sahte ve alerjene meydan hayvanlar arasında asetilkolin (Ach) klorür intravenöz doz artırarak yol açtığı solunum sistemi direnci (RRS) doz cevap eğrileri karşılaştırılarak değerlendirilir AHR, tespit edilmiştir. Daha sonra, böylece hava yolu hücreleri bu diferansiyel numaralandırma yapılabilir ve aynı entübasyon ile, sol akciğere lavaj oldu. Bu çalışmalar AHR ve BAL sıvı toplanması tekrarlanan ölçümler aynı hayvanların mümkün olduğunu ortaya koyuyor ve bu maksimum hava yolu aşırı duyarlılığı ve havayolu eozinofili allerjen başlatılması 7-10 gün içinde elde edilir. Bu roman tekniği uzunlamasına deney için gerekli olan farelerin sayısını önemli ölçüde azaltır ve çeşitli kemirgen türleri, hastalık modelleri ve havayolu fizyolojisi aletleri için geçerli.
Protokol
Allerjen:
- C57BL / 6 fareler, yaş 4-8 hafta, derin genel anestezi elde etmek için 10 dakika boyunca oksijen buhar karışımı% 3.2 izofluran ile tasfiye hava geçirmez bir pleksiglas odasında anestezi.
- Intranazal allerjen sorunları (45μL OVA (22.5 mikrogram) ve 7μL A. oryzae (7 mg), PBS içinde) olmak üzere toplam yedi ardışık uygulamaları, Perşembe ve Pazar günleri, her Salı, yönetilmektedir.
Anestezi:
- Önce her bir allerjen, ve 7. meydan, fare, bir ışık hariç yuvasına yerleştirme önce 48 mg / kg etomidat (2 mg / ml) intraperitoneal yönetilmektedir.
- Basınç arka pençeleri (5-10 dk) başvurusu üzerine gözlemlenebilir nörolojik yanıt eksikliği tespit edilene kadar Konu priz kalır.
Entübasyon:
- ~ 37 ° C vücut çekirdek sıcaklığı, hipotermi önlemek için işlem boyunca konuya odaklanmış olmalıdır bakım sağlamak için mesafe muhafaza radyant ısı lambası. Rektal termometre kullanılan ısı kaynağı ne olursa olsun euthermia onaylamak için başlangıçta en az kullanılmalıdır.
KRİTİK ADIMLAR deney hayvanları tarafından alınan tüm sıvı ve aletler steril olmalıdır; prosedürleri sıkı aseptik koşullar altında yapılmalıdır. Anestezi altında iken uzun süreli hipotermi hayvanların anormal veri ve / veya ölüme yol açacaktır. Yeterlilik tüm invaziv prosedürler ile canlı hayvanlar üzerinde çalışmaya başlamadan önce kadavra hayvanlar kullanarak geliştirilmelidir. Oftalmik yağ, genel anestezi altında hayvanların korneal abrazyon önlemek için kullanılmalıdır. - Anestezi fareler yuvadan kaldırılır ve Pletismograf masaya yatış pozisyonu (ventral yüzü yukarı), yerleştirilir, 45 derecelik bir açıyla ayarlanabilir.
- Tablo çevreleyen bir lastik bant yerine oturana kadar bu konuda güvence altına almak için en üst satırı kesici dişler arkasına eklenir. Sağ elinde cımbız ile, kavrama, genişletmek ve sol elinde depressor metal bir yerde güvence önce ağız dil kaldırın, böylece entübasyon için engelsiz bir havayolu sağlar.
- Angiocatheter içeri sokulur ve bir ışık kaynağına bağlı bir 0.8 mm çaplı fiberoptik konu, ucu ötesine 10 mm genişletilmiş. Depressor sol el ile sakinleştirdi olduğu gibi, ses tellerine görüntülenmiştir kadar fiberoptik iplik ışıklı sonunda sağ el ile ağız boşluğu ve yutak yoluyla yönlendirilir. Parçacığı sonra hareketli ses tellerinin ve trakea içine direk görüş altında geçti, kabloları maksimum açıkken meydana zaman aşımına uğradı.
- Kateter ucu trakeanın orta kısmı içinde yatıyor kadar angiocatheter sonra trakea içine fiberoptik konu geçti. 17-22 gram fareler için, bu konnektör ve konu s alt çene ve kafatası aşırı arasındaki görünür kalan 10 mm kateter segmentine karşılık gelir. Kateter geçirilir gerçek miktarı, ilgili boyutu ve genetik arka plan 2-3 kateterize farelerin trakea doğrudan muayene ile tespit edilmelidir.
- Başparmak ile konnektörün hemen aşağıdaki oklüzyon sonlandırmak düzenli derin nefes (göğüs kafesi ve karın ritmik geziler) gözlemleyerek fiberoptik konu kaldırılır ve başarılı entübasyon teyit edilir. Boğulma tepkisi ne olursa olsun, başparmak tıkanıklığı, düzensiz nefes, ya da nefes almada zorluk, diğer belirtileri malpositioning ve genellikle özofagus entübasyon işaret angiocatheter göstergesidir.
KRİTİK ADIM Arıza hızlı bir özofageal entübasyon tersine çevirmek için öldürücü olabilir. Özofageal entübasyon şüpheleniliyorsa, kateterin kolayca çıkartılabilir olmalıdır ve hayvanın normal solunum paterni devam ediyor sonra reinserted. Etomidat, mevcut tüm kemirgen anesteziklerin olarak tercih edilen anestezi, bu ajan en kardiyovasküler toksisite (hipotansiyon, aritmi, kardiyak arrest) kışkırtır. - Alt Pletismograf tablo çalışma tezgahı ve hava vantilatör port karşı karşıya kadar konu 180 ° dönüş paralel kadar. Ventilatöre bağlanmadan önce yan hayvan açın.
- Torakoabdominal gezi hava geçirmez bir bağlantı sağlamak ve ventilatör (150 solunum / dakika, 9 ml / g tidal volüm,% 100 oksijen işleyişi) aktive sonra, ventilatör ile ayak görüldüğü zaman, başarılı entübasyon daha da teyit edilmiştir.
İntravenöz hattı:
- A 10 mm konik açısı içine bakacak şekilde, 27ga iğne şırınga konektöründen ücretsiz eritme, ve steril forseps ve hemostat kullanarak orta noktada iğne 90 ° bükme yoluyla kaldırılır. Olmayan Eğimli sonunda IV enjeksiyon portu önde gelen PI10 boru bağlı.
- Potansiyel önlemek içinölümcül hava embolizasyon, tüp ve iğne 37 ile tasfiye ° C, 1 ml şırınga ile% 0.9 NaCl. 15ml bir santrifüj tüpüne kap içine açılan bir delikten itti 27ga iğne, enjeksiyon portu oluşur. Kap, böylece hava iğne sürüklenmemiş ve damar içine enjekte edeceğini olasılığını azaltarak, iğne ucu sürekli batık olduğunu tuzlu gibi ile doludur.
- Isı lambası altında kalan fare ile, iğne kaudal aşırı kuyruk paralel ve lateral ven üzerinden uyumlu hale gelmiştir. Damar s uzunluğu boyunca cranially yönettiği ve bend subkutan itti iğne, cilt altında biraz çalıştırmak. Başarılı IV yerleşimi şırınga pistonu hafif çekme ile IV tüp içine kan backflow gözlemleyerek teyit edilir. Ayrıca, kuyruk ven içine 50-100 ul salin enjeksiyonu üzerine IV hattı üzerinden akışı engelsiz olmalıdır. Ara sıra kuyruk damarları stably kanüle olamaz. Bu gibi durumlarda, fare, diğer tarafında ve IV genellikle zorlanmadan erişilebilir diğer kuyruk 180 derece dönebilir.
- Kurulumdan ısı lambası çıkardıktan sonra, konu daha sonra 4 kelepçeler uygulaması ile hava geçirmez olarak güvenli, Pletismograf içine alınır.
KRİTİK ADIM ısı lambası kalmasına izin Pletismograf odasında hava ısı ve potansiyel olarak sağlanmalıdır iv iğneler ve çözümler R RS Sterilite sonraki ölçümler değiştirmez. Iğne Sterilizasyon iv yerleştirme öncesinde steril serum fizyolojik ile durulama ve kızarma% 70 etanol ile çeker ve kızarma tarafından gerçekleştirilir. Ayrıca, kuyruk% 70 etanol veya iv ekleme önce izopropil alkol ile temizlenmesi gerekir.
Havayolu direnci ölçümleri:
- Tepe direnci katsayısı sürekli kantitatif tarafından belirlenir DPT / V (DPT trakeal basınç değişim ve V hava akışı) eşit akciğer hacmi puan (% 70 tidal hacim). DPT, trakeal angiocatheter bağlı bir basınç dönüştürücü kullanarak belirlenir. V belirlemek için, Pletismograf basınç değişimleri, fizyolojik aralıkları üzerinde çalışılan hacim değişiklikleri kalibre edilir. Preamp modül tarafından hesaplanan zamanla Pletismograf hacmi, diferansiyel, V. istikrarlı bir temel oluşturma sonra R RS (<3 dakika içinde% 5 varyasyon), ardışık beş artan dozlarda (hacim = 2 g / ml vücut ağırlığı) asetilkolin klorür (0.058, 0.18, 0.59, 1.58 ve 5.8 mg / kg vücut ağırlığı, pH 7.4,% 0.9 tuzlu su, buz ve her enjeksiyon öncesinde el ısındı idame) konsantrasyonları ile bir saniye içinde, iv enjekte edilir başlangıca R RS döndükten sonra uygulanan başlangıç direnci üç katına (yaklaşık 12 cm H 2 O x ml -1 x sn, yani yaklaşık 4 cm tipik temel üstünde hava yolu direnci% 200 oranında artış kadar, sonraki her bir doz H 2 O x ml -1 x sn) elde edilir. Bazal değerler (PC 200 adlandırdığı) R RS% 200 artışa neden vücut ağırlığının mg / g, provokatif konsantrasyon Ach Ach-R RS doz-yanıt eğrilerinin matematiksel enterpolasyon ile hesaplanır.
- PC 200 değerleri, serbest elemanları ulaştı ve Pletismograf sökmeye edilmiştir. Maksimum 5 Ach artan dozlarda verilir. Ach konsantrasyon aralığı yukarıda verilen en naif fare suşları için PC 200 değerleri elde etmek için uygundur.
KRİTİK ADIM yaklaşık 4 cm H 2 O x ml -1 x saniye 30 saniye boyunca direnç monitör temel üzerine kurulmuştur, normal serum fizyolojik 60 mcL iv anestezi uygun düzlemde elde edildiğini teyit etmek için enjekte edilebilir. Tam anestezi ile, direnç önemli bir değişiklik olacak, bacaklarda ya da kuyruk direnci ya da hareket bir artış fiziksel sıkıntının bir işareti temsil eden ve ek anestezik ihtiyacı gösterir. - Kuyruk ven IV çıkarın ve sonra trakeal kanül yerinde tutarak solunum yolu bakımı, ventilatör hayvan kesmek. Ara sıra hayvanların hemen spontan solunum devam etmek için başarısız. Bu gibi durumlarda, solunum, göğüs kafesi hafifçe masaj yaparak teşvik edilebilir.
KRİTİK ADIM spontan solunum kurtarma odasına transfer etmek için önce kurulmuş olması gerekir, aksi takdirde ölüm meydana gelir. - Spontan solunumun yeniden başlatılması üzerine, fareler 37% 100 O 2 ve bakımı ile temizlenir bir oda, bir yerde trakeal kanül ile aktarılır ° C bir ısı lambası kullanarak. 15-20 dakika içinde, fare, güçlü bir nefes ve trakeal kateter kaldırılır ve hayvanlar olabilir ve bu noktada, ekstremitelerde hareket etmeye başlayanafely düzenli kafeslerine aktarılır.
KRİTİK ADIM havayolu kolayca asetilkolinin indüklediği hiper salivasyon nedeniyle bilinçsiz bir fare tıkalı ve havayolu fizyolojik ölçümler aşağıdaki anestezi farelerde boğulmaya bağlı ölüm için önemli bir nedenidir. Bu nedenle, trakeal kanül uyandırılamadığı ve hiper-salivaton sona kadar çıkarılmamalıdır kadar, bronkoalveoler lavaj uygulanan farelerde bile yerinde kalmalıdır.
Bronkoalveoler lavaj:
- Bronkoalveoler lavaj sıvı toplanması, farelerin yeterli öğürme refleksi (kurtarma odasında yerleştirildikten sonra ~ 20 dk) kurtarabilirsiniz zaman güvenlidir. Öğürme refleksi angiocatheter hafifçe içe ve dışa doğru kayar tarafından değerlendirilir; açık öksürük ya da mücadele öğürme refleksi geri olduğunu göstermektedir.
Izin KRİTİK ADIM bir iyileşme süresi çok uzun süreli bireysel farelerden alınan BAL dönüş verimliliği büyük ölçüde azalacak; bu nedenle, önerilen 20 dakikalık dinlenme dönemi takip öğürme refleksi, her birkaç dakikada izlenebilir olmalıdır . Eğer fareler kısmi uyanışı nedeniyle lavaj işlemi tolere edemeyen,% 3.2 izofluran buhar anestezi kullanılabilir. - ~ 30 ° sol lob akciğer yönlendirilmiş sürekli bir bend ile metalik entübasyon kılavuz tel (0,5 mm OD), angiocatheter eklenir. Kılavuz tel ve kateter angiocatheter (hub hariç) sadece 1mm tarafından ön dişlerin ötesine uzanan öyle ki, akciğer sol lob birlikte gelişmiş olan.
KRİTİK ADIM Arıza sol akciğer izole etmek için büyük ölçüde hayvan ölüm olasılığını artırırken, verim düşürecektir . Bakım, kılavuz telin ucu açık angiocatheter sonuna kadar geçmez emin olmak için alınmalıdır. Çıkıntılı metal ucu ile angiocathether ilerlemek bir trakeal laserasyon ve trakea rüptürü nedeniyle ölüme yol açabilir. - Angiocatheter yerinde tutmak, kılavuz tel kaldırılır ve 300 mcL PBS (pH 7.4, steril) 1 ml şırınga ile sol akciğer temizlendi. Hemen negatif basınç oluşturmak için şırınga pistonu çizerken, angiocatheter yoğun akciğer masaj yaparken kaldırıldı (3 s) yavaş yavaş, sonra. 100-200 mcL BAL dönüş bekleniyor.
- 37 ° C,% 100 O 2 odasının sürekli toraks masaj yaparken. Lavaj farelerin hemen geri Sol tarafına yerleştirin fareler tamamen düzelene kadar (~ 20 dk). Hayvanlar kafesler içine yerleştirilir.
ZAMANLAMA:
Fare başına, bütün prosedürü yerine getirmek için 1 saat daha artık almalıdır: 3-4, 5-10 dakika Adım; Adımlar 5-21, 10 dk; Adım 22, 20-30 dakika; Adımlar 23-24. 10 dk. Artmış yeterlilik ile protokol şaşırtıcı konuları, 3 fareler / saat işlenebilir.
Temsilcisi Sonuçlar:
PC 200 değerleri tedbirler ile belirlenen farelerde Havayolu hiperreaktivite, aktivasyonu ve sitokin IL-135-7 T hücreleri ve sekresyon akciğerlere işe bir sonucudur. Böylece, havayolu hiperreaktivite allerjen ile havayolu meydan kaçınılmaz bir sonucu değildir, ama çok sağlam bir T hücre bağışıklık bölmesi ve T hücre yanıtları için tekrarlanan alerjene maruz ortamında geliştirmek için gereken süreyi bağlıdır. Şekil. 2a, havayolu hiperreaktivite, altıncı meydan sonra başka önemli bir artış ile 5 allerjen zorlukları sonra geliştirilen temel değerleri, önemli ölçüde kıyasla daha düşük PC 200 değerler olarak tanımlanır. Nedenlerden dolayı tam olarak anlaşılmış değildir ilk allerjen (Şekil 2a), hava yolu reaktivitesi sonra (PC 200 değerleri artan) azalmıştır. Benzer eğilimler aynı fareler (Şekil 2b) Ach doz cevap eğrileri karşılaştırılarak açıktır. Ancak, tam havayolu hiperreaktivite beşinci allerjen sonra aniden gelişir burada görülür, öyle ki fareler 30 kat daha fazla olmak, dördüncü ve altıncı sorunları arasında Ach daha duyarlı. Birlikte, AHR en güvenilir ölçümler altı allerjen zorlukları (12 gün) sonra elde edilen bu bulgular gösterir; önceki timepoints ölçümleri, son derece değişken veri verim muhtemeldir. Araç intranazal (tuzlu su) ile tekrar tekrar meydan Fare havayolu hiperreaktivite geliştirmek ve verilen Ach tüm dozlarda, R RS ölçümleri önemli ölçüde (Şekil 3 ve veri gösterilmemiştir) bazal değerlerinden farklılık gösterebilir yok.
Önce sağlam AHR ortaya çıkması, allerjen ile indüklenen hava yolu baskın hücre tipi nötrofil (Şekil 4) idi. AHR eğilim benzer şekilde, ancak, eozinofili yavaş yavaş tekrar tekrar allerjen ve af BAL sıvısında eozinofil sayısal baskın hücre tipi oldu güçlendirdineutrophis sayıları belirgin bir düşüş (Şekil 4) ile tesadüf ter altıncı zorluk,. Makrofajlar başlangıçta ilk birkaç allerjen zorluklarla sayısı artmış ve bundan sonra bolluk içinde dalgalanmıştır. Lenfosit bolluk ne olursa olsun, allerjen zorlukların sayısını önemli ölçüde değiştirebilir ve paradoksal model birincil önem verilen, genellikle BAL sıvısında az sayıda hücre vermedi.
Ne allerjen ne BAL örnekleme alan farelerde Havayolu direnci ölçümleri deney 17 gün içinde değişiklik yoktu. Havayolu fizyolojisi ölçümler veya allerjen yokluğunda tekrar BAL sıvısı örneklemesi yapılan ve 5 gün (veriler gösterilmemiştir) sonra da devam etmedi solunum yollarında sadece gelişmiş bir nötrofil ve makrofaj işe gösterdi. Bu bulgular, allerjen meydan farelerde gözlenen belirgin nötrofili büyük ölçüde usul ve antijen değil sonucu olduğunu göstermektedir.
Kontrol, PBS-meydan fareler, hava yolu direnci ölçümleri de zaman içinde önemli ölçüde değişiklik yoktu. Gelişmiş makrofaj ve nötrofil değil, BAL sıvısında eozinofil, istihdam da bu farelerin, sadece tekrarlanan BAL sıvısı örneklemesi (Şekil 4 b, d) alan farelerde gözlenen bu değişikliklerin benzer görüldü. Hep birlikte, bu veriler, alerjik (eozinofilik) hava yolu inflamasyonu ve AHR indüksiyon, havayolu farklı manipülasyonlar allerjen önemi alt çizgi değil.
Burada kullanılan proteinaz benzer intranazal allerjenler kullanarak benzer sonuçlar beklenebilir. Ancak, birçok araştırmacılar alerjik akciğer hastalığı neden ovalbumin kullanın. Ovalbumin intradermal veya intraperitoneal emişli (1-2 hafta) uygun bir süre havayolu hiperreaktivite de dahil olmak üzere, bir alüminyum tuzunun, sağlam bir astım fenotipi çöktürülmüş sonra, çözünür ovalbumin ile tek bir intranazal meydan sonra 24 saat içinde beklenebilir.
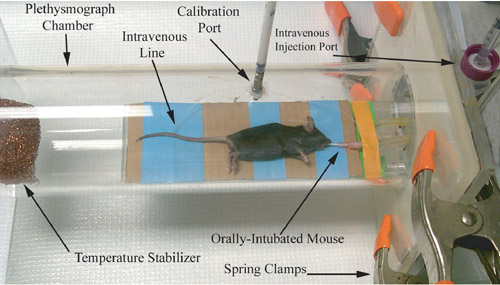
Şekil 1 kemirgen Pletismograf Fotografik gösterimi, havayolu fizyolojisi ölçüm kayıt hemen önce.

Şekil 2. Hava yolu direnci ölçümleri. A) istatistiksel amaçlar için, antilog PC 200 değerleri rapor edilmiştir. Ilk meydan okuma ve sonraki düşüş daha fazla zorluklar sonra antilog PC 200 yılında büyük bir artış dikkat edin . B) Solunum sistemi direnci (RRS):, altıncı ve yedinci zorlukları sonra Ach-RRS doz-yanıt eğrisinin dikliği unutmayın. Hata çubukları SEM temsil eder.
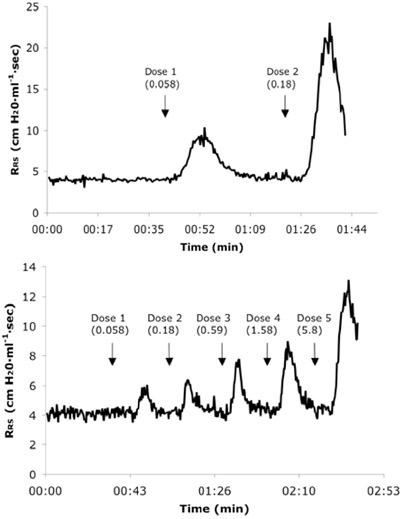
Şekil 3. Temsilcisi gerçek zamanlı solunum sistemi direnci (R SC) Ach ardışık IV dozları alan fare meydan naif bir (A) ve (B) 6X allerjen iz. Doz değerleri mg / kg birimlerinde sunulmaktadır.

Şekil 4 7 ardışık intranazal zorlukları ile tedavi edilen farelerde sol akciğerlerden edilen bronkoalveoler lavaj örneklerinde Diferansiyel bağışıklık hücre sayımı . Allerjen (A) veya PBS (B) ile tedavi edilen farelerde bağışıklık hücrelerinin yüzde (%) bolluğu. Allerjen (C) veya PBS (D) ile tedavi edilen farelerden alınan bağışıklık hücrelerinin toplam sayısı. Sem - Değerler ortalama + / olarak gösterilir.
Tartışmalar
Çalışmada, astım ve diğer çeşitli hava yolu obstrüktif hastalıkları, biyomedikal araştırmanın aktif ve genişleyen bir alan oluşturmaktadır. Astım ile ilgili deneysel araştırmaların önemli bir bileşeni, değişen koşullar altında havayolu boyutu değişiklikleri ölçmek için kapasite. Provokatif meydan okuma, kurallı bir özelliği, astım ve ilgili akciğer hastalıkları ve solunum yolu olarak adlandırılan hava yolu aşırı duyarlılığının bir özellik yanıt aşırı hava yolu daralma...
Teşekkürler
Dr. W. Mintzer fiberoptik orotrakeal entübasyon gerçekleştirmek için öneri için teşekkür ederim. Ulusal Sağlık Enstitüleri hibe U19AI070973, R01AI057696, K02HL75243 ve R01HL082487 tarafından desteklenir.
Malzemeler
Havayolu fizyolojisi ölçüm yazılımı (Rescomp) özel hazırlanmış (415-519-4371 Millennium Premier Grup) oldu.
Veriler, Pentium III işlemci (Intel, Inc. Santa Clara, CA) ve dijital sinyal dönüştürücü 17-pin analog (National Instruments, # PC-LPM16) ile donatılmış, Windows XP çalıştıran bir PC iş istasyonu kullanılarak analiz edildi.
Buxco, Inc. Wilmington, NC, küçük bir hayvan havayolu fizyolojisi iş istasyonu özel (Millenium Premier Group) piyasada bulunan basınç dönüştürücüleri (parça no TRD5700 ve TRD4510), preamp modülleri (# MAX2270), kasa (part # MAX1320 kullanarak toplandı ) ve özelleştirilmiş bir küçük hayvan Pletismograf.
0.5mm dış çaplı ışık kaynağına bağlı fiber optik iplik, (Cole Palmer Aydınlatıcı, 41.722 serisi)
Vantilatör (Harvard Apparatus Mouse Vantilatör, # 687)
10 mm, 27ga iğne (BD Biosciences, kedi yok. 309.602)
Isı lambası
1 ml şırınga (BD Biosciences, kedi yok. 305.109)
4 kelepçeleri (Pony 3200 bahar kelepçe)
Entübasyon kılavuz için 0,5 mm dış tel
Hemasitometre
SuperFrost / plus mikroskop lamı (Fisher kedi yok. 12-550-15)
Shandon Filtre Kartlar (Termo kedi yok. 5.991.022)
Diferansiyel hücre slayt leke (Fisher kedi yok. 122.911)
Işık mikroskobu (Leica)
Sitospin 3 (Shandon)
20 GA, 1.25 inç ProtectIV intravenöz kateterler (Smith Tıp)
0,5 mm polimer fiber optik (Edmund Optik # NT02-532).
Referanslar
- Hamelmann, E. Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography. Am. J. Respir. Crit. Care Med. 156, 766-775 (1997).
- Adler, A., Cieslewicz, G., Irvin, C. G. Unrestrained plethysmography is an unreliable measure of airway responsiveness in BALB/c and C57BL/6 mice. J. Appl. Physiol. 97, 286-292 (2004).
- Bates, J. The use and misuse of penh in animal models of lung disease. Am. J. Respir. Cell Mol. Biol. 31, 373-374 (2004).
- Lundblad, L. K., Irvin, C. G., Adler, A., Bates, J. H. A reevaluation of the validity of unrestrained plethysmography in mice. J. Appl. Physiol. 93, 1198-1207 (2002).
- Grunig, G. Requirement for IL-13 independently of IL-4 in experimental asthma. Science. 282, 2261-2263 (1998).
- Corry, D. B. Requirements for allergen-induced airway hyperreactivity in T and B cell-deficient mice. Mol. Med. 4, 344-355 (1998).
- Corry, D. B. Interleukin 4, but not interleukin 5 or eosinophils, is required in a murine model of acute airway hyperreactivity. J. Exp. Med. 183, 109-117 (1996).
- Amdur, M. O., Mead, J. Mechanics of respiration in unanesthetized guinea pigs. Am J Physiol. 192, 364-368 (1958).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır