Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Lazer Yakalama Mikrodisseksiyon Drosophila Periferik Nöronlar
Bu Makalede
Özet
Bu video makalede izole etmek için bir yöntem mevcut tek veya birden fazla Drosophila Kızılötesi yakalama (IR) Lazer Çekim Mikrodisseksiyon (LCM) sınıfı kullanarak üçüncü instar larvaları da nöronların. Izole nöronların elde edilen RNA kolayca QRT-PCR veya mikroarray analizleri de dahil olmak üzere aşağı uygulamalar için kullanılabilir.
Özet
Drosophila periferik sinir sistemi (PNS) (da) nöronların dendritik arborization sınıfa özel dendrit morfolojilerinden 1,2 altında yatan moleküler mekanizmaları araştırmak için mükemmel bir model sistemi sağlar. Moleküler analizlerin sınıf özgü da nöron gelişimi kolaylaştırmak için, saf bir nüfus bu hücreleri elde etmek için hayati önem taşımaktadır. Manyetik boncuk tabanlı hücre arıtma 3,4, Floresan Aktif Hücre Ayırma (FACS) 5-8 ve stratejileri 9 tabanlı RNA bağlayıcı protein de dahil olmak üzere Drosophila hücreler, farklı hücre ve doku-spesifik RNA izolasyon teknikleri bir dizi bulunmasına rağmen hiçbiri mekansal hassas bir yüksek derecesi ile tek veya birden fazla sınıf özel Drosophila da nöronların izole etmek için bu yöntemleri kolayca kullanılabilir. Lazer Yakalama Mikrodisseksiyon (LCM), yüksek uzaysal çözünürlük ve doğruluk derecesi ile doku bölümleri belirli hücre türlerini izole etmek için kullanılabilecek bir derece güçlü bir araç olarak ortaya çıkmıştır. Izole hücreler elde edilen RNA sonra Mah-PCR ve belirli bir hücre tipi 10-16 içinde mikroarray ifade profil de dahil olmak üzere analizler için kullanılabilir. LCM, bugüne kadar, üçüncü gelişim instar larval aşamada da nöronlar da dahil olmak üzere Drosophila doku ve hücreler 17,18, analizinde yaygın olarak uygulanan değil.
Burada LCM kızılötesi (IR) sınıfını kullanarak Drosophila da nöronların izolasyonu için optimize edilmiş protokol mevcut. Bu yöntem, yüksek özgüllük ve uzaysal çözünürlüğü ile tek, özel sınıf veya birden fazla da nöronların yakalamak için sağlar. UAS-mCD8 ifade Yaş uyumlu üçüncü instar larva: GFP 19 transgen kontrolü altında ya sınıfı IV da nöron spesifik PPK GAL4 20 sürücü veya pan-da nöron spesifik 21-7 GAL4 21 sürücü, bunlar için kullanılan deneyler. RNA izole da nöronların elde edilen çok yüksek kalitede ve doğrudan QRT-PCR veya mikroarray analizleri de dahil olmak üzere downstream uygulamalar için kullanılabilir. Ayrıca, bu LCM protokol diğer Drosophila hücre tipleri, hücre tipi GFP belirli, GAL4 odaklı ifade desen bağımlı bir kalkınma çeşitli aşamalarında yakalamak için kolayca adapte edilebilir .
Protokol
Drosophila Periferik Nöronlar LCM Genel Yorumlar
LCM için gerekli hücrelerin doku tipi ve sayısı bağlı olarak bir hafta veya daha uzun, 6 saat kadar izin verin.
Tüm işlemler kesinlikle RNAse koşullarda standart prosedürler izlenerek yürütülmektedir. 21-7-GAL4 ya ifade Larva, UAS-mCD8: GFP veya PPK GAL4, UAS-mCD8: GFP transgenik muhabiri hatları bu deneylerde kullanıldı.
1. Larvaların hazırlanması
- 30-40 yaş eşleştirilmiş üçüncü instar larvaları toplayın ve GKD 2 O yıkayın RNAse Away (Sigma-Aldrich) kısa çalkalama ve GKD 2 O Uzakta RNAse kaldırmak için son bir yıkama izledi. OCT larvaları gömme önce temiz bir Kimwipe fazla GKD 2 O tamamen kapalı Wick.
- Larvaları tek bir katman karşılamak için yeterli, temiz bir doku gömme ve küf tabakası OCT (1.5-2mm) ince bir tabaka ile çekin.
- Larvaları gömme önce, gerekirse, 0 ° C, doku gömme kalıpları OCT serin. Bir buz bloğu OCT içeren kalıp koyarak bunu yapın. Bu gömme işlemi sırasında larva hareket azaltmaya yardımcı olacaktır.
- , Önceden soğutulmuş Ekim temiz larvaları koyun ve birbirine paralel olarak düzenlemek. Larvaların düzenlenmiştir sonra, yavaş yavaş larva düzenleme bozmadan OCT ile kalıp doldurmak. Kuru buz bloğu üzerine yerleştirerek kalıp donma oturtun. [Kritik Adım: Snap-friz hareketi azaltmak için anında larvaları] Bu yöntem, larva, yakalamak için bölüm başına hücrelerinin sayısını maksimize, tek bir düzlemde olmasını sağlayacaktır .
Ilgi hücreleri tanımlamak için doku morfolojisi korumak için, veya beklenen sayıda Bölüm başına bir hücre, sonra 11. Adım doğrudan devam tatmin edici bulunursa gerekiyorsa.
Hücreler özellikle etiketli GFP veya RFP olarak kolayca tanımlanabilir bir kalemi ile tespit edilebilir, ancak bölüm başına hücre sayısı düşük olduğu bulunmuştur Alternatif olarak, eğer daha sonra 5-10 Adımlar hücrelerinin sayısını artırmak için yararlı olabilir Bölüm başına yakalamak için. Bu isteğe bağlı adım ve olumlu sonuçlar sağlamak için diğer bir yöntem başarısız olduğunda Bölüm başına LCM için kullanılabilir da nöronların sayısının artırılması için bir yöntem olarak, yalnızca çok gerekli olduğunda düşünülmelidir. [Dikkat: Bu yöntem genel olarak doku morfolojisi bozabilir ve doku tanımlama yapmak çok zor belirli bir mekansal konuma dayalı olabilir. ]
- 1. Adımda anlatıldığı gibi 50-70 üçüncü instar larvaları yıkayın. RNAse ücretsiz 1X PBS 500 ul içeren 1.5 ml mikrofuge'de tüp larvalar yerleştirin.
- 6-7 yavaş güçlü bir vuruş, bir polipropilen havaneli kullanarak (ABD Scientific) larvaları Dounce.
- 16.000 az çözüm Santrifüj (x) g (5-10 saniye larva tırnak etlerini mikrofuge'de tüp altına yerleşmek kadar. Süpernatantı atın. Pelet öncelikli olarak larva manikür oluşmalıdır da nöronlar da dahil olmak üzere PNS , sıkıca yapıştırılır.
- 500 ul 1X PBS 1X PBS ile tekrar süspansiyon pelet kütikula pelet 2-3 kez yıkayın. Kompakt bir granüle 1 dakika 16.000 (x) g çözüm Spin. Tamamen ince bir Pasteur pipeti kullanarak süpernatant aspire.
- Mikrofuge'de tüp temiz bir spatula ile dikkatlice pelet kaldırmak ve temiz bir Kimwipe dokusu kullanarak aşırı PBS fitil. [Not: Bu hücre verimi artırmak için mümkün olduğunca kompakt pelet tutmak için önemlidir]. Plastik bir kalıp üzerine ince bir tabaka OCT (1mm yaklaşık) içeren kompakt manikür pelet yerleştirin.
- Yavaşça ince bir dairesel alanda pelet yayıldı. OCT ile kalıp doldurun ve doku dondurma Adım 4 açıklandığı gibi.
- 5-8 mikron kalınlığında bir Kriyostat kullanarak, düz, etiketli, yüksüz, RNAse ücretsiz cam mikroskop slaytlar frozen kesti. [Kritik Adım: slayt merkezine yakın pozisyon doku bölümleri.]
- Doğrudan kuru buz veya -80 ° C'de temiz bir mikrodiseksiyon için hazır olana kadar slayt-box ya slaytlar saklayın. Doku kesit sonra bir hafta içinde tercihen LCM gerçekleştirin.
PAUSE NOKTASI
2. Dondurulmuş Larvaların Bölüm Dehidrasyon ve Tırnak Kaldırma
[Kritik Adım: dehidratasyon için tüm çözümleri her LCM oturumundan önce taze hazırlanmış olmalıdır. Dondurulmuş larva doku bölümleri komple dehidratasyon optimum mikrodiseksiyon verimliliği sağlamak için gerekli]
- -80 ° C derin dondurucu, dondurulmuş larva doku kesitleri içeren slaytları çıkarın ve kuru buz üzerine koyun.
- Kuru buz tek bir slayt çıkarın ve hemen doğrudan yerleştirin% 70 etanol fiksatörü, Tablo 1'de sunulan tavsiye kez göre RNAse ücretsiz GKD 2 O durulayın kısa bir takip ile dolu bir 50 ml konik tüp içine.
- Frozen larva manikür varlığı, non-spesifik yakalama yol açabilir verimli LCM kap-hücre teması önleyerek yakalama verimliliğini bozabilir. Gerekirse, doku kesitlerinde manikür temizlemek için aşağıdaki adımları (4-5) yürütmek.
- Yavaşça üzerine doğrudan doku kesitlerinde% 2.5 tripsin 50 ul pipet ve oda sıcaklığında 5-30 saniye süreyle inkübe edin. [Kritik Adım: Bu adım optimizasyonu gerekebilir. Inkübasyon süresi, microdissected doku ve kesit kalınlığı bağlıdır. Kısa bir inkübasyon manikür kaldırmak için yeterli olmayabilir ancak uzun inkübasyon, ilgi hücreleri de dahil olmak üzere her şeyi temizleyebilirsiniz.]
- Tripsin kaldırmak ve gevşek yapıştırılır manikür parçaları RNAse ücretsiz GKD 2 O içeren 50 ml konik boru bölümleri kısaca durulayın.
- Dehidratasyon işlemini tamamlamak için kalan etanol ve önerilen zamanlarda (Tablo 1) için ksilen çözümler her slaytlar sırayla batırın.
- Dehidratasyon degrade ardından, slaytlar kısaca LCM gerçekleştirmeden önce oda sıcaklığında 60-120 saniye süreyle hafif bir hava akımı altında kurutulur. [Dikkat: ksilen doku kesitlerinde LCM gerçekleştirmeden önce tamamen kurutun. Ksilen mikrodiseksiyon başarısızlıkla sonuçlanan LCM kap polimer] çözmek için bilinir.
| % 70 Etanol (Sabitleme) | 3-10 saniye |
| GKD 2 O | 5-10 saniye |
| % 2.5 tripsin Kuluçka | 5-30 Saniye |
| GKD 2 O | 5-10 saniye |
| % 70 Etanol | 60 Saniye |
| % 95 Etanol | 60 Saniye |
| % 100 Etanol | 120 saniye |
| % 100 Etanol | 120 saniye |
| 100% Ksilen | 120 saniye |
| 100% Ksilen | 120 saniye |
| Hava kuru hafif bir hava akımı | 60-120 Saniye |
Tablo 1: dondurulmuş larva doku kesitlerinde LCM dehidratasyon için önerilen prosedürü.
3. Lazer Yakalama Mikrodisseksiyon
EGFP için optimize Fluor 300 Epifloresans optik ile donatılmış PixCell IIe LCM enstrüman LCM gerçekleştirmek için kullanılmıştır.
[Kritik Adım: Eğer mümkünse, mikrodiseksiyon verimliliği artmış nem oranı nedeniyle herhangi bir azalmayı önlemek için nem kontrollü bir oda mikrodiseksiyon gerçekleştirin. Oda nem mikrodiseksiyon verimliliği etkileyen kritik bir faktör. Düşük oda nemi neden olabilir artış, düşük mikrodiseksiyon verimlilik, yüksek oda nem neden olurken, non-spesifik yakalama statik sarılmak. Biz% 25-50 bağıl nem koşulları arasında optimum LCM verimliliği elde etti.]
- Mikroskop ve lazer kontrol kutusu için güç açın.
- LCM kapakları iki kartuşları tek seferde yüklü olabilir: HS LCM kapaklar (Moleküler Cihazlar) CapSure kap tutucu yükleyin.
- Moleküler Aygıtlar yazılımını açın, slayt numarası ve kap lot numarası da dahil olmak üzere deneme ayrıntıları girin.
- Ilgili kapak yakalama alanında uygun pozisyonu sağlamak için yeni bir HS LCM kap PixCell IIe LCM enstrüman ve joystick ile ilgili doğru konumu üzerine kartuş yükleyin.
- Mikrodiseksiyon için mikroskop aşamasında taze kurutulmuş larva doku bölümleri içeren mikroskop lamı yerleştirin.
- Konsantriklik veya bilgisayar ekranı kullanarak floresan işaretli hücrelerin bulun. : UAS-mCD8 PPK-GAL4, yüksek özgüllüğü nedeniyle GFP transgenik muhabir hattı, sınıf IV da nöronların GFP floresan tarafından kolayca tanımlanabilir.
- Konu CapSure HS LCM kapaklar kullanarak LCM doku [LCM, cihaz lazer odaklama ve sahne için ayrıntılı bir dizi talimatlar için referans 22].
- "Güç" ve "Süre" lazer darbe parametreleri boyutunu seçilen lazer spot büyüklüğü karşılık gelen kesin bir erimiş polimer nokta, elde etmek için ayarlayın. Erimiş polimer alanının boyutunu özelleştirmek için ayarları yapın. Aşağıdaki parametreler, tek bir sınıf IV da nöronların microdissecting için kullanılır: Spot Çapı 7.5 mikron, lazer gücü 30-50 mW, lazer süresi ve 2-4 ms ve 1-2hücre başına hots kullanılmıştır. [Kritik Adım: doku kalınlığı ve oda nem koşulları ile uygun bir nokta için gerekli olan lazer parametreleri değişebilir. Tek veya birden fazla hücre microdissecting için gerekli erimiş polimer spot büyüklüğü elde etmek için "Güç" ve "Süre" ayarları ayarlayın.]
- Özgüllüğü en üst düzeye çıkarmak için en az örtüşme ve güçlü bir floresan ile hücreler microdissect. Her kap sayısız hücre gövdeleri yakalama yeteneğine sahiptir. [Kritik Adım: RNA bozulmasını önlemek için, en az 45 dakika dehidrasyon ve mikrodiseksiyon dahil toplam analiz zaman sınırı ]
- Microdissected hücreleri ile ilgi tüm hücreleri bir kez yakalanan HS LCM kapağı kaldırın ve temiz bir slayt yakalanan hücrelerinin varlığını doğrulamak ve görsel istenmeyen hücreleri veya enkaz varlığı için kap incelemek için üzerine yerleştirdi.
4. LCM elde edilen hücrelerin RNA izolasyonu
- ExtracSure (Moleküler Cihazlar) cihazı microdissected hücreler içeren kap takın. Hücreleri içeren kap yüzeye RNA ekstraksiyon tamponu (PicoPure, Moleküler Cihazlar) 12μl ekle ve ExtracSure cihaza (GeneAmp Applied Biosystems), ince duvarlı bir ters tepki tüp bağlamak. Hizalama tepsisi (Moleküler Cihazlar) montaj yerleştirin ve bir inkübasyon bloğu (Moleküler Cihazlar) ile 42 ° C inkübatör içinde önceden ısıtılmış ile örtün.
- 30 dakikalık bir inkübasyon sonrasında, 2 dakika süreyle (x) g 800 özleri içeren tüpler santrifüj. Tüpleri kapatın ve -80 hücre özleri saklamak ° C RNA saflaştırılması için hazır olana kadar.
PAUSE NOKTASI
- Özü ve sütun PicoPure (Moleküler Cihazlar) RNA ekstraksiyon kiti talimatlarına göre RNA arındırmak. DNAz tedavi isteğe bağlıdır, ve gerektiği gibi RNA saflaştırılması sırasında sütun üzerinde yapılabilir. Gerekirse, son RNA verimi artırmak için tek bir sütun arıtma sırasında birden fazla LCM örnekleri bir araya toplanmış ve elüsyon tampon küçük hacimli (11-30 ul) (PicoPure, Moleküler Cihazlar) yıkandı, olabilir ve -80 saklanan ° C kadar hazır. İsterseniz 1 ul kısım bir Bioanalyzer 2100 (Agilent Technologies, Inc.) Total RNA kalitesini değerlendirmek için kullanılan olabilir.
Temsilcisi Sonuçlar
Lazer yakalama mikrodiseksiyon (LCM), üçüncü instar larvaları (Şekil 1), sınıf tek özel veya birden fazla Drosophila da nöronların izole etmek için kullanılır oldu . LCM Drosophila da nöron hücre gövdeleri (Şekil 2a-c) izolasyonu yüksek derecede hassasiyet ve özgüllük sağlar. Ayrıca, bu da izole nöronların arınmış toplam RNA Agilent 2100 Bioanalyzer (Agilent Technologies, Inc.) (Şekil analiz edildiğinde keskin 5.8S, 18S ve 28S ribozomal RNA doruklarına varlığını gösterdiği gibi mükemmel kalitede olduğu tespit edilmiştir 2d).
Izole hücrelerinin nöronal özel zenginleştirme değerlendirmek için nöronal gen-spesifik marker, elav kullanarak gerçek zamanlı kantitatif ters transkripsiyon PCR (QRT PCR) uyguladık. Mah-PCR analizleri için, biz da nöronların endojen kontrol (rp49) ve 23 ΔΔCt yöntemi kullanarak bütün larva izole edilen total RNA göre normalize bu ifadeyi microdissected LCM elav ifade göreli seviyeleri hesaplandı. Bu analizler LCM elav göreli seviyeleri 2.5 kat zenginleşme üzerine ortaya mikro-disseke bütün hayvanlar (Şekil 3) ile karşılaştırıldığında da nöron örnekleri.
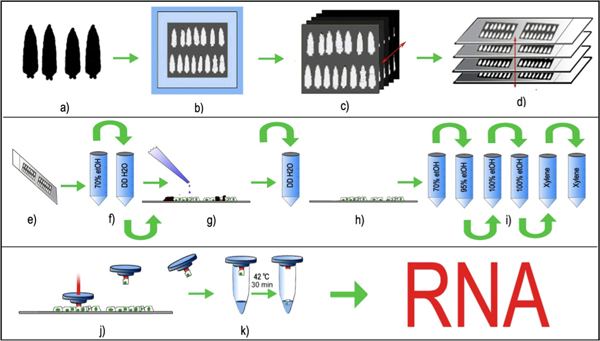
Şekil 1: Drosophila periferik nöronların LCM. (A) Yaş uyumlu üçüncü instar larvaları seçilen yıkanır ve (b), OCT ile bir cryomold gömülü ve -80 dondurulmuş ° C, (c) 8μm seri doku kesitlerinde bir standart Kriyostat kullanılarak oluşturulur ve (d) düzgün yerleştirilmiş . temiz cam slaytlar. Yapıştırılmış doku bölümleri ile cam slayt -80 saklanan ° C önceden LCM işleme (e, f)% 70 etanol içinde hemen LCM önceki doku bölümleri çözülmüş ve kısaca sabit GKD 2 O. kısa durulama tarafından takip (g) slayt kısaca ksilen tripsin ile inkübe ve larva bölümleri (h, i) doku bölümleri larva manikür olmadan tırnak etlerini (siyah) kaldırmak için, GKD 2 O ile durulanmalıdır, sonra bir etanol degrade daha susuz ve nihayet temizlendi. bir termolabil polimer ile (j) LCM kap doku bölümüne yerleştirilir ve lazer seçilen floresan hücre gövdesi darbeli. Lazer darbe polimer erir ve seçilmiş hücre gövdesi engulfs. Yakalanan hücre gövdesi ile birlikte polimer kapağını kaldırdı ve (k) RNA ekstraksiyon tamponu hücreye eklenir. RNA ekstraksiyon tamponu ile birlikte yakalanan hücre, 42 ° C'de 30 dakika inkübe edilir ve ya -80 saklanabilir ° C veya doğrudan RNA saflaştırılması için işlenmiş.
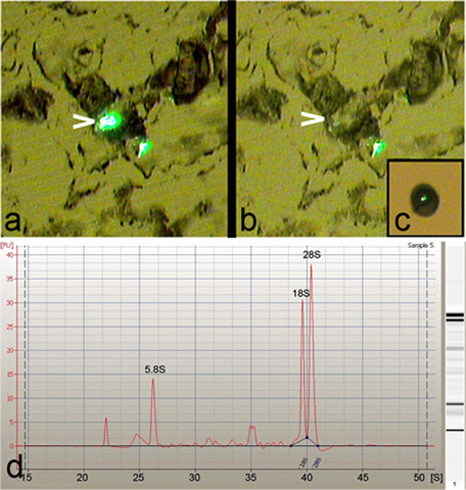
Şekil 2: LCM da nöronların yüksek hassasiyetli yakalama kolaylaştırır. GFP muhabiri suşu: (a), PPK-GAL4 GFP ile etiketli iki sınıf-IV da nöronlar, UASmCD8 gösteren bir kurutulmuş ve tripsin Temsilcisi görüntü, performans LCM önce 8 mikron doku bölümünde tedavi . Not nöronlar birini yakalamak için (ok ucu) vurgulanır (b) vurgulanan nöron (ok ucu) Hücre gövdesi temiz doku bölümünde yüksek özgüllük ile mikro-disseke. Tek bir sınıf (c) Son bakış -IV da nöron LCM kap ele geçirdi. keskin 5.8S, 18S varlığı ile belirtildiği gibi mükemmel RNA kalitesini gösteren LCM-türetilen da nöronların izole edilen total RNA, (d) Agilent 2100 Bioanalyzer (Agilent Technologies, Inc.) Elektroferogram ve 28S rRNA doruklarına.
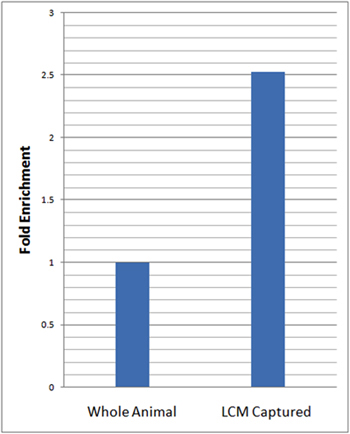
Şekil 3: QRT-PCR da nöronlar tüm hayvan göre yakalanan LCM nöronal belirteç gen ekspresyonu önemli zenginleştirme ortaya LCM nöron spesifik belirteç gen ekspresyonu (elav) Mah-PCR analizleri da nöronların (21-7-GAL4, yakalanan UAS-mCD8: GFP) ve bütün hayvanların yaş uyumlu üçüncü instar larvaları, üç nüsha olarak yapıldı . Bağıl LCM yakalanır da nöronların elav ifade seviyeleri endojen kontrol (rp49) ve 23 ΔΔCt yöntemi kullanarak tüm larvalara göre normalize edildi. LCM elav, göreli seviyeleri 2.5 kat zenginleştirme da nöron örnekleri bütün hayvanlar göre gözlendi ele geçirdi.
Sorun Giderme
Sorun: bozulmuş, düşük kaliteli veya RNA.
Deney boyunca RNAse durumu olun. 30 dakika, slayt başına LCM harcanan zaman miktarını azaltmayı deneyin. LCM performans durumlar dışında kuru buz üzerinde slayt ve örnekler tutun. Kesilir sonra doku kesitlerinde çözülme kaçının.
Sorun: Birçok hücre, tripsin tedavisi (17-18 adım) sırasında slayt kaybolur.
Tripsin tedavi süresi azaltmayı deneyin. Tripsin konsantrasyonu azaltmayı deneyin.
Sorun: kap polimer manikür ve diğer non-spesifik doku enkaz varlığı.
Bir yapışkan not 22 yapışkan tarafı polimer yüzey blot doku enkaz kaldırmayı deneyin.
Sorun: Düşük LCM verimliliği.
% 100 etanol ve xylene inkübasyon süresi artırmayı deneyin. Oda nem nem gidericiler kullanarak azaltın.
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Burada sunulan protokol LCM üzerinden Drosophila periferik nöronların izolasyonu için optimize edilmiş bir yöntem açıklanır . Bu LCM protokol gelişme üçüncü instar larva aşamasında tek, özel sınıf ya da birden fazla Drosophila da nöron spesifik izolasyonu için tasarlanmış iken, protokol küçük değişiklikler, kolaylıkla bütün gelişimsel diğer Drosophila hücre tipleri yakalamak için adapte olabilir aşamalarında, farklı GAL4 kullanarak, hücr...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Teşekkürler
Biz Dr teşekkür ederim. LCM yardım için bu çalışmada kullanılan sinek hisse senetleri, ve Virginia Espina, Dr. Emanuel Petricoin ve Dr Lance Liotta sağlamak için Yuh-Nung Jan ve Wes Grueber. Yazarlar bu araştırma desteği (DNC) ve George Mason Üniversitesi Provost Ofisi (EPRI) Thomas F. ve Kate Miller Jeffress Memorial Trust kabul etmiş sayılırsınız.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
Ekipman:
- Kriyostat
- 50 ml konik tüp slayt fiksasyon, durulama, tripsin tedavi ve etanol / ksilen dehidratasyon
- -80 ° C derin dondurucu
- Kuvöz
- PixCell IIe LCM Enstrüman Fluor 300 Epifloresans optik EGFP (Moleküler Cihazları-Moleküler Cihazlar) için optimize edilmiş
Referanslar
- Corty, M. M., Matthews, B. J., Grueber, W. B. Molecules and mechanisms of dendrite development in Drosophila. Development. 136, 1049-1061 (2009).
- Parrish, J. Z., Emoto, K., Kim,, Jan, Y. N. Mechanisms that regulate establishment, maintenance, and remodeling of dendritic fields. Annu. Rev. Neurosci. 30, 399-423 (2007).
- Wang, X., Starz-Gaiano, M., Bridges, T., Montell, D. Purification of specific cell populations from Drosophila tissues by magnetic bead sorting, for use in gene expression profiling. Nature Protocols. , (2008).
- Iyer, E. P. R., Iyer, S. C., Sulkowski, M. J., Cox, D. N. Isolation and purification of Drosophila peripheral neurons by magnetic bead sorting. J Vis Exp. 34, 2912-2917 (2004).
- Tirouvanziam, R., Davidson, C. J., Lipsick, J. S., Herzenberg, L. A., Tirouvanziam, R., Tirouvanziam, R. Fluorescence-activated cell sorting (FACS) of Drosophila hemocytes reveals important functional similarities to mammalian leukocytes. Proc. Natl. Acad. Sci. 101, 2912-2917 (2004).
- Shigenobu, S., Arita, K., Kitadate, Y., Noda, C., Kobayashi, S. Isolation of germline cells from Drosophila embryos by flow cytometry. Dev. Growth Differ. 48, 49-57 (2006).
- Reeves, N., Posakony, J. W. Genetic programs activated by proneural proteins in the developing Drosophila PNS. Dev. Cell. 8, 413-425 (2005).
- Jinushi-Nakao, S. Knot/Collier and Cut control different aspects of dendrite cytoskeleton and synergize to define final arbor shape. Neuron. 56, 963-978 (2007).
- Yang, Z., Edenberg, H. J., Davis, R. L. Isolation of mRNA from specific tissues of Drosophila by mRNA tagging. Nucl. Acids Res. 33, (2005).
- Appay, V. Sensitive Gene Expression Profiling of Human T Cell Subsets Reveals Parallel Post-Thymic Differentiation for CD4+ and CD8+ Lineages. J. Immunol. 179, 7406-7414 (2007).
- Ginzinger, D. G. Gene quantification using real-time quantitative PCR: An emerging technology hits the mainstream. Exp. Hematol. 30, 503-512 (2002).
- Keays, K. M., Owens, G. P., Ritchie, A. M., Gilden, D. H., Burgoon, M. P. Laser capture microdissection and single-cell RT-PCR without RNA purification. J. Immunol. Methods. 302, 90-98 (2005).
- Volgin, D. V., Swan, J., Kubin, L. Single-cell RT-PCR gene expression profiling of acutely dissociated and immunocytochemically identified central neurons. J. Neurosci. Methods. 136, 229-236 (2004).
- Emmert-Buck, M. R. Laser capture microdissection. Science. 274, 998-1001 (1996).
- Xiao, W. Gene expression profiling in embryonic mouse lenses. Mol. Vis. 12, 1692-1698 (2006).
- Scharschmidt, T. Analysis of human osteoarthritic connective tissue by laser capture microdissection and QRT-PCR. Connect. Tissue Res. 48, 316-323 (2007).
- Spletter, M. L. regulates Drosophila olfactory projection neuron identity and targeting specificity. Neural Dev. 2, 14-14 (2007).
- Hoopfer, E. D., Penton, A., Watts, R. J., Luo, L. Genomic analysis of Drosophila neuronal remodeling: a role for the RNA-binding protein Boule as a negative regulator of axon pruning. J. Neurosci. 28, 6092-6103 (2008).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker for studies of gene function in neuronal morphogenesis. Neuron. 22, 451-461 (1999).
- Grueber, W. B. Projections of Drosophila multidendritic neurons in the central nervous system: links with peripheral dendrite morphology. Development. 134, 55-64 (2007).
- Song, W., Onishi, M., Jan, L. Y., Jan, Y. N. Peripheral multidendritic sensory neurons are necessary for rhythmic locomotion behavior in Drosophila larvae. Proc. Natl. Acad. Sci. USA. 104, 5199-5204 (2007).
- Espina, V. Laser capture microdissection. Nat. Prot. 1, 586-603 (2006).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method. Methods. 25, 402-408 (2001).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır