Method Article
Yetişkin ve Embriyonik İskelet, Kas Microexplant Kültür ve İskelet Kası Kök Hücre İzolasyonu
Bu Makalede
Özet
Mikro-disseke eksplantlar tekniği, iskelet kas kök hücre kaynağı olarak çocuk, yetişkin ya da embriyonik kasları proliferatif iskelet kas hücreleri izole için sağlam ve güvenilir bir yöntemdir. Benzersiz, bu hücrelerin klonal in vivo nakli için kullanılan iskelet kas kök hücre hatları üretmek için türetilmiştir.
Özet
Kültüre embriyonik ve yetişkin iskelet kas hücreleri farklı kullanan bir dizi var. Bu bölümde açıklanan mikro-disseke eksplantlar tekniği, göreceli olarak çok sayıda iskelet kas kök hücre kaynağı olarak çocuk, erişkin veya embriyonik kas iskelet kas hücrelerinin proliferatif izole sağlam ve güvenilir bir yöntemdir. Yazarlar yabani tip ve distrofik kas iskelet kas hücrelerinin büyüme özelliklerini analiz mikro-disseke eksplant kültürleri var. Doku büyümesini bileşenleri her biri, hayatta kalma, yani hücre çoğalması, yaşlanması ve farklılaşması ayrı ayrı burada açıklanan yöntemleri kullanarak analiz edilebilir. Büyüme tüm bileşenleri net etkisi eksplant akıbet oranlarını ölçmek yoluyla kurulabilir. , Burada açıklandığı gibi, embriyonik iskelet kası öncüleri izolasyonu sağlamak için yazarlar tarafından adapte edilmiştir, geniş bir yelpazede farklı kas tipleri ve yaşları birincil kültürleri kurmak ve mikro-eksplant yöntem kullanılabilir.
Benzersiz mikro-eksplant kültürleri elde etmek için kullanılan klonal (tek hücre kökenli) iskelet kas kök hücre (SMSC) genişletilmiş ve in vivo nakli için kullanılabilir hatları gibi fonksiyonel, doku-spesifik, uydu hücreler in vivo nakledilen SMSC davranırlar iskelet kas lifi rejenerasyon katkıda bulunan değil, aynı zamanda mikro-eksplant yöntemi kullanılarak kültürünün yeniden izole edilebilir farklılaşmamış kök hücreler (uydu hücre niş) küçük bir havuz olarak korunur.
Protokol
Proliferatif iskelet kas hücreleri izole etmek için iki yaklaşım istihdam edilebilirler. Ilk kas dokuları enzimatik 1 çıkış kaplama öncesi tek hücreleri izole etmek için sindirilir. İkinci yöntem, hücreleri, inkübasyon 2, 3 sırasında büyümeye izin kas doku kültürü haline adet eksplant. İkinci yöntem, bu protokolde açıklanmıştır. Doku kültürü kendisi eksplant kültür kökleri vardır. 2007 yılı lenf 4 damla asılı sinir eksplantlar kuluçka nöron çıkıntılar aldığı Harrison klasik deneyler 100. yıldönümü idi. Eksplant kültür teknikleri, yetişkin ve embriyonik hücreler 4, 5 proliferatif birincil kültür üreten bir araç olarak takip eden 100 yıl içinde farklı bağlamlarda çeşitli ve rafine edilmiş . Eksplant tekniği arkasındaki prensip, ancak aynı kalır; zengin bir besin medya ile outgrowing hücreleri sağlarken, en önemli hücre akıbet erken aşamalarında ana dokusunun üç boyutlu yapısını koruyarak birincil hücre izolasyonu travma en aza indirmek için prolifere olan. Iskelet kas kas lifi travma, uydu hücre aktivasyonu, göç ve çoğalması 3, 6 için normal tetik kas dokusu kesme eylemi taklit eder, çünkü eksplant kültürü kullanarak ek bir avantajı var. Yetişkin iskelet kası uydu hücreleri (matür olarak adlandırılır), kas lifi onarım ve büyüme 7 sorumlu proliferatif kök hücre popülasyonu .
In vivo ortamda yenileyici kas iskelet kası eksplantlar böylece taklit ve kök hücre göçü ve bölünme teşvik. Somitomeres ve brankiyal kemerler baş 8, 9 kas doğuran rağmen embriyo, omurgalı iskelet kas çoğunluğu (gövde ve bacak kasları), Somitlerin türemiştir. Myotome iki ayrı grup olarak tespit edilebilir Myf-5, sırasıyla ifade farklılaşan hücre gruplarının dorsal medial ve lateral kenarlarında bulunan kök hücreler. Sırasıyla, bu hücreler in situ ayırt sırt, epaxial kasların, kas kök hücreleri hücre gruplarının 10 göç gerektiren ventral ve lateral hypaxial kas (bacaklarda, karın ve solunum kaslarının). Embriyonik kas kök hücre göçü 3 11 kişilik kontrol altında. Myf-5 ekspresyonu embriyonik kas kurulması ve bu önemin, doğum sonrası kaslar için devam esastır aktif uydu hücrelerinin% 98 ekspres Myf-5 12 . Myf-5, bu nedenle, hem yetişkin ve embriyonik dokularda prolifere iskelet kas kök hücre popülasyonu güvenilir ve spesifik bir işaretleyici. Embriyonik kas kök hücreleri (kas hücresi de denir atalarıdır, iskelet kas öncüleri, matür hatta embriyonik uydu hücreleri), erken evre fare, civciv ve kurbağa embriyoları 13 Somitlerin izole edilebilir . Embriyonik dokular için microdissected eksplant tekniği büyük embriyolar yazarlar embriyonik iskelet kaslarının miyojenik kültürler izole etmek için adapte var. Benzer bir yaklaşım Cossu ve arkadaşları tarafından kullanılan 14 embriyonik hücre gruplarının 14 klonal hücre popülasyonlarının oluşturmak için.
1. İskelet Kası Kök Hücreler in vitro Hücre Kültürü (SMSC)
SMSC klonal primer iskelet kası eksplant kültürler elde edilmiştir tek hücre kökenli hücre hatları. Onlar ise yeterli özen standart doku kültürü yöntemi ile yetiştirilebilir. Not, aksi belirtilmedikçe, açıklanan tüm manipülasyonlar laminer akış kapağı (Class 1 veya Class 2 steril kabin) ve tüm kültür reaktifler kullanarak aseptik koşullarda gerçekleştirilen, 37 ° C su banyosunda kullanmadan önce ısındı.
- Sıvı azot depolama (yöntem aşağı dondurmak için Bölüm 1.2 'ye bakınız) SMSC getirmek için cryovials hızla çözülmüş ve içeriği 5 ml prewarmed aktarılır olmalıdır (37 ° C) hemen santrifüj DF10 kültür ortamı (3 dk için 1.000 g) DMSO kaldırmak için . Hücreleri çözünmesi en iyi yöntem, santrifüj tüpüne aktarmadan önce şişenin içine az miktarda, önceden ısıtılmış kültür orta tekrar pipetleme yoluyla. Kriyoprezerve hücreleri, oda sıcaklığında (LD50 yaklaşık 2 dakika) hücreleri için toksik olan% 10 DMSO içerdikleri hücrelerinin çözülme süreci çok hızlı bir şekilde yapılmalıdır.
- 5 ml DF10 yeniden askıya hücre pelletini takiben santrifüj süpernatantı kaldırılır ve hücrelerin yıkanır, sonra eskisi gibi santrifüj.
- Pelet sonra ikinci kez 5 DF10 mL ve elde edilen hücre süspansiyonu ile karıştırılır hücre küçük bir 25 cm 2 adet plastik kültür ve aktarılırssel.
- Kültürler 37 korunur ° C nemlendirilmiş bir inkübatör hava% 5 CO 2 içeren. Gemiler filtrelenmiş bir kap ile kullanıldığı sürece, şişenin kapağını biraz kültür gemi hava inkübatör ile dengelenmesi ve kültür orta asitlenir izin birkaç saat için gevşetilmiş olmalıdır. ortamın pH kültür ortamı içine fenol kırmızısı bir boya pH indikatörü içeren yoluyla izlenir.
- Çözülmüş hücreleri (Notlar 1 ve 2) hücre enkaz ve kalan toksinler kaldırma sağlamak için her zaman taze DF10 orta kaplama ve yeniden beslenir sonra 24 saat takip edilmelidir.
1.1. Alt kültür
Kurulu SMSC hatları için, hücrelerin yaklaşık% 95 izdiham ulaştığınızda, onlar, kendi kültür gemi kaldırılır seyreltilir ve daha fazla büyümesini sağlamak için taze bir damar içine yerleştirilmiş olmalıdır. Bu altkültür prosedürü, tripsin / EDTA en sık (bkz. Not 3) kullanılmakta olan bir dizi farklı enzimatik prosedürler yoluyla elde edilebilir. Bu, onları büyüme üçüncü gününde pasajlandı gerektirir yoğunlukları hücreleri büyümek için her zamanki (ve iyi) bir uygulamadır. Çoğu SMS hücre hatları için bu her altkültürü bölme hücrelerin 1 / 10 ile elde edilebilir. Bu hücrelerin dikkatli izlenmesine olanak sağlar ve böyle bir dönüşüm ya da kültür koşullarına uyum nedeniyle apoptozis azalması gibi hücre hattı fenotipik değişikliklere işaret olağandışı büyüme davranış (örneğin daha hızlı büyüme) hemen tanımlamak için doku kültürü performans sağlar. Buna ek olarak, tutarlı ve dikkatli bir alt kültüre rutin büyük ölçüde bu tür olayların sıklığını azaltmaktadır.
- Tripsin (trypsinisation) kullanarak altkültür gemiler kuvöz ve aspirasyon tarafından atılan orta kaldırılır.
- Hücreler daha sonra steril ile iki kere yıkanır, kalsiyum ve magnezyum içermeyen salin (PBS), yıkama başına 10 ml, aspirasyon her zaman kaldırılır fosfat tamponlu.
- Hücre tek tabaka (25 mm 2 şişesi) 1 ml hücreleri (Not 4) ayırmak alıncaya kadar 1 tripsin / EDTA eklenir ve oda sıcaklığında 2 3 dk hücreleri üzerinde bırakılır. Ayırmak Bu balonun (Not 5) ışık tutulur biraz daha opak bir tek tabaka oluşturan küçük delikler gibi deneyimli bir kullanıcı tarafından görülebilir. Hücreleri tek bir hücre süspansiyonu sağlamak için yeterli bir süre trypsinised olması gerekirken, bu hücre ölümü ve hücrelerin yeniden kaplama kötü eklenti yüksek düzeyde neden olacağından, bakım trypsinisation için SMSC pozlama dikkat edilmelidir.
- Tripsin reaksiyon, serum içeren orta (DF10) durdurmak için en az 2 hacmi (yani tripsin çözüm iki kat daha fazla hacim) eklenir. 25 mm 2 şişeyi alt kültüre bu aşamada 9 ml DF10 eklemek için uygundur. Hücre bölünme sonra 1 / 10 daha fazla 9 ml taze DF10 orta 1 mL çıkan hücre süspansiyonu ile birlikte yeni bir 25 mm 2 kültür şişelerinde seyreltilmesi ile kolayca yapılabilir. Kriyoprezerve hücre genişleme (daha büyük bir gemiye transfer), geri kalan hücreler (bkz. (bkz. Bölüm 1.2) veya çoğalması ve hayatta kalma deneyleri, farklılaşma, büyüme faktörü tedavisi veya diğer amaçlar için deneysel yemekler, kuyu ya da plakaları sayılır ve kaplama olabilir altında).
1.2. Hücre Hatları ve İlköğretim Kültürler, Kriyoprezervasyon
- Kriyoprezervasyon hücreleri altkültürün tek tabaka (Bölüm 3.1.1) ayrı ve santrifüj (1.000 g az 3 dakika) pelet.
- Süpernatant aspirasyon tarafından kaldırılır ve hücrelerin dikkatli ve hızlı bir şekilde santrifüj yeniden-pelet önce 10 ml (DF10 içinde% 10 DMSO) karışımı aşağı dondurma yeniden askıya.
- Bu sefer pelet (bkz. Tablo 1) cryovial başına 0.5 ml hücre süspansiyonu izin yeterli dondurma karışımı aşağı yeniden askıya alındı ve hemen 80 ° C gecede yerleştirilir.
- Cryovials uzun süreli depolama için (bkz. Dipnot 6) Ertesi gün sıvı azot aktarılır . Hücre çözülme, Dondurmanın bu sürecin süratle yürütülmektedir olmalıdır. DMSO dondurma sırasında hücre zarları için koruyucu iken, non-dondurucu soğuklar hücreler için çok toksik.
1.3. Hücre Numaraları Belirlenmesi
- Neubauer haemocytometer, tek bir hücre süspansiyonu (aşağıdaki altkültürü) hücre konsantrasyonunu belirlemek için kullanılabilir. Lamel sayma doğruluğunu sağlamak için güvenli (Not 7) haemocytometer taban üzerine monte edilmelidir.
- Hücre süspansiyonu daha sonra küçük bir damla lamel kenarına yakın yerleştirilir ve kılcal eylem tarafından alınacaktır.
- Hücreler daha sonra, faz-kontrast aydınlatma ters bir mikroskop kullanarak sayılır. Son hücre konsantrasyonu, c doğruluğunu artırmak içinorijinal hücre süspansiyonu seyreltilir ve hücrelerin yeniden sayılır yoksa sayma odasında arşın, üst üste olmamalıdır. Topaklanma trypsinisation sırasında hücre kapsamlı ayrılma kaçınılmalıdır ve bilinen bir yüzey alana 100-200 hücre hücre sayısı doğru bir tahmin elde etmek için sayılmalıdır. Neubauer haemocytometer kullanarak uygun yöntem setleri 16 kare 2 veya daha fazla hücre saymak. Hücre yoğunluğu mililitrede sayılır setleri numarası (örneğin 2) toplam bölünmesi ve 10 4 ile çarpılarak elde edilir. Örneğin, 100 hücre 2 x 16 kare setleri = 100 / 2 = 5 x 10 5 hücre / ml üzerinde sayılır.
2. Birincil İskelet Kası Microexplant Kültürler oluşturulması
İlköğretim mikro-eksplant kültür, bireysel kasları ön ve arka bacaklarda, diyafram, sırt ve karın kasları dahil olmak üzere herhangi bir erişilebilir iskelet kası SMSC izole etmek için kullanılabilir. Juvenil ve erişkin kas microexplant kültürler kaynaklanan yöntemi, Smith ve Schofield 3 ayrıntılı olarak açıklanan ve sonradan juvenil, yetişkin ve yaşlı fare kasları SMS hücreleri elde etmek için yaygın olarak kullanılan olmuştur . Bu yöntem aynı zamanda, 24 balık ve insan iskelet kası (Rao ve Smith, yayınlanmamış) kültürlü iskelet kas hücreleri elde etmek için kullanılabilir . Bir fare kas microexplant SMSC sonucudur Şekil 1a, b gösterilmiştir. Bu yöntem, embriyonik kas habercisi hücreleri (bkz. Bölüm 3) izolasyonu için modifiye edilmiştir . Temel yöntem aşağıdaki gibi:
- Aseptik taze itlaf fare (ler) hedef kas diseksiyonu steril aletler, temiz bir çalışma alanı ve% 70 etanol sprey liberal kullanımı ile elde edilir.
- İzole kasları DF20 orta iki değişiklik ile yıkanır ve 60 mm 2 tabak taze DF20 orta yerleştirilir. Stereo diseksiyon mikroskobu kasları kullanmak, yağ, bağ doku ve kemik dışlamak için dikkatli bir şekilde steril koşullar altında microdissected.
- Temizlenmiş kas adet 400 mikron 3 küp kuyumcu s forseps kullanarak, 96-plaka 50 mcL DF20 (Not 8) içeren bir merkezi haline ayrı ayrı 60 kuyu yerleştirilir, sonra kesilir . Wells mikroskop altında kontrol ve inkübatöre yerleştirilir. Dış kuyu eksplantlar (3) içeren kuyuların kurumayı önlemek için tuzlu su ile doldurulur.
- Microexplant eki ve akıbet 24-48 saat inkübasyondan sonra ve daha sonra 48-72 saat aralıklarla (kültürlü olan kasların büyüme oranına bağlı olarak) attı.
- SMS hücrelerinin genişlemesi ve izolasyon için, akıbet kültürler ağırlıklı olarak SMSC morfolojisi, yani küresel mononucleate hücreleri (bkz. Şekil 3.1b) bir araya kümeleri yetişen yüksek kırıcılığı ile hücreler için ayrı ayrı izlenebilir .
- Orta artan hücre yoğunluğu nedeniyle acidifies eksplant akıbet bir kez bireysel kuyular 50 mcL aralıklarla orta (Not 9) ilavesi ile beslenen kurulmuştur. Iyi ve neredeyse konfluent kültür hücre olduğunda, kuyular hücreleri tarafından salgılanan "conditioning" faktörler (Bölüm 2.1 klonlama altında klimalı ortamda yorumlara bakınız) bakım sağlamak için% 50, orta her zaman değiştirilmesi beslenir. Farklılaşma bastırmak için,% 60-70 izdiham birincil eksplant çıkıntılar hücreleri 3 beslemek için kalsiyum tükenmiş DMEM/F12 (tüm takviyeleri aynı kalır) DF20 orta yerine kalsiyum tükenmiş ortama geçiş.
- Kültürlerden gelen bu aşamada klimalı ortamda hazırlanmış ve birincil SMSC (klonlama yöntemi için, bkz: Bölüm 2.1, Şekil 1c f) genişlemesi ve klonlama sırasında kullanılmak üzere depolanan Eksplant . Kültürler dispase yöntemi (bkz. Bölüm 3.5) kullanılarak pasajlandı.
- Klonal elde edilen SMSC intramüsküler enjeksiyon (Şekil 3.1 gk) 19 in vivo olarak analiz edilebilir.
- Karyotipleme (bkz. Bölüm 2.2, Şekil 3.1 l) 25. diploid durumunu onaylamak için klonal edilen SMSC hatları yapılabilir.
- Bu yöntem, kültür embriyonik kas (Bölüm 3) adapte edilebilir.
2.1. Klon türetilmesi
İlköğretim eksplant myoblast kültürleri (Şekil 1a, b), yabani tip ve mutant iskelet kaslarında farklı büyüme parametreleri çeşitli kurmak için doğru ve yararlı bir araçtır . Klon türev, tek bir hücreden bir hücre hattı izolasyon, iskelet kas kök hücrelerin izolasyonu önemli bir adımdır ve RNAi yapıları veya transgenlerin ile transfekte subclone SMSC hatları için de kullanılabilir. Kurulan SMSC ve birincil eksplant kültürleri oldukça yoğunluk bağımlı olan ve "Crash "(çanak ayırmak ve ölmek), çok düşük bir hücre yoğunlukta kaplama. büyüme ve hücre yaşamını sürdürmek için gerekli SMSC sürüm çözünür faktörler, yüksek yoğunluklu bir kültür taklit ve sırasında bu faktörlerin kaynağı, çünkü bu klonlama işlemi, SMSC kendinden klimalı ortamda klonlanmış. klimalı ortamın yanı sıra tek tek hücreler izole bir ortamda çoğalırlar izin vermek için gerekli olduğu tespit edilmiştir.
- 33 ve% 75 izdiham arasında 48 saat süreyle kültür prolifere SMSC klimalı ortamda hazırlanmıştır.
- Bu hücrelerin yetiştirilen hangi medya 48 saat sonra çıkarılır ve 0.2 mikron şırınga filtresi süzülür; bu şartlandırılmış ortamda steril sağlar ve kalan tüm hücreleri ve enkaz kaldırır.
- Bu klimalı ortamda taze kültür ortamı ile 1:1 oranında (klonlama orta bkz. Not 10) karışık ve tek bir hücre klonlama için kültür ortamı olarak kullanılır.
- Tek hücre dilüsyonları hücreleri elde etmek için dikkatli trypsinisation (SMSC kurulan) veya dispase tedavi (primer eksplant kültürler) tek bir hücre süspansiyonu ayrışmış ve 100 mcL klonlama orta başına bir hücre bir konsantrasyon için seyreltilmiş.
- 50 mcL bu hücre süspansiyonu daha sonra her bir 96-plaka merkezinde 60 kuyu içine kaplama olabilir.
- Hücreler 37 inkübasyon tarafından takmak için izin verilir ° C, 6 saat ve her bir kuyu için% 5 CO 2 sonra dikkatle hücrelerinin varlığı için attı . 0 veya daha fazla bir hücre içeren Wells, bu aşamada indirimli.
- Wells, tek bir ekli hücre içeren dikkatli bir şekilde not edilir ve bu tek hücreden elde edilen koloni sadece tek bir hücreden elde edilen bir koloni, mevcut sağlamak için dikkatle izlenir (ilk birkaç gün boyunca günlük). Hücre hatları sadece 1 hücre içeren kuyulardan elde edilmiştir. Şekil 1c-e gibi tek bir hücre elde edilen koloni genişlemesi gösterilmektedir.
- Sonra, koloni, 96 plaka, 48 plaka iyi birine pasajlandı olabilir izdiham ulaşır.
- Yeterli hücre plakaya 25 cm 2 balona kadar ve 6-kuyucuğu - klonlanmış hücre hatları daha sonra 24 içine dikkatlice genişletilmiş olabilir .
- Bu kültürlerin iskelet kası kökenli Myf-5 ekspresyonu (Şekil 1f) veya MyoD ve Pax 7 gibi diğer iskelet kas-spesifik belirteçler ortaya konabilir.
- Bu aşamada hatları (bkz. Tablo 1) daha fazla genişleme önce dondurulur.
2.2. Karyotipleme
Karyotipleme hücre fenotipi izlenmesi önemli bir yöntemdir. Klonal türetme elde edilen hücre hatları kendi fenotipi etkileyebilir brüt kromozom düzenlenmeleri olmadan diploid kromozom korunur olmasını sağlamak için karyotyped olmalıdır.
- Karyotipleme hücreleri için kültür mitotik hücrelerin oranını en üst düzeye çıkarmak için 25 cm 2 kültür damarlarının geç üstel faz (80% konfluent) (2 gün sonra alt kültüre) yetiştirilmektedir.
- Yirmi dört saat hücreleri karyotipleme önce 10 ml taze kültür ortamı ile beslenir. , 10 mg / ml kolşisin (Not 11) 0,2 ml, daha sonra 37 1 saat daha inkübe hücreleri eklenir ° C.
- 1 saat sonra, hücreler kültür ortamı ve PBS yıkar hem de hasat mitotik hücrelerin sayısını en üst düzeye çıkarmak için korunur dışında standart trypsinisation altkültürü prosedüre tabidir.
- Ayrışmış hücreleri, orta ve PBS yıkar 3 pelet hücreleri dak ve supernatant kaldırılır ve çamaşır suyu içine atılır. 1.000 g eğri muhafaza
- Hücre pelletini sonra hücreler tekrar santrifüj yoluyla pelet önce, tam 4 dakika için 5 ml 0,0075 M potasyum klorür yeniden askıya alınır.
- Çoğu süpernatantı tüp yeniden askıya alınması için küçük bir miktar (~ 50-100 mcL) bırakarak, aspire edilir. Bir hücre bulamaç elde edilinceye kadar doğan tüp tabanına hafifçe vurarak hücreleri tekrar Aşağıdaki gibi: hücreler daha sonra taze yapılmış buz fiksatif (3:1 oranında buzul asetik asit metanol): buz üzerinde yerleştirilir ve sabit fiksatif 10 ml yavaş yavaş, küçük bir bardak Pasteur pipeti kullanarak hücrelerin damla damla eklenir ( Bu) hücre topaklanma önler.
- Hücreler hücre pelletini 0,5 mL taze fiksatif yeniden askıya sonra santrifüj pelet sonra 30 dakika buz üzerinde yerleştirilir ve.
- 45 ° açıyla düzenlenen hazırlanan slaytlar (bkz. Bölüm 3.2.2.1) üzerine sabit hücre süspansiyonu bırakarak Slaytlar üretilmektedir. Iyi aralıklı metafaz sağlamak için pipet slayt en az 30 cm yukarıda tutulmalıdır yayılır.
- Kromozom görselleştirmek için, slaytlar kullanımdan hemen önce üç cilt Gurr tampon pH 6,8 ile seyreltilmiş, Leishman Kullanıcı Leke 2 dakika süreyle lekeli.
- Slaytlar oda sıcaklığında kurutulmuş ve DePex montaj orta monte edilir.
2.2.1. Slaytlar Karyotipik için hazırlanması
- Cam slayt (Premium mikroskop slaytlar, VWR International, İngiltere), sülfürik asit (cam) büyük bir kapta gecede koyarak karyotipleme protokolü kullanmak için hazırlanmıştır.
- Slaytlar daha sonra 8 saat süreyle musluk suyu altında yer alır ve sonra% 70 etanol kadar gerekli saklanır.
- Kullanmadan önce, slaytlar, musluk suyu çalıştıran ve bir 30 dakika daha 1-2 saat oda sıcaklığında hava kurutulmuş altında durulanmalıdır
3. Embriyolar İlköğretim Mikro-eksplant Kültürler kurulması
Üç fare suşlarının mdx ve CAV3KO (İki distrofik mutantlar) ile birlikte bu yöntem, wild-tip (C57BL/10) doğrulamak için kullanılır. Distrofin eksikliği mdx fare C57BL/10 kendiliğinden kaynaklandığı, bu hat, 1991 yılında Bullfield laboratuar elde edildi ve o zamandan beri, bizim kendilenmiş koloni 26 sürekli devam etmiştir. Kaveolin-3 genindeki bir mutasyon içeren CAV3KO distrofik farelerin, bu çalışmada 27 kullanılmadan önce 10 nesiller için C57BL/10 arka plan üzerine yetiştirilmiş. Her fare hattı embriyonik aşamada her bir suş için özel ve farklı bir sağlam tekrarlanabilir bir akıbet, proliferasyon ve hayatta kalma profili oluşturulur. Aşağıdaki protokolleri Smith ve aslında Schofield Merrick 21 PN (1994) 3, embriyolar için adapte edilmiştir.
3.1. Embriyo Koleksiyon
- Elde etmek için embriyolar sahnelenen, çift doğal (1:1) çiftleşmelerin olarak ayarlanır ve kadınlarda vajinal fişleri için her sabah kontrol etti. Fiş algılama gününde, embriyolar E0.5 gün (12 saat post-fertilizasyon) olarak sayılır.
- Vajinal fişler tespit ettikten sonra, erkek embriyonik evreleme doğruluğunu sağlamak için kafes çıkarılır.
- Istenilen embriyonik aşamada (E17.5 için E11.5) servikal dislokasyon tarafından öldürülen annelerin ulaşıldığında, karın traş, deri ve çevresindeki alanları% 70 alkol ile temizlenmesi ve rahim karın yatay bir kesi yoluyla çıkarılır steril diseksiyon aletleri kullanılarak yapılır.
- Rahim sonra diseksiyon önce taze PECM içeren küçük bir çanak içine yerleştirilmiş önce birincil eksplant kültür vasatı (PECM) bir kez yıkanır.
- E11.5, E17.5 embriyolar rahim diseksiyon mikroskobu kullanılarak diseke ayrı ayrı ve detaylı mikrodiseksiyon hazır PECM içeren Petri kapları içine yerleştirilir.
3.2. Embriyo Mikrodisseksiyon
- Bireysel embriyolar daha zengin iskelet kas alanları (bkz. Şekil 2a) izole etmek için disseke edilir. Hind ve ön ayakları (hypaxial iskelet kasları) yanı sıra, üst ve alt vücut duvarı (ağırlıklı olarak epaxial iskelet kasları), diseke edilir. Toraks uzunluğu boyunca bir kesi yapmak için, karın ve pelvis embriyonun iç organlarını çıkarıp izin vermek için oluşturulur.
- , Embriyonik iskelet kası kök hücreler (eSMSc) zenginleştirmek için, kafa, omurilik ve iç organların daha sonra kaldırılır.
- Büyük embriyolar (E15.5-E17.5 embriyolar) kültürlerde kas hücrelerinin oranını artırmak için tekrar deri ve kıkırdak / kemik kaldırmak da mümkündür.
3.3. Embriyo Microexplant Kültürler Ayarlama
- Taze PECM yerleştirilir dışarı sonra ön ayaklar, arka ve alt ve üst beden duvarları disseke edilmiştir ve daha eşit büyüklükte doku (~ 0.5 mm 3, Şekil 2a) küçük küpler üretmek için microdissected.
- Bu microexplants sonra her iyi 50μL PECM içeren bir 96-plaka merkezinde 60 kuyu (bir eksplant başına) konur. , Yanı başına eksplant 1 içeren en az 60 kuyu kurulmuş, her embriyo okudu.
- Eksplant (Şekil 2b) elde edilmiştir nerede gösteren bölgeler, kültür embriyolar merkezi 60 kuyu ayrılabilir . Bu tasarım, sırasıyla içeren, her biri 15 kuyu, ön ayakları, üst vücut duvarı, hindlimb ve alt vücut duvar eksplantlar 21 sağlar.
3.4. İzleme akıbet
Sonucudur oranı, embriyonik iskelet kası eksplant büyüme oranı güvenilir bir ölçüsüdür ve burada açıklanan dikkatle kontrol edilen koşullar altında yüksek tekrarlanabilir.
- Eksplantlarındaki 37 inkübe ° C ve 3 hafta süreyle% 5 CO 2 ve ters bir mikroskop kullanılarak kültür, 3., 7., 14. ve 21. gününde attı . Eksplantlarındaki (Şekil 3a, e) her bir hücre izdiham seviyesine göre puanlanır.
- Kültürlerin Fotoğrafik görüntüleri, örneğin mikroskop ve 100 ASA Fuji (renkli) veya Kodak TMAX (siyah ve beyaz) profesyonel film (Şekil 3f) bağlı bir SLR fotoğraf makinesi kullanarak alınacak.
- Bir iskeletkas-özel Myf-5 için spesifik antikor Myf-5 pozitif suşu izole hücreler bu yöntemi kullanarak 80% 95 göre, eSMSc iskelet kas kökenli göstermek için kullanılabilir. MyoD ve Pax 7 gibi diğer göstergeleri de bu hücre popülasyonlarının iskelet kas kökenini göstermek için kullanılabilir. Bu hücreler, embriyonik iskelet kas iskelet kas kökenli veya hepsi kök hücreler olduğunu kabul edilmedi (özellikle genç embriyoların) kök hücrelerin çok yüksek oranda içeren iken. Saf kök hücre popülasyonlarının ayırmak için Bölüm 2.1 'de açıklandığı gibi klonal birincil eksplant kültürleri elde etmek için gereklidir.
3.5. Alt kültüre İlköğretim Embriyonik eksplantlar
SMSC (Şekil 3f) morfolojik özellikleri gösteren birleşmiş, sonra eksplant kültürler aşağıdaki 3, 21 olarak pasajlandı olabilir:
- Kültür orta 0.2 mikron Acrodisc R_ şırınga filtresi kullanarak filtrelenmiş seçilen kuyu, kaldırılır ve klimalı aracı olarak kullanmak için korunur. Orta 1 hafta 4 ° C'de muhafaza edilebilir.
- PECM dispase seyreltilmiş 1:10 100 mcL her kuyucuğa eklenir ve levhalar sonra 20 dakika süreyle 37 ° C inkübatör döndü.
- Bir pipet yavaşça gevşetti iyi yüzey hücreleri kazımak için kullanılır.
- Hücre süspansiyonu daha sonra 1.000 g pelet süpernatant çıkarılır ve atılır hücreleri ve 3 dakika santrifüj edilir.
- Hücreler, klimalı, orta ve PECM 1:1 karışımı 200 mcL yeniden askıya alınır.
- Hücre karışımı daha da genişletilmesi için 48 kuyucuğu aktarılır.
- In vitro analizi hücreleri için 48-iyi levhalar (her biri 9 mm 2 steril cam lamel içeren) ya da 8-iyi-cam haznesi slaytlar ya 2 5 x 10 3 hücre / cm yoğunluğu kaplı olabilir . Farklılaşma izin ortamına aktarılmadan önce farklılaşma analiz hücrelerin fiksasyonu önce, 3 gün boyunca (in vitro yöntem ayrıntıları için Bölüm 4'e bakınız)% 50-60 izdiham gecede yetiştirilmektedir .
4. İskelet Kası Kök Hücreler ve İlköğretim Kültürler in vitro Analizi
4.1. Hücre hazırlanması
- 3 x 10 3 hücre / cm 2 yoğunluğu 48 kuyucuğu lamelleri üzerine Dispase pasajlandı (Bölüm 3.3) primer embriyonik eksplant kültürleri PECM / klimalı ortamda kaplama ve takmak için izin.
- Apoptozis ve proliferasyon lamelleri değerlendirilmesi için daha ileri bir 10 dakika PBS yıkama takip, oda sıcaklığında 20 dakika süreyle PBS (bkz. Bölüm 4.2)% 4 paraformaldehid sabit, PBS içinde iki kez yıkanır .
- Lameller PBS veya PBS / glisin 1 hafta kadar bu şekilde 4 ° C'de saklanabilir hazırladı.
4.2. Paraformaldehit Sabitleme hazırlanması
- Davlumbaz, 4 gr paraformaldehid tartmak (PFA, Sigma-Aldrich, Birleşik Krallık) ve manyetik karıştırıcı ile 100 ml steril PBS bir cam şişe eklemek. Korunması için bir yüz maskesi ve eldiven giyilmelidir.
- Davlumbaz, toz eriyene kadar çözüm manyetik bir ocak ısıtılır ve sürekli karıştırılır. Bu 65 ° C'de yaklaşık 5-10 dakika sürer 70 üzerinde yükselen sıcaklık önlemek için alınması gereken ° C, yüksek ısıda patlayan çözüm bir risk var.
4.3. Apoptozis ve Silahların Yayılmasının Önlenmesi Testi
- Sabit lamelleri (Bölüm 4.1 olarak hazırlanan), 10 mikrogram / ml DAPI 3 dk ile boyandı .
- Lameller PBS (5 to10 dakika) bir kez yıkanmış ve bir bardak slayt 17, 18, orta montaj vectashield bir nokta üzerine ters .
- Lamel kenarları tırnak cilası (bkz. Not 12) ile mühürlenir.
- Depolama için, slaytlar folyo ile sarılır ve 20 ° C'de yer
- Sayımı için, slaytlar, dik bir mikroskop floresans (UV filtre) altında görüntülenir ve apoptotik ve mitotik hücrelerin bir mercek graticule kullanarak için attı. Yirmi rastgele dağıtılan ızgaraları sayılır (~ 1.000 hücreleri temsil eden) ve hücrelerin morfolojik (Şekil 3 g), non-apoptotik apoptotik ve mitotik olarak karakterize edilirler.
- Mitotik ve apoptotik endeksleri toplam hücrelerinin oranı olarak hesaplanır.
4.4. İmmünohistokimya
Lamelleri üzerine sabit Hücreler immünohistokimya için de kullanılabilir. Kullanarak antijen alımı için bir düdüklü tencere lamelleri standart ataç kullanarak cam slaytlar sıkıca bağlı olmalıdır. Immün (bkz. Myf-5 (1 / 1, 000 dilüsyon) antikor kullanarak kimliğini belirlemek için, Ki67 (1 / 1, 000 dilüsyon) bir antikor kullanarak, hızla çoğalan hücreleri tanımlamak için, ya da gen ekspresyonu araştırmak için kullanılır.Bölüm 4.5). Immün bir dizi yöntem, aşağıdaki (açıklanan (28, 29)) yazarlar tarafından rutin olarak kullanılan kullanılarak elde edilebilir:
- Sodyum sitrat tamponu düdüklü tencere önceden ısıtılır. Antijen alımı için, kesitli doku içeren slayt ısıtılmış tampon içine yerleştirilir ve 2 dakika süreyle basınç altında ısıtılır. Basınç düdüklü tencere kapağı sıkıca kilitleme ve ağırlık yerleştirilmesi ile elde edilir. 2 dk alma süresi geçtikten sonra düdüklü tencere sonra basıncı azaltmak için soğuk musluk suyu altında dikkatlice yerleştirilir. Kadar kaynar tampon önlemek için, bakım basıncının atmosferik basınç ile eşitledi kadar kapağını kaldırmak için dikkat edilmelidir. Basınç yeterince ağırlık kolayca temizlenebilir (zorlama olmadan) ve kapağı kaldırılır zaman azalır. Slaytlar sonra tampon çıkarıldı ve 10 dakika oda sıcaklığında PBS ile yıkandı.
- Slaytlar için% 3 hidrojen peroksit / 5 dakika musluk suyu çeker ve daha sonra PBS içinde üç defa yıkanır tarafından önceden bloke +% 0.05 Tween 20 (Yıkama başına 10 dk).
- Engelleme TNB engelleme tampon bir oda sıcaklığında 30 dakika inkübasyon (TSA kiti verilen) tarafından sağlanır.
- Primer antikor uygun seyreltme (titrasyonu ile geldi, bakınız Not 12) TNB tampon seyreltilmiş ve 4 gece inkübe ° C (veya alternatif olarak 1 ila 2 saat oda sıcaklığında).
- PBS içinde üç 10 dakika yıkama +% 0.05 Tween 20, slaytlar TNB tampon seyreltilmiş uygun biotinlenmiş ikinci antikor oda sıcaklığında 1 saat inkübe edilir.
- PBS içinde daha üç 10 dakika yıkama +% 0.05 Tween 20, slaytlar TNB tampon 1:100 sulandırılmış Streptavidin-HRP 30 dakika (TSA kit sağlanan) inkübe edilir ve daha sonra (10 dk) içinde üç defa yıkanır PBS +% 0.05 Tween 20.
- Biotinyl tyramide (amplifikasyon reaktif kiti TSA), ardından 8 ila 15 dakika (hassas zaman optimizasyonu deneyler tarafından alınmalıdır) için her bölüm için eklenir.
- Takiben amplifikasyon, yıkama üç kez (10 dakika) sonra PBS +% 0.05 Tween 20 ve SA-HRP 30 dakika inkübe slaytlar.
- 5 ila 10 dakika _-diaminobenzidin tetrahydrochloride kromojen (DAB) takiben, üç daha fazla yıkama (10 dak) PBS +% 0.05 Tween 20 3,3 kullanarak görselleştirmek. Sonra hematoksilen slaytlar counterstaining ve coverslipping önce son iki yıkar su yürütmek. DAB bilinen bir kanserojen ve dikkatli bir şekilde ele alınmalıdır (Kolşisin, Bölüm 3.2.2).
4.5. Farklılaştırma
- (Bkz. Not 13) lamelleri veya odasının slaytlar üzerine kaplama SMSC myotube analizi için fiksasyon önce de ayırt edilebilir.
- Bu deneyler için hücreler 10 4 / cm 2 yoğunluğu kaplama ve 6 ila 8 saat takmak için izin verilir
- Hücreler daha sonra 3 gün (Not 14) farklılaşma izin koşulları devreye girerler.
- Farklılaşma orta DMEM oluşur + 0.5% FCS% 2 at serumu ve% 1 glutamin ile desteklenebilir. Bu farklılaşma müsamahakar kültür ortamı, 48 saat aralıklarla değiştirilir.
- Lameller sonra% 4 (Bölüm 3.4.1 ve 3.4.2) yukarıdaki gibi paraformaldehid sabitlenir.
4.6. SMSC Transfeksiyon: transgenlerin ve shRNAi oluşturur İfade
Kök hücreler ve birincil kültürler transfeksiyon dirençli ve yöntemlerden bir çoğunluğu ile SMSC ve primer iskelet kası hücrelerinde geçici transfeksiyon yöntemlerinin kullanımının önlenmesi, transfeksiyon oranı çok düşük (<% 10). Bu transgen transfekte kültürleri (bkz. Bölüm 3.2.1), kalsiyum fosfat ya da lipofectamine aşağıdaki transfeksiyon klonal türevleri izole etmek için laboratuarda standart bir uygulama olmuştur üstesinden gelmek için. Alternatif hücreleri verimli bir şekilde kullanarak, viral paketlenmiş yapıları enfeksiyon transfekte olabilir. Şekil 1m PD50A pIRV, çoğaltma ile G418 seçim enfeksiyona altında izole bir klonal SMSC türevi β-galaktosidaz istikrarlı ifade neo/G418 direnci ve β-galaktosidaz (19) genleri taşıyan kusurlu retrovirüs gösterir. Bu hücre hattı resmen SMSC (bkz. Şekil 3.1) in vivo fonksiyonel kök hücreleri gibi davranırlar göstermek için kullanılmıştır. Bir marker gen ifade istikrarlı bir klonal hücre hattı nesil in vivo kök hücre nakli deneyleri için arzu edilir olsa da, in vitro gen fonksiyonu analiz zaman alıcı ve yetersiz bir yöntemdir . Bu nedenlerden dolayı, yazarlar, son zamanlarda% 60 ila% 70 Transfeksiyonu oranları sunma yeteneğine sahiptir Lipofectamine 2000 transfeksiyon reaktif optimize edilmiş bir değişiklik geliştirdik. Bu gen fonksiyonu transgenlerin veya RNAi geçici transfeksiyon kullanarak analiz SM içine inşa sağlarSc veya primer eksplant kültürleri (Şekil 3h, i). Yazarlar SMSC mRNA gen özel hedefleme yeteneğine shRNAi yapıları oluşturmak için kısa bir saç tokası RNAi vektör (pSHAG RNAi) (30) kullanın. ShRNAi tekniğin başarı iki unsurdan bağlıdır: (a), etkin bir transfeksiyon yöntem ve özellikle hedef gen tanır kısa bir saç tokası dizisi (b) tasarım. ShRNAi eGFP RNAi demonte yöntemi (Şekil 3j, m) doğrulamak için kullanılan olabilir yönelik inşa.
4.7. SMSC için optimize edilmiş LipofectamineTM 2000 Transfeksiyon Protokolü
- Hücreler 05-10 Nisan hücre / 250 mcL DF10 kültür ortamı oda slaytlara cm 2 kaplama ve 18 saat için% 95 izdiham ulaşmak için (her bir hücre hattı için en uygun izdiham, farklı yoğunluklarda transfeksiyon oranlarını değerlendirirken tarafından kurulmuştur) kültür.
- Her iyi, 0.5 mg DNA (shRNAi vektörler, transgenlerin) 2 mM glutamin ile desteklenmiş ve steril Eppendorf tüp hafifçe karıştırılır serum serbest DMEM 33 mcL eklenir için.
- Her bir kuyu için Lipofectamine 2000 mcL 1.25 ayrı ayrı, bir başka 33 mcL serum orta DMEM + glutamin seyreltilmiş hafifçe karıştırılır ve 5 dakika boyunca oda sıcaklığında muhafaza
- DNA ve lipofectamine karışımları sonra hızla birbirine eklenir pipetleme tarafından 60 s için hafifçe karıştırılır ve oda sıcaklığında 19 dakika süreyle inkübe sonra DNA Lipofectamine 2000 komplekslerini oluşturmak için izin.
- Transfeksiyon için, karmaşık karışımı 66 mcL, her iki mecliste de eklenir ve slaytlar, hafifçe kompleksleri eşit dağılımını sağlamak için 10 s sarsan.
- Hücreler 37 ° C ve% 5 CO 2 'de 24-72 saat inkübe edilir . Yapı, fonksiyonel gen ekspresyonu veya shRNAi demonte bağlı olarak ilk 8 ve 24 saat post-transfeksiyon arasında tespit edilmiştir.
5. Temsilcisi Sonuçlar
Eksplantlar dikkatle yetişkin iskelet kası ya da embriyolardan eksplante eksplantlar 37 birkaç saat içinde 72 saat inkübasyon hücreleri ° C (% 5 CO 2 / hava) (Şekil 3A). Oluşturmaya başlayacak Bunun gerçekleşmesi için alınan eksplant kaynağına bağlıdır: embriyonik eksplantlar büyük yetişkin iskelet kas eksplantlar göre daha hızlı büyümek olacak. Bizim tecrübelerimize göre akıbet zamanlaması, 29 3 yüksek tekrarlanabilir. SMS hücre birincil kültürleri bir araya yüksek yoğunluklu (Şekil 3B-F bu kültürlerin resme bakınız) oluşturmak için hücre popülasyonu Genişleme gün (embriyo eksplantlarında) ya da hafta (eski iskelet kas eksplantlar) bir süre içinde gerçekleşir. Şekil 1 ve 3 iskelet kas ve embriyonik eksplantlar, klonal türetme ve iskelet kas kökenli göstermek için elde edilen yetişkin kök hücreler, β-galaktosidaz etiketleme, karyotipleme ve embriyonik SMSC myf-5 immünohistokimya iskelet kas in vivo nakli başarılı türev ve kültürünün temsilcisi sonuçlarını göstermek , embriyonik kas birincil hücrelerinin morfolojisi; apoptoz ve shRNAi transfeksiyon protokolü DAPI boyama hücre popülasyonlarının Şekil 3 akıbet puanlama temsili bir sonuç (SMSC görselleştirmek için Myf-5 immünohistokimya kullanarak) gösterir . Daha fazla ayrıntı, bu iki figür ile ilgili rakam efsanelerinde bulunabilir. Şekil 2 zenginleştirilmiş popülasyonları, embriyonik iskelet kası kök hücre üretmek için embriyo mikro-diseksiyonu prosedürü göstermektedir.
Tablo 1: Hesaplama tablosu protokolleri aşağı hücre dondurma sırasında maksimum hücre canlılığı için gerekli cryovials sayısını tahmin etmek
| Plaka / Flask / oda slayt | Kültür orta Hacmi | PBS yıkar | Ses tripsin | Şişeleri aşağı donma Sayısı (3.1.2) |
| 96-iyi | 50 mcL | 2 X 100 mcL | 25 mcL | N / A |
| 48-iyi | 150 mcL | 2 X 200 mcL | 50 mcL | N / A |
| 24-iyi | 500 mcL | 2 X 700 mcL | 200 mcL | N / A |
| 6-iyi | 3 mL | 2 X 3 mL | 500 mcL | 1 |
| Küçük (25 cm 2) | 10 mL | 2 X 10 mL | 1 ml | 2 |
| Orta (80 cm 2) | 10 mL | 2 X 10 mL | 3 mL | 4 |
| Büyük (175 cm 2) | 10 mL | 2 X 10 mL | 5 mL | 8 |
| Odası iyi | 500 mcL | 2 X 500 mcL | 100 mcL | N / A |
N / A = uygulanabilir değil; birden fazla kuyu birlikte donduruldu sürece hücre sayıları aşağı dondurmak için çok düşüktü.
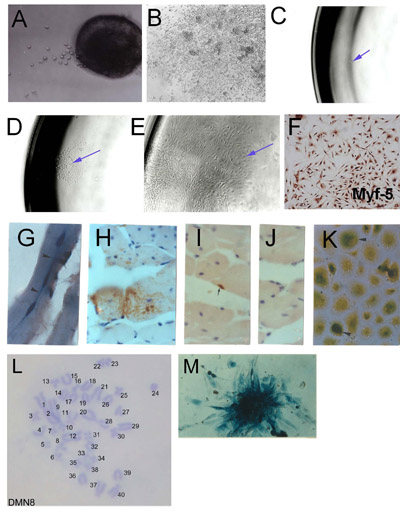
Şekil 1. Microexplants iskelet kas kök hücreleri (SMSC) İzolasyon: eksplante yetişkin iskelet kası (2 gün) (A) Erken akıbet toplu kültür ve yüksek hücre yoğunluğu gösteren (B) kurulan eksplant sonucudur. SMSC Klon türetme. (C) Tek hücreli bir 96 plaka izole Myf-5 immunhistokimya ile SMSC kimlik (D) tek hücre kökenli Colony (E) (F) klonal nüfus kuruldu. Doğrulama. SMSC klon PD50A 3 ay ev sahibi farelerde (β-galaktosidaz ifade) (G) ve (HJ) türetilen hücreler 2.000 PD50A hücrelerinin fare tibialis anterior kas içine enjeksiyon sonrası 14 ay (G) (Üç son zamanlarda merkezi bir konuma çekirdekleri erimiş kas lifi) β-galaktosidaz-pozitif hücreler (mavi leke) (uzunlamasına bölümünde) (H) Kapsamlı katkı β-galaktosidaz pozitif kas liflerinin hücre (anti-β-galaktosidaz antikor tarafından tespit leke kahverengi) (enine kesit ) (I) β-galaktosidaz pozitif uydu hücre (anti-β-galaktosidaz antikor tarafından tespit leke kahverengi) (J) İkincil antikor kontrolü (boyama) (K) β-galaktosidaz-pozitif hücrelerin (leke mavi) enjekte konak kasları izole kültür prolifere 12 ay sonrası enjeksiyon (L) PD50A hücrelerinin bir koloni β-galaktosidaz ekspresyonu gösteren normal diploid kromozom (M) Histokimya gösteren bir fare klonal SMSC hattı (DMN8) Karyotip ( Şekil 3.1 g, k, AACR basın, Smith ve Schofield, 1997) izni ile çoğaltılabilir.
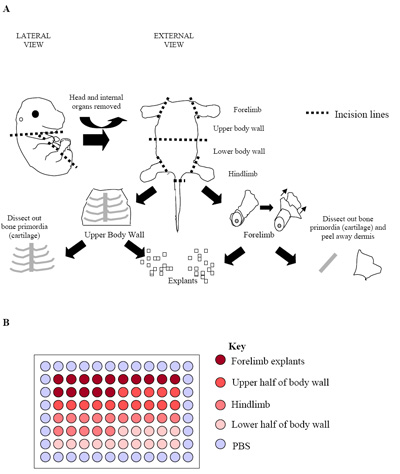
Şekil 2. (A) embriyo diseksiyonu süreci İllüstrasyon. Bu rakam bir E15.5 embriyo (kıkırdak) ilkel kemik kolayca tanınabilir ve çevresindeki iskelet kas dokusunun ücretsiz disseke olabilir temsil eder. Bu aşamada, ve daha sonraki aşamada embriyoların (E15.5 E17.5), dermis de elde edilen iskelet kas hücrelerinin oranını en üst düzeye çıkarmak için kaldırıldı. (B) 96 plaka birincil eksplant kültürlerin Kurulum . Her embriyo yukarıda görüldüğü gibi bir plaka üretmek için kullanılmıştır. Olağan uygulamada plaka akıbet oranlarını kurmak için üç ayrı embriyolar (üç tabak = 180 kuyu) çoğaltır.
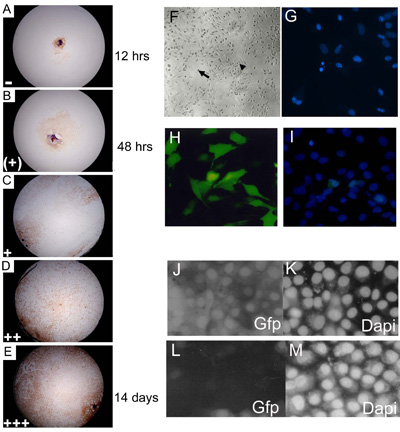
Şekil 3. Embriyonik birincil eksplant kültürleri, kültür, 3, 7, 14 ve 21 gün gol ve izdiham düzey bir sonucudur düzey temsilcisi ayrıldı. 15% 24 (+);; 25 49 (+)% 50% 74 (++); 75% 100 (% 0 14 () göstermek için Myf-5 ile boyanmış (AE) C57BL10 E15.5 birincil embriyonik eksplant kültürlerin + + +) izdiham seviyeleri. Veri harmanlama önce akıbet her düzeyde (her gün puanlama) gösteren kuyu orantılı bir rasgele sayı ile çarpılarak (+ = 4 + + + = 5; (+) = 2; + = 3 = 1) nihai bir sonucudur değer vermek. Wild-tip (C57BL/10) birincil eSMSc yaklaşık% 85'i iskelet kas hücre işaretleyici Myf-5 için leke. Büyütme 10 (F) kurulan embriyonik kültürler yetişkin SMSC, bipolar hücreleri (küçük ok) ve küresel monomorfik hücreler (büyük ok) morfolojik özellikleri var. DAPI boyama kullanarak apoptotik çekirdekleri parçalamadan (G) Tanımlama (HI) Yüksek seviyede (~% 75), optimize edilmiş Lipofectamine 2000 transfeksiyon yöntemi (I) toplam hücre sayısı Sayma kullanarak SMS hücre hatları bir GFP-ifade inşa transfeksiyon DAPI counterstain destekli . PSHAGshRNAigfp (JM) kullanarak RNAi (bu yapı, bir kontrol olarak kullanılan bir örnek için (29 bakınız)) SMSC GFP ifade ortadan kaldırmaktadır. GFP SMSC çizgi GFP ekspresyonu gösteren (J) Kontrol (sahte transfeksiyon) (K) DAPI kontrolü transfeksiyon sonra (L) shRNAiGfp 24 saat. shRNAiGfp transfekte hücreler için DAPI kontrolü (L) (M).
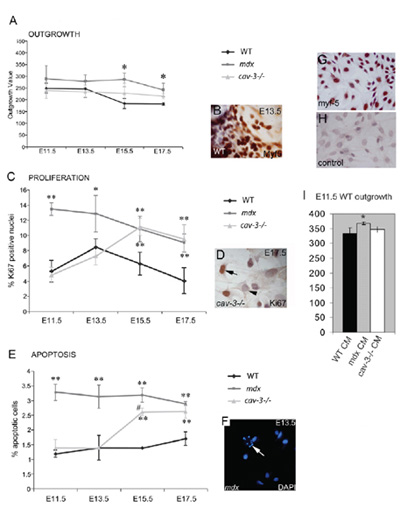
Şekil 4. Distrofik, embriyonik Myf5 pozitif myoblast hiperproliferatif ve apoptozis eğilimli. (A) embriyonik matür kas eksplant kültürünün sonucudur oranı iWT eksplantlar paralel olarak kültür ile karşılaştırıldığında E11.5 gelen mdx mutantlar ve E15.5, E17.5 cav-3 (-/-) mutantlar hem de arttı. (B) Myf5 ile immunohistokimyasal eksplant, (C ) mdx embriyolar E11.5 Ki67 pozitif immünoreaktivite (D) tarafından belirlenen E15.5, E11.5 mdx mutantlar ve cav-3 (-/-) mutantlar embriyonik matür hiperproliferasyonu (E) Yükseltilmiş apoptozis DAPI boyama (F) tarafından gösterildiği gibi cav-3 (-/-) embriyolar E15.5; F noktalarında ok apoptotik hücre. * P <0.05 WT ile karşılaştırıldığında; ** p <0.01 WT ile karşılaştırıldığında; * p <0.05 Myf5 boyama mdx cav-3 (-/-) (G, H) ile karşılaştırarak E15.5 birincil kültürlü WT embriyonik matür. (G) ve (H) ikinci bir antikor kontrolü (I) E11.5 WT eksplantlar akıbet oranı E11.5 mdx eksplant klimalı ortamda (CM) (* p <0.05) artış, ama değil cav-3 (-/-) veya WT CM. Hata Barlar sd Bu rakam, yazarların telif hakkı altında yeniden oluşturulur ve ilk Merrick ve arkadaşları, 2009 Biyologlar Şirket tarafından yayımlanan göstermektedir .
6. Notlar: kritik adımları ve olası değişiklikler
- Çözülmüş hücreleri hücre yoğunluğu çok düşük takılı olduğunda sadece kültür kazasında önlemek için yarım orta yerini ihtiyatlı bir davranıştır.
- Distrofik kas izole SMSC apoptozis duyarlı ve özel bir dikkatle tedavi edilmelidir. Distrofik SMSC (5 hafta eski distrofik (mdx) farelerde elde edilen iskelet kas kurulmuştur DFD-13 hücre hattı gibi) matür için normalden daha yüksek hücre yoğunluğu da yetiştirilir. Böyle apoptoz duyarlı hücre hatları, aynı zamanda daha yüksek yoğunluklarda (bkz. Bölüm 1.1 ve 1.2) (19) az Kriyoprezerve.
- Bir tek tabaka hücreleri kaldırarak alternatif bir yöntem FCS ve kalsiyum (DF10 içinde mevcut hem) varlığı yapılabilir avantajı ile, hücre disosiasyon daha yumuşak bir yöntem sağlar dispase kullanır. Dispase altkültüre bu nedenle kullanılan ve birincil iskelet kası eksplant kültürler ve earlystage SMSC klonlar (bkz. Bölüm 2 ve 3) genişletmek olabilir.
- Büyük şişeler için tripsin / EDTA kullanılan miktar aşağıdaki gibi büyütülüyor olmalıdır: 75 mm 2 balonuna (3 ml tripsin) ve 175 mm 2 balonuna (5 ml tripsin). Benzer şekilde, daha küçük yüzey alanları için kullanılır (bkz. Tablo 1) tripsin miktarını azaltır.
- Alternatif olarak, disosiasyon ters bir mikroskop kullanılarak takip edilebilir, bu yeni başlayanlar için tavsiye edilir.
- Hücre hatları Kriyoprezervasyon genellikle bir konfluent büyük (175 mm 2) plastik gemi kullanılarak yapılmaktadır. 7 ve 9 arasında cryovials Kriyoprezerve olan hücre hattı hayatta profiline bağlı olarak, böyle bir büyük damar elde edilebilir. Primer kültürler ve yeni kurulan hücre hatları genellikle prosedürleri dondurmak için çok dirençli. Kurtarma ve iki yaklaşım kullanılabilir (ayrı ayrı veya birlikte) bu hücreleri dondurma başarısını artırmak için. (A) karışımın donma FCS içeriği% 10 (maksimum% 50) artış olabilir. (B) işlemi dondurma sıvı faz şişeleri aktarmadan önce 12-24 saat süreyle buhar fazında N2 cryovials yerleştirerek önlenebilir.
- Haemacytometer lamel firma eki kontrol etmek için uygun bir şekilde, açık bir elini ters haemacytometer lamel tutun veya alternatif olarak Newton'un Yüzükler (cam gökkuşağı yansımaları), bakmak için.
- Eksplant yönteminin bir varyasyonu immünhistokimya, çoğalması ya da apoptoz tayinlerde kullanmak için kısa vadeli kültürler için istihdam edilecek. Microdissected eksplantlar 8-iyi odasının slaytlar kullanarak cam üzerine yerleştirilir. Alternatif bir yöntem, 9 mm, 24 kuyucuğu yerleştirilen 2 lamelleri kullanmaktır. Her iki durumda da iki eksplantlar 150 mcL DF20 orta her iyi transfer edilir. Alternatif olarak, birincil kültürler dispase yöntemi ile pasajlandı ve 8-iyi odasının slaytlara 24 kuyucuğu yerleştirilir lamelleri üzerine veya doğrudan dışarı kaplı olabilir.
- Akıbet oranlarını kantitatif analiz için en az 60 kuyu başına 1 eksplant içeren bir kas / fare suşu başına kurulur. En az üç ayrı hayvanlarda kullanılması gereken bir gerginlik için büyüme parametreleri kurmak için. Akıbet atılan Tabaklar ve bireysel kuyulardan beslenen değildir.
- Klonlama kurulan SMSC hatları için klimalı orta ve orta DF10 1:1 karışımı tek hücre kültürü için yeterli. Birincil eksplantlar için% 20, kültür ortamı ve serum miktarını arttırmak için gereklidir.
- Kolşisin son derece toksik ve kanserojen olarak bilinen ve uygun bakım ile ele alınmalıdır. Çift eldivenlik ve sınırları belirlenmiş bir tepsi çalışma esastır. Tüm tek (yani Gilsonipuçları) bir gecede atmadan önce Follo kanat gün bol miktarda su ile (% 5 sodyum hipoklorit), çamaşır suyu bir behere konur.
- Şu anda 1 / 1, 000 seyreltme her Ki67 ve Myf-5 özel ilköğretim antikorların kullanabilirsiniz. Primer antikorları için en iyi seyreltme, aynı kaynaktan elde edilen ampirik bile, aynı antikor farklı partiler için ideal olarak da kullanılan ve her bir antikor için kurulacak gerekiyor.
- Bu testte Odası slaytlar da kullanılabilir. 4% PFA hücre sabitleme önce, kültür ortamı kaldırılır ve hücreler 37 ◦ C steril PBS ile iki kez yıkanır. Iyi odaları, conta ve tutkal kaldırılır ve cam, 25 dakika sonra yavaşça Gyro-Rocker R_ çalkalayıcı derinden sarsılır oda sıcaklığında, taze hazırlanmış% 4 paraformaldehid içeren 50 ml'lik cam Coplin kavanoza yerleştirilir slaytlar. Slaytlar sonra PBS içinde iki kere yıkanır (oda sıcaklığı) ve 4 ya hemen ya da PBS içinde saklanan ◦ C (kısa vadeli, 1-2 hafta) immünohistokimyasal (İHK) analizi için.
- Primer iskelet kas hücreleri daha geniş myotube oluşumu gerekli ise en fazla 8 gün için ayırt edilebiliyor.
Tartışmalar
Microdissected eksplant kültürleri, güvenilir ve tekrarlanabilir proliferatif Myf 5 pozitif iskelet kas kök hücreleri (SMSC) çok yüksek oranda (~% 85) içeren hücre popülasyonlarının izole etmek için kullanılabilir. Titizlikle kontrol kültür koşullar altında birincil eksplant kültürlerinde üreme davranışları genetik mutant fare SMSC karakterize etmek ve farklılaşma süreçleri in vitro analizi ayrıntılı myotubes üreten bir araç olarak kullanılabilir kullanılabilir Burada anlatılan. Bu kültürlerin dikkatli bakım ve manipülasyon, uzun vadeli bir kültür ve genişleme sağlar. Yöntemleri kullanarak, tek bir hücre seyreltme yoluyla eksplant kültürler klonal iskelet kas kök hücre hatları elde etmek için aynı zamanda burada anlatılan. Klonlama işlemi sırasında izole tek hücrelerin çoğalması, "klimalı ortamda" yüksek yoğunluklu kültürü için bu hücrelerin normal gereksinimi taklit etmek için kullanılır ulaşmak için. Yöntemi (embriyonik, yetişkin ve yaşlı yetişkin dokulara (modifikasyon) uygulanabilir ve fare yanı sıra insan (Rao ve Smith, yayınlanmamış) de dahil olmak üzere diğer türlerin iskelet kas hücreleri, civciv embriyo ve balık izole etmek için kullanılır. somon) 24. Klonal elde edilen SMSC intramüsküler nakli, in vivo olarak analiz ve bu koşullar altında SMSC hibrid kas lifleri oluşturmak için ev sahibi myotubes ile bir araya getirecektir enjekte edilebilir . Intramüsküler enjekte SMSC tümörler oluşturmak ve bir yıldan fazla bir enjeksiyondan sonra uydu hücre pozisyonda ana kaslarda bulundu uydu kök hücre niche.These hücreleri endojen kontrol tabi olduğunu öne sürerek, yeniden enjekte dan izole edilebilir 12 aydan fazla 19 ana enjeksiyondan sonra proliferatif SMSC olarak ev sahipliği yapıyor.
Açıklamalar
Teşekkürler
Patrick Paddison shRNAi servis vektör hediye için teşekkür ederim. Angela Sloan Şekil 3'te GFP RNAi görüntü oluşturulur. Biz, verdikleri destek için aşağıdaki finansman kuruluşları da teşekkür:
Müsküler Distrofi Kampanyası hibe sayısı RA2/592/2; hibe sayısı 02BHM04, Royal Society hibe sayısı 574006.G503/1948./JE ve BBSRC hibe sayısı 6/SAG10077 Ateşledi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| DMEM/F12 1:1 mix | Sigma-Aldrich | Liquid medium: (Dulbecco’s Modified Eagles’s medium and Ham’s F12 medium, 1:1 v/v) | |
| 100× Glutamine (200mM) | Sigma-Aldrich | Diluted in medium to a 1× concentration of 2 mM (Glutamine HYBRI-MAX R) | |
| Fetal calf serum (FCS) | From a number of different companies | Batch tested on primary cultures and skeletal muscle cell lines. 10-20% supplement to liquid media | |
| Heraeus Labofuge 300 | Heraeus Instruments | Lab centrifuge capable of reaching 1,000 rpm | |
| 15 ml Falcon centrifuge tubes | Fisher Scientific | Must fit lab centrifuge | |
| Tissue culture plasticware (25, 75 or 175 mm2 tissue culture vessels; 96-well tissue culture plates. 60 mm Petri dishes). | Nalge Nunc international | ||
| Humidified CO2 incubator (Heraeus) | Heraeus Instruments | Ours is copper lined, recommended for reducing contamination | |
| Sterile hood with laminar air flow (Heraeus) | Heraeus Instruments | Ours is a Class II hood – suitable for use with Human tissues | |
| Water Bath | Grant Equipment | Maintained always at 37°C | |
| Inverted microscope | Leica Microsystems | ||
| 70% Ethanol | For sterilization (animals, dissection instruments) and swabbing benches, hood, etc. | ||
| Calcium- and magnesium-free phosphate-buffered saline (PBS) | Sigma-Aldrich | Cell culture-tested PBS (Dulbecco’s formula) is purchased as a ready-mixed powder or in tablet form and made up with doubledistilled water before sterilization by autoclave. PBS consists of 2.68 mM potassium chloride (KCl); 1.47 mM potassium phosphate monobasic (KH2PO4); 0.137 M sodium chloride (NaCl); and 8.1 mM sodium phosphatedibasic (Na2HPO4). PBS can be prepared from scratch as follows: 200 mg KCl, 200 mg KH2PO4, 8 g NaCl and 1.15 g Na2HPO4/l of double-distilled water followed bysterilization by autoclave. | |
| CryoTube vials | Nalge Nunc international | ||
| A Neubauer haematocytometer and coverslips | Fisher Scientific | For estimating cell counting | |
| Hand counter | Fisher Scientific | ||
| Dissection microscope, Zeiss Stemi 1000 | Carl Zeiss, Inc. | For preparation of explants | |
| Small sterile hood | |||
| Sterile dissection instruments (including Jeweler’s forceps) | Sterilised by autoclave | ||
| Sterile plastic collecting vessels (7 ml bijou tubes or 20ml universals) | Nalge Nunc international | ||
| Warm PECM | Sigma-Aldrich | Made up in the sterile hood and warmed to 37°C in the tissue culture waterbath. DMEM:F-12 supplemented with 20% FCS, 1% glutamine and + 1% penicillin & streptomycin solution | |
| Dispase (50 μg/ml, equivalent to 6 units/mg) | Available from MP Biomedicals, UK | ||
| 10 μg/ml 4_,6 Diamidino-2-phenylindole, dihydrochloride (DAPI). | Sigma-Aldrich | For microscopic visualization of apoptosis and mitosis | |
| Vectashield fluorescent mounting fluid | Vector Laboratories | ||
| Fluorescent upright microscope with ultraviolet filter (we use a Nikon Eclipse E600) | Nikon Instruments | ||
| Digital camera and imaging software (we use a Nikon Coolpix 995 camera; A Nikon D3 camera | Nikon Instruments | ||
| OpenLab4.0a software | PerkinElmer, Inc. | ||
| Photoshop CS4 | Adobe |
Referanslar
- Yaffe, D., Saxel, O. Serial passaging and differentiation of myogenic cells isolated from dystrophic mouse muscle. Nature. 270, 725-727 (1997).
- Askanas, V., Engel, W. K. A new program for investigating adult human skeletal muscle grown aneurally in tissue culture. Neurology. 25, 58-67 (1975).
- Smith, J., Schofield, P. N. The effects of fibroblast growth factors in long term primary culture of dystrophic (mdx) mouse muscle myoblasts. Exp Cell Res. 210, 86-93 (1994).
- Fell, H. The cell in culture. J Clin Pathol. 11, 489-495 (1958).
- Stewart, D. C., Kirk, P. L. The simultaneous measurement of several parameters of embryo heart explants growth in vitro. J Cell Physiol. 40, 183-198 (1952).
- Harvey, A. L., Robertson, J. G., Witkowski, J. A. Maturation of human skeletal muscle fibres in explant tissue culture. J Neurol Sci. 41, 115-122 (1979).
- Zammit, P. S., Heslop, L., Hudon, V., Rosenblatt, J. D., Tajbakhsh, S., Buckingham, M. E., Beauchamp, J. R., Partridge, T. A. Kinetics of myoblast proliferation show that resident satellite cells are competent to fully regenerate skeletal muscle fibers. Exp Cell Res. 281, 39-49 (2002).
- Konigsberg, I. . The embryonic origin of muscle. , (1986).
- Trainor, P. A., Tan, S. S., Tam, P. P. Cranial paraxial mesoderm: regionalization of cell fate and impact on craniofacial development in mouse embryos. Development. 120, 2397-2408 (1994).
- Tajbakhsh, S., Rocancourt, D., Cossu, G., Buckingham, M. Redefining the genetic hierarchies controlling skeletal myogenesis Pax-3 and Myf-5 act upstream of MyoD. Cell. 89, 127-138 (1997).
- Tremblay, P., Dietrich, S., Mericskay, M., Schubert, F. R., Li, Z., Paulin, D. A crucial role for Pax3 in the development of the hypaxial musculature and the longrange migration of muscle precursors. Dev Biol. 203, 49-61 (1998).
- Tajbakhsh, S., Bober, E., Babinet, C., Pournin, S., Arnold, H., Buckingham, M. Gene targeting the myf-5 locus with nlacZ reveals expression of this myogenic factor in mature skeletal muscle fibres as well as early embryonic muscle. Dev Dyn. 206, 291-300 (1996).
- Tam, P. P. A study of the pattern of prospective somites in the presomitic mesoderm of mouse embryos. J Embryol Exp Morphol. 92, 269-285 (1986).
- Cossu, G., Kelly, R., Donna, S. D. i., Vivarelli, E., Buckingham, M. Myoblast differentiation during mammalian somitogenesis is dependent upon a community effect. Proc Natl Acad Sci USA. 92, 2254-2258 (1995).
- Shainberg, A., Yagil, G., Yaffe, D. Control of myogenesis in vitro by Ca2+ concentration in nutritional medium. Exp Cell Res. 58, 163-167 (1969).
- Dodson, M. V., Martin, E. L., Brannon, M. A., Mathison, B. A., McFarland, D. C. Optimization of bovine satellite cell-derived myotube formation in vitro. Tissue Cell. 19, 159-166 (1987).
- Smith, J. Muscle Growth factors, ubiquitin and apoptosis in dystrophic muscle: Apoptosis declines with age in the mdx mouse. B Appl Myol. 6, 279-284 (1996).
- Smith, J., Fowke, G., Schofield, P. Programmed cell death in dystrophic (mdx) muscle is inhibited by IGF-II. Cell Death Differ. 2, 243-251 (1995).
- Smith, J., Schofield, P. N. Stable integration of an mdx skeletal muscle cell line into dystrophic (mdx) skeletal muscle: evidence for stem cell status. Cell Growth Differ. 8, 927-934 (1997).
- O Shea, L., Johnson, C., Rooney, M., Gleeson, R., Woods, K., Smith, J. Adipogenesis and skeletal muscle ageing. Mech Ageing Dev. 122, 1354-1355 (2001).
- Merrick, D. . A role for Igf-2 in fast skeletal muscle specification during myogenesis in dystrophic and wild type embryos [dissertation]. , (2006).
- Stadler, L. K. J., Merrick, D., Smith, J. Morphological stem cell and fast myosin abnormalities in the cav-3 / and mdx dystrophic embryo reveal an embryonic basis for muscular dystrophy. Abstr. Genet.Res. 90, 281-289 (2008).
- Merrick, D., Stadler, L. K. J., Larner, D. P., Smith, J. Morphological stem cell and fast myosin abnormalities in the cav-3 / and mdx dystrophic embryo reveal an embryonic basis for muscular dystrophy. Dis Model Mech. 2, 374-388 (2009).
- Matschak, T., Stickland, N. C., Smith, J. Explants of embryonic Atlantic salmon muscle in culture. Proc Soc Exp Biol A. 1, 23-23 (1997).
- Smith, J., Hooper, M. L. Dominance and independent segregation of metabolic cooperation competence and pluripotency in an embryonal carcinoma cell hybrid. Exp Cell Res. 181, 40-50 (1989).
- Bulfield, G., Siller, W. G., Wight, P. A., Moore, K. J. X chromosome linked muscular dystrophy (mdx) in the mouse. Proc Natl Acad Sci USA. 81, 1189-1192 (1984).
- Hagiwara, Y., Sasaoka, T., Araishi, K., Imamura, M., Yorifuji, H., Nonaka, I., Ozawa, E., Kikuchi, T. Caveolin-3 deficiency causes muscle degeneration in mice. Hum Mol Genet. 9, 3047-3054 (2000).
- Westbury, J., Watkins, M., Ferguson-Smith, A. C., Smith, J. Dynamic temporal and spatial regulation of the cdk inhibitor p57 (kip2) during embryo morphogenesis. Mech Dev. 109, 83-89 (2001).
- Merrick, D., Ting, T., Stadler, L. K. J., Smith, J. A role for Insulin-like growth factor 2 in specification of the fast skeletal muscle fibre. BMC Dev Biol. 7, 65-65 (2007).
- Paddison, P. J., Caudy, A. A., Hannon, G. J. Stable suppression of gene expression by RNAi in mammalian cells AQ4. Proc Natl Acad Sci USA. 99, 1443-1448 (2002).
- Smith, J., Merrick, D. Skeletal Muscle Microexplant Culture and Isolation of Skeletal Muscle Stem Cells. Methods in Molecular Biology. 633, (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır