Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Matrix Rijitlik Akrilamid tabanlı Hidrojeller kullanarak Hücresel Fonksiyon Üzerindeki Etkilerinin incelenmesi
Bu Makalede
Özet
Hücresel fonksiyonları katmanlarından sertlik etkisi modellenmiş olabilir In vitro Uyumluluklar değişen poliakrilamid hidrojeller.
Özet
Doku sertliği hücresel fonksiyonunun önemli bir belirleyicisi olup, doku sertliği değişiklikler yaygın fibrozis, kanser ve kardiyovasküler hastalık 1-11 ile ilişkilidir. Geleneksel hücre biyolojik yaklaşımlar hücresel fonksiyonu çalışmalarında elastik bir ECM ya da dokular arasında ECM sertlik değişikliklerin etkisini dikkate almaz, katı bir alt tabaka üzerinde kültür hücreleri (plastik tabaklar ya da cam lamelleri) içerir. In vitro, in vivo doku uyumu şartları model için, biz ve diğerleri ECM-kaplı hidrojeller kullanın. Laboratuvarımızda, hidrojeller dizi 12 biyolojik olarak görülen doku uygunluk bildirimleri taklit edebilir poliakrilamid dayanmaktadır. "Reaktif" kapak fişleri 3-APTMS Ayrıca NaOH ile kuluçka tarafından üretilir. Glutaraldehyde 3-APTMS ve poliakrilamid jel çapraz bağlamak için kullanılır. Akrilamid (AC), bis-akrilamid (Bis-AC) ve amonyum persülfat bir çözüm hidrojel polimerizasyon için kullanılır. N-hydroxysuccinimide (NHS), hidrojel çapraz ECM protein AC çözüm içine dahil edilmiştir. Hidrojel polimerizasyonu sonra jel yüzeyi, fibronektin, vitronectin, kollajen, vb gibi bir seçim ECM protein ile kaplıdır
Bir hidrojel sertlik reoloji veya atomik kuvvet mikroskobu (AFM) tarafından belirlenir ve çözüm 12 AC ve / veya bis-AC yüzdesi değişen ayarlanabilir. Bu şekilde, alt tabaka sertlik reoloji veya AFM kullanılarak belirlenebilir Biyolojik dokuların sertlik eşleştirilmiş olabilir. Hidrojeller ve kültürlü gerekli deneysel koşullar dayalı bu hücreler daha sonra numaralı seribaşı olabilir. Moleküler analiz için hücre ve onların kurtarma Görüntüleme basittir. Bu yazı için, yumuşak katmanlarından 20.000 Pascal <E 3000 Pascal ve sert doku katmanlarından /> elastik modülü (E) olarak tanımlar.
Protokol
Hazırlık
- Lameller otoklava olmalıdır.
- Steril distile veya deiyonize su çözümler hazırlamak ve çamaşır lamelleri için kullanılmalıdır.
- AC (% 40 w / v) ve bis-AC (% 1 w / v) çözümleri 0.2 mikron filtre ile sterilize edilir. Kullanımı ve steril filtre kısa bir süre önce,% 10 amonyum persülfat (100μg/ml su APS) hazırlayın. APS çözüm aylık değiştirin.
- 3-APTMS, kloroform, glutaradehyde, NHS ve SurfaSil gibi kimyasal reaktifler otoklavlanmalıdır sadece hidrojellerin hazırlanması için kullanılan atanmış bir şişe içinde tutulur.
- En iyi sonuç için, hidrojeller uygun ECM protein ile geceleme inkübasyondan sonra birkaç gün içinde kullanılabilir olmalıdır.
- Hidrojel dökülmesinden önce, 50 ml polipropilen Falcon tüp kloroform (10 ml genelde 20 üst lamelleri için yeterli)% 10 SurfaSil çözüm hazırlayın. (Bizim laboratuvar genellikle% 0.5 glutaraldehid kuluçka adımı sırasında üst lamelleri siliconizes). En az 10 dakika süreyle Falcon tüp ve kaya lamelleri ekleyin. SurfaSil çözüm Durusu ve hava hidrojeller hazırlanacaktır biyolojik güvenlik kabini Kimwipes lamelleri kuru.
- Isı ile inaktive edilmiş BSA çözüm aşağıdaki gibi hazırlayın: PBS içinde yağ asidi serbest BSA 20 mg / ml solüsyon 30 dakika süreyle 68 ° C su banyosunda inkübe edilir. Çözüm, daha sonra steril 4 ° C'de filtre ve depolanan
Prosedür
- 150 mm Petri kabında alt yarısında Parafilm bir kat yerleştirin.
- 9 Parafilm üstüne 25 mm lamelleri yukarı bakacak şekilde yerleştirin ve 1 ml 0.1 M NaOH ile onları kapsayacak. 3 dakika sonra bir vakum hattı ile aspire inkübe.
- Her lamel kimyasal bir davlumbaz, 3 yerde 0.5 ml APTMS çalışma. 3 dakika inkübe edin ve sonra APTMS aspirat. Çok uzun süre beklerseniz, bir köpük oluşacaktır.
- Lamelleri aynı çanak 20 ml deiyonize su ile durulayın. Kavisli bir forseps kullanarak çanak lamelleri çıkarın ve onların tedavi tarafı yeni bir 150-mm çanak yukarı bakacak şekilde aktarabilirsiniz. Her bir yıkama için 10 dakika, rocker, lamelleri üç kez deiyonize su ile yıkayın. Tüm APTMS kaldırmak için başarısız olursa, bir sonraki adımda glutaraldehid tepki ve beyaz bulutlu bir çökelti (Şekil 1) bırakın.
- Glutaraldehit Çözülme (~ kullanmadan önce 10 dakika).
- Kavisli bir forseps kullanarak, temiz bir tabak Parafilm katmanlı lamelleri transferi ve kalan herhangi bir sıvı aspire. Gerektiği gibi kalan suyu örtecek bir vakum hattı veya Kimwipe kullanın.
- Her lamel 0.5 ml steril deiyonize su içerisinde% 0.5 glutaraldehid ile tamamen örtün ve 30 dakika kimyasal bir kaput inkübe edin. Glutaraldehid aspire. Durulayın ve 4. adımda lamelleri yıkayın. Lamelleri tamamen kurulayın. [Burada durdurmak ve kuru bir alanda birkaç hafta lamelleri bırakabilirsiniz].
- Hidrojeller hazırlamak için hazır olduğunuzda, lamelleri, reaktif yüzü yukarı, biyolojik güvenlik kabini yüzeye bantlanmış olmuştur Parafilm bir sayfa aktarmak için kavisli bir forseps kullanın. Lamelleri Parafilm yüzey üzerinde düz olduğundan emin olun.
- Toluen doymuş bir NHS çözüm hazırlayın. (Özellikle deney için yeterli toluen NHS küçük bir miktar çözülür. NHS artık eriyene kadar biraz NHS biraz ekleyerek tutun. Doymuş çözüm genellikle bulutlu ve pembe.)
- Daha sonra, istenen akrilamid yüzde ulaşmak için akrilamid, bis-akrilamid, su ve APS hazırlar. 0.8ml toplam hacmi aşağıda özetlenen mikrosantrifüj tüpler reaktifler ekleyin.
- Daha sonra, her seferinde bir kısım, NHS ekleyin ve 0.8 ml AC çözüm TEMED, girdap kısa ve DERHAL biyolojik güvenlik kabini lamel başına 140 ul kullanarak 3-5 jeller dökün. Mümkün olduğunda, bu noktadan itibaren tüm adımları bir biyolojik güvenlik kabini yapılmalıdır. [Not: ihtiyaca göre farklı boyut lamelleri göre kullanılabilir. 18 mm lamelleri kullanılması durumunda, lamel ortalama ~ 33 ul AC çözümü ve 18 mm üst silikonlu lamel kullanın.]
Bis-AC (%) 0.3 (sert) 0,15 0,06 0.03 (yumuşak) ul ul ul ul Su 402 522 594 618 AC 150 150 150 150 Bis-AC 240 120 48 24 APS 8 8 8 8 TEMED 1 1 1 1 NHS 228 228 228 228 - Polimerize başlamadan önce her jel üstünde silikonlu 25 mm lamel hızla yerleştirin. Üst lamel eklenmesi AC tamamen alt lamel karşılamak için izin vermelidir. Bu "sandviç" AC polimerize kadar oda sıcaklığında inkübe edin. (Polimerizasyon oluştu belirlemek için mikrosantrifüj tüp içinde kalan AC çözüm kontrol edin. Genellikle birkaç dakika sert jeller ve yumuşak olanlar için biraz daha uzun yeterli olacaktır.)
- Dikkatle sandviç pick up (steril eldiven) ve çıkıntılar polimerize jel kadar üst lamel kapalı slayt. Daha sonra jel kapalı gözetlemek. Üst lamel çıkarmadan önce çok uzun süre beklemek durumunda lamel kaldırılmış olduğundan, jel rip.
- Üst lamel atın. 2 ml PBS / alt jel lamelleri (bundan sonra hidrojel denir) 6-iyi tabak içine yerleştirin. PBS, her kuyuya jel-lamel önce veya sonra eklenebilir. Rocker, yıkama başına 5 dakika hidrojeller, üç kez PBS ile yıkayın.
- Hidrojellerin gerekli sayıda hazırlanmıştır kadar tekrarlayın 11-14 adımları.
- Fibronektin solüsyonu (PBS içinde 3 mg / ml) veya diğer ECM protein (Klein ve ark. Ayrıntılar için 13) 2 ml her hidrojel örtün. ECM protein kovalent 4 ° C'de gece inkübasyon sırasında hidrojel bağlı olur
- , En az 30 dakika süreyle 37 ° ECM çözümü ve serum ücretsiz medya 1mg/ml ısı ile inaktive edilmiş yağ asidi serbest BSA blok girmemiş NHS aspire ° C hücre kültürü inkübatörde. Hidrojeller steril PBS veya hücre kültür ortamı ile bir kez durulayın.
- FBS içeren uygun bir kültür ortamı Levha hücreleri. Hidrojel numaralı seribaşı hücrelerin sayısı, hücre deneyleri için gerekli yayılması ve confluency derecesi dayalı kullanıcı tarafından belirlenmelidir. Yaklaşık 10 5 hücreleri genellikle batı ve qPCR blot analizi için yeterli olacaktır.
- Kuluçka döneminin ardından, hücrenin protein ya da mRNA elde edilebilir. Lamelleri kuyulardan kavisli bir forseps kullanarak dikkatlice çıkarılır ve laboratuarlarında Parafilm bir sayfa boyunca (2-3cm) aralıklı edilmiştir lizis tamponu 100 ul damlacıkları üst (hücre tarafı aşağı) yerleştirilir. (Biz batı blot örnekleri hazırlamak ve qPCR için RNA izole etmek için, sırasıyla standart SDS örnek tampon ve TRIzol kullanın.) Lizis tamponu ile hücrelerin tam bir dakika boyunca inkübe edin. Lamelleri çıkarın ve bir mikrosantrifüj tüp lizis tamponu aktarmak. Alternatif olarak, kullanıcı sadece RNA çıkarılması için yeni bir 6-plaka Her hidrojel transferi ve 1 ml TRIzol / iyi ekleyebilirsiniz. 3 dakika boyunca inkübe ve mikrosantrifüj tüp depolama için TRIzol çözüm kaldırmak.
Immünofloresan olarak prosedürler hakkında ek bilgi, hidrojeller üzerinde seribaşı hücreler için BrdU boyama, transfeksiyon, vb Klein ve ark. 13, 2007.
Temsilcisi Sonuçlar
APTMS ek lamelleri iyice yıkama "reaktif" lamelleri üretiminde önemli bir adımdır. APTMS tamamen kaldırmak için başarısız olursa, sonraki adımda glutaraldehid tepki ve Şekil 1A görüldüğü gibi beyaz bulutlu çökelti üretmek. Şekil 1B, uygun bir şekilde yıkanır ve kurutulur lamel gösterir. Çökelti oluşursa lamel artık deresindeki tüm prosedürü başından itibaren yeniden başlatılması gerekir.
Gecede ECM proteinleri ile hidrojel oluşumu ve kaplama sonrasında, hücrelerin ertesi gün seribaşı olabilir. Şekil 2'de görüldüğü gibi, sert karşı yumuşak hidrojeller yayılan hücre arasında belirgin bir fark vardır. Fare embriyonik fibroblastlar (MEFS) Phalloidin boyama tarafından görüleceği gibi yumuşak hidrojeller ile karşılaştırıldığında, hücre sert büyük ölçüde yayılmıştır. Gerçekten de, en hücreleri yumuşak hidrojel bağlama kompakt kalacaktır ve daha verimli bir şekilde takın.
Hücre yayılmasında fark sadece MEF morfolojisi Şekil 2'de gösterildiği gibi olmasına rağmen, diğer birçok hücre hatları tutarlı 11-12,14 test.
Başarı sırları
- Işlemi başladıktan sonra, "reaktif" yan lamelleri tutmak ve hangi tarafı kaplanmış akılda tutmak çok önemlidir.
- Eldivenler işlem sırasında mümkün olduğu kadar steril bir çalışma ortamı sağlamak için tüm zamanların giyilmelidir.
- Ilk adımlar çoğu kimyasal bir davlumbaz ve laboratuar tezgah arasında yapılmaktadır. Lamelleri fazla glutaraldehid çıkarmadan sonraki tüm adımlar, biyolojik güvenlik kabini altında yürütülmelidir.
- Hücre sprea farklılıklar nedeniyleding (Şekil 2) sert hidrojeller ile karşılaştırıldığında, yumuşak hidrojeller hücre sayısının iki katını ekim tavsiye ederiz.
- AC polimerizasyon işlemi son derece hızlı. Ilk kez kullananlar için, bir APS miktarını azaltabilir veya polimerizasyon süreci uzatmak için çözüm TEMED. Bir defada birkaç lamelleri daha hazırlamak için kalkmayın.
- G0 senkronizasyon gereklidir hücre döngüsü çalışmalarda, genellikle plastik kültür kaplarına hücreler serum açlıktan hücreleri trypsinize ve mitojenler varlığı (FBS ve / veya büyüme faktörleri) farklı uyumluluklar hidrojeller onları reseed. Bu prosedür G0 senkronize hücrelerinin başlangıç nüfus tüm örneklerde aynı olmasını sağlar. Ancak, birçok sinyal iletimi çalışmaları için gerekli mitojenle stimülasyon süresi eki ve hücrelerin yayılmasını sağlamak için yeterince uzun olmayabilir. Bu durumda, biz hidrojeller hücreler serum açlıktan ve sonra doğrudan mitojen ile onları uyarmak.

Şekil 1A. Yanlış lamel yıkanmış APTMS ek ardından, lamel glutaraldehid çözüm ek önce 1-2 dakika yıkandı. Usul özetlenen adımları göre yıkanmamış lamel bir çökelti oluşturur.

Şekil 1B. Düzgün lamel yıkanır. APTMS sonra eklenmesi, lamel glutaraldehid çözümünün yanı sıra her biri 10 dakika önce üç kez yıkandı . Lamel çökelti oluşturur.
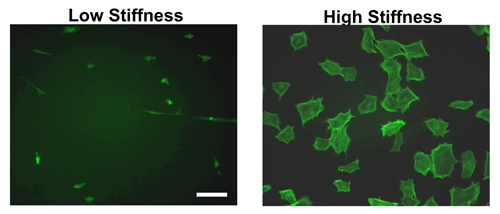
Şekil 2. Sertlik farklı. Hidrojeller hücre Morfoloji MEFS 9 saat boyunca yüksek veya düşük sertlik fibronektin kaplı hidrojeller numaralı seribaşı kuruldu. Kuluçka döneminin ardından, hücreler, sabit permeabilize ve f-aktin bağlanır FITC-Phalloidin ile boyandı. Yüksek sertlik jeller MEFS düşük sertlik hidrojeller numaralı seribaşı göre stres liflerin sergilemek ve iyi yayılır. Ölçek çubuğu = 50μm.
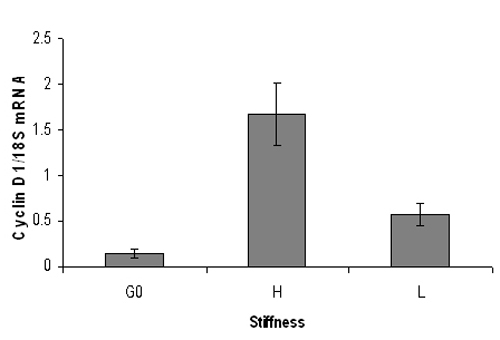
Şekil 3. Temsilcisi fare siklin D1 mRNA düzeyleri kantitatif PCR sonucu serum açlıktan fare embriyonik fibroblastlar yüksek (% 3 akrilamid) veya düşük (% 0.3 akrilamid) sertlik hidrojeller üzerine kaplama ve 9 saat 10% FBS ile uyarılır. RNA ekstraksiyonu takiben siklin D1 mRNA düzeyleri (18S RNA normalize), kantitatif gerçek zamanlı PCR analizi yapıldı. G0 siklin D1 mRNA latent hücreleri temsil eder. Siklin D1 mRNA düzeyleri sert hidrojeller değil yumuşak hidrojeller önemli ölçüde artırır. SD yinelenen PCR reaksiyonları - Veri + / ortalama.
Tartışmalar
Hidrojel polimerizasyon işlemi çok önemli bir unsur hücreleri ECM-kaplı hidrojel kendini daha ziyade cam lamel bağlamak sağlayacak hava kabarcığı oluşumunu önlemek için. Bu vorteks ve görsel hiçbir hava kabarcığı jel tuzak haline emin sonra dikkatli bir şekilde polimerizasyon çözüm pipetleme önlenebilir. Biz her zaman deneyler için yeterince sağlamak için ek "reaktif" lamelleri ve hidrojellerin hazırlanması önerilir.
Jeller PBS ile yıkanır zaman özel...
Açıklamalar
Teşekkürler
İş bizim laboratuar Ulusal Sağlık Enstitüleri hibe tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Glutaraldehyde, 70% | Sigma-Aldrich | G7776 | Store at -20°C |
| 3-APTMS (3-Aminopropyltrimethosysilane 97%) | Sigma-Aldrich | 281778 | Store at room temperature |
| SurfaSil Siliconizing Fluid | Thermo Fisher Scientific, Inc. | 42800 | Store at room temperature |
| NHS (N-hydroxysucinimide Ester) | Sigma-Aldrich | A-8060 | Store at 4°C Replace monthly |
| Albumin, bovine serum, essentially fatty acid free | Sigma-Aldrich | A6003-100G | Store at 4°C |
| Coverslips (25mm) | Fisher Scientific | 12-545-86 25 Cir 1D | |
| Coverslips (18mm) | Fisher Scientific | 12-545-84 18 Cir 1D |
Referanslar
- Beattie, D., Xu, C., Vito, R., Glagov, S., Whang, M. C. Mechanical analysis of heterogeneous, atherosclerotic human aorta. J Biomech Eng. 120, 602-607 (1998).
- Bernini, G. Arterial stiffness, intima-media thickness and carotid artery fibrosis in patients with primary aldosteronism. J Hypertens. 26, 2399-2405 (2008).
- Boonyasirinant, T. Aortic stiffness is increased in hypertrophic cardiomyopathy with myocardial fibrosis: novel insights in vascular function from magnetic resonance imaging. J Am Coll Cardiol. 54, 255-2562 (2009).
- Discher, D. E., Janmey, P., Wang, Y. L. Tissue cells feel and respond to the stiffness of their substrate. Science. 310, 1139-1143 (2005).
- Duprez, D. A., Cohn, J. N. Arterial stiffness as a risk factor for coronary atherosclerosis. Curr Atheroscler Rep. 9, 139-144 (2007).
- Lee, R. T. Prediction of mechanical properties of human atherosclerotic tissue by high-frequency intravascular ultrasound imaging. An in vitro study. Arterioscler Thromb. 12, 1-5 (1992).
- Levental, K. R. Matrix crosslinking forces tumor progression by enhancing integrin signaling. Cell. 139, 891-906 (2009).
- Paszek, M. J. Tensional homeostasis and the malignant phenotype. Cancer Cell. 8, 241-254 (2005).
- Samani, A., Zubovits, J., Plewes, D. Elastic moduli of normal and pathological human breast tissues: an inversion-technique-based investigation of 169 samples. Phys Med Biol. 52, 1565-1576 (2007).
- Wells, R. G. The role of matrix stiffness in regulating cell behavior. Hepatology. 47, 1394-1400 (2008).
- Pelham, R. J., Wang, Y. -. L. Cell locomotion and focal adhesions are regulated by substrate flexibility. Proc. Natl. Acad Sci USA. 94, 13661-13665 (1997).
- Klein, E. A., Yung, Y., Castagnino, P., Kothapalli, D., Assoian, R. K. Cell adhesion, cellular tension, and cell cycle control. Methods Enzymol. 426, 155-175 (2007).
- Klein, E. A. Cell-cycle control by physiological matrix elasticity and in vivo tissue stiffening. Current Biology. 19, 1511-1518 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır