Method Article
Embriyonik Fare Hipokampal ve Kortikal nöronlar primer Nucleofection ve Kültür
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, elektroporasyon ve kültür fare ve kortikal hipokampal nöronlar aracılığıyla transfect incelemek için gerekli adımları özetliyor. Kısa vadeli kültürleri, uzun vadeli kültürler sinaptogenez ve dendritik omurga analiz çalışmaları için kullanılabilir akson akıbet ve rehberlik çalışmaları için kullanılıyor olabilir.
Özet
Kortikal ve hipokampal nöronlar, merkezi sinir sistemi (MSS) nöronal kutuplaşma, akson / dendrit akıbet ve sinaps oluşumu ve işlevi incelemek için yaygın olarak kullanılmaktadır. Kültür, bu nöronların bir avantajı çok düşük yoğunluklarda iki boyutlu bir substrat üzerinde kolayca, farklı akson ve dendritler oluşturan, kutuplanma. Bu özellik, nöronal gelişimi birçok yönlerini belirlemek için son derece yararlı yaptı. Ayrıca, bu nöronlar glial klima sağlayarak, fonksiyonel sinaptik bağlantıları kurma ve kültür birkaç ay kalan geliştirmeye devam edecektir. Bu protokolde incelemek için teknik, kültür ve transfect embriyonik fare hipokampal ve kortikal nöronların anahat. Transfeksiyon nucleofection yoluyla kaplama önce nöronların içine DNA electroporating tarafından gerçekleştirilir. Bu protokol geliştirme (~ 4-8 saat sonra kaplama) polarizasyon, akson üremeyi ve dallanma sırasında proteinlerin dinamikleri ve fonksiyon çalışma erken floresan etiketli füzyon proteinleri ifade avantajı vardır. Biz de önce bu tek transfeksiyon kaplama nöron (kültür> 2 ay) ömür boyu görüntüleme için uygun seviyelerde floresan etiketli füzyon proteini ifade koruduğunu keşfetti. Böylece, bu metodoloji nöronal fonksiyonu çok az veya hiç kesinti ile merkezi sinir sistemi gelişimi boyunca protein yerelleştirme ve fonksiyon çalışmak için yararlıdır.
Protokol
1. Lameller ve Odalar hazırlanması
- Temiz lamelleri ve odaların hazırlanması, sağlıklı kültürler için esastır. Kısayollar bu adımların herhangi alınmamalıdır.
- Gecede özel bir cam kavanoz ya da beher konsantre nitrik asit (HNO3) - lamelleri (Carolina Yardımcısı Marka 12mm veya 22mm yuvarlak, Alman cam) yıkayın.
- Lamelleri çıkarın ve nitrik asit (5-7x) deiyonize su ile iyice yıkayın.
- Laminer akış başlığı veya biyogüvenlik kabini lamelleri ve kuru ayırın. Kuru, 30 dakika UV ışık ile sterilize edin. Lamelleri sterilize depolama için steril bir petri kutularının içine yerleştirin. 12mm lamelleri kaplama nöronlar doğrudan steril bir 35mm çanak lamelleri yeri ve Bölüm 2 geçin.
- Görüntüleme odaları, 15mm delik 35mm petri kutularının altında bir bütün çapak kaldırmak delme ve parafin ve vazelin 3:1 karışımı ile temizlenmelidir lamelleri takılarak tarafından inşa edilmiştir.
- Parafin / vazelin karışımı kaynayan su banyosu içinde konik bir tüp içinde eritin. Küçük bir boya fırçası ve 15mm delik etrafında çanak alt kat kullanın. Parafin / vazelin karışımı karıştırarak ayrı olarak tutmak için emin olun. Bu genellikle yemekler inkübatör yerleştirilir lamel dekolmanı, viskoz olacak vazelin daha yüksek bir konsantrasyon, birlikte yapıştırılmış odaları sonuçlanır. Kalan parafin / vazelin oda sıcaklığında saklanabilir.
- Düz bir tepsi üzerine ters çanak aşağı yerleştirin ve üzerine lamel deliğe yerleştirin. Isı 80 ° C fırında parafin karışımı eriyene kadar (~ 10 dakika). Düz bir yüzeye yemekleri çıkarın ve parafin karışımı ayarlamanıza izin.
- Bulaşıkları ters çevirin ve UV ışığı ile kapakları ve odalarının dipleri içi hem de sterilize edin.
- Kat lamelleri veya odaları 1.0mg/mL bir saat borat tamponu (pH 8.5, 0.1M sodyum borat) Poly-d-lisin (30kDa) ile cam bölgeleri. 3-5 kez bol miktarda doku kültürü notu deiyonize su ile durulayın. Borat tamponu tüm izlerini silmek için emin olun. Kuru ve hemen veya daha sonra kullanmak üzere saklayın odaları / lamelleri kullanabilirsiniz. Biz genellikle, bir ay içinde hazırlık temizlenir lamelleri kullanın.
2. Nöronal Diseksiyon ve Kültür Orta hazırlanması
- Diseksiyon orta (DM), 10x HBSS ve 100X Hepes uygun miktarlarda doku kültürü sınıf su ekleyerek hazırlayın. 4 ° C saklayınız Diseksiyonu sırasında buz üzerinde tutun.
- Diseksiyonu bir gün önce, kaplama, orta (PM) ve serum serbest orta (SFM) hazırlar. PM Neurobasal Orta, B27 takviyesi, 2 mM glutamin,% 0.3 glikoz, 37.5 mM NaCl ve% 5 fetal sığır serumu (FBS) oluşur. SFM Neurobasal Orta, B27 takviyesi, 2 mM glutamin,% 0.3 glikoz ve 37.5 mM NaCl oluşur.
- Kap ile bir gecede inkübatör biraz aralık orta equilibrates sıcaklık ve CO 2 içeriği bu sadece bir doku kültürü diseksiyon ve mağaza için yeterli olun. Biz ekstra glikoz ve NaCl ile yaklaşık 310mOsm osmolalitesi artırmak. Kültürler daha fizyolojik osmolalitesi (Neurobasal osmolalitesi genellikle 205-245mOsm) daha iyi bulabilirsiniz.
3. Uzun vadeli Kültürler Kortikal Glial Besleyici Layer Hazırlık
- Uzun vadeli kültürleri hazırlanan edilecekse, kortikal ve hipokampal diseksiyonları devam protokol 2-3 hafta önce bu bölümü gerçekleştirin.
- MEM ile orta glial (GM),% 0.3 glukoz, penisilin / streptomisin ve% 10 at serumu hazırlayın.
- 5 dakika buz üzerinde soğutma P1-P3 fare yavrularının Euthanize. % 70 etanol ile buz ve sprey her yavru çıkarın. Makas ile hızlı bir şekilde işten çıkarmak. Soğuk DM (adım 2.1) içeren bir çanak tüm beyin çıkarın.
- Iki serebral hemisferlerin ve meninks çıkarın. Vergi neokorteks ve herhangi bir ortam içeren yeni bir çanak kaldırmak. Toplam 4 beyinleri korteks hazırlayın.
- Mümkün olduğunca iyi, temiz, steril bir jiletle korteks Kıyma ve soğuk DM 12 ml içeren 50 ml konik tüp plastik bir pipet ile doğranmış doku kaldırmak. Son konsantrasyonları için sırasıyla% 0.25 'lik (1.5 mL) ve% 0,1 (1,5 ml), tripsin ve DNaz ekleyin. Aralıklı dönen 10 dakika süreyle 37 ° C'lik su banyosunda inkübe edin.
- Kortikal doku içeren tüp çıkarın ve doku kültürü kaputu içine getirmeden önce% 70 etanol ile iyice temizleyin. 10 ml pipet ile pipetleyin kortikal doku yukarı ve aşağı yaklaşık 10-15 kat kadar veya en parçaları kaybolur.
- Aralıklı dönen başka bir 10 dakika boyunca bir su banyosunda 37 ° C tüp dönün.
- % 70 etanol ile tüp iyice temizleyin ve doku kültürü kaputu geri getirmek. 5 m ile pipetleyin kortikal doku yukarı ve aşağıL pipet yaklaşık 10-15 kat kadar veya parçaları kaybolur.
- 15 ml sıcak GM ve 10 dakika 200xg (1000rpm) santrifüj ekleyin.
- Süpernatant atın, 20 ml taze GM pelet hücreleri tekrar süspansiyon haline getirin ve bir hemasitometre ile sayar. GM 75cm 2 şişesi ortalama 15 ml Plaka 5-7.5x10 6 hücre.
- Bir gün ve her kültür sonraki 2-3 gün sonra, elinizi karşı balon vurma gevşek hücreleri yerinden. Herhangi bir yerinden hücreleri ile birlikte orta çıkarın ve 15 ml taze GM ile değiştirin.
- Yaklaşık% 70-100 konfluent glia, matara büyüme 1-2 hafta sonra hasat edilebilir. Glia ile kaplanmış bireysel lamelleri hazırlamak için küçük bir boya fırçası ile bir üçgen desen, yer 6 nitrik asit, 3 nokta her lamel üzerine parafin / vazelin 3:1 karışımı temizlenir ve 10cm çanak 25mm yuvarlak lamelleri steril ve yer . UV ışık ile 30 dakika süreyle açık yemekleri davranın. Kat lamelleri 0.1 mg / ml borat tamponu Poly-d-lisin (30kDa), bir saat sonra (3-5x) steril doku kültürü notu deiyonize su ile iyice yıkayın ve kurumaya bırakın.
- Inkübatör glial içeren şişeyi çıkarın, orta atmak ve önceden ısıtılmış tripsin / EDTA çözeltisi 5 ml ile durulayın. Tripsin / EDTA çözeltisi şişeden çıkarın ve balonun içine taze önceden ısıtılmış tripsin / EDTA 3 mL pipetle. Az 1 dakika süreyle 37 ° C trypsinization durdurmak için 5 ml GM eklemeden önce şişeyi inkübe edin.
- 10-15 kez pipetleme tekrarlanan balon glia çıkarın ve sonra 15 ml konik tüp medya transfer. 8 dakika 200xg (1000rpm) Santrifüj. Süpernatantı ve lamelleri içeren 10cm çanak başına GM 12.5 ml 10 ml GM, sayısı hücreleri, ve plaka 5x10 5 hücre eklemek.
- Taze önceden ısıtılmış GM 2-3 günde bir orta Alım Satım. Nöron diseksiyonu bir gün önce, GM kaldırmak ve SFM (bölüm 2.2) ile değiştirin. Kortikal ve hipokampal kültürleri sel adım 4.12 Bu glial klimalı SFM kullanın.
4. Kortikal ve / veya Hipokampal Diseksiyon ve Elektroporasyon
- Nucleofection çözümleri (Lonza) uygun miktarlarda çıkarın, diseksiyon başlamadan önce, birleştirmek ve oda sıcaklığına kadar sıcak. Kombine edildiğinde Nucleofection çözüm sınırlı bir ömrü olduğundan, biz sadece her hazırlığı (transfeksiyon başına 100 mcL) için gerekli miktarı birleştirir.
- CO 2 (fiş gün E0.5) E15.5 hamile bir fare Euthanize ve 10cm petri rahim kaldırmak. Soğuk DM (bölüm 2.1) fetus ve başını kesmek çıkarın.
- Soğuk DM ayrı bir kapta içine tüm beyin çıkarın ve bükülmüş bir tungsten iğne ile, hem de neocortices kaldırmak. Soğuk DM yeni çanak içine microforceps ve yer korteks meninksler çıkarın. Küçük bir iris veya Wecker makas, soğuk DM 1.0 ml ile dolu bir 1.5 ml Eppendorf tüp korteks ve hipokampus ve yer çıkarın. Bu tüp buz tutun.
- Tüm korteks veya hippocampi diseksiyon sonra, 20 dakika boyunca 37 ° C inkübatör doku ve yer tüp içeren Eppendorf tüp% 2.5 tripsin 110 mcL ekleyin.
- Supernatant ve yıkama korteks veya hippocampi yavaşça tersine Eppendorf tüp ile 1,0 mL PM (bölüm 2.2) ile çıkarın. PM 1 ml tüp içinde bırakarak, yıkama iki kez tekrarlayın.
- P1000 bir pipet yardımıyla parçaları 15 kez Karışım ve Eppendorf tüp kalmasını parçaları bırakarak, 4 mL PM içeren yeni bir 15 ml konik tüp / supernatant hücreleri çıkarmak.
- 7 dakika fren off 20xg (350rpm) 15 ml tüp Spin. Süpernatantı atın ve her transfeksiyon için önceden karıştırılmış, oda sıcaklığında nucleofection solüsyonu (Lonza) 100 mcL ekleyin. P1000 pipet yukarı ve aşağı yumuşak bir hareket ile 5 kez Karışım.
- Her yeni Eppendorf tüp nucleofection çözüm / hücre karışımı 100 mcL çıkarın ve uygun miktarda DNA ekleyin. Uzun vadeli kültürleri için DNA transfeksiyon ortalama 1-2μg kullanmak. Ancak, bu etiketler kültür küçük bir nöron <% 10 oranı. Biz genellikle kısa süreli kültür için daha yüksek transfeksiyon verimliliği istiyorsanız transfeksiyon başına DNA 5-10μg kullanabilirsiniz. Iki farklı plazmid transfecting 40μg DNA toplam kadar kullandık. Plazmidler mcL / 1μg TE tampon saklanır.
- Hücre süspansiyon / DNA küvet (Lonza) ekleyin ve Program O-005 (Fare MSS nöronlar) kullanarak Nucleofector (Lonza) hücrelerin electroporate.
- Hızlı çalışma, küvet, önceden ısıtılmış ve dengelenir PM 500 mcL ekleyin ve çözüm / yeni bir 1.5 ml Eppendorf tüp hücreleri çıkarmak. Her transfeksiyon hacmi 1,0 mL getirmek için yeterli. Uzun vadeli kültürlere genç kültürleri, ya da 5-10x10 3 hücre / cm 2 için 3-5x10 3 hücre / cm 2 hemasitometre ve plaka ile hücre sayımı
- Kısa vadeli kültürleri, sel ısındı, 2.0 mL, kaplama bir saat sonra CO 2-dengelenmiş SFM ile 35mm kültür yemekleri. Lamelleri kullanarak, bir buçuk PM kaldırmak ve SFM ile değiştirin, daha sonra iki kez daha tekrarlayın. Ya görüntüleme odaları sel ya da çok düşük serum içeriği (<% 0.5) lamelleri yıkama sonuçlarını. Kısa vadeli kültürler glial besleyici bir tabaka ile kültür olması gerekmez ve yeniden beslenen gerekmez.
- Uzun vadeli kültürleri için, parafin / vazelin üç nokta içeren bir glia kaplı lamel kaldırmak ve 35mm çanak 15mm delik, bir saat sonra ilk kaplama üzerine ters. İki mililitre glial çanak klimalı SFM sonra görüntüleme odasına eklenir. Uzun vadeli kültürleri beslemek için, her 2-3 günde bir SFM üçte birini kaldırmak ve taze, önceden ısıtılmış ve CO 2-dengelenmiş SFM ile değiştirin .
5. Temsilcisi Sonuçlar:
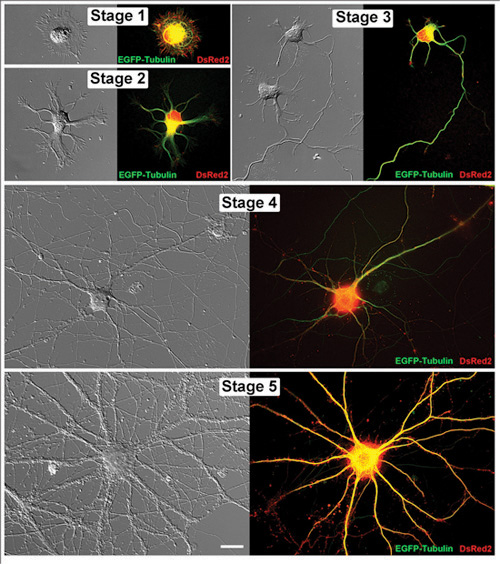
Şekil 1. Hipokampal nöronlar yaşayan temsilcisi hipokampal nöron gelişimi izleyen evrelerini yaşıyor. Eşleştirilmiş görüntüleri diferansiyel paraziti kontrastlı görüntü ve karşılık gelen bir floresan mikrografı olarak gösterilir. Bu hücrelerin her biri pCAX vektörler EGFP tubulin ve DsRed2 transfekte olmuştur. Sahne 1 (1DIV), Aşama 2 (1DIV) 3 (2DIV), Sahne, Sahne 4 (11DIV) ve Sahne 5 (32DIV): nöronlar in vitro olarak aşağıdaki gün (DIV) görüntülenmiştir. Ölçek çubuğu 20μm.
Tartışmalar
Bu protokol, sıçan nöronlar 1,2 kullanan Banker protokolü, bir değişiklik olarak kültür embriyonik hipokampal ve kortikal fare nöronları için geliştirilmiştir . Biz de 3,4,5,6,7 olarak kültür fare ve hamsteri nöronlar için bu protokolü kullanılır. Bu protokol, hem hipokampal ve neokortikal nöronlar için eşit derecede iyi çalışır ve Meberg ve Miller 8 tarafından yayınlanan bir protokol benzer . Genel olarak, iyi karakterize edilmiş ve daha oturmuş bir model sistem çünkü biz uzun vadeli bir kültür hipokampal nöronlar. Dahası, neokorteks daha nöronların daha homojen bir nüfus bulunma olasılığı vardır. Ancak, aynı zamanda hayatta kalma ve benzer ayırt (yayınlanmamış veri) neokortikal nöronların bu protokolü kullanarak kültür. Biz kısa vadeli kültürü için rutin neokortikal ve hipokampal nöronlar kullanın. Neokorteks diseksiyonu da Batı Örneğin, blot için malzeme daha iyi bir seçim yapar hipokampal diseksiyon (hippocampi çifti başına 2.5x10 5 nöronlar) göre önemli ölçüde daha fazla nöron (korteks çifti başına 1.5x10 6 nöronlar) sonuçlanır.
Herhangi bir birincil kültürü ile gibi, hayvanın ölüm hücreleri kaplama için gereken zamanı en aza indirmek için çok önemlidir. Genellikle, diseksiyon ve kaplama sürekli hızlı olmak için 10-20 diseksiyonları alacaktır. Ayrıca, nucleofection tampon bırakılırsa nöronların canlılığı hızla azalır Lonza Nucleofector çalışırken, elektroporasyon prosedürü sırasında hızlı çalışması için çok önemlidir.
Toplam iç yansıma floresan mikroskobu (TIRFM) görüntüleme ile yapılır. Mikroskopi Bu tür lamel ötesinde görüntüleme birkaç yüz nanometre sadece yeteneğine sahiptir. Bu nedenle, sık sık resim, aksonal büyüme konisi ve dendritik dikenler, lamel doğrudan uyulması nöronlar alanlarında ihtiyaç duyduğu. Böylece, uzun vadeli kültür glial besleme gerektiren düşük yoğunluklu kültürleri kullanın. Biz uzun vadeli kültürler için, glial besleyici katmanlar olmadan, (2x10 4 hücre / cm 2) yüksek yoğunluklu kültürler kullanılan ve az beslenme ile birlikte çok iyi hayatta. Geniş alan mikroskobu veya konfokal mikroskobu ile kolaylıkla tespit edilebilir rağmen, bu nöronların dendritik dikenler, kimi zaman çok uzak substrat TIRFM görüntü.
Çalışmaların çoğunda kaplama önce nöronların transfect ve kültürde üç ay için floresan etiketli proteinlerin görüntülü var. Bu uzun vadeli bir ifade floresan etiketli proteinlerin DNA (1 2μg) düşük konsantrasyonlarda kullanılarak nöronların aşırı ekspresyonu eserler üreten değil bize güven veriyor. Ancak, bu yordamı da, yüksek miktarda DNA kullanılması halinde (10-20μg) protein aşırı ekspresyonu incelemek için kullanılan olabilir. Biz de DsRed2 ya da tek başına EGFP nöron sitoplazma etiketi rağmen, nöronların transfect için kullandığınız plazmid genellikle EGFP veya mCherry füzyon proteinleri içeren. Bu vektörlerin sayısı elektroporasyon tekniği ile çalışır. Biz CMV geliştirici ve β-globin ile β-aktin organizatörü içeren plazmid tercih poli-ifade nispeten yüksek düzeylerde nedeniyle kuyruk (pCAGGs veya pCAX plazmid) 9, ve nöronlar tarafından iyi tolere olduğu gerçeği hem kısa ve uzun vadeli bir kültür. Genellikle, proteinler, kaplama yaklaşık 4 saat içinde ifade ve 10-24 saat 10 içinde görüntüleme için yeterli düzeyde ulaşmak için başlar . Biz kısa vadeli kültürlerde CMV organizatörü odaklı plazmid başarıyla kullanılır, ama uzun vadeli kültür nöronları öldürmeye aşırı ekspresyonu yüksek düzeyde neden olabilir bulduk. Bununla birlikte, düşük yoğunluklu kültürlerin glial klima, yüksek yoğunluklu (non-glial beslenen) kültürler karşılaştırıldığında, CMV organizatörü tahrik plazmid transfekte nöronların hayatta yardımcı olduğunu bulduk.
Açıklamalar
Teşekkürler
Tüm işlemler, Wisconsin Komitesi Hayvan Bakım Üniversitesi tarafından onaylanan ve NIH kurallar ile uyumlu idi. Biz onu Nucleofector cihazın cömert kullanımı için Dr. Katherine Kalil teşekkür ederim. Biz, protokol hakkında yorum yapmak için Dent laboratuvar üyeleri de teşekkür ederim. Bu çalışma, hibe NIH R01-NS064014 Dana Vakfı ve Whitehall Vakfı EWD için tarafından desteklenen
Christopher Viesselmann, Jason Ballweg ve Derek Lumbard bu kağıt eşit katkıda bulunmuştur.
Malzemeler
* -80 Saklayın ° C -20 ° C'de saklanabilir ki çoğu reaktif. -80 Saklanması ° C, onların raf ömrünü ve biraz daha tutarlı kültürler sonuçlar uzatır.
Referanslar
- Goslin, K., Asmussen, H., Banker, G., Goslin, K., Banker, G. Chapter 13. Culturing Nerve Cells. , 339-370 (1998).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nat Protoc. 1, 2406-2415 (2006).
- Dent, E. W., Callaway, J. L., Szebenyi, G., Baas, P. W., Kalil, K. Reorganization and movement of microtubules in axonal growth cones and developing interstitial branches. J Neurosci. 19, 8894-8908 (1999).
- Dent, E. W., Kalil, K. Dynamic imaging of neuronal cytoskeleton. Methods Enzymol. 361, 390-407 (2003).
- Dent, E. W. Filopodia are required for cortical neurite initiation. Nat Cell Biol. 9, 1347-1359 (2007).
- Hu, X., Viesselmann, C., Nam, S., Merriam, E., Dent, E. W. Activity-dependent dynamic microtubule invasion of dendritic spines. J Neurosci. 28, 13094-13105 (2008).
- Lebrand, C. Critical role of Ena/VASP proteins for filopodia formation in neurons and in function downstream of netrin-1. Neuron. 42, 37-49 (2004).
- Meberg, P. J., Miller, M. W., Hollenbeck, P. J., Bamburg, J. R. Chapter 7. Neurons: Methods and Applications for the Cell Biologist. , 112-129 (2003).
- Osumi, N., Inoue, T. Gene transfer into cultured mammalian embryos by electroporation. Methods. 24, 35-42 (2001).
- Zeitelhofer, M. High-efficiency transfection of mammalian neurons via nucleofection. Nat Protoc. 2, 1692-1704 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır