Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İskelet Kası Mitokondrial İzolasyon
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, iskelet kaslarının izole edilen mitokondri solunum çalışması için bir prosedür açıklanmıştır. Bu yöntem Scorrano uyarlanmıştır Ve ark. (2007). Mitokondrial izolasyon prosedürü yaklaşık 2 saat gerektirir. Mitokondriyal solunum yaklaşık 1 saat içinde tamamlanabiliyor.
Özet
Mitokondri hücrenin yaşam ve ölüm kontrol organelleri. Bunlar önemli metabolik reaksiyonlarda katılmak, ATP sentezlemek ve şelaleri 2,3 sinyal sayısını düzenleyen. Geçmiş ve mevcut araştırmacılar mitokondri, karaciğer, beyin ve 4,5 kalp gibi sıçan ve fareler dokulardan izole var . Son yıllarda, birçok araştırmacı, iskelet kaslarının mitokondriyal fonksiyon eğitimi üzerine odaklanmıştır.
Burada, iskelet kaslarının 6 mitokondri izolasyonu için başarılı bir şekilde kullanılan bir yöntem açıklanmaktadır. Bizim prosedür Tüm tamponları ve reaktifler taze ve iskelet kası hakkında 250-500 mg ihtiyacınız olduğunu gerektirir. Biz, sıçan ve fare gastroknemius ve diyafram izole edilen mitokondri okudu ve sıçan ekstraoküler kasları. Mitokondrial Bradford yöntemi ile protein konsantrasyonu ölçülür. Mitokondriyal numunelerin hazırlanması sırasında ve fonksiyonel çalışmalar nispeten kısa bir süre (~ 1 saat) içinde yapılmalıdır buz gibi soğuk tutulması önemlidir. Mitokondriyal solunum 37 Clark-tipi elektrot (Oxygraph sistemi) ° C arasında 7 polarografi kullanarak ölçülür. Oksijen elektrot kalibrasyonu bu protokolü önemli bir adım olduğunu ve günlük olarak yapılmalıdır. İzole mitokondri (150 mikrogram) deneysel tamponu (EB) 0,5 ml eklenir. Eyalet 2 solunum glutamat (5mM) ve malat (2.5 mM) eklenmesi ile başlar. Sonra, adenozin difosfat (ADP) (150 mcM) devletin 3 başlatmak için eklenir. Oligomycin (1 mcM), bir ATPaz sentaz bloker, 4 devlet tahmin etmek için kullanılır. Son olarak, karbonil siyanür p [trifluoromethoxy]-fenil-Hidrazon (FCCP, 0.2 mcM) 5 measurestate eklendi veya solunum 6 Kuplajsız. Solunum kontrolü oranı (RCR), devlet 4 devlet (3) oranı, her bir deney sonrası hesaplanır. Bir RCR ≥ 4, geçerli bir mitokondri hazırlık delil olarak kabul edilir.
Özetle, biz, uygulanabilir mitokondrinin biyokimyasal (örneğin, enzim aktivitesi, İmmuno, proteomik) ve fonksiyonel çalışmalar (mitokondrial solunum) kullanılabilir iskelet kaslarının izolasyonu için bir yöntem mevcut.
Protokol
1. Tamponlar hazırlanması
- Santrifüj 5804R açın ve ayarı 4 ° C 37 ° C'ye kadar Isotemp 3006D su banyosu ve set açın
- Kas izolasyon önce aşağıdaki çözümleri hazırlayın:
- PBS: distile su (5 tablet / litre) fosfat tamponlu salin (PBS) tablet eritin. İyice karıştırın.
- PBS artı 10 mM EDTA: 100 ml solüsyon hazırlamak için, 500 mM EDTA 2 ml, 98 ml PBS ekleyin.
- 8X Mitokondri tampon: 10.28 g sakaroz nihai konsantrasyonu 0.6 M, serbest yağ asit 400 mg sığır serum final konsantrasyon% 0.8, 160 mM son bir konsantrasyon için Hepes 2.08 g, pH albumin (BSA) 50 ml distile su ile 7.4 'e ve QS.
- İzolasyon Tampon 1 (IB1): 10, 0,392 için 215 mM son bir konsantrasyon için D-mannitol g, 1.25 ml 8X mitokondri tamponu, pH 7.4 ve QS 10 mM nihai konsantrasyonu 500 mM EDTA 200 ul ekle distile su ile ml.
- İzolasyon Tampon 2 (IB2): 10, 0,392 için 215 mM son bir konsantrasyon için D-mannitol g, 1.25 ml 8X mitokondri tamponu, pH 7.4 ve QS 3 mM nihai konsantrasyonu 500 mM EGTA 60 ul ekle distile su ile ml.
- Deneysel Buffer (EB): son bir konsantrasyon için 5 mM son bir konsantrasyon, D-mannitol 215 mM son bir konsantrasyon için 0.392 gr, 25 ul 2.5 mM KH 2 PO 4 için 500 mM MgCl 2 100 ul ekle 6.25 mcM, 20 mcM nihai konsantrasyonu 100 mM EGTA 2 ul, mitokondriyal tamponu, pH 7.4 'e ve QS 10 ml saf su ile 1.25 ml.
2. Kas İzolasyon
- Bir buz kovası, üç adet 10 ml bardak, Potter-Elvehjem doku öğütücüler ve buz üzerinde aletleri / gereçleri gerekli diğer tüm koydu. Her şey deney boyunca buz kalmalıdır.
- Yapılan ılık su banyosu, buz kovası ve EB IB1 ve IB2 yerleştirin.
- Üç adet 10 ml bardak, aşağıdaki çözümleri eklenmesi gerekmektedir:
- Beher 1: 10 ml PBS
- Beher 2: 10 ml PBS / EDTA
- Beher 3: IB1 3 ml
- Insanca yerel Kurumsal Hayvan Bakım ve Kullanım Kurulu tarafından onaylanan bir sıçan öldürün.
- Hızla, 250-500 mg iskelet kas izole Beher 1 durulayın, daha sonra 2 Beher aktarın.
3. Homojenizasyon / Mitokondrial İzolasyon
- Beher 3 kas transferi ve ince makas ile kas kıyma.
- Potter-Elvehjem homojenizatör çözüm aktarın. Havaneli (her zaman buz tüpü tutarak bir motorlu matkap basın iş yapacak) 10 kez kullanarak kas homojenize.
- 4 10 dakika için 700 g ° C önceden soğutulmuş 2 ml mikrosantrifüj tüpleri ve santrifüj Homojenat transfer
- Supernatant yeni bir ön-soğutulmuş mikrosantrifüj tüpüne aktarın. Pelet atın.
- 4 10 dakika 10.500 g supernatant Santrifüj ° C
- Yeni bir ön-soğutulmuş mikrosantrifüj tüp ve etiket SN1 (süpernatantın 1 numara) ve kas tipi supernatant aktarın.
- IB2, 500 ul pelet yeniden askıya.
- 10.500 g 10 dakika boyunca santrifüjleyin 4 ° C
- Transferi öncesi yeni bir soğuk mikrosantrifüj tüp ve etiket SN2 (süpernatantın 2) ve kas tipi supernatant.
- IB2 100 ul final mitokondriyal pelet askıya alınması.
- Birkaç saniye için minifuge Re-spin son mitokondriyal süspansiyon. Bir pelet varsa, yeni bir ön-soğutulmuş mikrosantrifüj tüp süpernatantı transferi ve pelet atın.
- Bradford tahlil 8 kullanarak protein konsantrasyonu belirleyin.
4. Elektrot Kalibrasyonu
NOT: mitokondriyal izolasyon sırasında Komple elektrot kalibrasyon.
- 250 ml'lik şişesi 100 ml distile su ekleyin. Atmosferik gaz ile su denge sağlaması için 20 dakika kuvvetlice karıştırın.
- Oxygraph elektrot KCl% 50 birkaç damla ekleyin.
- Elektrot Mavi Rizla haddeleme kağıt üstünde küçük bir parça yerleştirin.
- PTFE membran bir parça kağıt inişli üstüne yerleştirin.
- Iç halka halka aplikatör kullanarak uygulayın ve sonra elektrot oluk dış halkası.
- Elektrotlar bağlayın ve teçhizatın geri kalanı monte: büyük plastik halka kaideli, mitokondriyal haznesi ve su hortumları.
- Oxygraph kutuları açın ve Oxygraph yazılımını başlatmak.
- Mitokondriyal odasına dengelenmiş su ekleyin.
- Bar karıştırın ve 60 hız açmak ekleyin.
- Yeni bir deneme başlayın.
- Kalibre üzerine tıklayın ve ardından sıvı faz Kutu 1 kalibrasyon. 37 sıcaklık değişimi ° C ve "Tamam" iki kere tıklamanız yeterli.
- "Tamam" "Override" Değişiklikleri tıklatın ve nitrojen gazı tankının açtığınızda.
- Yeri ucu odasına azot tankına bağlı ve sıfır oksijen kurmak. Cgeçtiğinde, "Tamam" yalamak "geçersiz kılın."
- Aspire su ve mitokondriyal odalarına EB tampon 500 ul eklemek.
- Piston ile Seal odası.
- Birden fazla kutularını kullanarak, tekrar Kutu 2 kalibrasyonu için 11-15 adımları.
5. Mitokondriyal Solunum
- Yeni bir deneme başlayın; sinyali stabilize etmek için yaklaşık 1 dakika çalışmasına izin.
- Her odasında 150 mcg, mark olay için gerekli ses mitokondriyal süspansiyon (adım 3.11) ekleyin ve 1 dakika boyunca çalışmasına izin.
- 10 ul 250 mM/125 sıcak mM nihai bir konsantrasyon için 5 mM/2.5 mM glutamat / malat. Mark ve 1 dakika boyunca çalışmasına izin. Bu durum 2 olarak tanımlanır.
- 150 mcM, işareti nihai konsantrasyonu 10 mM ADP 7.5 ul ekleyin ve 30 saniye boyunca çalışmasına izin. Devlet 3 olarak tanımlanmıştır.
- 10 mM ADP işaretini başka bir 7.5 ul ekleyin ve 1,5 dakika çalışmasına izin.
- 1 mcM, işareti nihai konsantrasyonu 10 mM soğuk oligomycin 0.5 ul ekleyin ve 3 dakika boyunca çalışmasına izin. Devlet 4 olarak tanımlanır.
- 1 ul soğuk 0,1 mM FCCP son bir konsantrasyon için 0.2 mcM, işareti ekleyin ve 3 dakika boyunca çalışmasına izin. Devlet 5 olarak tanımlanır.
- Bittiğinde, deney sonu ve kaydetmek.
- Oxygraph yazılımı kullanarak solunum oranları edinin.
- Normalizasyon faktörü girin: mitokondriyal protein 150 mg eklenmesi, normalizasyon faktörü 0.15 olacaktır.
- Farklı solunum devletler için normalize solunum oranları hesaplayın.
- Devlet Devlet 4 3 bölerek Solunum Kontrol Oranı (RCR) hesaplayın.
6. Temsilcisi Sonuçlar:
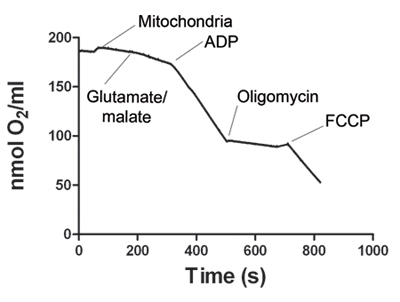
Şekil 1. mitokondri iskelet kasında oksijen tüketimi dayanan bir temsilci gösterir. Elektrot sinyali stabilize edildikten sonra, mitokondri örnek Oxygraph odasına eklenir. Eyalet 2 solunum glutamat ve malat ilavesi ile başlar. ADP Toplama tanımlayan devlet 3 solunum, oksijen tüketimini artırır. ATP sentaz devlet 4 solunum almak için oligomycin ek tarafından bloke edilir. Son olarak, mitokondriyal solunum (devlet 5) birbirinden ayırmak için FCCP eklenir. Tablo 1 devletler 2, 3, 4 ve 5 temsilci oksijen tüketimi oranlarını gösterir. Her bir deney için solunum kontrolü oranı (RCR) hesaplanır. RCR ≥ 4, geçerli bir mitokondri hazırlık delil olarak kabul edilir.
| Devletleri | Normalize Oranları |
| Eyalet 2 | 34,74 |
| Durum 3 | 153,40 |
| Devlet 4 | 16,49 |
| Devlet 5 | 143,70 |
| RCR | 9,30 |
Tablo 1. Mitokondriyal solunum oranları mitokondri iskelet kas Representativeoxygen tüketim oranları. Değerler odasına mitokondri miktarı normalize edilir. Solunum kontrol oranı (RCR), 4 devlet tarafından devlet 3'e bölerek belirlenir. Bir RCR ≥ 4 yaşayabilir bir mitokondri hazırlık dönemini temsil etmektedir.
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Biz iskelet kaslarının canlı mitokondri izole etmek için bir protokol mevcut. Verimi bir sorun ise, protokol, 30 dakika boyunca buz PBS/10mM EDTA/0.01% tripsin 5 ml izole kas kuluçka tarafından değiştirilebilir. Tripsin ile tam bir kas sindirim sağlamak için, kas tam kıyılmış gerekir. 30 dakika inkübasyondan sonra, PBS/10mM EDTA/0.01% tripsin çözüm tamamen izolasyon tampon 1 (IB1) 3 ml ile değiştirilmesi gerekir. Buna ek olarak, tripsin, mitokondriyal solunum protokol sırasında bazı substratlar en...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Teşekkürler
Bu çalışma, FH Andrade Ulusal Göz Enstitüsü (R01 EY12998) bir hibe ile desteklenmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 95% CO2 / 5% O2 mix | Local Gas Supplier | ||
| Adenosine 5′-diphosphate sodium salt | Sigma-Aldrich | A2754 | |
| Blue Rizla Paper | Hansatech | 890101 | |
| Bradford protein assay | Bio-Rad | 500-0006 | |
| Carbonylcyanide p-trifluoromethoxyphenylhydrazone (FCCP) | Sigma-Aldrich | C2920 | |
| Centrifuge 5804R | Eppendorf | ||
| Compressed nitrogen | Local Gas Supplier | ||
| D-mannitol | Sigma-Aldrich | M9647 | |
| Ethlyene-glycol-bis-tetraacetic acid (EGTA) | Sigma-Aldrich | E3889 | |
| Ethylenediaminetetraacetic acid (EDTA) | Bio-Rad | 161-0728 | |
| Free fatty acid bovine serum albumin | Sigma-Aldrich | A8806 | |
| Glutamic acid | Sigma-Aldrich | G5889 | |
| HEPES sodium salt | Sigma-Aldrich | H7006 | |
| Isotemp 3006D | Fisher Scientific | ||
| Magnesium chloride | Sigma-Aldrich | M8266 | |
| Male Sprague Dawley Rats | Harlan Laboratories | 300-500g | |
| Malic acid | Sigma-Aldrich | M9138 | |
| Minifuge | ISC Bioexpress | C1301P | |
| Oligomycin | Sigma-Aldrich | O4876 | |
| Oxygen electrode disc | Hansatech | S1 | |
| Oxygraph | Hansatech | ||
| Oxygraph Plus V1.01 Software | Hansatech | ||
| pH-meter | Mettler Toledo | 1225506149 | |
| Phosphate-buffered saline (PBS) | Sigma-Aldrich | P4417 | |
| Potassium chloride | Sigma-Aldrich | P3911 | |
| Potassium phosphate | Sigma-Aldrich | P8416 | |
| Potter-Elvehjem homogenizers | Fisher Scientific | 08-414-14A | |
| PTFE (0.0125mm × 25mm) membrane | Hansatech | S4 | |
| SKIL 3320 drill press | Hardware store | ||
| Sucrose | Sigma-Aldrich | S5016 |
Referanslar
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle and cultured fibroblasts. Nat Protoc. 2, 287-295 (2007).
- Duchen, M. R. Roles of mitochondria in health and disease. Diabetes. 53, Suppl 1. S96-S102 (2004).
- Johannsen, D. L., Ravussin, E. The role of mitochondria in health and disease. Curr Opin Pharmacol. , (2009).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 80, 3-44 (2007).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 65, 1-35 (2001).
- Gamboa, J. L., Andrade, F. H. Mitochondrial content and distribution changes specific to mouse diaphragm after chronic normobaric hypoxia. Am J Physiol Regul Integr Comp Physiol. , (2009).
- Patel, S. P., Gamboa, J. L., McMullen, C. A., Rabchevsky, A., Andrade, F. H. Lower respiratory capacity in extraocular muscle mitochondria: evidence for intrinsic differences in mitochondrial composition and function. Invest Ophthalmol Vis Sci. 50, 180-186 (2009).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır