Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Diseksiyon ve boyanması Drosophila Larvaların Yumurtalıkların
Bu Makalede
Özet
Nişler ve kök hücre gelişimi sırasında formu nasıl pratik etkileri olan önemli bir soru. Giriş Drosophila Yumurtalık, germ line kök hücreleri ve somatik nişler larva gelişimi sırasında oluşturur. Bu video geç üçüncü instar (LL3) kadın gonadlar, teşrih leke ve monte etmek için nasıl gösterir Drosophila Larvaları.
Özet
Birçok organların embriyogenez sırasında ve yetişkin ömrü boyunca bakım ve onarım için onların gelişimi için kök hücreleri bağlıdır. Onların çevre ile etkileşim kök hücre nasıl form ve nasıl olduğunu anlamak geliştirme, homeostaz ve hastalığı anlamak için bu nedenle çok önemlidir. Meyve sineği Drosophila melanogaster yumurtalık somatik destek hücreleri (niş) 1, 2 germ line kök hücreler (lerin) etkileşim için etkili bir model olarak görev yaptı. Genetik olarak onları manipüle etme yeteneği ile birleştiğinde, niş ve lerin bilinen yerde, araştırmacılar kök hücreleri ve nişler 3-12 arasındaki etkileşimleri çeşitli aydınlatmak için izin verdi.
GSC bakım ve farklılaşma kontrol mekanizmaları hakkında bilgi zenginliği rağmen, nispeten daha az lerin ve somatik nişler gelişimi sırasında formu hakkında bilinmektedir. Olan hücresel bileşenleri terminal filament ve kap hücreleri (Şekil 1), 13-17 sırasında instar üçüncü larva formu somatik nişler, yaklaşık 18. Lerin primordial germ hücrelerinin (PGCs) kaynaklanır. PGCs erken larva aşamasında çoğalırlar, ancak niş oluşumu takip PGCs bir alt lerin 7, 16, 18, 19 olur. Birlikte, somatik niş hücre ve lerin organizmanın ömrü boyunca yumurta üreten işlevsel bir birim.
GSC birim oluşumu ile ilgili birçok soru cevapsız kalmaktadır. Prekürsör hücreler, nişler ve kök hücre öncülleri veya lerin haline PGCs içinde asimetri nesil arasında koordinasyon gibi işlemler en iyi larva incelenebilir. Bununla birlikte, larva yumurtalık gelişme metodik bir çalışma, fiziksel olarak zordur. Birincisi, larva, yumurtalıklar küçük. Geç larva aşamasında bile onlar arasında sadece 100μm. Buna ek olarak, yumurtalıklar, şeffaf ve beyaz yağ vücut gömülü. Burada floresan antikorlar ile boyanarak takip geç üçüncü instar (LL3) Drosophila larvaları, yumurtalıklar izole etmek için bir adım-adım protokolünü açıklar. Biz, gibi sorunlar, yumurtalıkların yerini, lavabo değil doku boyama ve yıkama ve antikorlar doku içine nüfuz emin olun bazı teknik çözümler sunuyoruz. Bu protokol, daha önce larva aşamaları ve larva testisler gibi uygulanabilir.
Protokol
1. Döşeme Yumurta
- Diseksiyonu beş gün önce: 2-4 saat evlendirilen kadın, maya ile desteklenmiş taze gıda yumurtalarını bırakmak için izin verir. Senkronize ve iyi gelişmiş larva almak önemlidir kalabalık değil kültürlü (yaklaşık 30 yumurta / 25mm flakon). Tipik olarak, ne kadar iyi onlar yatıyordu bağlı olarak 7-16 kadın, şişe başına kullanılır.
2. Larvaları seçilmesi
- Ringer orta (128mm NaCl, 2mm KCl, 1.8mm CaCl 2, 4mm MgCl 2, 35.5mM Sakkaroz, 5mM HEPES pH 6.9) ile dolu bir 9-iyi cam diseksiyon tabak hazırlayın.
- Ringer orta ve buz üzerine yerleştirin içeren altı plaka hücre süzgeçler hazırlayın. Alternatif olarak, naylon örgü ile donatılmış özel yapılmış kalıplar kullanın.
- Flakon duvarları ince biyolojik cımbızla (forseps) kullanarak zaman larvaların seçin ve ringer içeren diseksiyon çanak koyun.
- Temiz bir iyi bir kadın larva transferi. Biz kendi gonadlar tarafından erkek kadın ayırt eder. Testislere kolayca yağ vücudun posterior üçte gömülü büyük açık oval olarak tanımlanır. Kadın yumurtalıklar, yağ vücudun aynı kısmında bulunan çok daha küçük, açık, yuvarlak bir küre olarak tespit edilebilir.
3. Larva diseksiyonu
- Forseps ile beyin sadece arka larva tutun ve ikinci bir çift forseps ile baş kaldırmak.
- Trakea aşağı bakacak şekilde, sırt tarafında kalan arka kısmı yerleştirin.
- Forseps bir çift ile arka spiracles larva tutun ve diğer çifti, yaklaşık yarım larva yağ vücut çıkıncaya kadar posteriora manikür sürgülü ise içe doğru yavaşça itin.
- Posterior ucunu sıkıca tutun ve manikür gevşek tutmak için forseps diğer çifti kullanın. Posterior uç ve yavaşça çekmeye aralağından manikür ve bağlı bağırsak slayt böylece. Bu sürecin sonunda, bağırsak ve manikür yağ vücut tamamen ayrılmış olmalıdır. Bağırsakta yağ vücudun ön kısmından ayırın. Boyama ve montaj kolaylaştırmak için, yağ vücut sağlam kalacağını önemlidir.
- Tercihen de içeren disseke larvaları, Ringer orta mera pipet ile iyice ıslatın. Bu katın pipet yardımcı olur ve yağ vücuda yapışmasını önler. Yağlı vücut hücre süzgeç buz Ringer ortama aktarmak için mera pipet kullanın.
4. Fiksasyon ve Boyama
Tüm adımlar 4, ilk antikor ile inkübasyon dışında, oda sıcaklığında yapılır ° C
- Ringer orta% 5 Formaldehit yağ vücut inkübe edin. 20 dakika boyunca yavaşça sallanarak.
- % 1 PBT (% 1 Triton PBS içinde x-100) ile 5 dakika yıkayınız. 10 dakika ve 45 dakika için üçüncü kez bu adımı tekrarlayın. % 1 Triton X-100 larva yumurtalık perfore ve antikorlar nüfuz izin gereklidir.
- Yavaşça sallanarak ile 1 saat boyunca,% 0.3 PBTB (% 0.3 Triton X-100 ve PBS içinde% 1 BSA) Blok
- 4 gece boyunca% 0.3 PBTB seyreltilmiş istenen 1. antikor ° C yavaşça sallanarak ile inkübe edin. Bu adım, genellikle bir rulo 0.2 ml tüpler yapılır.
- Yağ vücut hücre süzgeçler geri aktarın.
- Yavaşça sallanarak ile% 0.3 PBTB ile 3 kez, her biri 30 dakika yıkayın.
- % 0.3 PBTB yavaşça sallanarak ile 1 saat süreyle% 5 normal eşek serum ile takviye ile engelleyin.
- (Üreticisinin teknik verilerine göre) ile 2 saat boyunca yavaşça sallanarak engelleme solüsyonu (% 0.3,% 0.3 PBT% 5 normal eşek serum ile desteklenmiş PBTB) seyreltilmiş uygun bir ikincil antikor ile inkübe edin. Antikor floresan ise, bu noktadan itibaren karanlıkta inkübe edin. Bu adım, genellikle bir rulo 0.2 ml tüpler yapılır.
- 3 kez her yavaşça sallanarak% 0.3 PBT ile 30 dakika yıkayın.
5. Montaj
- Yağlı vücut temiz Eppendorf tüpüne aktarın. Çok dikkatli bir şekilde bütün sıvılar kaldırmak ve hemen Vectashield montaj medya ile kaplayın. Yumurtalıkların yağ vücuttan ayrılmış edilirken sertleşme olmadığından rutin vectashield kullanın.
Bir hafta için numuneler 4 ° C'de montaj medya saklanabilir. - Bir pipet ucu sonunda kesin ve dikkatli bir mikroskop lamı üzerine montaj medya minimal volüm (30mm kapak kayma için 30 ul) ile yağlı vücut aktarmak için kullanabilirsiniz.
- Yağlı vücut yaymak için 0,1 mm çapında pimleri tutarak, iki nikel kaplama pin sahipleri kullanın. Yumurtalıklar yağ vücudun posterior üçte yer almaktadır. Bunları çevreleyen yağ vücut genellikle bir 'çiçek' şeklindedir. Bu yumurtalıkların yerini belirlemenize yardımcı olur. Yağ vücudun geri kalanına 'çiçekler' inceleyin ve ikincisi atın.
- Yağlı vücut surro çıkarındikkatli bir şekilde iki iğne etrafında geçerek gonad unding. Yağlı vücut kalıntı uzak slayt izole gonad yerleştirin.
- Oje ile bir kapak kayma ve mühür ile kaplayın.
- Konfokal bir mikroskop kullanılarak doğrudan gözünüzde canlandırın. Numuneler üç hafta kadar 4 ° C'de muhafaza edilebilir.
6. Temsilcisi Sonuçlar
Lerin ve onların somatik nişler da dahil olmak üzere, somatik yumurtalık içinde birkaç hücre soyları, kurulmasını takip için yukarıdaki protokolünü kullandık. Bu amaçla, gelişmekte olan gonad farklı hücre tipleri ayırt etmek için özel antikorlar ve işaretleri kullanabilirsiniz. Burada antikorların farklı kombinasyonları ile boyanmış iki LL3 yumurtalıkların bir örnek göstermektedir. Şekil 1A birlikte niş somatik hücre oluşturan terminal filament ve kap hücreleri (yeşil), vurgulamaktadır. Şekil 1B, germ hücreleri (mavi) doğrudan temas Puntolu hücreler (IC, macenta) gösterir.
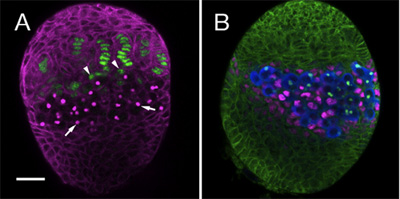
Şekil 1 LL3 yumurtalıklar. (A) monoklonal antikor 1B1 (magenta), somatik hücre ve lekeleri fusome PGCs içinde bir hücre içi organel (oklar) özetlenir. Arttırıcı tuzak ss-lacZ (anti-β-galaktosidaz, yeşil) terminali filamentler olarak ifade edilir. Tabanda filament somatik kap hücreleri (ok başları) görülebilir. (B) 1B1 antikor (yeşil), yumurtalık tüm somatik hücre özetliyor. Anti-Vasa (mavi), tüm PGCs etiketler. PGCs doğrudan Puntolu hücreler (IC, anti-trafik sıkışıklığı, kırmızı) başvurun. Bar (A ve B için) 20 mikron.
Tartışmalar
Bu video geç üçüncü instar larva yumurtalıkların bir izolasyon ve boyama protokolü göstermektedir. Bu protokol rutin ve güvenilir yapmak için, dikkat, aşağıdaki noktalara dikkat edilmelidir:
- Senkronize ve iyi gelişmiş larvalar için, üzerinde kalabalık kaçınılmalıdır.
- Küçük saydam yumurtalıkların kaybını önlemek için, yağ vücut sağlam incelemek için emin olun. Bu aynı zamanda, özellikle (ikinci ya da üçüncü instar başında) genç yumurtalıklar montaj, mo...
Açıklamalar
Teşekkürler
Sohbet Marie Curie yeniden bütünleşme hibe ile desteklenmektedir. Bu çalışma, İsrail Bilim Fonu Hibe No ile desteklenmiştir. 1146-1108, Helen ve Weizmann Bilim Enstitüsü Kök Hücre Araştırma ve Leir Vakfı Martin Kimmel Enstitüsü.
Malzemeler
| Name | Company | Catalog Number | Comments |
| NaCl | JT Baker | ||
| Kcl | Merck & Co., Inc. | ||
| CaCl2 | Sigma-Aldrich | ||
| MgCl2 | Merck & Co., Inc. | ||
| Sucrose | JT Baker | ||
| Hepes | Sigma-Aldrich | ||
| PBS | Sigma-Aldrich | ||
| Triton X-100 | Sigma-Aldrich | ||
| Albumin Bovine Fraction V | MP Biomedicals | 160069 | |
| Dumont biology tweezers 5 dumstar polished | Fine Science Tools | 11295-10 | |
| Nickel plated pin holder | Fine Science Tools | 26018-17 | |
| s.s minutien pins 0.1mm diam, 10mm long | Fine Science Tools | 26002-10 | |
| 9 well plates 85X100 mm, 22mm o.d.x7mm deep | Corning | 7220-85 | |
| Stereo Microscope MZ 16.5 with a standard transmitted light base TL ST | Leica Microsystems | ||
| 6 well plates | Costar | 3516 | |
| Slides | Menzel-Glaser | 798 | |
| Cover slips | Corning | 2940-223 | |
| Mounting media | Vectashield | H-1200 | |
| Cell strainer | Falcon BD | FAL352350 | |
| 1B1 antibody | Developmental Studies Hybridoma Bank | ||
| Anti-Traffic Jam | Laboratory of Dr. Dorothea Godt | ||
| Anti-Vasa | Laboratory of Dr. Ruth Lehmann | ||
| Anti β-Galactosidase | Cappel | ||
| Secondary Antibodies | Jackson ImmunoResearch |
Referanslar
- Fuller, M. T., Spradling, A. C. Male and female Drosophila germline stem cells: two versions of immortality. Science. 316, 402-404 (2007).
- Li, L., Xie, T. Stem cell niche: structure and function. Annual review of cell and developmental biology. 21, 605-631 (2005).
- Chen, D., McKearin, D. Gene circuitry controlling a stem cell niche. Curr Biol. 15, 179-184 (2005).
- Kai, T., Spradling, A. An empty Drosophila stem cell niche reactivates the proliferation of ectopic cells. Proceedings of the National Academy of Sciences of the United States of America. 100, 4633-4638 (2003).
- Kai, T., Spradling, A. Differentiating germ cells can revert into functional stem cells in Drosophila melanogaster ovaries. Nature. 428, 564-569 (2004).
- Lopez-Onieva, L., Fernandez-Minan, A., Gonzalez-Reyes, A. Jak/Stat signalling in niche support cells regulates dpp transcription to control germline stem cell maintenance in the Drosophila ovary. Development. 135, 533-540 (2008).
- Song, X., Zhu, C. H., Doan, C., Xie, T. Germline stem cells anchored by adherens junctions in the Drosophila ovary niches. Science. 296, 1855-1857 (2002).
- Tazuke, S. I. A germline-specific gap junction protein required for survival of differentiating early germ cells. Development. 129, 2529-2539 (2002).
- Xie, T., Spradling, A. C. decapentaplegic is essential for the maintenance and division of germline stem cells in the Drosophila ovary. Cell. 94, 251-260 (1998).
- Xie, T., Spradling, A. C. A niche maintaining germ line stem cells in the Drosophila ovary. Science. , 290-328 (2000).
- Guo, Z., Wang, Z. The glypican Dally is required in the niche for the maintenance of germline stem cells and short-range BMP signaling in the Drosophila ovary. Development. 136, 3627-3635 (2009).
- Wang, X., Harris, R. E., Bayston, L. J., Ashe, H. L. Type IV collagens regulate BMP signalling in Drosophila. Nature. 455, 72-77 (2008).
- Godt, D., Laski, F. A. Mechanisms of cell rearrangement and cell recruitment in Drosophila ovary morphogenesis and the requirement of bric a brac. Development. 121, 173-187 (1995).
- Sahut-Barnola, I., Godt, D., Laski, F. A., Couderc, J. L. Drosophila ovary morphogenesis: analysis of terminal filament formation and identification of a gene required for this process. Developmental biology. 170, 127-135 (1995).
- Song, X., Call, G. B., Kirilly, D., Xie, T. Notch signaling controls germline stem cell niche formation in the Drosophila ovary. 134, 1071-1080 (2007).
- Zhu, C. H., Xie, T. Clonal expansion of ovarian germline stem cells during niche formation in Drosophila. Development. 130, 2579-2588 (2003).
- Ward, E. J. Stem cells signal to the niche through the Notch pathway in the Drosophila ovary. Curr Biol. 16, 2352-2358 (2006).
- Gilboa, L., Lehmann, R. Repression of primordial germ cell differentiation parallels germ line stem cell maintenance. Curr Biol. 14, 981-986 (2004).
- Gilboa, L., Lehmann, R. Soma-germline interactions coordinate homeostasis and growth in the Drosophila gonad. Nature. 443, 97-100 (2006).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır