Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Bir In Vitro Sistem
Bu Makalede
Özet
In vitro sistemi değiştirilmiş 3-D sulandırılmış bazal membran birçok tümör hücre hatlarının büyüme özellikleri tümör hücrelerinin metastatik ikincil site uykuda veya proliferatif davranışı ile ilişkili olduğu In vivo.
Özet
Meme kanseri nüks genellikle kanserin hiçbir belirti bulunduğu uzun bir latent dönem takip ve metastaz primer tümörün çıkarılması ve adjuvan tedavi sonrası uzun yıllar kadar, klinik olarak belirgin hale olmayabilir. Bu olgunun olası bir açıklama, tümör hücrelerinin metastatik siteleri numaralı seribaşı geleneksel tedavilere dirençli ve 1-4 kez uzun süre atıl kalması olduğunu .
Ikincil sitelerde, uykuda kanser hücrelerinin varlığı, ne prolifere ne apoptozis 5-7 geçmesi latent tek kişilik hücrelerinde daha önce açıklandığı gibi olmuştur . Dahası, bu tek kişilik hücrelerinde erken bir aşamada hastalığın ilerlemesi 8-10 primer tümörün yaygınlaştırılması ve hastaların kemik iliği, kan ve lenf düğümleri 1,4,11 büyüme tutuklandı ikamet gösterilmiştir. Bu nedenle, proliferatif bir devlet ya da geçiş dormansi düzenleyen mekanizmaların anlaşılması, hastalığın tekrarını önlemek için yeni hedefler ve müdahaleler keşfetmek için kritik öneme sahiptir. Ancak, mevcut model sistemler eksikliği, metastatik büyüme tümör dormancy den anahtarı düzenleyen mekanizmalar çözülüyor engel olmuştur.
in vivo ve ex vivo tümör hücrelerinin metastatik ilerlemesini çalışma model sistemler daha önce 1,12-14 tarif edilmiştir. Ancak bu model sistemler, gerçek zamanlı ve yüksek kapasiteli metastatik hastalık olarak prolifere yalnız uyuyan tümör hücrelerinin ortaya çıkması ne tetikler bir şekilde mekanistik anlayışlar var. Yakın zamanda (D2A1, MDA-MB-231, K7M2) ya da uyuyan (D2.OR, MCF7, K7M2-AS.46) veya proliferatif metastatik davranış sergileyen hücreler in vivo büyüme özellikleri modeli in vitro sistemde 3D geliştirdik in vivo olarak. 3-boyutlu (3D) bazal membran ekstraktı (BME) kültüre, metastatik bir yerinde in vivo dormansi sergi tümör hücrelerinin in vivo metastatik hücreler son derece değişken sonra kolayca 3D kültür prolifere ise, latent kalır, ama nispeten daha kısa olduğunu göstermiştir sükunet, dönemleri. Daha da önemlisi, in vitro model sistem 3D kullanılarak biz ilk defa ECM kompozisyon uykuda tümör hücrelerinin proliferatif durumuna geçer ve in vivo çalışmalar 15-17 doğruladı olmadığını düzenlenmesinde önemli bir rol oynadığını göstermiştir. Bu nedenle, bu raporda açıklanan model sistem model tümör dormansi in vitro yöntem sağlar ve mikroçevresinin kaynaklanan proliferatif büyüme geçiş çalışma.
Protokol
1. Hücre kültürü uyuyan ve metastatik tümör hücre hatları bakım
- Dulbecco'nun Modifiye Kartal Orta (DMEM) yüksek glukoz ve% 10 fetal sığır serumu (10 cm kültür plakaları uykuda (D2OR / MCF7/K7M2-AS.46) ve metastatik tümör hücrelerinin (D2A1 / MDA-MB-231 / K7M2) büyütün FBS) ve antibiyotikler. Hücrelerin% 70-80 izdiham ulaştıklarında, aşağıdaki testleri geçin.
2. 3D BME sistemi atıl (latent) ve metastatik (prolifere) tümör hücreleri hücre proliferasyonu tayininde kültür
3D sistemi atıl / metastatik hücreler Kültürleme
- Tahlil yapılmadan önce, 4 çözülme Cultrex büyüme faktörü azaltılmış Bodrum Membran Extract (BME) ° C buzdolabında bir gece. BME her zaman buz üzerinde ele alınmalıdır.
- Ertesi gün, 96 plaka laminar kaput içinde buz bir tepsi yerleştirin. Buz BME bir şırınga ile bir dağıtıcı kullanarak 50-100μl Coat her yanı. Kuyularda kabarcıklar oluşur emin olun. 30 dakika boyunca 37% 5 CO 2 ile nemlendirilmiş bir inkübatör BME ile kaplı 96 plaka ° C yerleştirin.
- Bu arada uyuyan veya metastatik tümör hücrelerinin (Bölüm 1 hazırlanan) medya aspirat. Kültür plakaları, 10 ml fosfat tuzlu su, ph 7.4 (PBS) tamponlu ile durulayın. PBS ve eklemek 2ml tripsin 37 ° önceden ısıtılmış ° C, kültür plakaları aspire. 37 2 nemlendirilmiş bir% 5 CO plakaları ° C'de, 5 dk.
- 5ml% 10 FCS ve antibiyotikler ile desteklenmiş DMEM yüksek glikoz içeren 15 ml konik tüp hücreleri transferi ve hücreleri saymak.
- 5 dakika boyunca oda sıcaklığında, 1500g bir hızda bir doku kültür santrifüj kültüre toplam hücre sayısı aşağı spin. Analizlerde incelenmek üzere, her bir hücre hattı ya da zaman noktası / 2x10 3 hücre hazırlamak. Ancak, bu kullanılan hücre hatları bağlı olarak değişebilir.
- Süpernatantı dikkatlice aspire. Not Çoğu durumda, pelet görünmez. Bu nedenle, bazı medya geride bırakın. Bir tek hücre süspansiyonu elde olduğundan emin olmak için parmaklarınızı konik tüp 15ml alt dokunun. DMEM ile desteklenmiş antibiyotikler ile düşük glukoz ile pelet yeniden askıya% 2 FCS +% 2 BME (testi medya). 100 test medya ul her 2x10 3 hücreler için ilave edilmelidir. 5ml pipet yardımıyla tek bir hücre süspansiyonu muhafaza edilmesini sağlamak için hücrelerin birçok kez Karışım.
- Plaka hücre karışımı 100μl başına 96 BME kaplı plaka üstüne. Arka plan değerlendirme (bölüm 2.8) ek 100μl plaka başına 96 iyi BME kaplı plaka üstüne sadece tahlil medya için. 37 nemlendirilmiş bir% 5 CO2 inkübatör kültürlü 96 kuyucuğu inkübe ° C. Hücreler test medya ile her 4 günde bir yeniden beslenen olmalıdır.
Silahların Yayılmasını Önleme tahlil:
- Hücrelerin çoğalması tahlil: istenilen zamanda kuyuların eklemek Hücre titresi 96 sulu Bir Çözüm Hücre Çoğalması tahlil kiti 20 ul işaret ediyor. 2s için nemlendirilmiş bir% 5 CO2 inkübatör 37 ° C'de inkübe edin. 490nm bir Elisa Plaka Okuyucu kayıt absorbans kullanma. Hücre titresi 96 sulu Bir Çözüm Hücre Çoğalması tahlil kiti, BME ile kuyu öncesi kaplamalı arka plan değerlendirme ve çıkarma için 20μl ekleyin ve sadece tahlil medya ile kaplamış. Elisa Plaka Okuyucu kayıt absorbans 490 nm dalga boyunda kullanılması.
3. Ve / veya metastatik (prolifere) uykuda (latent) tümör hücrelerinin tümör hücrelerinin hücre sinyal molekülleri Immunofluorescent boyama
Immunfluorescence boyama 3D sistemi kültür uykuda / metastatik hücreler
* Aşağıdaki protokol Debnath J ve ark 18 tarafından yayınlanan bir 3D kültür protokolü bir değişiklik.
- BME bölüm 2.1 'de açıklandığı gibi hazırlayın. Ertesi gün: 8 oda cam slayt sistemi laminar kaput içinde buz bir tepsi. 200μl Pipetman kullanarak buz soğuk BME 50ul Coat her yanı. BME yayılır ve kuyulardan kabarcıklar oluşur emin olun. 20 dakika süreyle 37 2 nemlendirilmiş bir% 5 CO BME ile kaplı 8 odasının cam slayt ° C yerleştirin.
- Bölüm 1 ve bölüm 2.3-2.4 açıklandığı gibi kültür hazırlamak Hasat uykuda veya metastatik hücreler. 15 ml konik bir tüp içinde kültür hücrelerinin toplam sayısı toplayın. Biz, incelenmek üzere her hücre dizisi ve zaman noktası için / 5 x10 3 hücreleri hazırlarlar . 5 dakika boyunca oda sıcaklığında, hücrelerin doku kültürü santrifüj 1500g bir hızda dönerler. Supernate dikkatlice aspire. Not pelet görünmez olduğunu, bu nedenle bazı medya geride bırakmak. Tek bir hücre süspansiyonu elde olduğundan emin olmak için parmaklarınızı konik tüp 15ml alt dokunun.Tahlil medya pelet yeniden askıya aldı. Test medya 400μl her 5x10 3 hücreler için ilave edilmelidir. 5ml pipet ile hücreleri birçok kez Karışım. Bu adım, tek hücre süspansiyonu muhafaza edilmesini sağlamak için çok önemlidir.
- BME ile kaplı 8 odaların her birinin üstüne başına iyi hücre karışımı Plaka 400μl. 37 nemlendirilmiş bir% 5 CO2 inkübatör kültürlü 8 odaları cam slayt sistemi inkübe ° C. Hücreler test medya ile her 4 günde bir yeniden beslenen olmalıdır.
Immünofloresan boyaması:
- İstenilen zaman noktalarında, medyanın üst tabakası aspire ve% 4 Paraformaldehit (PFA),% 5 sakkaroz ve% 0.1 Triton X-100 içeren fiksatif 200μl ekleyin ve 5 dakika oda sıcaklığında inkübe edin. Fiksatif aspire ve oda sıcaklığında 25 dakika süreyle% 5 sakkaroz ve inkübe içeren% 4 PFA 200μl ekleyin.
- Fiksatif aspire fosfat eklemek 400 ul her kuyuya tamponlu salin (PBS). Oda sıcaklığında 10 dakika inkübe edin. PBS aspire ve 400 μ PBS oda sıcaklığında 10 dakika süreyle% 0.05 Tween 20 içeren ekleyin.
- % 10 eşek serum ya 200μl ile veya oda sıcaklığında 1 saat için% 3 (kullanılmak üzere bir çözüm, her bir birincil antikor için ampirik olarak tespit edilmelidir engelleme) BSA ile sabit hücreler engelleyin.
- Engelleme çözüm aspire ve primer antikor 200μl (seyreltme için ampirik olarak kullanılmak üzere her birincil antikor tespit edilmelidir). % 10 eşek serum engellemek için ise% 10 eşek serum primer antikor seyreltilir ya da% 3 BSA engelleme çözümü ise% 3 BSA primer antikor sulandırmak. 4 gece primer antikor ile inkübe ° C.
- Antikor aspire 400μl PBS ile 15 dakika boyunca kuyulardan yıkayın ve iki kez tekrarlayın. PBS aspire ve rodamin kırmızı (seyreltme ampirik olarak tespit edilmelidir) anti-ilgili-IgG konjuge eşek 200μl eklemek için alüminyum folyo ve oda sıcaklığında 1 saat inkübe 8 odasına slayt kapsayacak.
- 400μl PBS (Her yıkamadan 3x15 dakika) kuyular yıkayın. Aspire PBS. VECTASHIELD DAPI orta montaj monte edilmiştir. Karanlık oda sıcaklığında 40 dakika Kuru slaytlar. Slaytlar 4 ° C'de 1 hafta süreyle saklanabilir Slaytlar karanlıkta saklayın. Resim mikroskopisi slaytlar.
4. Temsilcisi Sonuçlar:
Şekil 1A 3D kültür uykuda D2.0R ve metastatik D2A1 tümör hücrelerinin çoğalması analiz bir örnek gösterilmiştir. Ise yüksek metastatik D2A1 hücreleri sadece 4-6 gün sonra hızla artmaya başlar uykuda kalır D2.0R hücreler, tüm deneysel, 14 günlük kültürü dönem boyunca (latent) uykuda. Prolifere olmayan diğer hücreleri çok hücresel parçacıklarının formu ise; uykuda ilk aşamasında, birçok hücre (Günde 4 Şekil 1B) 3-GE kültürü yalnız kalır. 3-GE kültürü proliferatif devletin atıl D2A1 hücreleri (Şekil 1B, 12 gün) geçiş hücre morfolojisi dramatik değişiklikler ile ilişkilidir. Bu nedenle, bu testte ne faktörü test etmek için kullanılır / s onların uykuda devlet ortaya atıl D2.0R hücreleri tetikleyebilir ve ne faktörü / s, hareketsiz duruma geçiş D2A1 hücreleri engelleyebilir. Şekil 2, bir ajanın bir örnektir uyuyan bir proliferatif devlet geçiş D2A1 hücreleri engeller. Şekil 2'de gösterildiği gibi, miyozin hafif zincir kinaz (ML-7) belirli bir inhibitörü ile D2A1 hücre tedavileri, atıl bir durumda D2A1 hücreleri sürdürdü .
3D sistemi kültür uyuyan ve prolifere olan tümör hücrelerinin sinyal Hücre hücre sinyal molekülleri için immünofloresan boyama ile incelenebilir. Şekil 3'te gösterildiği gibi, aktin stres lifler (yeşil boyama) oluşturan f-aktin filamentler reorganizasyonu ile takip D2A1 hücreleri (kırmızı boyama) miyozin hafif zincir fosforilasyon önemli bir artış dormancy den geçiş (1-4 gün) sırasında oluşur. proliferasyon (7 gün). Ancak, shRNA ya da belirli bir ilaç (ML-7) D2A1 hücre miyozin hafif zincir kinaz aktivitesini bloke D2A1 atıl bir durumda hücreler ve miyozin hafif zincir fosforilasyon ve f-aktin stres fiber organizasyonu (Şekil 4) inhibisyonu sonuçları korur.
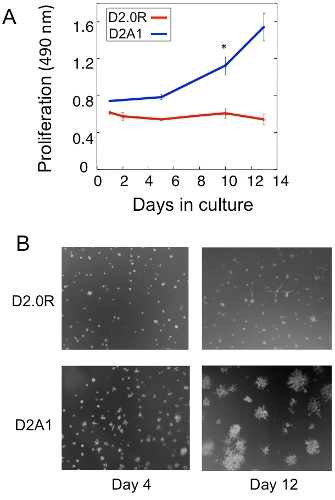
Şekil 1 soliter tümör hücre dinlenmesi ve metastatik büyümeye geçiş çalışma in vitro model. A) 3-D Cultrex BME uykuda D2.0R ve metastatik D2A1 Silahların Yayılmasının Önlenmesi, n = 8 (ortalama ± SE). Üç deneyleri (* p ≤ 0.05) Temsilcisi sonuçlar. B) D2.0R ve D2A1 hücreleri Işık mikroskobu görüntüleri, 3-D Cultrex BME büyütme x20 kültüre .Şekil 17 Barkan et al değiştirilmiş.
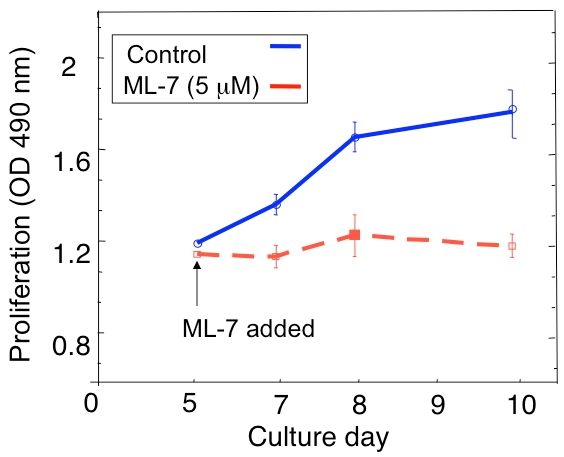
Şekil 2. Dormansi (sessizliğini) D2A1 hücrelerin çoğalma miyozin hafif zincir kinaz (MLCK) inhibisyonu 3D kültür sistemi geçiş önlenmesi. 3-D Cultrex BME n kültür D2A1 hücre proliferasyonu ders = 8 (ortalama ± SE). Hücreler (kontrol) tedavi edilmemiş ya da belirli bir MLCK inhibitörü (ML-7, 5 mcM) ile tedavi edilen kültür 5 gün 48 saat başında. Şekil 17 Barkan et al değiştirilmiş.
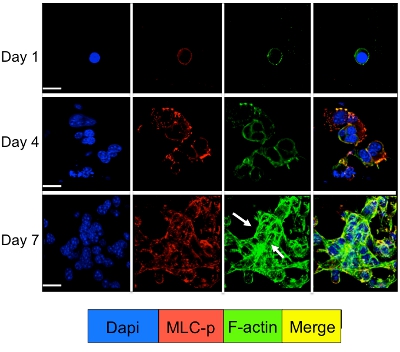
Şekil 3. F-aktin yeniden yapılanma ile miyozin hafif zincir fosforilasyon dormancy den D2A1 hücrelerin proliferatif büyüme geçiş sırasında izledi. 8 oda cam slayt D2A1 hücreleri 3-D Cultrex BME kültüre edildi. Hücreleri sabit ve nükleer lokalizasyonu için DAPI (mavi), f-aktin Phalloidin (yeşil) ve çeşitli zaman noktalarında belirtildiği miyozin hafif zinciri (MLC-p) (kırmızı), fosforile formu karşı bir antikor ile boyandı. F-aktin ve MLC-p boyama (sarı) Birleştirme. MLC-p İfade dormansi (gün1 4) D2A1 hücreleri aktin stres lif oluşumu (oklar) takip proliferatif büyüme (7 gün) geçiş sırasında arttı. Mikroskopisi, büyütme X63. Beyaz çubuğu, 20 mikron eşittir. Şekil 17 Barkan et al değiştirilmiş.
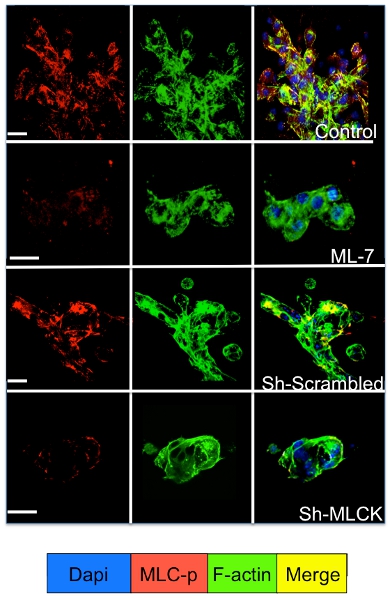
Şekil 4. Kültür günde 48 saat başında, miyozin hafif zincir kinaz (MLCK) D2A1 hücreler aracılı f-aktin stres lif oluşumunu inhibisyonu D2A1 Hücreler (kontrol) tedavi edilmemiş, ya da MLCK (5 mcM ML-7) için inhibitörleri ile tedavi edilen 5 ya da şifreli veya MLCK shRNA ile tedavi ve miyozin hafif zinciri (MLC-p) (kırmızı), f-aktin (yeşil) ve çekirdekleri (mavi) fosforile formu için boyanmış. F-aktin ve MLC-p boyama (sarı) Birleştirme. Mikroskopisi, büyütme X63. Beyaz çubuğu, 20 mikron eşittir.
Tartışmalar
Tümör hücrelerinin metastatik büyümeye geçiş sönmüş bir devlet ya da sonucu dissemine korumak altında yatan mekanizmaları büyük ölçüde bilinmemektedir kalır. Bu fenomen, insan hasta 4,12 ve birkaç preklinik modellerde bu sorunu çözmek için geliştirilmiştir çalışma için son derece zor olmuştur . Bununla birlikte, in vivo ve ex-vivo tümör dormansi için model sistemler (1,12 gözden) karakterize edilmiştir. Ancak, tümör dormansi in vivo mod...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Bu araştırma, Ulusal Kanser Enstitüsü İntramural Araştırma Programı tarafından kısmen desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktifin Adı | Şirket | Katalog numarası | Yorumlar |
|---|---|---|---|
| DMEM yüksek glukoz | Invitrogen | 11965-118 | |
| DMEM düşük glikoz | Invitrogen | 11885-092 | |
| Fetal sığır serumu (FBS) | Invitrogen | 10091-148 | |
| Büyüme faktörü azaltılmış 3-D Cultrex Bodrum Membran Özü | Trevigen Inc. | 14-15mg/ml arasında protein konsantrasyonu | |
| D2.0R ve D2A1 hücre hatları | 5,19 | ||
| K7M2 ve K7M2AS1.46 hücre | 20 | ||
| MCF-7 ve MDA-MB-231 meme kanseri hücrelerinin | ATCC | ||
| Bir 8 odasının cam slayt sistemi | (Lab-TEK, Thermo bilimsel) | 177402 | |
| Hücre titresi 96 sulu Tek Çözüm hücre proliferasyonu tahlil kiti | Promega | G3580 | |
| VECTASHIELD DAPI ile orta montaj | Vektör Laboratories Inc. | H-1200 | |
| Normal eşek serum | Jackson ImmunoResearch | 017-000-121 | |
| Elisa Levha Reader | Bio-Tec | Kayıt 490nm | |
| Konfokal mikroskop | Zeiss-EKK-510 | Büyütme X63 |
Referanslar
- Aguirre-Ghiso, J. A. Models, mechanisms and clinical evidence for cancer dormancy. Nat Rev Cancer. 7, 834-846 (2007).
- Pantel, K., Woelfle, U. Micrometastasis in breast cancer and other solid tumors. J Biol Regul Homeost Agents. 18, 120-125 (2004).
- Naumov, G. N. Ineffectiveness of doxorubicin treatment on solitary dormant mammary carcinoma cells or late-developing metastases. Breast Cancer Res Treat. 82, 199-206 (2003).
- Klein, C. A. Framework models of tumor dormancy from patient-derived observations. Curr Opin Genet Dev. , (2010).
- Naumov, G. N. Persistence of solitary mammary carcinoma cells in a secondary site: a possible contributor to dormancy. Cancer Res. 62, 2162-2168 (2002).
- Townson, J. L., Chambers, A. F. Dormancy of solitary metastatic cells. Cell Cycle. 5, 1744-1750 (2006).
- Chambers, A. F., Groom, A. C., MacDonald, I. C. Dissemination and growth of cancer cells in metastatic sites. Nat Rev Cancer. 2, 563-572 (2002).
- Pantel, K. Differential expression of proliferation-associated molecules in individual micrometastatic carcinoma cells. J Natl Cancer Inst. 85, 1419-1424 (1993).
- Demicheli, R. Tumour dormancy: findings and hypotheses from clinical research on breast cancer. Semin Cancer Biol. 11, 297-306 (2001).
- Braun, S. A pooled analysis of bone marrow micrometastasis in breast cancer. N Engl J Med. 353, 793-802 (2005).
- Pantel, K., Alix-Panabieres, C., Riethdorf, S. Cancer micrometastases. Nat Rev Clin Oncol. 6, 339-351 (2009).
- Goss, P. E., Chambers, A. F. Does tumour dormancy offer a therapeutic target. Nat Rev Cancer. 10, 871-877 (2010).
- Mendoza, A. Modeling metastasis biology and therapy in real time in the mouse lung. J Clin Invest. 120, 2979-2988 (2010).
- Naumov, G. N. A model of human tumor dormancy: an angiogenic switch from the nonangiogenic phenotype. J Natl Cancer Inst. 98, 316-325 (2006).
- Barkan, D. Metastatic growth from dormant cells induced by a col-I-enriched fibrotic environment. Cancer Res. 70, 5706-5716 (2010).
- Barkan, D., Green, J. E., Chambers, A. F. Extracellular matrix: A gatekeeper in the transition from dormancy to metastatic growth. Eur J Cancer. , (2010).
- Barkan, D. Inhibition of metastatic outgrowth from single dormant tumor cells by targeting the cytoskeleton. Cancer Res. 68, 6241-6250 (2008).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30, 256-268 (2003).
- Morris, V. L. Mammary carcinoma cell lines of high and low metastatic potential differ not in extravasation but in subsequent migration and growth. Clin Exp Metastasis. 12, 357-367 (1994).
- Khanna, C. The membrane-cytoskeleton linker ezrin is necessary for osteosarcoma metastasis. Nat Med. 10, 182-186 (2004).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır