Method Article
FM Boyalar Kültür Serebellar Granül Nöronlar Synaptic veziküllü Havuzu Yenileme Kantitatif Analiz
Bu Makalede
Özet
Merkezi sinir terminallerine ikmal ve belirli sinaptik vezikül (SV) havuzları seferberlik ölçmek için canlı bir floresan görüntüleme tekniği açıklanmıştır. SV geri dönüşüm iki tur bir iç kontrol sağlayan aynı sinir uçlarında izlenir.
Özet
Merkezi sinir uçlarında nörotransmitter yayımlanmasından sonra, SV hızla endositoz alınır. Sonra alındı. SV nörotransmitter ile doldurulabilir ve ekzositoz 1,2 SV olarak tanımlanan, geri dönüşüm havuzu, geri dönmek. Kolayca açıklanmaması havuzu (RRP) ve rezerv havuzu (RP) - geri dönüşüm havuz, genellikle iki ayrı havuza ayrılmıştır. Isimlerinin ima ettiğin gibi, RRP RP SV yoğun stimülasyonu 1,2 sırasında yayımlanan hemen füzyon için kullanılabilir olduğunu SV oluşur. 1) anlamak için bu SV havuzları diferansiyel ikmal raporlar güvenilir bir tahlil olması önemlidir. SV endositoz farklı modlar sonra trafik (clathrin bağımlı endositoz ve aktivite bağımlı toplu endositoz) ve 2) mekanizmalarının nasıl RRP ve RP hem de farklı uyaranlara tepki olarak seferber kontrol.
FM boyalar rutin olarak kullanır.ed kantitatif merkezi sinir terminallerine 3-8 SV ciro rapor etmek. Membranlar boyunca çift katlı lipid geri dönüşümlü bölümleme sağlar hidrofobik hidrokarbon kuyruk ve hidrofilik bir başı grup engelleyen geçit var. Boyalar, biraz sulu çözeltisi floresan, ancak membran 9 bölümlenmiş kuantum verimi önemli ölçüde artırır . Böylece FM boyalar aktif SV geri dönüşüm izleme için ideal bir floresan probları. FM boya kullanımı için standart bir protokoldür. Önce nöronlar uygulanır (Şekil 1) endositoz sırasında alınır. Olmayan içselleştirilmiş boya geri dönüşüm havuz içinde plazma membranı, geri dönüşümlü SV yeniden dağıtma yıkanıp sonra. Bu SV sonra boşaltma uyaranlara (Şekil 1) kullanarak tükenmiş. SV FM boya etiketleme quantal 10 olduğundan, ortaya çıkan floresans damla piyasaya veziküller miktarı ile doğru orantılıdır. Böylece, SV, geri dönüşüm ve füzyon pr eldeendositoz evious yuvarlak güvenilir bir şekilde belirlenebilir.
Burada, iki ek bilgi unsurları elde etmek için modifiye edilmiş bir protokol mevcut. Öncelikle, sıralı boşaltma uyaranlara farklı ölçümü belirli SV havuzları ikmal izin vermek için RRP ve RP boşaltmak için kullanılır. İkincisi, her sinir terminal protokolü iki defa uğrar. Böylece, bir iç kontrol sağlayan, aynı sinir terminal S1 yanıt S2 faz (Şekil 2) bir test maddenin varlığına karşı karşılaştırılabilir. SV geri dönüşüm farklı sinir uçları arasında 11 dereceye kadar oldukça değişken olduğundan bu önemlidir.
Herhangi yapışık birincil nöronal kültürlerin bu protokol için kullanılan olabilir, ancak kaplama yoğunluğu, çözümleri ve stimülasyon şartları, serebellar granül nöronların (CGNs) 12,13 için optimize edilmiştir .
Protokol
1. Serebellar Granül Nöron Hazırlık
- Otoklav yaklaşık 100 25 mm çapında lamelleri (Tablo 1).
- Poli-D-lizin steril solüsyon (Tablo 2) içeren 50 ml steril tüp yerleştirin lamelleri. Kat lamelleri 2 saat için dönen bir platform üzerine yerleştirin.
- Laminer akış kaputu steril kağıt mendil Kuru kaplı lamelleri (Tablo 1).
- Kullanmadan önce, steril 6 kuyucuğu ve sıcak bir CO 2 inkübatör (Tablo 1). Lameller içine yerleştirin lamelleri 4 ° C'de 1 ay boyunca saklanabilir .
- Yerel etik komite kurallarına göre yavru 7 gün eski Sprague Dawley sıçan Euthanize. Biz servikal dislokasyon kullanarak yavrular ötenazi.
- Beyincik inceleyin ve tuzları çözüm tamponlu (B çözeltisi, Tablo 3) bir fosfat içeren steril bir petri yerleştirin.
- 4-6 sıçan yavrular için 1.5 ve 1.6 adımları tekrarlayın.
- Cerebella sonra bir McIlwain Doku Cho steril sahne üzerine yerleştirilenpper (Tablo 1). Doku, 90 ° ile sahneye dönen ve aynı işlemi tekrarlayarak önce 375 mikron aralıklarla doğranmış.
- 37 önceden ısınmış olan bir tripsin çözümü (çözüm T, Tablo 4) ° C doğranmış cerebella aktarılır
- Inkübe cerebella az 37 ° C yavaşça sallanarak yaklaşık her 5 dk ile 20 dk.
- Triptik sindirim sırasında alev cilası, üç steril cam pipetler (Tablo 1) Bunsen alevi kullanarak. Alev ilgili ağızlarını pipetler ince bir delik, orta delik ve geniş bir delik oluşturmak için kullanın.
- Çözüm T 20 dakika inkübasyondan sonra, bir masa üstü santrifüj 1 dakika (Tablo 1) 1.000 g serebellar süspansiyon ve pelet hücreleri için 20 ml (çözüm B, Tablo 5), bir tripsin / DNaz inhibitörü çözüm ekleyin .
- Süpernatantı Durusu ve geniş delik pipet kullanarak konsantre tripsin / DNaz inhibitörü (C çözeltisi, Tablo 6) 1,5 ml hücre pelletini tekrar süspansiyon haline getirin.
- Ilk geniş delik pipet kullanarak hücrelerin Karışım, daha sonra orta çap ve nihayet hücre süspansiyonu kadar dar delik homojen Bu önemli bir adım, bu aşamada süspansiyon homojen olmalıdır.
- 10 ml üst katman hücre süspansiyonu prewarmed (37 ° C) 15 ml steril bir tüp içinde sığır serum albümin takviye Earles Dengeli Tuzlar Çözüm (Tablo 7).
- Az 5 dakika boyunca 1.500 g süspansiyon Santrifüj ve tekrar süspansiyon prewarmed 2 ml hücre pelletini (37 ° C) kültür vasatı (Tablo 8).
- Tahmini bir haemocytometer kullanarak hücre sayısı (Tablo 1) ve son bir ml'de 3.3 x 10 6 hücre yoğunluğu hücre süspansiyonu seyreltik.
- Hücreler hücre süspansiyonu 75 ul poli-D-lizin kaplı lamelleri (son yoğunluğu 2.5 x 10 5) merkezi ekleyerek kaplanmıştır.
- Lamelleri içeren kültür plakaları hücrelerin bir izin için 60 dakika CO 2 inkübatör yerleştirilirdhere.
- Her kaplama hücreleri de rahatsız ve CO 2 inkübatör kültür plakaları dönmek için özen içine kültür ortamı 1.5ml ekleyin.
- Ertesi gün mitoz inhibitörü sitozin arabinozid (Tablo 8) ile desteklenmiş taze kültür ortamı ile kültür ortamı değiştirin. Glial hücreler kültürde Bu tutuklamalar çoğalması.
2. Deneysel Kurulum
- Temel deney düzeneği (bkz. Tablo 1 ve kullanılan belirli donanım ve yazılım için 9) aşağıdaki gibidir:
- Tersyüz edilmiş epi-floresan mikroskop
- Soğutmalı CCD kamera
- Floresan ışık kaynağı (monokromatör veya filtre tekerleği)
- Yerçekimi perfüzyon cihazları
- Görüntüleme paralel platin elektrot haznesi
- Elektrik stimülatörü
- Bilgisayar
- Resim toplama yazılımı
- Deneyler karanlık veya kırmızı ışık koşul altında yapılmalıdırörnek en az floresan aydınlatma ile itions beyazlatma FM boya önlemek için.
- Deneyler oda sıcaklığında yapılmaktadır. Fizyolojik sıcaklık gerekiyorsa, ısı kontrollü perfüzyon sistemi kullanılıyor olabilir.
3. Numune Hazırlama
- Kültürler in vitro 8-12 gün sonra kullanılmalıdır.
- Yeni orta ve istikrar sağlamak için oda sıcaklığında 10 dakika tuzlu su solüsyonu (Tablo 10) tek bir lamel aktarın.
- Lamel çıkarın, alt ve küçük bir parça kağıt havlu veya emici kağıt ile ekli hücreleri çevreleyen bölgede kuru.
- Yapıştırıcı, silikon gres (Tablo 2) görüntüleme odasının alt lamel kullanılması. Hücreler iki paralel teller arasında olmalıdır. Yeterli silikon gres banyo odasının merkezine giren herhangi bir yağ haznesi olmadan tamamen sızdırmazlık için kullanılan ancak olmalıdır.
- ~ 260 ul sa ile banyo odasının yavaşça doldurunuzhat çözümü ve daha sonra aynı çözümü ile giriş tüp doldurun.
- Tutkal odasının üst silikon yağ ile temiz bir lamel sızdırmazlık için. Giriş ve çıkış boru, haznesinde sıkışmış olan herhangi bir hava kabarcıkları kaldırmak için kullanılabilir. Elektrik devresi, hava kabarcıkları tarafından kesintiye uğramaz olduğunu önemlidir.
- Paslanmaz çelik bir platformda görüntüleme odasının Immobilise ve yavaşça giriş tüp aracılığıyla serum fizyolojik solüsyonu perfüze sızıntı olup olmadığını kontrol edin.
- Mount ters bir mikroskop sahnede bir araya odasına ve odanın bir ağırlık perfüzyon sistemine bağlanmak, ilk tuzlu su çözeltisi ile giriş astarlanmalıdır.
- Odasının bağlantı kabloları, elektrik stimülatörü takın.
- Bir petrol lens kullanıldığında ise objektif bir damla immersiyon yağı ekleyin. Odanın ortasında parlak bir alan aydınlatma kullanarak hücreleri üzerinde odaklanın.
4. S1 Faz
- 1.5 ml serpmek nöronlartuzlu çözelti içinde seyreltilmiş FM boya (Tablo 2).
- Ekli stimülatörü kullanarak boya alımı uyandırmak için nöronları uyarır.
- Stimülasyon sonra 2 dakika süreyle taze tuzlu su çözeltisi ile serpmek nöronların aşırı FM boya (debisi 7 ml / dak) yıkayın. CGN kültür sistemi Glial kontaminasyon% 5'inden az 14, bu nedenle bu süre boya kaldırmak için yeterli olacaktır .
- 8 dakika dinlenmek için nöronların bırakın.
- Bu süre zarfında, bireysel FM boya yüklü sinir uçları görünür kullanarak floresein dalga boylarında (emisyon> 550 nm eksitasyon ve 480 nm) aksonal ağları bulun. Hücre kümeleri alanlardan kaçının bu aşamada minimum aydınlatma tutun, yoğun uyarım boya fototoksisite neden olabilir. Bunun en belirgin belirtileri, akson ve boya boşaltma eksikliği (sabitleme boya nedeniyle) blebbing .
- Ynt odak görüntü görüntü elde etme hemen önce hafif bir sürüklenme bu yana dinlenme döneminde meydana gelmiş olabilir.
- Time-lapse oranı her 4 saniyede 1 kare görüntü elde etme başlayın
- 5 edinme sonra 10 bazal görüntüleri, 2 s (60 aksiyon potansiyelleri) 8 30 Hz stimülasyon sunarak RRP ekzositoz uyandırmak kare yakalama hemen sonra el stimülasyon başlatın.
- Bir 10 görüntü aldıktan sonra, her biri 30 ayrı 8, 10 s (400 aksiyon potansiyelleri) için 40 Hz üç uyarılara kullanarak RP SV ekzositoz çağrıştırıyor.
- Bir 5 Edinme - 10 görüntüler ve daha sonra duraklama görüntü elde etme.
5. Kurtarma Faz (bkz. Şekil 2)
- Nöronların en az 20 dakika kurtarmak için izin verin.
- İsteğe bağlı - endositoz bir ilacın etkisini test edilecek ise, bu dönemde (Şekil 2b) 3,8 sırasında ilaç solüsyonu ile serpmek nöronlar.
6. S2 Faz
- Aynı alanını kullanarak kontrol deney için S1 faz protokolü (Bölüm 4) tekrarlayın.S1.
- İsteğe bağlı - endositoz bir ilacın etkisini test edilecek ise, FM boya (Şekil 2b) 3,8 ile takviye ilaç solüsyonu ile nöronların serpmek.
- İsteğe bağlı - ekzositoz uyuşturucu etkileri ilgi Alternatif varsa, önce ve RRP ve RP boşaltma uyaranlara (Şekil 2c) 3 sırasında her iki ilaç çözüm serpmek nöronlar.
7. Veri Analizi
- ImageJ ve Microsoft Excel veya veri analizi için benzer bir yazılım kullanın.
- Analizi için, yığın formatında bir görüntü dizisi gereklidir. Bazı görüntüleme yazılımı, tek bir görüntü olarak dizilerini ihraç edebilir. Bu durumda, bir yığın yığını bir ImageJ built-in fonksiyonu Görüntü> Bacalar> Görüntü kullanarak görüntüleri dönüştürmek.
- Dinamik aralık yığının en üst düzeye çıkarmak için parlaklık ve kontrastı ayarlayın. Image> Ayarla> Parlaklık / Kontrast (Şekil 3a).
- T sırasında meydana gelen önemli yatay sürüklenme varsao deney, çalıştırmak StackReg ( http://bigwww.epfl.ch/thevenaz/stackreg/ ) ve TurboReg ( http://bigwww.epfl.ch/thevenaz/turboreg/ ImageJ) eklentileri görüntü yığını (Şekil 3b) hizalamak için .
- Zaman Serisi Analyzer eklentisi (Çalıştır http://rsbweb.nih.gov/ij/plugins/time-series.html ) (Şekil 3c).
- Ilgi (ROI) bölgelerinde en az 90 sinir terminalleri üzerinden tanımlayın. Bu aynı olmalıdır (1.5 mikron çapında dairesel ROI'ler) önce görüntüler arasında geçiş yapmak için yararlı olur ve boya aktif sinir terminalleri (alternatif bir ön-uyarı görüntü stimülasyon sonrası görüntü çıkarılır olabilir) ortaya çıkarmak için boşalttıktan sonra ideal ROI boyutu tipik bir sinir terminali (Şekil 3c) biraz daha büyüktür.
- Tim üzerinde her ROI entegre / toplam floresan alınMicrosoft Excel (Şekil 3b ve 4a) e ve ihracat.
- S1 ve S2 her iki fazda ilk boşaltma uyaran (Şekil 4b-c) için Y-ekseni düzleminde izlerini hizalayarak aynı keyfi değeri ROI izleri Normale Bu, arka planda floresan küçük varyasyonları kontrol etmektir.
- S1 ve S2 (Şekil 4d) aşağıdaki gibi keyfi floresan birimleri her boşaltma uyaran tarafından uyarılmış floresans mutlak azalma ölçün:
- Floresan RRP = Değişim (mesafe kadar taşınmış) 30 Hz 2 s tarafından tetiklenen
- RP = Sum mesafe kadar taşınmış, 3 x 40 Hz 10 s tarafından tetiklenir
- Toplam geri dönüşüm havuz = RRP + RP
- 7.9 her bir ilgili parametre için, tek bir deneyde tüm sinir terminalleri üzerinden ortalama değerini hesaplamak.
- İstatistiksel analiz için, birden fazla bağımsız deneylerde elde edilen değerlerin ortalaması olabilir anlamına gelir. Sayısından daha çok sinir terminalleri lamelleri STATISTICA olarak kullanılmalıdırl n.
8. Temsilcisi Sonuçlar:
Şekil 5 CGNs iki tur aynı yükleme ve boşaltma adımları uygulanan bir kontrol deneyi temsil edilmektedir. Bir dizi deney başlamadan, böyle bir kontrol deneyi, S1 ve S2 S2 sırasında çeşitli deneysel koşullar önce karşılaştırılabilir olduğunu onaylamak için her gün yapılır esastır.
Bu örnekte, CGNs 10 mcM FM1-43 ile 80 Hz 10 stimülasyonu (Şekil 5a) kullanılarak yüklenmiştir. Şekil 5b floresan puncta tarafından temsil FM1-43 yüklenmiş sinir terminalleri gösterir. Şekil 5c gösterildiği gibi ROI'ler 90 sinir terminalleri üzerinden tanımlanmıştır. ROI'ler aynı set, hem S1 ve S2 için kullanılmıştır. Hem de kaldırır sırasında, RRP ilk RP 3 sıralı 40Hz (10 sn) uyaranlara (Şekil 5a) ile boşaltma, 30 Hz (2 saniye) stimülasyon ile kaldırıldı. Her uyaran sırasında floresans düşüş açıkça izlenmiştir (Şekil 5d-e) ve sayısal olarak ifade edilebilir. Bakıldığında, floresan RRP karşılık gelen damlalar, RP ve toplam geri dönüşüm havuzu, S1 ve S2 karşılaştırılabilir. Buna ek olarak% 80, S1 ve S2 hem de RP ikamet ederken,% 20 geri dönüştürülmüş SV RRP ikamet.
Şekil 1 tipik bir FM deneme şematik. A) SV endositoz FM boya (yeşil temsil) varlığı tetiklenir. Boya invaginating membran (tek SV veya toplu endosomes) tarafından alınır. Plazma zarı B) Sigara içselleştirilmiş boya perfüzyon yıkanabilir. C) floresan kaybı ile sonuçlanan plazma zarı ile serbest sigorta için kullanılabilir hale gelmiştir SV etiketli bir boşaltma uyarıcı, başvuru üzerine. D) piyasaya etiketli SV miktarı ile doğru orantılıdır floresans (mesafe kadar taşınmış) değişiklik sonra belirlenebilir.
_upload/3143/3143fig2.jpg "/>
Olası deneysel protokollerin 2 şematik diyagramları Şekil. A) hücreleri, yükleme ve boşaltma (S1 ve S2) FM boya iki tur geçmesi bir kontrol deneyi Akış şeması. Hücreler bir dizi farklı uyaranlar kullanılarak yüklenebilir. Boşaltma adımları 3 kez 10 saniye süreyle 40 Hz kullanarak boşaltma RP takip RRP 2 s için 30 Hz ile boş olduğunu aynı 30 sn ile 40 sn, diğer tüm uyaranlara RRP ve rezerv havuzu boşaltma uyaranlara ayrıldı. Hücreler 20 dakika S1 ve S2 arasındaki kurtarmak için bırakılır. Yatak ya da bir maddenin etkisini test etmek için olası değişiklikler akış şemaları) endositoz veya C) ekzositoz de gösterilir. Ilgili test ilaç, belirtilen süreler içinde odasına perfüze olabilir.
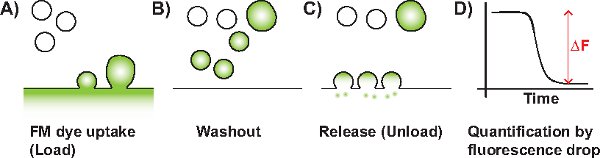
Görüntü J veri analizi Şekil 3 Ekran Ekran.Resim J. kullanarak) parlaklık ve kontrast ayarı, B) çerçeve hizalama, C) ROI seçimi, ve D) yoğunluk değerleri çıkarma
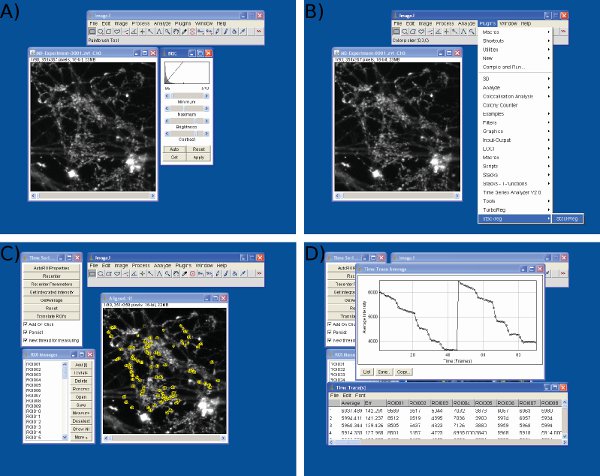
Şekil 4 Ekran, Microsoft Excel veri analizi . = Ekran A) Resim J (1. sütun ham veri almak için gösterilen kare sayısı, tek tek sinir terminallerinden kalan sütunları = veri) B) başında, keyfi bir değere (200) S1 başlangıç değerlerine (çerçeve 10) ayarlanması S1 aynı protokolü kullanarak çerçeve 55 S2 temel değerleri ilk uyaran, C) ayarı, Microsoft Excel kullanarak floresan damla D) ölçümü. D gösterilen ortalama iz her damla önce ve sonra zaman noktaları tanımlamak için kullanılır unutmayın. Her ROI için floresan damla boyutu C'de gösterildiği tablo üzerinde değerler tespit edilmelidir

Şekil 5. Temsilcisi kontrol deneyi. A) CGNs 10μM FM1-43, 80 Hz (10 sn) stimülasyon kullanarak yüklü bir kontrol deneyi Akış şeması. S1 ve S2 aşamaları aynıdır. 30 sn ile 40 sn, diğer tüm uyaranlara RRP ve rezerv havuzu boşaltma uyaranlara ayrıldı. B) sinir terminallerine gösteren bir görüntü FM1-43 ile yüklendi. C) 90 sayılı ROI'ler gösteren B gibi aynı görüntüyü analiz için seçildi. D) B kırmızı bir kutu seçilen zaman noktalarında tarafından tasvir bir alan görüntüler. Stimülasyon önce Bazal = 30 Hz = = 30 Hz 2 s uyarımı sonrası, 40 Hz 1,2,3 her 40 Hz 10 s stimülasyon sonra. Bu görüntüler değişiklikleri floresans (sağda görünen spektrum bar) göstermek için Pseudocolor sunulmaktadır. E) Ortalama ± SEM iz C. Bireysel uyaranlara gösterilen 90 sinir uçları elde edilen yatay çubuklar tarafından temsil edilmektedir. Ölçek bar = 10 mm.
Tartışmalar
FM boyalar yoğun birçok nöronal hazırlıkları sinir terminali fonksiyon araştırmak için kullanılır. Onlar ya SV endositoz, SV ciro veya ekzositoz 6 kinetiği ölçüde izlemek başta olmak üzere istihdam edilmiştir. Açıklanan protokol belirli SV havuzlarının boşaltılması diferansiyel incelemek için bu çalışmalar uzanır. Bu SV havuzlarının yenileme ve aynı zamanda seferberlik ölçüde ilgili ek bilgi sağlar.
FM boyalar aynı sinir terminalleri içinde SV geri dönüşüm birden fazla mermi etiket kullanılabilir. Biz her bir terminal SV ciro aynı sinir uçlarında iki kez takip edilebilir olan protokoller bu özelliği istismar ve tasarladık. Bu paralel sinir terminallerine 11 SV geri dönüşüm heterojen doğası nedeniyle gerekli, doğru bir iç kontrol sağlar. S1 faz bir iç kontrol sistemi olarak kullanımı, Via RRP, RP ve toplam dolumSV pool ilaçların varlığı güvenilir ve doğrudan mukayese edilebilir.
RRP ve RP havuzları, geri dönüşüm mutlak büyüklüğü bilgi vermenin yanı sıra, farklı stimülasyon koşullar altında, bu protokol, ayrıca şunları da veri sağlayabilir - 1) geri dönüşüm havuz bir fonksiyonu olarak RRP ve RP arasında SV, bölümleme S1 ve S2, 2) toplam S1 geri dönüşüm havuz ve 3) S2 S1 aynı havuzun bir fonksiyonu olarak tanımlanmış herhangi bir SV havuzu göreli büyüklüğü bir fonksiyonu olarak S2 havuzları göreceli büyüklüğü (RRP ve RP). Bu özel protokol alma süresi (kinetik ölçümler için satın alma süreleri mümkün ve görüntü yakalamak için senkronize otomatik olarak boşaltma gibi hızlı olmalıdır) çok yavaş olduğundan, ancak boşaltma kinetiği hakkında bilgi vermek olmaz.
30 Hz 2 s uyaranlara hipertonik sakaroz 8 boşaltma RRP özdeş bir ölçüde çağrıştırıyor. RRP boyutu bu yanahipertonik sakaroz boşaltma 15 tarafından tanımlanan, hipokampal nöronların 16 çalışmaları ile anlaşma bu protokol tüm RRP SV kaldırır ifade edebiliriz. Rezerv havuzu, 400 uyaranlara Bu uyarının bu yana (40 Hz 10 sn)% 95, tüm boya etiketli SV tüketir bir paradigma (50 mM KCl ile 2 uyaranlara) benzer bir miktarda boya kaldırır üç trenler neredeyse tamamen tükenmiş 8,17. Doğru kantifikasyon RRP ve rezerv havuzu her iki boyutu da CCD kamera doğrusal dinamik aralık içinde bilgi edinme bağlıdır.
Bu basit bir protokol daha da değiştirilebilir. Yükleme uyaranların gücü de nöronal aktivitenin nasıl ve farklı endositoz modları SV havuzu ikmal etkileyen belirlemek için çeşitli olabilir. Ayrıca, gerekirse iki kür daha fazla yükleme ve boşaltma yapılabilir. Bu protokol transfekte hücreler aşırı ekspresyonu ya da kullanılabilirshRNA vektörler. Birincil nöronal kültürlerin düşük transfeksiyon verimliliği nedeniyle, ifade proteinler floresan proteinleri ile etiketlenmiş olmalıdır. Bu fluoresan etiketleri (örneğin, camgöbeği veya kırmızı proteinler) FM boya sinyal ile müdahale etmediğini esastır. Bu durumda, aynı alanda görüş transfekte ve non-transfekte hücreler sinir uçları, aynı zamanda ek bir kontrol 8 olarak karşılaştırılabilir. Pertürbasyon yüklerin sırasında mevcut olduğundan, bu tür deneylerde, S1 ve S2 yükler arasında yükleme ölçüde bir karşılaştırma çok az değer taşır. SV havuzları arasında boya bölümleme hala ancak 8 görüntülendi olabilir.
Genetik gazetecilere pHluorins primer nöronal kültür SV ekzositoz ve endositoz izlemek için istihdam edilebilir çağırdı. Bu probları VAMP, sinaptofizin ve VGLUT1 18 olarak etiketlenen SV proteinler luminal etki pH ortamı pH duyarlı yeşil flüoresan protein Veziküler ATPaz inhibitörleri ile birlikte kullanıldığında, pHluorins SV havuzu seferberlik 19 kinetiği ve kapsamı hem de rapor edebilirsiniz . FM-boya dayalı bir yaklaşım, burada açıklanan pHluorin tekniği üzerinde bazı avantajları vardır, Öncelikle, FM boyalar SV endositoz modu RRP ve rezerv havuzları 8 takviye yapar hangi bilgileri sağlar . İkincisi özel SV havuzları, 20 farklı spektral özellikleri ve nihayet transfeksiyon için hiçbir gereklilik yoktur FM boyalarla etiketli olabilir . Görülebilmesi için endositoz sırasında boya ile yüklenmesi gerekir beri tanımı SV FM boyalar, dinlenme ve ancak SV havuzları geri dönüşüm (pHluorins 19 kontrast) arasında SV trafik hakkında bilgi sağlayamaz. Böylece FM boyalar ve pHluorins hem de güçlü ve zayıf yanları var ve aynı soruyu adresine bağımsız deneylerde kullanılan en güçlüsüdür.
Yüksek kaliteli görüntüleri, geçerli analiz ve reproducib için gerekli olanle sonuçları. Yatay sürüklenme kolayca düzeltilebilir iken, Z ekseninde bir kayma var deneyler geri alınamaz. Bu nedenle, S1 ve S2 kaldırır başlamadan önce görüntü tekrar odaklanmak için önemlidir. Önemli bir floresan çürüme meydana geldi durumlarda, çürüme düzeltmeler (genellikle stimülasyon yokluğunda FM yüklü hücrelerin önceden kaydedilmiş bir iz çıkarılarak) uygulanabilir. Ancak, herhangi bir kantitatif analiz için kullanılacak grafik gösterimi ve çürüme düzeltme için gerçekleştirildiğini öne sürülmektedir.
Açıklamalar
Biz ifşa etmek başka bir şey var.
Teşekkürler
Bu çalışma, Wellcome Trust (Ref: 084.277) bir hibe ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Isim | Şirket | Hayır Kataloğu. | |
|---|---|---|---|
| AxioCam MRM Rev 3 Dijital Kamera | Carl Zeiss | 4265099901000 | |
| Axio Observer.A1 Mikroskop | Carl Zeiss | 4310040000000 | |
| Hücre kültürü plakaları (6 kuyu) | Greiner biyo-bir | 657160 | |
| Santrifüj (Evrensel 32R) | Hettich Zentrifugen | 1610 | |
| CO 2 inkübatör | Heraeus Aletleri | 51014042 | |
| Falcon tüpleri (15/50 ml) | Greiner biyo-bir | 188271/210261 | |
| Fluar 20X / 0.75 ∞ / 0.17 hedefi | Carl Zeiss | 4401459901000 | |
| Cam lamelleri (25mm) | VWR uluslararası | 631-1584 | |
| Cam pasteur pipetler (230 nm) | Greiner biyo-bir | 612-1799 | |
| Haemocytometer | VWR | 15170-170 | |
| Görüntüleme kamara | Warner | RC-21 BRFS | |
| Laminar akış kapağı | BIOHIT | VLF BHS 1200 | |
| McIlwain Doku Chopper | Mickle Laboratuvar Engineering Co Ltd. | MTC / 2 | |
| Cıva lambası | Carl Zeiss | HBO 103 | |
| MultiStim Sistemi Elektrik Stimülatör (100mV, 1ms pluse genişlik) | Digitimer Ltd. | D330 | |
| Perfüzyon pompası | Watson-Marlow | 313S | |
| Serolojik Pipetler (5/10/25 ml) | Greiner biyo-bir | 606180/607180/760180 | |
| Shutter denetleyicisi | Carl Zeiss | MAC5000 | |
| Şırınga (20 ml) | BD Plastipak | ST01-B002 | |
| Şırınga Filtreler (Minisart - 0.20 mikron) | Sartorius Stedim | 16532 | |
| VC-6 Altı Kanal valf kontrolörü | Warner | 64-0135 | |
| YFP filter seti (46 Set) | Carl Zeiss | 1196-681 |
Tablo 1. Kullanılan özel ekipman ve cihazları
| Isim | Şirket | Hayır Kataloğu. | Konsantrasyon |
|---|---|---|---|
| FM1-43 | BioScience Cambridge | BT70021 | 10 mcM |
| FM2-10 | BioScience Cambridge | BT70044 | 100 mcM |
| Poly-D-lisin | Sigma | P7886 | 15 mg / ml |
| Silikon gres | Sigma | 85403 | - |
Tablo 2. Kullanılan Özel reaktifler
| Isim | Şirket | Hayır Kataloğu. | Konsantrasyon |
|---|---|---|---|
| Sığır Serum Albumin (BSA) | Sigma | A4503 | % 0.3 |
| D-glikoz | Sigma | G5767 | % 0.25 |
| Mg4 SO · 7H 2 O | Sigma | M2773 | 1.5 mM |
| D-PBS | Gibco | 21300 | 960 mg/100 ml |
Her hazırlanması için taze 100ml-
Kullanmadan önce steril filtre
Tablo 3. CGN hazırlık Çözüm B
| Isim | Şirket | Hayır Kataloğu. | Konsantrasyon |
|---|---|---|---|
| Çözüm B | - | - | 19 ml |
| Tripsin (5 mg / ml stok, -20 ° C) | Sigma | T9201 | 1 ml |
Tablo 4. Çözüm CGN hazırlanması için T
| Isim | Şirket | Hayır Kataloğu. | Konsantrasyon |
|---|---|---|---|
| Çözüm C | - | - | 3.2 ml |
| Çözüm B | - | - | 16.8 ml |
Tablo 5. Çözüm W CGN hazırlık için
| Isim | Şirket | Hayır Kataloğu. | Konsantrasyon |
|---|---|---|---|
| Deoksiribonükleaz (DNaz, 0.5 ml hisse başına 500 U, -20 ° C) | Sigma | D5025 | 0.5 ml |
| MgSO 4 · 7H 2 O | Sigma | M2773 | 1.5 mM |
| Çözüm B | - | - | 10 ml |
| Soya tripsin inhibitörü (SBTI, 0.5 ml hisse başına 0.5 mg, -20 ° C) | Sigma | T9003 | 0.5 ml |
Tablo 6. Çözüm CGN hazırlanması için C
| Isim | Şirket | Hayır Kataloğu. | Konsantrasyon |
|---|---|---|---|
| Sığır Serum Albumin (BSA) | Sigma | A4503 | % 4 |
| Earle Dengeli Tuz Çözeltisi (EBSS) | Gibco | 24010 | 10 ml |
| MgSO 4 · 7H 2 O | Sigma | M2773 | 3 mM |
Tablo 7. CGN hazırlanması için EBSS Çözüm
| Isim | Şirket | Hayır Kataloğu. | Konsantrasyon |
|---|---|---|---|
| Sitozin β-D-arabinofuranoside (Ara-C) * | Sigma | C1768 | 10 mcM |
| Fetal Bovine Serum | Gibco | 10106 | % 10 |
| D-glikoz | Sigma | G5767 | 30 mm |
| L-Glutamine | Sigma | G3126 | 2 mM |
| KCl | Sigma | P5405 | 25 mM |
| Minimal Essential Medium (MEM) | Gibco | 21090 | 500 ml |
| Penisilin (P) / Streptomisin (S) | Gibco | 15140 | 100 U / ml (P), 100 mg / ml (S) |
* Ara-C 1 DIV itibaren orta eklenmelidir
Tablo 8. CGN hazırlanması için Kültür Medya
| Isim | Versiyon | Şirket |
|---|---|---|
| AxioVision Rel. | 4,8 | Carl Zeiss |
| ImageJ | 1.42q | Ulusal Sağlık Enstitüleri |
| Microsoft Excel | 2003 | Microsoft |
Tablo 9. Belirli bilgisayar yazılımı kullandı
| Isim | Şirket | Hayır Kataloğu. | Konsantrasyon |
|---|---|---|---|
| CaCl 2 · 2H 2 O | Sigma | C7902 | 1.3 mm |
| Glikoz | Sigma | G5767 | 5 mM |
| KCl | Sigma | P5405 | 3.5 mm |
| KH 2 PO 4 | Sigma | P9791 | 0.4 mm |
| MgCl 2 · 6H 2 O | Sigma | M0250 | 1.2 mm |
| NaCl | Fluka | 71378 | 170 mm |
| NaHCO 3 | Fluka | 71627 | 5 mM |
| Na 2 SO 4 | BDH Laboratuvar Malzemeleri | 10264 | 1.2 mm |
| TES | Sigma | T1375 | 20 mM |
Tablo 10. Tuzlu Çözüm (pH 7.4)
Referanslar
- Rizzoli, S. O., Betz, W. J. Synaptic vesicle pools. Nat. Rev. Neurosci. 6, 57-69 (2005).
- Sudhof, T. C. The synaptic vesicle cycle revisited. Neuron. 28, 317-320 (2000).
- Evans, G. J., Cousin, M. A. Activity-dependent control of slow synaptic vesicle endocytosis by cyclin-dependent kinase 5. J. Neurosci. 27, 401-411 (2007).
- Clayton, E. L., Cousin, M. A. Differential labelling of bulk endocytosis in nerve terminals by FM dyes. Neurochem. Int. 53, 51-55 (2008).
- Clayton, E. L., Evans, G. J., Cousin, M. A. Bulk synaptic vesicle endocytosis is rapidly triggered during strong stimulation. J. Neurosci. 28, 6627-6632 (2008).
- Cousin, M. A. Use of FM1-43 and other derivatives to investigate neuronal function. Curr. Protoc. Neurosci. Chapter 2, Unit 2-Unit 2 (2008).
- Clayton, E. L. The phospho-dependent dynamin-syndapin interaction triggers activity-dependent bulk endocytosis of synaptic vesicles. J. Neurosci. 29, 7706-7717 (2009).
- Cheung, G., Jupp, O. J., Cousin, M. A. Activity-dependent bulk endocytosis and clathrin-dependent endocytosis replenish specific synaptic vesicle pools in central nerve terminals. J. Neurosci. 30, 8151-8161 (2010).
- Betz, W. J., Mao, F., Smith, C. B. Imaging exocytosis and endocytosis. Curr. Opin. Neurobiol. 6, 365-371 (1996).
- Ryan, T. A., Reuter, H., Smith, S. J. Optical detection of a quantal presynaptic membrane turnover. Nature. 388, 478-482 (1997).
- Murthy, V. N., Sejnowski, T. J., Stevens, C. F. Heterogeneous release properties of visualized individual hippocampal synapses. Neuron. 18, 599-612 (1997).
- Tan, T. C. Cdk5 is essential for synaptic vesicle endocytosis. Nat. Cell. Biol. 5, 701-710 (2003).
- Anggono, V., Cousin, M. A., Robinson, P. J. Styryl dye-based synaptic vesicle recycling assay in cultured cerebellar granule neurons. Methods. Mol. Biol. 457, 333-345 (2008).
- Gallo, V. Selective release of glutamate from cerebellar granule cells differentiating in culture. Proc. Natl. Acad. Sci. U.S.A. 79, 7919-7923 (1982).
- Stevens, C. F. Neurotransmitter release at central synapses. Neuron. 40, 381-388 (2003).
- Mozhayeva, M. G. Development of vesicle pools during maturation of hippocampal synapses. J. Neurosci. 22, 654-665 (2002).
- Cousin, M. A., Evans, G. J. O. Activation of silent and weak synapses by cAMP-dependent protein kinase in cultured cerebellar granule neurons. J. Physiol. 589, 1943-1955 (2011).
- Kim, S. H., Ryan, T. A. Synaptic vesicle recycling at CNS synapses without AP-2. J. Neurosci. 29, 3865-3874 (2009).
- Kim, S. H., Ryan, T. A. Cdk5 serves as a major control point in neurotransmitter release. Neuron. 67, 797-809 (2010).
- Groemer, T. W., Klingauf, J. Synaptic vesicles recycling spontaneously and during activity belong to the same pool. Nat. Neurosci. 10, 145-147 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır