Method Article
Canlı Hücre Görüntüleme Bacillus subtilis Ve Streptococcus pneumoniae Otomatik Zaman atlamalı Mikroskopi
Bu Makalede
Özet
Bu protokol, otomatik floresan zaman atlamalı mikroskopi kullanılarak zaman farklı bakteriler tek hücre davranışlarını izlemek için bir adım-adım yordam sağlar. Ayrıca, biz nasıl mikroskobu görüntüleri analiz etmek için yönergeler sağlar.
Özet
Son birkaç yılda bilim adamları mikrobiyal nüfusa dayalı deneylerden elde edilen ortalama veriler tek hücrelerinin davranış, durum veya fenotip temsilcisi olmadığı giderek daha duyarlı hale geldi. Bu yeni anlayış, tek bir hücre çalışmaları sayısı (son değerlendirmeleri için 1,2,3 bakın) sürekli artıyor . Ancak, birçok uygulanan tek bir hücre teknikleri, belirli bir zaman içinde tek bir hücrenin (örneğin, flow sitometri veya standart mikroskopi) gelişimini ve davranışlarını izlemek izin vermez.
Burada, biz, takip eden ve kayıt (floresan), Bacillus subtilis ve Streptococcus pneumoniae birçok nesiller için büyüme ve bölünme yoluyla bireysel bakteri hücrelerinin sağlayan birkaç son çalışmalar 4, 5, 6, 7, kullanılan mikroskop yöntemi ayrıntılı bir açıklama sağlar. Ortaya çıkan film, tek bir ortak atadan kökenli bir nüfus içinde tek bir hücrenin geçmişi geri izleme filogenetik soy ağaçları oluşturmak için kullanılabilir. Bu zaman atlamalı floresan mikroskopi yöntemi sadece tek tek hücrelerin büyüme, bölünme ve farklılaşma araştırmak için değil, aynı zamanda hücre geçmişi ve soy spesifik hücresel davranışı üzerinde etkisini analiz etmek için kullanılabilir. Ayrıca, ideal zaman atlamalı mikroskopi, bakteri hücre döngüsü sırasında, gen ekspresyonu dinamikleri ve protein lokalizasyonu incelemek için uygundur. Bu yöntem, bakteri hücrelerinin hazırlamak ve bir microcolony tek hücre akıbet etkinleştirmek için mikroskop lamı inşa nasıl açıklar. Kısacası, tek hücre, büyür ve bir sıcaklık kontrollü çevre oda içinde bir floresan mikroskop altında bölmek agaroz ile desteklenmiş büyüme orta oluşan bir yarı-katı yüzey fark vardır. Görüntüler belirli aralıklarla yakalanır ve daha sonra, açık kaynak yazılımı ImageJ kullanılarak analiz edilmektedir.
Protokol
1. B. hazırlanması subtilis kültürleri
- -80 Den İnokülasyon hücreleri ° C stokları 10 ml zaman atlamalı mikroskobu (TLM), orta (62 mM K 2 HPO 4, 44mm KH 2 PO 4, 15 mM (NH 4) 2, 4, 6.5 mM sodyum sitrat SO, 0.8 mM MgSO 4,% 0,02 casamino asitler, 27.8 mM glukoz, 0.1 mM L-triptofan, pH 7, gerekirse antibiyotik ile desteklenmiş bir KOH solüsyonu) kullanılarak kurulmuştur.
- Sallayarak balonuna (30 ° C, 225 rpm) geceleme hücreleri büyütün.
- Ertesi sabah, kimyasal olarak tanımlanmış önceden ısıtılmış orta (CDM) (62 mM K 2 HPO 4, 44mm KH 2 PO 4, 15 mM (NH 4) 2 SO 4, 6.5 mM sodyum sitrat, 0.8 01:10 hücreleri sulandırmak mM MgSO 4, 2.2mm glikoz, 2.1 mM L-glutamik asit, 6 mcM L-triptofan, 7.5 mcM MnCl 2, 0,15 x metal karışımı (50x MT içeren karışım stoku (ref 8) hazırlamak: 0.2 M MgCl 2, 70 mM CaCl 2, 5 mM MnCI 2, 0.1 mM ZnCl 2, 0.2 mM tiamin hidroklorür, 2 mM HCl, 0.5 mM FeCl antibiyotik olmadan 3 (son eklemek)).
- B. büyütün orta üstel faz (30 ° C, 225 rpm) subtilis hücreleri. Genellikle, bu yaklaşık dört saat sürer. Hücreleri (bkz. Bölüm 2) orta-üstel faz ulaşmadan da önemlisi, agaroz slayt bir saat hazırlamak.
- Kültür 600Nm (600) absorbansı ölçülür ve yaklaşık 600 CDM kullanarak 0.035 hücreleri sulandırmak. Bu OD uygun boşluklar tek hücre zaman atlamalı mikroskopi için mikroskop lamı üzerine tespit olmasını sağlar.
2. Mikroskop numune hazırlanması (bkz. Şekil 2)
Bir saat önce hücreleri orta üstel büyüme ulaşmak, mikroskop lamı şu şekilde hazırlayabilirsiniz:
- Iki mikroskop cam slaytlar (örneğin Knittel'in Cam, 7.6 x 2.6 cm),% 70 etanol ve su ile temizleyin.
- Bir gen çerçevesi (ABgene; 1.7 x 2.8 cm) ve dikkatli bir gen çerçeve diğer tarafındaki plastik kapağın sökülmesi neden olmadan gen çerçeve plastik folyo birini kaldırmak.
- Bir tırnak kalan gen çerçeve rehberli eki, sadece tek bir tarafına ilk kolaylaştırmak temas cam slaytlar ortasında gen çerçevesi takın. Gen çerçeve cam slayt takarken hava kabarcıklarını engellemek.
- 150 mg (% 1.5) 10 ml CDM yüksek çözünürlüklü düşük erime agaroz (Sigma) çözmek için bir mikrodalga kullanın. Agaroz zaman atlamalı mikroskopi deneyler için gerekli asgari arka plan elde etmek için tam olarak çözülmüş olması gerekir. Gerekirse, şu anda indükleyicisi veya diğer bileşikleri agaroz-CDM takviyesi
- Gen çerçevenin ortasında sıcak agaroz-CDM 500 ul aktarın. (Sınırları) dahil olmak üzere bütün bölgeyi tamamen kapalı olduğundan emin olun.
(2.6 - 2.10) aşağıdaki adımları hızla agaroz-CDM aşırı kurumasını önlemek için yapılması gereken var. - Agaroz-CDM dolu gen çerçeve üzerinde ikinci bir cam slayt yerleştirin. Hava kabarcıklarını önlemek için deneyin. ° C agaroz-CDM yeterince katılaşmaya izin vermek için buzdolabı sandviç slaytlar az 45 dakika süreyle 4 yatay konumda yerleştirin.
- Üst cam slayt dikkatlice kaydırın. Hücrelerin büyümüş olacak, hangi gen çerçevesinde ~ 5 mm genişlik, agar şeritler kesmek için jilet kullanın. Maksimum üç şeritler ~ 4 mm boşluk iki tarafa ayrılmış, slayt başına kullanılabilir. Bu alanlarda B. için gerekli olan hava sağlayacak subtilis büyüme. Dört farklı türlerin zaman içinde takip edilmesi gerekiyorsa, iki şeritler olabilir ve dört küçük kareler sonucu yarıya. Herhangi bir kalıntı katı orta çıkarın.
- Dikkatle gen çerçeve yapışkan tarafını ortaya çıkarmak için gen çerçeve ikinci ve son plastik kapağı çıkarın
- Pipetlemeyin ucu ile dokunmadan katı ortamda tek hücrelerin (1.5 adım) yükleyin. Bütün bir şerit, ya da küçük bir kare için 1 ul 2.5 ul kullanın. Her zaman agaroz pad üstünde başlamak ve sıvı slayt yukarı ve aşağı çevirerek tarafından verilen büyüme alanı eşit dağıtmak için izin verin. Slayt slayt açarken hazır, kısa sürede sıvı kenarları sıvı oluklu ve hareket olarak artık görünür.
- Bir tarafı diğerine gen çerçevesi (hava kabarcıkları önlemek) temiz bir mikroskop lamı kapak kayma (24 x 50 mm) yerleştirin. Parmağınızla gen çerçevesi boyunca kapak astar üzerine basınç uygulayarak tüm bağlantı ve eklentileriyle sağlayın. Kapak kayma onları yeterince uzun kurumasını sağlayan hücrelerin üzerine konur, hücreleri deney sırasında birbirlerinin üstüne büyürler. Ayrıca agaroz sonra çok kuru olacağından, kapak kayma uygulamadan önce çok uzun süre beklemek değil dikkatli olun.
- 1 saat 30 Pre-sıcak slayt ° C Eğer slayt would doğrudan mikroskop (adım 3.1 'e bakın) önceden ısıtılmış çevre odasına yerleştirilen sıcaklık dalgalanmaları Deneyin ilk saatlerde otofokus sorunlara neden olabilir.
3. Time-lapse floresan mikroskobu (Şekil 3 ve Film 1)
- Zamanında Pre-sıcak çevresel odası (elimizde deney başlamadan önce en az 2 saat) Deney başladıktan sonra otomatik odaklama problemleri önlemek için. Gereken süre, ısıtma sistemi ve mikroskop yanı sıra kullanılan çevre odasına bağlıdır.
- Deneme set-up göre uygun objektif, filtreler ve dikroik ayna seçin. Uzun deneyler için ışık kaynağı ve örnek arasında bir UV filtre yerleştirildiğinden emin olun. Ayrıca, eğer mümkünse, ikaz ışığı maruziyeti en aza indirmek için nötral yoğunluk filtreleri kullanarak bazı blok.
Aşağıdaki ekipman (DeltaVision, İngiltere tarafından sağlanan), de Jong ve ark yayınlanan zaman atlamalı mikroskopi deneyleri için kullanılan, 2010 5: IX71 Mikroskop (Olympus), CoolSNAP HQ2 kamera (Princeton Instruments), 300W Xenon Işık Kaynağı, 60x parlak alan objektif (NA 1.25), GFP filterset (Chroma, uyarılma, 470/40 nm'de emisyon 525/50 nm), mCherry filterset (Chroma, uyarılma, 572/35 nm'de emisyon 632/60 nm). Otofokus diascopic ışık kullanılarak ve otofokus rutin mevcut Deltavision Softworx yazılım kullanılarak yapıldı. Bu da Zeiss Kesin Focus, Nikon Mükemmel Odaklama Sistemi ve Leica Adaptif Odaklama Denetimi gibi uygun olan diğer otomatik odaklama sistemleri bir dizi olduğunu belirtmek gerekir.
- Deneme set-up göre deney programı. Bu gerçek deneme öncesinde diğer time-lapse mikroskoplar veya bakteriler için özel yapıları için gerekli ışık miktarını yanı sıra otomatik netleme ayarlarını belirlemek için akıllıca olacaktır. Kısa pozlama süreleri ve uyarma ışık az miktarda beyazlatma ve fototoksisite en aza indirecektir. Otofokus rutin diascopic ışık kullanın.
LED ışık ve 0.05 sn pozlama parlak alan resimler için aşağıdaki ayarları, de Jong ve ark yayınlanan zaman atlamalı mikroskopi deneyleri için kullanılan 2010 5:% 10 APLLC Beyaz kullanarak 8 veya 12 dakika aralıklarla filmler için anlık alındı. % 10 Xenon ışık ve GFP algılama ve% 32 Xenon ışık ve sırasıyla mCherry algılama maruz 0.8 s 0.5 sn pozlama. SoftWoRx 3.6.0 (Uygulamalı Presicion) ham verileri kullanılarak saklanır. Otofokus 0.06 mikron adımları ve toplam 1.2 mikron aralığı için programlandı.
- Mikroskop önceden ısıtılmış çevre odasında hazırlanan slayt (2. bölüm) yerleştirin ve 30 microcolony bir tek tabaka halinde tek hücre akıbet ° C izlemek
Özel ipuçları:
- Agar ped ortasında bulunan tek hücreleri seçin. Agar kenarları daha kolay kurumasına pedi. Mikroskop yazılımı kullanılarak X, Y, Z konumu saklayın.
- X, Y ve Z yönünde sahne Büyük hareketleri agaroz karıştırmayı ve dolayısıyla otofokus rutin hücrelerin tanımlanması engel olabilir. Genel olarak, bir slayt birden fazla suşları içeren olsa bile, X, Y, Z hareketi en aza indirmek için, bizim 10 pozisyon Deneme başına birden seçmek yok.
- Ilk hücreyi seçtikten sonra, sadece yazılım ile Z-odağı ayarlamak. Bu noktadan itibaren, bu dijital olarak kodlanmış sürece, "Z-topuzu" kullanılarak mikroskop vücuda elle odak değiştirmek yok. Her otofokus rutin sonra yeni X, Y, Z konumu yazılım tarafından saklanır olduğundan emin olun.
- Çalıştırmak başlamadan önce, otomatik netleme ayarlarını deneme için uygun olup olmadığını kontrol edin. Faz-kontrast mikroskobu kullanımı, gelişmiş kontrast, aydınlık ya da DIC mikroskopi ile karşılaştırıldığında otomatik netleme, rutin artırabilirsiniz. Ancak, faz faz-kontrast hedefleri halka floresan ışık toplama (yaklaşık% 10) daha az duyarlı hale getirir. Yani, zayıf floresan örnekleri, faz halka olmadan objektif bir daha uygundur.
- Deney stabil bir şekilde çalıştığından emin olana dek seçilen hücreleri, her yarım saatte bir odak hala olup olmadığını kontrol edin. Hücreleri bu noktada odak dışında elle ayarlayın. Sıcaklık değişimleri, kötü kurutulmuş örneklerin yanı sıra nedeniyle, bu ilk saatlerde gerekli olabilir. Ayrıca, görüş alanı daha fazla hücre olduğunda, gelişmiş kontrast nedeniyle otofokus daha iyi çalışır.
- Deney bittikten sonra, farklı film ve ayrı dosyalar olarak güvenli kanal (yani faz kontrast, GFP, mCherry) gerekirse (bazı satın alma paketleri yığılmış tek bir dosyada tüm kanallar) ayırın. Yayın, resimler, özellikle bize 2B deconvolution, tarafından geliştirilmiş olabilirprotein yerelleştirme çalışmaları için eful. Mikroskop yazılımı kullanarak görüntüleri Deconvolve veya Huygens (gibi bir ticari paketi ile www.svi.nl ).
- Verileri ImageJ (kullanarak analiz http://rsbweb.nih.gov/ij/ ) (bunun için ham, işlenmemiş görüntü dosyaları kullanmak) ve Microsoft Excel veya Sigma Arsa. Bacalar örneğin ImageJ olarak "avi" film dosyası olarak kaydedilebilir. Zaman içinde nasıl floresan tek hücre ölçülebilir ayrıntılı bir açıklama aşağıda verilmiştir.
4. ImageJ kullanarak, promotor aktivitesi dinamikleri Veri analizi
Biz diğer iyi yazılım paketleri BHV yazılımı 9, 4, Schnitzcell 10, PSICIC 11 ve 12 Mikrop-Tracker, gibi zaman atlamalı mikroskobu görüntüleri analiz konusunda uzmanlaşmış, ancak biz burada serbestçe kullanılabilir ImageJ paketi odaklanmak olduğu mevcut olduğunu unutmayın .
- Download ImageJ ( http://rsbweb.nih.gov/ij/ ) ve (gerekirse) (yığın) dosyasını açmak için doğru bir eklenti . Örneğin, film, bir deltavision mikroskop kullanılarak kaydedilen, sadece deltavision açıcı eklentisi ile ImageJ açılabilir. DV-plugin ImageJ eklenti klasörüne kopyalayın ve programı başlatın. Düzenleme 1250 / seçenek / bellek ve konuları bellek kapasitesi değiştirin. Bu, zaman atlamalı filmleri elde edilen gibi büyük dosyalar ile çalışan sağlar.
- Tek bir hücre hücre geçmişi değerlendirmek için, bir microcolony film ilgi son kareye gidin orijinal faz kontrast film açın. Menüde "bölümlenmiş çizgiler" seçim düğmesini seçin.
- Arka planda bir çizgi çizin ve "CTRL" + "T" tuşuna basın. Bu faiz getirisi (ROI) yöneticisi bölgelerde açılacak. (Ilgili eşiğe değeri elle arka plan çıkarmak için kullanılır... Alternatif olarak, aşağıya bakınız ImageJ içinde arka plan çıkarma rutin kullanabilirsiniz) Ayrıca ilgi hücrede bir çizgi çizin ve ROI yöneticisi ROI ekleyin. Bu durumda çalışma organizatörü-GFP füzyonlar soruşturma ve GFP sitoplazma boyunca yayılır bu yana, tüm hücre hücre uzunluğu boyunca, tek tek her bir piksel için floresan benzer değerlere sahip olmalıdır. Zaman içinde geriye gidin ve bir kare ilgi aynı hücrede yeni bir yatırım getirisi seçin. Bu üçüncü yatırım getirisi kaydedin ve filmin ilk karesi ilgili ROI kaydedildi kadar prosedürü ile devam edin.
Floresan kızı hücrelerinin hücre bölünmesi sonra büyük ölçüde değişir farkında olun. Ya septum formasyonunu görselleştirmek için hücrelerinin (örneğin kırmızı zarı boya FM ® 5-95 (Invitrogen) ve GFP birleşimi olarak) tarafından üretilen floresan proteinleri ile birlikte uygulanabilir bir zar boya kullanın. Bu durumda, ilgili floresan kanal ve, faz kontrast film hücreler zaman içinde takip edilmelidir. Alternatif olarak, tek bir hücrenin sadece bir yarısı ROI seçerek güvenli tarafta kalmak. - ROI yöneticisi içinde "Kaydet" butonuna tıklayınız. Dosya biten "roi" ise, o zaman bir roi listesinde seçilir ve sadece bu tek kaydedilir. "Zip" dosyası sona ermesi ise, daha sonra tüm seti (gerekli) kaydedilmiş olacaktır.
- Faz kontrast film kapatın ve orijinal floresan film (örneğin, GFP) açın. Tıklayın "tümünü göster" ve "ölçü" ROI yöneticisi. Yeni bir pencere açılacaktır (Sonuçlar). Sonuçları bir Excel sayfası içine kopyalayın ve orta arka plan floresan, tek tek her bir hücre için ortalama floresan çıkarmak. Ortaya çıkan net floresan zaman ilgi hücre promotor aktivitesi ortaya çıkarmak için zamana karşı çizilebilir.
- Alternatif olarak, tüm hücreleri bir microcolony floresan belirli bir zaman noktasına analiz edilebilir. Seçin ve yukarıda açıklandığı gibi, bir çerçeve içinde, arka plan ve her tek bir hücre için bir yatırım getirisi kaydetmek, Excel'e floresan değerleri kopyalamak ve histogramlar "aracı" menüsünden "histogram" fonksiyonunu kullanarak üretmek için.
- Yayın için tek kare fotoğraf elde etmek için, "görüntü" seçin, ilgi çerçeve seçin "görüntü yinelenen" ve "RGB" veya "görüntü" seçerek "8-bit" görüntü türünü değiştirmek - "tip" RGB renk "ya da" 8-bit ". Çoğaltılmış kare ". Tiff" olarak kaydedin. RGB/8-bit resim gibi CorelDraw veya Adobe Illustrator gibi geleneksel çizim programları tarafından açılabilir. ImageJ olarak "pencere / seviye" - "ayarlamak" - "parlaklık / kontrast" veya "görüntü" - "ayarlamak" Gerekirse, resimleri "görüntü" adapte olabilir.
5. ImageJ ile yayınlanması için film üretmek
- Yukarıda açıklandığı gibi orijinal ImageJ de faz kontrast ve ilgili floresan film (ler) açın. Gelişmekte olan microcolony ROI throu kapalı olduğunu, dikdörtgen seçimler düğmesini seçin (solda 1.) ve böyle bir şekilde ilk karede bir dikdörtgen ROI çizinbütün film ghout. "Kırpma" ve yeni bir isim altında film güvenli, bu daha küçük bir versiyonu - "görüntü" seçin. ROI yöneticisi ile aynı ROI floresan film seçin ve eskisi gibi devam edin.
- Filmleri yatay ya da dikey olarak birleştirmek için, "eklenti" seçin "yığın birleştirici". İsterseniz, bir süre Stamper "eklenti" ile eklenebilir - "zaman Stamper". Bir zamanlar "dv" ya da "tiff" ve bir kez kombine yığını olarak kaydet "avi" veya quicktime film.
Streptococcus pneumoniae için alternatif Protokolü Uyarlamalar (Şekil 4 ve Film 2):
6. S. hazırlanması pneumoniae kültürleri
- S. büyütün pneumoniae hücreleri (kapsüllü suşu D39 13 ya da 37 C + Y orta 15 ayakta kültürler olarak kitle şeklinde gerginlik R6 14 ° C yaklaşık 0.4 600Nm bir OD kadar ulaşmıştır. Santrifüj ve 14000 rpm'de 2 dakika süreyle hücreler tekrar süspansiyon taze C + Y orta bir 600Nm tam 0.4 neden% 14.5 gliserol (v / v) içeren Temsili miktar hücreleri ve -80 ° C ileride kullanmak üzere saklayın hacmi hücre pelet.
- Zaman atlamalı mikroskopi için, daha önce kültür S. bir kısım pneumoniae hücreleri. İnokülasyon 4 ml taze C + -80 ° C kısım hücreleri Y orta 1:100. 0,2 - 0,1 A 600Nm bir OD hücreleri orta-üstel faz kadar büyütün. -80 ° C alikotları hücreleri kullanarak Genellikle, bu yaklaşık 2 saat sürer.
7. Mikroskop numune hazırlanması
- B. yukarıda açıklandığı gibi bir mikroskop lamı hazırlayın subtilis ama agaroz karmaşık C + Y orta içerdiğinden emin olun. S. pneumoniae microaerophile, agaroz şeritler arasındaki hava boşlukları B. daha küçük olmalıdır subtilis (~ 1 mm boşluk her iki tarafta).
- 600 nm (600) kültür absorbansı ölçülür, katlanarak büyüyen S. pneumoniae hücreleri yaklaşık 600 C + Y orta kullanılarak 0.05 sulandırmak ve agaroz slayt yüklemek için bu seyreltme kullanın.
8. Time-lapse faz-kontrast mikroskobu
S. mikroskop ayarlarını yapın pneumoniae: S. faz-kontrast mikroskobu pneumoniae, parlak alan mikroskobu kullanılarak tespit etmek zordur . Protokol B. açıklandığı gibi devam edin subtilis (2,9 adımları takip - 3.7) S. pneumoniae hücreleri 30 ya da yetiştirilebilir ° C veya 37 ° C (37 ° C daha hızlı büyüdüklerini unutmayın).
9 - Temsilcisi sonuçları:
Bakteri microcolony tek tabaka halinde tamamen Deneyin sonunda görüş alanı içinde yer almaktadır (bkz. Şekil 5A-C) büyüdü, zaman atlamalı floresan deney başarıyla yürütülmektedir olmuştur. Hücreler birbirinin üstüne artış varsa, bu sadece kendi geçmişi doğru bir şekilde izlemek için imkansız değil, aynı zamanda üst üste hücrelerinin floresan seviyeleri doğru ölçülen olamaz. Orta kompozisyon daha yavaş bir büyüme elde etmek için ayarlanabilir gerekiyorsa benekli hücreleri yeterince kurutulmuş (adım 2.9) ya da sanki hücreler, birbirlerinin üstüne büyürler. Microcolony görünümü büyümüştür, daha sonra, bir koloni içinde floresan sinyalleri dağılımı belirlenecek olamaz. "Microcolony hareketi" için nedenleri benekli hücrelerin yetersiz kurutma (adım 2.9) olabilir, ya da yazılım geliştirme sırasında microcolony izlemek için programlanmış değildi. Ayrıca, bu hücreleri (bkz. Şekil 5D-F) gelen floresan sinyalleri örttüğü olarak artan floresan yerel yamalar orta algılanamaz olduğunu önemlidir. Etkilendiği ilgili sorunlar, medya bileşikleri, airbubbles veya çözünmemiş agaroz kümeleri ortaya çıkabilir. Bu görselleştirmek için, Şekil göstermektedir. 5F kırmızı floresan boyalar için uyarma / emisyon filtreleri kullanarak görüntü çekildi bu özel slayt arka plan sinyalleri. Görüldüğü gibi, parlak autofluorescent noktalar görüntüleme engel olabilir. Bu tür lekeleri önlemek için, agaroz tamamen çözülür ve mikroskop lamı üzerine lamel verirken hiçbir airbubbles vardır emin olun.
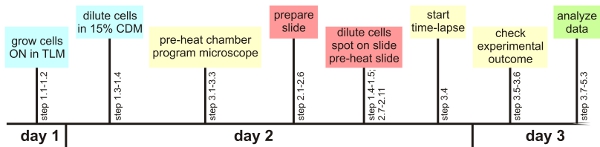
Şekil 1: Deneysel genel bakış

Şekil 2: mikroskop numune hazırlanması
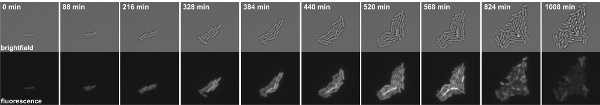
Şekil 3: B. Zaman atlamalı floresan mikroskopi P kinB-GFP füzyon barındıran subtilis hücreleri. Snapshots Movie 1 alınır. En paneller: parlak bir alan, alt paneller: GFP kanal.
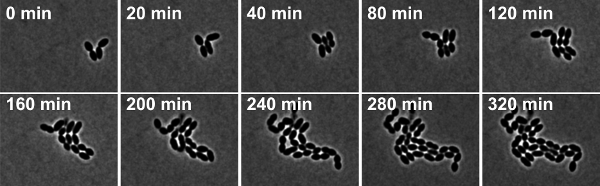
Incirure 4: S. Time-lapse faz-kontrast mikroskobu pneumoniae vahşi tip suşu R6. Snapshots Movie 2 alınır.
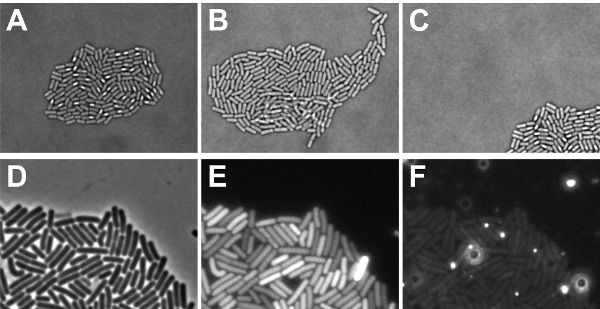
Şekil 5: mümkün mikroskobu (time-lapse) sonuçlarının İllüstrasyon. AC diascopic ışık ayarları ile elde edilen veriler için dikkate alınması gereken faktörler gösterir. (A) B. sporlanan microcolony tek tabaka aydınlık mikrografı (olumlu sonuç) B. subtilis hücreleri (B) aydınlık görüntü bazı hücreler birbirlerinin üstüne büyüdü sporlanan B. subtilis microcolony (olumsuz sonuç) (C) aydınlık görüntü odak alan (olumsuz sonuç) büyüyen subtilis microcolony. B. episcopic ışık ayarları ile elde edilen veriler için dikkate alınması gereken DF gösterisi faktörler (D) Faz kontrast resim E ve F floresan sinyalleri (E) D. Not arka plan sinyalleri her piksel (pozitif sonuç) benzer olduğu gösterilmiştir hücrelerinin GFP sinyaller geldiği yerin görselleştirmek için tasvir üstel fazda subtilis hücreleri. Ayrıca bir hücre arka plan artan kırmızı floresan düzeyleri (alanları içerdiğini D. Not gösterilen hücrelerinin kırmızı kanal aracılığıyla elde edilen doymuş sinyali (negatif sonuç), (F) İşaretler gösterir beri maruz kalma süresi çok fazla olabilir dikkat negatif sonucu).
B. Movie 1 Zaman atlamalı floresan mikroskopi P kinB-GFP füzyon barındıran subtilis hücreleri. Snapshots 8 dakika aralıklarla alınmıştır. Sol: parlak bir alan, Sağ: GFP kanal film izlemek için buraya tıklayın.
Film 2 S. Time-lapse faz-kontrast mikroskobu pneumoniae vahşi tip suşu R6. Snapshots 10 dakika aralıklarla alınmıştır. film izlemek için buraya tıklayın.
Tartışmalar
, Pek çok diğer tek hücreli tekniklere aksine, burada açıklanan geçen zaman floresan mikroskopi yöntemi atalarının, onun davranış ve bölünme olayları ile ilgili belirli bir hücre tarihini takip kullanılabilir. Floresan etiketli hedef rehberleri veya protein ile birlikte, belirli gelişim süreçleri etkinleştirme süresi ve protein yerelleştirme yanı sıra protein dinamikleri bakteriyel gelişimi sırasında izlenebilir takip edilebilir.
Yukarıda belirtildiği gibi, farklı bakteri türleri üzerinde yoğunlaşan çalışmalar, belirli bir bakteri gereklerine göre büyüme koşullarına adapte tarafından yapılabilir. Karşılaştığımız sınırlamalar büyüme koşulları ve örneklem büyüklüğü ile ilgili. Kapalı bir ortam olması nedeniyle, orta koşulları, deneme sırasında değiştirilecek. Ayrıca, deney başına dört suşlarının maksimum verimli bir şekilde takip edilebilir.
Bir kaç kritik adımlar göz önüne alındığında, tek bir hücrenin analiz yöntemi, burada açıklanan herhangi bir otomatik mikroskop kullanarak kolayca uygulanabilir. Aşağıda, bu kritik adımların bir bakış verilecektir. Ayrıntılı bilgi ana metin Genel hazırlık: deney öncesinde belirli bir bakteri için gerekli olan otomatik odaklama ayarlarını kontrol etmek akıllıca olacaktır. Aynı şekilde, eğer mümkünse yaklaşık floresan görünüm için en iyi ayarları, önceden belirlenmiş olmalıdır. Ayrıca, hazırlanmış bir zaman çizgisi izleyen zaman içinde kullanıma hazır tüm malzeme (öncesi ısınma, mikroskop odasının, mikroskop ayarları programlama, hücreler istenilen büyüme aşamasında önce bir saat slayt hazırlama, bkz Şekil 1) yardımcı olur B. Büyüme TLM ve CDM subtilis: TLM ve CDM kimyasal açlık medya tanımlanan hangi B. subtilis sadece yavaş yavaş büyür. Hücreleri medya yetiştirilen zaman dilimi belirli bir gerginlik bağlı olarak uzun süreli olabilir. Birbirlerine kazık yavaş büyüme hücreleri engeller mikroskop numunesinin hazırlanması: gen çerçeve, cam slayt ve kapak kayma arasında hava kabarcıkları agaroz tabanlı orta geniş kurumasını önlemek için önlenebilir. Aynı orta / kapak kayma arayüzü için de geçerlidir. Bu hücrelerin yeteri kadar kurumaya bırakın, yüzme ve / veya çok katmanlı büyümesini önlemek için çok önemlidir Time-lapse floresan mikroskopi: Ön ısınma slayt çevre odasının yanı sıra, önemli otofokus sorunları önlemek için çok önemlidir . Bu deney sırasında (örnek yeterince kurutulmuş) alan ve odak kalmak için en yüksek şansı beri Hücreler, bir agar ped ortasında seçili olmalıdır. Deneyler başına 10 yerde maksimum hala düzgün çalışır. Seçildikten sonra ilk hücrenin sadece ilgi odağı ayarlamak için (ayrıntılar için metne bakınız) yazılımını kullanabilirsiniz. Hücreler, ilk saatlerde 30 dakika aralıklarla deney Analiz hala odak olup olmadığını kontrol edin: Bu orta arka plan floresan kanallarda benzer değerlere sahip olup olmadığını önce genişletilmiş analiz prosedürleri kontrol etmek için önemlidir. Sorun Giderme analiz etmek için film zor veya imkansız hale Küçük toz partikülleri, orta bileşenler, kirli lensler veya küçük agaroz kümeleri, yerel olarak artan floresan katkıda bulunabilir: hücreler birbirinin üstüne büyürse, bu da lamel olduğunu gösteriyor olabilir çok erken ya da orta microcolony mono tabakaları büyüme için uygun değildir bağlı. Mutlu slayt diğer hücrelere bölmek ise ilgi hücreler sürekli ölen pozisyonda UV filtre koymak olmadığını kontrol etmek isteyebilirsiniz. Aynı zamanda uzun deneyler sırasında maruz kalma süresi ya da ışık yoğunluğunu azaltmak için yardımcı olabilir.
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
İş JWV grup AB Marie-Curie Reintegration Bursu, Sysmo2 Grant (NWO-ALW/ERASysBio), Horizon hibe (ZonMW) ve Veni dostluk (NWO-ALW) tarafından desteklenmektedir. OPK grubu birkaç STW hibe (NWO), SYSMO1 (IGdeJ) ve SYSMO2 hibe, bir ESF Eurocores SynBio hibe (SynMod) ve Endüstriyel Fermantasyon ve En İyi Gıda ve Beslenme için Enstitüsü Genomik Kluyver Merkezi tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktifin Adı | Şirket | Katalog numarası | Yorumlar (isteğe bağlı) |
|---|---|---|---|
| Gene Kare | ABgene | AB-0578 | 1.7 x 2.8 cm |
| yüksek çözünürlüklü düşük erime agaroz | Sigma | A4718 | |
| büyük kapak kayma | birkaç | 24 x 50 mm | |
| istenirse, membran boya, örneğin FM 5-95 | Invitrogen | T23360 | diğer membran boyalar da mevcuttur: http://probes.invitrogen.com/media/pis/mp34653.pdf |
| Zaman atlamalı mikroskop çevre odasına | birkaç | bizim cihaz için ilgili bölümlerde ayrıntıları görmek |
Referanslar
- Veening, J. W., Smits, W. K., Kuipers, O. P. Bistability, epigenetics, and bet-hedging in bacteria. Annu. Rev Microbiol. 62, 193-193 (2008).
- Dubnau, D., Losick, R. Bistability in bacteria. Mol Microbiol. 61, 564-564 (2006).
- Locke, J. C., Elowitz, M. B. Using movies to analyse gene circuit dynamics in single cells. Nat. Rev. Microbiol. 7 (5), 383-383 (2009).
- Veening, J. W. Bet-hedging and epigenetic inheritance in bacterial cell development. Proc. Natl. Acad. Sci. U. S. A. 105 (11), 4393-4393 (2008).
- de Jong, I. G., Veening, J. W., Kuipers, O. P. Heterochronic phosphorelay gene expression as a source of heterogeneity in Bacillus subtilis spore formation. J. Bacteriol. 192 (8), 2053-2053 (2010).
- Veening, J. W., Murray, H., Errington, J. A mechanism for cell cycle regulation of sporulation initiation in Bacillus subtilis. Genes Dev. 23 (16), 1959-1959 (2009).
- Eberhardt, A. Cellular localization of choline-utilization proteins in Streptococcus pneumoniae using novel fluorescent reporter systems. Mol Microbiol. 74 (2), 395-395 (2009).
- Vasantha, N., Freese, E. Enzyme changes during Bacillus subtilis sporulation caused by deprivation of guanine nucleotides. J Bacteriol. 144 (3), 1119-1119 (1980).
- Stewart, E. J. Aging and death in an organism that reproduces by morphologically symmetric division. PLoS. Biol. 3, 45-45 (2005).
- Rosenfeld, N. Gene regulation at the single-cell level. Science. 307 (5717), 1962-1962 (2005).
- Guberman, J. M. PSICIC: noise and asymmetry in bacterial division revealed by computational image analysis at sub-pixel resolution. PLoS. Comput. Biol. 4 (11), 1000233-1000233 (2008).
- Montero, L. l. o. p. i. s. . P. Spatial organization of the flow of genetic information in bacteria. Nature. 466, 77-77 (2010).
- Avery, O. T., Macleod, C. M., McCarty, M. Studies on the chemical nature of the substance inducing transformation of pneumococcal types: Induction of transformation by a desoxyribonucleic acid fraction isolated from pneumococcus type III. J Exp. Med. 79, 137-137 (1944).
- Hoskins, . Genome of the bacterium Streptococcus pneumoniae strain R6. J Bacteriol. 183, 5709-5709 (2001).
- Martin, B. The recA gene of Streptococcus pneumoniae is part of a competence-induced operon and controls lysogenic induction. Mol Microbiol. 15, 367-367 (1995).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır