Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Embriyonik Farelerde damarları Etiketleme Bir Yöntem
Bu Makalede
Özet
Bu makale, embriyonik deri ve timüs kan damarlarının etiketlenmesine yönelik bir yöntem açıklanmaktadır.
Özet
Fonksiyonel bir damar ağının kurulması organogenez önemli bir parçası olduğunu ve optimal organ fonksiyonları için gereklidir. Örneğin, timüs uygun damar oluşumu ve dokusunda organ ve çevre için olgun T-hücresi çıkışında içine timosit giriş için gereklidir. Timus kan damarlarının mekansal düzenleme yerel mikroçevrede, yani timik epitel hücreleri (TEC) gelen sinyalleri bağlıdır. Birkaç yeni raporlar timus damar kusurları 1,2 bu sinyallerin sonuçları bu bozulma göstermektedir. Önceki çalışmalarda yenidoğan ve yetişkin timus damar 1,2 etiketlemek için kullanılan teknikler tarif var. Biz burada embriyonik timus kan damarlarının etiketlenmesine yönelik bir tekniği göstermek. Yüz damar enjeksiyonu ve CD31 antikor boyama timüs va tespit etmek - bu yöntem simplicifolia lektin I (isolectin B 4 GSL 1) FITC-dekstran ya da Griffonia (Bandeiraea) kullanılması birleştirirscular yapıları ve PDGFR-β timik perivasküler mezenşimi 3-5 etiketlemek için. Cryosections veya vibratome bölümleri kullanma seçeneği de sağlanır. Bu protokol, timüs kan damarı oluşumuna TEC-türetilen molekülleri rollerin tanımlanması için kritik olan timus damar bozuklukları, belirlemek için kullanılabilir. Yöntemi, tüm damar etiket olarak, aynı zamanda deri ve kalp 6-10 içeren embriyo boyunca birden fazla organ ve dokularda damar ağları analiz etmek için de kullanılabilir.
Protokol
1. Flöresein dekstran ve GSL I-isolectin B 4 yüz ven enjeksiyonlar embriyonik damar etiketlemek için etiketlenmiş
- Fosfat içinde FITC-dekstran (50ug/mL) hazırlayın Tamponlu Tuz (PBS) veya GSL 1 - isolectin B, bir 1,5 mL Eppendorf tüpü içinde PBS içinde 4 (20ug/200uL) ve 37 ° C'de sıcak Yeşil / PBS GSL 1. Yeşil / PBS FITC-Dekstran solüsyonunun (toplam hacmi 1 ml) ve stok 1.25mm Fast 180uL stok 1.25mm Fast 100ul Ekle - isolectin çözümdür böylece B 4 (toplam hacim 200ul), gözle görülür mavi.
- Allantoik sapı (umblikal arter ve ven) zedelemeden, birlikte E14.5-E18.5 embriyo ve yolk kesesi teşrih.
- Yeni bir Petrie tabak (60 X 15 mm) kadar embriyo transferi ve oda sıcaklığında PBS içinde sokmaktan.
- Baş / yüzün sagittal bir görünüm sağlamak için embriyo yerleştirin. Yavaşça başında embriyo kavramak için mikro diseksiyon forseps kullanın.
- Bir 30G iğne kullanarak, 50uL FITC-dekstran (50ug/mL) veya GSL enjekte1 - isolectin başın arkasına doğru iğne işaret fasiyal vene B 4 (200ul PBS 20ug).
- Boya umbilikal ven görünür olduğunda, iğne kaldırmak ve allantoik sapı (umbilikal arter ve ven) gelen embriyo ayırın.
- Enjeksiyonu takiben, embriyo boya dolaşır embriyo böylece 2-3 dakika için oda sıcaklığında PBS içinde kalmasını sağlamaktadır.
2. Deri vaskülatürü Tüm montaj analizi
- Boya embriyo boyunca dolaşmaya izin verdikten sonra, sırt, bacakların bölgelerinden alınan deri örnekleri kaldırmak ve mide, vb 8,9.
- Soğuk PBS içinde deri örneği yıkayın ve 2 saat 8,9 için% 4 PFA / PBS düzeltin. 10 dakika 2mL soğuk PBS ile 4 mL berrak flakonda her biri için 3 kere yıkayın.
- Bir mikroskop yerleştirin deri örneği her slayt ve kapak cam montaj medya 100 ul kaydırın ve ekleyin.
- Slaytlar karanlık bir depolama alanında kurumasını bekleyin.
- P2 'Image Acquisition' bölümüne Adım roceed.
3. Timus ve kalp damar ve cryosections için perivasküler hücrelerin Çok renkli etiketleme (Bölüm 1, Adım 7 Devam)
- Sıvı azot 'Flaş don' bütün embriyo. Embriyolar olması ve -80 ° C'de analize kadar saklanır olabilir.
- Alternatif olarak, timus dışarı incelemek 4 ° C'de PBS ile yıkanır ve 2 saat boyunca 2mL% 4 paraformaldehit (PFA) / PBS içinde çözmek. -80 Kullanıma kadar soğuk PBS, OCT yer thymi ve dondurma ve mağaza ile 10 dakika boyunca 3 kez yıkayın ° C
- Cryosectioning için bir bölüm 'blok' üzerinde Ekim yaymak ve kesit için embriyo veya disseke organ / dokuların monte.
- 10 mikron kalınlığında kesitler halinde dondurulmuş doku Kes ve slaytlar üzerinde toplamak.
- 5-10 dakika aseton bölümler düzeltildi. Soğuk TBS içinde 3 kere yıkayın.
- Oda sıcaklığında bir nem odası içinde% 10 eşek serum / TBS içinde engelleme.
- Primer 100 ul ile 1 saatlik gecede için bölümler inkübe4 bir nem odası antikorlar ° C: Bu örnekte, biz etiket endotele Sıçan anti-fare CD31 (1:100) ve keçi anti-fare perivasküler hücreler etiketlemek için PDGFR-β (1:100) kullanın. Bu antikor düzgün bölümüne yayılmış olduğundan emin olmak için ayrı ayrı kesilmiş Parafilm şeritler ile slaytlar karşılamak için yararlıdır.
- Primer antikor ile inkübasyondan sonra, soğuk TBS bölümler 3 kere yıkayın. En az 30 dakika için uygun sekonder antikor 100 ul ile inkübe edin.
- Soğuk TBS içinde 3 kere yıkayın. Her slayt ve kapak cam montaj medya 100 ul ekleyin.
- Slaytlar karanlık bir depolama alanında kurumasını bekleyin.
- 'Image Acquisition' bölümüne geçin.
4. Timus ve damarsal vibratome bölümleri için perivasküler hücrelerin Çok renkli etiketleme (Bölüm 1, Adım 7 Devam)
- Embriyodan timus lobları dışarı inceleyin ve soğuk PBS içinde yıkayın.
- 2 saat için oda sıcaklığında% 4 PFA / PBS içinde timus saptamaks.
- PBS-Triton X (0.15%) 3 kez, 10 dakika ve erime düşük 4% küçük bir plastik kartuş ve batığın yerini thymi yıkayın agaroz / PBS (~ 4 ° C). Timus kartuşun dibi ile temas halinde olmalıdır.
- Agaroz buz (3-5 dakika) katılaşmaya bırakın. Aşırı agaroz kesmek için jilet kullanın. Vibratome blok tutkal ekleyin ve blok numune uygun.
- Örnek ve bıçak batırılır kadar vibratome su banyosuna soğuk PBS ekleyin.
- Hız ve genlik (yüksek genlikli ve düşük-orta hızda yumuşak timus bölümleri için idealdir) ayarlayın. Bölümlerde aşırı ajitasyon nedeniyle break up genliği azaltılmalıdır.
- 50 um bölümleri kesiniz.
- Bir fırça kullanarak, soğuk PBS içinde 24-kuyu mikroplak bölümler toplamak.
- 30 dakika boyunca PBS-Triton X (% 0.15) içinde% 10 eşek serum ve 500 ul içinde blok bölümleri.
- Bu tür anti-CD31 ve anti-PDGFR-β gibi birincil antikor ile bir gece 8 saat için bölümler için, inkübe, Kapalı bir 24-çukurlu bir mikrolevhadaki.
- 4 ° C'de 8 saatlik bir toplam boyunca PBS-Triton X (% 0.15) içinde 3 kere yıkayın
- 30 dakika boyunca PBS-Triton X (% 0.15) içinde% 10 eşek serum içinde blok bölümleri.
- 8 saat bölümler inkübe 4 gecede ° C uygun ikincil antikor ile.
- 4 ° C'de 8 saatlik bir toplam boyunca PBS-Triton X (% 0.15) içinde 3 kere yıkayın
- Re-fix örneklerinde% 4 PFA / buz üzerinde 30 dakika süreyle PBS.
- Buz üzerinde 30 dakika PBS-Triton X (0.15%) 3 kez yıkayın.
- % 25 MeOH,% 50 MeOH,% 75 MeOH, ve her adım için 10 dakika sonra% 100 MeOH: bir aşamalı MeOH / PBS-Triton X dizi örnekleri kurutmak. 10 dakika sonra taze MeOH ile% 100 MeOH değiştirin ve oda sıcaklığında 1 saat süreyle inkübe edilir.
- Bir cam kapta, mix Babb (Benzil Alkol: Benzil Benzoat) 1:2 oranında. Babb% 50 ve% 50 MeOH bir nihai konsantrasyon için MeOH ile Babb birleştirin. 10-15 dakika MeOH: Babb örnek inkübe edin.
- Transferi sa10-15 dakika için% 100 Babb ve inkübe ile bir cam kap için mple veya kadar oda sıcaklığında, temizlenir.
- Tarafı taze% 100 Babb ve transfer örneği ile depresyon slayt (0.7mm derinlik) doldurun. Cam (No 1.5) kapak ve oje 2-3 kat ile mühür ekleyin. Oda sıcaklığında karanlıkta sertleşmesine oje bırakın ve daha sonra 4 ° C'de örnek saklamak
Not: Slaytlar tamamen konfokal görüntü alımı öncesinde kapatılmalıdır. Floresan boyalar Babb fade gibi Görüntüler, 12-24 saat içinde satın alınmalıdır. - 'Image Acquisition' bölümüne geçin.
5. Görüntü edinimi
- Görüntü 10 488 ile Plan-Apochromat 20X/0.8 nesnel (512 X 512 piksel) kullanarak bir konfokal mikroskop ile mikron frozen - (FITC-dextran/GSL 1 - B 4 isolectin), 543 - ve 633-nm lazer çizgiler.
- Plan-Apochroma kullanarak bütün montaj cilt ve 50 mikron agaroz-gömülü kesitlerin konfokal z bölümler Edinme t 10X/0.4 488 ile nesnel (512 X 512 piksel) - (FITC-dextran/GSL 1 - B 4 isolectin), 543 - ve 633-nm lazer çizgiler. Seri Z bölümleri ilgili her kanal için 1 mikron sıralı olarak toplanmalıdır.
- Seri Yeniden İnşa Zeiss Axiovision 4.6 ya da diğer görüntü analiz yazılımı kullanılarak Z-bölümler.
6. Temsilcisi Sonuçlar:
Embriyonik damar Verimli etiketleme embriyonik farelerde kan damarı kusurları değerlendirmek için önemlidir. Şekil 1, sırasıyla sağ ve sol ventrikül (1E-F) arasında boyama ek olarak, özel E16.5 timüs kan damarlarının etiketleme (1A-B) ve CD31 (1B) ile birlikte etiketleme, göstermektedir. Gibi bölümlere 1, 3 içinde belirtilen cryosections ve 5 için GSL I-isolectin B 4 protokol bu deneylerde kullanılmıştır. Bütün monte edilir, E16.5 fareler üzerinde cilt kan damar ağının bölümleri etiketleme 1, 2 içerisinde tarif edilen protokoller kullanılarak, ve 5, şekil 1C-B 'de gösterilmiştir.
ntent ">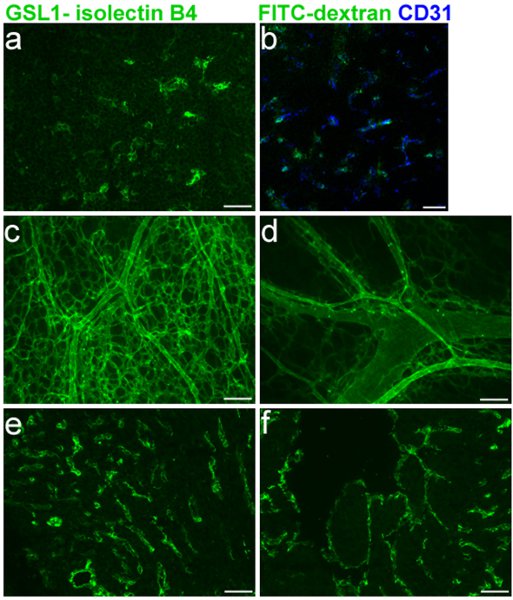
1. Legend Şekil. FITC GSL I - E16.5 fare embriyolarına isolectin B 4 yüz ven enjeksiyonlar. embriyonik kalp e enjeksiyonu takiben embriyonik Timus bir. Cryosection. b. isolectin B 4 CD31 ko-etiketleme Birleştirme. c. ve d. embriyonik deri vaskülatürü aşağıdaki enjeksiyon Tüm montaj. e. ve f. Cryosection. (sağ ventrikül) f. (sol ventrikül) aşağıdaki enjeksiyon.
Tartışmalar
Bölümlerde Tüm-mount ve PECAM-1 (CD31) boyama embriyonik farelerde damar etiketleme için geleneksel yöntemler vardır. Bu yöntemler doğrudan ve / veya dolaylı immunfloresan ve deterjan kullanımı fare doku geçirgenliği gerektirir. Bu oldukça zamanında süreç olduğunu kanıtlıyor. Burada, FITC-dekstran ya isolectin B 4 yüz damar enjeksiyonu doğrudan böylece antikor etiketleme adımlar için ihtiyacı ortadan kaldırarak, embriyonik damar etiketlemek için istihdam var. 'Sızdıran' f...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Bu eser hibe numaraları R01AI055001 ve NIAID gelen UYM ve JLB için SREB Tezi Bursu Ödülü R01AI082127 tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | |
|---|---|---|---|
| FITC-dekstran | Sigma | FD150S-1G | |
| Flöresein GSL 1 etiketli - B 4 isolectin | Vektör Laboratuvarları | FL-1201 | |
| Fast Green | MP Biomedicals | 195178 | |
| PFA | Fluka | 76240 | |
| Fetal Bovine Serum | Atlanta Biyolojik | S11550 | |
| Optimal Kesme Sıcaklık Bileşik (OCT | VWR | 25608-930 | |
| Aseton | JT Baker | 9006-33 | |
| Eşek Serum | Jackson | 017-000-121 | |
| Sıçan anti-fare CD31, | BD Pharmingen | 558736 | |
| keçi anti-fare PDGFR-β | R & D Systems | AF1042 | |
| eşek anti-fare CD31 Alexa 647 (Invitrogen) | Biolegend | 102516 | |
| eşek anti-keçi Alexa 594 (Invitrogen) | Invitrogen | A11058 | |
| Triton X -100 | Sigma-Aldrich | X-100 | |
| Düşük erime agaroz / PBS | Sigma-Aldrich | A9414-25G | |
| Metanol | Fisher Scientific | A413-4 | |
| Benzil Alkol | Acros Bilimsel | 148390010 | |
| Benzil Benzoat | Acros Bilimsel | 105860010 | |
| Depresyon slaytlar | Fisher Scientific | S175201 | |
| Fluorogel | Elektron Mikroskopi Bilimleri | 17985-10 | |
| Cam (22x22) -1.5 Kapak | Termo Scientific | 152222 | |
| Zeiss LSM 510 Meta Konfokal Mikroskop | Zeiss | ||
| Mikro diseksiyon forseps | Roboz | RS-5135 | |
| Parafilm No OM992 | Fisher Scientific | 13-374-16 | |
| 12 ve 24 de mikroplaklar | Evergreen Bilimsel | 222-8044-01F | |
| Superfrost / Artı Mikroskop Slaytlar | Fisher Scientific | 12-550-15 | |
| 4 mL berrak şişeleri | Ulusal Bilimsel | B7800-2 |
Referanslar
- Cuddihy, A. R. VEGF-mediated cross-talk within the neonatal murine thymus. Blood. 113, 2723-2731 (2009).
- Muller, S. M. Gene targeting of VEGF-A in thymus epithelium disrupts thymus blood vessel architecture. Proc. Natl. Acad. Sci. U. S. A. 102, 10587-10592 (2005).
- Muller, S. M. Neural crest origin of perivascular mesenchyme in the adult thymus. J. Immunol. 180, 5344-5351 (2008).
- Foster, K. Contribution of neural crest-derived cells in the embryonic and adult thymus. J. Immunol. 180, 3183-3189 (2008).
- Liu, C. Coordination between CCR7- and CCR9-mediated chemokine signals in prevascular fetal thymus colonization. Blood. 108, 2531-2539 (2006).
- Lavine, K. J. Fibroblast growth factor signals regulate a wave of Hedgehog activation that is essential for coronary vascular development. Genes Dev. 20, 1651-1666 (2006).
- Lavine, K. J., Kovacs, A., Ornitz, D. M. Hedgehog signaling is critical for maintenance of the adult coronary vasculature in mice. J. Clin Invest. 118, 2404-2414 (2008).
- Mukouyama, Y. S., Gerber, H. P., Ferrara, N., Gu, C., Anderson, D. J. Peripheral nerve-derived VEGF promotes arterial differentiation via neuropilin 1-mediated positive feedback. Development. 132, 941-952 (2005).
- Mukouyama, Y. S., Shin, D., Britsch, S., Taniguchi, M., Anderson, D. J. Sensory nerves determine the pattern of arterial differentiation and blood vessel branching in the skin. Cell. 109, 693-705 (2002).
- Murphy, P. A. Endothelial Notch4 signaling induces hallmarks of brain arteriovenous malformations in mice. Proc. Natl. Acad. Sci. U. S. A. 105, 10901-10906 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır