Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Bir Modifiye Zigmond Odası Testi kullanılarak Trunk Sinir Crest Hücre Göç Analizi
Bu Makalede
Özet
Eksplante hücreleri (gövde nöral krest hücreleri) göçü analiz etmek bir yaklaşım tarif edilmiştir. Bu yöntem, pahalı yumuşak, ve bu gibi ana gövde tepe nöral hücre kültürü içinde hücre-hücre etkileşimleri türetilmiş olanlar gibi, göç polarite hem chemokinesis ve diğer etkilerden kemotaksisi ayrım yapabilmektedir.
Özet
Nöral krest hücrelerinden (NCCS) epitelyal-mezenkimal geçiş 1,2 geçirildikten sonra dorsal nöral tüp (NT) göç omurgalı gelişimi mevcut hücrelerin geçici bir nüfusu vardır. Onların hedeflerine ulaşana kadar EMT ardından NCCS stereotipik yollar boyunca büyük mesafeler göç. NCCS nöronlar, glia, melanosit ve 1-3 kromaffin hücreleri de içeren farklı hücre tipleri geniş bir dizi farklılaşırlar. Onların doğru hedef konumlarına ulaşmak ve tanımak NCCS yeteneği gövde bileşenleri 3 NCC-türetilmiş içeren tüm yapıların uygun oluşumu için temel olduğunu. Gövde KKK göç için rehberlik mekanizmalarının aydınlatılmasına dolayısıyla büyük önem taşıyan bir konu olmuştur. Sayısız molekülleri KKK göç 4 yol gösterilmiştir. Örneğin, gövde NCCS bu tür Semaphorin, efrin ve yarık ligandları olarak 5-8 negatif kılavuz işaretler tarafından uzaklaştırılacaktır bilinmektedir. Ancak,Son zamanlarda gövde NCCS 9 belirlenmiştir herhangi chemoattractants kadar.
Yapışık hücrelerin kemotaktik davranışlarını incelemek üzere in vitro yaklaşımlar Konvansiyonel ölümsüzleştirdiği, homojen dağıldığı hücreler en iyi şekilde çalışır, ancak başlangıçta homojen bir dağılım eksikliği ve hızla (örneğin NCCS gibi) ayırt bazı primer kök hücre kültürleri uygulamak daha zor. Kemotaksisi çalışmaları için gövde NCCS dağılımı homojenize Bir yaklaşım birincil NT eksplant kültürlerden gelen gövde NCCS izole etmektir, sonra kaldırın ve onları neredeyse% 100 konfluent olmak replate. Ancak, bu kaplama yaklaşım, zaman ve yeterli hücre eksplantasyona çaba önemli miktarda gerektirir sert olduğunu, ve in vivo koşullarda bulunan bir farklı şekilde gövde NCCS dağıtır.
Burada, requirin olmadan gövde NCCS arasında kemotaksis ve diğer göçmen yanıtları değerlendirmek mümkün bir in vitro yaklaşımı raporhomojen hücre dağılımı ga. Bu teknik, primer time-lapse görüntüleme kullanan bir modifiye Zigmond odası (standart Zigmond odası başka bir yerde 10 açıklanan) iç gövde NCCS soğukkanlı. Bunların tahmin edilen doğal yön dik bir chemotactant gradyanı ile kültür çevresinde yer alan gövde NCCS açığa olarak, uygulanan chemotactant gradyanı ile oluşturulan göç polarite değişiklikler tespit edilebilir. Bu teknik, ucuz çoğaltma tedavi başına sadece iki NT eksplant kültür gerektirir, sert hücre kaldırma (örneğin tripsinizasyonla gibi) önler vivo koşullarda bir daha benzer dağılımda gövde NCCS bırakır eksplantasyonunun ve deneme arasındaki süreyi aşağı kesim (hangi büyük olasılıkla farklılaşma riskini azaltır), ve çok sayıda göçmen özellikleri time-lapse değerlendirilmesine olanak tanımaktadır.
Protokol
1. 1. Gün: lamelleri gecede kültür gövde nöral tüp İzolasyonu
- 38 az 56 saat süreyle civciv yumurta inkübe ° C inkübasyon yumurta çıkarın, hafif% 70 Etanol ile onları sprey, ve sonra onları kurutun. UV-steril cam tepsi içine açık yumurtaları kırın.
- Sarisi her embriyo ayıklayın ve civciv Ringer yerleştirin. Kavisli makas ile kan adaların etrafında ilk kesim tarafından bu yapın; ardından, künt forseps ile, onun extraembryonic zarla embriyo pick up ve civciv Ringer çözeltisi içeren bir steril plastik Petri kabı yerleştirin.
- Aşırı extraembryonic membranlar kapalı kırparak yanı sıra bir tungsten iğne (Şekil 1) kullanarak, kranial vagal ve sakral eksenel düzeyleri her embriyo gövde ayırın. İlk aşamalarında HH15-17 11 arasındadır yaklaşık 9 embriyolar seçin. Yukarı aşamaları ve HH15 için, ön beyin ve arka beyin eksenleri akut bir açı oluşturur ve bu nedenle, kafa kaudal eğmek için görüntülenir. Atsahne HH17, kuyruk tomurcuk mevcut olup tenteliler ventral ancak henüz Somitlerin içermez. Bir tungsten iğne ile embriyo yaklaşık 2 mm extraembryonic membranlar keserek ve 10 somite anterior herhangi bir embriyonik dokular kesilir. Ayrıca beşinci en yeni kurulan somite çevresinde başlayarak tüm kaudal embriyonik dokularda çıkarın.
- Dispase olarak izole edilmiş embriyonik gövdeleri (0.24 U / ml DMEM) yerleştirin ve 37 için 1 saat 15 dakika boyunca bu inkübe ° C ve% 5 CO2. Sandıklar inkübasyon başladığında, kültür NT eksplantlar için 6 lamelleri (CS) (adım 1.5-1.8) hazırlamaya başlamalıdır.
- % 70 etanol içinde 6 CS (steril, saf su ile seyreltilerek) yıkayın ve sonra onları kurutun. Bir laboratuar işaretleyici kullanarak, çapı 1 cm (a fibronektin katın uygulandığı yerlerde bu dairenin daha sonra tanımlamanıza yardımcı olacaktır) hakkında her CS merkezinde bir daire çizin. Her CS aynı yüzünde, sözcük (bu y yardımcı olacaktır çizilmiş çemberin dışında (veya diğer bazı asimetrik kelime veya şekil) "olarak" yazmakou CS işaretli tarafı aşağı yukarı bakacak şekilde ya da olup olmadığını belirlemek).
- Ayrı 40 her CS yerleştirin işaretli yüzeyi aşağı bakacak ve yemek 10 dakika antiseptik bir UV lamba altında açık oturmasına izin ile x 10 mm steril çanak.
- 60 ul fibronektin (FN, 10 ug / ml DMEM) uygulanır 1 cm bir daire içinde yer alan tüm emin iken CS işaretsiz yüzeyine kaplanır. 30 dk için 37 ° C sıcaklıkta inkübe edilir ve daha sonra dikkatli bir şekilde her bir CS fibronektin aspire bulaşık yerleştirin.
- Ve FN-kaplı bölge için 250 ul "kültürü" orta [L-glutamin ile DMEM (2 mM), penisilin (100U/ml), streptomisin (100 mcg / ml) ve% 8 fetal bovin serumu (FBS)] ekleme CS. 37 her CS içeren bulaşık yerleştirin ° C ve% 5 CO2 tekrar nts izole edilene kadar.
- L15 orta içeren bir 5 cm cam Petri çanak tüm İnkübe embriyo gövdeleri aktarın ve ince forseps ve tungsten iğne (Şekil 1) kullanarak her NT dışarı Anatomi başlar. CNT zarar vermemek için temkinli olurken arefully keskin bir tungsten iğne ile NT ve Somitlerin sınırı boyunca dilimleyin. Bu gövde kaudal-en uca her NT izole başlaması genellikle daha kolaydır.
- (Kabaca 8 ve 15 Somitlerin arasındaki NTS uzun önerilir) bir gecede kültürü düz ve uzun NTS 6 seçin. Kültür ortamı ile astarlanmalıdır bir mikropipet ucu kullanarak, (1,8 adımlarda 1,5) kendi önceden hazırlanmış CS 6 NTS her aktarın. NT yüzeyinde yüzen kalır olmadığından emin olun. NT yüzen ise bir mikropipet kullanarak lavabolar kadar, bunun üzerine orta damla.
- 37 ° C ve% 5 CO2 gece boyunca her bir çanak yerleştirin. Her NT hemen önce inkübatör tabak (bir referans olarak adım 1.5 çizilen daire kullanarak) yerleştirerek, ilgili CS FN kaplı alanı içinde olduğundan emin olmak için dikkatli olun. Bir mikropipet gerekirse daha iyisi her bir NT konumunu ayarlamak için kullanılabilir.
- Placeen az 2 bir steril 15 ml santrifüj tüpüne kültür ortamı ml (serum yok) ve 37 ° C ve% 5 CO2 de bir gece inkübe edilir. Kapak bırakın hafifçe gece boyunca ayarlamak için ortamın pH sağlamak için vida. Ön kuluçka orta moleküler bir degrade oluşturulması bozabilir sizin odasında kabarcık oluşumu önlemek için önemlidir. Böyle "preinkübe" orta gelecekteki tüm adımları kullanılmalıdır. Kullanılmadığı zaman, bu orta inkübe 37 ° C olmalıdır
2. 2. Gün: modifiye Zigmond odası ve hücre göçü time-lapse analizi yükleniyor
- Kültürlü 6 NTS Out, iyi analiz için uygundur 3 kültürleri seçin. Genel olarak, en az bir uzun, düz kenar NCC kültürler (Şekil 2A) seçilmelidir. 3 en iyi kültürleri farklı bir tedavi ile her gün boyunca, 3 modifiye Zigmond odaları yüklemek ve film için kullanılacaktır. 3 kültürlerin Out, loadin için birini seçing birinci bölme ve daha sonra kullanılmak üzere inkübatöre diğerleri dönün.
- Bir pamuklu çubukla kullanarak, rezervuarlar ve tek modifiye Zigmond kamara köprü çevreleyen vazelin ince, düz bir tabaka uygulayın.
- CS yüzeyine bağlı çevreleyen NCCS bırakarak bir tungsten iğne ile, yavaşça, CS NT çıkarın. KKK kültür düz kenarının yönünü hatırlamak için bir kalem ile çanak işaretleyin.
- Köprüye preinkübe orta birkaç damla koyun. Eski kültür ortamı çoğu kaldırmak için bir Kimwipe karşı ince forseps ile CS, dab CS kenarına Pick up, sonra hemen filme gereken kültür düz kenar üzerinde ortalanmış şekilde modifiye Zigmond odasının üzerine CS yerleştirin Köprünün uzunluğu ve yaklaşık dik köprü-rezervuar sınırına (Şekil 2A, B).
- Bir inverted mikroskop kullanarak, inci en yakın köprü tarafta olmak için düz KKK sınırına taşımak(; kontroller için bu ikinci yüklenen hangisi rezervuar karşılık gelecektir Şekil 2B) şüpheli chemotactant içerecektir e rezervuar. Ayrıca, daha ince köprü-rezervuar sınırına dik olmasını kültür düz kenarını hizalamak.
- Dikkatle, ama güvenli tamamen daha da hava geçirmez olmalarını sağlamak için CS kenarı boyunca ek vazelin koyun, sonra odasına üzerinde mühürlü emin Zigmond odası mevcut vazelin içine CS basın. Mühürleme işlemi sırasında herhangi bir hareketi düzeltmek için tekrar KKK sınır açısı İnce ayarlayın.
- Şüpheli chemotactant ilk (Şekil 2B) içermez rezervuar yükleyin. Yaklaşık 300 ul preinkübe orta ve (rezervuar herhangi kabarcıklar oluşturmak için dikkatli olurken) dolana kadar rezervuar içine orta enjekte ile 1 ml şırınga (ekli iğne inç 25 G x 1.5) yükleyerek bunu. Bir suff ile her iki tarafından rezervuar takınönceki sonraki rezervuar yükleme için vazelin icient miktarı.
- Aday chemotactant içeren preinkübe orta kullanarak bu sefer hariç, adım 2.7 tekrarlayın. Daima, test edilen molekül eksik rezervuar yüklemeden sonra, test edilecek molekülü içeren rezervuar yüklemek için kültürler arasında bir moleküler gradyanı üreten zaman çok önemlidir.
- ° C önce filme 1 saat boyunca inkübe 37 yüklü Zigmond odasına yerleştirin. Resim 90 s aralıklarla 3 saat boyunca NCC kültür düz sınır yaklaşık 37 ° C de (Şekil 2A, B) inkübe iken. Ideali temsil kesik kutu; önce herhangi bir film yaratmak için, elde edilecek görüntülerin kenar ve son rezervuar yüklenen sınırları köprü (Şekil 2B, üst panelin kenarına temas hizalanacak şekilde kamerayı hizalamak için emin olun görüntüleme için pozisyon). Bu moleküler uygulanan degrade ve inci yön standartlaştırarak sonraki yazılım analizi kolaylaştıracaktırher bir film filme rezervuar e mesafe üretti.
- Kontroller için tekrar (adım 2.1) seçilen diğer iki KKK kültürlerin her biri için 2,2-2,9 adımları, ama uygun bir ortamda her rezervuar doldurmak. Tek tür kontrol süreyle ön kuluçkaya tabi orta test edilecek molekül içermeyen ile her ikisi de rezervuar doldurun. Ikinci bir kontrol tedavisi için, başbakan CS montaj öncesinde şüpheli chemotactant içeren preinkübe orta birkaç damla ile köprü. Ardından, şüpheli chemotactant içeren aynı ortamda hem rezervuar yükleyin.
- ImageJ (NIH) Manuel İzleme kullanın (rsb.info.nih.gov / ij / plugins / parça / track.html) ve Kemotaksis ve Göç Aracı v1.01 (/ www.ibidi.de / uygulamaları ap_chemo.html) izlemek için eklentileri kültür j düz periferik kenar boyunca NCCS göçüust görüntülü ve elde göçmen yörüngeler (Şekil 2B-C) farklı parametreleri analiz etmek.
3. Temsilcisi Sonuçlar:
Birçok gövde NCCS Yukarıdaki tekniği kullanarak bir aday kemoatraktan yanıt veren bir film hücre yörüngeleri bir örnek (Şekil 2B) gösterilir. Olumlu bir yanıt bu örnekte Hücrelerin çoğu kemoatraktan degrade kadar net hareketi (gibi kırmızı renkte gösterilir) görüntülenir. Yörünge verilerin yanı sıra hücre göçü diğer özellikleri analiz etmek için de kullanılabilir.
Görsel olarak modifiye Zigmond odası, bir Alexa Fluor 488 IgM konjugat (MW ~ 900 kDa) ile uygulanan bir degrade değerlendirmek amacıyla modifiye Zigmond odasının ikinci rezervuarı (yaklaşık 40 ug / ml H 2 O da) konuldu. Degrade (Şekil 3) 1 h tarafından kurulan ve 26 saat sonra hala biraz mevcut, ama büyük ölçüde 50 h tarafından azaldı. Test edilecek daha küçük bir molekül ise, o zaman uygulanan eğim wine gösterileceğini daha hızlı düşmesine ll.

Şekil 1. Fibronektin kaplı lamelleri gecede yetiştiricilik için gövde düzeyinde NTS eksplantasyonunun. Dorsal NT gövde NCCS delamine Somitlerin 8-28 bitişik bulunan, çünkü bu kademeli NT mikrodisseksiyon ve NT eksplant dan NCCS göç etmesi için izin vermek için bir fibronektin kaplı CS gece boyunca kültive ile izole edilir. Onlar uzun düz kenarlar KKK kültürleri verim eğilimi olarak 8-15 Somitlerin uzun ve nispeten düz arasındadır İzole NTS iyi gecede yetiştiricilik için uygundur. Diğer sinirsel tepe eksenel seviyelerine neden nöral tüpün bölgeler daha küçük bir yazı 'de gösterilmiştir. s, somite.

Şekil 2. Eksplante gövde NCCS göç değerlendirmek için yöntemmodifiye Zigmond odalarını kullanarak. (A) Uzatılmış gövde NCC kültürler, en az bir uzun, düz kenarlı nts ve sonuç NCC kültürlerinin bir gecede kültürlenmesi ile hazırlanan deney için seçilir. Seçilen kültür en uzun düz kenar sonra köprü-rezervuar sınır dik olarak yerleştirilmiş ve gelecek uygulanan gradyan vektörünü bu nedenle paralel edilir. Zigmond haznesi ve mühürleme NCC kültür pozisyon hassas olarak ayarlanması (B) sonra odasına lamel, odasının yüklenir. Kemotaksisi sınarken, şüpheli chemotactant içermez rezervuar (-) ilk ve mühürlü yüklenir. Daha sonra, diğer rezervuarın şüpheli chemotactant (+) ve mühürlü ile yüklenir. Önceden seçilen sınır boyunca Periferik NCCS ardından görüntülü ve ImageJ (alt panel) Manuel İzleme eklentisi kullanarak izlenebilir. Yanıt (C) Çok sayıda göçmen özellikleriiçin uygulanan degrade izleme verilerine dayanarak tespit edilebilir. Örneğin, bir kemotaksis indeksi göç etmiş toplam mesafe ile x-ekseni boyunca bir hücre yerinden bölünmesi ile elde edilebilir. (D) 'cazip bir tepki için bir örnek başlangıçta kemotaksis ve Geçiş tarafından oluşturulan bir hücre yörünge arsa ile gösterilir ImageJ için Aracı eklentisi. Her yörünge başlangıç noktası başlangıç noktasına (0,0) olarak ayarlanır. Ayrıca kemoatraktan kaynağına yakın olduğunu; (eşit ağırlıklı tüm hücreleri mavi çapraz) nihai pozisyonda bütün hücrelerin kütlesi kemoatraktan source.The merkezine doğru göç daha kaç hücre unutmayın. NCCS, nöral krest hücreleri; Kırmızı parçaları, yüklü rezervuar doğru göç hücreleri şüpheli kemoatraktan; Siyah parça uzakta, göç hücreleri; (+), yüksek chemotactant konsantrasyon; (-), alt chemotactant konsantrasyonu.

Bir Alexa Fluor 488 IgM konjugat ilave izleyen farklı zamanlarda bir modifiye Zigmond odasının köprü üzerinden g> Şekil 3. yoğunluğu profili. oda ana istisnalar ile protokol 'de tarif edilene benzer bir şekilde yerleştirilmiş olduğu ön inkübasyona tabi su (yerine preinkübe orta) 40 mcg / ml antikor sulandırmak için kullanılır ve küçük hava cepleri köprünün uçları (uzakta yukarıda yoğunluğu profilleri alınan dilimden) mevcut idi. Başlangıçta, hiçbir degrade köprünün en genelinde mevcut idi. Tarafından 1 hektar degrade kurulan ve 26 saat kadar mevcut kalmıştır. 50 h tarafından degrade varlığı köprünün farklı alanlarda tutarsız ve ne zaman mevcut, degrade eğimi büyük ölçüde azalmış oldu. Tüm profiller AxioVision 4.6 yazılımını kullanarak köprü üzerinden özdeş bir dilim (bir köprü-rezervuar sınır diğerine) elde edildi. Unutmayın bile havacepleri mevcuttu, degrade kesintiye değildi. Yüksek, yüksek yoğunluklu, düşük, düşük yoğunluklu, köprünün tüm genişliği (2 mm) çapında x-ekseni, mesafe; (+), Alexa Fluor 488 IgM konjugat ile yüklenen rezervuarı; (-), rezervuar konjugat ile yüklü değil.
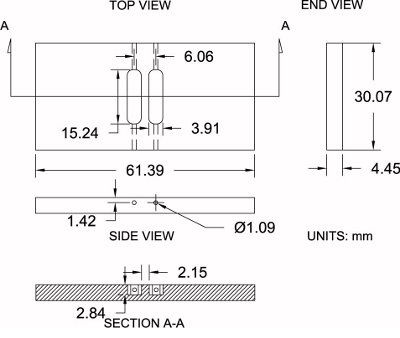
Şekil 4. Modifiye Zigmond odasının özellikleri. Gösterildi onun boyutlu spesifikasyonlar (± 0,2 mm) ile birlikte burada kullanılan modifiye Zigmond odasının bir diyagram. Ölçümler orta bireysel tercihlerini eşleştirmek için ayarlanabilir.
Ek Protokol: Modifiye Zigmond Odası Fabrikasyon
Aşağıdaki protokol için bir referans olarak Şekil 4'e bakınız:
- 3/16 "kalınlığında akrilik cilalı (4.45 mm gerçek kalınlığı) bir levha satın alın.
- Bir tablo kullanarak gördüm, büyük boyutlu odası boşlukları kesmek33.25 mm x 64,57 mm kaba ölçüler. Bu işleme için 3.175 mm ekstra malzeme sağlar.
- Bir mengene üzerinde haznesi boş ayarlayın. 30.07 mm x 61.39 mm: Bir freze makinesi ve 6,35 mm (1/4 ") freze ucu, finiş onların tam boyutlarına odasının tarafı ile.
- Freze makinesi üzerindeki odacık blank konumlandırın ve x ve bir kenar bulucu ile y ekseni hem boyunca boş merkezinin yerini, sonra merkezi konumu sıfır.
- Üst yüzeyine sonuna değirmen biraz dokunarak odası yüksekliği (z-ekseni) Edinme ve yüksekliği sıfır.
- Bir 3.91 mm (0,154 ") freze ucu kullanarak, ilk rezervuar için x-ekseni (pozitif yönde) boyunca bit 3.03 mm ofset. 2.84 mm derinliğe kadar odasına işleme başlayın tam rezervuar ters (negatif) yönde "(7,62 mm 0,300) için seçeceğimiz sonra ve 7.62 mm (0.300)" için y-ekseni (pozitif yönde) boyunca hareket ederken 15.24 mm (0.600 ") uzunluğu. Dengelemekx-ekseni (negatif yönde) boyunca 3,03 mm (0,119 ") bit ve ikinci rezervuar için aynı işlemi tekrarlayın.
- Onun kenarında odasına yerleştirin ve deney sırasında orta yükleme odasının yan rezervuarın sonunda her bağlandığında rezervuar (toplam 4) ucunda bir 1.09 mm (0.043) matkap ucu kullanarak bir delik açın.
- Herhangi bir kimyasal kirleticiler kaldırmak için ılık sabunlu su ile iyice odası bekletin.
- Herhangi bir sabun kaldırmak için çift distile su ile iyice odası bekletin ve durulayın. Odası hemen yukarıda tarif edildiği gibi kullanıma hazırdır.
Tartışmalar
Gövde NCCS üzerine kemotaksis araştırmaların yapılması nedenlerle bir dizi için zor olduğu kanıtlanmıştır. Bu nedenle, gövde NCCS gövde düzeyinde NT birincil eksplantasyonunun alınmalıdır; Trunk NCCS kültürlü uzun vadede ise farklılaştıracak bir heterojen kök hücre popülasyonu oluşturur. In vitro homojen dağıldığı hücre popülasyonlarının kemotaktik yanıtı incelemek için konvansiyonel yöntemler onlar ilk hücreler izole ve kemotaksis odası (örneğin, bir Boyden çember...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Biz bu yöntemin geliştirilmesi sırasında teknik yardım için Lino Kim, Steve Guzman ve Ujit Satyarthi özel şükretmezler. Myron Hawthorne, Richard Spengel ve Roberto Rojas burada kullanılan odaları işlenmiş ve çok ihtiyaç duyulan teknik yardım sağlamıştır. Özellikle, Roberto Rojas Şekil 4 üretti. Biz de yukarıda kemotaksis assay gelişimi öncesinde Scott Fraser değerli tavsiyeler için müteşekkiriz. Bu çalışma kısmen bir NIH-MBR SKOR-5S06GM048680-13 Medb ait ve CW CSU, Northridge Lisans Tez Destekleme Programı bir ödül tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | Yorumlar (isteğe bağlı) |
| DMEM | Omega Bilimsel | DM-22 | |
| Penisilin Streptomisin Çözüm | Omega Bilimsel | PS-20 | 100X Stok Konsantrasyon |
| L-Glutamine | Omega Bilimsel | GS-60 | 100X Stok Konsantrasyon |
| Fetal Bovine Serum | Omega Bilimsel | FB-11 | Lot # 105247 (veya karşılaştırılabilir başka) |
| Modifiye Zigmond odası | Home made | N / A | Rezervuar hacmi: ~ 160 ul adet, ek özellikler için, bkz. 4 ve ek imalat protokolü |
| Hücre kültürü çanak | Denville | T6040 | 40 x 10 mm |
| Fibronektin | BD | 354008 | 10X Hazır 1 ml H2O ve 9 ml DMEM içinde 1 mg FN seyreltilmesi ile prepped |
| Lameller | Balıkçı | 12-548-B | Precleaned; 22 x 22 mm |
| L15 orta | Thermo Scientific | SH30525.02 | |
| Vazelin | Comforts | 011110794642 | % 100 |
| Santrifüj tüpü | Biologix | 10-9152 | 15 ml |
| Dispase | Hücre Sistemleri | 4Z0-850 | 10X Stok Konsantrasyon |
| Şırınga | BD | 309602 | 1 mL |
| Iğne | BD | 305127 | 25 G x 1,5 inç |
| Alexa Fluor 488-IgM | Bennvitrogen | A21042 | Hazır 2 mg / ml 'dir; 7 mol boya / mol IgM |
| Diseksiyon Forseps | FST | Misc. | Dumont # 5 veya 55; düz uçlu, paslanmaz çelik ya da titanyum |
| Tungsten İğne | N / A | N / A | Ev yapımı; pim tutucu yerleştirilir |
| Blunt Forseps | Tiemann | 160-18 | Yumurta sarısı Ringer embriyo transferi için kullanılır |
Ek Protokol: Modifiye Zigmond Odası Fabrikasyon
Aşağıdaki protokol için bir referans olarak Şekil 4'e bakınız:
- 3/16 "kalınlığında akrilik cilalı (4.45 mm gerçek kalınlığı) bir levha satın alın.
- Bir tablo kullanarak 33,25 mm x 64,57 mm kaba boyutları normalden büyük kamara boşlukları kesip, gördüm. Bu işleme için 3.175 mm ekstra malzeme sağlar.
- Bir vi odacık blank ayarlayınse. 30.07 mm x 61.39 mm: Bir freze makinesi ve 6,35 mm (1/4 ") freze ucu, finiş onların tam boyutlarına odasının tarafı ile.
- Freze makinesi üzerindeki odacık blank konumlandırın ve x ve bir kenar bulucu ile y ekseni hem boyunca boş merkezinin yerini, sonra merkezi konumu sıfır.
- Üst yüzeyine sonuna değirmen biraz dokunarak odası yüksekliği (z-ekseni) Edinme ve yüksekliği sıfır.
- Bir 3.91 mm (0,154 ") freze ucu kullanarak, ilk rezervuar için x-ekseni (pozitif yönde) boyunca bit 3.03 mm ofset. Y-ekseni boyunca hareket ederken (2.84 mm derinliğe kadar odasına işleme başlayın 7.62 mm (0.300 ile) yönünde pozitif 15.24 mm (0.600 ") tam bir rezervuar uzunluğa karşı (negatif) yönünde)" O) ve 7.62 mm (0.300 ile çapraz ". X-ekseni (negatif yönünde) 3.03 mm (0.119 ") için bit Ofset ve ikinci hazne için aynı işlem tekrarlayın.
- Onun kenarında odasına yerleştirinve deney sırasında orta yükleme odasının yan rezervuarın sonunda her bağlandığında rezervuar (toplam 4) ucunda bir 1.09 mm (0.043) matkap ucu kullanarak bir delik açın.
- Herhangi bir kimyasal kirleticiler kaldırmak için ılık sabunlu su ile iyice odası bekletin.
- Herhangi bir sabun kaldırmak için çift distile su ile iyice odası bekletin ve durulayın. Odası hemen yukarıda tarif edildiği gibi kullanıma hazırdır.
Referanslar
- Le Douarin, N. M. The avian embryo as a model to study the development of the neural crest: a long and still ongoing story. Mechanisms of Development. 121, 1089-1102 (2004).
- Baker, C. V. . Neural Crest and Cranial Ectodermal Placodes. , (2005).
- Gammill, L. S., Roffers-Agarwal, J. Division of labor during trunk neural crest development. Dev. Biol. 344, 555-565 (2010).
- Kulesa, P. M., Gammill, L. S. Neural crest migration: patterns, phases and signals. Dev. Biol. 344, 566-568 (2010).
- Wang, H. U., Anderson, D. J. Eph family transmembrane ligands can mediate repulsive guidance of trunk neural crest migration and motor axon outgrowth. Neuron. 18, 383-396 (1997).
- Krull, C. E. Interactions of Eph-related receptors and ligands confer rostrocaudal pattern to trunk neural crest migration. Curr. Biol. 7, 571-580 (1997).
- Gammill, L. S., Gonzalez, C., Gu, C., Bronner-Fraser, M. Guidance of trunk neural crest migration requires neuropilin 2/semaphorin 3F signaling. Development, Cambridge, England. , 133-199 (2006).
- De Bellard, M. E., Rao, Y., Bronner-Fraser, M. Dual function of Slit2 in repulsion and enhanced migration of trunk, but not vagal, neural crest cells. The Journal of cell biology. 162, 269-279 (2003).
- Kasemeier-Kulesa, J. C., McLennan, R., Romine, M. H., Kulesa, P. M., Lefcort, F. CXCR4 controls ventral migration of sympathetic precursor cells. J. Neurosci. 30, 13078-13088 (2010).
- Zigmond, S. H. Ability of polymorphonuclear leukocytes to orient in gradients of chemotactic factors. The Journal of Cell Biology. 75, 606-616 (1977).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chicken embryo. J. Morph. 88, 49-52 (1951).
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. The Journal of Experimental Medicine. 115, 453-466 (1962).
- Davis, E. M., Trinkaus, J. P. Significance of cell-to cell contacts for the directional movement of neural crest cells within a hydrated collagen lattice. Journal of Embryology and Experimental Morphology. 63, 29-51 (1981).
- Zicha, D., Dunn, G. A., Brown, A. F. A new direct-viewing chemotaxis chamber. Journal of Cell Science. 99, 769-775 (1991).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır